BAB I
PENDAHULUAN
1.1 LATAR BELAKANG
Dalam kehidupan sehari – hari, seyawa kimia memegang peranan penting, seperti dalam makhuluk hidup, sebagai zat pembentuk atau pembangun di dalam sel, jaringan dan organ. Senyawa – senyawa tersebut meliputi asam nukleat, karbohidrat, protein dan lemak. Proses interaksi organ memerlukan zat lain seperti enzim dan hormon. Tubuh kita juga memiliki sistem pertahanan dengan bantuan antibodi. Demikian pula dengan alam sekitar kita seperti tumbuhan dan minyak bumi, juga disusun oleh molekul molekul yang sangat khas dan dibangun oleh atom – atom dengan kerangka atom karbon (C).
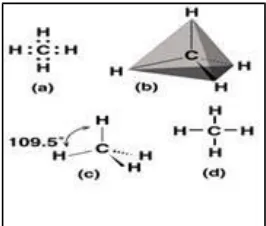
Atom Karbon memiliki massa 12 dengan nomor atom 12. Konfigurasi elektronnya adalah 1s2, 2s2, 3p2, dan mengalami hibridisasi dimana 1 elektron dari orbital 2s berpindah ke orbital 2pz, sehingga memiliki konfigurasi stabil 1s2, 2s1, 2p3, dengan membentuk orbital hybrid sp3. Sehingga atom karbon memiliki kesempatan untuk membentuk empat ikatan dengan atom lainnya, kestabilan struktur ini ditunjukan dengan sudut yang sama 109,50 dengan bentuk tetrahedral, perhatikan Gambar 1.1di bawah ini.
Berdasarkan karakteristik tetrahedral maka atom karbon dapat mengikat atom lain selain atom karbon itu sendiri. Secara sederhana atom karbon dapat membentuk empat ikatan dengan atom hydrogen seperti pada Gambar B. Kerangka senyawa hidrokarbon dibangun oleh banyak ikatan antar atom karbonnya. Kerangka senyawa hidrokarbon yang paling sederhana memiliki sebuah atom karbon, dilanjutkan dengan dua atom karbon, tiga atom karbon dan seterusnya, perhatikan Gambar 1.2 di bawah ini :
Gambar 1.2 kerangka senyawa karbon
Gambar 1.3 ikatan antar senyawa karbon
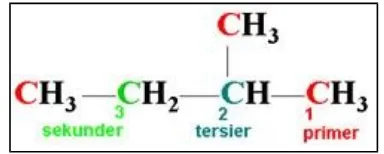
Atom karbon pada senyawa hidrokarbon memiliki posisi yang berbeda – beda. Coba kita perhatikan rumus bangun dibawah ini pada Gambar di bawah ini. Semua atom karbon (merah) yang dapat mengikat 3 atom hidrogen dan berposisi di tepi, disebut dengan atom karbon primer. Atom karbon nomor 3 (hijau) yang mengikat 2 atom hidrogen disebut dengan atom karbon sekunder. Demikian pula atom karbon yang mengikat hanya 1 atom hidrogen (warna abu – abu) memiliki posisi sebagai atom karbon tersier. Setiap atom Karbon dalam kerangka senyawa hidrokarbon dapat mengikat atom lain seperti atom hidrogen, oksigen, nitrogen, belerang, klor dan lainnya.
Gambar 1.4 atom C primer,sekunder,tersier
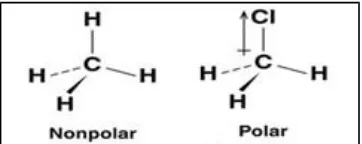
Gambar 1.5 perbedaan kepolaran
Dari berbagai unsur-unsur kimia yang kita kenal, ada satu unsur yang cakupannya sangat luas dan pembahasannya sangat mendalam yakni KARBON. Karbon mempunyai nomor atom 6 sehingga jumlah elektronnya juga 6, dengan konfigurasi 6 C = 2, 4. Dari konfigurasi elektron ini terlihat atom C mempunyai 4 elektron valensi (elektron pada kulit terluar). Untuk memperoleh 8 elektron (oktet) pada kulit terluarnya (elektron valensi) dibutuhkan 4 elektron sehingga masing-masing elektron valensi mencari pasangan elektron dengan atom-atom lainnya. Kekhasan atom karbon adalah kemampuannya untuk berikatan dengan atom karbon yang lain membentuk rantai karbon. Bentuk rantai2 karbon yang paling sederhana adalah Hidrokarbon. Hidrokarbon hanya tersusun dari dua unsur yaitu Hidrogen dan Karbon.
Berdasarkan jumlah atom C lain yang terikat pada satu atom C dalam rantai karbon, maka atom C dibedakan menjadi :
a. Atom C primer, yaitu atom C yang mengikat satu atom C yang lain. b. Atom C sekunder, yaitu atom C yang mengikat dua atom C yang lain. c. Atom C tersier, yaitu atom C yang mengikat tiga atom C yang lain.
.
atom C primer, atom C nomor 1, 7, 8, 9 dan 10 (warna hijau) • atom C sekunder, atom C nomor 2, 4 dan 6 (warna biru) • atom C tersier, atom C nomor 3 (warna kuning)• atom C kwarterner, atom C nomor 5 (warna merah) Berdasarkan bentuk rantai karbonnya :
• Hidrokarbon alifatik = senyawa hidrokarbon dengan rantai lurus/terbuka yang jenuh (ikatan tunggal/alkana) maupun tidak jenuh (ikatan rangkap/alkena atau alkuna).
• Hidrokarbon alisiklik = senyawa hidrokarbon dengan rantai melingkar / tertutup (cincin).
• Hidrokarbon aromatik = senyawa hidrokarbon dengan rantai melingkar (cincin) yang mempunyai ikatan antar atom C tunggal dan rangkap secara selang-seling / bergantian (konjugasi).
Berdasarkan ikatan yang ada dalam rantai C-nya, senyawa hidrokarbon alifatik dibedakan atas :
1. Alkana (CnH2n+2) 2. Alkena (CnH2n) 3. Alkuna (CnH2n-2)
1.2 BATASAN MASALAH
1. Apa yang dimaksud dengan alkuna ? 2. Bagaimana struktur alkuna?
3. Apa sifat fisika & kimia alkuna? 4. Bagaimana aturan tata nama alkuna? 5. Bagaimana reaksi pembuatan alkuna? 6. Apa saja reaksi-reaksi dari alkuna? 7. Apa kegunaan alkuna dan dampaknya?
1.3 TUJUAN
2. Menjelaskan manfaat dan dampak senyawa hidrokarbon alkuna dalam kehidupan sehari-hari.
BAB II
ISI
2.1 PENGERTIAN
Gambar 2.1. Pembuatan gas asetilena
Dalam skala kecil, reaksi ini akan memberikan nyala asetilena untuk lampu karbida. Dulu pekerja tambang menggunakan lampu semacam ini; banyaknya gas yang dihasilkan diatur dengan mengendalikan laju air yang diteteskan ke dalam tempat reaksi. Metode komersial yang baru untuk membuat asetilena adalah dengan memanaskan metana dan homolog-homolognya pada temperatur tinggi dengan menambahkan suatu katalis.
Gambar 2.2. Reaksi dekomposisi metana
Gambar 2.3. Struktur molekul etuna (asetilen)
2.1.1 Isomer Alkuna
Isomer adalah senyawa-senyawa yang mempunyai rumus molekul yang sama tetapi mempunyai struktur atau konfigurasi yang berbeda. Struktur berkaitan dengan cara atom-atom saling berikatan, sedangkan konfigurasi berkaitan dengan susunan ruang atom-atom dalam molekul.
Keisomeran dibedakan menjadi 2 yaitu :
1) Keisomeran struktur : keisomeran karena perbedaan struktur. 2) Keisomeran ruang : keisomeran karena perbedaan konfigurasi
1) Keisomeran Struktur
Dibedakan menjadi 3 yaitu :
a) keisomeran kerangka : jika rumus molekulnya sama tetapi rantai induknya (kerangka atom) berbeda. b) keisomeran posisi : jika rumus molekul dan rantai induknya
(kerangka atom) sama tetapi posisi cabang/gugus penggantinya berbeda. c) keisomeran gugus fungsi
2) Keisomeran Ruang
Dibedakan menjadi 2 yaitu :
a) keisomeran geometri : keisomeran karena perbedaan arah (orientasi) gugus- gugus tertentu dalam molekul dengan struktur yang sama.
Keisomeran geometri menghasilkan 2 bentuk isomer yaitu bentuk cis (jika gugus-gugus sejenis terletak pada sisi yang sama) dan bentuk trans (jika gugus-gugus sejenis terletak berseberangan).
b) keisomeran optik
Gambar 2.4 . Contoh bentuk isomer
Perbedaan struktur molekul menyebabkan perbedaan sifat fisik, molekul pertama memiliki titik leleh = 1380C, titik didih = 10C, dengan densitas 0.58 g/mL, sedangkan molekul yang kedua memiliki titik leleh = 1590C, titik didih = 120C dan densitas 0,55 g/mL. Bentuk isomer lainnya adalah adanya perbedaan gugus yang dikandung dalam senyawa hidrokarbon. Hal ini bisa dicermati pada Gambar di bawah ini.
Gambar 2.5. Contoh bentuk isomer
dua atom karbon (-C-O-C-). Perbedaan ini juga menyebabkan adanya perbedaan sifat fisika dan sifat kimia dari kedua molekul tersebut. Senyawa hidrokarbon dapat diklasisifikasikan atas dua golongan besar yaitu senyawa hidrokarbon jenuh dan hidrokarbon tidak jenuh.
Senyawa hidrokarbon jenuh bercirikan ikatan tunggal antar atom karbon sebagai penyusun rantai utamanya, berbeda dengan senyawa hidrokarbon tidak jenuh yang dapat membentuk ikatan rangkap dua atau rangkap tiga antar atom karbon penyusunnya
Etuna (C2H2), propena (C3H4) tidak mempunyai isomer karena hanya ada satu struktur. Isomer dari butuna (C4H6)
Sifat sifat fisik.
Alkuna mempunyai kepolaran rendah, tidak larut dalam air, larut baik dalam pelarut organik seperti eter, benzen, karbontetrakhlorida, titik didih naik sesuai dengan jumlah atom karbon. Reaktiftas alkuna disebabkan karena terbongkarnya ikatan rangkap tiga dan membentuk senyawa baru. Atas dasar ini maka reaksi alkuna umumnya reaksi adisi. Contoh reaksi adisi alkuna dengan gas halogen, seperti gas bromine (Br2), klorine (Cl2) dan iodine (I2). Ikatan rangkap tiga terlepas dan senyawa halogen masuk pada kedua atom karbon. Reaksi terus berlangsung sehingga seluruh ikatan rangkapnya terlepas, dan membentuk senyawa haloalkana.. Sifat fisis alkuna, yakni titik didih mirip dengan alkana dan alkena. Semakin tinggi suku alkena, titik didih semakin besar.
Pada suhu kamar, tiga suku pertama berwujud gas, suku berikutnya berwujud cair sedangkan pada suku yang tinggi berwujud padat. titik cair dan titik didih alkena dan alkuna bertambah dengan makin panjangnya rantai. akan tetapi, tidak ada rotasi bebas yang terjadi pada ikatan ganda (alkena) dan ikatan rangkap tiga (alkuna) seperti pada alkana, karena adanya ikatan phy. jarak antara atom karbon pada ikatan ganda lebih pendek daripada jarak antara karbon-karbon dengan ikatan tunggal akiabt interaksi ikatan phy dan meningkatnya sifat sigma dari ikatan sigma, demikian pula ikatan karbon-karbon ganda tiga bersifat lebih kuat dan lebih pendek daripada ikatan karbon-karbon ganda.
Kestabilan ikatan rangkap bertambah dengan subtitusi. untuk ikatan ganda, isomer cis lebih stabil dibandingkan trans karena interaksi eklip dari subtituen. atom-atom karbon pada ikatan rangkap sedikit lebih elektronegatif daripada atom karbon sp3. atom karbon pada ikatan rangkap tiga sedikit lebih elektronegatif daripada atom karbon pada ikatan ganda akibat makin bertambahnya sifat ikatan sigma dari orbital sp.
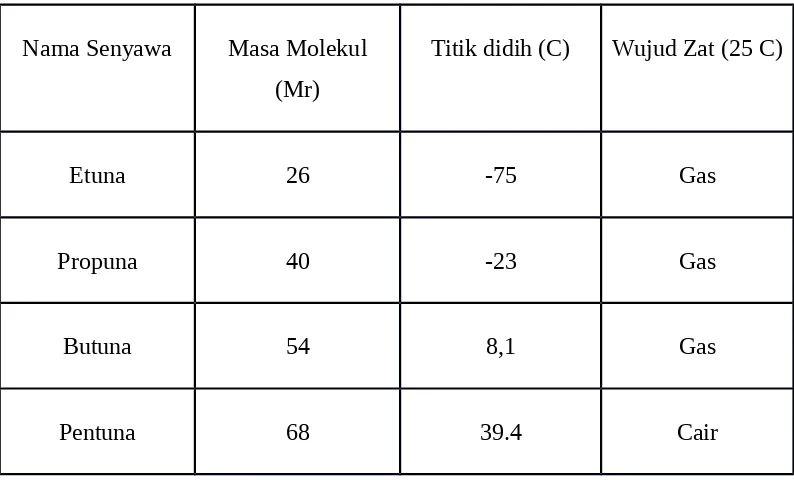
Gambar 2.6. hidrogenasi 2-butuna dengan katalisator Nikel Tabel.2.1. Sifat-sifat Fisik Senyawa Alkuna
Nama Rumus Mp (oC) BP (oC) Densiti
Acetylen e
HC CH -82 -75
Propyne HC CHCH3 -101,5 -23
1-butyne HC CHCH2CH3 -122 9
1-pentyne HC CH(CH2)2CH3 -98 40 0,695
1-hexyne HC CH(CH2)3CH3 -124 72 0,719
1-heptyne HC CH(CH2)4CH3 -80 100 0,733
1-octyne HC CH(CH2)5CH3 -70 126 0,747
Tabel 2.1 Senyawa Fisik Alkuna
Nama Senyawa Masa Molekul (Mr)
Titik didih (C) Wujud Zat (25 C)
Etuna 26 -75 Gas
Propuna 40 -23 Gas
Butuna 54 8,1 Gas
Heksuna 82 72 Cair
Sifat kimia
Adanya ikatan rangkap tiga yang dimiliki alkuna memungkinkan terjadinya reaksi adisi, polimerisasi, substitusi dan pembakaran. Sifat keelektronegatifan dari alkuna lebih besar daripada atom karbon lain karena adanya ikatan rangkap tiga. Jadi suatu ikatan CH alkunil lebih polar daripada ikatan CH alkana atau alkena. Tingkat keasaman alkuna (pKa = 25) lebih rendah daripada air (pKa = 15,7), akan tetapi lebih kuat daripada ammonia (pKa = 35). Alkuna dapat bereaksi dengan suatu basa kuat seperti sodamida (NaNH2) atau reagen Grignard. Pada kondisi ini alkana dan alkena tidak bereaksi.
2.3 Tata Nama Alkuna.
Ada dua cara penamaan alkuna, yaitu menggunakan kata akhir asetilen dan penamaan secara IUPAC.
H – C C - C2H5 : etil asetilen : 1-butuna
CH3 – C C - CH3 : dimetil asetilen : 2- butuna
CH3 – C C – CH(CH3)2 : metil isopropil asetilen : 4-metil-2-pentuna
Gambar 2. 7. Contoh penamaan alkuna
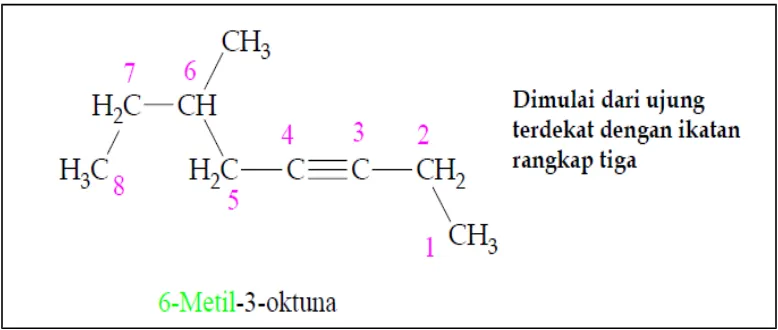
Ketika terdapat lebih dari satu ikatan rangkap tiga, senyawa tersebut dinamakan diuna, triuna, dan seterusnya. Senyawa yang memiliki ikatan rangkap dua dan ikatan rangkap tiga disebut enuna. Penomoran rantai enuna dimulai dari ujung terdekat dengan ikatan rangkap, entah itu ikatan rangkap dua atau ikatan rangkap tiga.
Gambar 2.8. Contoh penamaan alkuna.
Gambar 2.9. Alkil, alkenil, alkunil .
Rantai karbon bercabang
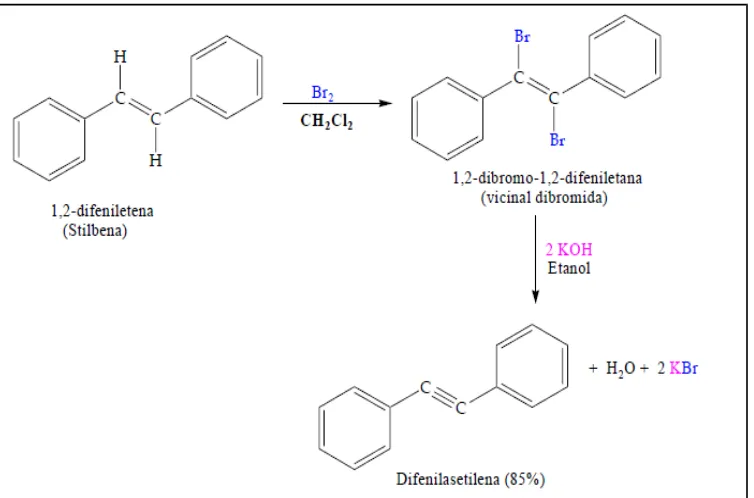
2.4 Reaksi Pembuatan Alkuna
Reaction of sodium acetylides with primary alkyl halides
Contoh :
CH ≡CH NaNH+¿+2CH3
→ CH ≡C:−Na
¿ - CH2−Cl →CH ≡C−CH3−CH2+NaCl
Dehydrohalogenation of alkyl dihalides
Contoh
CH3 -CH ¿CH2+Br2→ CH3−CH
-CH2KOH
→ CH3−CH=CH NaNH→ 2CH3 -C ≡CH
Dehalogenation of tetrahalides
Contoh
Cl Cl
CH3−C−C−CH3+2Zn→ CH3−C ≡C−CH3+2ZnCl2
Cl Cl
2,2,3,3 tetrakhlorobutana 2-butuna
Reaksi Eliminasi Dihalida
Gambar 2.10. Konversi alkena menjadi alkuna
Dua kali reaksi dehidrohalogenasi akan melalui pembentukan interemediet vinilik halida yang akan menghasilkan alkuna ketika diperlakukan dalam suasana basa.
2.5 Reaksi senyawa alkuna
Adition of hydrogen
H H
-C = C- + H2 -C –
H H
H
NH3,Na or Li C = C Trans
H2, Pd C = C Cis
Reaksi diatas menunjukkan reaksi hidrogenasi 2-butuna dengan katalisator Nikel
Catatan :
* Alkynes sebagian dapat dikurangi menjadi cis-alkena dengan H2 dalam kehadiran katalis beracun.
* (Mis. Pd / CaCO3 / quinoline yang juga dikenal sebagai katalis Lindlar's) Alkynes dapat dikurangi untuk alkana dengan H2 dalam kehadiran katalis (Pt, Pd, Ni dll)
* Reaksi stereospecific hanya memberikan produk tambahan syn. * Katalis mencegah over-reduksi, yang akan memberikan alkana dengan mengurangi alkena
Terkait reaksi
* Pembubaran logam pengurangan alkynes * Hidrogenasi alkena
Penambahan katalis hidrogen untuk 2-butyne tidak hanya berfungsi sebagai contoh dari reaksi Selain itu, tetapi juga menyediakan data panas reaksi yang mencerminkan kestabilan relatif termodinamika hidrokarbon ini, seperti ditunjukkan dalam diagram ke kanan. Dari memanaskan hidrogenasi, diperlihatkan dengan warna biru dalam satuan kkal / mol, akan terlihat bahwa alkynes adalah termodinamika kurang stabil dari alkena ke tingkat yang lebih besar dari alkena kurang stabil daripada alkana.
Energi ikatan standar untuk ikatan karbon-karbon mengkonfirmasi kesimpulan ini. Dengan demikian, ikatan ganda lebih kuat daripada ikatan tunggal, tapi tidak dua kali lebih kuat. Perbedaan (63 kkal / mol) dapat dianggap sebagai kekuatan komponen π-ikatan. Demikian pula, tiga ikatan lebih kuat daripada ikatan ganda, tapi tidak 50% lebih kuat. Berikut perbedaan (54 kkal / mol) dapat diambil sebagai kekuatan ikatan-π kedua. The 9 kkal / mol melemahnya ikatan-π kedua tercermin dalam panas nomor hidrogenasi(36,7-28,3=8.4).
menjadi alkena tanpa pengurangan lebih lanjut untuk sebuah alkana. Penambahan hidrogen stereoselectively syn (misalnya 2-butyne memberikan cis-2-butena). Alkena dan alkynes menunjukkan perbedaan yang aneh dalam perilaku terhadap hidrogenasi katalitik. Studi Independen tingkat hidrogenasi untuk setiap kelas menunjukkan bahwa alkena bereaksi lebih cepat dibandingkan alkynes. Namun, hati-hati hidrogenasi alkuna suatu hasil secara eksklusif ke alkena sampai mantan dikonsumsi, di mana titik alkena produk sangat cepat terhidrogenasi untuk sebuah alkana. Perilaku ini baik dijelaskan oleh perbedaan dalam tahapan reaksi hidrogenasi. Sebelum hidrogen dapat menambah beberapa ikatan alkena atau alkuna harus terserap pada permukaan katalis.
Dalam hal ini, pembentukan platinum stabil (dan paladium) kompleks dengan alkena telah dijelaskan sebelumnya. Sejak alkynes menyerap lebih kuat pada permukaan katalitik tersebut daripada alkena, mereka preferentially menempati situs reaktif pada katalis. Setelah transfer hidrogen untuk hasil alkuna terserap perlahan, relatif terhadap transfer hidrogen yang sesuai pada molekul alkena teradsorpsi. Akibatnya, pengurangan obligasi tiga terjadi secara selektif pada tingkat yang moderat, diikuti dengan penambahan cepat hidrogen terhadap produk alkena. Katalis Lindlar izin adsorpsi dan pengurangan alkynes, tetapi tidak menyerap alkena cukup untuk memungkinkan pengurangan mereka.
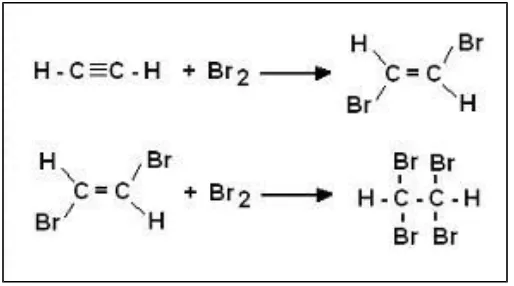
Addition of halogens
berlangsung sehingga seluruh ikatan rangkapnya terlepas, dan membentuk senyawa haloalkana. Persamaan reaksi :
Gambar 2.11 . Reaksi adisi alkuna dengan halogen
Pada reaksi adisi gas HX (X = Cl, Br atau I) terhadap alkena dan alkuna berlaku aturan Markovnikov yaitu :
“ Jika atom C yang berikatan rangkap mengikat jumlah atom H yang berbeda, maka atom X akan terikat pada atom C yang sedikit mengikat atom H ”.
Contoh :
Cl Cl
CH3 -C ≡CH+HCl→ CH3−C=CH2+HI → CH3−C−CH3
I
Ketika reaksi adisi dari reagen elektrofilik, seperti asam Brønsted kuat dan
halogen, untuk alkynes dipelajari kita menemukan paradoks penasaran. Reaksi
bahkan lebih eksotermik daripada penambahan alkena, namun laju Selain alkynes
lebih lambat dengan faktor 100 sampai 1000 dari samping alkena dipersamakan
diganti. Reaksi bromin satu ekuivalen dengan 1-penten-4-yne, misalnya,
memberikan 4,5-dibromo-1-pentyne sebagai produk utama.
HC ≡ C-CH 2-CH = CH 2 + Br 2 - ≡ HC> C-CH 2-CH Br CH 2 Br
Meskipun tambahan ini elektrofilik untuk alkynes yang lamban, mereka
mengambil tempat dan umumnya menampilkan Markovnikov regioselectivity
Peraturan dan anti-stereoselektivitas. Satu masalah, tentu saja, adalah bahwa
produk ini penambahan itu sendiri alkena diganti dan karenanya dapat mengalami
penambahan selanjutnya. Karena elektronegativitas tinggi, halogen substituen
pada tindakan ikatan ganda untuk mengurangi nucleophilicity, dan dengan
demikian menurunkan laju reaksi adisi elektrofilik. Akibatnya, ada keseimbangan
untuk apakah produk tambahan awal untuk alkuna yang akan menderita tambahan
lebih lanjut untuk produk jenuh. Meskipun produk alkena awal sering dapat
diisolasi dan diidentifikasi, mereka biasanya hadir dalam campuran produk dan
tidak dapat diperoleh dengan rendemen tinggi. Reaksi berikut menggambarkan
banyak dari fitur ini. Dalam contoh terakhir, 1,2-diodoethene tidak mengalami
Sebagai aturan, reaksi adisi elektrofilik ke alkena dan alkuna melanjutkan
dengan formasi awal-pi sebuah kompleks, di mana elektrofil menerima elektron
dari dan menjadi lemah terikat ikatan ganda. kompleks tersebut terbentuk
reversibel dan kemudian dapat merombak ke intermediate reaktif dalam langkah
lambat, laju-menentukan. Reaksi dengan alkynes lebih sensitif terhadap
perubahan pelarut dan pengaruh katalitik daripada alkena setara.
Mercury (II) ion adalah elctrophile dalam reaksi ini. Berinteraksi dengan atom karbon kurang sangat diganti dari ikatan rangkap tiga. Karbokation vinylic dihasilkan diserang oleh air, yang kemudian terdeprotonasi. Ion merkuri digantikan oleh hidrogen asam untuk membentuk enol perantara. enol ini tautomerizes ke keton lebih stabil.
alkynes internal tidak simetris menyebabkan campuran keton. Seperti alkena, penambahan air untuk alkynes membutuhkan asam kuat, biasanya asam sulfat, dan difasilitasi oleh sulfat merkuri. Namun, tidak seperti penambahan ganda obligasi yang memberikan produk alkohol, penambahan air untuk alkynes memberikan produk keton (kecuali untuk asetilena yang menghasilkan asetaldehida). Penjelasan untuk penyimpangan ini terletak pada tautomerization enol-keto, digambarkan oleh persamaan berikut. Produk awal dari penambahan air untuk alkuna adalah sebuah enol (suatu senyawa memiliki substituen hidroksil yang melekat pada ikatan-ganda), dan ini segera mengatur ulang ke tautomer keto lebih stabil.
Tautomer didefinisikan sebagai isomer konstitusional interconverted cepat, biasanya dibedakan dengan lokasi ikatan berbeda untuk atom hidrogen labil (berwarna merah di sini) dan ikatan ganda berbeda berada. Keseimbangan antara tatomer tidak hanya cepat dalam kondisi normal, tetapi sering sangat nikmat salah satu isomer (aseton, misalnya, adalah 99,9% keto tautomer). Bahkan di satu sisi kesetimbangan tersebut, bukti kehadiran tautomer kecil berasal dari sifat kimia senyawa. kesetimbangan tautomer jejak dikatalisis oleh asam atau basa yang biasanya hadir dalam sampel bahan kimia yang digunakan. Tiga contoh yang ditunjukkan di bawah ini menggambarkan reaksi-reaksi untuk pengganti yang berbeda dari ikatan-tiga. Langkah tautomerization ditunjukkan oleh panah merah. Untuk terminal alkynes penambahan air mengikuti aturan Markovnikov, seperti pada contoh kedua di bawah, dan besarbesaran produk akhir sebuah keton metil (kecuali untuk asetilen, ditunjukkan dalam contoh pertama). Untuk alkynes internal (ikatan-tiga berada dalam rantai lagi) penambahan air tidak regioselective. Jika ikatan-tiga tidak simetris terletak (yaitu jika R & R 'dalam persamaan ketiga tidak sama) dua keton isomerik akan terbentuk.
Berdasarkan kemiripan sifat elektroniknya, alkuna dan alkena memiliki sifat yang mirip pula,sehingga reaktivitas kedua gugus fungsi tersebut juga mirip. Meskipun demikian, terdapat juga perbedaan yang signifikan.
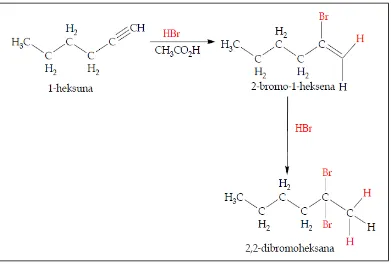
a. Adisi HX dan X2
Secara umum, elektrofil akan lebih banyak bereaksi dengan alkuna dibandingkan dengan alkena. Contohnya reaksi adisi HX pada alkuna. Pada kondisi di mana HX berlebih, reaksi alkuna dengan HX akan memberikan hasil akhir berupa dihalida. Jadi, satu mol alkuna membutuhkan dua mol HX. Contohnya, reaksi antara 1-heksuna dengan HBr akan menghasilkan 2,2-dibromoheksana. Regiokimia reaksi adisi ini mengikuti aturan Markovnikov: Halogen akan berikatan dengan karbon yang lebih tersubstitusi, sedangkan hidrogen pada karbon yang kurang tersubstitusi. Stereokimia trans biasanya (meski tidak selalu) ditemukan dalam produk reaksi ini.
Gambar 2.12.adisi H-Br pada 1 heksuna
Gambar 2.13. Adisi Br2 pada butuna
Mekanisme reaksi adisi elektrofilik alkuna mirip tetapi tidak sama dengan adisi pada alkena. Ketika elektrofil seperti HBr mengadisi alkena, reaksinya berjalan dalam dua tahap dan melibatkan pembentukan intermediet karbokation alkil. Jika reaksi adisi HBr pada alkuna sama dengan reaksinya dengan alkuna, maka akan terbentuk intermediet karbokation vinilik.
Gambar 2.14.Intermediet karbokation alkil dan vinil
b. Hidrasi Alkuna
Seperti alkena, alkuna dapat juga mengalami reaksi hidrasi dengan dua cara. Adisi air secara langsung dengan katalis ion merkuri (II) menghasilkan produk Markovnikov, adisi air secara tak langsung melalui reaksi hidroborasi/oksidasi menghasilkan produk non-Markovnikov.
1) Hidrasi Alkuna dengan Katalis Merkuri (II)
Alkuna tidak dapat bereaksi secara langsung dengan air asam, tetapi membutuhkan katalis merkuri (II) sulfat. Reaksinya terjadi mengikuti regiokimia Markovnikov, gugus OH akan mengadisi karbon yang lebih tersubstitusi, sedangkan hidrogen pada karbon yang kurang tersubstitusi.
Gambar 2.15.hidrasi 1-heksuna
Gambar 2.16. Tautomeri keto-enol
Mekanisme reaksi dari merkuri (II) sulfat denganalkuna mirip dengan reaksi oksimerkurasi pada alkena. Adisi elektrofilik ion merkuri pada alkuna menghasilkan intermediet karbokation vinilik, yang kemudian bereaksi dengan air dan melepaskan proton dan membentuk intermediet enol yang mengandung merkuri. Kondisi reaksinya adalah asam untuk menggantikan merkuri dengan hidrogen
Akan terbentuk campuran produk (keton) ketika alkuna asimetris dihidrasi. Contohnya adalah sebagai berikut:
2) Hidroborasi/ Oksidasi Alkuna
Boran bereaksi dengan alkuna seperti halnya pada alkena, dan menghasilkan boran vinilik yang kemudian dioksidasi oleh H2O2 menghasilkan enol.
Gambar 2.19.Reaksi hidroborasi terminal dan internal alkuna Proses tautomerisasi kemudian menghasilkan keton atau aldehida, tergantung pada struktur alkuna yang direaksikan. Hidroborasi terminal alkuna akan menghasilkan aldehid, sedangkan hidroborasi internal alkuna akan menghasilkan keton. Catat bahwa terminal alkuna akan mengalami dua kali adisi menghasilkan intermediet terhidroborasi dobel. Oksidasi dengan H2O2 pada pH 8 kemudian mengganti kedua boron oleh dua hidrogen dan menghasilkan aldehid. c. Reduksi Alkuna
dengan asetat dan quinolon. Hidrogenasi terjadi dengan syn stereokimia menghasilkan cis alkena.
Gambar 2.20. Perbedaan reaksi reduksi dekuna dengan katalis Pd/C dan katalis Lindlar
Metode lain yang dapat digunakan untuk mengubah alkuna menjadi alkena adalah dengan menggunakan natrium atau litium sebagai reduktor dalam larutan amonia sebagai pelarut. Metode ini digunakan untuk melengkapi metode katalis Lindlar, karena produk yang dihasilkan adalah trans alkena
Gambar 2.22.Mekanisme reaksi umum reduksi alkuna dengan katalis Li d. Pemecahan Oksidatif Alkuna
Gambar 2.23. Pemecahan oksidatif alkuna
e. Pembentukan Anion Asetilida
Terminal alkuna bersifat asam. Hal ini terbukti ketika direaksikan dengan basa kuat, NaNH2, hidrogen terminal dilepaskan dan terbentuk anion asetilida
Gambar 2.24. Reaksi pembentukan anion asetilida Tabel 2.2. Keasaman hidrokarbon
Gambar 2.25. Perbandingan anion alkil, vinil, dan asetilida
f. Alkilasi Asetilida
Adanya muatan negatif dan pasangan elektron bebas pada karbon membuat ion asetilida dapat bertindak sebagai nukleofil kuat. Anion asetilida dapat bereaksi dengan alkil halida seperti bromometana menghasilkan alkuna baru.
Gambar 2.26. Reaksi asetilida dengan bromometana
Gambar 2.27. Mekanisme reaksi alkilasi dari anion asetilida
Alkilasi alkuna tidak hanya terjadi untuk asetilena saja, tetapi juga pada terminal alkuna yang lain. Alkilasi terminal alkuna dapat menghasilkan internal alkuna. Contohnya 1-heksuna dikonversi menjadi anionnya, lalu direaksikan dengan 1- bromobutana, hasilnya adalah 5-dekuna.
Terminal alkuna dapat diperoleh dari alkilasi asetilena, sedangkan internal alkuna diperoleh dari alkilasi terminal alkuna.
Gambar 2.29. Reaksi umum alkilasi alkuna
Alkilasi ion asetilida hanya terbatas pada alkil bromide primer dan alkil iodida saja. Hal ini karena anion asetilida merupakan basa kuat, sehingga jika bereaksi dengan alkil halide sekunder atau tersier justru akan mengalami reaksi dehidrohalogenasi dari pada reaksi substitusi.
Gambar 2.30. Reaksi bromosikloheksana dengan asetilida
2.6 PENGGUNAAN ALKUNA 2.6.1 Bidang Industri
dapat dibuat dari reaksi batu perhatikan, gas karbid berbau tidak sedap. Namun sebenarnya gas asetilena murni tidaklah berbau busuk bahkan sedikit harum. Bau busuk itu terjadi karena gas asetilena yang dibuat dari batu karbid tidak murni, tetapi mengandung campuran. Perlu diketahui bahwa gas forfin juga bersifat racun. Jadi ada untungnya gas ini berbau tidak sedap, sehingga orang akan menghindarinya.
Etuna (asetilena), gas asetilena digunakan untuk mengelas besi dan baja ataupun memotong logam. Reaksi pembentukan etuna (asetilena) :
4 CH4 (g) + 3 O2 (g) →2 C2H2 (g) + 6 H2O (g)
CaC2 (s) + 2 H2O (l) Ca(OH)2 (aq) + C2H2 (g)
Pada pengelasan : dibakar dengan O2 memberi suhu yang tinggi (+- 3000oC), dipakai untuk mengelas besi dan baja.
Untuk penerangan
Untuk sintesis senyawa lain
2.6.2 Bidang Kesehatan
BAB III
JAWABAN PERTANYAAN
3.1 Pertanyaan & Jawaban
1. Sebutkan aplikasi penggunaan alkuna dalam kehidupan sehari-hari!
Jawab : Alkuna yang mempunyai nilai ekonomis penting hanyalah etuna (C2H2). Nama lain etuna adalah asetilena. Dalam industri asetilena dibuat dari metana melalui pembakaran tak sempurna. Dalam jumlah sedikit, asetilena dapat dibuat dari reaksi batu perhatikan, gas karbid berbau tidak sedap. Namun sebenarnya gas asetilena murni tidaklah berbau busuk bahkan sedikit harum. Bau busuk itu terjadi karena gas asetilena yang dibuat dari batu karbid tidak murni, tetapi mengandung campuran. Perlu diketahui bahwa gas forfin juga bersifat racun. Jadi ada untungnya gas ini berbau tidak sedap, sehingga orang akan menghindarinya.
Etuna (asetilena), gas asetilena digunakan untuk mengelas besi dan baja ataupun memotong logam. Reaksi pembentukan etuna (asetilena) :
4 CH4 (g) + 3 O2 (g) →2 C2H2 (g) + 6 H2O (g)
Pada pengelasan : dibakar dengan O2 memberi suhu yang tinggi (+-3000oC), dipakai untuk mengelas besi dan baja.
Untuk penerangan
Untuk sintesis senyawa lain
Penyusun beberapa obat sintetik
3-metil-1-pentuna-3-ol
(obat penenang, pereda nyeri)
2. Pada addition of hydrogen halides, kenapa HF tidak digunakan..?
Jawab : karena HF mudah membentuk ikatan hydrogen. Apabila sudah membentuk ikatan hydrogen mengakibatkan F sulit untuk bereaksi dengan yang lain.
3. Kenapa semakin besar jumlah atom C nya, titik didihnya makin tinggi.?
suhunya paling besar. Dan makin keatas makin rendah suhunya dan makin pendek rantainya.
4. Kenapa propuna tidak mempunyai isomer??
Jawab : karena propuna hanya memilki satu struktur yaitu CH=C-CH3 5. Apa perbedaan isomer geometris cis dengan isomer geometris trans pada
alkuna ?
Jawab : keisomeran geometri: keisomeran karena perbedaan arah (orientasi) gugus- gugus tertentu dalam molekul dengan struktur yang sama. Keisomeran geometri menghasilkan 2 bentuk isomer yaitu bentuk cis (jika gugus-gugus sejenis terletak pada sisi yang sama) dan bentuk trans (jika gugus-gugus sejenis terletak berseberangan).
6. Sebutkan sifat kimia alkuna ?
BAB IV
KESIMPULAN & SARAN
4.1 Kesimpulan
Alkuna adalah senyawa hidrokarbon tidak jenuh rangkap tiga. Alkuna paling sederhana adalah asetilena (etuna) yang digunakan
secara industrial sebagai bahan awal pembuatan asetaldehida, asam asetat, dan vinil klorida . HC-CH (etuna).. Asetilena dibuat dari dekomposisi metana dalam suhu tinggi.
Sifat – sifat fisik alkuna yaitu: kepolaran rendah, tidak larut dalam air, larut baik dalam pelarut organik seperti eter, benzen, karbontetrakhlorida, titik didih naik sesuai dengan jumlah atom karbon.
Sifat – sifat kimia alkuna yaitu : Adanya ikatan rangkap tiga yang dimiliki alkuna memungkinkan terjadinya reaksi adisi, polimerisasi, substitusi dan pembakaran.
Isomer adalah senyawa-senyawa yang mempunyai rumus molekul
Reaksi pembuatan alkuna: Reaction of sodium acetylides with
primary alkyl halides,dehydrohalogenation alkyl of
halides,dehalogenation tetrahalides,
Reaksi senyawa alkuna : addition of hydrogen, addition of halogens,addition of halogen halides,addition of water hydration. Ada beberapa manfaat alkuna diantaranya gas asetilen ( etuna)
digunakan untuk mengelas besi dan baja ataupun memotong logam. Selain itu alkuna juga bisa digunakan untuk penyusun beberapa obat sintetik dan untuk penerangan dll.
4.2 Saran
DAFTAR PUSTAKA
Fessenden & Fessenden ,1982. Kimia organic edisi ketiga, Jakarta : Erlangga
http://jasmansyah.50megs.com/korg1.htm < diakses tanggal 18 maret 2012
>
http://www.chem-is-try.org/materi_kimia/kimia-smk/kelas_xi/alkuna-2/
< diakses tanggal 18 maret 2012 >
http://id.wikipedia.org/wiki/Alkuna < diakses tanggal 18 maret 2012 >
http://www.chem-is-try.org/materi_kimia/kimia_organik_dasar/hidro- http://id.wikipedia.org/wiki/Asetilena < diakses tanggal 18 maret 2012 > http://kimiadahsyat.blogspot.com/2009/06/senyawa-alkuna.html< diakses