Alkohol dan Eter
Alkohol dan Eter
A
A.. PPeennddaahuhulluuanan
Gugus hidroksil (-OH) adalah salah satu kelompok fungsional yang paling penting yang Gugus hidroksil (-OH) adalah salah satu kelompok fungsional yang paling penting yang ter
terjadjadi i secsecara ara alaalami mi molmolekul ekul orgorganianik. k. SemSemua ua karkarbohbohidridrat at dan dan turturunanunannyanya, , tertermasmasuk uk asaasamm nuklea
nukleat, t, memimemiliki gugus liki gugus hidrokhidroksil. eberapa asam sil. eberapa asam aminoamino, , yang yang palinpaling g sterosteroid, banyak id, banyak terpeterpene,ne, dan
dan pigmpigmen en tumbutumbuhan han memimemiliki gugus liki gugus hidrohidroksilksil. . !at-"!at-"at at ini melayani berbagai tujuan yangini melayani berbagai tujuan yang beragam untuk dukungan dan pemeliharaan kehidupan.
beragam untuk dukungan dan pemeliharaan kehidupan.
Salah satu contoh ekstrim adalah tetrodoto#in racun ampuh, yang terisolasi dari jenis ikan Salah satu contoh ekstrim adalah tetrodoto#in racun ampuh, yang terisolasi dari jenis ikan tertentu
tertentu dan memiliki penggunaan yang jelas untuk pertahanan terhadap predator. Senya$a inidan memiliki penggunaan yang jelas untuk pertahanan terhadap predator. Senya$a ini memiliki bunga biokimia khusus, memiliki enam fungsi hydro#ylic berbeda diatur pada struktur memiliki bunga biokimia khusus, memiliki enam fungsi hydro#ylic berbeda diatur pada struktur seperti
seperti sangkar sangkar ((cagelikecagelike).).
Gambar % . Strukur molekul tetrodo#in Gambar % . Strukur molekul tetrodo#in
&ada sisi yang lebih prakti
&ada sisi yang lebih praktis, sejumls, sejumlah besar alkohol sederhaah besar alkohol sederhana seperti na seperti metanmetanol, etanol, '-ol, etanol, '- propanol, % butanol
propanol, % butanol - dan banyak senya$a alohol lainnya yang - dan banyak senya$a alohol lainnya yang dibuat dari hidrokarbon minyak dibuat dari hidrokarbon minyak bumi.
bumi. lkohol lkohol saat saat ini ini banyak banyak digunakan digunakan sebagai sebagai pelarut pelarut dan dan sebagai sebagai perantara perantara untuk untuk sintesissintesis senya$a
senya$a yang lyang lebih ebih kompleks.kompleks. *e
*eakaksi si yayang ng memelilibatbatkan kan hihidrdrogogen en dadari ri kekelomlompok pok alalkokohol hol yayang ng mememimililiki ki guggugus us OHOH diharapkan mirip dengan air (HO
diharapkan mirip dengan air (HOH), atau H), atau senya$a hidrosiklis sederhana. senya$a hidrosiklis sederhana. lkohol, *OH, lkohol, *OH, dapatdapat diangg
dengan gugus alkil + sehingga membentuk *-OH. amun, dengan alkohol kita akan tertarik tidak hanya dalam reaksi itu dilanjutkan pada ikatan O-H, tetapi juga dengan proses yang menghasilkan pembelahan ikatan - atau perubahan dalam kelompok organik *. /ang berupa eter sederhana (*O*). &enggunaan senya$a eter *-O-* umumnya kurang ber0ariasi dibandingkan dengan alkohol, eter banyak digunakan sebagai pelarut untuk berbagai reaksi organik, misalnya untuk reagen Grignard. 1eskipun demikian, eter siklik dengan cincin kecil menunjukkan reakti0itas meningkat dikarenakan adanya regangan cincin dan ini merupakan salah satu untuk alasan terjadinya "at antara (intermediet) yang berharga dalam sintesis organik. B. Alkohol
lkohol merupakan senya$a turunan hidrokabon alkana, dimana atom hidrogen pada senya$a alkana diganti dengan gugus OH, sehingga membentuk rumus molekul *-OH dimana * merupakan gugus alkil dengan rumus nH'n2% atau dapat dituliskan nH'n2% OH.
1. Tatanama Alkohol
Senya$a hidroksi yang sering ditemui dalam kimia organik dan gugus fungsi OH adalah prioritas tinggi tetapi senya$a asam, aldehid dan keton memiliki prioritas yang lebih tinggi
dibandingkan gugus alkohol (OH). Sehingga banyak senya$a memiliki sistem induk alkohol. 34& nama sistem terpanjang rantai hidrokarbon sebagai induk, tetapi huruf terakhir -a pada alkana diganti menjadi huruf ol. Gugus alkohol memiliki prioritas yang lebih tinggi di nomenklatur dari alkena, alkuna, kelompok alkil dan halogen dan kelompok gugus-gugus tersebut diberi nomor rendah daripada kelompok alkohol. Setelah senya$a induk diidentifikasi dan lokasi fungsi alkohol yang ditentukan, fungsi lain yang disebut dalam urutan abjad. ama 34& dan nama umum untuk beberapa alkohol diberikan papad tabel % di ba$ah ini.
5abel %. ama 4mum dan nama 34& lkohol
lkohol siklik diberi nama menggunakan siklo pada a$alan dan mempertimbangkan kedudukan -OH harus pada terikat -%, misalnya seperti yang terdapat pada gambar ' di ba$ah ini.
Sikloheksanol 2-metilsiklopentanol
Gambar '. Struktur molekul dari sikloheksanol dan '-metilsiklopentanol
Suatu senya$a alkohol bila memiliki gugus hidroksi (OH) lebih dari satu, maka sistem 34& menggunakan nomor untuk menunjuk lokasi hidroksil bersama dengan a$alan di, tri, untuk menunjukkan jumlah hidroksi (OH). eberapa sistem dengan lebih dari satu hidroksi memiliki nama umum seperti yang ditunjukkan pada gambar 6 di ba$ah ini.
2. Klasifikasi Alkohol
kohol mono gugus OH dapat diklasifikasikan lebih lanjut sesuai dengan hibridisasi atom karbon yang gugus hidroksil terpasang.
(a) Senyawa yang mengandung ikatan C-OH − sp37 8i kelas ini dari alkohol, gugus-OH terikat pada sebuah atom karbon sp6 hibrid dari gugus alkil. 1ereka diklasifikasikan lebih lanjut
sebagai berikut7
&rimer, sekunder dan alkohol tersier7 8alam tiga jenis alkohol, gugus-OH terikat pada atom karbon primer, sekunder dan tersier, masing-masing seperti yang digambarkan di ba$ah ini7
(b) alkohol alilik 7 8alam alkohol ini, gugus-OH terikat pada sebuah karbon dengan hibridisasi sp6 di sebelah ikatan rangkap karbon-karbon, yaitu suatu karbon alilik. Sebagai contoh
3. Keisomeran Alkohol
Seperti yang dijelaskan pada bab sebelum, alkohol yang merupakan senya$a yang memiliki rumus umum nH'n2%-OH, akan memiliki berbagai isomer, seperti isomer struktural
baik yang merupakan isomer rantai, isomer posisi dan fungsi dan stereoisomer seperti isomer konformasi dan optic. Setiap senya$a yang memiliki isomer akan memiliki sifat fisik dan sifat kimia yang berbeda, misalnya suatu senya$a dengan rumus molekul 9H%O, maka senya$a
tersebut dapat memiliki fungsi alkohol dan eter. Senya$a tersebut akan memiliki. a. 3somer struktural yang berupa
%. *antai yaitu H6H'H'H'OH (%-butanol) dan (H6)'HH'OH ('-metil-propanol %)
'. &osisi yaitu H6H'H'H'OH (%-butanol) dan H6H'H(OH)H6 ('-butanol)
6. :ungsi yaitu yaitu H6H'H'H'OH (%-butanol) dan H6H'OH'H6 (dietil eter)
b. Stereoisomer yang berupa
%. 3somer konformasi yaitu H6H'H'H'OH (%-butanol) dapat membentuk konformasi
'. 3somer optik yaitu H6H'H(OH)H6 ('-butanol) dapat membentuk *-'-butanol dan
S-'-butanol.
4. Sifat Fsik Alkohol a. Titik didh
&erbandingan sifat fisik alkohol dengan hidrokarbon dengan berat molekul yang sebanding menunjukkan beberapa perbedaan mencolok, terutama pada itik leleh dan titik didih. lkohol secara substansial kurang stabil, memiliki titik leleh yang lebih tinggi, dan kelarutan air lebih besar dari hidrokarbon yang sesuai (lihat 5abel '), meskipun perbedaan menjadi semakin kecil dengan semakin meningkatnya berat molekul.
5abel '. &erbanding sifat fisik antara alkoho dengan senya$a hidrokarbon
lasan untuk perbedaan ini dalam sifat fisik adalah terkait dengan polaritas tinggi dari kelompok hidroksi, yang ketika diganti pada rantai hidrokarbon, menyebabkan terjadinya ukuran karakter polar pada molekul. kibatnya, terjadi atraksi yang signifikan antara satu molekul untuk lain yang terutama pada kondisi padat dan cair. ;arakter kutub ini menyebabkan asosiasi molekul alkohol dimana hidrogen kan lebih positif dari satu kelompok hidroksil dengan oksigen menjadi negatif.
<enis asosiasi disebut =ikatan hidrogen,= dan, meskipun kekuatan dari ikatan tersebut jauh lebih rendah daripada kebanyakan ikatan kimia kon0ensional, mereka masih signifikan (sekitar > sampai % kkal per bond). 8engan demikian ini merupakan alasan mengapa alkohol memiliki titik didih lebih tinggi dibandingkan dengan alkil halida, eter, atau hidrokarbon, karena untuk menguapkan molekul, diperlukan energi tambahan untuk memutus ikatan hidrogen. tau, asosiasi melalui ikatan hidrogen dapat dianggap sebagai efektif meningkatkan berat molekul, sehingga mengurangi 0olatilitas.
Gambar 9. 3katan hidrogen dalam alkohol
;elarutan alkohol dalam air dikarenakan kemampuan alkoho m untuk membentuk ikatan hidrogen dengan molekul air. ;elarutan alkohol di dalam air semakin berkurang seiring dengan peningkatan ukuran gugus alkil ?kelompok (hidrofobik)., 3katan hidrogen antara alkohol dan air seperti yang ditunjukan pada gambar > di ba$ah ini.
Gambar >. ;elarutan alkohol dalam air diakibatkan adanya ikatan hidrogen antara alkohol dengan air
eberapa alkohol dengan massa molekul relatif rendah dapat bercampur dengan air di semua proporsi seperti dapat dilihat pada tabel > berikut ini.
5abel 6. ;elarutan alkohol dalam air
. Sifat Kimia Alkohol ! "eaksi Alkohol 1) Sifat Kimia
Salah satu sifat Alkohol adalah sebagai "at amfoter, yakni dapat bertindak sebagai asam (donor proton) atau sebagai basa (akseptor proton). Sifat asam dan basa dari alkohol yang relatif sangat lemah ditunjukan oleh reaksi berikut.
a) Sebagai asam, alkohol dapat bereaksi dengan dengan larutan basa pekat (OH ) dan basa
kuat seperti H' .
'H>OH 2 OH @ 'H>O 2 H'O
'H>OH 2 H' @ 'H>O 2 H6
b) Sebagai basa, alkohol dapat bereaksi dengan asam kuat seperti Hr H6OH 2 Hr @ H6OH'2 2 r H6r 2 H'O
<enis reaksi pada alkohol tidak hanya melibatkan gugus OH nya yang reaktif, tetapi juga kerangka karbonnya.
2) "eaksi Alkohol a) "eaksi Su#stitusi
(1) *eaksi alkohol dengan logam natrium
Senya$a alkohol dan eter memiliki sifat fisis dan sifat kimia yang sangat berbeda namun demikian keduanya merupakan isomer gugus fungsi. 4ntuk membedakan kedua gugus fungsi tersebut (*-OH) dengan (*-O-*) dapat dilakukan dengan mereaksikan keduanya dengan logam a, seperti terlihat pada contoh di ba$ah ini.
'H6H'OH 2 'a(s) @ 'H6H6Oa 2 H'(g)
Atanol natrium etoksida H6OH6 2 a tidak dapat bereaksi
8imetil eter
lkohol akan bereaksi dengan logam natrium dan membebaskan gas hidrogen. Sementara itu, jika ke dalam eter ditambahkan natrium maka tidak akan terjadi reaksi. (2) "eaksi su#stitusi $u$us %& oleh halo$en mem#entuk haloalkana ("')
(a) *eaksi alkohol dengan ion l pada &l
> atau SOl'. *eaksi ini menghasilkan gas Hl
dan reaksi ini dapat digunakan sebagai reaksi identifikasi alkohol. * OH(l) 2 &l>(l) @ * l(l) 2 &Ol6(l) 2 Hl(g)
Selain alkohol dapat bereaksi dengan ion l pada &l
>, bisa juga dengan &l6. &erhatikan
contoh berikut.
6H6H'OH 2 &l6 @ ''H>l 2 &(OH)6
Atanol etil klorida
(b) *eaksi alkohol dengan ion 3 dan r berlangsung dengan bantuan H
'SO9 pekat.
'H>OH(aB) 2 H3(l) pekat @ 'H>3(l) 2 H'(l) (dengan H'SO9 pekat dan pemanasan)
(#) "eaksi alkohol den$an Asam kar#oksilat (Esterifikasi)
Asterifikasi merupakan reaksi antara alkoohol dengan asam karboksilat. Semua alkohol dapat bereaksi dengan asam karboksilat membentuk senya$a ester (alkil alkanoat) yang dikenal dengan proses esterifikasi, sedangkan eter tidak dapat bereaksi dengan asam karboksilat. *eaksi ini pertama kali dideskripsikan oleh Hermann Amil Couis :ischer dan rthur Speier (%DE>, sehingga disebut sebagai esterifikasi :ischer. 8alam reaksi ini, gugus OH dalam asam karboksilat diganti dengan gugus O* dari alkohol. Oleh karena itu,
gugus O* dalam ester berasal dari alkohol,s edangkan *O- berasal dari asam karboksilat.
ontoh7 H6H'OH 2 H6OOH (katalis H'SO9) H6OOH'H6 2 H'O
Atanol asam etanoat etil etanoat (ester) (c) "eaksi su#stitusi radikal
lkohol dapat bereaksi dengan halogen (F') melalui reaksi susbstitusi radikal dengan
bantuan cahaya. danya cahaya memungkinkan F' terpisah membentuk radikal bebas (F).
H6OH(l) 2 l'(g) (cahaya) @ H'lOH(l) 2 Hl(g)
*eaksi substitusi akan menggantikan gugus atom H dengan l d) *eaksi Aliminasi (eliminasi air dari alkohol atau disebut dehidrasi)
(%) lkohol dapat membentuk alkena dengan bantuan katalis H'SO9 pekat berlebih.
(') lkohol dapat bereaksi membentuk eter
*eaksi pembentukan garam alkoksida dengan katalis logam. lkohol dapat bereaksi dengan logam aktif, seperti a dan ;, menghasilkan garam alkoksida dan gas hidrogen.
lkohol 2 a @ Garam 2 H'
'* OH 2 'a @ '* Oa 2 H'
Sebagai contoh, natrium bereaksi secara cepat dengan etanol menghasilkan gas hidrogen H6H'OH 2 ' a 'H6H'Oa 2 H'
Atanol atrium etoksida e) *eaksi Oksidasi
lkohol bereaksi dengan oksidator seperti ; 'r 'O , ;1nO9, dan O' dengan bantuan
katalis.
(%) Oksidasi etanol oleh O', oksidasi sempurna pada alkohol akan menghasilkan air dan gas
O', seperti yang terlihat pada persamaan di ba$ah ini 'H>OH(l) 2 6O'(g) @ 'O'(g) 2 6H'O(l)
(a) Oksidasi oleh ; 'r 'O, ;1nO9. lkohol primer, sekunder dan tersier memberikan reaksi
berbeda terhadap oksidator seperti ; 'r 'O, ;1nO9, dan O'. 8engan bantuan katalis,
atom O dari oksidator akan menyerang atom H yang terikat pada atom yang mengandung gugus OH (atom karbinol).
Alkohol rimer mudah teroksidasi membentuk aldehida, yang akan teroksidasi dengan cepat membentuk asam karboksilat.
H6H'OH @ H6HO @ H6OOH
Atanol Atanal asam etanoat (asam cuka) Alkohol sekunder mudah teroksidasi membentuk alkanon (keton)
Alkohol tersier tidak mudah teroksidasi karena tidak memiliki atom H yang terikat pada atom karbinol atau atom tidak ada atom H yang tertikat pada gugus -OH
(tidak dapat dioksidasi)
(f) Fermentasi alkohol
:ermentasi alkohol adalah reaksi perubahan gula menjadi alkohol dengan bantuan miikroorganisme atau en"im tertentu. *eaksi fermentasi secara umum dapat ditunjukan sebagai berikut.
H%'O @ ''H>OH 2 'O'
Glukosa etanol
1inuman beralkohol pertama kali dibuat melalui fermentasi buah anggur. Hal tersebut dilakukan oleh negara negara Aropa. Senya$a alkohol yang terdapat dalam minuman hasil fermentasi anggur terutama etanol. ahan baku pembuatan etanol adalah glukosa. Ann"im untuk mengubah glukosa menjadi etanol yaitu en"im "imase yang diproduksi oleh ragi. Glukosa dapaat diperoleh dari tetes tebu atau amilum. 5etes tebu adalah cairan gula tebu yang tidak berbentuk kristal. 5etes tebu banyak mengandung sukrosa. Sukrosa dapat dihidrolisis menghasilkan glukosa (H%'O). milum adalah
polimer dari glukosa. milum banyak terdapat pada akar, biji, dan umbi tumbuhan. 1isalnya ubi jalar, kentang dan singkong. 5anaman jagung juga mengandung amilum. $) Per#edaan Struktur Fun$sional Alkohol dan Eter
8alam lkohol oksigen gugus-OH terikat dengan ikatan sigma ( σ) pada satu
karbon sp6 (sp6-OH), sedangkan eter gugus O diikat oleh dua gugus karbaon sp6 (sp6
-O-sp6). Gambar di ba$ah ini menggambarkan aspek struktural metanol dan
TUGAS A
arilah konsep-konsep kunci dari bacaan di atas kemudian susunlah peta konsepnya dengan langkah-langkah
%. 3dentifikasi konsep-konsep kunci
'. nalisis konsep-konsep kunci secara hirarkhi dengan meletakannya pada matrik kolom hirarkhi konsep
Tin$kat konse* konse*
4tama Superordinat Ordinat subordinat Subsubordinat?spesifik? contoh
6. Susunlah peta konsepnya
9. Hubungkan dengan menggunakan kata-kata yang logis agar hubungan antar konsep memiliki makna
+. ETE"
Ater merupakan senya$a organic yang mengndung oksigen dengan hibridisasi sp6 dengan rumus umum yaitu *-O-* (* merupakan gugus alkil). Sen ya$a eter tidak hanya terjadi pada rantai lurus (alifatis) yang terbuka tetapi terjadi pada senya$a yang berbentuk rantai yang tertutup (siklis). Apoksida merupakan senya$a yang mengandung cincin eter yang
beranggotakan tiga atom yaitu , H, dan O. Apoksida merupakan senya$a yang lebih reaktif dibandingkan dengan eter yang lain yang disebabkan oleh ukuran cincinnya yang kecil. Sistem cincin dengan satuan yang terulang dari O-H'-H'- disebut makhota (crown). Senya$a ini
merupakan reagensia yang berharga yang dapat digunakan untuk membantu melarutkan garam garam anorganik dalam pelarut organic. eberapa senya$a eter dalam bentuk siklis dapat dilihat pada gambar di ba$ah ini.
Gambar . eberapa senya$a eter siklis 1. Penamaan Eter
Ater dalam system 34& disebut alkoksialkana. &enamaan dengan member nama alkoksi pada gugus alkil terkecil (yang terikat pada atom oksigen (-O*) dan nama alkana pada gugus
4ntuk eter yang lebih komplek penamaannya tetap menggunakan a$al jumlah alkoksi yang diikat pada system hidrokarbon, misalnya di untuk ' gugus alkoksi, tri untuk 6 gugus alkoksi, dan tetra untuk 9 gugus alkoksi.
,AT-&A A
5abel 9. 5atanama dari senya$a Ater baik nama tri0ial maupun 34&
2. Sifat'sifat fisika Eter
Sifat-sifat fisika yang akan dibahas pada senya$ eter meliputi titik didih dan kelarutan eter
a. Titik didih
Senya$a eter memiliki titik didih (boiling points) yang hamper sama dengan senya$a hidroharbon jika gugus atom oksigen menggantikan gugus H'. 5itik didih dari senya$a eter
dan senya$a hidrokabon dapat dilihat pada gambar di ba$ah ini.
amun demikian titik didih senya$a eter lebih kecil dari pada alkohol yang memiliki masa molekul relati0e yang sama. Hal ini disebabkan eter tidak dapat membentuk ikatan hydrogen, disebabkan eter tidak mempunyai hydrogen yang terikat pada oksigen.
#. Kelarutan
;elarutan eter dalam air hamper sama dengan alkohol, karena eter akan membentuk ikatan hidrogen dengan air.
* O * ikatan hidrogen
H O H
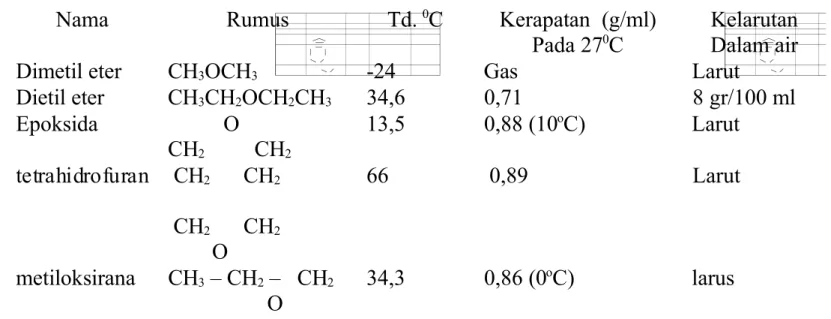
5abel >. sifat fisik eter dan epoksida
ama *umus 5d. ;erapatan (g?ml)
&ada '
;elarutan 8alam air 8imetil eter H6OH6 -'9 Gas Carut
8ietil eter H6H'OH'H6 69, ,% D gr?% ml
Apoksida O H' H' %6,> ,DD (%o) Carut tetrahidrofuran H' H' H' H' O ,DE Carut metiloksirana H6 H' H' O 69,6 ,D (o) larus
Alektron non-bonding pada alkil eter bersifat basa sangat lemah. 3katan atom hydrogen yang lemah akan terjadi bila bertemu dengan air sehingga eter mudah larut dalam air. Oksigen pada eter akan bila berada di dalam senya$a yang memiliki keasaman yang sangat kuat ( strong acids), seperti yang terlihat pada gambar D di ba$ah ini.
3. "eaksi Su#stitusi Eter
Ater merupakan senya$a yang sanat tidak reaktif dan berprilaku seperti alkena daripada senya$a yang mengndung gugus fungsional. Ater bila direaksi dengan asam kuat pada kondisi panas maka akan terjadi reaksi substitusi. 1isalnya suatu asam H3 atau Hr dipanaskan
kemudian direaksikan dengan eter, maka akan menghasillkan alkohol dan alkil halida. amun dalam hal ini alkohol akan berreaksi lanjut dengan H3 atau Hr untuk menghasilkan alkil iodide atau alkil bromide.
H6H'OH'H6 2 Hr (kalor) H6H'r 2 H6H'OH
dietil eter romoetana etanol
2 Hr H6H'r
Suatu substitusi epoksida dengan menggunakan reagen Grignard yang mengandung atom karbon bermuatan negatif akan mampu menyerangkan cincin epoksida akan menghasilkan produk garam 1g suatu alkohol kemudian akan menghasilkan alkohol setela dihidrolisis.
O O- 21gr
H6(H')61gr 2 H' H' H6(H')6H'H'
H'O, H2 H6(H')6H'H'OH
4. Sintesis Eter
a. Sintesis dietileter
8i dalam kondisi yang tepat reaksi antara H'SO9 (asam sulfat) dengan
H6H'OH (etanol) akan menghasilkan dietileter melalui etil hydrogen sulfat sebagai "at
antara
H6H'OH 2 H'SO9 H6H'OSO6H 2 H6H'OH H6H'OH'H6
b. Sintesis Iiliamson
Sintesis Iiliamson merupakan prosedur sintesis eter yang paling sering dilakukan di laboratorium. Sintesis ini mengikuti mekanisme S' antara alkil halide dengan suatu alkosida atau fenoksida. *endemen terbaik akan diperoleh bila alkil halide itu berupa gugus metil atau alkil halide primer, karena bila digunakan alkil halide skunder atau
H6O 2 H6H'H'-l H6OH'H'H6 2 l (S')
3on metoksida %-kloropropona metil propil eter
H6H'H'O- 2 H6l H6OH'H'H6 2 l- (S')
3on propoksida klorometana metil propil eter /. Eter 0ahkota
Ater mahkota merupakan eter siklik yang strukturnya terdiri dari satuan OH'H'- yang
berulang, gugus tersebut merupakan turunan dari %,'-etadiol. Sen ya$a ini diberi nama sebagai #-cro$n-y. dimana # merupakan jumlah atom total dalam cincin, sedangkan y adalah banyaknya atom oksigen dalam cincin. Sebagai contoh perhatikan gambar di ba$ah ini.
Gambar . 1erupakan gambaran struktur molekul dari %D-cro$n-
&ada contoh gambar di atas tampak bah$a jumlah atom total yang terdapat di dalam cincin sebanyak %D atom (#) dan atom oksigen (y).
TAS B
acalah bahan ajar eter di atas, carilah konsep-konsep kuncinya, kemudian susunlah peta konsepnya berbentuk hirarki. Cakukan seperti tugas di atas
8:5* &4S5;
%. linger, orman C., 1ichael &. a0a., 8on 8e <ongh., arl *
<honson. . %EE, Organic Chemistry, second Adition, 4nited State merica, Iorth &ublishers. 3nc
'. arey, :.. ('). Organic Chemistry! 9rd Ad. e$ /ork7
1cGra$-Hill ompanies, 3nc.
6. :essenden, *.<. dan :essenden, <.S. (%EED). "imia Organik . <ilid %. &enerjemah H &udjaatmaka. <akarta7 Arlangga
9. :essenden, *.<. dan :essenden, <.S. (%EED). "imia Organik . <ilid '. &enerjemah H &udjaatmaka. <akarta7 Arlangga
>. Hart, H., raine, C.A. J Hart, 8.<. ('6). "imia Organik! Suatu "uliah Singkat . Adisi ke F3. &enerjemah7 chmadi, S.S., <akarta7 Arlangga.
. Solomon, 5.I.G. J :ryhle, .. ('%%). Organic Chemistry! e$