KARAKTERISASI BAKTERI NITRIFIKASI KOLAM IKAN
AIR TAWAR DI KABUPATEN CIREBON, JAWA BARAT
MEILIANA CHOIRIYAH
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
BOGOR 2016
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Karakterisasi Bakteri Nitrifikasi Kolam Ikan Air Tawar di Kabupaten Cirebon, Jawa Barat adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Desember 2016
Meiliana Choiriyah
ABSTRAK
MEILIANA CHOIRIYAH. Karakterisasi Bakteri Nitrifikasi Kolam Ikan Air Tawar di Kabupaten Cirebon, Jawa Barat. Dibimbing oleh IMAN RUSMANA dan YUNI PUJI HASTUTI.
Penurunan kualitas lingkungan perairan kolam ikan akibat akumulasi nitrogen anorganik berpengaruh terhadap respon fisiologis dan respon pertumbuhan biota budidaya secara langsung dan tidak langsung. Pencemaran lingkungan tersebut dapat diatasi melalui teknologi bioremediasi. Bioremediasi adalah salah satu metode yang diaplikasikan dalam penanggulangan pencemaran lingkungan dengan melibatkan aktivitas metabolisme mikroba yang mampu menurunkan konsentrasi nitrogen anorganik yang toksik dalam air tanpa mengganggu kehidupan ikan selama periode budidaya, dengan cara mengkondisikan proses oksidasi amonium menjadi nitrit (nitritasi) dan oksidasi nitrit menjadi nitrat (nitratasi) yang semua proses tersebut disebut sebagai nitrifikasi. Terkait dengan kajian terhadap mekanisme proses nitrifikasi tersebut, maka perlu dilakukan uji aktivitas terhadap mikroba yang terlibat di dalamnya. Penelitian ini bertujuan melakukan karakterisasi bakteri nitrifikasi kolam ikan air tawar di Kabupaten Cirebon, Provinsi Jawa Barat. Kelimpahan kelompok bakteri nitritasi (AOB) lebih tinggi dibandingkan bakteri nitratasi (NOB). Karakterisasi kedua kelompok bakteri dilakukan pada 18 isolat yang merupakan bakteri Gram negatif. Hasil seleksi aktivitas penurunan konsentrasi amonium dan nitrit menunjukkan bahwa isolat CRB 106 (AOB) dan isolat CRB 202 (NOB) merupakan isolat yang paling mampu menurunkan konsentrasi amonium dan penurunan konsentrasi nitrit. Pengujian kinetika oksidasi nitrit pada isolat CRB 202 menghasilkan laju maksimum (Vmaks) dan nilai Km sebesar 0.071 mM.jam-1 dan 0.010 mM.
Kata kunci: bioremediasi, kolam ikan, nitratasi, nitritasi, nitrogen anorganik
ABSTRACT
MEILIANA CHOIRIYAH. Characterization of Nitrifying Bacteria of Freshwater Fish Ponds in Cirebon Regency, West Java. Supervised by IMAN RUSMANA and YUNI PUJI HASTUTI.
The decresing of environmental quality in freshwater ponds due to inorganic nitrogen accumulation influences directly or indirectly to the physiological and growth responses of cultivated aquatic biota. Pollution of aquatic environment can be solved by bioremediation technology. Bioremediation is one of the environmental pollution treatment method by involving microbial metabolic activities to decrease the concentration of inorganic nitrogen without disturbing the fish during the cultivation period. One of the microbial processes involved in bioremediation is the oxidation process of ammonium into nitrite (nitritation) and nitrite oxidation into nitrate (nitratation), which the whole processes are known as nitrification. To understand mechanism process of the nitrification, the activity examination towards the involved microbes in bioremediation is needed. Therefore the aim of this research was to characterize nitrifying bacteria isolated from freshwater fish ponds in Cirebon Regency, West Java. The bacterial isolates were isolated from water and sediment samples of a freshwater pond in Cirebon, West Java. Ammonium Oxidizing Bacteria (AOB) abundance in the freshwater pond was higher than Nitrite Oxidizing Bacteria (NOB). The characterization was perfomed to the 18 isolates. All of them were Gram-negative bacteria. The result showed that CRB 106 isolate (AOB) was the best isolate in decreasing ammonium concentration and CRB 202 isolate (NOB) was the best isolate in decreasing nitrite concentration. The maximum rate (Vmax) and the Km value of nitrite oxidation kinetics of CRB 202 isolate were 0.071 mM.h-1 and 0.010 mM, respectively.
Keywords: bioremediation, freshwater ponds, inorganic nitrogen, nitratation, nitritation
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biologi
KARAKTERISASI BAKTERI NITRIFIKASI KOLAM IKAN
AIR TAWAR DI KABUPATEN CIREBON, JAWA BARAT
MEILIANA CHOIRIYAH
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
BOGOR 2016
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Februari ini yaitu Bioremediasi, dengan judul Karakterisasi Bakteri Nitrifikasi Kolam Ikan Air Tawar di Kabupaten Cirebon, Jawa Barat.
Terima kasih penulis ucapkan kepada Dr Ir Iman Rusmana, MSi dan Yuni Puji Hastuti, SPi, MSi selaku pembimbing atas saran dan dukungan dalam penelitian dan penyusunan karya ilmiah ini dan kepada Dr Ir Miftahudin, MSi sebagai penguji ujian karya ilmiah. Keluarga tercinta, yaitu Bapak Djunita, Ibu Saidah, Kak Nurudin Dian Oriza, Kak Iman Hakim, Kak Yusuf serta keluarga besar atas limpahan doa, dukungan, dan motivasinya. Ucapan terima kasih juga saya sampaikan kepada rekan-rekan IRCrew yaitu Louis, Adel, Amel, Kak Ukin, Mas Alfan, Ibu Rina, Kak Uli, Ka Erma dan rekan Mikrobiologi lainnya, yang telah memberikan arahan dan motivasi selama penelitian, tak lupa juga saya ucapkan terima kasih kepada rekan-rekan Biologi angkatan 49 atas segala dukungan dan doanya kepada saya dalam menyelesaikan karya ilmiah ini. Semoga karya ilmiah ini bermanfaat.
Bogor, Desember 2016
DAFTAR ISI
DAFTAR TABEL vi DAFTAR GAMBAR vi DAFTAR LAMPIRAN vi PENDAHULUAN 1 Latar Belakang 1 Tujuan Penelitian 2 Manfaat Penelitian 2 METODE 2Waktu dan Tempat Penelitian 2
Alat dan Bahan 2
Metode Penelitian 2
HASIL DAN PEMBAHASAN 4
SIMPULAN DAN SARAN 11
Simpulan 11
Saran 11
DAFTAR PUSTAKA 11
RIWAYAT HIDUP 16
DAFTAR TABEL
1 Kelimpahan bakteri nitritasi dan nitratasi pada kolam ikan air tawar
di Kabupaten Cirebon, Jawa Barat 4
2 Karakteristik morfologi koloni dan sel isolat bakteri nitritasi hasil isolasi dari kolam ikan air tawar di Kabupaten Cirebon, Jawa Barat 6
3 Karakteristik morfologi koloni dan sel isolat bakteri nitratasi hasil isolasi dari kolam ikan air tawar di Kabupaten Cirebon, Jawa Barat 7
4 Aktivitas oksidasi amonium isolat bakteri nitritasi hasil isolasi dari kolam ikan air tawar di Kabupaten Cirebon, Jawa Barat setelah 3 hari inkubasi 8
5 Aktivitas oksidasi nitrit isolat bakteri nitratasi hasil isolasi dari kolam ikan air tawar di Kabupaten Cirebon, Jawa Barat setelah 3 hari inkubasi 8
DAFTAR GAMBAR
1 Bentuk morfologi koloni bakteri nitrifikasi: a. Koloni bundar, b. Koloni bundar tepian berkarang 52 Bentuk morfologi sel bakteri nitrifikasi: a. Kokus, b. Basil 6
3 Laju oksidasi amonium isolat CRB 106 dan laju oksidasi nitrit isolat CRB 202 10
DAFTAR LAMPIRAN
1 Komposisi media nitritasi 142 Komposisi media nitratasi 14
3 Kurva standar amonium 15
PENDAHULUAN
Latar Belakang
Sektor perikanan tangkap ataupun perikanan budidaya menjadi potensi utama sumber daya alam yang dimanfaatkan oleh masyarakat bertempat tinggal di wilayah garis pantai, salah satunya di wilayah Kabupaten Cirebon. Hal ini menjadikan Kabupaten Cirebon sebagai salah satu kontributor pangan terutama dalam produksi budidaya air tawar dan air payau untuk wilayah Provinsi Jawa Barat (Yulianti 2015). Hasil produksi perikanan yang tinggi didukung dari sistem budidaya yang intensif, dengan adanya peningkatan kepadatan ikan dan pakan tambahan. Masalah yang dapat muncul dalam budidaya secara intensif yaitu terjadinya penurunan kualitas air yang disebabkan karena meningkatnya limbah nitrogen anorganik yang dihasilkan dari degredasi sisa pakan berupa amonia (NH3), nitrit (NO2-), dan nitrat (NO3-) (Widiyanto 2006). Akumulasi limbah nitrogen dapat menyebabkan penurunan kualitas air yang berpengaruh terhadap proses fisiologi, tingkah laku, pertumbuhan, dan mortalitas ikan (Effendi et al. 2015). Permasalahan lingkungan tersebut menjadi salah satu dampak penurunan produksi perikanan budidaya untuk wilayah Jawa Barat pada tahun 2013 sebesar 546.051 ton dari tahun sebelumnya yang mencapai 778.999 ton (SIDATIK 2013).
Permasalahan akumulasi senyawa nitrogen anorganik dapat ditanggulangi melalui bioremediasi. Bioremediasi menjadi salah satu metode yang diaplikasikan dengan tujuan menurunkan akumulasi nitrogen dalam bentuk amonia dan nitrit pada tingkat konsentrasi aman. Konsentrasi yang aman untuk budidaya ikan air tawar, yaitu amonia kurang dari 0.01 mg/L dan nitrit kurang dari 0.06 mg/L (BBPBAT 2014). Konsentrasi amonia yang melebihi konsentrasi aman akan berpengaruh terhadap rusaknya jaringan insang ikan, lembaran insang akan mengalami pembengkakan, sehingga fungsi insang sebagai alat pernapasan akan terganggu dalam pengikatan oksigen dari air (Kilawati dan Maimunah 2015). Sedangkan konsentrasi nitrit yang tinggi, menyebabkan ion nitrit mengoksidasi Fe2+ dalam haemoglobin menjadi Fe3+ membentuk methaemoglobin. Kandungan methaemoglobin dalam darah 30-40% mampu menimbulkan gejala klinis pada biota akuatik (Anjana et al. 2007).
Salah satu pendekatan bioremediasi yang dapat dilakukan adalah dengan mengkaji proses nitrifikasi. Nitrifikasi adalah proses bioremediasi yang melibatkan kedua kelompok bakteri kemolitoautotrof, yaitu ammonia-oxidizing bacteria (AOB) atau bakteri nitritasi yang mengoksidasi amonia menjadi nitrit dan nitrite-oxidizing bacteria (NOB) atau bakteri nitratasi yang mengoksidasi nitrit menjadi nitrat (Park dan Noguera 2007). Bakteri nitrifikasi yang memiliki peran penting dalam proses degredasi polutan yaitu bakteri autotrof dan heterotrof (Xie et al. 2012). Bakteri autotrof menjadi kelompok bakteri nitrifikasi yang memiliki peran paling tinggi dalam mengoksidasi amonia (Wang et al. 2009), bakteri autotrof menggunakan senyawa anorganik sebagai sumber karbonnya. Selain konsentrasi amonia dan nitrit, faktor pengontrol lingkungan lainnya dalam proses nitrifikasi yaitu pH, Dissolved Oxygen (DO), dan suhu (Wu et al. 2007). Pendekatan bioremediasi melalui proses nitrifikasi diharapkan dapat menjaga keseimbangan senyawa nitrogen anorganik pada kolam dengan melepaskan N2
2
atau N2O ke atmosfir. Sehingga karakterisasi dan seleksi aktivitas bakteri nitrifikasi dalam menurunkan amonium dan nitrit yang ditumbuhkan pada media autotrof perlu dilakukan sebagai langkah awal untuk mendapatkan agen bioremediasi terbaik, yang selanjutnya akan digunakan dalam pengelolaan dan monitoring kualitas lingkungan perairan.
Tujuan Penelitian
Penelitian ini bertujuan melakukan karakterisasi bakteri nitrifikasi yang diisolasi dari kolam ikan air tawar di Kabupaten Cirebon, Jawa Barat.
Manfaat Penelitian
Penelitian ini dijadikan sebagai informasi awal, yaitu mendapatkan isolat bakteri nitrifikasi yang memiliki kemampuan terbaik dalam menurunkan konsentrasi amonium dan nitrit, sehingga selanjutnya dapat dijadikan acuan dalam penelitian lanjutan yang berkaitan dengan penelitian bakteri nitrifikasi.
METODE
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Februari 2015 sampai Juli 2016 di Laboratorium Mikrobiologi, Departemen Biologi, FMIPA IPB. Sampel merupakan isolat yang diambil dari kolam ikan air tawar di Kabupaten Cirebon, Jawa Barat.
Alat dan Bahan
Alat yang digunakan dalam penelitian ini adalah Laminar Air Flow Cabinet, autoklaf, spektrofotometer, inkubator berpenggoyang, cawan petri, pipet mikro, dan sentrifus. Bahan yang digunakan dalam penelitian ini adalah sampel campuran air dan sedimen dari kolam ikan air tawar di Kabupaten Cirebon, Jawa Barat. Media nitritasi dan nitratasi dengan natrium karbonat (NaCO3) sebagai sumber karbonnya. Reagen yang digunakan adalah reagen amonium dan nitrit.
Metode Penelitian Isolasi Bakteri Nitrifikasi
Sampel air dengan sedimen kolam ikan air tawar di Kabupaten Cirebon, Jawa Barat dengan kode isolat CRB. Isolasi bakteri nitrifikasi menggunakan
3 metode langsung cawan sebar pada media nitritasi dan nitratasi (Novita et al. 2014) (Lampiran 1 dan 2). Sampel dikulturkan selama 7 hari pada suhu 28◦C. Kemudian setelah 7 hari, dilakukan perhitungan jumlah koloni menggunakan metode Colony Forming Unit (CFU), pada cawan yang mengandung jumlah koloni antara 30-300. Setiap koloni yang terpisah dimurnikan dengan metode kuadran sampai diperoleh koloni murni. Isolat murni diamati morfologi koloninya, meliputi bentuk, warna, elevasi, dan tepiannya. Selanjutnya dilakukan teknik pewarnaan Gram.
Seleksi Aktivitas Bateri Nitrifikasi
Seleksi ini bertujuan memilih isolat bakteri dengan penurunan konsentrasi amonium dan nitrit tertinggi selanjutnya akan dilakukan uji kinetika aktivitas nitrifikasi. Sebanyak 2 lup isolat murni bakteri nitrifikasi diinokulasi pada 50 mL media cair nitritasi dan nitratasi. Selanjutnya diinkubasi pada inkubator berpenggoyang 120 rpm selama 3 hari pada suhu 28◦C. Pengukuran aktivitas oksidasi amonium dan nitrit dilakukan melalui analisis kadar amonium dan nitrit. Kinetika Aktivitas Oksidasi Amonium dan Oksidasi Nitrit
Inokulum ditumbuhkan pada 50 mL media cair nitritasi untuk bakteri pengoksidasi amonium dan media cair nitratasi untuk bakteri pengoksidasi nitrit. Selanjutnya diinkubasi pada kecepatan 120 rpm dan pada suhu 28◦C selama tiga hari. Kultur bakteri yang telah diinkubasi dibuat pelet dengan cara sentrifugasi pada kecepatan 10.000 rpm selama 15 menit. Pelet dipisahkan dan diresuspensi dengan medium nitritasi tanpa amonium dan medium nitratasi tanpa nitrit. Sebanyak 1 mL kultur bakteri nitritasi dan nitratasi diinokulasikan ke dalam 10 mL medium nitritasi dan nitratasi dengan konsentrasi amonium atau nitrit pada masing-masing kultur sebesar 0, 200, 400, 600, 800, dan 1000 µM dilakukan secara duplo. Kemudian diinkubasi selama 3 jam pada kecepatan 120 rpm, pada suhu 28◦C. Kontrol masing-masing perlakuan dibuat tanpa diinokulasi kultur bakteri. Analisis kinetika oksidasi amonium dan nitrit dilakukan dengan persamaan kinetika Michaelis-Menten menggunakan plot Lineweaver Burk. Analisis Kadar Amonium
Sebanyak 2 mL sampel ditambah 0.08 mL fenol alkohol 10 %, 0.08 mL sodium nitroprusid, 0.2 mL campuran hipoklorit teknis dan alkalin sitrat 20 % (1:4). Kemudian didiamkan selama 1 jam pada ruang gelap. Setiap setelah pemberian pereaksi dilakukan pengadukan. Pemberian pereksi akan menghasilkan warna biru. Kadar amonium ditentukan dengan metode spektrofotometri yang diukur pada panjang gelombang 640 nm (Greenberg et al. 1992). Nilai absorban yang diperoleh dikonversi menggunakan kurva standar hingga diperoleh satuan dalam konsentrasi (Lampiran 3).
4
Analisis Kadar Nitrit
Sebanyak 2 mL sampel ditambah dengan 0.08 mL pewarna nitrit. Pewarna nitrit dibuat dengan membuat larutan stok sulfanilamid dan NED. Kemudian didiamkan selama 10 menit. Setiap setelah pemberian pereaksi dilakukan pengadukan. Pemberian pereaksi akan menghasilkan warna merah muda hingga keunguan. Kadar nitrit ditentukan dengan metode spektrofotometri yang diukur pada panjang gelombang 543 nm (Eaton et al. 2005). Nilai absorban yang diperoleh dikonversi menggunakan kurva standar hingga diperoleh satuan dalam konsentrasi (Lampiran 4).
HASIL DAN PEMBAHASAN
Isolat Bakteri Nitrifikasi dari Kolam Ikan Air Tawar
Bakteri nitrifikasi yang diisolasi dari sampel air dan sedimen kolam ikan air tawar ditumbuhkan pada media cawan agar nitritasi dan nitratasi selama 48 sampai 72 jam pada kondisi aerob. Penghitungan kelimpahan dilakukan sampai tingkat pengenceran 10-4. Kelimpahan bakteri yang ditumbuhkan pada media nitritasi lebih tinggi dibandingkan bakteri yang ditumbuhkan pada media nitratasi. (Tabel 1).
Tabel 1 Kelimpahan bakteri nitritasi dan nitratasi pada kolam ikan air tawar di Kabupaten Cirebon, Jawa Barat
Jenis sampel Media Jumlah isolat
didapat cfu.mL-1 Jumlah isolat digunakan Air dan sedimen Nitritasi 250 x 104 8 Nitratasi 134 x 102 10
Isolasi bakteri nitrifikasi kolam ikan air tawar dibedakan menjadi kelompok bakteri pengoksidasi amonium menjadi nitrit (nitritasi) dan pengoksidasi nitrit menjadi nitrat (nitratasi). Berdasarkan hasil isolasi bakteri nitrifikasi bahwa kelimpahan bakteri yang ditumbuhkan pada media nitritasi lebih tinggi dibandingkan bakteri yang ditumbuhkan pada media nitratasi (Tabel 1). Kelimpahan yang berbeda pada kedua kelompok bakteri nitrifikasi dari campuran air dan sedimen kolam ikan didukung oleh jumlah nitrogen anorganik dalam bentuk amonium lebih banyak dibandingkan nitrogen anorganik dalam bentuk nitrit. Senyawa amonia dan amonium paling banyak ditemukan pada sedimen kolam, sehingga keberadaan agen nitrifikasi pada sedimen kolam didominasi oleh keberadaan bakteri dan golongan archaea pengoksidasi amonia (NH3) dan amonium (NH4+) (Berman dan Francis 2006). Nitrogen dalam bentuk amonia dan amonium akan dimanfaatkan sebagai sumber energi bakteri tersebut. Sistem perairan yang mempunyai kandungan oksigen tinggi, senyawa nitrit sangat jarang ditemukan dalam konsentrasi tinggi, karena sifat nitrit yang tidak stabil (Makmur
5
et al. 2012), sehingga keberadaan bakteri pengoksidasi nitrit yang memanfaatkan nitrit sebagai substratnya lebih rendah dibandingkan keberadaan bakteri pengoksidasi amonium. Selain substrat, pengaruh suhu menjadi salah satu faktor yang menentukan kelimpahan kedua kelompok bakteri pada suatu lingkungan tertentu (Yang et al. 2007).
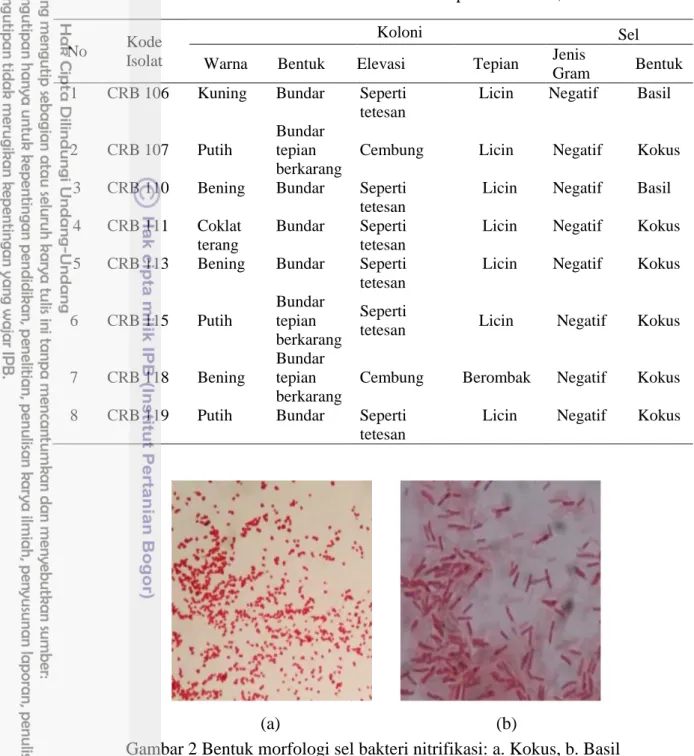
Karakteristik Morfologi Isolat Hasil Isolasi dari Kolam Ikan Air Tawar Isolat bakteri nitrifikasi yang berhasil dimurnikan dengan metode kuadran, selanjutnya dikarakterisasi berdasarkan koloni morfologi dan sel. Berdasarkan pengamatan koloni tunggal pada kedelapan belas isolat, terlihat bahwa isolat bakteri nitrifikasi mempunyai bentuk koloni bundar dan sebagian lainnya berbentuk bundar berkarang (Gambar 1), dengan koloni didominasi tepian licin. Isolat menunjukkan warna muda pada selnya, sehingga semua sel bakteri pengoksidasi amonium dan nitrit digolongkan bakteri Gram negatif. Sel pada 5 isolat bakteri pengoksidasi amonium berbentuk kokus, sedangkan 3 isolat lainnya berbentuk basil (Tabel 2) (Gambar 2). Sel pada 8 isolat bakteri pengoksidasi nitrit berbentuk kokus, sedangkan 2 isolat lainnya berbentuk basil (Tabel 3) (Gambar 2). Kedelapan belas isolat bakteri nitritasi dan nitratasi murni ditumbuhkan pada media nitritasi dan nitratasi dengan karbonat sebagai sumber karbonnya secara aerobik, karena bakteri nitrifikasi yang tumbuh pada kondisi aerob menggunakan oksigen sebagai akseptor elektron terakhir (Wunderlin et al. 2012), yang digunakan dalam proses respirasi untuk pembentukan energi.
(a) (b)
Gambar 1 Bentuk morfologi koloni bakteri nitrifikasi: a. Koloni bundar, b. Koloni bundar tepian berkarang
6
Tabel 2 Karakteristik morfologi koloni dan sel isolat bakteri nitritasi hasil isolasi dari kolam ikan air tawar di Kabupaten Cirebon, Jawa Barat
(a) (b)
Gambar 2 Bentuk morfologi sel bakteri nitrifikasi: a. Kokus, b. Basil
Berdasarkan hasil karakteristik morfologi koloni dan sel dari kedua kelompok bakteri nitrifikasi, bahwa kelompok bakteri nitrifikasi tergolong bakteri Gram negatif dengan bentuk sel kokus dan basil. Hal ini sesuai dengan pernyataan Holt et al. (1994) bahwa bakteri nitrifikasi aerobik yang hidup pada pH optimum 7-9 dan pada suhu 28oC, umumnya mempunyai ciri jenis Gram negatif sel berbentuk kokus, basil, spiral, atau ellipsoid, dan koloni berwarna kuning kecoklatan hingga coklat terang dan bening pada media agar. Selanjutnya kedelapan belas koloni murni diseleksi aktivitasnya berdasarkan kemampuan menurunkan konsentrasi amonium dan nitrit.
No Kode
Isolat
Koloni Sel
Warna Bentuk Elevasi Tepian Jenis
Gram Bentuk
1 CRB 106 Kuning Bundar Seperti
tetesan
Licin Negatif Basil
2 CRB 107 Putih
Bundar tepian berkarang
Cembung Licin Negatif Kokus
3 CRB 110 Bening Bundar Seperti
tetesan
Licin Negatif Basil
4 CRB 111 Coklat
terang
Bundar Seperti
tetesan
Licin Negatif Kokus
5 CRB 113 Bening Bundar Seperti
tetesan
Licin Negatif Kokus
6 CRB 115 Putih
Bundar tepian berkarang
Seperti
tetesan Licin Negatif Kokus
7 CRB 118 Bening
Bundar tepian berkarang
Cembung Berombak Negatif Kokus
8 CRB 119 Putih Bundar Seperti
tetesan
7 Tabel 3 Karakteristik morfologi koloni dan sel isolat bakteri nitratasi hasil
isolasi dari kolam ikan air tawar di Kabupaten Cirebon, Jawa Barat
No Kode
Isolat
Koloni Sel
Warna Bentuk Elevasi Tepian Jenis
Gram Bentuk
1 CRB 201 Bening
Bundar tepian berkarang
Cembung Licin Negatif Kokus
2 CRB 202 Putih
Bundar tepian berkarang
Cembung Licin Negatif Basil
3 CRB 204 Coklat
Bundar tepian berkarang
Cembung Licin Negatif Basil
4 CRB 205 Kuning
Bundar tepian berkarang
Cembung Licin Negatif Kokus
5 CRB 206 Bening
Bundar tepian berkarang
Cembung Licin Negatif Kokus
6 CRB 207 Bening Bundar Cembung Licin Negatif Kokus
7 CRB 210 Bening Bundar Seperti
tetesan
Licin Negatif Kokus
8 CRB 211 Bening Bundar Seperti
tetesan
Licin Negatif Kokus
9 CRB 212 Bening
Bundar tepian berkarang
Cembung Licin Negatif Kokus
10 CRB 213 Bening Bundar tepian berkarang Cembung Licin Negatif Kokus
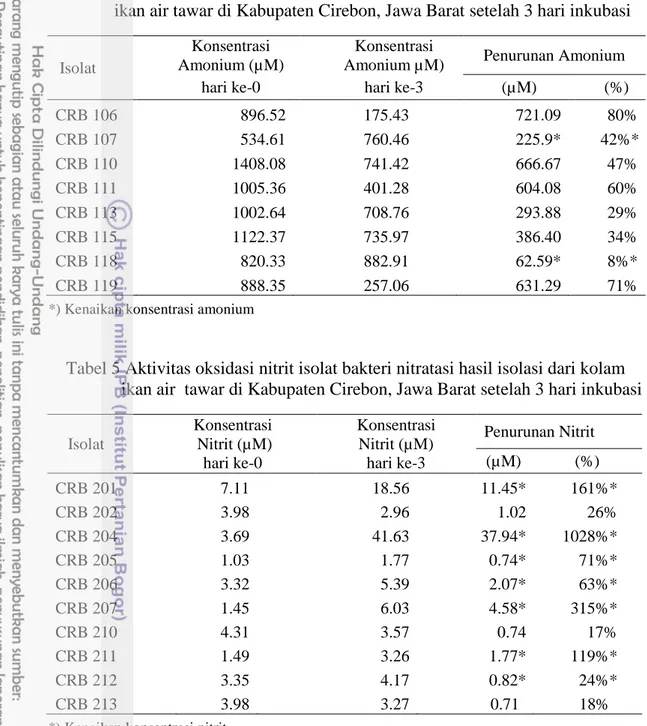
Aktivitas Bakteri Pengoksidasi Amonium dan Bakteri Pengoksidasi Nitrit Isolat nitrifikasi yang berhasil dikarakterisasi, selanjutnya diseleksi berdasarkan kemampuan dalam menurunkan senyawa amonium dan nitrit (Megawati 2014). Penyeleksian ini guna mendapatkan bakteri nitrifikasi yang akan dijadikan sebagai agen bioremediasi. Berdasarkan hasil seleksi aktivitas amonium menunjukkan penurunan konsentrasi amonium sebesar 29-80 % (Tabel 4), sedangkan penurunan konsentrasi nitrit sebesar 17-26 % (Tabel 5). Konsentrasi penurunan nitrit yang dihasilkan relatif kecil disebabkan karena nitrit akan digunakan sebagai sumber energi bakteri setelah amonia teroksidasi (Widanarni et al. 2010).
8
Tabel 4 Aktivitas oksidasi amonium isolat bakteri nitritasi hasil isolasi dari kolam ikan air tawar di Kabupaten Cirebon, Jawa Barat setelah 3 hari inkubasi
Isolat
Konsentrasi Amonium (µM)
Konsentrasi
Amonium µM) Penurunan Amonium
hari ke-0 hari ke-3 (µM) (%)
CRB 106 896.52 175.43 721.09 80% CRB 107 534.61 760.46 225.9* 42%* CRB 110 1408.08 741.42 666.67 47% CRB 111 1005.36 401.28 604.08 60% CRB 113 1002.64 708.76 293.88 29% CRB 115 1122.37 735.97 386.40 34% CRB 118 820.33 882.91 62.59* 8%* CRB 119 888.35 257.06 631.29 71%
*) Kenaikan konsentrasi amonium
Tabel 5 Aktivitas oksidasi nitrit isolat bakteri nitratasi hasil isolasi dari kolam ikan air tawar di Kabupaten Cirebon, Jawa Barat setelah 3 hari inkubasi
Isolat Konsentrasi Nitrit (µM) hari ke-0 Konsentrasi Nitrit (µM) hari ke-3 Penurunan Nitrit (µM) (%) CRB 201 7.11 18.56 11.45* 161%* CRB 202 3.98 2.96 1.02 26% CRB 204 3.69 41.63 37.94* 1028%* CRB 205 1.03 1.77 0.74* 71%* CRB 206 3.32 5.39 2.07* 63%* CRB 207 1.45 6.03 4.58* 315%* CRB 210 4.31 3.57 0.74 17% CRB 211 1.49 3.26 1.77* 119%* CRB 212 3.35 4.17 0.82* 24%* CRB 213 3.98 3.27 0.71 18%
*) Kenaikan konsentrasi nitrit
Berdasarkan hasil aktivitas oksidasi amonium oleh bakteri nitritasi, menunjukkan bahwa enam isolat bakteri nitritasi yaitu CRB 106, CRB 110, CRB 111, CRB 113, CRB 115, dan CRB 119 mampu mengoksidasi amonium dengan bantuan enzim AMO dan HAO, dimana penurunan konsentrasi amonium tertinggi pada isolat CRB 106 sebesar 80%, sedangkan pada kedua isolat lainnya, amonium terakumulasi atau mengalami kenaikan konsentrasi amonium setelah 3 hari inkubasi (Tabel 4). Berdasarkan aktivitas oksidasi nitrit oleh bakteri nitratasi, menunjukkan bahwa tiga isolat bakteri nitratasi yaitu CRB 202, CRB 210, dan CRB 213 mampu mengoksidasi nitrit dengan bantuan enzim NOR, dimana penurunan konsentrasi tertinggi pada isolat CRB 202 sebesar 26 %, sedangkan pada tujuh isolat lainnya, nitrit terakumulasi (Tabel 5).
9 Penurunan konsentrasi amonium dan nitrit mengindikasikan bahwa isolat tersebut dapat memanfaatkan amonium dan nitrit sebagai sumber nitrogen dengan bantuan kerja enzim. Kelompok enzim yang bekerja pada bakteri nitritasi yaitu enzim AMO terdapat di membran dan enzim HAO yang terdapat di periplasma. Enzim AMO bekerja mengoksidasi amonia menjadi NH2OH (hidroksilamin) dan H2O serta enzim HAO bekerja mengoksidasi NH2OH menjadi nitrit (Todt dan Doersch 2016). Sedangkan enzim yang bekerja pada bakteri pengoksidasi nitrit yaitu enzim NOR (nitrit oksidoreduktase) yang mampu mengoksidasi nitrit menjadi nitrat (Pester et al. 2014).
Salah satu terjadinya akumulasi amonium dan nitrit, karena pengaruh komposisi biomassa sel (Todt dan Doersch 2016), yang dikaitkan dengan kerja enzim yaitu enzim AMO dan HAO. Kerja enzim AMO dan HAO pada kedua isolat nitritasi lebih rendah dari isolat yang mampu menurunkan konsentrasi amonium. Hal ini juga terjadi pada nitrit yang terakumulasi, yaitu karena kerja enzim NOR pada ketujuh isolat bakteri nitratasi yang lebih rendah dari isolat yang mampu menurunkan konsentrasi nitrit (Widiyanto 2006). Selain itu, pengaruh pH,
Dissolved Oxygen (DO), dan suhu menjadi faktor eksternal terjadinya akumulasi amonium dan nitrit (Ruiz et al. 2003). Kondisi pH tinggi dari pH optimum (7-9) menjadi faktor terjadinya akumulasi (Shen et al. 2003). Oksigen terendah (DO) yang rendah akan mengurangi populasi bakteri pengoksidasi amonium dan nitrit, sehingga aktivitas oksidasi menurun dan terjadinya akumulasi amonium atau nitrit (Guo et al. 2009). Selanjutnya, kenaikan suhu akan mempengaruhi nitrit mudah terakumulasi (Kim et al. 2008). Pengaruh lainnya yang dapat mempengaruhi akumulasi amonium dan nitrit yaitu pemberian substrat yeast ekstrak dalam media nitritasi dan nitratasi. Substrat yeast ekstrak mendukung pertumbuhan mikroba dari kelompok bakteri nitrifikasi lain, yang berperan dalam kenaikan konsentrasi amonium dan nitrit. Selain itu, yeast esktrak dengan komposisi asam glutamat menjadi tambahan sumber nitrogen selain dari amonium dalam NH4Cl dan nitrit dalam NaNO2 (Fadilah et al. 2009), sehingga nitrogen total tidak hanya dari amonium dan nitrit, melainkan nitrogen yang ditambahkan dari yeast ekstrak. Adanya nitrogen tambahan ini dikaitkan dengan kenaikan konsentrasi amonium dan nitrit.
Laju Rata-rata Penurunan Konsentrasi Amonium Isolat CRB 106 dan Penurunan Konsentrasi Nitrit Isolat CRB 202
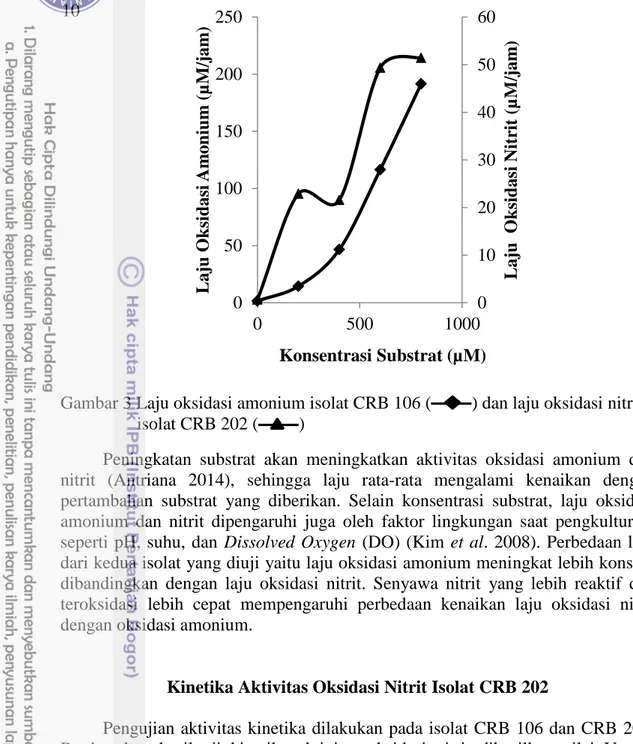
Berdasarkan seleksi aktivitas bakteri pengoksidasi amonium dan pengoksidasi nitrit, maka dipilih 2 isolat yaitu isolat CRB 106 dan CRB 202 untuk pengukuran laju rata-rata oksidasi amonium dan oksidasi nitrit. Selanjutnya kedua isolat tersebut akan diuji kinetika oksidasi amonium dan oksidasi nitrit. Hasil laju rata-rata penurunan amonium dan nitrit yang diujikan pada isolat CRB 106 dan CRB 202 berbanding lurus dengan penambahan konsentrasi substrat amonium dan nitrit, yaitu sebesar 0, 200, 400, 600, 800, hingga 1000 µM. Laju rata-rata mengalami kenaikan dengan pertambahan substrat yang diberikan (Gambar 3).
10
Gambar 3 Laju oksidasi amonium isolat CRB 106 ( ) dan laju oksidasi nitrit isolat CRB 202 ( )
Peningkatan substrat akan meningkatkan aktivitas oksidasi amonium dan nitrit (Antriana 2014), sehingga laju rata-rata mengalami kenaikan dengan pertambahan substrat yang diberikan. Selain konsentrasi substrat, laju oksidasi amonium dan nitrit dipengaruhi juga oleh faktor lingkungan saat pengkulturan, seperti pH, suhu, dan Dissolved Oxygen (DO) (Kim et al. 2008). Perbedaan laju dari kedua isolat yang diuji yaitu laju oksidasi amonium meningkat lebih konstan dibandingkan dengan laju oksidasi nitrit. Senyawa nitrit yang lebih reaktif dan teroksidasi lebih cepat mempengaruhi perbedaan kenaikan laju oksidasi nitrit dengan oksidasi amonium.
Kinetika Aktivitas Oksidasi Nitrit Isolat CRB 202
Pengujian aktivitas kinetika dilakukan pada isolat CRB 106 dan CRB 202. Berdasarkan hasil uji kinetika aktivitas oksidasi nitrit dihasilkan nilai Vmaks isolat CRB 202 sebesar 0.071 mM.jam-1. Sedangkan Isolat CRB 202 memiliki nilai Km yang rendah yaitu sebesar 0.010 mM. Nilai Km dan Vmaks isolat CRB 106 tidak dapat dihitung karena menghasilkan nilai negatif dengan plot Lineweaver-Burk, sehingga tidak ditampilkan.
Parameter kinetika enzim yang digunakan adalah Vmaks dan Km. Vmaks merupakan parameter terhadap kecepatan reaksi enzim, dimana nilai laju (V) akan tetap dengan bertambahnya konsentrasi substrat. Parameter konstanta Km (Michaelis-Menten) digunakan untuk menetukan ukuran afinitas enzim-substrat (E-S), yang merupakan indikator kekuatan ikatan kompleks E-S atau suatu tetapan keseimbangan untuk disosiasi kompleks E-S menjadi E dan S (Putra 2009). Uji kinetika dilakukan pada CRB 106 dan CRB 202. Berdasarkan hasil uji kinetika aktivitas oksidasi nitrit dihasilkan nilai Vmaks isolat CRB 202 sebesar 0.071 mM.jam-1, artinya pada kondisi optimum enzim NOR dapat mengubah substrat
0 10 20 30 40 50 60 0 50 100 150 200 250 0 500 1000 L aj u Ok sid asi Nitr it (µM/j am ) L aj u Ok sid asi Am on iu m (µM/j am ) Konsentrasi Substrat (µM)
11 NO2- menjadi NO3- sebesar 0.071 mM tiap jamnya. Sedangkan Isolat CRB 202 memiliki nilai Km yang rendah yaitu sebesar 0.010 mM, artinya isolat CRB 202 mempunyai enzim dengan afinitas tinggi terhadap substratnya.
SIMPULAN DAN SARAN
Simpulan
Kelimpahan tertinggi bakteri nitrifikasi kolam ikan air tawar Kabupaten Cirebon, Provinsi Jawa Barat yaitu kelompok bakteri nitritasi. Isolat CRB 106 dan CRB 202 merupakan isolat yang memiliki kemampuan oksidasi amonium dan nitrit terbaik. Uji kinetika oksidasi nitrit pada Isolat CRB 202 menghasilkan laju maksimum (Vmaks) sebesar 0.071 mM.jam-1. Sedangkan nilai konstanta Michaelis-Menten (Km) isolat CRB 202 sebesar 0.010 mM.
Saran
Tahap isolasi akan lebih baik jika sampel sedimen dan air diisolasi secara terpisah, sehingga dapat diketahui kelimpahan yang berbeda pada sedimen dan air kolam ikan. Perlu ditambahkan metode yaitu mengukur kadar nitrit dan nitrat yang terbentuk pada tahap seleksi aktivitas oksidasi amonium dan nitrit, sehingga data yang didapatkan lebih baik.
DAFTAR PUSTAKA
Anjana, Umar S, Iqbal M. 2007. Nitrate accumulation in plants, factors affecting the process, and human health implication: a review. Agronomy for Sustainable Development. 27(1): 45-57.
Antriana N, Rusmana I, Mubarik NR. 2014. Diversity and kinetics of bacterial nitrification isolated from soil of rubber and oil palm plantation in Jambi Indonesia. Advances inEnvironmental Biology.1: 319-326.
Breman MJ, Francis AC. 2006. Diversity of ammonia-oxidizing archaea and bacteria in the sediment of a hypernutrified subtropical estuary: Bahia del Tobari, Mexico. Applied and Environmental Microbiology. 77(12): 7767-7777.
[BBPBAT] Balai Besar Perikanan Budidaya Air Tawar. 2014. Baku Mutu Kualitas Air Budidaya. Balai Besar Perikanan Budidaya Air Tawar
[Internet]. [diunduh 2015 Nov 18]. Tersedia pada:
12
Eaton AD, Clesceri LS, Greenberg AE, Rice EW. 2005. Standard Method of Examination of Water and Wastewater21th Edition. Washington DC (US): APHA-AWWA-WPCF.
Effendie H, Utomo BA, Darmawangsa GM, Hanafiah DA. 2015. Wastewater treatment of freshwater crayfish (Cherax quadricarinatus) culture with lettuce (Lactuca sativa). International Journal of Applied Environmental Sciences. 10(1): 409-420.
Fadilah, Distantina S, Dwiningsih SR, Ma’rifah DS. 2009. Pengaruh penambahan glukosa dan ekstrak yeast terhadap biodelignifikasi ampas aren.
Ekuilibrum. 8(1): 29-33.
Greenberg AE, Clesceri LS, Eaton AD.1992. Standard Method for Examination of Water and Wastewater 18th Edition. Washington DC (US): Publication Office American Public Health Association.
Guo J, Peng Y, Wang S, zheng Y, Huang H, Wang Z. 2009. Long term effect of dissolved oxygen on partial nitrification performance and microbial community structure. Bioresource Technology. 100: 2796-2802.
Holt JG, Krieg NR, Smeath PHA, Stanley JT, Williams ST. 1994. Bergey’s
Manual of Determinative Bacteriology 9th Edition. Baltimore (US): Williams and Wilkins Company.
Kilawati Y, Maimunah Y. 2015. Kualitas lingkungan tambak intensif Litapenaeus vannamei dalam kaitannya dengan prevalensi penyakit White Spot SyndromeVirus. Research Journal of Life Science. 2(1): 50-59.
Kim JH, Guo X, Park HS. 2008. Comparison study of the effects of temperature and free amonia concentration on nitrification and nitrite accumulation.
Process Biochemistry. 43: 154-160.
Makmur M, Kusnoputranto H, Moersidik SS, Wisnubroto DS. 2012. Pengaruh limbah organic dan rasio N/P terhadap kelimpahan fitoplankton di kawasan budidaya kerang hijau Cilincing. Jurnal Teknologi Pengelolaan Limbah. 15(2): 51-64.
Megawati. 2014. Karakterisasi bakteri nitrifikasi kolam ikan air tawar Provinsi Riau dan Jambi [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Novita L, Rusmana I, Widiyanto T. 2014. Struktur komunitas pengoksidasi amonia berdasarkan gen amoA di situ Sawangan Bojongsari, Jawa Barat.
Limnotek. 21(1): 74-86.
Park HD, Noguera DR. 2007. Characterization of two ammonia-oxidizing bacteria isolated from reactors operated with low dissolved oxygen concentrations.
Journal of Applied Microbiology.102: 1401-1417.
Pester M, Maixner F, Berry D, Rattei T, Koch H, Luecker S, Nowka B, Richter A, Spiek E, Lebedeva E, Loy A, Wagner M, Daims H. 2014. NxrB encoding the beta subunit of nitrite oxidoreductase as functional and phylogenic marker for nitrite-oxidixing Nitrospira. Environmental Mocrobiology. 16(10): 3055-3071.
Putra GPG. 2009. Penentuan kinetika enzim poligalakturonase (PG) endogenous dari pup biji kakao. Jurnal Biologi.8(1): 21-24.
Ruiz G, Jeison D, Chamy R. 2003. Nitrification with high nitrite accumulation for the treatment of wastewater with high ammonia concentration. Water Research. 37: 1371-1377.
13 Shen QR, Ran W, Cao ZH. 2003. Mechanisms of nitrite accumulation occurring
in soilnitrification. Chemospere. 50: 747-753.
[SIDATIK] Sistem Informasi Diseminasi Data dan Statistik Kelautan dan Perikanan.2013. Kelautan dan Perikanan dalam Angka Tahun 2009-2014. [Internet]. [diunduh 2016 Nov 11]. Tersedia pada: http://statistik.kkp.go.id/sidatik-dev/index.php?m=5.
Todt D, Doersch P. 2016. Mechanism leading to N2O production in wastewater treating biofilm systems. Reviews Environmental Science and Biotechnology. 7: 1-24.
Wang KL, Pereira CN, Hung TY. 2009. Biological Treatment Processes. Lenox (US): Humana Press.
Widanarni, Pranoto SH, Sukenda. 2010. Seleksi bakteri nitrifikasi dan denitrifikasi serta aplikasinya pada media budidaya udang vename (Litopenaeus vennamei). Jurnal Akuakultur Indonesia. 9(2): 184-195. Widiyanto T. 2006. Seleksi bakteri nitrifikasi dan denitrifikasi untuk bioremediasi
di tambak udang [disertasi]. Bogor (ID): Institut Pertanian Bogor.
Wu C, Chen Z, Liu X, Peng Y. 2007. Nitrification-denitrification via nitrite in SBR using real time control strategy when treating domestic wastewater.
Biochemical Engineering Journal. 36: 87-92.
Wurderlin P, Mohn J, Joss A, Emmenegger L, Siegrist H. 2012. Mechanism of N2O production in biological wastewater treatment under nitrying and denitrifying condition. Water Research. 46: 1027-1037.
Xie WM, Ni BJ, Seviour T, Sheng GP, Yu HQ. 2012. Characterization of autotrophic and heterotrophic soluble microbal product (SMP) fraction from activated sludge. Water Research. 46: 6210-6217.
Yang Q, Peng Y, Liu X, Zeng W, Mino T, Satoh H. 2007. Nitrogen removal via nitrite from municipal wastewater at low temperatures using real-time control to optimize nitrifying communities. Environmental Science Technology. 41(23): 8159-8164.
Yulianti W. 2015. Kontribusi usaha budidaya tambak terhadap pemenuhan kebutuhan hidup pekerja tambak di Kecamatan Gunungjati Kabupaten Cirebon [skripsi]. Bandung (ID): Universitas Pendidikan Indonesia.
14
Lampiran 1 Komposisi media nitritasi (g/L) (Novita et al. 2014)
Na2HPO4 0.9 KH2PO4 0.2 MgSO4.7H2O 0.1 FeCl3.6H2O 0.005 CaCl2.6H2O 0.0184 Yeast ekstrak 0.25 Na2CO3 5 NH4Cl 1 Agar 25
Lampiran 2 Komposisi media nitratasi (g/L) (Novita et al. 2014) Na2HPO4 0.9 KH2PO4 0.2 MgSO4.7H2O 0.1 FeCl3.6H2O 0.005 CaCl2.6H2O 0.0184 Yeast ekstrak 0.25 Na2CO3 5 NaNO2 1 Agar 25
15 Lampiran 3 Kurva standar amonium
Lampiran 4 Kurva standar nitrit
y = 0.0147x + 0.0612 R² = 0.9973 0 0.2 0.4 0.6 0.8 1 1.2 1.4 1.6 1.8 0 20 40 60 80 100 120 A bs orb an (640 nm ) Konsentrasi Amonium (µM) y = 0.0427x - 0.0056 R² = 0.9975 -0.1 0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0 5 10 15 20 A bsorban (543 nm ) Konsentrasi Nitrit (µM)
16
RIWAYAT HIDUP
Penulis dilahirkan di Cirebon pada tanggal 11 Mei 1994 sebagai anak keempat dari empat bersaudara, dengan nama ayah Djunita dan ibu bernama Saidah. Pada tahun 2012, penulis lulus dari SMA Negeri 1 Palimanan dan pada tahun yang sama diterima di Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor melalui jalur undangan.
Selama mengikuti perkuliahan di IPB, penulis aktif berorganisasi. Pada tahun 2012/2013, penulis pernah menjadi anggota Unit Kegiatan Mahasiswa Seni Sunda Gentra Kaheman, pada tahun yang sama penulis aktif menjadi anggota dan pengurus Greda-C Club dan pernah menjadi pengurus HIMABIO divisi Badan Pengawas pada tahun 2013/2014 dan 2014/2015. Penulis juga aktif di berbagai kepanitian nasional. Penulis sebagai penerima beasiswa PPA/BBM dari semester empat hingga semester delapan. Pada tahun 2016 penulis menjadi juara 1 dalam ajang Business Competition pada acara Agrifest di Universitas Hassanudin Makassar dan menjadi finalis 20 besar pada ajang Lomba Karya Tulis Ilmiah dalam acara IASC di Universitas Brawijaya. Penulis pernah terlibat pada perlombaan yang didanai oleh Dikti yaitu PKM-Pengabdian Masyarakat. Penulis pernah menjadi asisten laboratorium untuk Mata Kuliah Biologi Dasar (2016), Botani Umum (2015), Biologi Alga dan Lumut (2015), Anatomi dan Morfologi Tumbuhan (2016), dan Mikrobiologi Dasar (2016).
Pada tahun 2014, penulis melaksanakan studi lapang di Taman Nasional Gunung Walad dengan topik Keanekaragaman Hymenoptera dan Dyptera di Hutan Pendidikan Gunung Walat. Pada tahun 2015, penulis melaksanakan praktik lapangan di Taman Buah Mekarsari, Cileungsi, Bogor dengan topik Sistem Budidaya Melon (Cucumis melo) secara Hidroponik di Taman Buah Mekarsari.