DARI CAIRAN RUMEN DOMBA SECARA IN VITRO
SKRIPSI
ZICKRI CHAIRULLISAN
PROGRAM STUDI BIOLOGI
FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH
JAKARTA
DARI CAIRAN RUMEN DOMBA SECARA IN VITRO
Skripsi
Sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana Sains Program Studi Biologi
Fakultas Sains dan Teknologi
Universitas Islam Negeri Syarif Hidayatullah Jakarta
Oleh :
ZICKRI CHAIRULLISAN NIM: 1113095000011
PROGRAM STUDI BIOLOGI
FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH
JAKARTA
iv
Wangi (Cymbopogon nardus) Terhadap Emisi Gas Metana (CH4) dari Cairan
Rumen Domba Secara In Vitro. Dibimbing oleh Dr. Irawan Sugoro dan drh.
RR. Bhintarti S.M. Biomed. Jurusan Biologi. Fakultas Sains dan Teknologi.
Universitas Islam Negeri Syarif Hidayatullah Jakarta.
Salah satu sumber emisi CH4 dapat berasal dari ternak domba. Seekor domba
menghasilkan emisi gas CH4 sebesar ±21,9 g/ hari. Besarnya emisi gas tersebut
mendorong munculnya program penekanan gas CH4 dengan cara pemberian
suplemen zat aditif pada pakan. Daun serai wangi hasil dari proses penyulingan merupakan salah satu limbah pertanian yang berpotensi sebagai pakan tambahan ternak. Tujuan penelitian ini adalah mengetahui pengaruh pemberian suplemen ekstrak limbah daun serai wangi (Cymbopogon nardus) terhadap produk fermentasi dan emisi gas CH4 yang dihasilkan oleh mikroba cairan rumen domba
secara in vitro. Penelitian ini menggunakan cairan rumen dari domba Garut dan ekstrak limbah daun serai wangi. Penelitian ini dilakukan secara in vitro dengan menggunakan Hohenheim Gas Test yang diinkubasi dalam waterbath pada suhu 39oC selama 24 jam dan pakan hijauan berupa rumput lapangan. Parameter uji penelitian ini terdiri atas pH, amonia, Volatile Fatty Acids (VFA), degradasi bahan organik (DBO), degradasi Neutral Detergent Fibre (DNDF), total bakteri, metanogen, Butyrivibrio fibrisolvens, protozoa, total produksi gas dan gas CH4.
Hasil penelitian menunjukkan pemberian ekstrak limbah daun serai wangi dengan pelarut heksana maupun pelarut butanol tidak berpengaruh nyata (sig > 0,05) terhadap parameter uji : pH, DBO, serta DNDF, sedangkan ekstrak dengan pelarut heksana dan pelarut butanol berpengaruh nyata (sig < 0,05) terhadap nilai NH3,
total bakteri, metanogen, B. fibrisolvens, protozoa, total produksi gas dan produksi CH4. Emisi gas CH4 berhasil ditekan oleh penambahan ekstrak heksana sebesar
23%, sedangkan ekstrak butanol mengalami peningkatan gas CH4 sebesar 28%
dibandingkan dengan kontrol. Berdasarkan hasil yang diperoleh, ekstrak heksana limbah daun serai wangi memiliki potensi untuk dimanfaatkan sebagai suplemen tambahan pada pakan ternak untuk menekan emisi gas CH4.
v
Extract (Cymbopogon nardus) on Methane (CH4) Gas Emissions From Sheep’s Rumen Fluids by In Vitro. Guided by Dr. Irawan Sugoro and drh. RR.
Bhintarti S. M. Biomed. Department of Biology. Faculty of Science and
Technology. Syarif Hidayatullah State Islamic University Jakarta.
One source of CH4 emissions can come from ruminant animals, such as a sheep.
A sheep can produce CH4 emissions of 21.9 g /day. The amount of CH4 gas
emissions has led to the emergence of CH4 gas suppression program by adding
plant extract supplements to feed. Fragrant citronella grass leaves are one of the agricultural waste that has the potential as additional livestock feeds. The aim of this study was to determine the effect of supplementation of extracts of fragrant citronella leaves (Cymbopogon nardus) on animal feed on the production of CH4
gas emissions in sheep rumen fluid. This study uses Garut Sheep rumen liquid and fragrant citronella leaves waste extracts. This research was carried out in vitro by using the Hohenheim Gas Test method which was incubated at 39˚C for 24 hours and forage feed in the form of field grass. The research test parameters are pH, ammonia, Volatile Fatty Acids (VFA), degradation of organic matter (DBO), degradation of Neutral Detergent Fiber (DNDF), total population of bacteria, metanogen, Butyrivibrio fibrisolvens, protozoa, total gas production and CH4 gas
production. The results showed that the extract treatment of citronella leaves waste with hexane and butanol solvents had no significant effect (sig> 0.05) on test parameters such as pH, DBO, and DNDF, while hexane and butanol solvents significantly (sig <0.05) on NH3 gas, total bacteria, metanogen, B. fibrisolvens,
protozoa, total gas production and CH4 gas concentration. CH4 gas emissions
were successfully suppressed by the addition of hexane extract by 23%, while butanol extract increased CH4 gas by 28% compared to the control. Based on the
results obtained, hexane extract of fragrant lemongrass leaves has the potential to be used as an additional supplement to sheep's feed in suppressing CH4 emissions.
vi
Assalamualaikum warrohmatullahi wabarokatuh
Segala puji milik Allah Subhanahu wa Ta’ala karena izin dan kuasa-Nya, penulis dapat menyelesaikan tulisan ini. Alhamdulillah, telah selesai penulisan skripsi penelitian ini yang berjudul “Pengaruh Suplementasi Ekstrak Limbah Daun Serai Wangi (Cymbopogon Nardus (L.) Rendle) Terhadap Emisi Gas Metana (CH4) dari Cairan Rumen Domba Secara In Vitro” disusun guna
memenuhi tugas mata kuliah “Sidang Skripsi atau Munaqosyah” Fakultas Sains dan Teknologi Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta.
Skripsi penelitian ini tidak mungkin selesai tanpa pihak-pihak yang terus menerus memberikan bimbingan, dukungan, motivasi serta doa sehingga ucapan terima kasih ditujukan kepada:
1. Dr. Irawan Sugoro M.Si, selaku dosen pembimbing I yang telah memberikan pengarahan, motivasi serta bimbingannya sehingga penulis bisa menyelesaikan skripsi ini dengan sangat baik.
2. drh. R.R. Bhintarti S.,M.Biomed, selaku dosen pembimbing II yang telah membimbing, serta memberikan saran, masukan dan motivasi kepada penulis hingga bisa menyelesaikan skripsi ini dengan sangat baik.
3. Dr. Dasumiati, M.Si selaku Ketua Program Studi Biologi Fakultas Sains dan Teknologi UIN Syarif Hidayatullah Jakarta dan Dosen Pengampu Akademik.
4. Dr. Agus Salim, M.Si selaku Dekan Fakultas Sains dan Teknologi UIN Syarif Hidayatullah Jakarta.
5. Ayah dan umi tercinta: Rojalih, S.E. dan Trias Politica, S.E., kakek dan nenek tersayang: alm. H. Ahmad Pungut dan Hj. Rohaya, adik-adikku: Syamil dan Anza, dan seluruh keluarga besar atas segala doa, nasihat, pengorbanan dan motivasinya kepada penulis hingga bisa selesai dan lulus.
6. Seluruh Dosen Program Studi Biologi yang telah memberikan ilmu pengetahuan dan nasihat-nasihat berharganya kepada penulis.
7. Semua kaka kelas dan Mahasiswa/i Program Studi Biologi UIN Jakarta, khususnya Biologi angkatan 2013, HIMBIO Oryza sativa 2014, 2015 dan adik-adik semua yang selalu memberi dukungan, semangat, motivasi.
vii
media serta laboratorium untuk pcr, Pak Beny yang telah meminjamkan lab beserta untuk me-rotav, Pak Dono yang telah mengizinkan memakai lab tanah, Pak Dadang yang sudah membimbing penulis ketika semhas, Pak Deddy yang telah membantu mengukur gas dilab, Pak Yaya yang sudah membantu penelitian dan seluruh peneliti atau karyawan-karyawan Batan, yang telah banyak membantu hingga selesainya penelitian ini.
9. Teman satu lab 47A Batan: Ka Arina, Adit, Bisma, Galih, Nadya, Chintia, Arif, Wawan, Reynaldi, Dimas, Chata, Lina, Aisyah, kakak-kakak ISTN, anak-anak UHAMKA dan teman-teman lainnya yang sudah membantu serta memberi motivasi dan dukungan kepada penulis.
10. Teman-temanku Yusti, Fajar, Novi, Cantika, Azzam, dkk yang telah memberi semangat, doa dan motivasinya kepada penulis.
11. Seluruh anggota Generation of Microbiology and Molecular, TREIZE FLAT UIN Jakarta, teman-teman Wahana Indonesia Prestasi dan KKN TERBAIK 165, guru-guru GAMA UI, guru-guru serta adik-adik Sc biologi MAN 7 Jakarta atas dukungan serta doanya.
12. Pihak-pihak lain yang tidak dapat disebutkan satu persatu. Namun, tidak mengurangi rasa hormat dan kasih sayang penulis kepada kalian.
Penulis menyadari bahwa dalam penyusunan skripsi ini masih jauh dari kesempurnaan. Oleh karena itu, penulis sangat mengharapkan kritik dan saran yang membangun agar menjadi lebih baik. Terima kasih.
Ciputat, Oktober 2018
viii
ABSTRAK ... iv
ABSTRACT ...v
KATA PENGANTAR ... vi
DAFTAR ISI ... viii
DAFTAR TABEL...x
DAFTAR GAMBAR ...xi
DAFTAR LAMPIRAN ... xii
BAB I PENDAHULUAN ...1 1.1. Latar Belakang ... 1 1.2. Rumusan Masalah ... 4 1.3. Hipotesis Penelitian ... 4 1.4. Tujuan Penelitian ... 4 1.5. Manfaat Penelitian ... 4 1.6. Kerangka Berpikir ... 5
BAB II TINJAUAN PUSTAKA ...6
2.1. Pemanasan Global ... 6
2.2. Gas CH4 (Metana) ... 7
2.3. Domba Garut ... 8
2.4. Sistem Pencernaan Ruminansia ... 10
2.5. Proses Fermentasi Pakan di dalam Rumen ... 13
2.6. Metabolisme pembentukan gas CH4 ... 15
2.7. Serai wangi ... 16
2.8. Penelitian penurunan gas CH4...19
BAB III METODE PENELITIAN ...22
3.1. Waktu dan Tempat Penelitian ... 22
3.2. Alat dan Bahan ... 22
3.3. Prosedur Kerja ... 23
3.3.1 Preparasi sampel ... 23
3.3.2 Uji Proksimat ... 23
3.3.2.1. Pengukuran Bahan kering dan Bahan organik ... 23
3.3.2.2 Pengukuran Lemak Total ... 24
3.3.2.3 Pengukuran Protein Kasar ... 25
3.3.3 Ekstraksi Limbah Daun Serai Wangi ... 26
3.3.4. Uji Simulasi In vitro ... 26
3.3.4.1. Sampling Cairan Rumen Domba ... 26
3.3.4.2. Pembuatan Larutan Mc Dougall ... 26
3.3.4.3. Uji Kecernaan Secara In vitro ... 27
3.3.5. Analisis Parameter Uji ... 28
3.3.5.1. Skrining Fitokimia Secara Kualitatif ... 28
ix
3.3.5.6 Pengukuran Degradasi Neutral Detergen Fiber (DNDF) ... 30
3.3.5.7. Analisis Populasi Mikroorganisme Cairan Rumen ... 31
3.3.5.8. Pengukuran Produksi dan Konsentrasi CH4 ... 33
3.6. Analisis Data ... 34
BAB IV HASIL DAN PEMBAHASAN...35
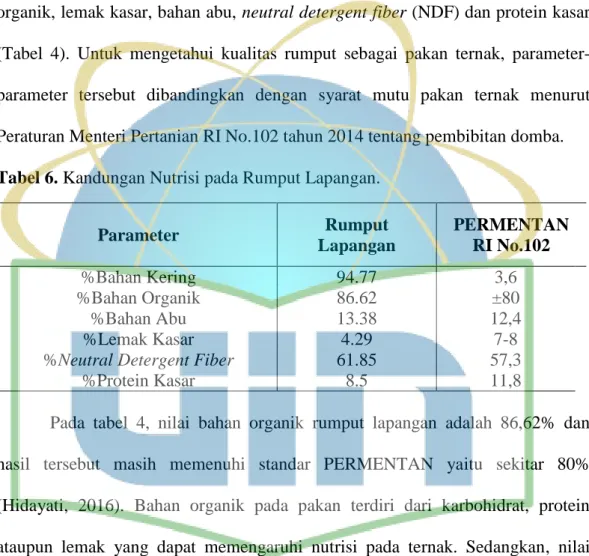
4.1. Analisis Proksimat Rumput Lapangan ... 35
4.2. Analisis Fitokimia Ekstrak Limbah Daun Serai wangi ... 37
4.3. Nilai pH ... 38
4.4. Nilai Konsentrasi NH3 ... 39
4.5. Konsentrasi Volatile Fatty Acids (VFA) Total dan Parsial ... 42
4.6. Nilai Degradasi Bahan Organik ... 47
4.7. Degradasi Neutral Detergent Fiber (DNDF) ... 49
4.8. Analisis Populasi Mikroorganisme Cairan Rumen ... 51
4.9. Analisis Produksi Total Gas dan Nilai gas CH4 ... 58
BAB V PENUTUP ...66
5.1. Kesimpulan ... 66
5.2. Saran ... 66
DAFTAR PUSTAKA ...67
x
Halaman
Tabel 1. Populasi ternak domba di Indonesia ... 9
Tabel 2. Jenis mikrobiota rumen ... 14
Tabel 3. Kandungan tanaman serai wangi ... 18
Tabel 4. Perlakuan sampel ... 27
Tabel 5. Primer PCR bakteri dan protozoa ... 33
Tabel 6. Kandungan nutrisi rumput lapangan ... 35
Tabel 7. Hasil uji fitokimia ekstrak limbah daun serai wangi ... 37
xi
Halaman
Gambar 1. Kerangka berpikir ... 9
Gambar 2. Domba Garut ... 11
Gambar 3. Gambar domba beserta jalur nutrisi pakan di sistem pencernaan... 11
Gambar 4. Jalur pembentukan komponen susu ... 12
Gambar 5. Tanaman serai wangi (x) dan limbah daun serai wangi (y) ... 17
Gambar 6.Nilai pH ... 38
Gambar 7. Nilai konsentrasi NH3 ... 40
Gambar 8. Volatile Fatty Acids (VFA) total... 43
Gambar 9. Degradasi bahan organik (DBO) ... 47
Gambar 10. Degradasi Neutral Detergent Fiber (DNDF) ... 49
Gambar 11. Analisis populasi mikroorganisme (RT-PCR) ... 52
Gambar 12. Jenis protozoa pada cairan rumen ... 57
Gambar 13. Hasil produksi gas total ... 57
Gambar 14. Hasil pengukuran nilai gas CH4 ... 59
xii
Halaman
Lampiran 1. Dokumentasi Penelitian ... 81
Lampiran 2. Diagram Alur Penelitian ... 83
Lampiran 3. Kondisi Pengaturan RT-PCR ... 84
Lampiran 4. Contoh Perhitungan Data Hasil ... 84
Lampiran 5. Analisa statistik One way ANOVA ... 88
1
BAB I
PENDAHULUAN
1.1. Latar Belakang
Pemanasan global adalah proses meningkatnya suhu rata-rata di atmosfer,
laut, dan daratan bumi. Intergovernmental Panel on Climate Change (IPPC)
(2007) mengatakan sebagian besar peningkatan suhu rata-rata global sejak
pertengahan abad ke-20 disebabkan oleh meningkatnya konsentrasi gas-gas rumah
kaca akibat aktivitas manusia melalui efek rumah kaca. Efek rumah kaca terjadi
akibat peningkatan akumulasi gas rumah kaca yang dipengaruhi oleh kuantitas
gas-gas yang dihasilkan oleh aktivitas di bumi dan terkumpul di lapisan udara,
diantaranya karbondioksida (CO2), metana (CH4), nitrogen oksida (N2O), ozon
(O3) dan uap air (H2O). Badan Litbang Pertanian (2011) menyatakan bahwa
peningkatan emisi gas rumah kaca oleh gas CO2 adalahsebesar 55%, CH4 sebesar
15% dan N2O sebesar 18% (Pidwirny, 2006).
Gas metana (CH4) merupakan gas yang terbentuk dari proses fermentasi
anaerob dari bahan pakan di dalam rumen oleh bakteri metanogen. Gas CH4
memiliki kontribusi gas terbesar kedua penyebab efek rumah kaca, setelah CO2.
Namun, CH4 memiliki kemampuan 20 kali lebih besar dalam meretensi panas
dibandingkan dengan CO2 (IPPC, 2007). Ada lima kegiatan yang menjadi sumber
CH4 yaitu peternakan, budidaya padi sawah, pembakaran padang sabana dan
limbah pertanian, kegiatan antropogenik dan tanah lahan pertanian (IPPC, 2006).
Emisi gas-gas pada sektor peternakan bersumber dari aktivitas sistem pencernaan
Menurut Beauchemin et al. (2008), ternak ruminansia memiliki kontribusi
terhadap akumulasi gas CH4 antropogenik sebesar 28%. Emisi CH4 pada
ruminansia yaitu berasal dari hasil fermentasi saluran pencernaan (enteric
fermentation) dan kotoran (manure) (Hidayah, 2016). Gas CH4 yang dihasilkan
dari proses fermentasi pakan di dalam saluran pencernaan, berasal dari aktivitas
metanogen atau bakteri pendegradasi selulosa (selulolitik), salah satunya adalah
Butyrivibrio fibrisolvent.
Salah satu ternak ruminansia yang cukup berkontribusi terhadap produksi
CH4 adalah domba. Domba merupakan hewan ruminansia kecil yang dapat
menyumbang emisi gas rumah kaca. Perkiraan emisi CH4 pada sapi; kerbau;
domba dan kambing di negara maju, diantaranya adalah 150,7; 137; 21,9 dan 13,7
(g/hewan/hari) (Sejian et al. 2011).
Emisi gas CH4 tidak hanya terkait dengan masalah lingkungan saja, namun
juga merefleksikan hilangnya sebagian energi dari domba yang seharusnya juga
dapat digunakan untuk menunjang produktivitas ternak tersebut. Jumlah energi
yang hilang dari ternak ruminansia 8 –14% dari total energi tercerna (Cottle et al.,
2011) dan 8%-10% dari energi bruto pakan ternak ruminansia hilang sebagai gas
CH4 (Jayanegara, 2008). Berdasarkan hal tersebut, perlu dilakukannya upaya
penurunan CH4 dari ternak ruminansia.
Upaya untuk menurunkan produksi emisi CH4 enterik telah banyak
dilakukan antara lain dengan perbaikan manajemen pakan (Krisnan et al., 2009),
simulasi in vitro (Hess et al., 2003), penggunaan ransum atau limbah sebagai
pakan, penambahan bahan aditif dan manipulasi rumen (Thalib, 2011). Beberapa
menurunkan emisi gas CH4, diantaranya adalah silase jagung (Bakrie et al., 2008),
Moringa oleifera (Soliva et al., 2004), chestnut (Jayanegara, 2009), daun
mahagoni (Yugianto et al., 2010), Sapindus rarak (Suharti et al, 2011), Leucaena
leucocephala (Tan et al., 2011).
Serai wangi (Cymbopogon nardus) merupakan salah satu jenis tanaman
golongan rumput-rumputan yang biasanya digunakan oleh masyarakat untuk
diambil minyak atsirinya. Namun, setelah daun tersebut diambil minyak atsirinya,
daun tersebut sudah tidak digunakan lagi (limbah). Limbah daun serai wangi
digunakan masyarakat hanya untuk menambah bara api dalam proses
penyulingan. Padahal, limbah tersebut masih terkandung berbagai senyawa seperti
tanin, steroid, flavonoid dan senyawa metabolit lainnya yang bisa dimanfaatkan
(Hendrik, 2013).
Dalam memperoleh senyawa tersebut, diperlukan pelarut yang tepat.
Penelitian ini menggunakan 2 macam pelarut, yakni butanol dan heksana. Pelarut
butanol digunakan untuk melarutkan senyawa-senyawa polar, sedangkan pelarut
heksana digunakan untuk melarutkan senyawa-senyawa non-polar yang
terkandung dalam limbah daun serai wangi, yang nantinya senyawa metabolit
tersebut berpotensi dalam fermentasi pakan dan penurunan gas CH4.
Badan Penelitian dan Pengembangan Pertanian (2014) melaporkan limbah
serai wangi hasil penyulingan dapat menyebabkan ternak memiliki kotoran yang
tidak terlalu bau, kandungan protein 7% lebih tinggi dibandingkan limbah jerami.
Serat kasarnya pun lebih mudah dicerna (25,73%) dibandingkan rumput gajah
(34,15%) dan jerami (32,99%) (Badan Pengawas Obat dan Makanan Republik
Oleh karena itu, perlu dilakukannya penelitian mengenai pengaruh
suplementasi ekstrak limbah daun serai wangi terhadap produk fermentasi dan
emisi gas CH4 dari cairan rumen domba secara in vitro yang diharapakan dapat
menekan emisi gas CH4, tanpa mempengaruhi efisiensi pemanfaatan pakan ternak
serta pertumbuhannya.
1.2. Rumusan Masalah
Apakah pakan yang disuplementasi ekstrak limbah daun serai wangi dapat
berpengaruh pada produk fermentasi dan emisi gas CH4 yang dihasilkan oleh
mikroba cairan rumen domba secara in vitro?
1.3. Hipotesis Penelitian
Suplementasi ekstrak limbah daun serai wangi ke dalam pakan dapat
berpengaruh terhadap produk fermentasi dan emisi gas CH4 yang dihasilkan oleh
mikroba cairan rumen domba secara in vitro.
1.4. Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui pengaruh suplementasi ekstrak
limbah daun serai wangi terhadap produk fermentasi dan emisi gas CH4 yang
dihasilkan oleh mikroba cairan rumen domba secara in vitro.
1.5. Manfaat Penelitian
Penelitian ini diharapkan mampu menurunkan emisi gas CH4 dan sebagai
salah satu langkah dalam meminimalisir efek rumah kaca atau global warming.
meningkatkan efisiensi pakan serta dapat menjadi produk suplemen pakan yang
bernilai ekonomis, khususnya bagi para peternak.
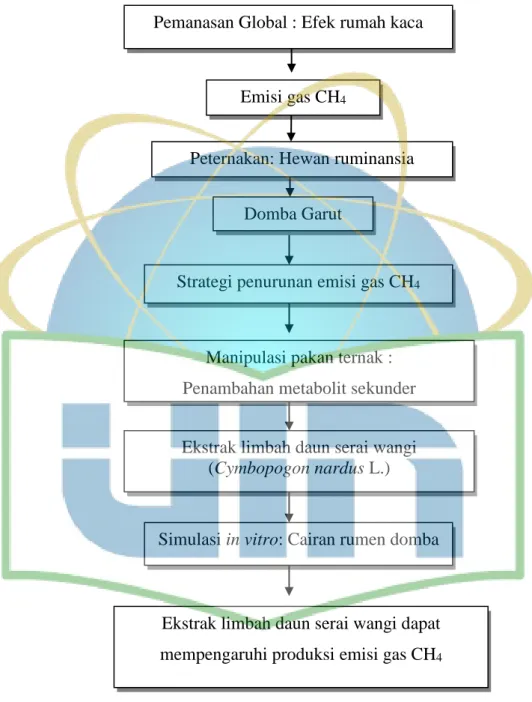
1.6. Kerangka Berpikir
Gambar 1. Kerangka Alur Berpikir
Pemanasan Global : Efek rumah kaca
Strategi penurunan emisi gas CH4
Peternakan: Hewan ruminansia
Ekstrak limbah daun serai wangi dapat mempengaruhi produksi emisi gas CH4
Emisi gas CH4
Ekstrak limbah daun serai wangi (Cymbopogon nardus L.)
Domba Garut
Simulasi in vitro: Cairan rumen domba Manipulasi pakan ternak : Penambahan metabolit sekunder
6
BAB II
TINJAUAN PUSTAKA
2.1. Pemanasan Global
Pemanasan global adalah kejadian terperangkap radiasi gelombang
panjang matahari (gelombang panas atau infra merah) yang dipancarkan ke bumi
oleh gas-gas rumah kaca. Jenis-jenis gas rumah kaca tersebut, diantaranya
Karbondioksida (CO2), Metana (CH4), Karbon monoksida (CO), Nitrogen oksida
(NO), Hydroperfluorokarbon (HFCs), Perfluorokarbon (CFC),Sulfur Heksaflorida
(SF6). Gas-gas rumah kaca secara alami terdapat di udara (atmosfer) dan apabila
berlebih akan menyebabkan efek rumah kaca (Knapp et al, 2014).
Efek rumah kaca terjadi akibat energi matahari memasuki bagian atmosfer
sebagai radiasi gelombang pendek dan membuat jalan ke tanah tanpa bereaksi
dengan gas rumah kaca. Kemudian tanah, awan, dan permukaan bumi lainnya
menyerap energi ini dan melepaskannya kembali ke angkasa sebagai radiasi
gelombang panjang. Radiasi gelombang panjang naik ke atmosfer, itu diserap oleh
gas rumah kaca. Gas rumah kaca kemudian memancarkan radiasi mereka (juga
gelombang panjang), yang akan terus diserap dan dipancarkan oleh berbagai
permukaan, bahkan gas rumah kaca lainnya, sampai akhirnya meninggalkan
atmosfer (IPCC, 2014).
Peristiwa efek rumah kaca dapat dijelaskan sebagai berikut: energi
matahari yang masuk ke bumi mengalami serangkaian proses, 25% energi
dipantulkan oleh awan atau partikel lain ke atmosfer, 25% diadsorpsi oleh awan,
permukaan bumi, berarti energi yang diabsorpsi oleh awan dan permukaan bumi
dipantulkan kembali dalam bentuk radiasi infra merah atau gelombang panas
matahari. Namun, sebagian besar infra merah yang dipancarkan bumi tertahan
oleh awan, gas CO2 dan gas rumah kaca lainnya untuk dikembalikan ke
permukaan bumi (Sulistyono,2007).
Bila kecenderungan peningkatan gas rumah kaca terjadi secara terus
menerus akan menyebabkan peningkatan mencapai 1-3,5 ºC (IPPC, 2006).
Konsentrasi Gas Rumah Kaca secara global meningkat akibat kegiatan manusia
terutama yang berhubungan dengan pembakaran bahan bakar fosil, pembakaran
dan penggundulan hutan yang mengakibatkan pengeluaran CO2, CH4, dan NO2.
Apabila konsentrasi gas rumah kaca meningkat di atmosfer, maka akan semakin
banyak gelombang panas yang dipantulkan dari permukaan bumi dan diserap
atmosfer. Hal ini akan mengakibatkan suhu permukaan bumi menjadi meningkat.
Peningkatan suhu permukaan bumi akan mengakibatkan adanya perubahan iklim
yang sangat ekstrim. Hal ini dapat mengakibatkan terganggunya hutan dan
ekosistem lainnya, sehingga mengurangi kemampuannya untuk menyerap karbon
dioksida di atmosfer (Hardy, 2003).
2.2. Gas CH4 (Metana)
Senyawa CH4 terdiri atas unsur C dan H. CH4 memiliki karakteristik tidak
berwarna, mudah terbakar, gas beracun dengan bau. CH4 merupakan komponen
utama dari gas alam. Gas CH4 berasal dari alam seperti kutub, lautan, lapisan es
permanen, tanah yang gembur, serta berasal dari aktivitas manusia. CH4 terbentuk
secara alami dari reduksi CO2 oleh H2 yang dikatalisis oleh enzim yang dihasilkan
CH4 dapat membuat semakin tipisnya lapisan ozon di wilayah troposfer
dari suasana di mana efek rumah kaca terjadi, dan meningkatkan uap air
stratosfer, yang keduanya dapat menambah kekuatan radiasi dari gas sekitar 70%.
CH4 lebih berbahaya 20-30 kali lebih besar dibandingkan dengan CO2.
Ada lima kegiatan yang menjadi sumber CH4 yaitu peternakan, budidaya
padi sawah, pembakaran padang sabana dan limbah pertanian, kegiatan
antropogenik dan tanah pertanian (IPPC, 2006). Sektor peternakan memiliki
pengaruh cukup besar dalam penyumbang emisi gas CH4 (Beauchemin, 2008).
Emisi CH4 ruminansia berasal dari fermentasin enterik dan kotoran, yang
berkontribusi berjumlah sekitar 94% dari total emisi CH4 (Hidayah, 2016). Ternak
ruminansia bertanggung jawab terhadap 85 Tg (1 Tg sama dengan 1012 g = 1 juta
metrik ton) dari 550 Tg gas CH4 yang dibebaskan ke alam setiap tahunnya.
2.3. Domba Garut
Domba garut (Ovis aries) merupakan hasil persilangan antara domba lokal
Indonesia (Jawa Barat), domba merino (Spanyol), dan domba kaapstad (Afrika
Selatan) (Herdis, 2008). Domba Garut berasal dari domba lokal dari daerah
Cibuluh dan Wanaraja yang memiliki ciri spesifik, yaitu memiliki kombinasi
telinga rumpung (rudimenter) dengan ukuran di bawah 4 cm dan ekor berukuran 4
- 8 cm (Heriyadi, 2009). Domba ini juga memiliki berat badan rata-rata di atas
domba lokal Indonesia lainnya. Herdis (2005) menyebutkan bahwa domba garut
Gambar 2. Domba Garut (Ovis aries), Sumber : Dok. Pribadi (2017)
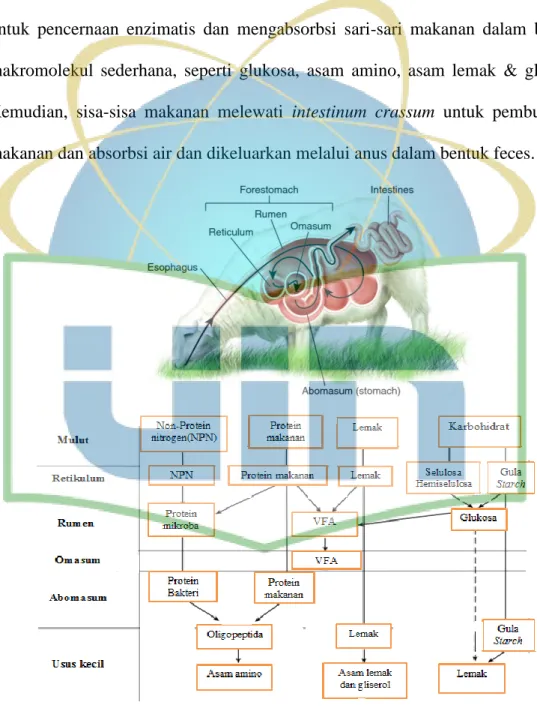
Berdasarkan data ternak kementerian pertanian RI (2016), populasi domba
tertinggi di Indonesia ditemukan pada provinsi Jawa Barat dengan kenaikan
populasi sebesar ±900.000-1.200.000/ekor tiap tahunnya. Selain Jawa Barat,
provinsi yang memiliki populasi domba cukup tinggi, adalah Jawa Tengah dan
Jawa Timur. Sebagian besar masyarakat mengembangbiakkan ternak domba
untuk berbagai tujuan, diantaranya hari raya qurban, adu domba, aqiqah, upacara
keagamaan ataupun tradisi adat istiadat lainnya.
Tabel 1. Populasi ternak domba di Indonesia
No Provinsi 2012 2013 2014 2015 2016 1 Aceh 163.542 157.111 111.030 107.163 112.394 2 Sumatera Utara 374.286 595.517 610.103 611.427 623.677 3 Jambi 72.927 77.151 79.708 79.793 85.043 4 Lampung 88.873 89.005 70.936 65.072 65.185 5 DKI Jakarta 1.450 1.174 2.211 2.180 2.398 6 Jawa Barat 8.249.844 9.391.590 10.612.726 11.575.359 12.462.091 7 Jawa Tengah 2.429.132 2.458.303 2.395.671 2.304.131 2.363.158 8 Yogyakarta 151.772 156.860 166.567 177.578 179.408 9 Jawa timur 1.088.602 1.165.472 1.221.758 1.282.910 1.328.834 10 Banten 612.583 637.218 657.674 644.167 611.693 11 NTT 63.109 63.877 64.645 65.421 66.205
2.4. Sistem Pencernaan Ruminansia
Sistem pencernaan merupakan rangkaian proses perubahan fisik dan kimia
yang dialami bahan makanan selama berada di dalam organ pencernaan. Proses
pencernaan makanan pada ruminansia relatif lebih kompleks dibandingkan proses
pencernaan lainnya. Ternak ruminansia (Forestomach) dibagi menjadi 4 bagian
perut, yaitu retikulum (perut jala), rumen (perut beludru), omasum (perut bulu),
dan abomasum (perut sejati). Pencernaan pada ternak meliputi pencernaan
mekanik, pencernaan fermentatif, dan pencernaan hidrolitik. Pencernaan mekanik
terjadi di mulut oleh gigi melalui proses mengunyah (mastikasi) dengan tujuan
untuk memperkecil ukuran partikel pakan. Pencernaan di lambung depan berjalan
secara fermentatif oleh mikroba rumen, sedangkan pencernaan di lambung sejati
(abomasum) terjadi secara hidrolitis oleh enzim pencernaan (Bessa et al., 2015).
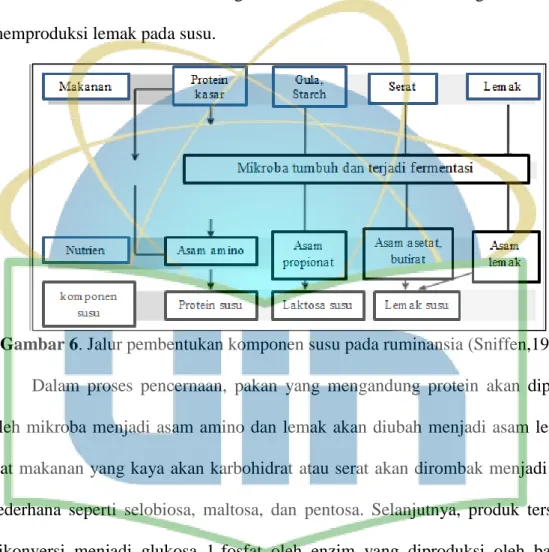
Gambar 3 menjelaskan karbohidrat, protein, lemak dan non-protein
Nitrogen (NPN) yang terkandung dalam pakan dihidrolisis secara mekanis dan
kimiawi di dalam mulut, lalu setelah melewati esophagus masuk ke lambung,
bagian retikulo-rumen. Dalam studi fisiologi ternak ruminasia, rumen dan
retikulum sering dipandang sebagai organ tunggal dengan sebutan retikulo-rumen,
dimana makanan dicerna menjadi bubur (kim). Di retikulum, selulosa,
hemiselulosa dan gula starch akan didegradasi oleh mikroba menjadi glukosa
sebagai substrat fermentasi dan di rumen, NPN atau protein nantinya akan
digunakan untuk sintesis protein mikroba di dalam rumen. Beberapa
makromolekul, lemak dan protein akan masuk ke proses fermentasi, dan
VFA yang dihasilkan sebagian langsung diserap melalui dinding rumen dan
sebagian lagi diserap dalam omasum (perut buku), dimana terjadi penyerapan air,
amonia, asam lemak terbang (VFA) dan elektrolit. Kemudian, zat makanan
diteruskan ke abomasum yang merupakan lambung sebenarnya. Beberapa protein
ada yang diteruskan ke abomasum untuk dipecah oleh enzim menjadi
oligopeptida. Selanjutnya, makanan tersebut masuk ke dalam intestinum tenue
untuk pencernaan enzimatis dan mengabsorbsi sari-sari makanan dalam bentuk
makromolekul sederhana, seperti glukosa, asam amino, asam lemak & gliserol.
Kemudian, sisa-sisa makanan melewati intestinum crassum untuk pembusukan
makanan dan absorbsi air dan dikeluarkan melalui anus dalam bentuk feces.
Gambar 3. Gambar domba beserta jalur nutrisi pakan di dalam sistem pencernaan
Protein kasar, karbohidrat (gula, serat) serta lemak difermentasi oleh
mikroba secara enzimatis menjadi produk sederhana seperti asam amino dan
beberapa asam lemak terbang seperti propionat dari gula, asetat dan butirat dari
serat dan asam lemak. Hasil produk tersebut digunakan sebagai berikut: asam
amino digunakan sebagai protein susu, asam propionat digunakan dalam
pembentukan laktosa susu, sedangkan asam asetat serta butirat digunakan untuk
memproduksi lemak pada susu.
Gambar 6. Jalur pembentukan komponen susu pada ruminansia (Sniffen,1991)
Dalam proses pencernaan, pakan yang mengandung protein akan dipecah
oleh mikroba menjadi asam amino dan lemak akan diubah menjadi asam lemak.
Zat makanan yang kaya akan karbohidrat atau serat akan dirombak menjadi gula
sederhana seperti selobiosa, maltosa, dan pentosa. Selanjutnya, produk tersebut
dikonversi menjadi glukosa 1-fosfat oleh enzim yang diproduksi oleh bakteri
rumen, dan glukosa melalui proses glikolisis dibentuk menjadi asam piruvat, dan
energi berupa ATP (Mc Donald et al.,2002).
Asam piruvat yang terbentuk, akan difermentasi oleh mikroba di dalam
rumen dan menghasilkan asam asetat, propionat dan butirat (volatile fatty acid),
dibutuhkan oleh ruminansia untuk menghasilkan energi dan memproduksi laktosa
susu. Asam amino digunakan untuk memproduksi protein susu. Sedangkan, asam
lemak beserta asam asetat dan butirat digunakan ruminansia sebagai substrat
dalam memproduksi lemak susu (Sniffen, 1991).
2.5. Proses Fermentasi Pakan di dalam Rumen
Hasil fermentasi pakan dalam cairan rumen, salah satunya Volatile Fatty
Acids. VFA merupakan produk pakan hasil fermentasi karbohidrat dan menjadi
sumber energi utama ruminansia asal rumen. Awalnya, polisakarida di dalam
rumen dihidrolisis menjadi monosakarida (glukosa dan fruktosa). Hasil
pencernaan tahap pertama masuk ke jalur glikolisis Embden-Mayerhoff untuk
mengalami pencernaan tahap kedua yang menghasilkan piruvat. Piruvat
selanjutnya akan di ubah menjadi VFA (Arora, 1995). Konsentrasi VFA
dipengaruhi oleh beberapa faktor, antara lain jenis pakan, pH, kandungan serat
kasar atau karbohidrat, populasi mikroba dan kadar NH3.
NH3 berasal dari protein dan nitrogen bukan protein (NPN) yang dihidrolisis
oleh enzim proteolitik yang dihasilkan oleh mikroba (Arora, 1995). Produksi NH3
dipengaruhi oleh waktu setelah makan dan umumnya produksi maksimum di
capai pada 2-4 jam setelah pemberian pakan yang bergantung pada sumber protein
yang digunakan dan mudah tidaknya protein tersebut didegradasi. Jika pakan yang
mengandung protein dan protein tersebut terdegradasi, maka konsentrasi N-NH3
rumen akan rendah (lebih rendah dari 50 mg/L) dan pertumbuhan organisme
rumen akan melambat. Sebaliknya, jika degradasi protein lebih cepat daripada
optimumnya. Kisaran optimum NH3 dalam rumen berkisar antara 85-300 mg/L
(McDonald et al., 2002).
Kandungan NH3, VFA serta pembentukan protein mikroba merupakan tolak
ukur nilai gizi dan manfaat bahan serta aktivitas di dalam rumen. Mc Donald
(2002) menyatakan bahwa konsentrasi NH3 yang tinggi dapat menunjukkan
proses degadasi protein pakan lebih cepat dari pada proses pembentukan protein
mikroba, sehingga NH3 yang dihasilkan terakumulasi dalam rumen.
Kondisi ideal adalah pada saat sumber energi yang dapat difermentasi
sama cepatnya dengan pembentukan NH3, sehingga pada saat NH3 terbentuk
terdapat produksi fermentasi asal karbohidrat yang akan digunakan sebagai
kerangka karbon dari protein mikroba. Jenis-jenis mikroba yang ada di dalam
rumen bermacam-macam (tabel 2), mereka menggunakan senyawa turunan
karbohidrat sebagai substrat pertumbuhannya seperti selulosa, hemiselulosa atau
starches. Lalu, akibat dari penggunaan substrat tersebut akan menghasilkan
produk fermentasi diantaranya asam asetat, butirat, propionat, CO2 dan CH4.
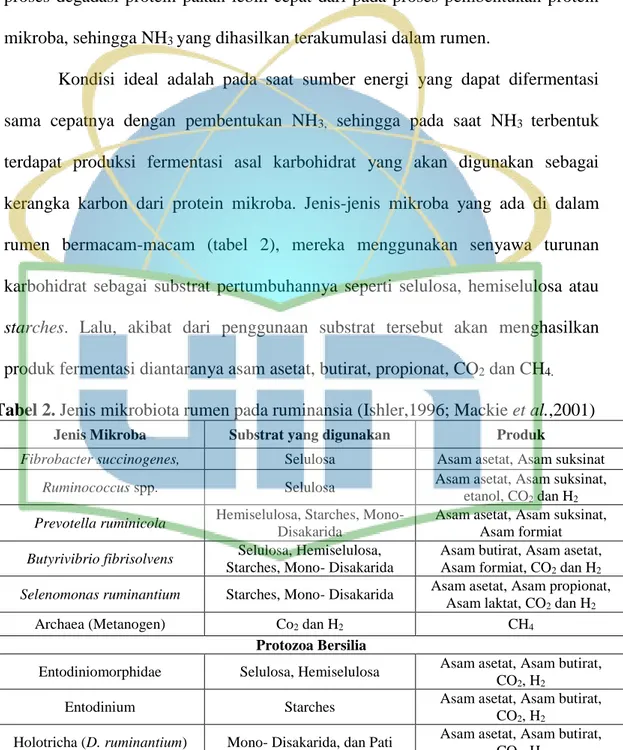
Tabel 2. Jenis mikrobiota rumen pada ruminansia (Ishler,1996; Mackie et al.,2001)
Jenis Mikroba Substrat yang digunakan Produk
Fibrobacter succinogenes, Selulosa Asam asetat, Asam suksinat
Ruminococcus spp. Selulosa Asam asetat, Asam suksinat, etanol, CO2 dan H2
Prevotella ruminicola Hemiselulosa, Starches, Mono- Disakarida
Asam asetat, Asam suksinat, Asam formiat
Butyrivibrio fibrisolvens Selulosa, Hemiselulosa, Starches, Mono- Disakarida
Asam butirat, Asam asetat, Asam formiat, CO2 dan H2
Selenomonas ruminantium Starches, Mono- Disakarida Asam asetat, Asam propionat, Asam laktat, CO2 dan H2
Archaea (Metanogen) Co2 dan H2 CH4
Protozoa Bersilia
Entodiniomorphidae Selulosa, Hemiselulosa Asam asetat, Asam butirat, CO2, H2
Entodinium Starches Asam asetat, Asam butirat, CO2, H2
Holotricha (D. ruminantium) Mono- Disakarida, dan Pati Asam asetat, Asam butirat, CO2, H2
2.6. Metabolisme Pembentukan Gas CH4
Secara garis besar proses pembentukan gas CH4 dibagi dalam tiga tahap,
yaitu: hidrolisis, asidifikasi (pengasaman) dan pembentukan gas CH4 (Haryati,
2006). Tahap pertama adalah reduksi senyawa organik yang komplek menjadi
senyawa yang lebih sederhana oleh bakteri hidrolitik atau disebut dengan tahap
hidrolisis. Bakteri hidrolitik ini bekerja pada suhu antara 30-40oC untuk kelompok mesophilik dan antara 50-60oC untuk kelompok termophilik. Tahap pertama ini berlangsung dengan pH optimum antara 6 sampai 7 (Budiyanto, 2002).
Tahap kedua adalah asidifikasi (pengasaman) dimana terjadi perubahan
senyawa sederhana menjadi asam organik yang mudah menguap (Vollatile fatty
acids) seperti asam asetat, asam butirat, asam propionat dan lain-lain. Asam
organik yang terbentuk menyebabkan pH akan terus menurun, namun pada waktu
yang bersamaan terbentuk buffer yang dapat menetralisir pH. Bakteri pembentuk
asam-asam organik tersebut di antaranya adalah Pseudomonas, Flavobacterium,
Escherichia dan Aerobacter (Budiyanto, 2002).
Tahap ketiga adalah pembentukan gas CH4 atau metanogenesis,
merupakan tahap konversi asam organik menjadi CH4, CO2 dan gas-gas lain
seperti hidrogen sulfida (H2S), H dan nitrogen (N). CH4 dihasilkan dari asetat atau
dari reduksi CO2 oleh bakteri asetotropik dan hidrogenotropik. Konversi tersebut
dilakukan oleh bakteri metanogen seperti Methanobacterium omelianskii, M.
sohngenii, M. suboxydans, M. propionicum, M. formicium, M. ruminantium, Methanosarcina barkeril, Methanococcus vannielli dan Methanococcus mazei.
Pada tahap ini, pembentukan emisi gas CH4 di dalam rumen terjadi melalui
metanogen. Pembentukan ini bertujuan untuk menjaga tekanan H2 yang sangat
rendah (menghindari pembentukan laktat yang tinggi) dan hal ini berpengaruh
penting terhadap fermentasi secara keseluruhan (Jayanegara, 2008). Gas CH4
nantinya dikeluarkan melalui anus serta mulut ruminansia, lalu dilepaskan ke
atmosfer (Martin et al., 2008).
2.7. Serai Wangi
Tanaman serai wangi termasuk golongan rumput-rumputan yang disebut
sebagai Andropogon nardus atau Cymbopogon nardus. Genus ini meliputi hampir
80 spesies, dan beberapa jenis tanaman tersebut dapat menghasilkan minyak atsiri.
Tanaman serai wangi mampu tumbuh sampai 1-1,5 m. Panjang daunnya mencapai
70-80 cm dan lebarnya 2-5 cm, berwarna hijau muda, kasar dan memiliki aroma
yang kuat (Balai teknologi pertanian, 2016).
Serai wangi di Indonesia ada dua jenis varietas dari sereh wangi ini yaitu
varietas Lena batu dan verietas Mahapengiri.Perbedaannya adalah jika jenis
mahapengiri mempunyai ciri-ciri daunnya lebih lebar, pendek, menghasilkan
minyak dengan kadar sitronellal 30-45% dan geraniol 65- 90%. Sedangkan, jenis
lenabatu menghasilkan minyak dengan sitronellal 7-15% dan geraniol 55-65%
(Santoso, 2006). Serai wangi (Cymbopogon nardus. L) merupakan salah satu jenis
tanaman minyak atsiri, yang tergolong sudah berkembang. Dari hasil penyulingan
daunnya diperoleh minyak serai wangi yang dalam dunia perdagangan dikenal
dengan nama Citronella Oil. Tahun 2012, Menurut data dari Balai tanaman
perkebunan propinsi Jawa Barat (2015), Produksi serai wangi di wilayah Jawa
barat yakni mencapai 3.482 ton dan produksi serai pada tahun tersebut paling
Menurut Sukamto et al. (2011), luas rata-rata budidaya seraiwangi di
Indonesia yang umumnya dilakukan dalam skala pertanaman rakyat mencapai
20.900 ha/th. Tanaman tersebut juga memiliki daya hidup kuat, bahkan sering
digunakan di daerah marginal. Balai Penelitian Tanaman Obat dan Aromatik
(2011) menyatakan serai wangi dapat tumbuh di dataran rendah hingga ketinggian
1.200 mdpl, cocok ditanam di lahan terbuka intensitas cahaya sekitar 75-100%.
Klasifikasi ilmiah (taksonomi) tanaman serai wangi adalah sebagai berikut;
Kingdom: Plantae, Subkingdom: Trachebionta, Divisi: Spermatophyta, Subdivisi:
Magnoliophyta, Kelas: Liliopsida, Subkelas: Commelinidae, Ordo: Cyperales,
Famili: Gramineae, Genus: Cymbopogon, Spesies: Cymbopogon nardus (L.)
Rendle (USDA, 2016).
(x) (y)
Keterangan: (x) = Tanaman serai wangi (y) = Limbah daun serai wangi
Gambar 6. Tanaman Serai wangi dan Limbah Daun Serai wangi Sumber : Dok. Pribadi (2017)
2.7.1. Kandungan Senyawa pada Serai wangi
Tanaman serai wangi mengandung 0,4% minyak atsiri, dengan komponen
yang terdiri dari sitral, α-pinen, kamfen, sabinen, mirsen,β-felandren, psimen,
geraniol, farnesol, metil heptenon, n-desialdehida, dipenten, metil heptenon,
bornilasetat, geranilformat, terpinil asetat, sitronelil asetat, geranil asetat, β-elemen, β-kariofilen, β-bergamoten, trans- metilisoeugenol, β- kadinen, elemol,
kariofilen oksida (Kristiani, 2013). Selain itu, Wei & Wee (2013) menyatakan
bahwa senyawa aktif pada daun serai wangi antara lain sitronelal, nerol, geraniol,
geranial, linalol, limonen, eugenol yang memiliki aktivitas anti-bakteri.
Tabel 3. Kandungan daun serai wangi (Hendrik, 2013)
Jenis Senyawa JENIS EKSTRAK Ekstrak Kasar Metanol Fraksi Heksana Fraksi Etil Asetat Alkaloid - - - Saponin - - - Steroid - + - Terpenoid + - + Flavonoid + - + Fenolik + - +
Daun serai wangi yang sudah mengalami proses penyulingan pun dapat
memiliki beberapa senyawa-senyawa tersebut yang dapat dimanfaatkan, salah
satunya PUFA (Polyunsaturated fatty acids). PUFA adalah asam lemak poli tak
jenuh yang memiliki lebih dari satu ikatan rangkap dan maksimum memiliki 6
ikatan rangkap dalam struktur rantai karbon. Asam lemak poli tak jenuh memiliki
gugus utama asam karboksilat (−COOH) dan pada rantai karbon mengandung dua
atau lebih ikatan rangkap, ikatan rangkap tidak terkonjugasi tetapi terpisah oleh gugus metilen (−CH2). Menurut wuryanti (2015), pemberian suplementasi nutrisi
diperkaya PUFA mampu menurunkan status inflamasi. Jafari et al. (2016)
mengatakan bahwa asam lemak tak jenuh (PUFA) dengan pelarut non-polar
(heksana dan kloroform) mereduksi gas CH4 sekitar 5-6%, sedangkan pelarut
2.8. Penelitian mengenai penurunan gas CH4
Hewan ruminansia khususnya sapi perah telah diteliti dan diterapkan
beberapa strategi penurunan gas CH4 yaitu dilakukan penambahan ionofor, lemak,
penggunaan hijauan berkualitas tinggi, dan meningkatkan penggunaan biji-bijian
(konsentrat). Pengurangan emisi gas CH4 dapat dilakukan dengan memanipulasi
proses fermentasi di dalam rumen baik itu dengan langsung menghambat populasi
metanogen protozoa, atau dengan mengalihkan senyawa hidrogen.
Beberapa sumber mengidentifikasi cara baru untuk mengurangi emisi gas
CH4a yaitu dengan penambahan probiotik, strategi manajemen pakan, manipulasi
rumen, acetogens, archaea, asam organik, ekstrak tumbuh-tumbuhan untuk pakan,
dan seleksi genetik sapi. Gas CH4 merupakan produk akhir fermentasi karbohidrat
dalam rumen. Cara meningkatkan produktivitas ternak menjadi cara yang cukup
efektif untuk mengurangi pelepasan gas CH4 dalam jangka pendek, akan tetapi
hampir semua melibatkan peningkatan penggunaan pakan yang mengandung
kualitas lebih tinggi atau rendah kandungan seratnya (Moss et al., 2000).
Strategi pemberian pakan yang dilakukan salah satunya adalah pemberian
pakan yang mengandung tanin pada ternak ruminansia karena tanin silase,
diproduksi dengan memfermentasi jagung di dalam silo. Pakan tersebut dapat
mengurangi emisi polutan dari knalpot kendaraan sebanyak 6%. Jika memiliki
kadar gula yang lebih tinggi mampu mengurangi emisi tersebut sekitar 20% dan
apabila ditambah gandum tanpa sekam dapat mengurangi CH4 sekitar 33%.
Hasil penelitian Suharti et al. (2011) melaporkan bahwa penambahan
ekstrak Lerak (Sapidus rarak) yang mengandung 81,5% saponin pada level 0,6
penelitian Tan et al., (2011) secara in vitro penambahkan tanin terkondensasi
murni dari ekstrak tanaman Leucaena leucocephala pada level 0, 10, 15, 20, 25,
30 mg dalam 500 mg sampel, menunjukkan bahwa semakin tinggi penambahan
tanin terkondensasi murni, maka semakin menurun produksi gas CH4, VFA,
protozoa dan bakteri metanogen. Produksi gas CH4 yang diperoleh adalah sebesar
10- 5,5 mg/g dibandingkan dengan kontrol yakni sebesar 14,9 mg/g.
Jayanegara (2009) menyatakan penambahan tanin murni dari chestnut 1
mg/ml dapat menurunkan konsentrasi gas CH4 sebesar 6.5% dan 7.2%. Jumlah
pemberian buffer 1,5% NaHCO3 + 0,5% MgO dari BK ransum pada Sapi
Holstein dengan pemberian Hay alfalfa dan silase jagung pada pakan dapat
meningkatkan pH rumen hingga 2%, meningkatkan kecernaan NDF sebesar 16%
dan VFA total sebesar 6%. Penelitian Jayanegara lainnya dilaporkan penambahan
tanin murni baik dari jenis tanin terkondensasi ataupun tanin terhidrolisis pada
konsentrasi rendah 0,5 mg/ml cairan rumen atau yang setara dengan 25mg/500 mg
sampel mampu menurunkan VFA total pasial, produksi gas dan total gas CH4
dibandingkan dengan perlakuan kontrol. Jumlah produksi CH4 yang diperoleh
dengan penambahan tanin adalah sebesar 13,3-13,5%, dan produksi CH4 pada
kontrol sebesar 14,7%.
Hasil penelitian Bauchemin et al. (2007) melaporkan bahwa penambahan
ekstraktanin terkondensasi dari tanaman quebracho yang mengandung 91% tanin.
Penambahan tanin yang berasal dari tanaman Sericea lespedeza (17,7% tanin
terkondensasi) menurunkan emisi CH4 (10,7 g/kg kecernaan BK). Penggunaan
minyak jagung sebagai agen defaunasi mampu mengeliminasi protozoa rumen
populasi bakteri rumen dari 8,80 x 1010 sel/ml menjadi 11,40 x 1010 sel/ml (Zain et
al., 2008). Hess et al. (2003) melaporkan bahwa penelitian pengukuran protozoa
dengan PCR menunjukkan penambahan tanin terkondensasi mampu menurunkan
populasi protozoa, yang berefek pada penurunan gas CH4.
Pen et al. (2006) melaporkan bahwa penggunaan dosis saponin yang
berbeda menghasilkan respon yang berbeda terhadap produksi CH4 dan populasi
protozoa. Penambahan ekstrak Yucca schidigera (80-100 g/kg saponin) dengan
level 2, 4 dan 6 ml/l cairan rumen menurunkan produksi CH4 dari 32-42%. Hasil
penelitian secara in vitro menggunakan saponin juga dilaporkan oleh Hu et al.
(2005) bahwa penambahan ekstrak saponin dari biji teh (60% saponin) level 0,2
dan 0,4 mg/ml cairan rumen sangat signifikan menurunkan populasi protozoa, dan
produksi gas CH4. Populasi protozoa dengan penambahan ekstrak saponin sebesar
0,53 - 0,11x105 ml−1, sementara perlakuan kontrol populasinya sebesar 0,61x105
ml−1. Jika dibandingkan dengan kontrol, populasi protozoa setelah penambahan saponin menjadi menurun. Hasil produksi CH4 setelah penambahan ekstrak
22
BAB III
METODE PENELITIAN
3.1. Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan September 2016 sampai dengan
bulan Maret 2017 di Laboratorium Pengujian Pusat Aplikasi Teknologi Isotop dan
Radiasi Badan Tenaga Nuklir Nasional (BATAN) yang beralamat di Jalan Lebak
Bulus Raya, Pasar Jumat, kota Jakarta Selatan.
3.2. Alat dan Bahan
Peralatan yang digunakan penelitian ini adalah kain kassa, kertas saring,
desikator, gunting, rotary evaporator, destilator (Glass Col), buret (Assistant
Germany), grinder (Fritsch Standard Funnel V2A 14304), Gas Cromatography
(GC), labu Kjeldahl, pemanas, kondensor, tanur listrik (Pyrolabo), hotplate (Ika
Labortechnik) pH meter (Hanna Istrumens), oven (Fisher Isotemp Oven), neraca
analitik (Satrorius), tanur (Heraeus), cawan porselen, cawan conway (Phyrex),
glass syringe (Fortuna® Optima glass syringes), gas bags (Techinstro), reflux
(Gerhardt), gelas ukur, pompa vakum, desikator (Phyrex), gas analyzer (MRU
vario), inkubator, mikropipet, mikrotip, erlenmeyer (Phyrex), soxhlet (Atico),
tabung reaksi, sentrifuge (Hitachi), waterbath (Dolphin® Instruments),
mikrosentrifuge, mikrotub, thermal cycler.
Bahan-bahan yang digunakan dalam penelitian ini adalah daun serai wangi
setelah proses penyulingan dari Desa Cibunian Bogor, pelarut heksana, pelarut
butanol, aquades, cairan rumen domba, NaOH (Merck), H2SO4 (Merck), HCl
larutan EDTA, vaselin, methylen blue, methylen red, asam asetat glasial, metanol,
asam asetat, larutan Mc.Dougall, FeCl (III), NaHCO3, NH4HCO3, Na2HPO4,
KH2PO4, MgSO4.7H2O, natriumlauryl sulfat (Merck), metanol, etanol, indikator
Conway, petroleum eter ,selenium, NaCl Fisiologis, Aquades steril, larutan
lysozyme (LL), Rnase, Proteinase-K, DNA template, primer, Dna contents, Taq
polymerase, PureLink Genomic Digestion Buffer, PureLink Genomic Lysis binding buffer, PureLink Genomic Elution Buffer, Wash buffer, Cyber green, CO2.
3.3. Prosedur Kerja
Penelitian ini terdiri dari beberapa tahapan, yaitu preparasi sampel daun, uji
proksimat: bahan kering, bahan organik, bahan abu, Neutral Detergent Fiber,
lemak total dan protein kasar. Setelah itu, dilanjutkan dengan pengukuran nilai
pH, nilai NH3, degradasi bahan organik, Volatile Fatty Acids, degradasi NDF,
analisis RT-PCR untuk mengetahui jumlah total bakteri, bakteri metanogen, B.
fibrisolvent, total protozoa, produksi gas dan total gas CH4.
3.3.1 Preparasi Sampel
Rumput lapangan yang digunakan sebagai pakan ternak dan limbah daun
serai wangi hasil digunting sekitar 2-5 cm. Kemudian, dipanaskan dalam oven
dengan suhu 60oC selama 48 jam. Kemudian, sampel dihaluskan menggunakan
grinder dengan ukuran 0,4 mesh hingga berbentuk serbuk simpilisia. 3.3.2 Analisis Proksimat rumput lapangan
3.3.2.1. Pengukuran Bahan Kering dan Bahan Organik
Bahan kering dan organik diukur dengan menggunakan metode gravimetri
berdasarkan Association of Official Analytical Chemistry (2005). Langkah
jam pada oven 105̊C, didinginkan dalam desikator, berat cawan kosong (X)
ditimbang. Kemudian, rumput lapangan ditimbang sebanyak 0,2 gram diletakkan
ke dalam cawan. Selanjutnya, cawan dimasukkan ke dalam oven 105˚C selama ±
24 jam, didinginkan dalam desikator, lalu ditimbang dan dicatat beratnya.
Keterangan : X = Bobot cawan kosong (g) Y = Bobot sampel (g)
Z = Bobot akhir (g)
Cawan kosong dikeluarkan dari oven dan dimasukkan ke dalam desikator
selama 1 jam, ditimbang. Sampel (c) kemudian di tanur dengan suhu 600˚C
selama 4 jam. Setelah itu, pakan tersebut dimasukkan ke dalam desikator selama 1
jam lalu ditimbang (d). Penentuan berat abu (%BA) dan bahan organik (%BO)
diketahui dengan rumus sebagai berikut :
% BO = % BK - % BA
Ket : α = Bobot cawan kosong (g) c = Bobot yang telah di oven(g)
d = Bobot akhir (g)
3.3.2.2 Pengukuran Lemak Total
Lemak total diukur menggunakan metode Association of Official Analytical
Chemistry (2005) yang telah dimodifikasi. Sebanyak 0,5 g sampel (x) ditimbang
dan dibungkus dengan kertas saring bebas lemak yang bobotnya telah diketahui
(y). Kemudian, disokhlet menggunakan petroleum eter sebanyak 6-7 siklus,
kemudian ditimbang bobotnya (z) dan dilakukan perhitungan % lemak kasar :
3.3.2.3 Pengukuran Protein Kasar
Penentuan Protein Kasar menggunakan metode Association of Official
Analytical Chemistry (2005). Pertama, sampel rumput lapangan ditimbang
sebanyak 0,3 g ditambahkan 1,5 g katalis selenium mixture, selanjutnya
dimasukkan kedalam labu Kjeldahl 20 mL HCl, lalu sampel didestruksi sampai
warna larutan menjadi hijau-kekuningan jernih, setelah itu didinginkan selama 15
menit. Kemudian, ditambahkan 300 mL aquadest dan dinginkan kembali. Setelah
itu, ditambahkan 100 mL NaOH, kemudian, dilakukan destilasi tampung hasil
destilasi dengan 10 mL HCl 0,1 N yang ditambah 3 tetes indikator campuran
methylen blue dan methylen red. Dilakukan titrasi dengan NaOH 0,1 N sampai
terjadi perubahan warna menjadi biru kehijauan. Selanjutnya, ditetapkan
penetapan blanko, pipet 10 ml HCl 0,1 N dan ditambah 2 tetes indikator PP
selanjutnya dititrasi dengan NaOH 0,1 N.
3.3.3 Ekstraksi Limbah Daun Serai Wangi
Metode ekstraksi merujuk pada jurnal Jafari et al. (2016), Hal pertama yang
dilakukan adalah daun serai wangi hasil penyulingan (limbah) dikeringanginkan
selama ±2 hari. Setelah itu, limbah daun serai wangi dipotong sekitar 3-5 cm.
Lalu, sampel di oven pada suhu 60˚C selama 48 jam dan dihaluskan
menggunakan grinder. Ekstraksi sampel dilakukan dengan metode sokletasi,
sampel sebanyak 125 g ditimbang dan dibungkus dengan kertas saring. Metanol
1,25 L ditambahkan ke dalam labu bulat, sampel yang telah dibungkus kemudian
Ekstrak yang telah diuapkan, diekstraksi dengan corong pisah menggunakan 400
ml akuades, 150 ml heksana dan 150 ml butanol. Lalu, ekstrak heksana dan
ekstrak butanol tersebut diuapkan menggunakan rotary evaporator hingga
diperoleh ekstrak dalam bentuk jel.
3.3.4. Uji Simulasi In vitro
3.3.4.1. Sampling Cairan Rumen Domba
Mula-mula domba garut dipotong, diambil isi rumen domba yang berwarna
hijau, kemudian diperas isi rumen tersebut dengan kain kasa dan dimasukkan ke
termos yang sebelumnya diisi air panas pada suhu ±40oC yang kemudian dibuang dan digantikan oleh cairan rumen. Setelah itu, cairan rumen diukur dengan gelas
ukur. Cairan rumen tersebut diambil 150 ml untuk tiap perlakuan. Pengambilan
cairan rumen dilakukan di pusat aplikasi isotop dan radiasi BATAN.
3.3.4.2. Pembuatan Larutan McDougall
Pembuatan larutan McDougall (Saliva buatan) digunakan sebagai suatu
medium buffer yang menyerupai kondisi dalam rumen ternak ruminansia
bersama-sama cairan rumen (Mc Donald, 2001). Larutan McDougall dibuat
dengan mencampurkan larutan-larutan ke dalam Erlenmeyer: CaCl2.2H2O 13,2 g,
MnCl2.4H2O 1 g, COCl2.6H2O 1 g, FeCl3.6H2O pada 100 ml aquades. Larutan
buffer dengan mencampurkan NaHCO3 35 g dan NH4HCO3 4 g pada 1000 ml
akuades. Larutan makromineral dibuat dengan mencampurkan Na2HPO4 5,7 gr,
KH2PO4 6,2 gr dan MgSO4.7H2O yang dicampurkan dalam 1000 ml akuades.
Resazurin dibuat dari 100 mg resazurin yang dilarutkan pada 100 ml akuades.
62 ml. Larutan tersebut dihomogenkan dengan magnetic stirrer dalam waterbath
dengan suhu 38- 39oC.
3.3.4.3. Uji Kecernaan Secara In vitro
Uji kecernaan ini dilakukan dengan metode Hohenheim Gas Test (Widiawati
et al., 2008). Pertama, disiapkan syringe glass yang sebelumnya sudah diberikan
rumput lapangan sebanyak 200 mg. Kemudian, cairan rumen yang telah
dimasukkan dalam erlenmeyer yang berisi larutan Mc.Dougall dipindahkan
sebanyak 30 ml ke dalam syringe glass. Bagian tepi syringe diberi vaselin agar
kedap udara. Setelah itu, dibuat sebanyak 3 perlakuan, diantaranya adalah kontrol
(K), perlakuan A : ditambah 15 mg ekstrak heksana limbah daun serai wangi,
perlakuan B : ditambah 15 mg ekstrak butanol limbah daun serai wangi, dibuat 3
kali pengulangan pada tiap perlakuan. Setelah semua dipindahkan ke dalam
syringe glass, diberi vaselin pada bagian tepi supaya kedap udara. Kemudian,
diinkubasi dalam waterbath suhu 38-39oC selama 24 jam. Setelah diinkubasi, dilakukan analisis parameter, seperti : pH, NH3, VFA Total Parsial, DBO, DNDF,
menganalisis populasi mikroorganisme RT-PCR, produksi gas dan total gas CH4.
Tabel 4. Perlakuan tiap sampel
Perlakuan
Limbah Daun Serai
wangi Rumput Lapangan
Cairan rumen Domba Ekstrak Heksana Ekstrak Butanol K - - 200 mg 30 ml A 15 mg - 200 mg 30 ml B - 15 mg 200 mg 30 ml Blanko - - - 30 ml
Keterangan: K= Kontrol; A= Penambahan sampel ekstrak heksana limbah daun serai wangi; B= Penambahan sampel ekstrak butanol limbah daun serai wangi; (-) = Tidak ditambahkan sampel. Dibuat triplo tiap perlakuan.
3.3.5. Analisis Parameter Uji
3.3.5.1. Skrining Fitokimia Secara Kualitatif
Skrining fitokimia dilakukan untuk mengetahui kandungan metabolit
sekunder pada ekstrak limbah daun serai wangi. Metabolit sekunder yang
diidentifikasi untuk uji fitokimia ada 3 senyawa, yaitu :
1. Identifikasi Terpenoid
Ekstrak dimasukkan ke dalam tabung reaksi kemudian ditambahkan asam
asetat glasial sampai sampel terendam semuanya, dibiarkan selama kira-kira 15
menit, ekstrak ditambahkan 2-3 tetes H2SO4. Adanya triterpenoid ditunjukkan
dengan terjadinya perubahan warna menjadi kecoklatan, sedangkan steroid
ditunjukkan dengan adanya warna biru kehijauan.
2. Identifikasi Saponin
Larutan uji sebanyak 10 mL dikocok vertikal di dalam tabung reaksi selama
10 detik, kemudian dibiarkan selama 10 detik. Saponin ditunjukkan dengan
terbentuknya buih busa setinggi 1-10 cm yang stabil selama tidak kurang dari 1
menit. Pada penambahan 1 tetes HCl 2N busa tidak hilang (Depkes RI, 1995).
3. Identifikasi Tanin
Pertama ditambahkan 100 ml air panas, lalu dimasukkan ekstrak dan
dididihkan selama 5 menit, lalu larutan uji tersebut 1 mL direaksikan dengan
larutan besi (III) klorida 10%, jika terjadi warna biru tua atau hitam kehijauan
menunjukkan adanya tanin (Robinson, 1991).
3.3.5.2. Derajat Keasaman (pH)
Pengukuran dilakukan dengan menggunakan pH meter. Sebelum pengukuran,
dicelupkan ke masing-masing sampel perlakuan (A&B), kontrol beserta
ulangannya. Lalu, dicatat di lembar pengamatan.
3.3.5.3. Analisis Amonia (NH3)
Kadar NH3 dilakukan dengan metode Microdifusi Conway. Kadar NH3 diukur
untuk mengetahui adanya degradasi protein yang berasal dari pakan. Cawan
Conway bagian tengahnya diisi dengan 1 ml indikator Conway. Lalu ditambahkan
1 ml K2CO3 jenuh pada sekat bagian kiri dan dimasukkan pula 1 ml sampel cairan
rumen pada sekat bagian kanan. Sampel yang digunakan adalah sampel jam ke-0
dan sampel yang diinkubasi dalam waterbath selama 24 jam. Bagian tepi Conway
diberi vaselin lalu ditutup rapat. Setelah itu, Conway digoyangkan secara perlahan
hingga sampel bercampur dengan K2CO3. Kemudian dibiarkan selama 2 jam pada
suhu ruang hingga larutan pada cawan kecil di bagian tengah Conway berubah
menjadi kebiruan. Indikator Conway diukur dengan spektrofotometer panjang
gelombang 700 nm. Konsentrasi NH3 dihitung dengan persamaan:
y = a + bx
3.3.5.4. Pengukuran Kandungan Volatile Fatty Acids (VFA)
Pengukuran Kandungan Volatile Fatty Acids (VFA) Total menggunakan
metode General Laboratory Procedures (1996). Sampel (filtrat) hasil fermentasi
sebanyak 1 mL dimasukkan ke dalam tabung eppendorf ditambahkan dengan 30
mg asam sulfo-5-salisilat dihidrat dan dihomogenkan. Tabung eppendorf
disentrifus pada kecepatan 12000 rpm selama 10 menit pada suhu 7oC. Sampel kemudian diinjeksikan ke dalam GC. Konsentrasi VFA parsial dihitung dengan :
VFA (mM) =
Keterangan : VFA = Volatile fatty acids (asetat, propionat, butirat) BM = Berat molekul VFA parsial
3.3.5.5 Pengukuran Degradasi Bahan Organik (DBO)
Bahan organik adalah selisih bahan kering dan abu yang secara kasar
merupakan kandungan karbohidrat, lemak dan protein (Association of Official
Analytical Chemistry, 2005). Serai wangi tiap sampel hasil inkubasi dalam syringe
glass disaring dengan filtering crusible sambil dibilas air panas, lalu aseton 1 ml.
Filtering crusible yang berisi limbah yang tidak tersaring kemudian dipanaskan ke
dalam oven 105oC selama 24 jam. Filtering crusible dimasukkan ke tanur 600oC
selama 3 jam untuk memperoleh berat bahan organik tidak terdegradasi. Rumus
degradasi bahan organik adalah sebagai berikut :
% DBO = (Berat sampel) x (% bahan organik) – Berat residu sampel x 100% (Berat sampel) x (% Bahan organik)
3.3.5.6 Pengukuran Degradasi Neutral Detergen Fiber (DNDF)
Pengukuran dengan menggunakan metode Krishnamoorthy (2001) dan
AOAC (2005) yang dimodifikasi. Kandungan NDF dapat ditentukan dengan cara
sampel hasil inkubasi ditimbang sebanyak 0,2 g (a) ke beaker glass ukuran 500
ml. Setelah itu, larutan Neutral Detergent Soluble (NDS) 40 ml ditambahkan ke
dalamnya. Bahan- bahan tersebut dipanaskan sampai mendidih selama satu jam,
lalu disaring dengan kertas saring yang sebelumnya telah diketahui bobotnya (b)
dengan bantuan pompa vakum. Residu hasil penyaringan dibilas air panas dan
ditambah dengan aseton ± 30 ml. Hasil saringan tersebut dimasukkan ke oven
bersuhu 105ºC selama 24 jam, kemudian diletakkan di desikator dan ditimbang
(c). Kandungan NDF dihitung dengan rumus:
%NDF=
a b c
Nilai DNDF dihitung dengan rumus: DNDF (%) = ) ( ) ( ) ( BKxAxNDF BKxBxNDF BKxAxNDF x 100% Keterangan: DNDF (%) : degradasi NDF
BK (%) : kandungan bahan kering
A : berat sampel sebelum inkubasi
B : berat sampel setelah inkubasi
3.3.5.7. Analisis Populasi Mikroorganisme Cairan Rumen
Hasil pengujian in vitro terjadi dalam 2 tahapan, yaitu isolasi DNA dan
pengukuran populasi mikroorganisme dengan Real Time-PCR. Hasil ini untuk
menganalisis populasi mikroorganisme pada cairan rumen domba. Sebelumnya,
mikrotub diberi label perlakuan kontrol, ekstrak heksana dan ekstrak butanol.
Langkah pertama isolasi DNA yaitu sampel cairan rumen seluruh perlakuan dan
kontrol dimasukkan ke dalam mikrotub steril sebanyak 1 ml. Sampel DNA
tersebut akan digunakan untuk isolasi DNA bakteri Gram positif dan negatif.
Isolasi bakteri Gram positif dimulai dari sentrifugasi seluruh sampel DNA
dengan kecepatan 10.000 rpm selama 10 menit pada suhu 4ºC kemudian
dipindahkan peletnya ke dalam collection tube. Pelet yang telah dipindahkan ke
mikrotube kemudian disuspensi dengan 180 µl larutan Lysozyme (LL), lalu
divortex agar homogen. Sampel diinkubasi selama 30 menit pada dry bath dengan
suhu 37ºC. Setelah diinkubasi, sampel ditambahkan 20 µl Proteinase K dan
divortex. Setelah homogen, sampel diberi 200 µl PureLink Genomic Lysis binding
buffer dan sampel kembali divortex. Sampel yang telah homogen diinkubasi
kembali pada suhu 55ºC selama 30 menit. Setelah inkubasi, sampel diberi 200 µl
Sampel bakteri Gram negatif yang telah didapatkan peletnya dari hasil
sentrifugasi 10.000 rpm selama 10 menit pada suhu 4ºC diberi 180 µl PureLink
Genomic Digestion Buffer. Kemudian, sampel diresuspensi dengan 20 µl
Proteinase K, lalu divortex hingga homogen. Sampel yang telah homogen lalu
diinkubasi selama 60 menit pada suhu 55ºC. Sampel yang telah diinkubasi diberi
20 µl Rnase A dan divortex hingga homogen. Sampel yang telah homogen
kemudian diinkubasi selama 2 menit pada suhu ruang. Kemudian sampel
ditambahkan 200 µl PureLink Genomic Lysis/ binding buffer dan divortex
kembali. Sampel yang telah divortex diberikan 200 µl 90 - 100% etanol dan
divortex lagi.
Setelah mendapatkan sampel bakteri Gram positif dan negatif, selanjutnya
dilakukan purifikasi. Yaitu dengan memindahkan sampel bakteri Gram positif dan
negative ke dalam PureLink Spin Column, kemudian disentrifugasi dengan
kecepatan 10.000 xg selama 1 menit. Collection tube dibuang dan diganti dengan
yang baru untuk dipasangkan pada spin column. Spin colum tersebut ditambahkan
500 µl Wash Buffer 1, kemudian disentrifugasi dengan kecepatan 10.000 x g
selama 1 menit pada suhu ruang.
Setelah disentrifugasi, collection tube diganti dengan yang baru, lalu
ditambahkan 500 µl Wash Buffer 2 ke dalam spin column tersebut. Kemudian
sampel disentrifugasi kembali dengan kecepatan maksimal selama 3 menit dengan
suhu kamar. Collection tube hasil sentrifugasi dibuang, sedangkan spin column
dipasangkan dengan tabung mikrosentrifuge steril 1.5 ml. Setelah itu,
ditambahkan 25 – 200 µl PureLink Genomic Elution Buffer dan diinkubasi pada
kecepatan maksimum selama 1 menit pada suhu ruang. Supernatan yang terbentuk
pada mikrosentrifuge tersebut adalah mengandung DNA.
Sebelum dilakukan RT-PCR, terlebih dahulu dibuat larutan mix PCR yang
terdiri dari 175 µl CyberGreen, 0.4 µl primer (Tabel 2), dan 3.6 µl akuades.
Larutan mix PCR tersebut diambil sebanyak 9 µl dan dicampur dengan sampel
DNA sebanyak 2 µl. Larutan yang dicampur kemudian di spin-down lalu
dimasukkan ke Thermal cycler RT-PCR. Setelah itu diatur siklus RT-PCR
tersebut (Lampiran 1). Berikut primer PCR bakteri protozoa yang digunakan:
Tabel 5. Primer PCR Bakteri dan Protozoa
Mikroorganisme Sekuens 5’-3’ Pustaka
Total Bakteri F1 CGGCAACGAGCGCAACCC (Koike & Kobayashi 2001) Total Bakteri R2 CCATTGTAGCACGTGTGTAGCC (Liu et. al. 2012) Butyrivibrio fibrisolvens F1 TAACATGAGTTTGATCCTGGCTC
Butyrivibrio fibrisolvens F2 CGTTACTCACCCGTCCGC
Total Metanogen F1 TTCGGTGGATCDCARAGRGC (Zhang et. al. 2008) Total Metanogen R2 GBARGTCGWAWCCGTAGAATCC
Total Protozoa F1 ACCGCATAAGCGCACGGA
Total Protozoa R2 CGGGTCCATCTTGTACCGATAAAT (Sylvester et. al. 2004) Keterangan: F1= forward, R2= reverse
Setelah kurang lebih 60 menit, hasil quantification cycle DNA bisa dilihat di
komputer yang terhubung pada thermal cycler. Data yang didapat disajikan dalam
bentuk tabel dengan kode perlakuan yang sesuai dengan label microtube. Setelah
itu, hasil dikelompokkan berdasarkan perlakuan sampel dan dibuat grafik fungsi
untuk mendapat persamaan (y). Setelah didapat grafik fungsi (R2=1), lalu hasil
quantification cycle (Cq) sebagai nilai x dimasukkkan dalam rumus yang ada pada
persamaan (y) yang ada pada grafik fungsi (lampiran 3f) untuk mendapatkan
jumlah total bakteri, populasi Butyrivibrio fibrisolvent, bakteri metanogen dan
3.3.5.8. Pengukuran Produksi Total Gas dan Nilai Gas CH4
Pengukuran produksi total gas dilakukan pada jam ke-0 dan 24 dengan
membaca skala yang tertera pada syringe. Jika posisi piston telah melebihi 60 ml
maka nilai yang tertera pada skala syringe glass dicatat dilembar pengamatan,
kemudian posisi piston dikembalikan ke posisi 40 ml. Pembacaan nilai dilakukan
dengan cepat untuk meminimalisir perubahan suhu. Perhitungan produksi gas total
(Krishnamoorthy, 2001) menggunakan rumus:
Keterangan: PG = Produksi gas
Pengukuran konsentrasi pada gas CH4 dan CO2 dilakukan menggunakan
MRU gas Analyzer®. Pengukuran konsentrasi gas CH4 dan CO2 dilakukan
terhadap hasil inkubasi pada jam ke 24 dan 48. Angka yang terbaca pada MRU
gas Analyzer® adalah persentase gas yang tertampung di dalam syringe. 3.6. Analisis Data
Data yang telah diperoleh berupa pH, amonia, DBO, DNDF, produksi total
gas dan produksi CH4 dianalisis dengan menggunakan Statistical Package for the
Social Science (SPSS) 20. Tiap data dianalisis dengan uji analisis variansi
(ANOVA) satu arah pada batas kepercayaan 95% (α = 0,05). Apabila hasil
terdapat perbedaan nyata pada tiap parameter, maka dilanjutkan dengan uji
Duncan. Pengambilan keputusan pada penelitian ini dengan menguji H0 dan H1,
dengan hipotesa sebagai berikut:
H0 = Suplementasi ekstrak limbah daun serai wangi tidak berpengaruh terhadap
produk fermentasi dan emisi gas CH4 pada cairan rumen domba.
H1 = Suplementasi ekstrak limbah daun serai wangi berpengaruh terhadap
produk fermentasi dan emisi gas CH4 pada cairan rumen domba.