MIKOBIOTA PADA BUAH CABAI: PENGARUHNYA
TERHADAP Colletotrichum capsici, CENDAWAN PENYEBAB
ANTRAKNOSA
MELLY FITRIANI
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
BOGOR 2014
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Mikobiota pada Buah Cabai: Pengaruhnya terhadap Colletotrichum capsici, Cendawan Penyebab Antraknosa adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juli 2014 Melly Fitriani NIM G34100048
ABSTRAK
MELLY FITRIANI. Mikobiota pada Buah Cabai: Pengaruhnya terhadap Colletotrichum capsici, Cendawan Penyebab Antraknosa. Dibimbing oleh OKKY SETYAWATI DHARMAPUTRA dan LISDAR I SUDIRMAN.
Colletotrichum capsici merupakan cendawan patogen penyebab antraknosa pada berbagai buah tropis, terutama pada buah cabai. Penggunaan agens kontrol biologi merupakan alternatif pengendalian penyakit pascapanen pada produk hortikultura. Penelitian ini bertujuan untuk menguji potensi antagonistik mikobiota pada buah cabai terhadap C. capsici. Cendawan patogen dan cendawan uji diisolasi dari buah cabai merah besar var. Imperial-308 dan Hibrida F1 Maraton yang diperoleh dari 3 pasar tradisional di Kotamadya Bogor. Isolasi C. capsici menghasilkan 4 isolat. Colletotrichum capsici CPB I.1 memiliki patogenisitas tertinggi pada buah cabai merah besar var. IPB Perbani. Isolasi cendawan uji dilakukan dengan menggunakan metode pengenceran serial yang dilanjutkan dengan metode cawan tuang menghasilkan 14 isolat, terdiri atas 7 isolat cendawan berfilamen dan 7 isolat khamir. Uji antagonisme dilakukan dengan menggunakan metode oposisi langsung pada media Potato Dextrose Agar (PDA) menghasilkan 4 isolat cendawan antagonis yang menyebabkan persentase hambatan pertumbuhan lebih dari 70% terhadap C. capsici CPB I.1, yaitu 3 isolat cendawan berfilamen (Plectosphaerella cucumerina, isolat MF 2, dan Aspergillus flavus) dan 1 isolat khamir (Issatchenkia orientalis). Dua cendawan antagonis (P. cucumerina dan I. orientalis) tidak menyebabkan penyakit pada buah cabai var. IPB Perbani, sehingga berpotensi sebagai agens kontrol biologi.
Kata kunci: antraknosa, buah cabai, Colletotrichum capsici, mikobiota
ABSTRACT
MELLY FITRIANI. Mycobiota on Chilli Fruits: Their Effect on Colletotrichum capsici, causing Anthracnose. Supervised by OKKY SETYAWATI DHARMAPUTRA and LISDAR I SUDIRMAN.
Colletotrichum capsici is a pathogenic fungus causing anthracnose on various tropical fruits, especially chilli fruit. Biological control agents have been used as an alternative to control postharvest diseases. This study aims to examine the antagonistic potential of mycobiota on chilli fruit against C. capsici. Pathogenic fungus and test fungi were isolated from red chilli fruits var. Imperial-308 and Hibrida F1 Maraton collected from 3 traditional markets in Municipality of Bogor. Four isolates of C. capsici were obtained from red chilli fruits infected by anthracnose. Colletotrichum capsici CPB I.1 showed the highest pathogenicity on red chilli fruits var. IPB Perbani. Fourteen isolates of test fungi were obtained from healthy red chilli fruits using serial dilution method, followed by pour plate method. They consisted of 7 filamentous fungi and 7 yeast isolates. Test of antagonism using direct opposition method on PDA obtained 4 antagonist fungal isolates which inhibited the growth of C. capsici CPB I.1 more than 70%. They consisted of 3 filamentous fungi (Plectosphaerella cucumerina, isolate MF 2, and Aspergillus flavus) and 1 yeast (Issatchenkia orientalis). Two isolates of antagonist fungi (P. cucumerina and I. orientalis) did not cause any diseases of chilli fruits var. IPB Perbani, consequently they can be used as biocontrol agents. Keywords: anthracnose, chilli fruit, Colletotrichum capsici, mycobiota
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biologi
MIKOBIOTA PADA BUAH CABAI: PENGARUHNYA
TERHADAP Colletotrichum capsici, CENDAWAN PENYEBAB
ANTRAKNOSA
MELLY FITRIANI
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
BOGOR 2014
Judul Skripsi : Mikobiota pada Buah Cabai: Pengaruhnya terhadap Colletotrichum capsici, Cendawan Penyebab Antraknosa
Nama : Melly Fitriani NIM : G34100048
Disetujui oleh
Prof Dr Okky Setyawati Dharmaputra Pembimbing I
Dr Ir Lisdar I Sudirman Pembimbing II
Diketahui oleh
Dr Ir Iman Rusmana, MSi Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga penulis dapat menyelesaikan karya ilmiah dengan judul “Mikobiota pada Buah Cabai: Pengaruhnya terhadap Colletotrichum capsici, Cendawan Penyebab Antraknosa”. Penelitian ini dilaksanakan dari bulan Januari sampai dengan Mei 2014 di Laboratorium Fitopatologi SEAMEO BIOTROP, Bogor.
Penulis mengucapkan terima kasih kepada Ibu Prof Dr Okky Setyawati Dharmaputra dan Ibu Dr Ir Lisdar I Sudirman selaku pembimbing dan Ibu Dr Ir Utut Widyastuti, MSi selaku dosen penguji yang telah memberi arahan dan masukan dalam penulisan karya ilmiah ini. Penulis juga mengucapkan terima kasih kepada Direktur SEAMEO BIOTROP atas izin penggunaan sarana dan fasilitas laboratorium, kepada Ibu Ir Ina Retnowati yang telah banyak membantu dan memberikan saran, Bapak Edi Suryadi dan Kak Nijma yang telah membantu selama penelitian, dan terima kasih kepada BIDIK MISI yang telah membantu sebagian dana penelitian, serta kepada Ibu Atit Kanthi, MSc yang telah mengidentifikasi isolat cendawan dan khamir secara molekuler. Ungkapan terima kasih juga penulis sampaikan kepada kedua orang tua dan seluruh keluarga, serta teman-teman Biologi 47 atas segala doa, dukungan, dan bantuan selama melaksanakan penelitian dan penyusunan karya ilmiah ini.
Semoga karya ilmiah ini bermanfaat.
Bogor, Juli 2014 Melly Fitriani
DAFTAR ISI
DAFTAR TABEL vi DAFTAR GAMBAR vi DAFTAR LAMPIRAN vi PENDAHULUAN 1 Latar Belakang 1 Tujuan Penelitian 2 METODE 2 Pengambilan Sampel 2Isolasi dan Identifikasi Cendawan Penyebab Antraknosa 2
Uji Patogenisitas Isolat-Isolat C. capsici 3
Isolasi Cendawan Uji 3
Uji Antagonisme antara Cendawan Uji dengan C. capsici 4 Uji Patogenisitas Cendawan Uji yang Bersifat Antagonistik terhadap
C. capsici pada Buah Cabai 5
Identifikasi Cendawan Antagonis yang Berpotensi sebagai Agens Kontrol
Biologi 5
Prosedur Analisis Data 5
HASIL DAN PEMBAHASAN 5
Cendawan Penyebab Antraknosa 5
Patogenisitas C. capsici 6
Cendawan selain C. capsici pada Buah Cabai dan Hasil Uji Antagonismenya
dengan C. capsici 7
Patogenisitas Cendawan Antagonis yang Potensial pada Buah Cabai 11
SIMPULAN DAN SARAN 13
Simpulan 13
Saran 13
DAFTAR PUSTAKA 14
LAMPIRAN 17
DAFTAR TABEL
1 Persentase keberadaan Colletotrichum spp. pada buah cabai merah besar dari 3 pasar tradisional di Kotamadya Bogor 6 2 Hasil uji patogenisitas 4 isolat Colletotrichum capsici terhadap buah
cabai merah besar 7
3 Persentase hambatan pertumbuhan Colletotrichum capsici CPB I.1 oleh isolat cendawan uji, jarak zona hambatan, dan tipe interaksi setelah 7 hari inkubasi pada suhu ruang (28±2 oC) 10 4 Hasil uji patogenisitas 4 isolat cendawan antagonis pada buah cabai
merah besar 11
DAFTAR GAMBAR
1 Skema uji antagonisme antara cendawan uji dengan Colletotrichum capsici; A = C. capsici dan B = cendawan uji; j1 = jari-jari koloni C.
capsici yang tumbuh ke arah berlawanan dengan tempat cendawan uji; j2 = jari-jari koloni C. capsici yang tumbuh ke arah cendawan uji
(mm) 4
2 Cabai merah besar varietas IPB Perbani yang terserang antraknosa (a), biakan murni Colletotrichum capsici CPB I.1 pada media Potato Dextrose Agar setelah 7 hari inkubasi pada suhu ruang (28±2 oC) (b), foto mikrograf C. capsici CPB I.1 (200x) (c); dan foto mikrograf
konidium C. capsici CPB I.1 (1000x) (d) 6
3 Hasil uji antagonisme antara Colletotrichum capsici CPB I.1 dengan Plectosphaerella cucumerina (tipe interaksi E) (1), Aspergillus flavus (tipe interaksi E) (2), Issatchenkia orientalis (tipe interaksi E) (3), isolat MF 2 (tipe interaksi B) (4), dan kontrol pada media Potato Dextrose Agar setelah 7 hari inkubasi pada suhu ruang (28±2 oC) (5);
a = C. capsici; b = cendawan uji 9
4 Uji patogenisitas isolat cendawan antagonis dan dan gejala penyakit ( ) pada buah cabai merah besar varietas IPB Perbani 12 5 Biakan murni Plectosphaerella cucumerina pada media Potato
Dextrose Agar (PDA) setelah inkubasi 7 hari pada suhu ruang (28±2
o
C) (a), dan foto mikrograf P. cucumerina (1000x) (b) 12 6 Biakan murni Issatchenkia orientalis pada media Potato Dextrose
Agar (PDA) setelah inkubasi 7 hari pada suhu ruang (28±2 oC) (a),
dan foto mikrograf I. orientalis (1000x) (b) 13
DAFTAR LAMPIRAN
1 Bagan tahapan strategi pengendalian hayati terhadap patogen menunjukkan peranannya dalam penelitian ( ) dan perdagangan
( ) (Korsten et al. 1993) 17
2 Deskripsi varietas cabai merah besar 18
3 Komposisi media untuk isolasi dan identifikasi cendawan (Pitt dan
4 Kode isolat Colletotrichum capsici, tanggal isolasi, lokasi pengambilan, dan varietas buah cabai merah besar 20 5 Analisis ragam pengaruh isolat Colletotrichum capsici terhadap luas
permukaan gejala antraknosa 20
6 Analisis ragam pengaruh isolat cendawan uji terhadap persentase
hambatan Colletotrichum capsici CPB I.1*) 20
7 Analisis ragam pengaruh isolat cendawan uji terhadap persentase
hambatan Colletotrichum capsici CPB I.1*) 20
8 Analisis ragam pengaruh isolat cendawan uji terhadap persentase
hambatan Colletotrichum capsici CPB I.1*) 21
9 Tipe interaksi antar cendawan (Wheeler dan Hocking 1993 yang
PENDAHULUAN
Latar BelakangCabai (Capsicum annum) merupakan salah satu komoditas hortikultura yang memiliki nilai ekonomi tinggi, sehingga dapat meningkatkan pendapatan petani Indonesia. Menurut BPS (2013) produksi cabai merah besar pada tahun 2012 sebesar 1 656 615 ton. Produksi cabai merah besar tertinggi berada di pulau Jawa sebesar 881 058 ton. Susut pascapanen pada buah cabai merupakan salah satu masalah utama pada produksi cabai di Indonesia, sehingga dapat menyebabkan kerugian yang cukup besar bagi petani. Ippolito dan Nigro (2000) menyatakan, bahwa besarnya susut pascapanen buah-buahan dan sayuran segar di negara kurang berkembang mencapai hampir 50%. Sebagian besar penyebabnya adalah serangan cendawan patogen.
Salah satu penyakit akibat serangan cendawan patogen pada buah cabai adalah antraknosa, disebabkan oleh Colletotrichum spp. Pembusukkan akibat antraknosa pada buah cabai akan terjadi pada saat buah matang, sehingga menyebabkan penurunan produksi dan kualitas buah cabai. Rata-rata kehilangan hasil cabai akibat serangan antraknosa lebih tinggi pada musim hujan dibandingkan dengan musim kemarau. Kehilangan hasil cabai akibat serangan antraknosa pada musim hujan di Kabupaten Magelang mencapai 54%, sedangkan di Kabupaten Rembang dan Kabupaten Brebes mencapai 20–25% (Mariyono dan Bhattarai 2009). Terdapat 3 spesies Colletotrichum yang telah diidentifikasi dapat menyebabkan antraknosa pada buah cabai, yaitu C. capsici, C. gloeosporioides dan C. acutatum. Morfologi ketiga spesies Colletotrichum berbeda, baik dari ukuran, bentuk konidium dan apresorium, maupun warna koloni pada media Potato Dextrose Agar (PDA) (Than et al. 2008a). Syukur et al. (2007) melaporkan bahwa spesies Colletotrichum yang paling banyak dijumpai menyerang buah cabai di Indonesia adalah C. acutatum. Selain Colletotrichum, patogen yang dapat menyerang buah cabai adalah Phytophthora capsici, Aspergillus flavus, Fusarium proliferatum, Xanthomonas campestris, dan Erwinia carotovora (Duriat et al. 2007; Rampersad dan Teelucksingh 2011; Sudha 2013).
Pengendalian penyakit pascapanen pada buah-buahan dan sayuran dapat dilakukan dengan 3 cara, yaitu pengendalian fisik, kimia, dan biologi. Pengendalian fisik berupa perlakuan suhu panas atau dingin dalam penanganan pascapanen buah-buahan dan sayuran lebih mudah dilakukan, tetapi dapat menyebabkan penurunan mutu buah-buahan dan sayuran. Penggunaan fungisida sintetik, seperti tiabendazol (TBZ), imazalil, atau benomil hanya dapat digunakan dalam jumlah terbatas, karena dapat menimbulkan polusi lingkungan, berpengaruh terhadap kesehatan manusia, dan dapat menimbulkan resistensi patogen terhadap fungisida (Mari et al. 2014). Salah satu alternatif pengendalian penyakit pascapanen yaitu penggunaan agens kontrol biologi. Strategi umum pengendalian hayati adalah dengan menggunakan salah satu organisme hidup untuk mengendalikan organisme lain. Cendawan antagonis dapat digunakan sebagai agens kontrol biologi dengan syarat tidak memproduksi spora yang bersifat alergi atau toksin pada manusia (Chanchaichaovivat et al. 2007).
2
Penggunaan agens kontrol biologi terhadap cendawan penyebab antraknosa pada buah cabai dapat diperoleh dari mikroorganisme antagonis epifit alami yang ada pada buah. Menurut Korsten et al. (1993), strategi penelitian untuk memperoleh agens kontrol biologi dilakukan dengan penapisan epifit alami secara in vitro dan in vivo terhadap patogen pascapanen dengan kisaran yang luas. Pengujian penggunaan agens kontrol biologi dilakukan dengan mengevaluasi mekanisme antagonis, kemampuan bertahan, dan toksisitas dari mikroorganisme antagonis dalam pengaplikasian di lapangan atau pada skala komersial (Lampiran 1).
Beberapa cendawan antagonis telah dilaporkan dapat digunakan sebagai agens kontrol biologi terhadap antraknosa pada beberapa buah-buahan. Siregar et al. (2007) melaporkan bahwa bakteri Bacillus polymyxa dan cendawan Trichoderma harzianum dapat mengendalikan cendawan penyebab antraknosa pada tanaman cabai. Dengan adanya informasi tersebut, maka diharapkan adanya cendawan antagonis yang dapat memperkecil tingkat kehilangan (susut) hasil/kerusakan akibat serangan antraknosa dan meningkatkan daya simpan dan daya guna.
Tujuan Penelitian
Tujuan penelitian ini adalah menguji potensi antagonistik mikobiota pada buah cabai merah besar terhadap C. capsici.
METODE
Pengambilan SampelCabai merah besar yang terserang antraknosa dan cabai merah besar sehat diperoleh dari pasar tradisional di Kotamadya Bogor, yaitu cabai merah besar varietas Imperial-308 dari pasar Anyar dan cabai merah besar varietas Hibrida F1 Maraton dari pasar Bogor dan pasar Gembrong. Uji patogenisitas dilakukan pada cabai merah besar varietas IPB Perbani yang diperoleh dari kebun Leuwikopo, milik Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor. Deskripsi buah cabai merah besar varietas Imperial-308, Hibrida F1 Maraton, dan IPB Perbani dapat dilihat pada Lampiran 2.
Isolasi dan Identifikasi Cendawan Penyebab Antraknosa
Isolasi cendawan penyebab antraknosa pada buah cabai merah besar varietas Imperial-308 dan Hibrida F1 Maraton dilakukan dengan cara memotong jaringan kulit dan daging buah (5x5 mm) di antara bagian yang sakit dan sehat, kemudian bagian permukaannya didesinfeksi dengan etanol 70%, dibilas dengan akuades steril dan dikering-udarakan (Lim et al. 2002). Selanjutnya potongan jaringan kulit buah cabai merah besar diletakkan pada media Potato Dextrose Agar (PDA) yang mengandung 100 mg/L kloramfenikol di dalam 3 cawan Petri (diameter 9
3 cm) (3 potong jaringan buah per cawan). Komposisi media PDA dapat dilihat pada Lampiran 3. Cawan-cawan Petri diinkubasi pada suhu ruang (28±2 oC) selama 5 hari. Setiap koloni cendawan yang diduga C. capsici dimurnikan pada media PDA tanpa kloramfenikol. Biakan murni C. capsici dibuat preparat dengan menggunakan pewarna laktofenol biru katun untuk mengamati struktur aservulus dan konidium C. capsici di bawah mikroskop merek Olympus. Identifikasi C. capsici menggunakan pustaka acuan Sutton (1980), Barnett dan Hunter (1999).
Uji Patogenisitas Isolat-Isolat C. capsici
Buah cabai merah besar varietas IPB Perbani yang sehat dengan ukuran dan kematangan yang sama dibilas dengan air leding dan dibiarkan kering-udara, selanjutnya didesinfeksi dengan etanol 70%. Bagian pangkal dan tengah setiap buah, dibuat goresan vertikal dan horizontal masing-masing 1 cm menggunakan cutter. Di atas goresan tersebut ditempatkan inokulum berupa potongan biakan (diameter 8 mm) setiap isolat C. capsici yang berumur 7 hari pada PDA, kemudian ditutup dengan selotip. Sebagai kontrol, a) di atas goresan ditempatkan potongan media PDA (diameter 8 mm) tanpa isolat C. capsici dan b) buah cabai merah besar yang telah digores tanpa potongan media dan tanpa isolat C. capsici. Baik pada setiap perlakuan, maupun kontrol dibuat 6 ulangan (=6 buah cabai merah besar). Tiga buah cabai merah besar ditempatkan di dalam sebuah wadah plastik yang telah didesinfeksi dengan etanol 70%. Selain itu, kondisi di dalam wadah dibuat lembab. Untuk memperoleh kelembapan relatif 85% di dalam wadah, kapas steril (5 g) yang telah dibasahi dengan akuades steril (15 mL) ditempatkan di dalam setiap wadah. Selanjutnya semua wadah diinkubasi pada suhu ruang (28±2 oC) selama 7 hari. Pengamatan patogenisitas dilakukan terhadap luas permukaan cabai merah yang terserang oleh setiap isolat C. capsici dengan metode gravimetri, yaitu menimbang jiplakan luas permukaan gejala pada plastik tebal, kemudian membandingkan berat jiplakan tersebut dengan berat plastik yang telah diketahui luasnya (mm2) (Sudirman LI 7 Mei 2014, komunikasi pribadi). Isolat yang menyebabkan gejala dengan luas permukaan paling besar dianggap isolat yang mempunyai patogenisitas paling tinggi.
Isolasi Cendawan Uji
Isolasi cendawan selain C. capsici pada buah cabai merah besar sehat varietas Imperial-308 dan Hibrida F1 Maraton dilakukan dengan menggunakan metode pengenceran serial yang dilanjutkan dengan metode cawan tuang pada media PDA. Sebanyak 100 g kulit dan daging buah cabai merah besar ditempatkan di dalam blender merek Miyako, kemudian ditambah akuades steril hingga mencapai volume 500 mL, selanjutnya digiling selama 1 menit, sehingga diperoleh suspensi dengan pengenceran 1:5. Dari pengenceran ini, 50 mL suspensi ditempatkan ke dalam labu Erlenmeyer (volume 250 mL) dan ditambahkan akuades steril sebanyak 50 mL sehingga diperoleh pengenceran 1:10. Selanjutnya dengan cara yang sama, dibuat pengenceran 1:20; 1:100; dan 1:1000. Sebanyak 1 mL suspensi dari setiap pengenceran diambil dengan pipet dan ditempatkan di
4
dalam cawan Petri (diameter 9 cm), kemudian ditambahkan 12±1 mL media PDA (40±2 oC) yang mengandung kloramfenikol (100 mg/L). Setiap pengenceran dibuat 3 ulangan (=3 cawan Petri). Cawan-cawan Petri diinkubasi pada suhu ruang (28±2 oC) selama 7 hari. Pengamatan dilakukan terhadap koloni cendawan yang berbeda warna dan pola pertumbuhannya dari pengenceran yang memberikan koloni cendawan terpisah. Setiap koloni cendawan tersebut yang selanjutnya disebut setiap isolat cendawan uji dipindahkan pada media PDA tanpa kloramfenikol. Setiap isolat cendawan diuji sifat antagonistiknya terhadap C. capsici yang patogenisitasnya terhadap buah cabai merah besar varietas IPB Perbani paling tinggi.
Uji Antagonisme antara Cendawan Uji dengan C. capsici
Setiap isolat cendawan selain C. capsici yang diisolasi dari kulit dan daging buah cabai merah besar yang sehat diuji sifat antagonistiknya terhadap C. capsici yang patogenisitasnya paling tinggi dengan menggunakan metode oposisi langsung (Dennis dan Webster 1971). Colletotrichum capsici ditumbuhkan secara berpasangan dengan setiap isolat cendawan uji di tengah media PDA di dalam cawan Petri (diameter 9 cm) dengan jarak 3 cm (Gambar 1).
Colletotrichum capsici ditumbuhkan pada 3 waktu yang berbeda, yaitu ditumbuhkan a) pada waktu yang sama dengan inokulasi cendawan uji (cendawan berfilamen dan khamir); b) 3 hari setelah inokulasi cendawan uji (cendawan berfilamen); dan c) 7 hari setelah inokulasi cendawan uji (khamir). Inokulum setiap isolat cendawan terdiri atas potongan biakan pada media PDA berdiameter 4 mm. Setiap perlakuan dibuat 3 ulangan. Semua cawan Petri diinkubasi pada suhu ruang (28±2 oC) selama 7 hari. Persentase hambatan pertumbuhan isolat C. capsici yang patogenisitasnya paling tinggi oleh cendawan uji dihitung berdasarkan Fokkema (1973):
Hambatan pertumbuhan (%) = – x 100
Cendawan uji yang menyebabkan persentase hambatan pertumbuhan C. capsici lebih dari 70% dianggap sebagai cendawan antagonis. Pengamatan mekanisme antagonisme dilakukan secara makroskopis, yaitu dengan mengamati tipe interaksi antar cendawan (Wheeler dan Hocking 1993 yang dimodifikasi dari Magan dan Lacey 1984).
Gambar 1 Skema uji antagonisme antara cendawan uji dengan Colletotrichum capsici; A = C. capsici dan B = cendawan uji; j1 = jari-jari koloni C.
capsici yang tumbuh ke arah berlawanan dengan tempat cendawan uji; j2 = jari-jari koloni C. capsici yang tumbuh ke arah cendawan uji (mm)
5
Uji Patogenisitas Cendawan Uji yang Bersifat Antagonistik terhadap C.
capsici pada Buah Cabai
Uji patogenisitas isolat-isolat cendawan antagonis yang menyebabkan persentase hambatan pertumbuhan C. capsici lebih dari 70% dilakukan seperti uji patogenisitas isolat-isolat C. capsici pada buah cabai merah besar varietas IPB Perbani.
Identifikasi Cendawan Antagonis yang Berpotensi sebagai Agens Kontrol Biologi
Isolat-isolat cendawan antagonis yang berpotensi sebagai agens kontrol biologi dan tidak menyebabkan penyakit pada buah cabai diidentifikasi menggunakan pustaka Pitt dan Hocking (2009) dan diidentifikasi secara molekuler menggunakan pustaka Hamby et al. (2012). Biakan murni setiap cendawan antagonis dibuat preparat dengan menggunakan pewarna laktofenol biru katun untuk mengamati ciri khusus dari setiap cendawan antagonis di bawah mikroskop merek Olympus.
Prosedur Analisis Data
Uji patogenisitas isolat-isolat C. capsici pada buah cabai merah besar varietas IPB Perbani, uji antagonisme antara cendawan uji dengan C. capsici yang ditumbuhkan secara berpasangan pada 3 waktu yang berbeda, dan uji patogenisitas isolat-isolat cendawan antagonis terhadap buah cabai merah besar varietas IPB Perbani digunakan Rancangan Acak Lengkap (Mattjik dan Sumertajaya 2002). Semua analisis statistika dilakukan dengan menggunakan program SPSS versi 16.0. Jika hasil analisis ragam (ANOVA) memberikan perbedaan yang nyata, maka dilakukan uji lanjut menggunakan uji banding Duncan (DMRT).
HASIL DAN PEMBAHASAN
Cendawan Penyebab AntraknosaAntraknosa menjadi masalah utama pada produksi buah tropis, khususnya buah cabai merah besar yang menyebabkan kehilangan nilai ekonomi cukup besar pada buah. Antraknosa disebabkan oleh Colletotrichum spp., yaitu C. capsici, C. gloeosporiodes dan C. acutatum (Than et al. 2008a). Namun pada hasil penelitian ini, persentase keberadaan C. capsici pada buah cabai merah besar yang diperoleh dari 3 pasar tradisional di Kotamadya Bogor lebih dominan (63.89%) (Tabel 1). Selain menyerang buah cabai merah besar, C. capsici dilaporkan menyerang buah pepaya (Carica papaya), sirih (Piper betle) dan golongan legum, seperti kacang
6
tunggak (Vigna unguiculata) dan buncis (Phaseolus vulgaris) (Pring et al. 1995; Tarnowski dan Ploetz 2010).
Buah cabai merah besar yang terserang antraknosa menunjukkan gejala berupa timbulnya cekungan yang membesar pada permukaan buah. Pada bagian tengah cekungan terdapat kumpulan titik-titik hitam yang merupakan kelompok aservulus. Serangan C. capsici pada buah tidak bersifat toksik terhadap manusia dan hewan, tetapi kerusakan pada buah menjadi pertimbangan untuk kelayakan konsumsi manusia(Nayaka et al. 2009).
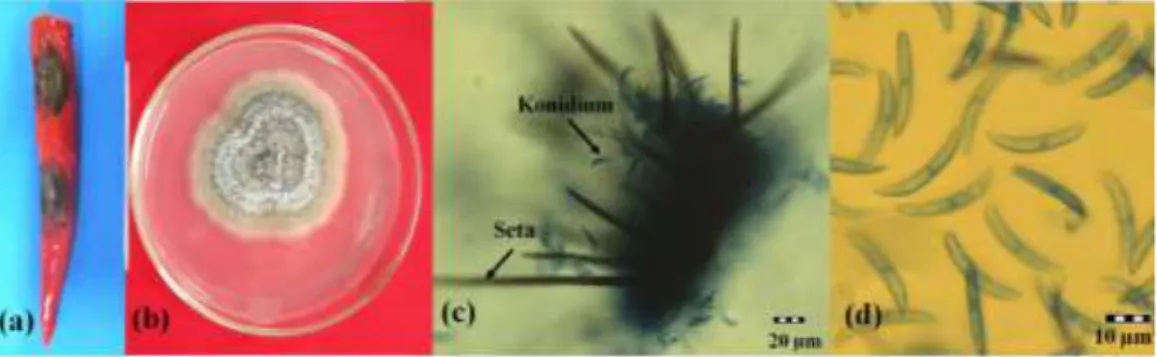
Koloni isolat C. capsici pada media PDA berwarna kelabu dengan miselium berwarna kelabu keputihan yang tumbuh secara bertahap. Konidium C. capsici berbentuk sabit tanpa sekat. Buah cabai merah besar yang terserang antraknosa, biakan murni, dan foto mikrograf C. capsici CPB I.1 dapat dilihat pada Gambar 2. Sebanyak 4 isolat telah diisolasi dari buah cabai merah besar yang terserang antraknosa varietas Imperial-308 dari pasar Anyar dan varietas Hibrida F1 Maraton dari pasar Bogor dan pasar Gembrong. Kode isolat C. capsici dibedakan berdasarkan lokasi dan waktu pengambilan buah cabai merah besar (Lampiran 4).
Patogenisitas C. capsici
Beberapa penyakit pascapanen pada buah tidak menunjukkan gejala sampai buah matang (Than et al. 2008b). Serangan C. capsici bersifat laten, terjadi pada Gambar 2 Cabai merah besar varietas IPB Perbani yang terserang antraknosa (a), biakan murni Colletotrichum capsici CPB I.1 pada media Potato Dextrose Agar setelah 7 hari inkubasi pada suhu ruang (28±2 oC) (b), foto mikrograf C. capsici CPB I.1 (200x) (c); dan foto mikrograf konidium C. capsici CPB I.1 (1000x) (d)
Tabel 1 Persentase keberadaan Colletotrichum spp. pada buah cabai merah besar dari 3 pasar tradisional di Kotamadya Bogor
Spesies Persentase keberadaan Colletotrichum spp. (%)
Colletotrichum capsici 63.89
C. gloeosporioides 35.56
C. acutatum 13.33
Persentase keberadaan Colletotrichum spp. berdasarkan jumlah koloni spesies Colletotrichum dari 9 potongan kulit dan daging buah cabai merah besar pada media PDA yang mengandung 100 mg/L kloramfenikol
7 beberapa tahap perkembangan pada buah dan pembusukkan akan tertunda sampai buah matang (Ippolito dan Nigro 2000). Colletotrichum capsici tetap membentuk apresorium selama fase quiescent dan saat buah matang terbentuk bintik-bintik cokelat kehitaman di perikarp dan busuk lunak dalam mesokarp. Hal tersebut dikarenakan terjadi peningkatan kandungan nutrisi dan penurunan kadar senyawa antifungi pada buah matang (Prusky 1996). Inisiasi serangan Colletotrichum spp. melibatkan beberapa proses, yaitu pelekatan konidium pada permukaan tanaman, perkecambahan konidium, produksi apresorium sebagai alat bantu penetrasi, penetrasi ke jaringan epidermis tanaman, tumbuh dan mengkolonisasi jaringan tanaman (Mendgen dan Hahn 2002). Jaringan buah yang membusuk akan membentuk aservulus dan menghasilkan konidium (Kim et al. 2004).
Hasil uji patogenisitas 4 isolat C. capsici terhadap buah cabai merah besar varietas IPB Perbani setelah inkubasi 7 hari pada suhu ruang (28±2 oC) menunjukkan perbedaan yang sangat nyata terhadap luas permukaan gejala antraknosa berdasarkan analisis ragam dengan taraf kepercayaan 99% (Lampiran 5). Isolat C. capsici yang menyebabkan luas permukaan gejala antraknosa tertinggi (294.00 mm2) pada buah cabai merah besar varietas IPB Perbani adalah isolat CPB I.1, diisolasi dari cabai merah yang diperoleh dari pasar Bogor dengan varietas Hibrida F1 Maraton (Tabel 2), sehingga isolat ini digunakan untuk uji antagonisme antara cendawan uji dengan C. capsici. Selain menggunakan metode gravimetri dalam pengukuran luas permukaan gejala antraknosa, dapat juga dilakukan dengan metode Hand Scanner yang dihubungkan dengan program Area II berdasarkan penghitungan jumlah pixel pada hasil scanner luas permukaan gejala (Caldas et al. 1992).
Cendawan selain C. capsici pada Buah Cabai dan Hasil Uji Antagonismenya dengan C. capsici
Mikroorganisme antagonis dapat digunakan sebagai agens kontrol biologi dalam menekan pertumbuhan patogen dengan syarat memiliki kemampuan beradaptasi terhadap kondisi lingkungan dengan nutrisi yang rendah, tidak menyebabkan patogen pada inang, tidak menghasilkan metabolit berbahaya, dan efektif melawan patogen yang memiliki kisaran inang yang cukup luas (Barkai-Golan 2001). Terdapat 2 pendekatan penggunaan mikroorganisme antagonis sebagai agens kontrol biologi pada penyakit pascapanen pada buah, yaitu menggunakan mikroorganisme antagonis yang berasal dari buah itu sendiri dan dapat menggunakan mikroorganisme dari buah lain untuk melawan patogen Tabel 2 Hasil uji patogenisitas 4 isolat Colletotrichum capsici terhadap buah
cabai merah besar
Kode isolat Luas permukaan gejala antraknosa pada buah cabai (mm2)
CPB I.1 294.00a
CPA II.2 156.71ab
CPG II.1 147.78ab
CPA I.2 15.43b
Angka-angka yang diikuti oleh huruf yang sama tidak berbeda nyata berdasarkan uji banding Duncan pada taraf kepercayaan 99%
8
(Sharma et al. 2009). Selain berasal dari buah, mikroorganisme antagonis dapat diisolasi dari permukaan daun, bunga dan sayuran(Beasley et al. 2001; Ekow dan Kobina 2012). Mikroorganisme antagonis dapat berupa bakteri saprob, khamir, dan cendawan berfilamen (Sharma et al. 2009).
Sebanyak 14 isolat cendawan uji telah diisolasi dari buah cabai merah besar yang sehat varietas Imperial-308 dari pasar Anyar dan varietas Hibrida F1 Maraton dari pasar Bogor dan pasar Gembrong, terdiri atas 7 isolat cendawan berfilamen dan 7 isolat khamir. Dari 7 isolat cendawan uji berfilamen, salah satunya adalah Aspergillus flavus. Pada uji antagonisme antara cendawan uji dengan C. capsici, cendawan patogen ditumbuhkan pada 3 waktu yang berbeda, karena setiap isolat, baik cendawan uji, maupun cendawan patogen memiliki kecepatan pertumbuhan berbeda (Johnson et al. 1960).
Berdasarkan analisis ragam diperoleh hasil, bahwa isolat cendawan uji menyebabkan perbedaan yang sangat nyata terhadap persentase hambatan pertumbuhan C. capsici CPB I.1, baik apabila cendawan patogen ditumbuhkan pada waktu yang sama dengan cendawan uji, maupun pada waktu yang berbeda (Lampiran 6, 7,dan 8). Persentase hambatan pertumbuhan C. capsici CPB I.1 yang ditumbuhkan pada waktu yang sama dengan cendawan uji (a), 3 hari setelah inokulasi cendawan uji (cendawan berfilamen) (b), dan 7 hari setelah inokulasi cendawan uji (khamir) (c) dapat dilihat pada Tabel 3.
Persentase hambatan pertumbuhan C. capsici CPB I.1 pada uji antagonisme yang ditumbuhkan pada waktu yang sama dengan cendawan uji kurang dari 50%, yaitu berkisar antara 14.00-47.33%. Cendawan uji yang menyebabkan persentase hambatan pertumbuhan C. capsici CPB I.1 tertinggi adalah isolat MF 2 sebesar 47.33%. Persentase hambatan pertumbuhan C. capsici CPB I.1 yang ditumbuhkan 3 hari setelah inokulasi cendawan uji (cendawan berfilamen) lebih tinggi dibandingkan ditumbuhkan bersama dengan cendawan uji, berkisar antara 48.33-76.67%. Persentase hambatan pertumbuhan C. capsici CPB I.1 lebih dari 70% disebabkan oleh Plectosphaerella cucumerina (72.50%), isolat MF 2 (76.67%) dan Aspergillus flavus (71.67%). Berdasarkan pengamatan visual setelah 7 hari inkubasi pada suhu ruang (28±2 oC), pertumbuhan P. cucumerina, isolat MF 2, dan A. flavus sangat cepat, sehingga ruang untuk tumbuh C. capsici CPB I.1 sangat terbatas. Selain itu, penghambatan pertumbuhan C. capsici CPB I.1 diduga karena terjadi persaingan dalam memperoleh nutrisi dengan isolat cendawan uji. Persentase hambatan pertumbuhan C. capsici CPB I.1 yang ditumbuhkan 7 hari setelah inokulasi cendawan uji (khamir) lebih tinggi daripada C. capsici CPB I.1 yang ditumbuhkan pada waktu yang sama dengan cendawan uji berkisar antara 38.00-77.33%. Isolat cendawan uji berupa khamir (Issatchenkia orientalis) menyebabkan persentase hambatan pertumbuhan C. capsici CPB I.1 lebih dari 70%, yaitu 77.33%. Berdasarkan pengamatan secara visual, koloni khamir dan C. capsici CPB I.1 saling kontak tanpa membentuk zona hambatan. Menurut Wisniewski dan Wilson (1992), khamir memiliki potensi yang cukup besar sebagai agens kontrol biologi dalam mengendalikan serangan penyakit pascapanen pada produk pertanian, karena mampu mengkolonisasi permukaan target dalam waktu yang lama meskipun dalam kondisi kering dan mampu menggunakan nutrisi dengan cepat, sehingga berkembang biak lebih cepat dan dapat menghambat perkecambahan spora dan pertumbuhan cendawan patogen.
9 Cendawan uji yang memiliki persentase hambatan lebih dari 70% dianggap sebagai cendawan antagonis.
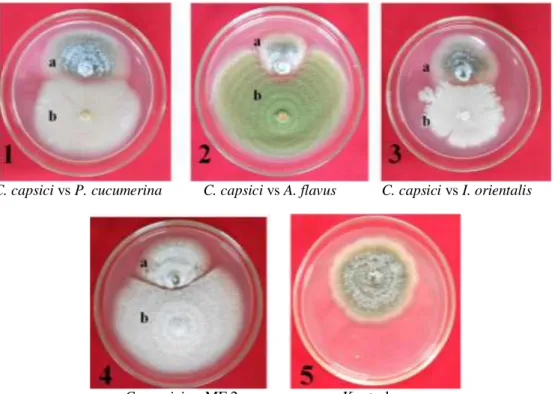
Interaksi antara cendawan uji dengan C. capsici pada PDA menghasilkan 2 tipe interaksi (Gambar 3), yaitu inhibisi mutual (tipe B) yang ditunjukkan terbentuknya zona hambatan kurang dari 2 mm dan inhibisi patogen (tipe E), cendawan patogen yang dihambat tidak mengalami pertumbuhan lagi, sedangkan cendawan uji tetap mengalami pertumbuhan (Wheeler dan Hocking 1993). Interaksi antara P. cucumerina dan A. flavus (cendawan berfilamen) dan I. orientalis (khamir) dengan C. capsici CPB I.1 menunjukkan tipe E, sedangkan interaksi antara isolat MF 2 (cendawan berfilamen) dengan C. capsici CPB I.1 menunjukkan tipe interaksi B. Tipe-tipe interaksi antar cendawan menurut Wheeler dan Hocking (1993) yang dimodifikasi dari Magan dan Lacey (1984) dapat dilihat pada Lampiran 9.
C. capsici vs P. cucumerina C. capsici vs A. flavus C. capsici vs I. orientalis
C. capsici vs MF 2 Kontrol
Gambar 3 Hasil uji antagonisme antara Colletotrichum capsici CPB I.1 dengan Plectosphaerella cucumerina (tipe interaksi E) (1), Aspergillus flavus (tipe interaksi E) (2), Issatchenkia orientalis (tipe interaksi E) (3), isolat MF 2 (tipe interaksi B) (4), dan kontrol pada media Potato Dextrose Agar setelah 7 hari inkubasi pada suhu ruang (28±2 oC) (5); a = C. capsici; b = cendawan uji
10
Tabel 3 Persentase hambatan pertumbuhan Colletotrichum capsici CPB I.1 oleh isolat cendawan uji, jarak zona hambatan, dan tipe interaksi setelah 7 hari inkubasi pada suhu ruang (28±2 oC)
No Isolat cendawan uji Lokasi pengambilan cabai
Hambatan pertumbuhan (%) Jarak zona hambatan (mm)
Tipe interaksi
a b c a b c a b c
1 Plectosphaerella cucumerina
Pasar Gembrong 32.00abc 72.50ab - 0 0 - E E
2 MF 2 Pasar Gembrong 47.33a 76.67a - 1 0 - B B -
3 MF 3 Pasar Gembrong 38.50ab 59.33bcd - 0 0 - E E -
4 MF 6 Pasar Gembrong 37.67ab 66.67abc - 0 0 - E B -
5 Aspergillus flavus Pasar Bogor 46.67a 71.67ab - 0 0 - E E -
6 MF 10 Pasar Bogor 37.67ab 53.67cd - 0 0 - B E -
7 MF 14 Pasar Bogor 27.67bcd 48.33d - 0 0 - B E -
8 MF 4 Pasar Gembrong 37.67ab - 63.00ab 0 - 0 E - E
9 MF 7 Pasar Gembrong 43.50a - 62.00ab 0 - 0 B - E
10 MF 8 Pasar Gembrong 14.00d - 38.00c 0 - 0 B - B
11 Issatchenkia orientalis
Pasar Bogor 45.33a - 77.33a 0 - 0 E - E
12 MF 12 Pasar Anyar 20.00cd - 38.50c 0 - 0 B - E
13 MF 13 Pasar Bogor 28.00bcd - 64.67ab 0 - 0 E - E
14 MF 15 Pasar Anyar 43.00ab - 57.33b 0 - 0 E - B
Angka-angka yang diikuti oleh huruf yang sama sama pada kolom yang sama tidak berbeda nyata berdasarkan uji banding Duncan pada tar af kepercayaan 99%; (a) : C.
capsici CPB I.1 ditumbuhkan pada waktu yang sama dengan cendawan uji (cendawan berfilamen dan khamir); (b) : C. capsici CPB I.1 ditumbuhkan 3 hari setelah
11 Patogenisitas Cendawan Antagonis yang Potensial pada Buah Cabai
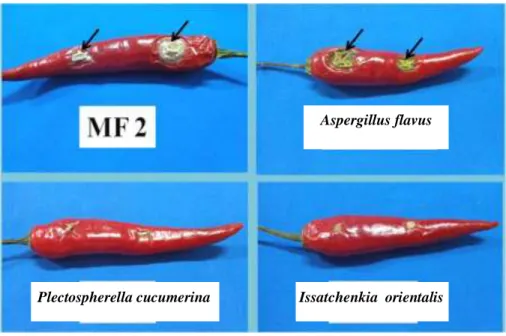
Cendawan antagonis yang digunakan sebagai agens kontrol biologi harus memiliki toleransi terhadap keadaan nutrisi yang rendah, suhu tinggi, radiasi sinar ultraviolet, dan kondisi kekeringan, serta tidak menyebabkan penyakit pada inang (Ippolito dan Nigro 2000). Hasil uji patogenisitas cendawan antagonis isolat MF 2, A. flavus, P. cucumerina, dan I. orientalis menunjukkan, bahwa isolat MF 2 dan A. flavus menyebabkan penyakit pada buah cabai merah besar varietas IPB Perbani. Gejala penyakit akibat isolat MF 2 ditunjukkan timbulnya cekungan pada permukaan buah yang ditutupi oleh miselium berwarna putih, sedangkan gejala penyakit akibat A. flavus ditunjukkan dengan timbulnya cekungan berwarna hijau yang merupakan kumpulan konidium A. flavus pada permukaan buah cabai merah besar (Gambar 4). Menurut Sudha et al. (2013) A. flavus merupakan cendawan patogen yang dapat menyerang buah cabai. Serangan A. flavus dapat terjadi selama dan setelah panen, juga selama penyimpanan. Dua isolat cendawan antagonis lainnya, yaitu P. cucumerina (cendawan berfilamen) dan I. orientalis (khamir) tidak menyebabkan penyakit pada buah cabai merah besar varietas IPB Perbani (Gambar 4), sehingga kedua isolat ini berpotensi sebagai agens kontrol biologi. Patogenisitas isolat cendawan antagonis dan luas permukaan gejala penyakit dapat dilihat pada Tabel 4.
Tabel 4 Hasil uji patogenisitas 4 isolat cendawan antagonis pada buah cabai merah besar Isolat cendawan antagonis dan kontrol Patogenisitas pada buah cabai Luas permukaan gejala penyakit (mm2) Isolat cendawan antagonis MF 2 + 308.34 Aspergillus flavus + 461.12 Plectosphaerella cucumerina - - Issatchenkia orientalis - - Kontrol C. capsici CPB I.1 + 294.00 K1 - - K2 - -
+ : menyebabkan penyakit pada buah cabai; - : tidak menyebabkan penyakit pada buah cabai; K1 :
kontrol 1 (media PDA tanpa isolat C. capsici); K2 : kontrol 2 (tanpa media PDA, tanpa isolat C.
12
Identifikasi dilakukan secara molekuler terhadap 2 isolat cendawan antagonis yang tidak menyebabkan penyakit pada buah cabai merah besar varietas IPB Perbani, yaitu P. cucumerina dan I. orientalis. Plectosphaerella cucumerina merupakan cendawan berfilamen yang menyebabkan persentase hambatan pertumbuhan C. capsici CPB I.1 sebesar 72.50%, sedangkan I. orientalis merupakan khamir yang mampu menyebabkan persentase hambatan pertumbuhan C. capsici CPB I.1 sebesar 77.33%. Menurut Atkins et al. (2003) P. cucumerina diketahui berpotensi sebagai agens kontrol biologi terhadap serangan nematoda. Biakan murni dan foto mikrograf P. cucumerina dan I. orientalis dapat dilihat pada Gambar 5 dan 6.
Gambar 5 Biakan murni Plectosphaerella cucumerina pada media Potato Dextrose Agar (PDA) setelah inkubasi 7 hari pada suhu ruang (28±2 oC) (a), dan foto mikrograf P. cucumerina (1000x) (b)
Gambar 4 Uji patogenisitas isolat cendawan antagonis dan gejala penyakit ( ) pada buah cabai merah besar varietas IPB Perbani
Aspergillus flavus
Issatchenkia orientalis Plectospherella cucumerina
13
SIMPULAN DAN SARAN
SimpulanEmpat isolat C. capsici telah diisolasi dari buah cabai merah besar varietas Imperial-308 yang diperoleh dari pasar Anyar dan cabai merah besar varietas Hibrida F1 Maraton yang diperoleh dari pasar Bogor dan pasar Gembrong. Colletotrichum capsici CPB I.1 merupakan isolat yang memiliki patogenisitas tertinggi pada buah cabai merah besar varietas IPB Perbani. Sebanyak 14 isolat cendawan uji diisolasi dari buah cabai merah besar yang sehat varietas Imperial-308 dari pasar Anyar dan cabai merah besar varietas Hibrida F1 Maraton dari pasar Bogor dan pasar Gembrong. Persentase hambatan pertumbuhan C. capsici CPB I.1 lebih tinggi apabila C. capsici CPB 1.1 ditumbuhkan 3 dan 7 hari setelah inokulasi cendawan uji pada media Potato Dextrose Agar. Empat isolat cendawan uji yang menyebabkan persentase hambatan pertumbuhan C. capsici CPB I.1 lebih dari 70%, yaitu 3 isolat cendawan berfilamen (Plectosphaerella cucumerina, isolat MF 2, dan Aspergillus flavus) dan 1 isolat khamir (Issatchenkia orientalis). Dua dari 4 isolat cendawan antagonis, yaitu P. cucumerina dan I. orientalis tidak menyebabkan penyakit pada buah cabai merah besar varietas IPB Perbani, sehingga 2 isolat tersebut berpotensi sebagai agens kontrol biologi.
Saran
Penelitian lanjutan perlu dilakukan untuk (1) meneliti mekanisme antagonisme antara Colletotrichum capsici dengan Plectosphaerella cucumerina dan Issatchenkia orientalis, (2) melakukan uji antagonisme antara cendawan antagonis yang diperoleh dengan berbagai cendawan patogen lain pada buah cabai dan (3) mendapatkan metode yang tepat dalam produksi massal cendawan antagonis, sehingga memudahkan dalam pelaksanaan penelitian yang mengarah Gambar 6 Biakan murni Issatchenkia orientalis pada media Potato Dextrose
Agar (PDA) setelah inkubasi 7 hari pada suhu ruang (28±2 oC) (a), dan foto mikrograf I. orientalis (1000x) (b)
14
kepada aplikasi agens kontrol biologi dalam mengendalikan pertumbuhan berbagai cendawan patogen pada buah cabai.
DAFTAR PUSTAKA
Atkins SD, Clark IM, Sosnowska D, Hirsch PR, Kerry BR. 2003. Detection and quantification of Plectosphaerella cucumerina, a potential biological control agent of potato cyst nematodes, by using conventional PCR, real-time PCR, selective media, and baiting. App Environ Microbiol. 69(8):4788-4793.doi:10.1128/AEM.69.8.4788–4793.2003.
Barkai-Golan R. 2001. Postharvest Diseases of Fruits and Vegetables Development and Control. Amsterdam (NL): Elsevier Sciences.
Barnett HL, Hunter BB. 1999. Illustrated Genera of Imperfect Fungi. 8th ed. St. Paul (US): APS Pr.
Beasley DR, Joyce DC, Coates LM, Wearing AH. 2001. Saprophytic microorganisms with potential for biological control of Botrytis cinerea on Geraldton waxflower. Aust J Experimental Agr. 4(15):697-703.doi:10.1071/EA00112.
[BPS] Badan Pusat Statistik. 2013. Data Sosial Ekonomi [Internet]. [diunduh 2013 Okt 03]. Tersedia pada: http://www.bps.go.id.
Caldas LS, Bravo C, Piccolo H, Faria CRSM. 1992. Measurement of leaf area with hand-scanner linked to microcomputer. R Bras Fisiol Veg. 4(1):17-20. Chanchaichaovivat A, Panijpan B, Ruenwongsa P. 2007. Screening and
identification of yeast strains from fruits and vegetables: potential for biological control of postharvest chilli anthracnose (Colletotrichum capsici). Biol Control. 42:326–335.doi:10.1016/j.biocontrol.2007.05.016. Dennis C, Webster J. 1971. Antagonistic properties of species groups of
Trichoderma III. Hyphal Interaction. Trans Brit Mycol Soc. 57:363-369. [Ditbenih] Direktorat Perbenihan Hortikultura. 2014. Database Varietas [Internet].
[diunduh 2014 Juli 12]. Tersedia pada:
http://ditbenih.hortikultura.deptan.go.id.
Duriat AS, Gunaeni N, Wulandari AW. 2007. Penyakit Penting Tanaman Cabai dan Pengendaliannya. Bandung (ID): Balitsa.
Ekow E, Kobina L. 2012. Application of antagonistic microorganism for the control of postharvest decay in fruits and vegetables. IJABR. 2(1):1-8. Fokkema NJ. 1973. The role of saprophytic fungi in antagonism against
Drechslera sorokiniana (Helminthosporium sativum) on agar plates and on rye leaves with pollen. Physiol Plant Pathol. 3:195-205.
Hamby KA, Hermandez A, Boundy-Mills K, Zalom FG. 2012. Associations of yeast with spotted wing Drosophila (Drosophila suzukii; Diptera: Drosophilidae) in cherries and rasberries. App Environ Microbiol. 78(14): 4869-4873.
Ippolito A, Nigro F. 2000. Impact of preharvest application of biological control agents on postharvest diseases of fresh fruits and vegetables. Crop Protection. 19:715-723.
15 Johnson LF, Curl EA, Bond JH, Fribourg HA. 1960. Methods for Studying Soil
Microflora-Plant Disease Relationships. Minneapolis (US): Burgess. Kim KH, Yoon JB, Park HG, Park EW, Kim YH. 2004. Structural modifications
and programmed cell death of chilli pepper fruit related to resistance responses to Colletotrichum gloeosporioides infection. Phytopathol. 94:1295-1304.
Korsten L, Villiers EE de, Wehner FC, Kotze JM. 1993. A review of biological control of postharvest disease of subtropical fruit. Di dalam: Champ BR, Higley E, Johnson GI, editor. Postharvest Handling of an International Conference: Chiang Mai, 19-23 Juli 1993. Canbera (AU): ACIAR. 172-185.
Lim J, Tae HL, Cha B. 2002. Isolation and identification of Colletotrichum musae from imported bananas. Plant Pathol J. 18(3):161-164.
Magan N, Lacey J. 1984. The effect of water activity, temperature and structure on interactions between field and storage fungi. Trans Brit Mycol Soc. 92:83-93.
Mari M, Francesc AD, Bertolini P. 2014. Control of fruit postharvest disease: old issues and innovative approaches. Stewart Postharverst Rev. 1:1.doi:2212/spr.2014.1.1.
Mariyono J, Bhattarai M. 2009. Chili Production Practices in Central Java, Indonesia : A Baseline. Shanhua (TW): AVRDC Publication.
Mattjik AA, Sumertajaya IM. 2002. Perancangan Percobaan dengan Aplikasi SAS dan Minitab. Ed ke-2. Bogor (ID): IPB Pr.
Mendgen K, Hahn M. 2002. Plant infection and the establishment of fungal biotrophy. Trends in Plant Sci. 7:352-356.doi:10.1016/S1360-1385(02)02297-5.
Nayaka SC, Shankar ACU, Niranjana SR, Prakash HS, Mortensen CN. 2009. Anthracnose disease of chilli pepper. Technical Bull. 4:4.
Pitt JI, Hocking AD. 2009. Fungi and Food Spoilage. Ed ke-3. New York (US): Springer.
Pring RJ, Nash C, Zakaria M, Balley JA. 1995. Infection process and host range of Colletotrichum capsici. Physio and Mol Plant Pathol. 46:137-152.
Prusky D. 1996. Pathogen quiesence in postharvest disease. Annu Rev Phytophatol. 34:413-434.
Rampersad SN, Teelucksingh LD. 2011. First report of Fusarium proliferatum infecting pimento chili peppers in Trinidad. Plant Dis. 95(10):1313.doi:10.1094/PDIS-03-11-0194.
Sharma RR, Singh D, Singh R. 2009. Biological control of postharvest diseases of fruits and vegetables by microbial antagonists: A review. J Biocontrol. 50:205-221.doi:10.1016/j.biocontrol.2009.05.001.
Siregar AN, Ilyas S, Fardiaz D, Murniati E, Wiyono S. 2007. Penggunaan agens biokontrol Bacillus polymyxa dan Trichoderma harzianum untuk peningkatan mutu benih cabai dan pengendalian penyakit antraknosa. J Peny Pert. 2(2):105-114.
Siregar IZ, Khumaida N, Noviana D, Wibowo MH, Azizah. 2013. Varietas Tanaman Unggul Institut Pertanian Bogor. Bogor (ID). IPB Pr.
16
Sudha M, Naik MK, Ajithkumar K. 2013. An integrated approach for the reduction of aflatoxin contamination in chilli (Capsicum annum L.). J Food Sci Technol. 50(1):159-164.doi:10.1007/s13197-011-0471-4.
Sutton BC. 1980. The Coelomycetes; Fungi Imperfecti with Pycnidia Acervuli and Stromata. Surrey (GB): Commonwealth Mycological Institute.
Syukur M, Sujiprihati S, Koswara J, Widodo. 2007. Pewarisan ketahanan cabai (Capsicum annuum L.) terhadap antraknosa yang disebabkan oleh Colletotrichum acutatum. Bul Agron. 35(2):112-117.
Tarnowski TLB, Ploetz RC. 2010. First report of Colletotrichum capsici causing postharvest anthracnose on papaya in Shout Florida. Plant Dis. 94(8):1065.doi:10.1094/PDIS-94-8-1065B.
Than PP, Jeewon R, Hyde KD, Pongsupasamit S, Mongkolporn O, Taylor PWJ. 2008a. Characterization and pathogenicity of Colletotrichum species associated with anthracnose on chilli (Capsicum spp.) in Thailand. Plant Pathol. 57:562–572.doi:10.1111/j.1365-3059.2007.01782.x.
Than PP, Prihastuti H, Phoulivong S, Taylor PWJ, Hyde KD. 2008b. Chilli anthracnose disease caused by Colletotrichum species. J Zhejiang Univ Sci B. 9(10):764-778.doi:10.1631/jzus.B0860007.
Wheeler KA, Hocking AD. 1993. Interactions among xerophilic fungi associated with dried salted fish. J Applied Bacteriol. 74:164-169.
Wisniewski ME, Wilson CL. 1992. Biological control of postharvest diseases of fruits and vegetables: recent advances. Hort Sci. 27(2):94-98.
17 Lampiran 1 Bagan tahapan strategi pengendalian hayati terhadap patogen menunjukkan peranannya dalam penelitian ( ) dan perdagangan ( ) (Korsten et al. 1993) Identifikasi Tipe interaksi Kemampuan hidup Uji toksisitas Registrasi
Epifit alami Isolasi Patogen
Pemurnian dan
pemeliharaan Penapisan antagonis Uji patogenisitas
In vitro (pada media yang
mengandung agar-agar) In vivo (pada buah)
Produksi skala laboratorium Pengoptimalan Tanaman uji Skala penggunaan Fermentasi komersial Antagonis potensial Percobaan di lapangan Penelitian semikomersial Penggunaan secara komersial
18
Lampiran 2 Deskripsi varietas cabai merah besar
1. Cabai merah besar varietas IPB Perbani (Siregar et al. 2013) Pendaftaran varietas No. 161/PVHP/2010
Asal : Departemen Agronomi dan Hortikultura, IPB Golongan varietas : galur murni
Umur berbunga (HST) : 33 hari Umur panen (HST) : 95 hari
Penampang melintang buah : agak bergelombang Warna buah intermediate : oranye
Warna buah masak : merah Permukaan buah : licin
Bentuk buah : kerucut
Bobot buah (g) : 17.89 Panjang buah (cm) : 10.67 Diameter buah (cm) : 2.38
Sifat khusus : diameter buah besar, permukaan licin, dan rasa buah pedas
Peneliti/Pemulia : Dr Muhamad Syukur, Prof Dr Sriani Sujiprihati (Almh), dan Dr Rahmi Yunianti (Almh)
2. Cabai merah besar varietas Imperial-308 (Ditbenih 2014) Pendaftaran varietas No. 641/Kpts/SR.120/10/2006
Asal tanaman : hibrida persilangan induk betina HP-6A dan HP-6B dengan induk jantan HP-6C
Umur berbunga (HST) : 24 hari Umur panen (HST) : 75 hari Bentuk buah : silindris Bobot buah (g) : ±8.6 Panjang buah (cm) : 15.3 Diameter (cm) : 1.2
Permukaan kulit buah : halus mengkilat Tebal kulit buah : ± 2 mm
Warna buah masak : merah
Keterangan : beradaptasi baik pada ketinggian 200 – 1.050 m di atas permukaan laut
Pengusul/ Peneliti : PT. Benih Inti Subur Intani/ Nasib W.W., Kim In Tae, Mulyantoro, Andy Wahyono, Tauchid, Firman Darmawan
19
3. Cabai merah besar varietas Hibrida F1 Maraton (Ditbenih 2014) Pendaftaran varietas No. 867/Kpts/TP.240/7/1999
Asal tanaman : persilangan induk jantan 966 M dengan induk betina 966 F
Golongan : hibrida F1 Umur berbunga (HST) : 50 hari Umur panen (HST) : 95-100 hari
Bentuk buah : triangular, ujung buah runcing Bobot buah (g) : 8.4
Kulit buah : mengkilat Tebal kulit buah : 2 mm Warna buah muda : hijau tua Warna buah tua : merah Panjang buah (cm) : 13 Diameter buah (cm) : 1.35
Keterangan : dataran rendah sampai menengah Peneliti /Pengusul : PT. East West Seed Indonesia
Lampiran 3 Komposisi media untuk isolasi dan identifikasi cendawan (Pitt dan Hocking 2009)
Media untuk isolasi
Potato Dextrose Agar (PDA)
Kentang 250 g
Dekstrosa 20 g
Agar-agar batang merek AA 20 g
Akuades 1 000 mL
Media untuk identifikasi
Czapek Yeast Agar (CYA)
KH2PO4 1 g
Konsentrat czapek 10 mL
Trace metal solution 1 mL
Ekstrak khamir 5 g
Sukrosa 30 g
Agar-agar batang merek AA 20 g
20
Lampiran 4 Kode isolat Colletotrichum capsici, tanggal isolasi, lokasi pengambilan, dan varietas buah cabai merah besar
Kode isolasi Tanggal isolasi
Lokasi pengambilan buah cabai merah
besar
Varietas buah cabai merah besar CPA I.2 24 Januari 2014 Pasar Anyar Imperial-308 CPA II.2 04 Februari 2014 Pasar Anyar Imperial-308 CPG II.1 05 Februari 2014 Pasar Gembrong
Hibrida F1 Maraton CPB I.1 04 Februari 2014 Pasar Bogor
Hibrida F1 Maraton
Lampiran 5 Analisis ragam pengaruh isolat Colletotrichum capsici terhadap luas permukaan gejala antraknosa
Sumber keragaman Jumlah kuadrat db Kuadrat tengah F-hitung
A 368 155.96 3 122 718.65 7.37**
Galat 482 708.64 29 16 645.13
Total 850 864.60 32
A: Isolat C. capsici; **: Berbeda sangat nyata pada taraf kepercayaan 99%
Lampiran 6 Analisis ragam pengaruh isolat cendawan uji terhadap persentase hambatan Colletotrichum capsici CPB I.1*)
Sumber keragaman Jumlah kuadrat db Kuadrat tengah F-hitung
A 3 868.89 13 297.607 9.50**
Galat 751.67 24 31.319
Total 4 620.55 37
A: Isolat C. capsici; **: Berbeda sangat nyata pada taraf kepercayaan 99%; *) C. capsici CPB I.1
ditumbuhkan pada waktu yang sama dengan cendawan uji
Lampiran 7 Analisis ragam pengaruh isolat cendawan uji terhadap persentase hambatan Colletotrichum capsici CPB I.1*)
Sumber keragaman Jumlah kuadrat db Kuadrat tengah F-hitung
A 1 943.70 6 323.95 9.692**
Galat 434.50 13 33.42
Total 2 378.20 19
A: Isolat C. capsici; **: Berbeda sangat nyata pada taraf kepercayaan 99%; *) C. capsici CPB I.1
21 Lampiran 8 Analisis ragam pengaruh isolat cendawan uji terhadap persentase
hambatan Colletotrichum capsici CPB I.1*)
Sumber keragaman Jumlah kuadrat db Kuadrat tengah F-hitung
A 2 909.18 6 484.86 13.64**
Galat 426.50 12 35.54
Total 3 335.68 18
A: Isolat C. capsici; **: Berbeda sangat nyata pada taraf kepercayaan 99%; *) C. capsici CPB I.1
22
Lampiran 9 Tipe interaksi antar cendawan (Wheeler dan Hocking 1993 yang dimodifikasi dari Magan dan Lacey 1984)
Tipe interaksi Deskripsi klasifikasi
A Pertumbuhan antar cendawan saling
bercampur, kedua cendawan tumbuh tanpa adanya interaksi secara makroskopis.
B Inhibisi mutual; kedua cendawan
saling kontak atau zona hambatan kecil ( kurang dari 2 mm).
C Inhibisi pada cendawan uji;
cendawan uji yang dihambat tidak mengalami pertumbuhan lagi, sedangkan patogen tetap mengalami pertumbuhan.
D Inhibisi mutual; terbentuk zona
hambatan (lebih dari 2 mm)
E Inhibisi pada patogen; cendawan
patogen dihambat tidak mengalami pertumbuhan lagi, sedangkan cendawan uji tetap mengalami pertumbuhan
F Inhibisi pada salah satu cendawan; cendawan inhibitor tetap mengalami pertumbuhan melewati cendawan yang dihambat
23
RIWAYAT HIDUP
Penulis dilahirkan dari pasangan Rokhmat dan Fatikhah di Cirebon, 4 Desember 1991. Penulis merupakan anak ke-2 dari 4 bersaudara. Penulis menempuh pendidikan menengah atas di SMA Negeri 2 Cirebon dan lulus pada tahun 2010, kemudian melanjutkan kuliah di IPB melalui jalur Undangan Seleksi Masuk Institut Pertanian Bogor dan diterima di Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam.
Selama menempuh perkuliahan penulis pernah mengikuti Studi Lapang dengan judul “Struktur Jaringan Sekretori pada Tumbuhan Obat Anggota Suku Lauraceae dan Solanaceae di Taman Nasional Gunung Gede Pangrango” di bawah bimbingan Dr Yohana C. Sulistyaningsih, MSi dan Praktik Lapangan dengan judul “Proses Pengolahan Limbah Cair dengan Activated Sludge Unit di PT Pertamina (Persero) Refinery Unit VI Balongan, Indramayu-Jawa Barat” di bawah bimbingan Dr Ir Ence Darmo Jaya Supena, MSi. Penulis pernah mengikuti UKM Gentra Kaheman tahun 2010 dan aktif dalam organisasi mahasiswa daerah Ikatan Keluarga Cirebon (IKC). Selain itu, penulis aktif dalam Paguyuban Mahasiswa Biologi (PAMABI) HIMABIO sebagai sekretaris 1 tahun 2012-2013.