3. METODE PENELITIAN
3.1. Lokasi dan Waktu Penelitian
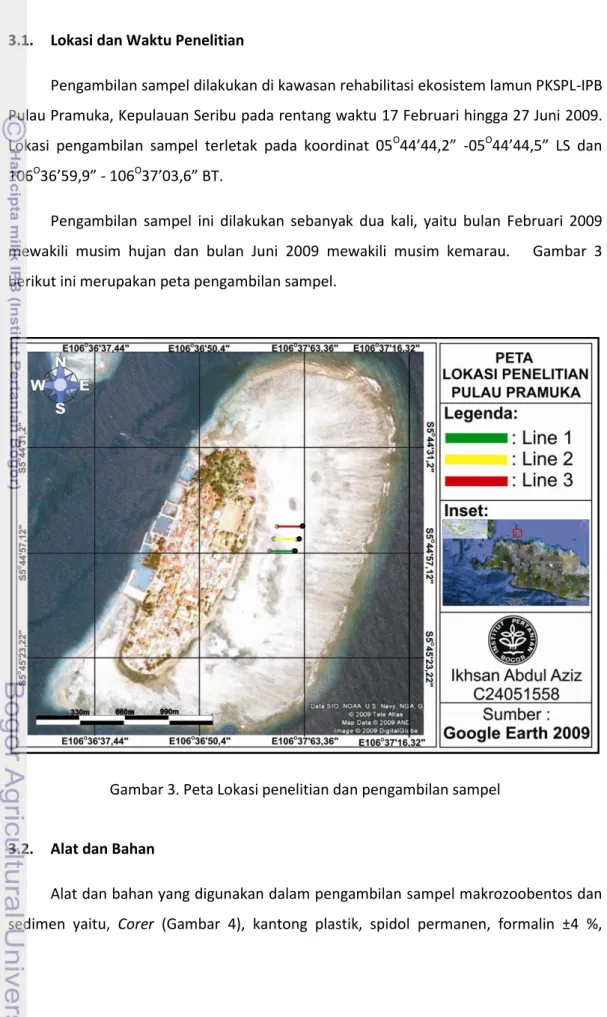
Pengambilan sampel dilakukan di kawasan rehabilitasi ekosistem lamun PKSPL-IPB Pulau Pramuka, Kepulauan Seribu pada rentang waktu 17 Februari hingga 27 Juni 2009. Lokasi pengambilan sampel terletak pada koordinat 05O44’44,2” -05O44’44,5” LS dan 106O36’59,9” - 106O37’03,6” BT.
Pengambilan sampel ini dilakukan sebanyak dua kali, yaitu bulan Februari 2009 mewakili musim hujan dan bulan Juni 2009 mewakili musim kemarau. Gambar 3 berikut ini merupakan peta pengambilan sampel.
Gambar 3. Peta Lokasi penelitian dan pengambilan sampel
3.2. Alat dan Bahan
Alat dan bahan yang digunakan dalam pengambilan sampel makrozoobentos dan sedimen yaitu, Corer (Gambar 4), kantong plastik, spidol permanen, formalin ±4 %,
saringan halus dengan diameter ±500 µm (Eleftheriou & Moore 2005), pewarna rose
bengel. Sedangkan untuk penanganan sampel yaitu saringan halus dengan diameter 500
µm (Lampiran 1), ember, gayung, baki, pinset, botol film, alkohol 70%, mikroskop, kaca pembesar, kertas label, spidol, data sheet, dan buku identifikasi. Untuk lebih jelas lagi dapat dilihat pada Tabel 1.
Gambar 4. Corer yang dipakai untuk pengambilan sampel
Beberapa parameter fisika dan kimia diamati secara in situ dengan menggunakan alat dan bahan seperti termometer untuk mengukur suhu, refraktometer untuk mengukur salinitas, meteran untuk mengukur kedalaman, Secchi disk untuk mengukur kecerahan, pH stick untuk mengukur pH, dan satu set alat untuk mengukur DO dengan menggunakan metode titrasi Winkler. Untuk lebih jelasnya lagi, alat dan parameter fisika-kimia yang diukur dapat dilihat pada Tabel 2. Selain alat dan bahan di atas, untuk penentuan stasiun digunakan GPS (Global Positioning System) serta roll meter untuk mengukur luas stasiun pengamatan.
Diameter (D) = 4 inch (10,16 cm) Luas (L) = π.r2
= 3,14.(5,08)2 = 81,032 cm2 = 0,0081 m2
Tabel 1. Alat dan bahan yang digunakan dalam pengambilan dan penanganan sampel makrozoobentos dan sedimen berikut fungsinya masing-masing
Alat dan Bahan Fungsi / Kegunaan Pengambilan sampel Alat: 1. Corer 2. Kantong plastik 3. Spidol permanen 4. Saringan halus Bahan: 1. Formalin ±4 % 2. Rose bengel
Mengambil sampel substrat Wadah sampel
Menandai stasiun dan ulangan pada plastik sampel Menyaring air sebelum dimasukan ke dalam plastik
Mengawetkan sampel
Memberikan warna pada organisme yang ada pada sampel Penanganan sampel Alat: 1. Saringan halus 2. Ember 3. Gayung 4. Baki 5. Pinset 6. Botol film 7. Kertas label 8. Spidol 9. Data sheet 10. Mikroskop 11. Buku identifikasi Bahan: 1. Alkohol 70% 2. Air Menyaring organisme
Wadah air untuk membilas sampel substrat Untuk mengambil air
Wadah untuk menyaring makrozoobentos
Mengambil organisme yang ditemukan pada sampel Menaruh sampel bentos
Menandai botol film Menandai botol film
Menulis data hasil identifikasi makrozoobentos yang ditemukan
Melihat makrozoobentos untuk diidentifikasi Mengetahui jenis makrozoobentos yang didapatkan
Mengawetkan sampel makrozoobentos Membersihkan sampel
3.3. Rancangan Penelitian
Penentuan stasiun untuk pengambilan sampel makrozoobentos dan lamun ditentukan berdasarkan keterwakilan spasial dan temporal wilayah ekosistem lamun tersebut, yaitu di kawasan rehabilitasi pada musim hujan (Februari 2009) dan kemarau (Juni 2009). Perbedaan secara spasial dan temporal dalam pengambilan sampel tersebut digunakan untuk mengidentifikasi adanya pengaruh faktor lingkungan terhadap makrozoobentos yang diamati. Menurut Bender et al. (1984) in Underwood & Chapman (2005), Pengaruh lingkungan dapat berupa kematian atau memperpendek usia organisme tersebut (pulse disturbances) dan tekanan yang berlangsung lama pada rentang waktu tertentu (press disturbances).
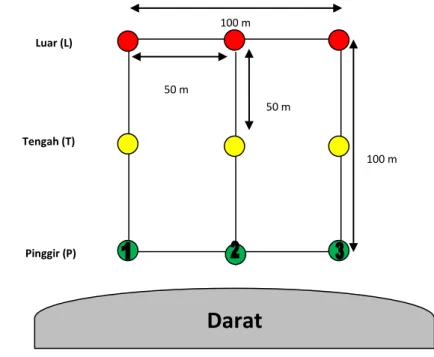
Gambar 5. Rancangan penelitian
Daerah pengambilan sampel ditentukan pada lokasi dengan luas 10.000 m2 (100 m X 100 m) dimana daerah tersebut dibagi menjadi tiga transek garis. Pada masing-masing transek garis ditentukan 3 titik pengamatan, yaitu pada titik 0 m, 50 m, dan 100 m, sehingga pada lokasi tersebut terdapat 9 stasiun pengamatan yang dapat dikelompokan menjadi tiga berdasarkan transek garis dan berdasarkan posisi dari stasiun tersebut (pinggir, tengah, dan luar). Untuk lebih jelas dapat dilihat pada Gambar 5. Pada setiap stasiun pengamatan dilakukan pengambilan sampel sebanyak tiga ulangan.
Penamaan stasiun dilakukan dengan cara memperhatikan letak pada transek garis serta posisinya pada transek garis tersebut. Misal, stasiun 1L berarti stasiun berada pada transek garis pertama (1) dengan posisi di luar (L).
3.4. Pengambilan dan Penanganan Sampel
Pengambilan sampel makrozoobentos dilakukan sebanyak 3 ulangan pada setiap titik pengamatan dengan total 27 sampel pada setiap bulan. Sedangkan untuk pengambilan sampel sedimen dilakukan satu kali ulangan pada masing-masing titik pengamatan (9 sampel pada setiap bulan). Sampel tersebut selanjutnya dimasukan
100 m 100 m 50 m 50 m Luar (L) Tengah (T) Pinggir (P)
Darat
kedalam plastik yang telah diberi keterangan nomor stasiun sebelum dilakukan analisis tekstur dan kandungan C-organik dalam sedimen. Untuk parameter kimia dan fisika air yang diukur langsung (in situ) setiap titik pengamatan. Beberapa parameter fisika dan kimia yang diukur beserta metode yang digunakan dapat dilihat pada Tabel 2.
Penanganan yang dilakukan pada sampel pasir yang telah diambil pertama kali adalah disaring dan dipisahkan antara pasir dan lamun yang terambil pada saat mengambil sampel menggunakan corer. Pasir dan lamun selanjutnya dimasukkan ke dalam kantong plastik berbeda yang sudah diberi label nomor stasiun dan ulangan. Sampel bentos diawetkan dengan menggunakan formalin ±4%, lalu diberikan rose
bengel secukupnya sebagai pewarna, sedangkan sampel lamun disimpan di lemari
pendingin untuk mencegah terjadinya pembusukan, kemudian lamun tersebut diukur biomassa basahnya di Laboratorium Produktifitas dan Lingkungan, Departemen MSP-IPB. Pengukuran biomassa dilakukan dengan cara meniriskan lamun sampai air di permukaan (external water) kering kemudian ditimbang dengan menggunakan timbangan digital.
Penanganan sampel makrozoobentos secara umum dilakukan dalam beberapa tahap, yaitu penyaringan, penyortiran, pengawetan dan identifikasi. Penyaringan dan penyortiran dilakukan dengan menggunakan wadah saringan halus dengan ukuran diameter pori ±500 µm dan pinset hingga sampel makrozoobentos terpisah dari serasah dan sedimen. Makrozoobentos hasil penyortiran dimasukkan ke dalam botol film yang telah diberi label, lalu diawetkan dengan menggunakan alkohol (konsentrasi 70%). Selanjutnya, makrozoobentos yang telah disortir diidentifikasi dengan bantuan lup dan mikroskop, serta buku identifikasi (Gosner 1971, Kozloff et al. 1987, Dance 1977, Fauchald 1977).
Identifikasi dilakukan pada setiap organisme makrozoobentos yang ditemukan dan pada penelitian ini sampai tingkat genus. Setiap jenis individu yang ditemukan dihitung jumlahnya berdasarkan titik pengamatan dan ulangannya. Untuk mengukur biomassa, metode yang dilakukan sama seperti mengukur biomassa lamun. Sampel sedimen yang diambil untuk diamati tekstur dan kandungan C-Organiknya dianalisis di Laboratorium Ilmu Tanah, Fakultas Pertanian, Institut Pertanian Bogor.
Tabel 2. Parameter yang diamati beserta satuan, alat, dan metode yang digunakan
Parameter Satuan Alat Metode
Fisika 1. Suhu 2. Kedalaman 3. Kecerahan O C m % Termometer Meteran Sechii disc Pemuaian Perbandingan Visual Kimia 1. Salinitas 2. pH 3. DO (Dissolved Oxygen) 4. NO3-N 5. PO4-P PSU - mg l-1 mg l-1 mg l-1 Refraktometer pH stick
Satu set alat dan bahan untuk mengukur DO
Beberapa alat dan bahan untuk mengukur NO3-N
Beberapa alat dan bahan untuk mengukur PO4-N Pembiasan Perubahan warna Winkler Refraksi cahaya Refraksi cahaya Sedimen 1. Tekstur 2. C-Organik - mg l-1
Beberapa alat dan bahan untuk mengukur tekstur
Beberapa alat dan bahan untuk mengukur C-Organik
Kohn
Walkley-Black
3.5. Analisis Data
Data yang dianalisa yaitu data primer dari pengambilan sampel bulan Februari 2009 dan Juni 2009 yang terbagi menjadi dua, yaitu musim hujan (Februari) dan musim kemarau (Juni). Selain itu digunakan pula data sekunder yang didapat dari studi pustaka. Untuk memudahkan pengolahan data primer (Kepadatan, indeks keanekaragaman, indeks keseragaman, agregasi, dan similaritas), maka digunakan
software PRIMER versi 5.2 (Plymouth Routines In Multivariate Ecological Research)
(Clarke & Gorley 2001 in Taurusman 2007). Software PRIMER versi 5.2 merupakan program yang digunakan untuk mempermudah penghitungan beberapa analisis yang berhubungan dengan ekologi. Dengan program tersebut, pengolahan data menjadi lebih cepat dan efisien sehingga hasil dari analisis dapat langsung dijelaskan.
3.5.1. Kepadatan makrozoobentos
Kepadatan makrozoobentos menurut Brower et al. (1997) didefinisikan sebagai jumlah individu makrozoobentos per satuan luas (m2). Sampel makrozoobentos yang
telah diidentifikasi kemudian dihitung kepadatannya dengan menggunakan rumus yang dimodifikasi dari Brower et al. (1997):
𝐾𝑖 =𝑁𝑖 𝐴 Keterangan :
Ki = Kepadatan makrozoobentos jenis i (individu m-2)
Ni = Jumlah makrozoobentos jenis i yang ditemukan pada setiap ulangan (individu)
A = Luas bukaan mulut Corer (0,0081 m2)
3.5.2. Struktur komunitas makrozoobenthos
Karakteristik dari makrozoobentos dapat dijelaskan dengan melihat jumlah taksa (genus), kepadatan, dan biomassnya (Pearson & Rosenberg 1978 in Taurusman 2007). Selain beberapa parameter tersebut, untuk melihat keanekaragaman dari bentos maka digunakan beberapa indeks seperti indeks keanekaragaman Shannon-Wiener dan indeks keseragaman Pielou.
a. Indeks keanekaragaman
Kekayaan spesies dan kesamaannya dalam satu nilai tunggal digambarkan dengan indeks diversitas atau indeks keanekaragaman. Keanekaragaman ditentukan oleh dua hal penting, yaitu: pertama, jumlah spesies atau taksa yang berbeda dan kedua, keseragaman yang mencerminkan penyebaran individu dalam satu kategori sistematik (Bengen 2000). Dalam analisis data, dipakai indeks Shannon-Wiener untuk melihat keanekaragaman jenis yang ditemukan pada setiap stasiun. Berikut rumus indeks keanekaragaman dengan menggunakan logaritma basis dua (Brower et al. 1997):
𝐻′ = − (𝑝𝑖 𝑙𝑜𝑔 2 𝑝𝑖) 𝑛
𝑖=1
Keterangan :
H' : Indeks Keanekaragaman (Shannon-Wiener)
pi : Jumlah individu genus ke-i per jumlah individu total (ni/N)
Dimana : ni (jumlah spesies i) dan N (jumlah total spesies yang ditemukan) b. Indeks keseragaman
Indeks keseragaman (equitabilitas) diartikan sebagai nilai yang dapat menjelaskan penyebaran individu antar spesies yang berbeda dan diperoleh dari hubungan antara keanekaragaman (H’) dengan keanekaragaman maksimalnya (Bengen 2000). Untuk analisis keseragaman, digunakan indeks Pielou (J’) dengan rumus sebagai berikut (Brower et al. 1997 ):
𝐽′ = 𝐻′ 𝑙𝑜𝑔2 (𝑆) Keterangan :
J : Indeks Keseragaman Pielou
H' : Indeks Keanekaragaman (indeks Shannon) S : Jumlah taksa (genus)
3.5.3. Indeks similaritas
Indeks similaritas digunakan untuk melihat kesamaan dari dua komunitas, sehingga dapat dilihat pengelompokan stasiun berdasarkan jenis makrozoobentos yang ditemukan pada setiap stasiun. Selain itu dari hasil pengelompokan tersebut, dapat dianalisis beda antara stasiun dengan melihat nilai dari indeks tersebut. Analisis similaritas dari kepadatan dan komposisi makrozoobentos yang ditemukan antar stasiun pengamatan dilakukan dengan bantuan software PRIMER versi 5 dan disajikan dalam bentuk dendogram. Rumus jarak kedekatannya yaitu:
𝑑 𝑖, 𝑗 = 𝑋𝑖𝑗 − 𝑋𝑘𝑗 2 𝑛
𝑖=1
Keterangan :
d(i,j) : Jarak Euclidean antara pengamatan i dan j
Xij : Kepadatan kelas makrozoobentos ke-i untuk sampling ke-j Xkj : Kepadatan kelas makrozoobentos ke-k untuk sampling ke-j
3.5.4. Korelasi Pearson
Koefesien korelasi adalah pengukuran statistik kovarian atau asosiasi antara dua variabel. Besarnya koefesien korelasi berkisar antara +1 s/d -1. Koefesien korelasi menunjukkan kekuatan (strength) hubungan linier dan arah hubungan dua variabel acak. Adapun rumus perhitungan korelasi sebagai berikut (walpole 1992):
𝑟 = 𝑛 𝑋𝑌 − 𝑋 𝑌 𝑛 𝑗 =1 𝑛 𝑖=1 𝑛 𝑖,𝑗 =1 𝑛 𝑋2− ( 𝑛 𝑋) 𝑖=1 2 𝑛 𝑖=1 𝑛 𝑛𝑗 =1𝑌2− ( 𝑛𝑗 =1𝑌)2
Interpretasi hasil analisis korelasi:
(1) Melihat kekuatan hubungan dua variabel dengan kriteria sebagai berikut 0 : Tidak ada korelasi antara dua variabel
>0 – 0,25 : Korelasi sangat lemah >0,25 – 0,5 : Korelasi cukup >0,5 – 0,75 : Korelasi kuat >0,75 – 0,99 : Korelasi sangat kuat
1 : Korelasi sempurna
(2) Melihat arah hubungan.
Jika koefesien korelasi positif, maka kedua variabel mempunyai hubungan searah. Artinya jika nilai variabel X tinggi, maka nilai variabel Y akan tinggi pula. Sebaliknya, jika
koefesien korelasi negatif, maka kedua variabel mempunyai hubungan terbalik. Artinya jika nilai variabel X tinggi, maka nilai variabel Y akan menjadi rendah.
(3) Melihat signifikansi hubungan
Signifikansi / probabilitas / α memberikan gambaran mengenai bagaimana nilai korelasi tersebut mendekati kebenaran atau tidak. Nilai signifikansi sebesar 0,01, berarti hasil penelitian mempunyai kesempatan untuk benar sebesar 99% dan untuk salah sebesar 1%.
Hipotesis : · H0: Tidak ada hubungan signifikan antara X dengan Y · H1: Ada hubungan signifikan antara X dengan Y
Hasil : · Jika angka signifikansi hasil penelitian < 0,05 maka H0 ditolak. · Jika angka signifikansi hasil penelitian > 0,05 maka H0 diterima