III. METODOLOGI PENELITIAN
3.1
BAHAN DAN ALAT
Bahan yang digunakan dalam penelitian ini terdiri atas bahan untuk pembuatan beras artificial dan bahan untuk analisis. Bahan untuk pembuatan beras terdiri dari tepung sorgum, tepung mocaf, tepung jagung, tepung maizena, tepung sagu, air dan GMS (Gliserol Monostearat). Bahan untuk analisis terdiri dari beras artificial dan bahan untuk analisis kimia.
Alat yang digunakan dalam penelitian ini terdiri atas alat-alat untuk pembuatan beras artificial dan alat-alat untuk analisis. Alat-alat yang digunakan untuk pembuatan beras artificial adalah ekstruder ulir ganda (Berto BEX-DS-2256), dough mixer, oven dryer, waskom, baki, sendok, timbangan, neraca analitik, blender, saringan, disc mill, plastik, dan rice cooker. Alat-alat yang digunakan untuk analisis yaitu neraca analitik, hot plate, oven, tanur, erlenmeyer, gelas piala, sudip, cawan porselen, cawan alumunium, labu takar, gelas ukur, tabung reaksi bertutup, pipet volumetrik 1 ml, pipet volumetrik 10 ml, kuvet, Spectrophotometer UV-Vis, pipet tetes, labu Kjeldahl dan alat Sokhlet.
3.2
TAHAPAN PENELITIAN
Tahapan penelitian ini meliputi persiapan bahan, trial and error, pembuatan beras analog, uji pemasakan, uji organoleptik, dan uji kimia dan fisik formula terpilih. Persiapan bahan meliputi persiapan bahan tepung sorgum dan tepung jagung. Uji trial and error untuk mengetahui jumlah air yang ditambahkan, jenis emulsifier, jumlah emulsifier, optimasi proses, dan optimasi cara pemasakan.
Tahap berikutnya adalah pembuatan beras analog dengan membandingkan dua faktor yaitu penambahan 30% tepung (sorgum dan mocaf) dan penambahan pati (sagu aren 30%; maizena 30%; dan campuran sagu 15% dan maizena 15%). Dari rancangan percobaan tersebut didapatkan enam buah sampel beras yang diuji organoleptiknya dalam bentuk beras mentah dan nasi matang. Formula terbaik adalah sampel yang memiliki nilai kesukaan paling tinggi. Formula terpilih akan diuji lebih lanjut sifat kimianya yaitu melalui analisis proksimat, kadar pati dan amilosa dan sifat fisik melalui analisis warna dan tekstur.
3.3
PEMBUATAN TEPUNG JAGUNG DAN TEPUNG SORGUM
Tahapan pembuatan tepung sorgum yaitu perontokkan, penyosohan, penambahan air, penyimpanan selama satu malam dalam wadah plastik, penggilingan, pengeringan dan pengayakan 60 mesh. Pembuatan tepung jagung meliputi pemipilan, penghancuran biji menjadi grits, pemisahan dengan lembaga, penambahan air, penyimpanan selama satu malam dalam plastik, penggilingan, pengeringan, pengayakan 100 mesh.
3.4
PEMBUATAN BERAS ANALOG
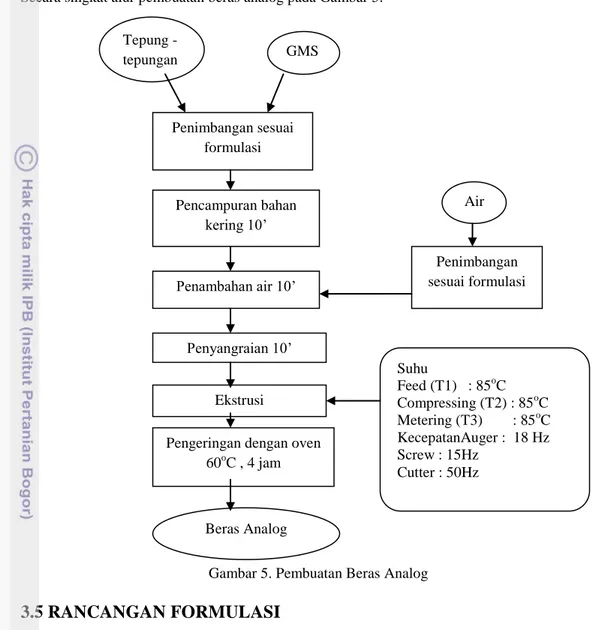
Pembuatan beras analog menggunakan teknologi ekstrusi dengan suhu tinggi (hot extrusion). Tahap awal adalah penimbangan bahan sesuai formulasi. Setelah itu bahan-bahan kering meliputi tepung, pati dan GMS dicampurkan dengan mixer selama 10 menit. Kemudian air ditambahkan sedikit-demi sedikit hingga adonan rata. Adonan tersebut disangrai selama 10 menit dan tahap berikutnya adalah proses ekstrusi menggunakan Twin Screw Extruder.
15 Tepung - tepungan GMS Air Penimbangan sesuai formulasi Pencampuran bahan kering 10‟ Penimbangan sesuai formulasi Penambahan air 10‟ Penyangraian 10‟ Ekstrusi
Pengeringan dengan oven 60oC , 4 jam Beras Analog Suhu Feed (T1) : 85oC Compressing (T2) : 85oC Metering (T3) : 85oC KecepatanAuger : 18 Hz Screw : 15Hz Cutter : 50Hz
Produk hasil ekstrusi kemusian dikeringkan dalam over dryer pada suhu 60oC selama 4 jam. Secara singkat alur pembuatan beras analog pada Gambar 5.
Gambar 5. Pembuatan Beras Analog
3.5
RANCANGAN FORMULASI
Rancangan formulasi pada penelitian ini menggunakan Rancangan Acak Lengkap Faktorial dengan dua faktor, yaitu faktor A = tepung substitusi dan faktor B = jenis dan jumlah pati.
Tepung substitusi yang digunakan adalah : t1 = Sorgum 30%
t2 = Mocaf 30%
Jenis pati yang digunakan adalah adalah : p1 = Sagu Aren 30%
p2 = Sagu Aren 15% dan Maizena 15% p3 = Maizena 30%
Sehingga formula yang didapatkan adalah sebagai berikut:
Faktor p1 p2 p3
t1 A (t1p1) B (t1p2) C(t1p3)
t2 D (t2p1) E (t2p2) F(t2p3)
Keterangan :
16
3.6
PROSEDUR ANALISIS
3.6.1
Uji sensori Pemilihan Formula Terbaik
Uji sensori yang dilakukan pada penelitian ini adalah uji rating hedonik pada atribut warna, rasa dan tekstur. Sampel beras analog yang telah dimasak disajikan di atas pisin, kemudian panelis diminta untuk memberikan penilaian. Skala yang digunakan adalah skala garis sepanjang 15 cm. Panelis yang diambil responnya adalah panelis tidak terlatih sebanyak 70 orang. Data yang diperoleh akan diolah dengan uji Analysis of Variance (ANOVA). Jika hasil uji ANOVA menyatakan bahwa sampel yang diujikan berbeda nyata pada taraf kepercayaan 0.05, maka akan dilakukan uji lanjut Duncan.
3.6.2
Analisis Kimia
Kadar Air (AOAC 2006)
Cawan alumunium dikeringkan dalam oven selama 15 menit, didinginkan dalam desikator selama 10 menit, kemudian ditimbang (A). Sejumlah sampel dengan bobot tertentu (B) dimasukkan dalam cawan. Cawan beserta isinya dikeringkan dalam oven bersuhu 105oC selama 6 jam, didinginkan dalam desikator selama 15 menit, kemudian ditimbang. Cawan beserta isinya dikeringkan kembali sampai diperoleh berat konstan (C). Kadar air contoh dapat dihitung dengan persamaan berikut : Kadar air (%bb) = ( )
Kadar air (%bk) ( ) ( )
Dimana: bb = basis basah bk = basis kering
Kadar Abu (AOAC 2006)
Cawan porselen yang dipersiapkan untuk pengabuan dikeringkan dalam oven selama 15 menit, lalu didinginkan dalam desikator dan ditimbang (A). Sampel dengan bobot tertentu (B) dimasukkan ke dalm cawan, kemudian dibakar dalam ruang asap sampai tidak mengeluarkan asap lagi. Selanjutnya, dilakukan pengabuan di dalam tanur listrik pada suhu 400-600oC selama 4-6 jam hingga terbentuk abu berwarna putih dan memiliki bobot konstan. Abu berserta cawan didinginkan dalam desikator, kemudian ditimbang (C). kadar abu contoh dapat dihitung dengan persamaan berikut:
Kadar abu (%bb) = ( )
Kadar abu (%bk) = ( ) ( )
Kadar Lemak(AOAC 2006)
Sebanyak 1-2 gram contoh dimasukkan ke dalam kertas saring. Kertas saring berisi contoh tersebut dikeringkan dalam oven bersuhu 105°C hingga kering.Kertas saring yang telah dikeringkan dimasukkan ke dalam selongsong dengan sumbat kapas. Selongsong tersebut kemudian dimasukan ke dalam alat ekstraksi soxhlet dan dihubungkan dengan kondensor dan labu lemak. Alat kondensor diletakkan di atasnya dan labu lemak diletakkan di bawahnya. Pelarut hexana dimasukan ke dalam labu lemak secukupnya. Selanjutnya dilakukan ekstraksi selama 6
17 jam. Pelarut yang ada dalam labu lemak didestilasi dan ditampung kembali. Kemudian labu lemak yang berisi lemak hasil ekstraksi dikeringkan dalam oven pada suhu 105oC, didinginkan dalam desikator dan ditimbang. Pengeringan diulangi hingga mencapai berat tetap. Kadar lemak dapat diperoleh dengan persamaan berikut :
% 100 W W2 -W1 (%bb) Lemak Kadar x Keterangan:
W : Bobot sampel (gram) W1: Bobot labu+ lemak (gram) W2: Bobot labu (gram)
Kadar Protein (AOAC 2006)
Sebanyak 0,1-0.25 gram contoh ditimbang di dalam labu Kjeldahl, lalu ditambahkan 1.0 + 0.1 gram K2SO4, 40 + 10 ml HgO, dan 2.0 + 0.1 ml H2SO4, selanjutnya contoh didihkan sampai
cairan jernih kemudian didinginkan. Larutan jernih ini dipindahkan ke dalam alat destilasi secara kuantitatif. Labu Kjeldahl dibilas dengan 1-2 ml air destilata, kemudian air cuciannya dimasukan ke dalam alat destilasi, pembilasan dilakukan sebanyak 5-6 kali. Tambahkan 8-10 ml larutan 60% NaOH – 5% Na2S2O3.5H2O ke dalam alat destilasi.
Di bawah kondensor diletakkan erlenmeyer yang berisi 5 ml larutan H3BO3 jenuh dan 2-4
tetes indikator (campuran 2 bagian 0.2% metilen red dan 1 bagian 0.2% metilen blue dalam etanol 95%). Ujung tabung kondensor harus terendam dalam larutan H3BO3, kemudian dilakukan
destilasi sehingga diperoleh sekitar 15 ml destilat. Destilat yang diperoleh kemudian dititrasi dengan HCl 0.02 N sampai terjadi perubahan warna dari hijau menjadi abu-abu. Kadar protein kasar dapat dihitung dengan persamaan :
% 100 contoh mg 14.007 x HCl N x blanko) HCl V -contoh HCl (V (%bb) N Kadar x Fk x N % bb) % ( protein Kadar Keterangan :
Fk : Faktor konversi (6.25 untuk tepung dan mi)
Kadar Karbohidrat (by difference)
Perhitungan kadar karbohidrat dilakukan dengan cara by difference dengan persamaan : Kadar karbohidrat = 100% - (% air + %abu + %protein + % lemak)
Serat Pangan Metode Multienzim (Asp et al. 1983)
Sampel sebanyak 1 gram dimasukkan ke dalam Erlenmeyer, kemudian ditambahkan 25 ml larutan buffer Na-phospat pH 6 dan diaduk hingga terbentuk suspensi. Selanjutnya ditambahkan 0.1 ml enzim termamyl ke dalam erlenmeyer yang berisi sampel. Erlenmeyer kemudian ditutup dengan alumunium foil dan diinkubasi dalam penangas air suhu 100oC selama 15 menit sambil diaduk sesekali.
Sampel diangkat dan didinginkan, lalu ditambahkan 20 ml air destilata dan pH diturunkan sampai 1.5 menggunakan HCl 4 N. Selanjutnya ditambahkan enzim pepsin sebanyak 100 mg ke dalam sampel, lalu ditutup dan diinkubasi dalam penangas air bergoyang suhu 40oC selama 1 jam. Erlenmeyer kemudian diangkat, ditambahkan air destilata, dan pH diatur menjadi 6.8 menggunakan NaOH. Setelah pH 6.8 tercapai, ditambahkan enzim pankreatin sebanyak 100mg ke dalam erlenmeyer. Erlenmeyer ditutup, diinkubasikan pada suhu 40oC selama 1 jam. Selanjutnya
18 pH diatur sampai 4,5 menggunakan HCl. Larutan sampel tersebut kemudian disaring menggunakan crucible kering yang telah ditimbang beratnya (porositas 2) dan ditambahkan 0.5 gram celite kering (berat tepat diketahui). Pada penyaringan dilakukan dua kali pencucian dengan masing-masing 10 ml air destilata.
Residu (Serat pangan tidak larut)
Hasil yang diperoleh selanjutnya dicuci dengan 2 x 10 ml etanol 95 % dan 2 x 10 ml aseton lalu dikeringkan pada suhu 105oC sampai berat tetap (sekitar 12 jam). Selanjutnya didinginkan dalam desikator, lalu timabang. Setelah itu diabukan dalam tanur 500oC selama minimal 5 jam, lalu didinginkan dalam desikator dan timbang beratnya.
Filtrat (serat pangan larut)
Volume filtrate diatur dengan air sampai 100 ml, kemudian ditambahkan 400 ml etanol 95 % hangat (60oC) dan diendapkan selam 1 jam. Selanjutnya disaring dengan crucible kering (porositas 2) yang mengandung 0.5 g celite kering, dicuci lagi dengan 2x 10 ml etanol 78 %, 2 x 10 ml etanol 95 %, dan 2 x 10 ml aseton, kemudian dikeringkan pada suhu 105oC sampai berat konstan. Setelah itu didinginkan dalam desikator dan timbang beratnya. Selanjutnya diabukan dalam tanur suhu 550oC selama 5 jam dan ditimbang setelah didinginkan dalam desikator.
Blanko
Penetapan blanko dapat dilakukan dengan cara seperti pada prosedur untuk sampel, tetapi tanpa penambahan sampel.
Setelah mendapatkan berat sampel sebelum dan sesudah diabukan serta berat blanko, persamaan untuk menghitung sebagai berikut :
% Serat tak Larut (IDF) = (
% Serat Larut (SDF) = (
% Total Serat (TDF) = (SDF + IDF) (%) Keterangan :
D = berat setelah pengeringan (g) I = berat setelah pengabuan (g) B = berat blanko bebas abu (g)
Analisis Kadar Pati Metode Luff Schoorl (Sudarmadji et al. 1997)
Pembuatan Larutan Luff Schoorl
Sebanyak 12.5 g CuSO4.5H2O dilarutkan dalam 50 ml air destilata (larutan A). sebanyak 25 g
asam sitrat dilarutkan dalam 25 ml air destilata (larutan B). Larutan C dibuat dengan melarutkan 194 g Na2CO3.10H2O dalam 150-200ml air mendidih. Larutan B kemudian dituang ke dalam larutan C dan diaduk. Selanjutnya larutan A ditambahkan ke dalam campuran larutan B dan C. Setelah dingin, ditambahkan air destilata hingga volume 500 ml.
19 Standarisasi larutan Na2S2O3 0.01 N
Larutan Na2S2O3 0.1 N dibuat dengan mencampurkan 12.5 g Na2S2O3.5H2O dan 0.15 g Na2CO3,
kemudian ditambahkan air destilata hingga volume 500 ml. standardisasi larutan Na2S2O3 0.1 N
dilakukan dengan menimbang 140-150 mg KIO3 ke dalam Erlenmeyer 300 ml. kemudian larut kan dengan air destilata secukupnya dan tambahkan ± 2 mg KI. Tambahkan 10 ml HCl 2 N ke dalam larutan (titrasi harus segera dilakukan setelah penambahan HCl). Titrasi dilakukan dengan Na2S2O3 0.1 N yang akan distandardisasi hingga warna larutan berubah dari merah bata menjadi
kuning pucat. Selanjutnya tambahkan 1-2 ml larutan pati dan titrasi dilanjutkan hingga warna biru menghilang. Normalitas larutan Na2S2O3 0.1 N dapat dihitung dengan persamaan :
Normalitas Na2S2O3=
Pengukuran Sampel
Sebanyak ± 0.1 g sampel dan 5 ml HCl 25 % dimasukkan ke dalam gelas piala pendingan balik, kemudian direfluks selama 3 jam. Setelah selesai, netralkan pH larutan dengan NaOH 45 %. Tambahkan air destilata hingga volume larutan 100 ml. larutan tersebut kemudian disaring dengan kertas saring. Sebanyak 25 ml filtrat dimasukkan ke dalam Erlenmeyer, kemudian ditambahkan 25 ml larutan Luff Schoorl. Tutup erlenmeyer dengan alumunium foil dan panaskan hingga larutan mendidih. Lakukan pemanasan selama 10 menit sejak larutan mendidih. Selanjutnya tambakan 15 ml KI 20 % dan 25 ml H2SO4 26.5 %. Lakukan titrasi dengan Na2S2O3 0.1 N yang telah
distandardisasi hingga warna larutan berubah dari merah bata menjadi kuning pucat. Tambahkan 1-2 ml larutan pati dan titrasi dilanjutkan hingga warna biru menghilang. Pengukuran blanko juga dilakukan dengan mengganti 25 ml filtrat sampel dengan 25 ml air destilata.
Kadar pati contoh dapat dihitung dengan persamaan berikut :
Volume Na2S2O3 yang digunakan =
( – )
Kadar Gula (%) =
Kadar Pati (%) = Kadar gula x 0.9
Keterangan :
Vb = Volume Na2S2O3 yang digunakan untuk titrasi blanko
Vs = Volume Na2S2O3 yang digunakan untuk titrasi sampel
FP = Faktor pengenceran
Analisis Kadar Amilosa ( Apriyanto et al. 1989)
Pembuatan kurva standar
Sebanyak 40 mg amilosa murni dimasukkan ke dalam labu takar 100 ml., ditambahkan 1 ml etanol 95 % dan 9 ml larutan NaOH 1 N. Kemudian labu takar dipanaskan dalam penangas air pada suhu 95oC selama 10 menit. Setelah didinginkan, ditambahkan air destilata hingga tanda tera. Larutan tersebut digunakan sebagai larutan stok. Pipet larutan stok sebanyak 1, 2, 3, 4, dan 5 ml ke dalam labu takar 100 ml. Larutan asam asetan 1 N ditambahkan sebanyak 0.2, 0.4, 0.6, 0.8 dan 1.0 ml ke dalam masing-masing labu takar. Kemudian tambahkan 2 ml larutan iod (0.2 g I2 dan 2 g KI
20 Larutan dibiarkan 20 menit, lalu diukur absorbansinya dengan menggunakan spektrofotometer pada panjang gelombang 625 nm.
Pengukuran Sampel
Sebanyak 100 mg sampel dimasukkan ke dalam tabung reaksi. Kemudian ditambahkan 1 ml etanol 95 % dan 9 ml larutan NaOH 1 N ke dalam tabung reaksi. Tabung reaksi kemudian dipanaskan dalam penangas air pada suhu 95oC selama 10 menit. Larutan gel pati dipindahkan ke dalam labu takar 100 ml, kemudian ditambahkan air destilata hingga tanda tera dan dihomogenkan. Larutan dipipet sebanyak 5 ml ke dalam labu takar 100 ml. tambahkan 1 ml asam asetat dan 2 ml larutan iod ke dalam labu takar tersebut, lalu ditera dengan air destilata. Larutan dibiarkan selama 20 menit, lalu diukur absorbansinya dengan spektrofotometer pada panjang gelombang 625 nm. Kadar amilosa contoh dapat dihitung dengan persamaan berikut :
Kadar Amilosa (%)
Kadar Amilopektin (%) = Kadar pati – Kadar amilosa
3.6.3
Analisis Fisik
Analisis warna dengan Chromamater CR 300 Minolta (Firmansyah 2003)
Chromameter CR 300 Minolta adalah suatu alat untuk analisis warna secara tristimulus untuk mengukur warna yang dipantulkan oleh suatu permukaan. Data pengukuran dapat berupa nilai absolut maupun nilai selisih dengan standar. Cara kerjanya sebagai berikut, pertama lakukan kalibrasi terlebih dahulu dengan menekan tombol „CALIBRATE‟; masukkan data kalibrasi Y, x dan y yang terdapat pada penutup bagian plat kalibrasi. Kemudian letakkan measuring head pada plat kalibrasi yang berwarna putih, tekan tombol „MEASURE‟. Biarkan alat bekerja secara otomatis sebanyak tiga kali hingga pengukuran selesai. Setelah kalibrasi selesai, pengukuran contoh atau sampel baru bisa dilakukan. Pertama letakkan measuring head pada contoh yang akan diukur, dan tekan tombol „MEASURE‟, biarkan alat bekerja sendiri, tunggu beberapa saat hingga pengukuran selesai. Pengujian warna dilakukan sebanyak dua kali ulangan.
Tabel 5. Nilai HUE dan Daerah Kisaran Warna Kromatisitas
Nilai oHUE Daerah Kisaran Warna Kromatisitas 342-18 Red Purple (RP)
18-54 Yellow Red (YR)
54-90 Yellow (Y)
90-126 Yellow Green (YG) 162-198 Green (G) 198-234 Blue Green (BG) 234-270 Blue (B) 270-306 Blue Purple (BP) 306-342 Purple (P) Sumber : Hutchings (1999)
Hasil analisis uji warna kemudian dikonversi ke dalam nilai oHue. Nilai oHue yang didapat kemudian disesuaikan dengan tabel daerah kisaran warna kromatisasi. Rumus konversi nilai L*ab ke nilai oHue sebagai berikut:
o
21
Bobot Seribu Butir
Sampel yang dipilih memiliki butir yang utuh, baik, dan memiliki panjang hampir sama. Sampel tersebut diambil sebanyak seribu butir kemudian ditimbang menggunakan timbangan analitik untuk diketahui bobotnya. Bobot seribu butir tersebut dibagi 1000 sehingga diketahui bobot rata-rata beras per butir.
Densitas Kamba
Sampel dengan ukuran yang sama dimasukkan ke dalam gelas ukur hingga volume 10 ml dan diketuk-ketuk sebanyak 25 kali. Sampel tersebut kemudian ditimbang. Cara perhitungannya adalah sebagai berikut:
Densitas Kamba (g/ml) = ( ) ( )