Prosiding Kimia-FMIPA ITS
PENGARUH PENAMBAHAN ION I- TERHADAP INHIBISI KOROSI BAJA SS 304 DALAM LARUTAN HCl 1 M DENGAN SENYAWA PURIN/HASIL KONDENSASI
FORMAMIDA
Kartika Anoraga M.*, Dra. Harmami, MS1, Drs. Agus Wahyudi, MS2
Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Teknologi Sepuluh Nopember
Abstrak
Pengaruh penambahan ion I- terhadap inhibisi korosi baja SS 304 dalam larutan HCl 1 M dengan senyawa
purin/hasil kondensasi formamida telah diteliti dengan metode pengurangan berat dan polarisasi potensiodinamik. Hasil penelitian ini menunjukkan bahwa baja SS 304 yang mengandung 18% Cr masih dapat mengalami korosi pada larutan HCl 1 M dengan laju korosi sebesar 4,41 mmpy. Penambahan inhibitor berupa senyawa purin/hasil kondensasi formamida pada variasi konsentrasi 300-1500 ppm dalam larutan HCl 1 M dapat menurunkan laju korosi baja SS 304 hingga 3,04 mmpy. Sedangkan penambahan ion I- (dari larutan KI) sebesar 1,0x10-4 M terhadap larutan
HCl 1 M dengan adanya inhibitor menyebabkan laju korosi baja SS 304 semakin menurun hingga 2,96 mmpy, sehingga efisiensi inhibisinya meningkat dibandingkan efisiensi inhibisi tanpa adanya penambahan ion I- dengan
nilai %EI meningkat dari 77,14% menjadi 92,01%.
Kata kunci: Inhibisi korosi, baja SS 304, ion I-, senyawa purin/hasil kondensasi formamida 1. Pendahuluan
Baja merupakan material kontruksi utama yang secara luas digunakan pada berbagai macam industri, seperti industri nuklir, perminyakan, industri makanan, obat-obatan dan industri elektrokimia. Baja terdapat dalam berbagai jenis, salah satunya adalah baja
stainless steel (SS) tipe 304. Baja SS tipe ini sering
digunakan dalam industri karena memiliki sifat mekanik berupa kekuatan dan keuletan yang memadai,
harganya relatif murah, dan memiliki
resistensi/ketahanan yang baik terhadap korosi (Fouda, 2009). Ketahanan ini berdasarkan pada adanya lapisan pasif pada permukaannya. Namun, dalam proses industri, baja SS 304 sering mengalami proses pickling atau pencucian dengan asam (biasanya asam sulfat atau asam klorida). Asam-asam yang digunakan tersebut bersifat korosif sehingga baja SS 304 yang memiliki kandungan minimal 18% Cr akan larut dan tidak dapat membentuk lapisan pasifnya. Hal ini akan membuat ketahanannya berkurang dan dapat terjadi korosi. Korosi adalah reaksi kimia/elektrokimia antara logam dan lingkungannya yang dapat menurunkan mutu logam. Secara umum, untuk pengendalian lingkungan yang korosif dapat dilakukan dengan pengontrolan pH dan penggunaan inhibitor. Saat ini penggunaan inhibitor merupakan pengendalian korosi yang lebih banyak diteliti, karena mudah dalam penggunaannya dan tidak menyebabkan gangguan
yang signifikan terhadap proses produksi di industri (Scendoa, 2007).
Inhibitor adalah suatu zat yang ditambahkan dalam jumlah kecil secara berkala yang efektif menurunkan laju korosi dengan cara membentuk lapisan pasif (lapisan pelindung) pada permukaan logam. Salah satu inhibitor yang sering digunakan adalah inhibitor organik. Biasanya inhibitor organik adalah senyawa-senyawa organik yang memiliki atom elektronegatif seperti S, N, O dan selebihnya banyak senyawa N-heterosiklik yang merupakan inhibitor yang efektif untuk korosi baja pada media asam, seperti asam klorida (Asan, 2005).
Penggunaan inhibitor organik sintesis terkadang menimbulkan masalah lingkungan, karena pada kenyataannya bahan kimia sintesis adalah bahan kimia yang berbahaya (beracun), harganya lumayan mahal, dan tidak ramah lingkungan. Keamanan dan permasalahan lingkungan akibat inhibitor ini menjadi perhatian khusus selama beberapa puluh tahun terakhir, karena sifat racunnya dapat menyebabkan kerusakan sementara atau permanen pada sistem organ, ginjal, hati, dapat mengganggu proses biokimia dan dapat mengganggu sistem enzim dalam tubuh. Oleh karena itu penggunaan inhibitor yang aman, mudah didapat, bersifat biodegradable, murah, dan ramah lingkungan (green and friendly inhibitors) sangatlah diperlukan (Raja, 2007). Purin dan turunannya merupakan salah satu senyawa organik N-heterosiklik yang aman karena tidak beracun dan bersifat biodegradable, sehingga purin dapat digunakan sebagai inhibitor baru untuk masalah korosi pada baja stainless steel.
* corresponding author phone: +6285731531666 E-mail: kartika.an@gmail.com
1,2 Alamat sekarang: Jurusan Kimia, FMIPA, Institut
Prosiding Kimia-FMIPA ITS
Beberapa penelitian mengenai purin sebagai inhibitor korosi telah banyak dilaporkan. Diantaranya adalah penelitian yang dilakukan oleh Scendoa (2007)
yaitu mengenai pengaruh purin pada korosi tembaga dalam larutan NaCl. Penelitian ini menggunakan variasi konsentrasi inhibitor 1,0x10-4, 0,5x10-4, 1,0x10 -3, 0,5x10-3, dan 1,0x10-2 M dan metode yang
digunakan untuk mengurangi laju korosinya adalah dengan metode pengurangan berat, metode polarisasi, teknik EQCM dan SEM. Hasil metode-metode tersebut sama-sama menunjukkan bahwa purin merupakan inhibitor yang baik untuk tembaga dalam larutan NaCl 1 M dengan pH 6,8. Efisiensi inhibisinya meningkat dengan meningkatnya konsentrasi purin. Efisiensi inhibisi terbesar adalah 76% pada konsentrasi purin 10-2 M.
Yan, dkk (2008) meneliti senyawa-senyawa purin sebagai inhibitor korosi baja lunak dalam media HCl 1 M ditinjau dari elektrokimia dan studi kimia kuantum. Senyawa-senyawa purin yang digunakan adalah guanin, adenin, 2,diaminopurin, 6-thioguanin, dan 2,6-dithiopurin dengan variasi konsentrasi 1,0x10-5, 3,2x10-5, 1,0x10-4, 3,2x10-4, dan
1,0x10-3 M. Metode yang digunakan untuk
mengurangi laju korosinya adalah dengan metode pengurangan berat, uji elektrokimia dan perhitungan secara kimia kuantum. Hasilnya menunjukkan bahwa efisiensi inhibisi meningkat dengan meningkatnya konsentrasi inhibitor dengan urutan sebagai berikut: 2,6-dithiopurin > 6-thioguanin > 2,6-diaminopurin > adenin > guanin. Efisiensi inhibisi terbesar adalah 88% pada 1,0x10-3 M 2,6-dithiopurin. Perhitungan
secara kimia kuantum menunjukkan adsorpsinya adalah adsorpsi fisika yang terjadi karena interaksi ikatan π antara elektron π dari purin dengan permukaan logam.
Penelitian lainnya juga dilakukan oleh Li, dkk (2009) yang menggunakan senyawa turunan purin yaitu 6-benzilaminopurin sebagai inhibitor cold rolled
steel (CRS) dalam larutan HCl 1 M. Penelitiannya
mengenai adsorpsi dan efek inhibisi dari 6-benzilaminopurin pada CRS dalam larutan HCl 1 M pada suhu 25°-50°C dengan variasi konsentrasi 5, 10, 20, 30, 40, 50, 70 dan 100 mg/L. Metodenya adalah dengan metode pengurangan berat dan metode polarisasi. Hasilnya menunjukkan bahwa senyawa tersebut merupakan inhibitor yang baik dengan efisiensi inhibisi yang terus meningkat dengan meningkatnya konsentrasi inhibitor. Efisiensi inhibisi maksimumnya adalah sebesar 95,8% pada konsentrasi inhibitor sebesar 100 mg/L. Adsorpsinya mengikuti adsorpsi isoterm Langmuir.
Dari berbagai penelitian tersebut diatas, menunjukkan bahwa purin dan turunannya merupakan senyawa organik yang baik sebagai inhibitor korosi dengan efisiensi inhibisi rata-rata diatas 70%. Namun,
pada penelitian yang dilakukan oleh Amin, dkk (2009) mengenai efek sinergisitas ion I- pada inhibisi korosi
Al dalam larutan H3PO4 1 M dengan purin
menunjukkan bahwa efek purin sendiri sebagai inhibitor korosi adalah rendah, sehingga perlu
ditambahkan ion I- (dari larutan KI) untuk
meningkatkan efek inhibisi dari purin tersebut. Hasil penelitian ini menunjukkan bahwa efisiensi inhibisi terbesar dari purin sendiri adalah 55,01% pada konsentrasi purin 1,0x10-2 M sedangkan efisiensi
inhibisi terbesar dari purin yang ditambahkan ion I
-adalah 94,07% pada konsentrasi purin 1,0x10-2 M
dengan konsentrasi I- 1,0x10-4 M. Berdasarkan hasil
tersebut diperoleh kesimpulan bahwa ion I
-memberikan efek sinergis pada purin untuk inhibitor korosi pada logam Al dalam larutan H3PO4 1 M.
Berdasarkan penelitian tersebut diatas,
menunjukkan bahwa purin dengan adanya ion I
-efektif sebagai inhibitor korosi pada logam Al. Namun demikian, masih harus diuji lagi penggunaan purin tanpa dan dengan penambahan ion I- sebagai inhibitor
korosi baja SS 304 dalam media HCl. Akan tetapi, karena harga purin relatif mahal di pasaran, maka pada penelitian ini akan diuji penggunaan senyawa purin/hasil kondensasi formamida sebagai inhibitor korosi pada baja SS 304 dalam media HCl 1 M tanpa dan dengan penambahan ion I-.
2. Metodologi
2.1 Pembuatan Spesimen Baja SS 304
Baja SS 304 yang berbentuk lembaran dengan ketebalan 0,1 cm dipersiapkan untuk metode pengurangan berat dan polarisasi. Untuk metode pengurangan berat, baja dipotong persegi dengan ukuran 3x3 cm. Sedangkan untuk metode polarisasi, baja dipotong silinder dengan diameter 1,4 cm. Permukaan baja yang telah dipotong, kemudian digosok dengan kertas ampelas grade 500 dan 1000 secara berturut-turut, lalu dicuci dengan aquabidest dan aseton, dan terakhir dikeringkan.
2.2 Pembuatan Media Pengkorosi 2.2.1 Pembuatan Larutan HCl 1 M
Larutan HCl pekat (37%) sebanyak 82,9 ml dimasukkan ke dalam labu ukur 1 L yang telah berisi beberapa ml aquabidest, kemudian diencerkan dengan aquabidest sampai tanda batas sehingga diperoleh konsentrasi HCl 1 M. Larutan HCl 1 M kemudian distandarisasi dengan larutan NaOH yang telah distandarisasi dengan larutan asam oksalat.
2.2.2 Pembuatan Media Pengkorosi dengan Inhibitor tanpa dan dengan penambahan I
-Inhibitor yang digunakan dalam penelitian ini adalah senyawa purin/hasil kondensasi formamida. Inhibitor ditimbang sebanyak 1,5000 gram, lalu
Prosiding Kimia-FMIPA ITS
dimasukkan ke dalam labu ukur 1 L dan ditambahkan larutan HCl 1 M hingga tanda batas, sehingga diperoleh media pengkorosi HCl dengan konsentrasi inhibitor 1500 ppm. Media pengkorosi HCl dengan variasi konsentrasi inhibitor 300, 600, 900, dan 1200 ppm dapat dibuat dari media pengkorosi HCl dengan konsentrasi inhibitor 1500ppm menggunakan prinsip pengenceran. Data komposisi media pengkorosi yang digunakan dapat dilihat dalam tabel 2.1.
Tabel 2.1 Komposisi media pengkorosi baja SS 304 Media Pengkorosi HCl (M) Inhibitor (ppm) KI (M) I 1 - - II 1 300 - III 1 600 - IV 1 900 - V 1 1200 - VI 1 1500 - VII 1 300 1,0x10-4 VIII 1 600 1,0x10-4 IX 1 900 1,0x10-4 X 1 1200 1,0x10-4 XI 1 1500 1,0x10-4
2.3 Metode Pengurangan Berat
Spesimen baja SS 304 yang telah dipersiapkan untuk metode pengurangan berat ini, mula-mula ditimbang dan dicatat berat awalnya. Baja kemudian direndam masing-masing pada media pengkorosi seperti pada tabel 2.1, selama 3 jam pada suhu kamar. Setelah proses perendaman, baja dicuci dengan aquabidest dan aseton secara berturut-turut lalu dikeringkan dan ditimbang berat akhirnya. Perlakuan ini dilakukan secara truplo. Perhitungan Efisiensi inhibisi dilakukan saat akhir keseluruhan proses metode ini. Efisiensi inhibisi dihitung dengan menggunakan persamaan 2.1.
(2.1)
dimana w0 adalah pengurangan berat baja dalam
larutan uji tanpa inhibitor, dan wi adalah pengurangan
berat baja dalam larutan uji dengan inhibitor tanpa dan dengan penambahan ion I- 1,0x10-4 M. Pengukuran
fraksi dari permukaan baja yang dilapisi oleh molekul adsorben (θ) dapat dihitung dengan persamaan:
(2.2) 2.4 Metode Polarisasi Potensiodinamik
Metode ini dilakukan untuk mengetahui nilai parameter korosi (arus korosi, potensial korosi, konstanta Tafel katodik dan anodik). Instrumen yang
digunakan adalah potensiostat tipe PGS 201 T dengan sistem 3 elektroda. Elektroda acuan adalah tipe calomel (SCE), elektroda pembanding berupa platina dan elektroda kerja adalah spesimen baja berbentuk silinder. Elektroda kerja, elektroda bantu, dan elektroda pembanding dirangkai menjadi suatu sel dengan larutan elektrolit dari media pengkorosi yang telah dibuat. Kemudian sistem tersebut dihubungkan dengan potensiostat dan komputer untuk membaca data yang diperoleh. Metode polarisasi dilakukan pada suhu kamar. Efisiensi inhibisi (EI) dihitung menggunakan persamaaan 2.3.
(2.3)
dimana Io merupakan densitas arus korosi pada media
pengkorosi tanpa inhibitor dan Ii pada media
pengkorosi dengan inhibitor.
3. Hasil dan Pembahasan 3.1 Metode Pengurangan Berat
Metode pengurangan berat merupakan metode yang sederhana untuk menentukan laju korosi dan efisiensi inhibisi. Pengurangan berat tersebut terjadi karena logam larut menjadi keadaan teroksidasinya akibat reaksi kimia antara logam dengan lingkungannya. Pada metode ini akan diperoleh hasil berupa selisih pengurangan berat dari baja SS 304 dalam larutan uji tanpa dan dengan penambahan inhibitor berupa senyawa purin hasil sintesis formamida. Hasil ini secara langsung dapat digunakan untuk menentukan nilai efisiensi inhibisinya.
3.1.1 Hasil inhibisi Korosi Baja SS 304 tanpa dan dengan Senyawa Purin/Hasil Kondensasi Formamida
Hubungan antara konsentrasi inhibitor dengan pengurangan berat spesimen yang telah direndam selama 3 jam pada suhu kamar dalam larutan HCl 1 M dan dengan variasi konsentrasi inhibitor ditunjukkan pada Tabel 3.1. Pada Tabel 3.1, terlihat bahwa semakin besar konsentrasi inhibitor yang ditambahkan pada range 300-1500 ppm, maka pengurangan berat rata-rata (w) baja SS 304 semakin berkurang, sehingga efisiensi inhibisinya (%EI) dan fraksi pelingkupan permukaan baja (θ) semakin besar. Hal tersebut berarti bahwa semakin besar konsentrasi inhibitor pada range 300-1500 ppm maka laju korosi baja SS 304 semakin menurun.
Berdasarkan data pada Tabel 3.1, diperoleh bahwa efisiensi inhibisi (%EI) terbesar pada penelitian ini adalah 77,14% pada konsentrasi inhibitor 1500 ppm dari range 300-1500 ppm. Data tersebut juga menunjukkan bahwa efisiensi inhibisi berbanding lurus dengan fraksi pelingkupan (θ) permukaan logam oleh molekul inhibitor. Lapisan adsorpsi yang
Prosiding Kimia-FMIPA ITS
terbentuk pada permukaan logam menunjukkan adanya suatu lapisan pembatas antara media pengkorosi dengan permukaan logam secara langsung sehingga dapat menurunkan laju korosi. Fraksi dari permukaan yang dilapisi oleh molekul inhibitor tertinggi diperoleh pada konsentrasi 1500 ppm dengan nilai 0,7714.
Tabel 3.1 Data efisiensi inhibisi dalam larutan uji dengan metode pengurangan berat
Konsentrasi Inhibitor (ppm) (gram) ∆ (%) EI θ 0 300 600 900 1200 1500 0,0179 ± 5,77x10-5 0,0108 ± 1,15x10-4 0,0086 ± 1,53x10-4 0,0074 ± 5,77x10-5 0,0053 ± 5,77x10-5 0,0041 ± 1,00x10-4 0 39,59 51,86 58,55 70,26 77,14 0 0,3959 0,5186 0,5855 0,7026 0,7714 Berdasarkan hasil %EI pada Tabel 3.1, maka diperoleh pola inhibisi inhibitor pada baja SS 304. Pola inhibisi tersebut ditunjukkan pada Gambar 3.1.
Gambar 3.1 Grafik hubungan efisiensi inhibisi dengan variasi konsentrasi inhibitor
Pola yang diperoleh pada penelitian ini, menunjukkan pola yang sama dengan penelitian Scendo, 2007, dimana efisiensi inhibisi meningkat seiring dengan meningkatnya konsentrasi inhibitor (purin) pada tembaga dalam larutan NaCl 1 M, dengan %EI terbesarnya adalah 76% pada konsentrasi purin 1x10-2 M. Hasil ini juga memiliki pola yang sama
dengan 2 penelitian Scendo yang menggunakan turunan purin berupa adenin sebagai inhibitor pada
tembaga dalam larutan NaCl 1 M dan larutan Na2SO4
0,5 M. Hasilnya menunjukkan bahwa adenin efektif menurunkan laju korosi pada tembaga dalam kedua larutan tersebut (Scendo, 2008).
3.1.2 Hasil Inhibisi Korosi Baja SS 304 Dengan
Senyawa Purin / Hasil Kondensasi
Formamida Dan Penambahan Ion I-
Penelitian ini juga dilakukan dengan
menambahkan ion I- (dari larutan KI) pada variasi
konsentrasi inhibitor dari 300-1500 ppm dalam larutan uji. Tujuannya adalah untuk mengetahui pengaruh penambahan ion I- tersebut pada proses inhibisi korosi
baja SS 304 dengan senyawa purin/hasil kondensasi formamida. Data efisiensi inhibisi dengan penambahan ion I- 1,0x10-4 M pada variasi konsentrasi inhibitor
dalam larutan uji dengan metode pengurangan berat ditunjukkan pada Tabel 3.2.
Tabel 3.2 Data efisiensi inhibisi dalam larutan uji dengan penambahan ion I- 1,0x10-4 M
Konsentrasi Inhibitor (ppm) (gram) ∆ (%) EI θ 0 300 600 900 1200 1500 - 0,0019 ± 5,77x10-5 0,0018 ± 5,77x10-5 0,0017 ± 5,77x10-5 0,0016 ± 1,00x10-4 0,0014 ± 5,77x10-5 - 89,03 89,77 90,33 91,08 92,01 - 0,8903 0,8977 0,9033 0,9108 0,9201 Tabel 3.2 menunjukkan pola yang sama dengan larutan uji tanpa penambahan ion I- (Tabel 3.1). Kedua
tabel tersebut menunjukkan bahwa efisiensi inhibisinya meningkat seiring dengan meningkatnya konsentrasi inhibitor (300-1500 ppm) baik tanpa
maupun dengan penambahan ion I- sebesar
1,0x10-4 M.
Berdasarkan data pada Tabel 3.2, terlihat bahwa semakin besar konsentrasi inhibitor dari 300-1500
ppm dengan penambahan ion I- 1,0x10-4 M
mengakibatkan efisiensi inhibisinya semakin besar.
Hal ini menunjukkan bahwa penambahan ion I
-meningkatkan efisiensi inhibisi inhibitor pada baja SS 304 dalam larutan uji. Namun pengurangan berat rata-rata baja SS 304 memiliki selisih yang kecil dengan bertambahnya konsentrasi inhibitor. Hal tersebut dapat terjadi karena konsentrasi ion I- yang ditambahkan
tetap. Pola efisiensi inhibisi tanpa dan dengan penambahan ion I- dapat dilihat pada Gambar 3.2.
Gambar 3.2 Grafik hubungan Efisiensi Inhibisi dengan variasi konsentrasi inhibitor
0 50 100 0 300 600 900 1200 1500 E fis ie n si In h ib is i (% ) Inhibitor (ppm) 0 20 40 60 80 100 0 300 600 900 1200 1500 E fis ie n si In h ib is i (% ) Inhibitor (ppm) tanpa dengan
I-Prosiding Kimia-FMIPA ITS
Pola yang sama juga ditunjukkan pada penelitian Rehim, (2008), yang menggunakan turunan purin berupa adenin. Pada penelitian ini, ion I- yang
ditambahkan sebesar 0,005 M dan 0,001 M pada larutan asam sulfat 4 M dengan adenin sebagai inhibitor pada low carbon steel (LCS) juga meningkatkan efisiensi inhibisinya.
3.2 Metode Polarisasi Potensiodinamik
Metode polarisasi potensiodinamik bertujuan untuk mengetahui seberapa besar arus korosi (Ikor),
potensial korosi (Ekor), dan konstanta tafel anodik dan
katodik (βa dan βc) dari baja SS 304 dalam larutan uji
tanpa dan dengan penambahan inhibitor serta dengan inhibitor yang ditambahkan ion I-. Parameter korosi
tersebut dapat diperoleh dengan cara menggunakan ekstrapolasi tafel dari hasil polarisasi. Hasil yang diperoleh dari metode ini adalah berupa kurva polarisasi katodik dan anodik baja SS 304 dalam larutan uji.
3.2.1 Hasil Inhibisi Korosi Baja SS 304 Tanpa dan dengan Senyawa Purin/Hasil Kondensasi
Formamida serta dengan Senyawa
Purin/Hasil Kondensasi Formamida yang ditambahkan ion I-
Kurva polarisasi katodik dan anodik baja SS 304 dalam larutan HCl 1 M tanpa dan dengan penambahan inhibitor serta dengan inhibitor yang ditambahkan ion I- ditunjukkan pada Gambar 3.3, 3.4
dan 3.5. Gambar 3.3 dan 3.4 menunjukkan arus yang dihasilkan pada proses polarisasi semakin menurun seiring dengan bertambahnya konsentrasi inhibitor dari 300 ppm sampai 1500 ppm. Hasil ini mengindikasikan bahwa inhibitor dapat menginhibisi laju korosi baja SS 304 secara efektif dengan bertambahnya konsentrasi inhibitor sampai pada konsentrasi 1500 ppm. Sedangkan, pada konsentrasi tersebut menghasilkan arus korosi terkecil akibat adsorpsi molekul inhibitor terjadi pada sisi aktif permukaan logam sehingga memperlambat proses korosinya. Hasil dari kurva polarisasi tersebut menunjukkan pola yang sama dengan metode pengurangan beratnya, yaitu pada konsentrasi inhibitor yang semakin besar pada range 300-1500 ppm diperoleh efisiensi inhibisi yang semakin besar pula.
Gambar 3.5 menunjukkan arus yang dihasilkan dengan penambahan ion I- 1,0x10-4 M dalam larutan
HCl 1 M dengan konsentrasi inhibitor 1500 ppm menurun jika dibandingkan dengan tanpa penambahan I- pada konsentrasi yang sama. Penurunan arus ini
menunjukkan bahwa proses inhibisi senyawa purin/hasil kondensasi formamida yang ditambah ion I- lebih efektif untuk mengurangi laju korosi baja SS
304 dalam larutan HCl 1 M dari 3,04 mmpy menjadi 2,96 mmpy. Hasil ini menunjukkan pola yang sama
dengan metode pengurangan beratnya, yaitu ion I
-yang ditambahkan menyebabkan efisiensi inhibisinya semakin besar dengan efisiensi inhibisi terbesar diperoleh pada konsentrasi inibitor sebesar 1500 ppm. Nilai %EI terbesar dengan adanya ion I- hasil metode
ini mencapai 32,84%.
Gambar 3.3 Kurva polarisasi baja SS 304 dalam larutan: (1) HCl 1 M, (2) HCl 1 M dengan senyawa purin 300 ppm, (3) HCl 1 M dengan senyawa purin 600 ppm
Gambar 3.4 Kurva polarisasi baja SS 304 dalam larutan: (4) HCl 1 M dengan senyawa purin 900 ppm, (5) HCl 1 M dengan senyawa purin 1200 ppm, (6) HCl 1 M dengan senyawa purin 1500 ppm
Gambar 3.5 Kurva polarisasi baja SS 304 dalam larutan: (6) HCl 1 M dengan senyawa purin 1500 ppm tanpa KI 1,0x10-4 M
dan (7) HCl 1 M dengan senyawa purin 1500 ppm dengan KI 1,0x10-4 M 1 3 2 Potensial (E) mV Potensial (E) mV Potensial (E) mV 6 5 4 6 7
Prosiding Kimia-FMIPA ITS
Parameter korosi baja SS 304 di dalam larutan HCl 1 M tanpa dan dengan variasi konsentrasi inhibitor serta dengan adanya ion I- pada konsentrasi
inhibitor sebesar 1500 ppm ditunjukkan pada Tabel 3.3. Berdasarkan Tabel 3.3 dapat ditarik hubungan antara konsentrasi larutan uji yang digunakan dengan laju korosi yang diperoleh (r). Hubungan tersebut ditunjukkan pada Gambar 3.6.
Tabel 3.3 Parameter korosi baja SS 304 dalam larutan uji
Gambar 3.6 Hubungan antara konsentrasi inhibitor dengan laju korosi (r)
Berdasarkan Gambar 3.6 tersebut terlihat bahwa baja SS 304 yang mengandung 18% Cr dalam larutan HCl 1 M masih dapat mengalami korosi dengan laju korosi sebesar 4,41 mmpy. Penambahan inhibitor dari 300 ppm-1500 ppm, menunjukkan laju korosinya semakin menurun, dengan laju korosi paling rendah diperoleh pada konsentrasi inhibitor sebesar 1500 ppm. Hal ini, menunjukkan bahwa pada konsentrasi tersebut terjadi proses inhibisi yang lebih efektif dibandingkan konsentrasi inhibitor 300-1200 ppm. Laju korosi baja SS 304 dalam larutan HCl 1 M dengan adanya inhibitor yang ditambahkan pada range 300-1500 ppm menurun dari 4,41 mmpy menjadi 3,04 mmpy.
Berdasarkan Tabel 3.3 juga menunjukkan hubungan antara konsentrasi inhibitor dengan
potensial korosi. Potensial korosi yang dihasilkan cenderung naik turun, karena pelapisan baja SS 304 oleh inhibitor tidak merata dan tidak stabil. Namun, proses inhibisi korosi tetap berlangsung, karena nilai Ikor terus menurun saat ditambahkan inhibitor pada
variasi konsentrasi 300-1500 ppm.
Data konstanta tafel anodik (βa) dan katodik (βc) yang ditunjukkan pada Tabel 3.3 juga tidak beraturan. Data ini dapat dilihat dengan naik turunnya βa dan βc, seiring dengan meningkatnya konsentrasi inhibitor dari 300 ppm-1500 ppm. Nilai βa yang tidak beraturan mengindikasikan bahwa adsorpsi yang terjadi pada permukaan logam adalah fisisorpsi. Fisisorpsi ini menandakan ikatan yang terjadi antara inhibitor dengan permukaan logam dapat putus dan terikat kembali. Sedangkan nilai βc yang tidak beraturan menunjukkan bahwa inhibitor kurang optimal untuk menurunkan reaksi katodik pada logam. Namun, berdasarkan kurva polarisasinya terlihat bahwa inhibitor berupa senyawa purin/hasil kondensasi formamida dapat mempengaruhi reaksi anodik dan katodiknya (terlihat dari pergeseran kurva polarisasi dengan inhibitor) sehingga senyawa purin/hasil kondensasi formamida termasuk inhibitor campuran.
Hasil yang diperoleh pada penelitian ini, memiliki pola yang sama dengan penelitian Yan, dkk (2009). Kurva polarisasi hasil penelitian tersebut menunjukkan bahwa senyawa-senyawa purin yang digunakan (adenin, guanin, diaminopurin, 6-thioguanin, 2,6-dithiopurin) termasuk inhibitor campuran karena mempengaruhi reaksi anodik dan katodiknya. Selain itu, kurva polarisasinya juga menunjukkan nilai Ekor,
βa dan βc yang tidak beraturan. Sedangkan nilai Ikor
menurun dengan adanya senyawa-senyawa purin tersebut sehingga efisiensi inhibisinya semakin
meningkat dengan meningkatnya konsentrasi
senyawa-senyawa purin.
3.3 Mekanisme Adsorpsi Senyawa Purin/Hasil Kondensasi Formamida
Inhibitor korosi dapat bekerja mengurangi laju korosi dengan berbagai cara. Salah satunya adalah melalui proses adsorpsi inhibitor pada permukaan logam. Proses tersebut dapat mengurangi laju korosi dengan cara menaikkan atau menurunkan reaksi anodik/katodik, menurunkan laju difusi reaktan ke permukaan logam dan menurunkan resistansi elektrik dari permukaan logam (Raja, 2007).
Proses adsorpsi senyawa organik pada permukaan logam dapat dijelaskan dengan 2 tipe interaksi, yaitu fisisorpsi dan kemisorpsi. Fisisorpsi terjadi karena interaksi elektrostatik antara inhibitor dengan logam. Sedangkan kemisorpsi terjadi karena transfer muatan antara molekul inhibitor dengan permukaan logam sehingga membentuk ikatan koordinasi (Amin, 2009).
0 1 2 3 4 5 0 300 600 900 1200 1500 L aj u k o ro si (m m p y ) Inhibitor (ppm) Konsentrasi inhibitor (ppm) Ekor
(mV) (µA/cmIkor 2) (mV) βc (mV) βa (mmpy) r %EI
0 -591,4 424,56 -269,4 1222,2 4,41 0 300 -582,1 393,93 -259,4 984,3 4,09 7,21 600 -586,4 348,57 -266,4 788,2 3,62 17,90 900 -588,5 311,85 -212,3 630,8 3,24 26,55 1200 -587,3 304,19 -209,5 659,6 3,16 28,35 1500 -591,4 292,57 -206,8 586,7 3,04 31,09 1500 + I -1,0x10-4 M -591,6 285,12 -205,8 665,5 2,96 32,84
Prosiding Kimia-FMIPA ITS
Senyawa purin/hasil kondensasi formamida sebagai inhibitor pada penelitian ini, merupakan basa organik yang terprotonasi dalam larutan asam (Gambar 3.7). Proses protonasi ini dapat menurunkan jumlah H+
dalam larutan uji sehingga pembentukan H2 yang
menyebabkan korosi pada baja berkurang atau dengan kata lain proses protonasi ini dapat menurunkan reaksi katodik pada logam sehingga laju korosinya menurun.
N N NH N H+ + N N NH N H R R
Gambar 3.7 Mekanisme protonasi inhibitor dalam larutan asam
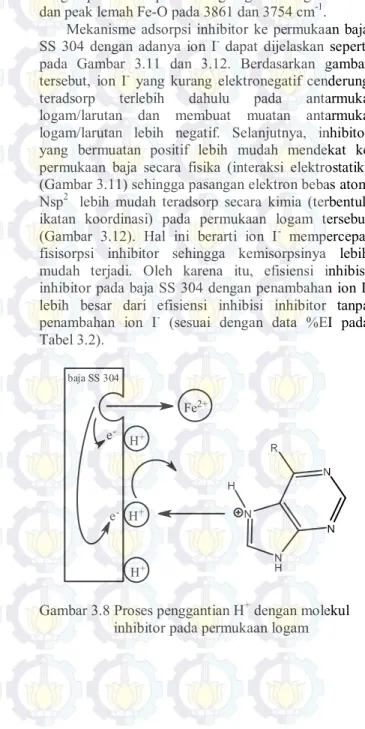
Mekanisme adsorpsi inhibitor pada permukaan baja SS 304 diduga dimulai dengan fisisorpsi. Fisisorpsi terjadi karena interaksi elektrostatik antara molekul inhibitor dengan permukaan logam. Interaksi ini terjadi akibat tergantikannya H+ pada permukaan
logam oleh molekul inhibitor yang telah terprotonasi (Gambar 3.8). Fisisorpsi ini dibuktikan dari nilai βa
yang tidak beraturan (sesuai dengan Tabel 3.3). Namun, interaksi elektrostatik ini lemah sehingga tidak akan terbentuk ikatan yang kuat antara molekul inhibitor dengan logam. Kemudian, setelah interaksi tersebut, pasangan elektron bebas atom Nsp2 yang
tidak terdelokalisasi ke cincin pirimidin akan teradsorp ke permukaan logam sehingga terbentuk ikatan koordinasi (kemisorpsi). Kemisorpsi ini menunjukkan terbentuknya suatu lapisan pembatas antara logam dengan larutan yang dapat menurunkan kontak logam dengan larutan yang korosif sehingga reaksi oksidasi logam (Fe) berkurang. Kemisorpsi ini ditunjukkan pada data spektra IR inhibitor pada baja (Gambar 3.9). Pada spektra IR tersebut (Gambar 3.9) terdapat peak Fe-N pada bilangan gelombang 474,50 cm-1 yang
menunjukkan adanya ikatan koordinasi antara pasangan elektron bebas atom N inhibitor dengan logam (Fe). Selain itu, pada spektra tersebut juga terdapat peak lemah Fe-O pada 3761,32 cm-1. Ikatan
Fe-O ini terjadi antara molekul inhibitor yang memiliki gugus karbonil seperti sitosin dan 4(3H)-pirimidinon dengan logam (Fe). Spektra IR senyawa purin/hasil kondensasi formamida pada baja SS 304 (Gambar 3.9) memiliki kemiripan dengan spektra IR senyawa purin/hasil kondensasi formamida seperti yang terlampir pada lampiran F. Gambar 3.9 juga menunjukkan gugus-gugus yang terdapat dalam senyawa purin/hasil kondensasi formamida seperti
gugus C-N pada 1060,88 cm-1, N-heteroaromatik
cincin purin pada 1431,23 cm-1, gugus karbonil (C=O)
pada 1627,97 cm-1 dan gugus N-H pada 3383,26 cm-1.
Secara umum mekanisme adsorpsi inhibitor pada permukaan baja dapat dijelaskan pada Gambar 3.10.
Mekanisme adsorpsi senyawa purin/hasil kondensasi formamida pada permukaan baja SS 304 pada penelitian ini sesuai dengan mekanisme adsorpsi pada penelitian yang dilakukan oleh Li, dkk (2009). Pada penelitian tersebut, inhibitor yang digunakan adalah turunan purin, yaitu 6-benzilaminopurin. Mekanisme adsorpsinya juga didahului fisisorpsi dan diikuti kemisorpsi. Kemisorpsi yang terjadi ditunjukkan dengan adanya ikatan koordinasi antara pasangan elektron bebas atom N dan O dengan orbital kosong logam (Fe). Kemisorpsi ini ditunjukkan
dengan peak Fe-N pada bilangan gelombang 473 cm-1
dan peak lemah Fe-O pada 3861 dan 3754 cm-1.
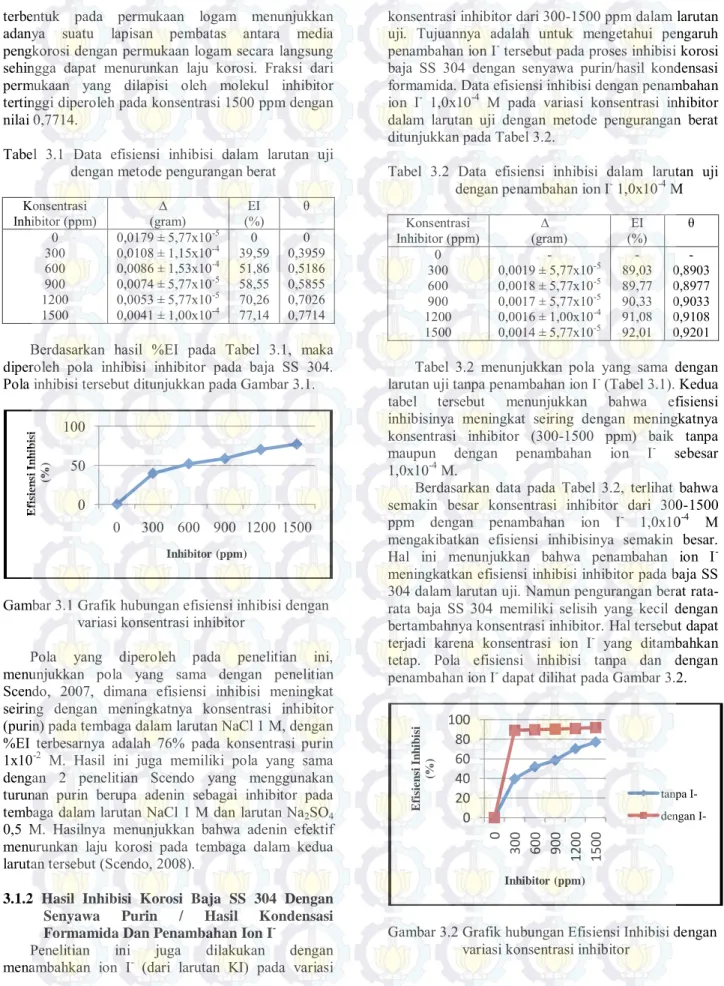
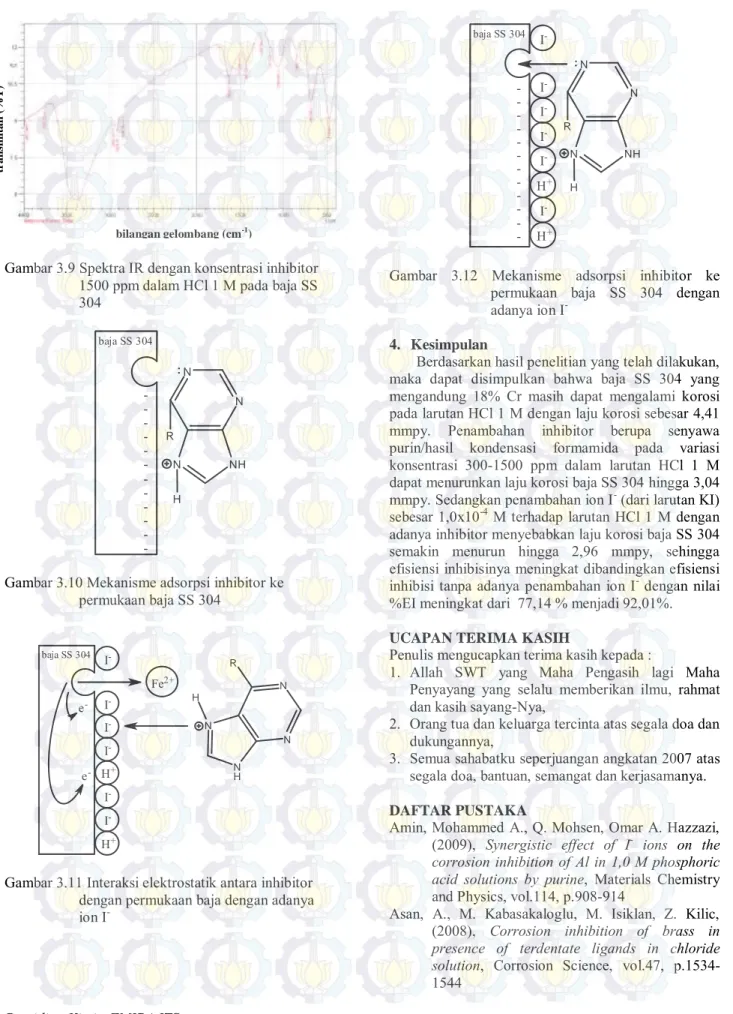
Mekanisme adsorpsi inhibitor ke permukaan baja SS 304 dengan adanya ion I- dapat dijelaskan seperti
pada Gambar 3.11 dan 3.12. Berdasarkan gambar tersebut, ion I- yang kurang elektronegatif cenderung
teradsorp terlebih dahulu pada antarmuka
logam/larutan dan membuat muatan antarmuka logam/larutan lebih negatif. Selanjutnya, inhibitor yang bermuatan positif lebih mudah mendekat ke permukaan baja secara fisika (interaksi elektrostatik) (Gambar 3.11) sehingga pasangan elektron bebas atom Nsp2 lebih mudah teradsorp secara kimia (terbentuk
ikatan koordinasi) pada permukaan logam tersebut (Gambar 3.12). Hal ini berarti ion I- mempercepat
fisisorpsi inhibitor sehingga kemisorpsinya lebih mudah terjadi. Oleh karena itu, efisiensi inhibisi
inhibitor pada baja SS 304 dengan penambahan ion I
-lebih besar dari efisiensi inhibisi inhibitor tanpa penambahan ion I- (sesuai dengan data %EI pada
Tabel 3.2). N N N N H H+ H+ H+ Fe2+ baja SS 304 e -e -R H
Gambar 3.8 Proses penggantian H+ dengan molekul
Prosiding Kimia-FMIPA ITS
Gambar 3.9 Spektra IR dengan konsentrasi inhibitor 1500 ppm dalam HCl 1 M pada baja SS 304 baja SS 304 -N N N NH H R
Gambar 3.10 Mekanisme adsorpsi inhibitor ke permukaan baja SS 304 baja SS 304 I -I -I -H+ I -I -H+ I -N N N N H H e -e -Fe2+ R
Gambar 3.11 Interaksi elektrostatik antara inhibitor dengan permukaan baja dengan adanya ion I -baja SS 304 -I -I -I -I -H+ I -H+ I -N N N NH H R
Gambar 3.12 Mekanisme adsorpsi inhibitor ke permukaan baja SS 304 dengan adanya ion I
-4. Kesimpulan
Berdasarkan hasil penelitian yang telah dilakukan, maka dapat disimpulkan bahwa baja SS 304 yang mengandung 18% Cr masih dapat mengalami korosi pada larutan HCl 1 M dengan laju korosi sebesar 4,41 mmpy. Penambahan inhibitor berupa senyawa purin/hasil kondensasi formamida pada variasi konsentrasi 300-1500 ppm dalam larutan HCl 1 M dapat menurunkan laju korosi baja SS 304 hingga 3,04 mmpy. Sedangkan penambahan ion I- (dari larutan KI)
sebesar 1,0x10-4 M terhadap larutan HCl 1 M dengan
adanya inhibitor menyebabkan laju korosi baja SS 304 semakin menurun hingga 2,96 mmpy, sehingga efisiensi inhibisinya meningkat dibandingkan efisiensi inhibisi tanpa adanya penambahan ion I- dengan nilai
%EI meningkat dari 77,14 % menjadi 92,01%.
UCAPAN TERIMA KASIH
Penulis mengucapkan terima kasih kepada :
1. Allah SWT yang Maha Pengasih lagi Maha Penyayang yang selalu memberikan ilmu, rahmat dan kasih sayang-Nya,
2. Orang tua dan keluarga tercinta atas segala doa dan dukungannya,
3. Semua sahabatku seperjuangan angkatan 2007 atas segala doa, bantuan, semangat dan kerjasamanya.
DAFTAR PUSTAKA
Amin, Mohammed A., Q. Mohsen, Omar A. Hazzazi, (2009), Synergistic effect of I- ions on the
corrosion inhibition of Al in 1,0 M phosphoric acid solutions by purine, Materials Chemistry
and Physics, vol.114, p.908-914
Asan, A., M. Kabasakaloglu, M. Isiklan, Z. Kilic, (2008), Corrosion inhibition of brass in
presence of terdentate ligands in chloride solution, Corrosion Science, vol.47,
p.1534-1544 tr an sm it an ( %T ) bilangan gelombang (cm-1)
Prosiding Kimia-FMIPA ITS
Fouda, A.S., Ellithy, A.S., (2009), Inhibition Effect of
4-Phenyltiazole derivatives on corrosion of 304L Stainless Steel in HCl Solution, Cairo,
Egypt
Li, Xianghong, Shuduan Deng, Hui Fu, Taohong Li, (2009), Adsorpsion and inhibition effect of
6-benzylaminopurine on cold rolled steel in 1,0 M HCl, Electrochimica Acta, vol.54, p.
4089-4098
Raja, P. Bothi, M.G. Sethuraman, (2008), Natural
products as corrosion inhibitor for metals in corrosive media - A review, Materials Letters,
vol.62, p.113-116
Scendoa, M., (2007), The effect of purine on the corrosion of copper in chloride solutions,
Corrosion Science, vol49, p. 373-390
Yan, Ying, Weihua Li, Lankun Cai, Baorong Hou, (2008), Electrochemical and quantum chemical
study of purines as corrosion inhibitors for mild steel in 1 M HCl solution, Electrochimica