Kurikulum Berbasis Kompetensi PSPD FK ULM TA 2018/2019 hal 1
BLOK KETERAMPILAN KLINIK DASAR 1
KELUHAN BERKAITAN DENGAN SISTEM RESPIRASI
1. PENDAHULUAN
Blok keterampilan klinis dasar 1 akan dilaksanakan pada semester 3 dalam waktu 18 minggu. Selama 18 minggu ini, mahasiswa diharapkan memiliki keterampilan teknik komunikasi efektif dan teknik pemeriksaan terkait keluhan dan penyakit beberapa sistem. Program pembelajaran aktif yang akan dilaksanakan yaitu dengan melakukan pengembangan dan inovasi dalam dunia pendidikan kedokteran. Salah satu yang telah disepakati untuk dikembangkan adalah program pembelajaran dan pelatihan kemampuan keterampilan sesuai dengan standar kompetensi dokter Indonesia. Program ini bertujuan untuk memaparkan pengetahuan, pengalaman, dan kemampuan keterampilan klinik kepada mahasiswa kedokteran sedini mungkin.
2. TUJUAN BLOK
Setelah menyelesaikan blok ini, mahasiswa diharap mampu: a. Melakukan anamnesis keluhan sistem respirasi
b. Melakukan pemeriksaan fungsi paru
c. Melakukan pengecatan Ziehl-Neelsen dan Gram d. Melakukan pembacaan X-Ray Thorax
3. PRAKTIK KETERAMPILAN
Skill lab terdiri atas pembelajaran kemampuan dan keterampilan anamnesis,pemeriksaan fisik diagnostik, pemeriksaan penunjang, keterampilan prosedural, dan keterampilan terapeutik. Pada blok ini terdapat 9 topik keterampilan, dan masing-masing keterampilan dilatihkan sebanyak 2 kali selama 3 jam.
4. PENILAIAN a. Formatif
Prasyarat ujian :
- Kehadiran skill lab : 100%
- Etika pada skill lab : sufficient (berbasis checklist) b. Sumatif, terdiri atas :
Kurikulum Berbasis Kompetensi PSPD FK ULM TA 2018/2019 hal 2 - posttest : 15 % - Skill : 25% - Ujian OSCE : 55% NBL Ujian OSCE = 70 c. Standar Penilaian
Penilaian Acuan Patokan (PAP)/ criterion-reference dengan nilai patokan berdasarkan aturan institusi
A = 80-100 C = 60-64,99
B+ = 75-79,99 D+ = 55-59,99 B = 70-74,99 D = 50-54,99 C+ = 65-69,99 E = 0-49,99 d. Remediasi
Jika nilai mahasiswa berada di bawah NBL ujian OSCE maka dilakukan 1 kali remedial di minggu remedial pada akhir semester dengan ketentuan:
1. Apabila nilai ujian keterampilan masih berada di bawah nilai lulus (70), mahasiswa diberi kesempatan untuk melakukan remedial sebanyak 1 kali dengan nilai maksimal yang diperoleh adalah 70.
2. Apabila setelah dilakukan 1 kali remediasi ujian keterampilan, nilai yang diperoleh masih berada di bawah nilai lulus, maka nilai yang diambil adalah nilai yang tertinggi.
5. TATA TERTIB
a. Mahasiwa wajib mengikuti seluruh proses kegiatan skill lab 100% b. Ketidakhadiran hanya diperkenankan apabila:
1. sakit yang dibuktikan dengan surat keterangan sakit dari dokter
2. mendapat musibah kematian keluarga inti dengan surat keterangan dari orangtua/wali
3. mendapat tugas dari fakultas/universitas dengan surat keterangan dari Ketua Program Studi/Pembantu Dekan/Dekan/Rektor
c. Apabila tidak hadir dengan alasan yang tidak jelas pada saat skill lab/ujian skill lab maka akan mendapat nilai nol (0)
Kurikulum Berbasis Kompetensi PSPD FK ULM TA 2018/2019 hal 3 d. Apabila tidak hadir dengan alasan seperti point (c) pada saat skill lab/ujian wajib
mengganti waktu skill lab/ujian dengan ketentuan administrasi yang telah ditetapkan oleh MEU
e. Bagi mahasiswa yangtidak hadir dengan alasan seperti pada point b.3 maka wajib segera melapor ke bagian/lab/MEU pada saat hadir kembali ke kampus dan penggantian jadwal skill lab harus segera dilaksanakan secepatnya maksimal 3 hari setelah masuk kembali
f. Pada saat ujian mahasiswa harus sudah hadir 30 menit sebelum ujian dilaksanakan sesuai jadwal
g. Bagi mahasiswa yang terlambat hadir pada saat ujian maksimal 10 menit maka tidak akan diperkenankan ikut ujian
h. Remedial ujian skill lab hanya ditujukan bagi mahasiswa yang mendapat nilai di bawah ketentuan blok dan secara administratif tidak ada pelanggaran (kehadiran, etika)
i. Bagi mahasiswa yang melanggar ketentuan administratif dan etika maka dinyatakan tidak lulus blok dan wajib mengulang pada tahun-tahun berikutnya.
6. TIM BLOK
Koordinator : dr. Husnul Khatimah, M.Sc Anggota : dr. Nika Sterina Skripsiana
7. SUMBER REFERENSI
1. Sudoyo AW, Setiyohadi B, Alwi I, Simadibrata M, Setiati S.2006. Buku Ajar Ilmu Penyakit Dalam. Pusat Penerbitan Departemen Ilmu Penyakit Dalam FK UI.
2. Toy, Patlan, Cruse, Faustinella, 2004. Case Files Interal Medicine. Lange Medical Books/McGraw-Hill. Singapore.
3. Almatsier S, 2007. Penuntun Diet. Edisi baru. Instalasi Gizi Perjan RS. Dr. Cipto Mangunkusumo dan Asosiasi Dietisien Indonesia. Gramedia Pustaka Utama, Jakarta.
4. Rab, T., 1996. Ilmu Penyakit Paru. Hipokrates, Jakarta.
5. Farzan, S, 1997, A Concise Hardbook of Respiratory Diseases, Fourth Ed., Apple & Lange, Connecticut
6. Roentgen Signs in Diagnostic Imaging 7. David SM. Text book of Radiology Imaging
8. Laboratorium Mikrobiologi. 2008. Penuntun Praktikum Mikrobiologi FK UNLAM. 9. Guyton AC, Hall JE. Textbook of Medical Physiology 10th Edition. Philadelphia:
Kurikulum Berbasis Kompetensi PSPD FK ULM TA 2018/2019 hal 4 10. Ganong WF. Review of Medical Physiology 19th Edition. Connecticut: Appleton &
Lange Stanford, 2001.
11. Meschan, I. Rontgen Sign in Clinical Diagnosis, 1974.
Kurikulum Berbasis Kompetensi PSPD FK ULM TA 2018/2019 hal 5
MODUL SKILL LAB
ANAMNESIS KELUHAN SISTEM RESPIRASI
Pengantar
Anamnesis gangguan respirasi tidak lengkap tanda informasi tentang enam gejala utama penyakit respirasi, yaitu batuk, dahak, hemoptisis, nyeri dada, dispneu dan wheezing. Telah diketahui sejak lama bahwa diagnosis dapat dibuat hanya berdasarkan anamnesis dan dikonfirmasi dari pemeriksaan fisik dan kemudian pemeriksaan penunjang. Anamnesis riwayat penyakit dahulu penting pada gangguan respirasi. Sebagai contoh, infeksi berulang seperti bronkitis kronis ditemukan pada musim hujan dan serangan dispneu dan wheezing pada musim semi untuk asma alergi. Riwayat keluarga biasanya juga sangat penting; sebagai contoh pasien dengan dispneu yang tidak dapat dijelaskan (unexplained dyspneu) mungkin memiliki riwayat asma yang dicetuskan alergi pada keluarga. Hal ini sama dengan riwayat TB paru. Anamnesis sosial juga penting terutama untuk paparan industri di tempat kerja, sebagai contoh untuk asbestosis paru atau mesotelioma paru; sama halnya dengan riwayat merokok penting untuk bronchitis kronis dan kanker paru.
Batuk
Batuk bisa disengaja, bisa juga tidak disengaja dan bertujuan untuk membersihkan secret dari batang bronkus dengan desakan udara ekspirasi. Pada awal batuk, penderita melakukan inspirasi dalam, glotis tertutup sesaat, otot intercostal dan diafragma berkontraksi dengan kuat, menghasilkan tekanan intra thorak yang tinggi. Glotis membuka dan hembusan udara yang kuat dikeluarkan. Tekanan intra thorak yang tinggi di awal berfungsi untuk memulai aliran udara yang kuat dan untuk mempersempit pusat jalan udara sehingga menjamin kecepatan linier yang tinggi di sepanjang dinding bronkus dan memungkinkan sekret dan debris dibatukkan dengan kuat. Seringkali ada spasme dari batuk tetapi harus diingat bahwa hanya batuk kedua dan ketiga awal saja yang efisien sedangkan sisanya tidak efisien dan cenderung melelahkan. Jalan napas yang menyempit selanjutnya, distal dari level subsegmen, cenderung menutup sewaktu batuk dan bersihan jalan napasnya cenderung tidak baik. Di daerah ini dan di daerah perifer mekanisme bersihan jalan napas yang utama adalah mengangkatan debris dan sekret oleh mukosiliar. Pada orang sehat, batuk jarang terjadi dan sedikit mukus bronkus ditelan secara tidak sengaja. Kemampuan pembersihan dilakukan dengan menelan ke lambung pada malam
Kurikulum Berbasis Kompetensi PSPD FK ULM TA 2018/2019 hal 6 hari ini. Hal ini yang menjelaskan penggunaan aspirat lambung pada pagi hari untuk pemeriksaan Ziehl Neelsen pada pasien yang diduga menderita TB paru tanpa disertai adanya sputum.
Batang tracheobronkial sangat kaya dengan reseptor batuk di mukosa, suatu serabut yang membawa ke N. Vagus. Iritasi dari reseptor ini mulai dari faring ke perifer paru dapat menyebabkan batuk.
Batuk kronis dapat didefinisikan sebagai batuk yang menetap lebih dari 2 atau 4 minggu. Batuk pada infeksi saluran napas atas sering terjadi dan tidak bermakna. Batuk kronis disebabkan oleh banyak faktor dan tergantung pada beberapa faktor seperti kebiasaan dan paparan industri. Secara umum, penyebab tersering adalah:
1. Bronkitis kronis
Penyakit ini didefinisikan dari riwayat klinis saja yaitu sebagai peningkatan kronis atau berulang volume sekresi mukus di atas normal dan menyebabkan batuk yang bukan disebabkan oleh penyakit bronkopulmonal terlokalisir (seperti bronkiektasis). Pada prakteknya, diagnosis dibuat jika pasien mengalami batuk berulang atau kronis disertai sputum paling tidak selama 3 bulan dalam setahun untuk paling tidak dua tahun berurutan.
Sebaliknya, emfisema merupakan diagnosis anatomis yang dibuat jika terdapat peningkatan ukuran ruang udara distal sampai bronkiolus terminal yang diikuti dengan kerusakan dinding alveolar. Meskipun emfisema dapat merupakan gambaran bronkitis kronis, tidak mungkin untuk menentukannya secara pasti meskipun gambaran radiologis tertentu dan transfer gas yang rendah dapat mengindikasikan kondisi tersebut.
2. Pneumonia dari berbagai tipe, atau kolaps paru karena obstruksi bronkial.
3. Asma, terutama jika ditemukan gambaran batuk kering pada malam hari dengan atau tanpa disertai wheezing. Terkadang, gambaran ini dapat dikacaukan dengan
paroxsysmal nocturnal dispnoea dan asma kardial dengan gagal ventrikel kiri.
4. Kanker bronkial, sering dihubungkan dengan hemoptisis 5. TB paru
6. Bronkiektasis, dengan jumlah sputum yang banyak
7. Penyakit parenkim paru, seperti alveolitis fibrosis atau edema pulmo 8. Benda asing
Kurikulum Berbasis Kompetensi PSPD FK ULM TA 2018/2019 hal 7 Batuk dapat memiliki gambaran spesifik tergantung dari sisi iritasi atau sifat dari penyakit yang mendasari. Pada bronkitis kronis, batuk pada pagi hari ditemukan sangat parah tetapi berkurang dengan pengeluaran sputum, dan wheezing dan dispneu kemudian membaik setelahnya. Pada pasien ini, batuk dapat menjadi masalah ketika berbaring di malam hari. Hal ini mungkin disebabkan karena redistribusi sekret, penyempitan jalan napas atau peningkatan diafragma.
Batuk dapat merupakan gambaran laringitis atau trakeitis yang dapat menyebabkan nyeri retrosternal menyerupai angina. Pada kelumpuhan laring berulang, batuk menjadi batuk tipe kuda karena ketidakkompetenan dari batang trakea. Post nasal drip pada malam hari dapat menyebabkan batuk dan kondisi ini berhubungan dengan sinusitis dan bronkiektasis. Pada bronkiektasis, sputum biasanya banyak. Batuk pada kondisi yang disengaja merupakan tanda dari cemas.
Sputum
Pada banyak kondisi, batuk bersifat kering. Volume, warna, konsistensi dan bau dapat sangat bervariasi. Penting untuk menginspeksi sputum karena ini memberikan informasi tentang penyebab yang mendasari. Pada bronkitis kronis sputum biasanya jernih, putih atau abu-abu, dan biasanya berubah menjadi hijau atau kuning ketika ditemukan adanya infeksi. Pada bronkiektasis, sputum dapat banyak, terinfeksi dan berlapis (nanah dan sputum). Pada abses paru ditemukan adanya organisme anaerobik.
Pada asma bronkial, sputum menjadi banyak, lengket, dan jernih dan dapat mengandung partikel mikroskopis yang disebut kristal Charcot Leyden dan spiral Curschmann; mungkin yang lebih penting adalah adanya eosisnofil yang mengindikasikan reaksi alergi dan pada beberapa kasus dapat membedakan antara pasien asma dengan bronkitis. Pada keadaan ditemukan banyaknya eosinofil akan menyebabkan pewarnaan pada sputum penderita asma yang mengindikasikan adanya infeksi.
Pada pneumonia lobaris, biasanya sputum seperti berkarat, meskipun saat ini sudah jarang ditemukan, dan seringkali sputum tidak memiliki karakteristik yang jelas. Sputum dapat berwarna pink, dan berbusa pada edema paru akut dan kadang-kadang pada kasus yang jarang yaitu kanker sel alveolar.
Hemoptisis
Hemoptisis didefinisikan sebagai batuk darah atau mukus yang mengandung sedikit darah yang bukan disebabkan oleh perdarahan saluran napas atas (contoh, hidung, gusi) atau saluran cerna (contoh, hematemesis dengan aspirasi). “Hemoptisis tunggal” biasanya
Kurikulum Berbasis Kompetensi PSPD FK ULM TA 2018/2019 hal 8 bertahan satu atau dua hari, awalnya segar kemudian berkembang menjadi lebih apek. “Hemoptisis berulang“ bertahan lebih dari 7 hari atau diselingi dengan tidak adanya hemoptisis. “Hemoptisis yang sebenarnya” mengindikasikan batuk darah saja yang tidak disertai dengan sputum. Pasien harus ditanyakan tentang tipe, volume, dan durasi hemoptisis, dan kemungkinan lokasi (beberapa pasien dapat menyebutkan lokasi), adanya infeksi saluran napas atas, dan adanya kecenderungan perdarahan lainnya atau merokok atau paparan industri.
Pemeriksaan fisik harus memastikan adanya atau selain perdarahan hidung atau mulut, infeksi saluran napas atas atau bawah dan hipertensi atau penyakit jantung dan termasuk pemeriksaan foto thoraks, sputum dan sitologi. Informasi yang terbatas tentang penyebab hemoptisis dapat diperoleh dari tipe hemoptisis. Pada TB paru aktif dan bronkiaktasis dikatakan hemoptisisnya singkat dan cepat sedangkan pada kanker lebih lama dan biasanya hanya berupa bekuan kecil. Pada bronkitis kronis, hemoptisis biasanya tidak ditemukan tetapi biasanya mengikuti infeksi atau batuk yang parah. Pada emboli paru berukuran sedang dengan infark biasanya mengalami “hemoptisis sebenarnya”, cerah, dan seperti berkarat¸ awalnya mengindikasikan lokasinya di bagian paru. Seringkali dikatakan bahwa hemoptisis jarang masif. Misetoma paru pada kavitas TB tampaknya memiliki kecenderungan untuk mengalami perdarahan lebih.
Tabel 1. Diagnosis 324 pasien dengan hemoptisis oleh Johnson dkk
Diagnosis Frekuensi
Infeksi saluran napas atas Normal Bronkitis Bronkiektasis TB paru Aktif Quiescent Pneumonia Penyakit kardiovaskular Hipertensi
Penyakit katup mitral Kanker Lain-lain 24% 21% 17% 13% 5% 6% 6% 2% 2% 2% 2%
Kurikulum Berbasis Kompetensi PSPD FK ULM TA 2018/2019 hal 9 Berdasarkan tabel terlihat bahwa 45% pasien tidak mengalami gangguan penyakit yang serius (24% infeksi saluran napas atas, 21% normal). Hal yang sama terjadi untuk bronkitis dan bronkiektasis yang insidensinya masih tinggi (30%) menurut tabel di atas.
Nyeri Dada
Hal yang harus diperhatikan untuk nyeri dada adalah tipe, lokasi, radiasi, presipitasi, durasi dan faktor yang mengurangi gejala. Beberapa penyebab akibat gangguan saluran napas dijabarkan di bawah ini.
Nyeri trakea merupakan nyeri retrosternal yang parah yang terkadang dikacaukan dengan angina dan sering ditemukan pada pasien dengan infeksi virus pada saluran napas atas yang dapat menyebar ke trakea. Influenza merupakan penyebab paling sering. Ketika batuk berkurang dan menjadi berdahak, nyeri akan hilang. Nyeri terutama sangat jelas apabila ada spasme batuk yang berlanjut di mana trakea yang kolaps menyebabkan permukaan mukosa yang mengalami inflamasi terpapar terhadap batuk.
Paru-paru sendiri tidak dijalari oleh serabut nyeri tetapi tumor dan lesi yang menempati ruang paru baik pada hilus maupun pada daerah yang lebih perifer dapat menyebabkan nyeri tumpul. Nyeri retrosternal juga dapat disebabkan oleh lesi mediastinum seperti tumor dan emfisema mediastinum.
Tipe nyeri yang paling sering dan berhubungan dengan paru adalah nyeri pleura yang mencerminkan banyaknya suplai saraf dari pleura parietal. Nyeri pleura biasanya terlokalisir dan menusuk dan keluhan makin memburuk dengan tindakan yang merangsang permukaan pleura seperti pernapasan dalam, batuk atau bersin. Terkadang dapat terjadi radiasi/penyebaran nyeri, terutama pada infeksi pleura diafragma ke bahu yang mencerminkan inervasi umum dari diafragma dan dermatom bahu (C4-5), dan ke abdomen. Nyeri pada infeksi pleura yang kering dapat berkurang jika efusi muncul pemisahan permukaan pleura yang mengalami inflamasi.
Nyeri yang sama dapat muncul bersama fraktur iga seperti halnya dengan batuk yang menyebabkan fraktur pada bronkitis. Pada pneumothoraks spontan dapat pula terjadi nyeri pleura sesaat. Nyeri dada dapat muncul dari jantung (angina, perikarditis), aorta, esofagus, atau struktur mediastinum lainnya, dari akar saraf posterior (herpes zooster) dan erosi iga (tumor Pancoast). Selain itu nyeri dada dapat merupakan refleksi dari kecemasan. Tetapi, sebelum diagnosis ini diterima, kemungkinan lainnya harus sudah disingkirkan.
Kurikulum Berbasis Kompetensi PSPD FK ULM TA 2018/2019 hal 10 Dispneu
Dispneu dapat dideskripsikan sebagai rasa tidak nyaman, dan sulit saat bernapas yang dikeluhkan oleh pasien. Keluhan ini dapat merupakan manifestasi dari penurunan kapasitas ventilasi, seperti pada:
1. Defek obstruksi – asma, bronkitis kronis, atau emfisema
2. Defek restriktif – fibrosis, kolaps, kongesti, efusi pleura, pneumothoraks, kifoskoliosis atau ankilosis spondilitis.
3. Kelemahan dari otot pernapasan, seperti pada miopati, neuropati. Selain penyakit di sistem respirasi, ada pula penyebab lain dari dispneu, yaitu
1. Penyakit jantung (edema atau kongesti paru) 2. Anemia (oleh faktor yang tidak diketahui)
3. Obesitas (dengan peningkatan kerja dari pernapasan dan terbatasnya pernapasan) 4. Tirotoksikosis (dengan rangsangan langsung dari pusat napas dan peningkatan
konsumsi O2) 5. Kecemasan
Dispneu dapat dibagi menjadi menjadi:
1. Dispneu akut, yang dapat merupakan gambaran pneumotoraks spontan (terutama pada tension pneumothorax), emboli paru masif, kolaps paru, efusi pleura masif atau retensi sputum
2. Dispneu paroksismal, dapat merupakan gambaran asma bronkial dengan wheezing dan obstruksi jalan napas. Dapat pula ditemukan pada gagal ventrikel kiri (asma kardia). Pasien seringkali mengeluhkan paroxysmal nocturnal dispneu. Hal ini merupakan gambaran peningkatan aliran darah paru dan akumulasi cairan intersisial saat pasien menyingkirkan secara perlahan tumpukan bantalnya.
3. Dispneu progesif, umumnya merupakan gambaran dari penyakit respirasi seperti bronktis obstruksi kronis, emfisema, asma bronkial kronis, alveolitis oleh fibrosis atau alergi atau penyakit vaskular paru (emboli paru) dan penyakit jantung seperti yang sudah disebutkan di atas.
Wheezing
Wheezing merupakan bunyi musikal yang mengindikasikan sumbernya. Wheezing dapat dihasilkan dihasilkan dari individu normal ketika melakukan ekspirasi volume residual secara paksa ketika jalan napas menyempit. Wheezing merupakan keluhan utama pada pasien dengan obstruksi jalan napas difus baik karena bronkitis kronis, asma maupun
Kurikulum Berbasis Kompetensi PSPD FK ULM TA 2018/2019 hal 11 emfisema. Tanggapan pasien terhadap wheezing sangat bervariasi. Pada kasus yang ringan, pasien terkadang menganggap normal. Terkadang, keluhan disampaikan oleh pasangan penderita asma dengan wheezing ketika pasien tidur.
Pada serangan asma, wheezing dapat diinduksi oleh paparan alergen (debu rumah, kutu rumah, polen, dst), infeksi saluran napas atas oleh virus, olahraga, dam terkadang oleh faktor emosi. Terkadang, wheezing pada asma di malam hari dikacaukan dengan asma kardial dan edema paru stadium awal. Pada bronkitis kronis, wheezing dan tingkat obstruksi jalan napas dapat diperparah oleh adanya infeksi. Meskipun jarang, wheezing dapat terjadi unilateral karena penyempitan bronkus lokal oleh tumor atau benda asing.
Kurikulum Berbasis Kompetensi PSPD FK ULM TA 2018/2019 hal 12 DAFTAR TILIK
ANAMNESIS GANGGUAN SALURAN NAPAS
No Aspek yang dinilai Taraf Kemampuan
0 1 2
Aspek komunikasi
1 Mengucapkan salam dan memperkenalkan diri 2 Mendengarkan secara aktif
3 Tidak memotong pembicaraan pasien selama masih relevan
4 Menggunakan bahasa yang bisa dipahami pasien 5 Mempertahankan kontak mata dengan pasien 6 Menunjukkan empati
Aspek anamnesis
1 Menanyakan identitas pasien: nama, umur, jenis kelamin, alamat, pekerjaan
2 Menanyakan keluhan utama (batuk, nyeri dada, dispneu, wheezing)
3 Menggali riwayat penyakit sekarang Batuk:
Onset Frekuensi
Sifat munculnya keluhan (mendadak, perlahan-lahan)
Durasi
Sifat batuk: berdahak, kering, berdarah
- Dahak: warna, volume, bau, dan konsistensi - Jika berdarah; bercak atau masif
- Buih
Upaya yang dilakukan untuk mengurangi keluhan Nyeri dada
Tipe (tajam, tumpul, menusuk,dll) Lokasi
Penyebaran (+/-) Sesak nafas
Upaya yang dilakukan untuk mengurangi keluhan Sesak napas
Onset Frekuensi
Sifat munculnya keluhan Durasi
Sifat sakit
Upaya yang dilakukan untuk mengurangi keluhan Hubungan keluhan dengan aktivitas (olahraga,
aktivitas harian) Wheezing (mengi)
Kurikulum Berbasis Kompetensi PSPD FK ULM TA 2018/2019 hal 13 Frekuensi
Sifat munculnya keluhan Durasi
Sifat sakit
Akibat yang timbul terhadap aktivitas sehari-hari Upaya yang dilakukan untuk mengurangi keluhan 4
Menggali riwayat penyakit dahulu:
Ada tidaknya penyakit seperti ini sebelumnya Penyakit lain yang pernah diderita
5 Menggali riwayat penyakit keluarga Ada tidaknya penyakit serupa
6 Menanyakan riwayat alergi (terhadap berbagai alergen: seperti makanan, obat, musim, dll)
7 Menanyakan keluhan penyerta (berdasarkan sistem) 8 Membuat resume anamnesis
Keterangan:
0 = tidak dilakukan
1 = dilakukan tetapi kurang benar 2 = dilakukan dengan benar
Kurikulum Berbasis Kompetensi PSPD FK ULM TA 2018/2019 hal 14
MODUL SKILL LAB
PEMERIKSAAN UJI FUNGSI PARU DENGAN
SPIROMETER BTL-08
PENDAHULUAN Dasar Teori
Spirometri adalah suatu metode penilaian fungsi paru dengan mengukur volume udara yang dapat dikeluarkan dari paru setelah inspirasi maksimal. Alat yang digunakan disebut spirometer. Secara konvensional, spirometer adalah alat yang digunakan untuk mengukur volume ekspirasi dan inspirasi, dan dari sini dapat dihitung seberapa efektif dan seberapa cepat paru dapat diisi dan dikosongkan. Metode ini dapat digunakan untuk membedakan gangguan obstruksi jalan napas (misalnya COPD dan asma) dan penyakit restriktif (dimana ukuran paru berkurang, misalnya Penyakit paru fibrotic). Spirometri merupakan cara paling efektif untuk menentukan keparahan COPD.
Kontraindikasi untuk spirometri : a. Absolut
Post operasi dada
Kondisi setelah infark miokardium Instabilitas serius jalan napas – emfisema Hipersensitivitas bronchial non-spesifik
Kesulitan serius pertukaran gas – insufisiensi respiratori total atau parsial. b. Relatif
Kondisi setelah pneumotoraks spontan Aneurisma arterial-veonosa.
Hipertensi berat
Kehamilan dengan komplikasi dalam bulan ketiga. Pro test dalam profil MVV: sindroma hiperventilasi. Kondisi-kondisi yang dapat mempengaruhi hasil pengukuran (3)
Nyeri pulmoner atau nyeri perut Nyeri pada mulut atau wajah Inkontinensia tekanan
Demensia atau gangguan mental Merokok 1 jam/<sebelum pemeriksaan
Kurikulum Berbasis Kompetensi PSPD FK ULM TA 2018/2019 hal 15 Konsumsi alkohol 4 jam/<sebelum pemeriksaan
Aktivitas yang melelahkan 30 menit/<sebelum pemeriksaan Kekenyangan/makanbesar 2 jam/<sebelum pemeriksaan.
Pakaian ketat yang dapat mempengaruhi pernapasan maksimal.
Kerapian sensor spirometri - selalu pelihara sensor dan pastikan selalu kering dan bersih.
Pasang segel silicon antara sensor primometer dan pneumotachograph – tanpa ini tidak dapat mengukur kurva atau mengkalibrasi sensor.
Pengukuran yang biasanya dibuat adalah sebagai berikut:
1. VC (vital capacity) adalah volume maksimal udara yang bias diekshalasi atau diinhalasi selama maneuver usaha maksimal (FVC) atau tenang (VC). VC normalnya sama dengan FVC kecuali terdapat obstruksi jalan napas, di mana pada kasus ini VC biasanya lebih tinggi daripada FVC yang mengalami pengurangan yang nyata karena penutupan prematur saluran napas yang kecil dan akibat udara yang terperangkap. Nilai VC bermanfaat dalam memberikan informasi mengenai kekuatan otot-otot pernapasan serta beberapa aspek fungsi pernapasan lain.
Kapasitas vital paru dipengaruhi oleh faktor : - Jenis kelamin
- Umur
- Tinggi badan - Berat badan
Dengan ukuran-ukuran badan tersebut dapat dihitung harga perkiraan kapasitas vital dari orang tersebut (predictive vital capacity).
2. Force Expiratory Volume (FEV).
FEV adalah kapasitas persatuan waktu. FEV1 adalah volume udara yang dapat diekspirasi dalam waktu 1 detik selama tindakan FVC dan berguna untuk mengukur seberapa cepat paru dikosongkan secara penuh. Hal ini didapat dari perpotongan grafik atau kurve FEV yang terbentuk dengan garis waktu 1 detik. Kondisi fisiologis memungkinkan 75% FVC diekspirasikan dalam 1 detik (FEV1).Jika FVC normal 4500 ml, maka FEV1nya 3375 ml.
FEV2 adalah kapasitas vital dalam 2 detik yaitu perpotongan kurve FEV dengan garis waktu 2 detik dan seterusnya.
Kurikulum Berbasis Kompetensi PSPD FK ULM TA 2018/2019 hal 16 Volume udara yang dikeluarkan pada FEV1 sebagian besar merupakan volume udara yang berada pada zona konduksi saluran pernapasan. Saluran pernapasan y ang dilewati oleh udara pada pengukuran FEV1 berada antara bronkus sampai bronkiolus terminalis. Pada daerah tersebut terdapat otot polos yang memegang peranan penting dalam pengukuran jumlah udara yang dihasilkan pada FEV1. oleh karena itu FEV1 bisa dijadikan sebagai indikator kontraksi otot polos pada saluran pernapasan tersebut. Nilai FEV1 yang kurang dari 1 L menunjukkan adanya gangguan fungsi yang berat. Gangguan fungsi tersebut berupa obstruksi atau sumbatan pada saluran pernapasan yang mengakibatkan nilai FEV1 berkurang.
3. Force Expiratory Volume Ratio adalah FEV1 yang diekspresikan sebagai persentase dari VC (menurut Tiffenau) atau FVC (menurut Cansler) dan berguna secara klinik memberikan indeks pembatasan aliran udara.
4. FEF25-75% adalah rata-rata aliran ekspirasi pada pertengahan FVC dan dianggap
sebagai pengukuran yang lebih sensitive untuk penyempitan jalan napas kecil dibanding FEV1.Sayangnya, FEF25-75% mempunyai rentang normal yang lebar, kurang reproducible daripada FEV1, dan sulit untuk diinterpretasikan jika VC (atau FVC) menurun atau meningkat.
5. FEF50% dan FEF75% (forced expiratory flow pada 50% atau 75% FVC) adalah
aliran ekspirasi maksimal yang diukur pada titik di mana 50% FVC telah diekspirasikan (FEF50%) dan 75% setelah dieksperasikan (FEF75%). Keduanya mempunyai rentang normal yang lebar tapi biasanya reproducible.
6. Maximum Expiratory Flow Rate (MEFR).MEFR merupakan jumlah aliran udara maksimal yang dihembuskan dalam saluran pernapasan sampai habis tanpa batas waktu. MEFR dapat digunakan untuk melihat aliran udara maksimal yang berada pada saluran pernapasan antara kavum nasi, faring, laring, trakhea, bronkus, bronkioli terminalis, bronkioli respiratoris, duktus alveolaris, saccus alveolaris dan selanjutnya alveoli. MEFR digunakan untuk melihat batas aliran udara maksimal yang dapat dihembuskan oleh saluran pernapasan, di mana nilai MEFR tersebut dipengaruhi oleh kapasitas vital paru.
MEFR pada beberapa pemeriksaan uji fungsi paru disebut sebagai FEF200-1200. Aliran udara yang diukur pada MEFR adalah aliran udara yang berada pada saluran pernapasan yang besarnya antara 200 – 1200 ml yang dihembuskan tanpa dibatasi oleh waktu.Pada usia 70 tahun MEFR dapat menjadi 100 liter/menit atau lebih, ini
Kurikulum Berbasis Kompetensi PSPD FK ULM TA 2018/2019 hal 17 disebabkan makin tua makin banyak alveoli atau sistem pernafasan lainnya yang mengalami kerusakan.
7. PEF (peak expiratory flow) adalah laju aliran ekspirasi maksimal yang bias dicapai dan terjadi di awal ekspirasi paksa.
8. MMEF = Maximal Mid-Expiratory Flow [l/s], dihitung setelah akhir pengukuran, kadang-kadang juga berhubungan dengan FEF25 - 75% sebagai pertengahan aliran ekspirasi maksimal dari FVC yang diekshalasikan.
9. FIVC = Forced Inspiratory Vital Capacity [l], setelah ekspirasi total, aspirasi paksa mengikuti posisi maksimum.
Pola obstruktif
Penyakit obstruksi jalan napas membatasi volume gas yang dapat diekspirasikan secara paksa dalam 1 detik, oleh karena itu, rasio FEV1/FVC akan menjadi rendah.
Pola restriktif
Penyakit paru obstruktif menurunkan FVC tetapi secara umum tidak mempengaruh di awal ekspirasi. Sehingga, rasio FEV1/FVC dapat normal atau tinggi.
Volume dan kapasitas paru merupakan pengukuran anatomis yang dipengaruhi oleh latihan fisik dan penyakit.Kelainan pada paru yang restriktif bila kelainan atau kerusakan terjadi pada jaringan paru, misalnya pada pnemonia yang berat, tuberkulosa, dan sebagainya.Kelainan pada paru yang obstruktif bila terjadi penyempitan dalam jalan nafas misalnya: asma bronkhiale di mana terjadi penyempitan dari bronkhus, dan sebagainya.
SPIROMETER BTL-06
BTL-08 spiro dilengkapi dengan sensor untuk mengukur temperatur ruangan, tekanan barometer dan kelembaban relatif. Oleh sebab itu, spirometer ini dapat melakukan koreksi secara otomatis kondisi BTPS.
1.1 TUJUAN
Setelah melakukan percobaan ini diharapkan mahasiswa dapat :
1. Melakukan pengukuran dengan alat Spirometer BTL-08 dengan profile force: - Force Vital Capacity (FVC)
Kurikulum Berbasis Kompetensi PSPD FK ULM TA 2018/2019 hal 18 - Kapasitas vital paksa 1 detik pertama Force Expiratory Volume1 (FEV1)
2. Menginterpretasikan hasil pengukuran menggunakan BTS interpretation. 1.2 ALAT DAN BAHAN
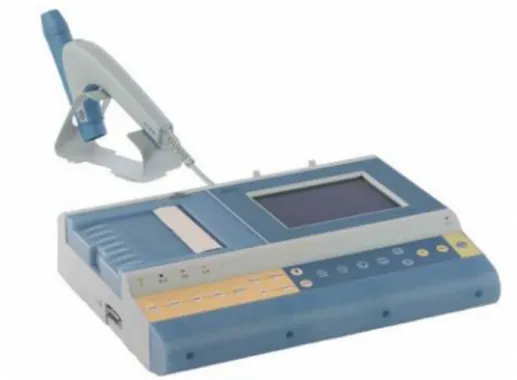
Alat yang dipergunakan pada percobaan ini adalah BTL-08 Spiro, yang terdri dari:
- Main Unit, merupakan bagian utama dari rangkaian spiroteri BTL-08.
- Pneumotachograph set, yang terdiri dari pneumotachograph unit, plastic mouth piece,
dan silicone seal.
Gambar 1. Spirometer BTL-08
1.1 CARA KERJA
Adapun langkah-langkah percobaan ini adalah : 1. Persiapan alat:
Letakkan Spirometer pada tempat yang datar dan kuat sehingga tidak mengganggu jalannya percobaan
Merakit Pneumotachograph Set, yaitu dengan menghubungkan
plasticmouthpiece dengan pneumotachograph serta meletakkan siliconeseal
untuk mencegah terjadinya kebocoran saat melakukan pemeriksaan. Menghubungkan Pneumotachograph Set dengan Main Unit
Kurikulum Berbasis Kompetensi PSPD FK ULM TA 2018/2019 hal 19 2. Melakukan pengukuran:
a. Nyalakan alat dengan menekan tombol ON/Off
b. Tekan tombol forced untuk melakukan tes ForceSpirometry
c. Tekan tombol , kemudian masukan data pasien, pengisian harus tepat karena akan mempengaruhi nilai Predictive Vital Capacity.
d. Tekan tombol start, dan bersiaplah untuk melakukan percobaan.
Gambar 2. Cara meniupkan udara melalui mouth piece
e. Probandus memegang Pneumotachograph set dan mulut diletakkan pada bagian mouthpiece kemudian probandus disuruh melakukan inspirasi maksimal, lalu melakukan ekspirasi maksimal dengan cepat dan tuntas.Ekspirasi dilakukan melalui mouthpiece, hidung ditutup.
f. Jika prosedur e telah dianggap benar, tekan tombol accept. g. Probandus disuruh bernapas normal minimal selama 30 detik. h. Ulangi prosedur d, e dan f sebanyak 3 kali.
i. BTL-08 spiro akan secara otomatis memilih hasil percobaan yang terbaik. j. Tekan tombol print untuk mencetak hasil percobaan.
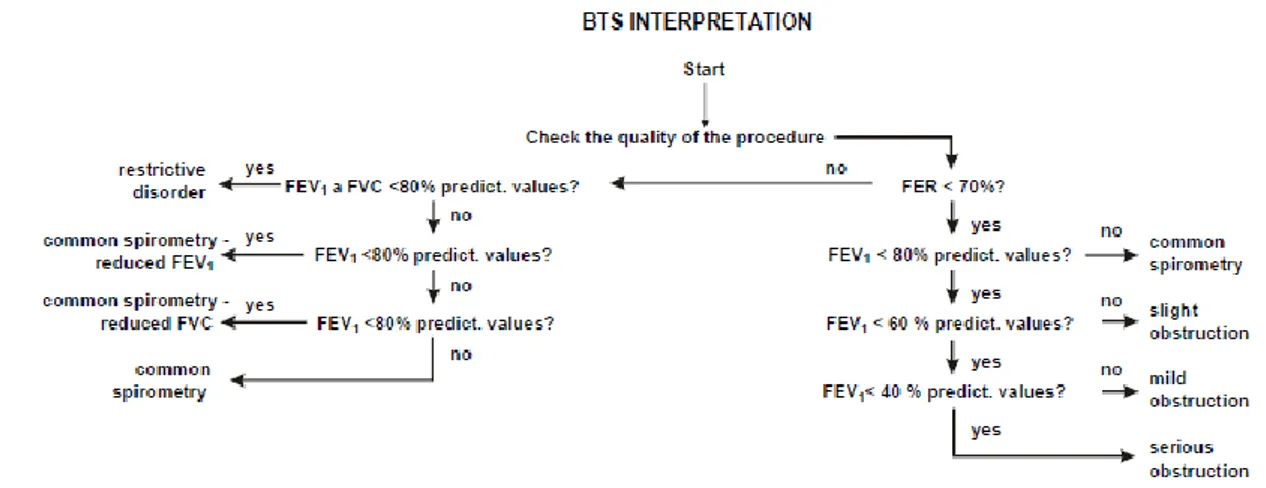
Kurikulum Berbasis Kompetensi PSPD FK ULM TA 2018/2019 hal 20 Gambar 3. Interpretasi BTS
Kurikulum Berbasis Kompetensi PSPD FK ULM TA 2018/2019 hal 21 DAFTAR TILIK
KETERAMPILAN SPIROMETRI
No MATERI Taraf Kemampuan
0 1 2
PERSIAPAN ALAT 1 Pastikan alat telah terhubung ke aliran listrik 2 Hidupkan alat dengan menekan tombol ON 3 Pilihlah profile – menu – profile set up – forced
dan ikuti petunjuk pada layar di alat
4 Tekan “tombol pasien”. Masukkan nama dan data pasein (tanggal lahir, jenis kelamin, berat badan, tinggi badan dan ras).
5 Periksa kejernihan sensor spirometer 6
PELAKSANAAN (EKSPIRASI PAKSA) 1 Membersihkan bagian mulut dari alat spirometri 2 Tekan “tombol start” dan meminta pasien untuk menarik napas secara maksimal, segera setelah bagian mulut dari spirometri terpasang pada bibir pasien meminta pasien untuk menghembuskan napas secara maksimal dengan cepat. Hembusan napas dilakukan melalui mulut, hidung ditutup.
3 Pengambilan data berakhir secara otomatis sesudah waktu tertentu atau dengan menekan “tombol stop” 4 Tepat setelah prosedur pertama berhasil dilakukan,
“tombol accept” akan muncul pada sebelah bawah layar sentuh. Tekanlah tombol ini dan melanjutkan pemeriksaan dengan menekan “tombol start” 5 Lakukan pemeriksaan sebanyak 3 kali 6 Tekan “tombol print” untuk mencetak hasil
PEMBACAAN
1 Lakukan pembacaan hasil pemeriksaan spirometri menurut yang tertera pada kertas rekam
menggunakan BTS interpretation
Keterangan:
0= Apabila tidak dilakukan 1=Apabila dilakukan, tetapi salah 2=Apabila dilakukan dengan benar
Kurikulum Berbasis Kompetensi PSPD FK ULM TA 2018/2019 hal 22
MODUL SKILL LAB
PERSIAPAN, PEMERIKSAAN SPUTUM, DAN INTERPRETASINYA (PENGECATAN GRAM DAN ZIEHL NIELSEN [BTA])
PENGANTAR
Infeksi saluran nafas masih merupakan penyakit infeksi yang menempati sepuluh besar penyakit berbahaya dan mematikan di Indonesia. Infeksi saluran nafas dapat disebabkan oleh virus, bakteri, jamur, dan parasit. Infeksi saluran nafas dapat bermanifestasi sebagai infeksi saluran nafas atas dan bawah. Pneumonia yang disebabkan oleh berbagai mikroorganisme dan tuberkulosis yang disebabkan oleh
Mycobacterium tuberculosis menjadi 2 jenis penyakit infeksi saluran nafas bawah
yang paling sering ditemukan. Penegakan diagnosis dapat dibantu dengan pemeriksaan laboratorium menggunakan sampel klinik sputum.
SPUTUM
Sputum adalah cairan yang diproduksi dalam alveoli dan bronkioli. Sputum yang memenuhi syarat pemeriksaan harus betul-betul dari trakea dan bronki bukan berupa air ludah. Sputum dapat dibedakan dengan ludah antara lain: ludah biasa akan membentuk gelembung-gelembung jernih di bagian atas permukaan cairan, sedang pada sputum hal ini jarang terjadi. Secara mikroskopis ludah akan menunjukan gambaran sel-sel gepeng sedang pada sputum hal ini tidak ditemukan.
Sputum paling baik untuk pemeriksaan adalah sputum pagi hari, karena sputum pagi paling banyak mengandung kuman. Sputum pagi di kumpulkan sebelum menggosok gigi, tetapi sudah berkumur dengan air untuk membersihkan sisa makanan dalam mulut yang tertinggal.
KLASIFIKASI SPUTUM
Sputum yang dikeluarkan oleh seorang pasien hendaknya dapat dievaluasi sumber, warna, volume dan konsistensinya, karena kondisi sputum biasanya memperlihatkan secara spesifik proses kejadian patologik pada pembentukan sputum itu sendiri. Sputum yang dihasilkan sewaktu membersihkan tenggorokan, kemungkinan berasal dari sinus, atau saluran hidung, bukan berasal dari saluran napas bagian bawah. Sputum banyak sekali dan purulen,berasal dari proses supuratif (contoh Abses paru). Sputum yg terbentuk perlahan
Kurikulum Berbasis Kompetensi PSPD FK ULM TA 2018/2019 hal 23 dan terus meningkat, menjadi tanda bronkhitis/bronkhiektasis. Sputum kekuning-kuningan atau kuning kehijauan, mukopurulen atau purulen berasal proses infeksi. Sputum kemerahan (merah muda) dan berbusa merupakan pertanda edema paru akut. Sputum berlendir, lekat, abu-abu/putih menjadi tanda bronkitis kronik. Sputum berbau busuk tanda abses paru/bronkhiektasis.
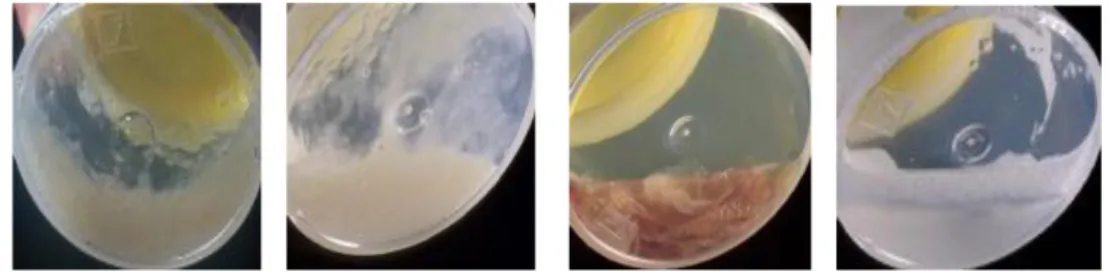
A B C D
Gambar 4. A. Sputum mukoid, B. Sputum purulen, C. Sputum + darah, D. Bukan sputum,
tetapi air liur
Sputum yang berkualitas baik adalah sputum yang mukoid, purulen atau bercampur darah, sputum yang pada pewarnaan Gram dan pembesaran objektif 10x sesuai dengan kriteria jumlah leukosit lebih banyak dibandingkan dengan sel epitel (sel epitel < 10 dan sel lekosit > 25 per lapang pandang untuk 20 — 30 lapang pandang yang berbeda).
PEMERIKSAAN SPUTUM
Pemeriksaan sputum biasanya diperlukan jika diduga adanya penyakit paru. Membran mukosa saluran pernapasan berespons terhadap inflamasi dengan meningkatkan keluaran sekresi yang sering mengandung organisme penyebab. Perhatikan dan catat volume, konsistensi, warna dan bau sputum. Pemeriksaan sputum mencakup pemeriksaan: a. Pengecatan/pewarnaan Gram, biasanya pemeriksaan ini memberikan cukup informasi
tentang mikrorganism yang cukup untuk menegakkan diagnosis presumtif.
b. Kultur sputum untuk mengidentifikasi mikrorganisme spesifik untuk menegakkan diagnosis definitif. Untuk keperluan pemeriksaan ini, sputum harus dikumpulkan sebelum dilakukan terapi antibiotik dan setelahnya untuk menentukan keberhasilan terapi.
Pemeriksaan Basil Tahan Asam (BTA) menentukan adanya Mycobacterium
Kurikulum Berbasis Kompetensi PSPD FK ULM TA 2018/2019 hal 24 warna oleh alkohol asam. Pemeriksaan BTA bertujuan untuk menegakkan diagnosis TB, menentukan potensi penularan dan memantau hasil pengobatan pasien.
PENGUMPULAN SPUTUM
Waktu Pengumpulan Spesimen Sputum
Dibutuhkan tiga specimen sputum untuk menegakkan diagnosis TB secara mikroskopis. Spesimen sputum paling baik diambil pada pagi hari selama 3 hari berturut-turut (pagi-pagi-pagi), tetapi untuk kenyamanan penderita pengumpulan sputum dilakukan: sewaktu – pagi – sewaktu (SPS) dalam jangka waktu 2 hari.
Sewaktu hari-1 (sputum sewaktu pertama = A)
1. Kumpulkan sputum specimen pertama pada saat pasien berkunjung ke UPK (Unit Pelayanan Kesehatan)
2. Beri pot sputum pada saat pasien pulang untuk keperluan pengumpulan sputum ada hari berikutnya
Pagi hari – 2 (Sputum pagi = B)
1. Pasien mengeluarkan sputum specimen kedua pada pagi hari kedua setelah bangun tidur dan membawa specimen ke laboratorium
Sewaktu hari -2 (sputum sewaktu kedua = C)
Kumpulkan sputum spesimen ketiga di laboratorium pada saat pasien kembali ke laboratorium pada hari kedua saat membawa sputum pagi (B).
Tempat Pengumpulan Sputum
Pengumpulan sputum dilakukan di ruang terbuka dan mendapat sinar matahari langsung atau di ruangan dengan ventilasi yang baik, untuk mengurangi kemungkinan penularan akibat percikan sputum yang infeksius. Jangan mengambil sputum di ruangantertutup dengan ventilasi yang buruk, misalnya: kamar kecil / toilet, ruang kerja (ruangpendaftaran, ruang pengumpulan sampel, laboratorium, dsb), ruang tunggu, ruang umum lainnya.
Sputum ditampung dalam pot sputum yang memenuhi syarat. Syarat pot sputum yang ideal adalah: sekali pakai; bahan kuat, tidak bocor dan tidak mudah pecah; tutup berulir, dapat menutup rapat; plastik jernih/ tembus pandang; mulut lebar, diameter 6 cm;
Kurikulum Berbasis Kompetensi PSPD FK ULM TA 2018/2019 hal 25 dan dapat ditulisi dengan pena. Pot sputum yang tidak dianjurkan berupa pot yang tidak tembus pandang, terlalu kecil, dan tutup tidak berulir.
Bahan dan Alat
1. Pot sputum 3 buah
2. Kertas label 3 buah 3. Spidol hitam kecil 1 buah 4. Kantong plastik 3 buah
5. Masker 1 buah
6. Handscoen 1 pasang
7. Parafilm (selotip) 1 buah 8. Kotak plastik 1 buah
9. Cool box 1 buah
Prosedur dan Daftar Tilik Pengumpulan Sputum
NO LANGKAH / KEGIATAN NILAI
PERSIAPAN TINDAKAN 0 1 2
1. Cucilah kedua tangan
2. Siapkan 3 buah pot sputum yang ideal
3. Berikan label identitas pasien yang jelas pada dinding pot sputum, yaitu nama, jenis kelamin, umur. Tempelkan label pada dinding pot sputum, jangan pada tutupnya.
PERSIAPAN PASIEN
4. Sapa pasien dengan ramah dan perkenalkan diri pada pasien
5. Persilahkan pasien untuk duduk
6. Berikan informasi kepada pasien tentang tindakan yang akan dilakukan dan minta persetujuan atas tindakan yang akan dilakukan
7. Jelaskan kepada pasien bahwa sputum akan diambil sebanyak 3 kali (SPS), sesuai dengan jumlah tabung yang disiapkan.
8. Jelaskan kepada pasien untuk tidak makan, minum atau merokok sebelum sputum besok pagi (P) dibatukkan 9. Jelaskan tentang kemungkinan hasil yang akan diperoleh PENGUMPULAN SPUTUM
10. Pakai handschoen dan masker
Kurikulum Berbasis Kompetensi PSPD FK ULM TA 2018/2019 hal 26 terbuka dan mendapat sinar matahari langsung atau
ruangan dengan ventilasi yang baik, dan berada jauh dari orang sekitar untuk mencegah penularan kuman TB.
12. Beri petunjuk pada pasien untuk :
- Berkumur dengan air (jangan ditelan) sebelum sputum dikumpulkan untuk meminimalisir kontaminasi spesimen oleh sisa makanan atau kotoran lain di dalam mulut.
- Bila pasien memakai gigi palsu, minta pasien untuk melepaskannya
- Menarik napas panjang dan dalam sebanyak 2-3 kali dan setiap kali hembuskan nafas dengan kuat. - Membuka penutup pot sputum lalu dekatkan pada
mulut.
- Batuk secara dalam untuk mengeluarkan sputum (bukan air liur) dari dalam dada ke dalam pot sputum.
- Mengulangi sampai mendapatkan sputum yang berkualitas baik dan volume yang cukup (3-5 ml / 1 sendok teh)
- Segera tutup rapat tabung dengan cara memutar tutupnya, kemudian masukkan ke dalam
pembungkus atau kantong plastik.
Jika sputum sulit dikeluarkan, pasien diberi petunjuk untuk :
- Melakukan olah raga ringan kemudian menarik napas dalam beberapa kali. Apabila pasien merasa akan batuk, napas ditahan selama mungkin lalu meminta pasien untuk batuk
13. Apabila spesimen jelek, pemeriksaan tetap dilakukan dengan :
- Mengambil bagian yang paling mukopurulen / kental kuning kehijauan
- Memberi catatan bahwa “spesimen tidak memenuhi syarat / air liur”
- Mengulang pengumpulan sputum apabila spesimen jelas air liur
14. Ingatkan pasien untuk mengumpulkan sputum ke-2 setelah bangun pagi keesokan hari dan datang lagi untuk membawa
Kurikulum Berbasis Kompetensi PSPD FK ULM TA 2018/2019 hal 27 malam hari sebelum tidur sebagai persiapan untuk
pengumpulan sputum ke-2 besok pagi. Jika sputum sulit dikeluarkan, meminta pasien menelan 1 tablet gliseril guaikolat 200 mg pada malam hari sebelum tidur
PENGIRIMAN SPUTUM
16. Pastikan pot sputum sudah memiliki label nama 17. Pastikan sputum segera dikirim setelah pengumpulan
sputum (sebaiknya tidak lebih dari 24 jam). Selama pengiriman, sputum disimpan dalam cool box
18. Beri parafilm (selotip) pada pinggir tutup pot untuk mencegah cairan sputum keluar dari celah –celah tutup ulir
19. Masukkan ke dalam plastik (kotak)
20. Masukkan ke dalam cool box yang sudah berisi ice gel atau es batu
21. Pastikan spesimen dalam posisi tegak tidak terbalik kemudian menutup cool box.
Kurikulum Berbasis Kompetensi PSPD FK ULM TA 2018/2019 hal 28 pada tempat yang telah disediakan
23. Cuci kembali kedua tangan
PEMBUATAN SEDIAAN APUS
Untuk melakukan pengecatan haruslah terlebih dahulu dibuat suatu preparat yang baik yaitu tidak terlalu tebal dan di fiksasi dengan baik. Sediaan apus yang baik ialah berasal dari sputum mukopurulen, bukan air liur; berbentuk spiral-spiral kecil berulang (coil type), yang tersebar merata, ukuran 2 x 3 c m, tdak terlalu tebal atau tipis. Setelah dikeringkan sebelum diwarnai, tulisan pada surat kabar 4 - 5 cm di bawah sediaan apus masih terbaca.
Sebagian sprutum terutama yang berasal dari penderita TB sering bercampur dengan darah. Cara penanganan sputum yang bercampur darah adalah:
1. Sputum dengan darah sedikit. Pilih bagian sputum yang tidak mengandung darah, dan buat sediaan seperti biasa.
2. Sputum dengan darah sedang. Buat sediaan, kemudian fiksasi, genangi dengan air bersih/aquades lalu digoyang-goyang sampai warna merah darah hilang. Lalu air dibuang dan bilas lagi dengan air kemudian warnai dengan Ziehl-Neelsen.
Bahan dan Alat
1. Kaca sediaan yang bersih 2. Pensil 2B
3. Aplikator dari lidi /bambu atau ose 4. Lampu spiritus
5. Botol berisi pasir dan disinfektan 6. Wadah pembuangan
7. Handscoen 8. Masker
Kurikulum Berbasis Kompetensi PSPD FK ULM TA 2018/2019 hal 29 Prosedur dan Daftar Tilik Pembuatan Sediaan
NO LANGKAH / KEGIATAN NILAI
PERSIAPAN TINDAKAN 0 1 2
1. Tulis nomor identitas pasien pada bagian ujung kaca sediaan. Bila menggunakan kaca frosted, tulis dengan menggunakan pensil 2 B pada bagian yang buram/frosted. Bila menggunakan kaca biasa, tulis dengan spidol
permanen pada stiker yang diletakkan di balik kaca sediaan.
2. Lakukan cuci tangan rutin
3. Gunakan handscoen (dapat menggunakan handscoen yang tidak steril)
PENGAMBILAN SPUTUM
4. Ambil dan pilih bagian dari dahak yang purulen yang telah didekontaminasi dengan menggunakan ose atau lidi
5. Letakkan sputum yang terdapat pada ose ke kaca sediaan. Sediaan dibuat tersebar merata, ukuran 2 x 3 cm, dan tidak terlalu tipis untuk menghindari apusan menjadi kering sebelum diratakan.
6. Ratakan sediaan dengan m embuat spiral-spiral kecil sewaktu apusan setengah kering dengan m enggunakan lidi lancip sehingga didapat sebaran leukosit lebih rata dan area baca lebih homogen. Jangan membuat spiral-spiral keci l pada apusan yang sudah kering, karena dapat terkelupas dan menja di aerosol yang berbahaya.
Kurikulum Berbasis Kompetensi PSPD FK ULM TA 2018/2019 hal 30 7. Keringkan apusan di udara bebas
8. Lakukan fiksasi apusan dengan pemanasan : Pastikan apusan menghadap ke atas
Lewatkan 3 X melalui api dari lampu spiritus
Gunakan pinset atau penjepit kayu untuk memegang kaca
(pemanasan yang berlebihan akan merusak hasil)
9. Keringkan apusan di atas rak sediaan, hindari sinar matahari langsung.
10. Celupkan ose yang telah digunakan pada botol pasir disinfektan,kemudian membakarnya sampai ose membara. Bila menggunakan lidi, langsung dibuang ke dalam botol berisi disinfektan.
Kurikulum Berbasis Kompetensi PSPD FK ULM TA 2018/2019 hal 31 11. Lepaskan handschoen dan buang pada tempat yang telah
disediakan 12. Cuci tangan rutin
PEWARNAAN GRAM
Pewarnaan Gram ditemukan oleh Hans Christian Gram, berkebangsaan Denmark tahun 1884. Pewarnaan Gram merupakan pewarnaan diferensial yang menggunakan setidaknya 3 reagen kimia. Reagen pertama disebut pewarna primer (primary stain) yang berfungsi untuk mewarnai semua sel bakteri. Reagen kedua digunakan sebagai agen peluntur (decolorizing agent) untuk mempertahankan kontras warna. Berdasarkan komposisi kimia dari komponen sel bakteri, agen peluntur mungkin dapat menghilangkan pewarna primer dari sel atau hanya dari hanya struktur sel tertentu. Reagen terakhir adalah pewarna tandingan (counterstain) yang berfungsi sebagai pewarna kontras dari pewarna primer. Setelah pelunturan, jika warna primer tidak tercuci, pewarna tandingan tidak dapat terserap dan sel atau komponennya akan mempertahankan warna dari pewarna primer. Jika pewarna primer dihilangkan, komponen seluler yang telah dilunturkan akan menerima dan menyerap warna kontras dari pewarna tandingan. Dengan demikian tipe sel atau strukturnya dapat dibedakan satu dengan yang lainnya berdasarkan sifat pewarnaannya. Berdasarkan pewarnaan Gram bakteri dibagi dalam 2 group utama yaitu Gram positif dan Gram negatif. Hal ini menjadikan pewarnaan ini sebagai alat esensial untuk klasifikasi dan deferensiasi mikroorganisme. Reaksi pewarnaan Gram didasarkan pada komposisi kimia dinding sel. Sel Gram positif mempunyai lapisan peptidoglikan (peptidogycan) yang tebal sedangkan sel Gram negatif mempunyai lapisan peptidoglikan yang lebih tipis dan dikelilingi oleh lapisan luar yang mengandung lipid.
Pewarnaan Gram menggunakan 4 reagen yang berbeda baik dalam komposisinya maupun mekanisme kerjanya, yaitu :
1. Pewarna Primer (Primary Stain)
Cat Gram A : R/ Kristal violet ... 2 gram (warna ungu) Alkohol 96% ... 20 ml
Kurikulum Berbasis Kompetensi PSPD FK ULM TA 2018/2019 hal 32 Ammonium oxalat 1% in aqua ... 80 ml
Kristal violet (Hucker’s) berwarna ungu digunakan sebagai pewarna pertama dan memberikan warna ungu pada semua sel.
2. Penguat (Mordant)
Cat Gram B : R/ Yodium ... 1 gram (warna coklat) Kalium Iodida ... 2 gram Aquadest ... 300 ml
Yodium Gram berperan sebagai mordant yang akan meningkatkan afinitas (daya ikat) sel terhadap pewarna. Pada saat terjadi ikatan yodium dengan pewarna primer akan terbentuk kompleks yang tidak larut. Resultan kompleks kristal violet-yodium (crystal-iodine complex/CV-I) meningkatkan intentitas warna sehingga semua sel akan tampak berwarna ungu tua.
3. Bahan Peluntur (Decolorizing Agent)
Cat Gram C : R/ Aceton ... 30 ml (tak berwarna) Alkohol ... 70 ml
Etil alkohol 95% berfungsi ganda sebagai agen penghidrasi protein (protein-dehydrating) dan pelarut lemak. Hal ini ditentukan oleh dua faktor yaitu konsentrasi lipid dan dan ketebalan lapisan peptidoglikan di dinding sel bakteri. Pada sel Gram negatif, alkohol meningkatkan porositas dinding sel dengan melarutkan lipid pada lapisan dinding sel. Oleh karena itu, kompleks CV-I dapat dengan mudah dihilangkan dari dinding sel dengan lapisan peptidoglikan dan lipid yang lebih tipis. Efek pelunturan alkohol memudahkan pelepasan kompleks CV-I yang tidak terikat, meninggalkan sel yang tidak/kurang terwarnai. Lapisan peptidoglikan yang lebih tebal pada sel Gram positif berperan dalam retensi kompleks CV-I yang lebih kuat, sehingga pori-pori sel lebih kecil akibat efek dehidrasi dari alkohol. Ikatan yang lebih kuat antara kompleks pewarna primer sulit untuk dihilangkan dan sel tetap berwarna ungu.
4. Pewarna Tandingan (Counterstain)
Cat Gram D : R/ Safranine ... 1 gram (warna merah) Alkohol 96% ... 10 ml Aquadest... 90 ml
Kurikulum Berbasis Kompetensi PSPD FK ULM TA 2018/2019 hal 33 Safranin merupakan reagen terakhir yang digunakan untuk memberi warna merah pada sel-sel yang sebelumnya telah dilunturkan. Karena hanya sel Gram negatif yang dilunturkan sehingga dapat menyerap pewarna ini dan akan berwarna merah. Sel-sel Gram positif tetap mempertahankan warna ungu dari pewarna primer.
Untuk mendapatkan sediaan/preparat yang terwarnai dengan baik harus memperhatikan hal-hal berikut ini :
1. Fase paling kritis pada pewarnaan adalah pada pelunturan (decolorization), yang berdasarkan pada lepasnya kompleks CV-I dari sel. Perlu diingat bahwa pelunturan yang berlebihan akan menghilangkan pewarna primer sehingga organisme Gram positif tampak sebagai Gram negatif. Proses pelunturan yang kurang juga tidak menghilangkan kompleks CV-I secara lengkap sehingga organisme Gram negatif tampak sebagai Gram positif. Dengan demikian harus diperhatikan semua instruksi serta pengalaman dan praktik yang lebih banyak untuk dapat mendapatkan hasil yang tepat.
2. Pada periode antara pemberian setiap reagen, slide dicuci secara langsung di bawah air mengalir atau air diteteskan dengan pipet di atas slide. Hal ini berguna untuk menghilangkan sisa reagen dan mempersiapkan sediaan untuk pemberiaan reagen berikutnya.
3. Preparat dengan pewarnaan Gram terbaik dibuat dari kultur yang baru yaitu berumur tidak lebih dari 24 jam (8-24 jam). Berdasarkan umur kultur, terutama untuk sel-sel Gram positif, maka organisme dapat kehilangan kemampuan untuk mengikat dan mempertahankan warna primer sehingga mungkin tampak sebagai Gram yang bervariasi, sehingga sel-sel sebagian berwarna ungu dan lainnya akan tampak merah Berdasarkan pewarnaan Gram, maka bakteri dapat digolongkan ke dalam bakteri Gram positif dan bakteri Gram negatif.
a. Bakteri Gram positif adalah bakteri yang pada pengecatan Gram akan tahan terhadap alkohol, sehingga tetap mengikat warna cat pertama (Gram A) dan tidak mengikat warna yang kedua (warna kontras/Gram D) sehingga bakteri akan berwarna ungu. b. Bakteri Gram negatif adalah bakteri yang pada pengecatan Gram tidak tahan terhadap
alkohol sehingga warna cat yang pertama (Gram A) akan dilunturkan dan bakteri akan mengikat warna kedua yang diberikan (Gram D) sehingga bakteri akan berwarna merah.
Kurikulum Berbasis Kompetensi PSPD FK ULM TA 2018/2019 hal 34 Prosedur dan Daftar Tilik Pewarnaan Gram
No LANGKAH/KEGIATAN
Nilai
0 1 2
1. Mempersiapkan bahan (cat Gram A, B, C, D, aquadest, minyak imersi, ketas tissue) dan alat (bak pewarnaan, pipet Pasteur/tetes 4 buah, lampu Bunsen, kaca objek, kaca penutup, mikroskop cahaya)
2. Buat sediaan/preparat, dikeringkan di udara kemudian dilakukan fiksasi
3. Preparat yang telah siap diwarnai, perlahan dituangi dengan cat Gram A dan dibiarkan selama 1-3 menit
4. Sisa bahan pewarna dibuang dengan dicuci dengan air mengalir
5. Preparat dituangi dengan cat Gram B dan dibiarkan selama 1 menit
6. Sisa bahan pewarna dibuang dengan dicuci dengan air mengalir
7. Preparat dituangi cat Gram C tetes per tetes selama 5 – 10 detik
8. Sisa bahan pewarna dibuang dengan dicuci dengan air mengalir
9. Preparat dituangi cat Gram D selama 30 – 45 detik
10. Sisa bahan pewarna dibuang dengan dicuci dengan air mengalir
11. Preparat dikeringkan dengan kertas penghisap/tissue, ditetesi minyak imersi dan dilihat di bawah mikroskop cahaya dengan lensa objektif pembesaran 97-100 kali
Kurikulum Berbasis Kompetensi PSPD FK ULM TA 2018/2019 hal 35 Gambar 5. Prosedur Pewarnaan Gram
Kurikulum Berbasis Kompetensi PSPD FK ULM TA 2018/2019 hal 36 PEWARNAAN BAKTERI TAHAN ASAM METODE ZIEHL-NEELSEN
Hampir semua bakteri dapat diwarnai dengan pewarnaan sederhana atau pewarnaan Gram, kecuali sebagian kecil bakteri dari genera/genus Mycobacterium, yang resisten dan hanya dapat diwarnai dengan metode tahan asam (acid-fast). Sejak Mycobacterium
tubeculosis dan Mycobacterium leprae diketahui sebagai bakteri patogen pada manusia,
metode pewarnaan ini menjadi metode diagnostik yang penting dalam mengidentifikasi mikroorganisme tersebut. Pewarnaan tahan asam membagi bakteri menjadi dua golongan, yaitu bakteri tahan asam (acid fast) dan bakteri tidak tahan asam (non acid fast). Karakteristik yang membedakan antara Mycobacteria dan bakteri lainnya adalah adanya dinding sel yang mengandung banyak lilin (wax/lipoidal) yang disebut asam mikolat. Adanya asam mikolat inilah yang menentukan sifat tahan asam dari bakteri tersebut dikarenakan komponen tersebut menyebabkan penetrasi zat warna menjadi sangat sulit. Satu kali zat warna terserap, maka tidak mudah untuk menghilangkannya walaupun menggunakan alkohol asam (alkohol 96% dicampur dengan asam kuat) sebagai bahan peluntur.
Pewarnaan tahan asam ada beberapa metode, tetapi yang sering digunakan adalah pewarnaan tahan asam menurut Ziehl-Neelsen yang ditemukan oleh dua dokter dari Jerman, Franz Ziehl (1859-1926), seorang bakteriologist dan Friedrich Neelsen (1854-1894), seorang patologist. Metode pewarnaan tahan asam yang lain adalah Tan Thiam Hok dan Kinyoun Gabbet.
Pewarnaan tahan asam menggunakan tiga reagen berbeda dan dua jenis intensifier yaitu intensifier kimiawi berupa karbol atau fenol dan intensifier fisis berupa panas. Reagen yang dipakai pada pewarnaan tahan asam yaitu :
Pewarna Primer (Primary Stain)
Cat Ziehl-Neelsen A : R/ Fuchsin basis ... 1 gram
(warna merah) Alkohol 96% ... 10 ml Phenol 5% in aqua ... 90 ml
Karbol fuchsin (carbol fuchsin) digunakan sebagai pewarna dasar dan memberikan warna merah pada sel. Berbeda dengan bakteri lainnya, Mycobacteria tidak dapat diwarnai dengan pewarna yang umum digunakan seperti kristal violet dan methylene blue. Karbol fuchsin merupakan pewarna mengandung fenol yang larut dalam komponen lipoidal (komponen utama dinding sel Mycobacteria). Penetrasi zat warna ditingkatkan oleh panas, yang membawa karbol fuchsin melewati komponen lipoidal dinding sel ke dalam sitoplasma
Kurikulum Berbasis Kompetensi PSPD FK ULM TA 2018/2019 hal 37 sel. Modifikasi Ziehl-Neelsen dengan menggunakan panas atau dengan penambahan Turgitol sebagai wetting agent mengurangi tegangan permukaan antara dinding sel Mycobacteria dan zat warna.
Bahan Peluntur (Decolorizing Agent)
Cat Ziehl-Neelsen A : R/ Asam klorida pekat ... 3 ml
(tak berwarna) Alkohol 96% ... 97 ml R/Asam sulfat pekat ... 5 ml
Alkohol 70% ... 95 ml
Awal pelunturan, sediaan apus menjadi dingin sehingga komponen lilin (wax) dinding sel engeras. Pada pemberian alkohol asam, sel yang tahan asam akan tahan tehadap proses pelunturan sehingga warna primer (cat ZN-A) akan tetap bertahan dan bakteri akan tetap berwarna merah. Ini berbeda dengan sel yang tidak tahan asam sehingga pewarna prime akan luntur dan sel akan kurang berwarna atau tidak berwarna.
Pewarna Tandingan (Counterstain)
Cat Ziehl-Neelsen C : R/ Methylene blue (metilen biru) 0,2%
(warna biru)
Metilen biru merupakan reagen terakhir yang digunakan untuk memberi warna biru pada sel sel yang sebelumnya telah dilunturkan. Karena hanya sel tidak tahan asam yang dilunturkan sehingga dapat menyerap pewarna ini dan akan berwarna biru. Sel-sel tahan asam tetap mempertahankan warna merah dari pewarna primer.
Pewarnaan Ziehl-Neelsen membagi bakteri ke dalam dua golongan yaitu :
a. Bakteri tahan asam dan alkohol; adalah bakteri yang pada pewarnaan Ziehl-Neelsen warna
pertama yang diberikan (ZN-A) tidak dilunturkan oleh asam alkohol (ZN-B), sehingga bakteri tidak akan mengikat warna yang kedua (ZN-C) dan tetap bewarna merah.
b. Bakteri tidak tahan asam dan alkohol; adalah bakteri yang pada pengecatan Ziehl-Neelsen
warna pertama yang diberikan (ZN-A) dilunturkan oleh asam alkohol (ZN-B), sehingga bakteri dapat mengikat warna yang kedua (ZN-C) dan bewarna biru.
Kurikulum Berbasis Kompetensi PSPD FK ULM TA 2018/2019 hal 38 Prosedur dan Daftar Tilik Pewarnaan Ziehl – Neelsen
No LANGKAH/TINDAKAN NILAI
PERSIAPAN TINDAKAN 0 1 2
1 Lakukan cuci tangan rutin 2 Pakai Handscoen
PEWARNAAN SEDIAAN
3 Letakkan sediaan dengan bagian apusan menghadap ke
atas pada rak yang ditempatkan di atas bak cuci atau baskom, antara satu sediaan dengan sediaan lainnya masing-masing berjarak kurang lebih 1 jari.
4 Genangi seluruh permukaan sediaan dengan carbol
fuchsin 0.3%
5 Panasi dari bawah dengan menggunakan sulut api
setiap sediaan sampai keluar uap (sekitar 5 menit), didiamkan kemudian dipanasi lagi sebanyak 3 kali. Usahakan jangan sampai api langsung mengenai sediaan.
6 Diamkan sediaan selama 5 menit
7 Bilas sediaan dengan hati-hati (jangan sampai ada
Kurikulum Berbasis Kompetensi PSPD FK ULM TA 2018/2019 hal 39
8 Miringkan sediaan menggunakan penjepit kayu atau
pinset untuk membuang air
9 Genangi dengan asam alkohol sampai tidak tampak
warna merah carbol fuchsin
10 Bilas sediaan dengan hati-hati (jangan sampai ada percikan ke sediaan lain)
11 Genangi permukaan sediaan dengan methylene blue
0.1% 1 menit
12 Bilas sediaan dengan air mengalir (jangan ada percikan ke sediaan lain)
Kurikulum Berbasis Kompetensi PSPD FK ULM TA 2018/2019 hal 40
13 Miringkan sediaan untuk mengalirkan air
14 Lepas handshoen dan membuang ditempat yang telah
ditentukan
15 Lakukan cuci tangan rutin
KETERAMPILAN PEMBACAAN SEDIAAN APUS
Sediaan dahak yang telah diwarnai dapat dinilai baik atau jelek dengan memperhatikan beberapa hal secara makroskopis dan mikroskopis, di antaranya :
- Kualitas dahak : ditemukan adanya makrofag atau leukosit > 25 LP dengan pembesaran 100x
- Ukuran sediaan: 2 x 3 cm
- Kerataan: Sediaan tampak rata atau tidak terkelupas
- Ketebalan sediaan: seluruh bagian sediaan dapat dilihat dengan jelas pada setiap lapang pandang
- Kualitas pewarnaan: BTA dan latar belakang dapat dibedakan dengan jelas
- Kebersihan sediaan: adanya sisa zat warna, kotoran harus dihindarkan agar tidak mengganggu pembacaan
Kurikulum Berbasis Kompetensi PSPD FK ULM TA 2018/2019 hal 41
Interpretasi BTA
Hasil dilihat dibawah lensa objektif 100 x (+ minyak emersi). Minimum diperiksa sebanyak LP, sebelum dinyatakan negatif (–). Intepretasi BTA (quantitative report) menurut Kemenkes / Union Against Tuberculosis and Lung Diseases ( IUATLD ):
Prosedur dan Daftar Tilik Pembacaan Sediaan Apus
NO LANGKAH / KEGIATAN NILAI
MENCUCI TANGAN 0 1 2
1 Lakukan cuci tangan rutin
MENYIAPKAN MIKROSKOP
2 Siapkan mikroskop dan letakkannya di meja dengan permukaan datar dan tidak licin
3 Atur tegangan lampu ke minimum
4 Nyalakan mikroskop memakai tombol ON
5 Sesuaikan dengan pelan-pelan sampai intensitas cahaya yang diinginkan tercapai
6 Letakkan sediaan yang telah diwarnai ke atas meja sediaan. 7 Putar lensa objektif ke objektif 10 x
8 Atur dengan tombol pengatur fokus kasar dan pengatur fokus halus sampai sediaan terlihat jelas
9 Sesuaikan jarak antar pupil sampai gambar kiri dan gambar kanan menyatu dengan cara menggeser-geser kedua lensa okuler (karena
setiap orang mempunyai jarak antar pupil yang berbeda-beda)
10 Fokuskan gambar dengan mata kanan dengan cara melihat ke dalam okuler kanan dan sesuaikan dengan tombol pengatur focus halus.
11 Fokuskan gambar dengan mata kiri dengan cara melihat ke dalam okuler kiri dan putar. cincin penyesuai diopter sampai didapatkan gambar yang paling jelas, baik untuk mata kiri maupun mata kanan.
12 Buka diafragma sampai 70 – 80%, hingga lapangan pandang terang dengan merata.
Kurikulum Berbasis Kompetensi PSPD FK ULM TA 2018/2019 hal 42 tidak boleh menyentuh kaca objek. Tetesan harus jatuh
bebas ke permukaan sediaan apus agar aplikator minyak emersi tidak terkontaminasi dengan sediaan
14 Putar lensa objektif 100x dengan hati-hati ke atas sediaan apus. Jangan sekali-kali lensa menyentuh kaca sediaan. 15 Sesuaikan fokus dengan hati-hati sampai sel-sel terlihat
dengan jelas
16 Lakukan pembacaan sediaan apus secara sistematis untuk memastikan hasil yang dilaporkan mewakili seluruh bagian sediaan
17 Mulai pembacaan dari ujung kiri ke ujung kanan dan
dilakukan pada sediaan yang sel-selnya terlihat, bila sediaan tampak kosong, geser pada lapang pandang lainnya
18 Lakukan interpretasi sediaan secara kuantitatif
19 Begitu sediaan selesai dibaca, putar objektif 100 x menjauhi kaca sediaan, tempatkan objektif 10 x di atas sediaan, lalu sediaan diambil.
20 Bila telah selesai, atur kembali pengatur tegangan lampu ke minimum dan matikan mikroskop dengan menekan tombol OFF.
21 Setelah selesai pembacaan, bersihkan minyak dari sediaan apus dengan menggunakan kertas tissue
22 Setelah kering, tempatkan sediaan apus tersebut dengan hati-hati dalam kotak penyimpanan guna pengontrolan kualitas oleh laboratorium rujukan
23 Setiap selesai menggunakan mikroskop, bersihkan dengan hati-hati minyak emersi dari lensa objektif 100 x dengan menggunakan kertas lensa/kain halus,
MENCUCI TANGAN
24 Cuci tangan rutin
Keterangan :
0 = Apabila tidak dilakukan
1 = Apabila dilakukan, tetapi salah
Kurikulum Berbasis Kompetensi PSPD FK ULM TA 2018/2019 hal 43
MODUL SKILL LAB
PEMERIKSAAN RADIOLOGI SISTEM RESPIRASI
Pendahuluan
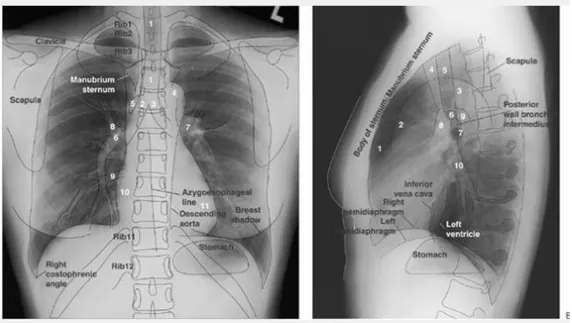
Pemeriksaan radiologi toraks dilakukan dengan modalitas radiologi konvensional dengan proyeksi rutin yaitu Postero-Anterior (PA) dan pemeriksaan suplemen Antero-Posterior (AP), lateral, oblique, dan lordotik. Radiologi toraks bagian yang integral dari pemeriksaan pasien dengan tanda dan gejala traktus respiratorius. Interpretasi foto toraks harus memperhatikan validitas dan kualias foto toraks. Foto toraks yang baik harus memiliki nama/usia, tanggal pembuatan, nomor rekam medis, dan marker. Parameter kualitas foto adalah penetrasi, rotasi, inspirasi, magnifikasi, dan angulasi.
Sasaran Belajar
Setelah mengikuti keterampilan medik ini mahasiswa mampu a. Mengenal foto toraks yang valid untuk dianalisis.
b. Mengenal radioanatomi toraks. c. Mengenal foto toraks yang normal.
Pelaksanaan Validasi foto
Identitas foto: nama pasien , umur, dan jenis kelamin Marker R/L serta nomor foto
Klinis: guna untuk mengetahui apa yang akan dicari. Tidak ada artefak (kalung, proses pencucian yang salah dll) Semua bagian thorax tercakup, tidak boleh ada yang terpotong. Tidak goyang (OS menahan nafas, waktu pemotretan singkat)
Kualitas foto
Syarat foto toraks memiliki kualitas yang baik: 1. Penetrasi
Kualitas foto toraks memiliki nilai kV (60-90 kV) sebagai parameter paparan dan mAs (16-20 mA) sebagai parameter waktu atau lamanya paparan yang diberikan.
2. Rotasi dinilai dengan membandingkan kanan kiri dengan melihat patokan dari midsternal ke kanan dan kiri dari klavikula. Diukur sama panjang atau tidak dengan toleransi 5 mm.
3. Insipirasi maksimal bertujuan agar paru dapat berkembang sempurna sehingga corakan paru dan vaskuler tidak saling tumpang tindih dan terlihat dengan jelas, diafragma terlihat dengan sinusnya dan jantung bias dinilai dengan benar. Parameter inspirasi maksimal adalah ICS 5-6 anterior tepat pada middiafragma.
4. Magnifikasi dapat dilihat pada ukuran jantung normal pada posisi AP