BAB II
TINJAUAN PUSTAKA
2.1 Definisi
Resistensi kuman M. tuberculosis terhadap OAT adalah keadaan di mana kuman tersebut sudah tidak dapat lagi dibunuh dengan OAT (Ditjen PP dan PL, 2013), sedangkan Multidrug Resistant Tuberculosis (resistensi ganda terhadap OAT) didefinisikan sebagai M. tuberculosis yang resisten terhadap isoniazid dan rifampisin, dengan atau tanpa OAT lini pertama lainnya (WHO, 2012; Caminero, 2013). Rifampisin dan isoniazid merupakan 2 obat terbaik untuk melawan M. tuberculosis karena rifampisin dan isoniazid merupakan obat yang paling efektif, paling bertoleransi, dan tidak mahal (Caminero, 2013).
Tuberkulosis resistensi OAT pada dasarnya adalah suatu fenomena buatan manusia atau man made phenomenon, sebagai akibat dari pengobatan pasien TB yang tidak adekuat maupun penularan dari pasien TB resistensi OAT (Ditjen PP dan PL, 2013). Resistensi OAT merupakan infeksi dan dapat ditransmisikan dari manusia ke manusia (Enarson dan Harries, 2013). Multidrug resistant tuberculosis merupakan gambaran dari mismanagement pada penderita TB, salah diagnosa, lamanya menegakkan diagnosa, pengobatan yang tidak tepat atau terputus, serta mistreatment lini pertama dan lini kedua (Hakeem et al, 2010).
Dalam Soepandi (2010) disebutkan bahwa secara umum resistensi terhadap OAT dibagi menjadi :
a. Resistensi primer yaitu apabila pasien sebelumnya tidak pernah mendapat pengobatan OAT atau telah mendapat pengobatan OAT kurang dari 1 bulan. b. Resistensi initial yaitu apabila kita tidak tahu pasti apakah pasien sudah ada
riwayat pengobatan OAT sebelumnya atau belum pernah.
c. Resistensi sekunder yaitu apabila pasien telah mempunyai riwayat pengobatan OAT minimal 1 bulan.
2.2 Epidemiologi
Sampai pada akhir 2012 berdasarkan data yang ada, resistensi terhadap OAT terdapat pada 136 negara (70% dari 194 negara anggota WHO). Ini termasuk 70 negara yang mempunyai sistem survey berkelanjutan berdasarkan diagnostik uji kepekaan obat pada semua pasien dan 66 negara yang mengandalkan data pada survey epidemiologi. Eropa Timur dan khususnya negara-negara di Asia Tengah termasuk negara dengan tingkat TB MDR tinggi (WHO, 2013a). Menurut Frieden et al dalam Soepandi (2010) prevalensi TB meningkat 4,3% di seluruh dunia dan lebih dari 200 kasus baru terjadi di dunia dan di negara berkembang prevalensi TB MDR berkisar 4,6%-22,2%.
Indonesia telah melakukan beberapa survey resistensi OAT untuk mendapatkan data OAT. Survey tersebut diantaranya dilakukan di Kabupaten Timika Papua pada tahun 2004, menunjukkan data kasus TB MDR diantara kasus baru TB adalah 2%; di Propinsi Jawa Tengah pada tahun 2006, data kasus TB MDR diantara kasus baru TB adalah 1,9% dan kasus TB MDR pada TB yang pernah diobati sebelumnya adalah 17,1%; di Kota Makasar pada tahun 2007, data kasus TB MDR diantara kasus baru TB adalah 4,1% dan pada TB yang pernah diobati sebelumnya adalah 19,2% (Ditjen PP dan PL, 2013).
Penelitian yang dilakukan oleh Pires et al di Mozambique tahun 2011 menunjukkan dari 280 pasien TB MDR, 188 (65,7%) diantaranya mempunyai riwayat pengobatan TB sebelumnya dan laki-laki dengan usia 21-40 tahun lebih sering menderita TB MDR. Penelitian lain yang dilakukan di Brazil pada tahun 2007 menunjukkan bahwa dari 299 penderita TB MDR, 221 (73,9%) diantaranya adalah laki-laki dan 77 (27,3%) mempunyai riwayat TB serta usia rata-rata penderita TB adalah 36 tahun. Prevalensi TB MDR 4,7%, 2,2% diantaranya adalah dari kasus baru TB dan 12% diantaranya dari pasien yang mempunyai riwayat pengobatan TB sebelumnya. Lamanya waktu diagnosa dan riwayat pengobatan sebelumnya dapat digunakan sebagai prediksi TB MDR (Micheletti et al, 2014).
2.3 Faktor yang Mempengaruhi Terjadinya TB MDR
Faktor utama penyebab terjadinya resistensi kuman terhadap OAT adalah ulah manusia sebagai akibat tatalaksana pengobatan pasien TB yang tidak dilaksanakan dengan baik. Penatalaksanaan pasien TB yang tidak adekuat tersebut dapat ditinjau dari sisi:
1. Pemberi jasa/petugas kesehatan, yaitu karena: a. Diagnosis tidak tepat
b. Pengobatan tidak menggunakan paduan yang tepat
c. Dosis, jenis, jumlah obat, dan jangka waktu pengobatan yang tidak adekuat
d. Penyuluhan kepada pasien yang tidak adekuat 2. Pasien, yaitu karena:
a. Tidak memenuhi anjuran dokter/petugas kesehatan b. Tidak teratur menelan paduan OAT
c. Menghentikan pengobatan secara sepihak sebelum waktunya d. Gangguan penyerapan obat
3. Program Pengendalian TB, yaitu karena: a. Persediaan OAT yang kurang
b. Kualitas OAT yang disediakan rendah atau Pharmaco-vigillance (Ditjen PP dan PL, 2013).
4. Obat
a. Pengobatan TB jangka waktunya lama lebih dari 6 bulan sehingga membosankan pasien
b. Obat toksik menyebabkan efek samping sehingga pengobatan komplit atau sampai selesai gagal
c. Obat tidak dapat diserap dengan baik misalnya rifampisin diminum setelah makan atau ada diare
5. Faktor HIV/AIDS
a. Kemungkinan terjadinya TB MDR lebih besar b. Gangguan penyerapan obat
6. Faktor kuman
Kuman M. tuberculosis super strain (kuman yang resisten paling sedikit 3 atau 4 OAT) sangat virulen dan memiliki daya tahan tubuh lebih tinggi (Soepandi, 2010).
Penderita dengan resiko resisten OAT dibagi atas 3 kelompok yaitu: penderita yang kontak dengan pasien yang resisten OAT, penderita yang pernah mendapat pengobatan, dan penderita yang gagal pengobatan (Pinto dan Menzies, 2011). Penelitian yang dilakukan Liang et al pada tahun 2012 di Cina menunjukkan bahwa pasien yang mendapat pengobatan ulang beresiko 5,48 kali (95% CI 4,04 -7,44) menderita TB MDR dibandingkan dengan kasus baru. Pasien yang pernah mendapat isoniazid dan rifampisin lebih dari 180 hari beresiko 4,82 kali (95% CI 2,97-7,81) menderita TB MDR dibandingkan dengan pasien yang pernah mendapat isoniazid dan rifampisin kurang dari 180 hari. Ada hubungan antara usia dan lamanya mendapat pengobatan TB dengan TB MDR. Kemiskinan, kurangnya pengetahuan, dan efek samping pengobatan TB juga merupakan faktor yang mempengaruhi terjadinya TB MDR. Kurangnya koordinasi pelayanan dan pengawasan pengobatan yang tidak memuaskan dapat mengancam pengendalian TB MDR.
Pasien yang mendapat beberapa pengobatan TB dan mendapat pengobatan terakhir di rumah sakit 13 kali rmempunyai resiko TB MDR dibandingkan dengan pasien yang mendapat pengobatan di tempat lain. Ada beberapa penjelasan yang mungkin untuk penemuan kasus ini: pasien mungkin saja sudah TB MDR ketika pasien terdaftar di rumah sakit dan pasien tidak menerima pengobatan yang efektif untuk TB MDR; pasien telah terdaftar tanpa TB MDR dan menerima pengobatan salah yang menyebabkan permasalahan dalam perkembangan TB MDR; atau pasien adalah TB MDR yang didapat dari transmisi nosokomial (Zhao et al, 2012).
Menurut Masniari et al dalam Sarwani (2012), pengobatan yang terputus ataupun tidak sesuai dengan standar Directly Observed Treatment, Short-Course (DOTS) juga dapat berakibat pada munculnya kasus TB MDR. Penyebaran TB MDR, maupun TB MDR dengan HIV dan tidak tersedianya rapid diagnostic ikut
menyumbang terjadinya kegagalan pengendalian TB di seluruh dunia (Lawn dan Nicol, 2011; Zumla et al, 2013). Bahkan di negara kaya, TB MDR berhubungan dengan meningkatnya resiko yang merugikan, termasuk kematian (Low et al, 2009; Migliori et al, 2009; Minion et al, 2013).
2.4 Klasifikasi Resistensi OAT
Menurut WHO (2013b) dan dalam buku petunjuk Direktorat Jenderal Pengendalian Penyakit dan Penyehatan Lingkungan (Ditjen PP dan PL) tahun 2013 klasifikasi resistensi OAT yaitu:
a. Monoresitance: resisten terhadap salah satu OAT misalnya resisten isoniazid (H).
b. Polyresistance: resisten terhadap lebih dari satu OAT, selain kombinasi isoniazid (H) dan rifampisin (R), misalnya resistensi isoniazid dan etambutol (HE), rifampisin etambutol (RE), isoniazid etambutol dan streptomisin (HES), rifampisin etambutol dan streptomisin (RES).
c. Multi Drug Resistance (MDR): resisten terhadap isoniazid dan rifampisin dengan atau tanpa OAT lini pertama yang lain, misalnya HR, HRE, HRES. d. Extensively Drug Resistance (XDR): TB MDR disertai resisten terhadap salah
satu obat golongan fluorokuinolon dan salah satu dari OAT injeksi lini kedua (kapreomisin, kanamisin dan amikasin).
e. TB Resisten Rifampisin (TB RR): resisten terhadap rifampisin (monoresisten, poliresisten, TB MDR, TB XDR) yang terdeteksi menggunakan metode fenotip atau genotip dengan atau tanpa resisten OAT lainnya.
2.5 Suspek TB Resisten Obat
Suspek TB resisten obat adalah semua orang yang mempunyai gejala TB yang memenuhi satu atau lebih kriteria suspek di bawah ini:
1. Pasien TB kronik.
2. Pasien TB pengobatan kategori 2 yang tidak konversi setelah 3 bulan pengobatan.
3. Pasien TB yang mempunyai riwayat pengobatan TB yang tidak standar serta menggunakan kuinolon atau obat injeksi lini kedua minimal selama 1 bulan.
4. Pasien TB kategori 1 yang gagal.
5. Pasien TB pengobatan kategori 1 yang tetap positif setelah 3 bulan pengobatan.
6. Pasien TB kasus kambuh (relaps) kategori 1 dan kategori 2.
7. Pasien TB kasus kambuh setelah loss to follow-up (lalai berobat/default). 8. Suspek TB yang mempunyai riwayat kontak erat dengan pasien TB MDR. 9. Pasien koinfeksi TB-HIV yang tidak respon terhadap pemberian OAT.
Pasien yang memenuhi salah satu kriteria suspek TB resisten obat harus dirujuk secara sistematik ke RS Rujukan TB MDR untuk kemudian dikirim ke laboratorium rujukan TB MDR dan dilakukan pemeriksaan apusan basil tahan asam (BTA) mikroskopis, biakan, dan uji kepekaan M. tuberculosis dengan metode konvensional maupun rapid test atau metode cepat (Ditjen PP dan PL, 2013).
2.6 Mekanisme Resistensi M. tuberculosis Terhadap OAT
Mycobacterium tuberculosis merupakan kuman obligat aerob dan pertumbuhannya memerlukan oksigen konsentrasi tinggi. Pada lesi kavitas parenkim paru yang mempunyai oksigen konsentrasi tinggi, M. tuberculosis bereplikasi dengan cepat (Chiang, 2013). Resistensi terhadap OAT bukanlah fenomena yang baru terjadi. Sejak pertama kali antimikroba digunakan untuk pengobatan TB, munculnya resistensi obat telah meningkat, sehingga antimikroba yang baru menjadi banyak digunakan di masyarakat (Enarson dan Harries, 2013). Strain M. tuberculosis resisten terhadap strepromisin segera muncul setelah diperkenalkannya obat untuk mengobati TB pada tahun 1944 (Zhang dan Yew, 2009).
Resisten terhadap antimikroba merupakan karakteristik innate (bawaan) M. tuberculosis. Hal ini berhubungan dengan mutasi genetik yang terjadi secara alamiah pada sebagian besar populasi M. tuberculosis wild type dimana antimikroba belum pernah digunakan dan tidak menimbulkan gejala klinis. Timbulnya gejala klinis yang signifikan disebabkan karena pemakaian antimikroba yang salah dan ini merupakan fenomena buatan manusia. Jika pasien
hanya diobati dengan 1 antimikroba saja (hanya 1 M. tuberculosis yang sensitif), M. tuberculosis yang sensitif akan mati, sedangkan M. tuberculosis yang resisten bertahan untuk memperbanyak diri sehingga seluruh populasi M. tuberculosis menjadi resisten obat. Resisten terhadap lebih dari 1 jenis antimikroba biasanya terjadi ketika antimikroba terus menerus digunakan dengan salah, sehingga M. tuberculosis yang resisten obat jumlahnya semakin banyak (Enarson dan Harries, 2013).
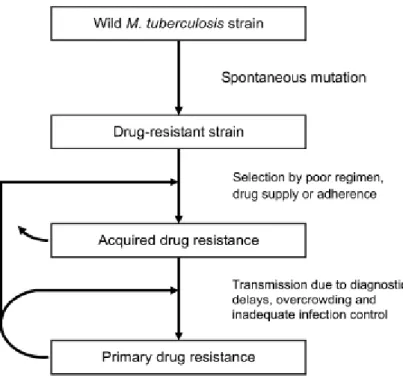
Gambar 2.1 Konsep Perkembangan Resistensi OAT (Sumber : Zhang & Yew, 2009)
Secara mikrobiologi resistensi disebabkan oleh mutasi genetik dan hal ini membuat obat tidak efektif melawan basil mutan. Mutasi terjadi secara spontan dan berdiri sendiri menghasilkan resistensi OAT. Pada kasus baru resisten OAT terdapat galur M. tuberculosis pada pasien baru yang didiagnosis TB dan sebelumnya tidak pernah diobati dengan OAT atau durasi kurang dari 1 bulan. Pasien ini terinfeksi galur M. tuberculosis yang resisten OAT disebut dengan resistensi primer. Kasus resisten OAT yang telah diobati sebelumnya yaitu terdapatnya galur M. tuberculosis resisten pada pasien selama mendapatkan terapi TB paling sedikit 1 bulan. Pada awalnya TB resisten OAT terjadi karena terinfeksi
galur M. tuberculosis yang masih sensitif obat tetapi selama perjalanan terapi timbul resistensi obat atau disebut dengan resistensi obat yang didapat atau resistensi sekunder. Populasi galur M. tuberculosis resisten mutan dalam jumlah kecil dapat dengan mudah diobati. Terapi yang tidak adekuat menyebabkan proliferasi dan meningkatkan populasi galur resisten obat (Hanafi dan Prasenohadi, 2010).
Mekanisme terjadinya resistensi obat yaitu:
a. Intrinsik Drug Resistance atau Natural Resistance (Resistensi Obat Intrinsik atau Resistensi Alami)
Resistensi obat intrinsik M. tuberculosis terjadi karena adanya struktur asam mikolat yang terkandung dalam dinding sel yang menyebabkan bakteri mempunyai permeabilitas yang rendah terhadap berbagai jenis bahan seperti antibiotik dan obat kemoterapi lainnya (Da Silva dan Palomino, 2011; Chiang, 2013).
Hasil penelitian menunjukkan bahwa pada M. tuberculosis, aktivitas β-laktamase dikode oleh blaC dan blaS. Penelitian terbaru menunjukkan bahwa dalam M. tuberculosis, Rv1698 mempunyai peranan fungsi yang sama dengan MspA dalam resistensi intrinsik terhadap bahan hidrofilik. Tidak hanya permeabilias barier atau β-laktamase yang bertanggung jawab terhadap resistensi
intrinsik tetapi juga adaptasi fisiologi yang terjadi diantara host (Da Silva dan Palomino, 2011).
b. Acquired Drug Resistance (Resistensi Obat Didapat)
Penelitian yang dilakukan Kochi et al dalam Da Silva dan Palomino (2011) menunjukkan bahwa resistensi M. tuberculosis berbeda dengan bakteri lainnya. Pada bakteri lain resistensi obat didapat umumnya terjadi melalui perpindahan horizontal dengan elemen genetik seperti plasmid, transposon atau integron. Resistensi obat didapat pada M. tuberculosis kebanyakan disebabkan oleh mutasi spontan pada gen kromosomal, menghasilkan seleksi strain M. tuberculosis resisten selama pemakaian obat yang kurang optimal (Da Silva dan Palomino, 2011; Chiang, 2013).
Menurut penelitian yang dilakukan David dalam Chiang (2013), rata-rata mutasi tiap bakteri/generasi adalah 2,56 X 10-8 untuk isoniazid, 2,95X10-8 untuk streptomosin, 2,2X10-7 untuk etambutol dan 2,25X10-10 untuk rifampisin. Penelitian lain menunjukkan bahwa rata-rata mutasi terjadi pada seleksi obat alami, tetapi pada kebanyakan OAT hal ini terjadi pada rata-rata 10-9 mutasi perbagian sel. Hal ini merupakan alasan utama mengapa OAT diberikan banyak kombinasi, karena suatu mutan beresiko mengalami 2 mutasi resisten 10-18 (Da Silva dan Palomino, 2011).
Menurut Espinal dalam Patel et al (2012) ketika diobati dengan 1 jenis obat, populasi basil TB awalnya berkurang karena membunuh populasi TB yang sensitif dan pada sputum smear (apusan dahak) sering memberikan hasil yang negatif (menunjukkan bahwa organisme hanya sedikit). Organisme yang bertahan pada fase awal adalah mutan yang resisten obat, kemudian berproliferasi dan akhirnya menyebabkan seluruh populasi basil menjadi resisten obat dan terus menerus melakukan proliferasi sampai jumlah basil yang resisten obat cukup untuk menyebabkan gejala dan pada sputum smear memberikan hasil positif, inilah yang disebut dengan “fall and rise phenomenon”.
Menurut Canetti dan Crofton dalam Pinto dan Menzies (2011) jika hanya diobati dengan 1 jenis obat saja, bacillary load organisme melebihi 106 dan munculnya strain yang resisten obat pasti terjadi. Jika bacillary load melebihi 108, resistensi berkembang jika hanya 2 obat saja yang digunakan. Bacillary load yang melebihi 106 terjadi pada penderita dengan infiltrat tuberkulosis (ketika hasil apusan dahak negatif meskipun hasil kulturnya positif) dan melebihi 108 ketika kavitas ada pada penderita TB dan biasanya sputum direct smear (apusan langsung) hasilnya positif.
2.6.1 Resistensi Terhadap Isoniazid
Isoniazid merupakan salah satu obat utama dalam pengobatan TB (Zhang & Yew, 2009; Da Silva dan Palomino, 2011). Isoniazid hanya aktif melawan pertumbuhan kuman M. tuberculosis dan tidak aktif melawan yang bukan M. tuberculosis atau di dalam suasana asam (Zhang dan Yew, 2009). Isoniazid memiliki struktur yang sederhana yang berisi cincin piridin dan grup hidrazid
yang merupakan komponen penting untuk aktivitas melawan M. tuberculosis. Meskipun strukturnya sederhana, tetapi kerja isoniazid lebih rumit dan strain resisten isoniazid telah diisolasi segera setelah aktivitas anti TB diketahui. Resistensi terhadap isoniazid merupakan proses yang rumit. Mutasi pada beberapa gen termasuk katG, ahpC, inhA, kasA dan ndh telah dihubungkan dengan resistensi isoniazid (Da Silva dan Palomino, 2011).
Isoniazid merupakan pro-drug yang membutuhkan aktivasi enzim katalase/peroksidase yang dikode oleh katG (Zhang dan Yew, 2009; Da Silva dan Palomino, 2011). Aktivasi isoniazid dipengaruhi oleh sintesis asam mikolat dengan menginhibisi NADH-dependent enoyl-ACP reduktase, yang dikode oleh inhA (Da Silva dan Palomino, 2011). Mekanisme dua molekuler tersebut telah menunjukkan bahwa penyebab utama resistensi isoniazid yaitu mutasi pada katG dan mutasi pada inhA atau lebih, dalam region promoter (Zhang dan Yew, 2009; Da Silva dan Palomino, 2011).
Beberapa penelitian menunjukkan bahwa dari analisa 240 alele menjelaskan hubungan resistensi isoniazid dan menemukan mutasi pada katG, inhA dan ahpC lebih kuat hubungannya dengan resistensi isoniazid, sementara mutasi pada kasA tidak ada hubungannya dengan resistensi (Da Silva dan Palomino, 2011). Frekuensi terjadinya mutasi katG dalam strain resisten isoniazid antara 50% sampai 90% dan frekuensi terjadinya mutasi inhA antara 4% sampai 83%. Oleh karena itu metode molekuler untuk mendeteksi mutasi katG atau mutasi inhA kemungkinan tidak sensitif untuk mendeteksi adanya resistensi isoniazid (Chiang, 2013).
2.6.2 Resistensi Terhadap Rifampisin
Rifampisin merupakan lipophylic ansamycin yang diperkenalkan pada tahun 1972. Oleh karena kerja antimikroba yang efisien, rifampisin dianjurkan bersama dengan isoniazid menjadi dasar pada pengobatan TB (Da Silva dan Palomino, 2011). Rifampisin merupakan obat yang paling efektif untuk melawan M. tuberculosis dan mungkin merupakan satu-satunya obat yang mampu membunuh mikroorganisme dalam semua kondisi pertumbuhan metabolik (Caminero, 2013).
Target rifampisin pada M. tuberculosis adalah sub unit βRNA (ribonucleid acid) polymerase, yang mengikat dan menginhibisi perpanjangan RNA messenger atau mRNA (Da Silva & Palomino, 2011). Karakteristik utama rifampisin adalah melawan secara aktif kuman yang sedang tumbuh dan yang lambat metabolismenya atau tidak tumbuh (Zhang dan Yew, 2009; Da Silva dan Palomino, 2011).
Resistensi rifampisin pertama kali diketahui pada tahun 1970-an, tetapi tidak mendapat perhatian sampai pada tahun 1990-an (Caminero, 2013). Mycobacterium tuberculosis yang resisten rifampisin menunjukkan adanya mutasi
pada gen rpoB yang dikode β-subunit RNA polymerase. Hasil ini menyebabkan afinitas obat yang rendah dan berkembangnya resistensi. Mutasi pada hot spot region pada 81 base phare (bp) dari rpoB telah ditemukan pada sekitar 96% M.
tuberculosis yang resisten rifampisin. Region ini, pada kodon 507-533, juga
dikenal sebagai rifampicin resistance-determining region (RRDR). Mutasi pada kodon 531 dan 526 (Da Silva dan Palomino, 2011), 516 lebih sering dilaporkan pada kebanyakan penelitian (Zhang dan Yew, 2009; Da Silva dan Palomino, 2011).
Beberapa studi juga melaporkan adanya mutasi di luar hot spot region
rpoB dari M. tuberculosis resisten rifampisin yang diisolasi. Penelitian di Vietnam
menunjukkan bahwa prevalensi mutasi resisten rifampisin pada rpoB region core
(76%) sama dengan prevalensi resistensi isoniazid dengan mutasi di katG kodon 315 sebesar 76,83% (Minh et al, 2012). Hal utama yang berhubungan dengan rifampisin adalah hampir semua strain yang resisten rifampisin juga menunjukkan resisten terhadap obat lain, khususnya isoniazid (Yao et al, 2010; Da Silva dan Palomino, 2011). Untuk alasan inilah deteksi resistensi rifampisin telah diajukan sebagai surrogate molecular marker (penanda molekular pengganti) untuk MDR
(Da Silva dan Palomino, 2011). Metode molekuler untuk mendeteksi mutasi rpoB pada resisten terhadap rifampisin umumnya lebih sensitif daripada metode yang digunakan untuk mendeteksi katG atau mutasi inhA untuk identifikasi mutasi isoniazid (Chiang, 2013).
2.6.3 Resistensi Terhadap Pirazinamid
Pirazinamid adalah suatu struktur analog nikotinamid dan pro-drug yang memerlukan konversi dari asam pirazinoik oleh enzim pirazinamidase (PZase) yang dikode dalam M. tuberculosis oleh gen pncA. Pirazinamid ditemukan pada tahun 1952 dan selanjutnya digunakan dalam pengobatan TB yang sebelumnya selama 9 bulan menjadi 6 bulan (Zhang dan Yew, 2009; Da Silva dan Palomino, 2011). Salah satu karakteristik pirazinamid adalah kemampuannya menginhibisi basil semi dorman yang ada dalam suasana asam ((Da Silva dan Palomino, 2011; Chiang, 2013) dan membunuh basil yang tidak dapat dibunuh oleh obat lain jika dalam suasana asam (Zhang dan Yew, 2009). Aktivitas pirazinamid meningkat dalam oksigen yang sedikit atau dalam kondisi anaerobik (Chiang, 2013).
Beberapa penelitian menunjukkan bahwa pirazinamid memasuki M. tuberculosis melalui difusi pasif, dikonversi ke dalam asam pirazinoik oleh PZase dan diekskresikan oleh efflux pump yang lemah. Dalam suasana asam, proton asam pirazinoik diabsorbsi dan diakumulasi di dalam sel oleh karena efflux pump yang tidak efisien, menghasilkan kerusakan selular. Teori lain juga menyatakan bahwa asam pirazinoik dan n-propil ester menghambat sintesa asam lemak tipe 1 dalam replikasi kuman. Mutasi pada pncA merupakan mekanisme utama resistensi pirazinamid dalam M. tuberculosis. Perubahan terbanyak terjadi pada region 561 bp atau pada region 82 bp putative promoter (Da Silva dan Palomino, 2011).
2.6.4 Resistensi Terhadap Streptomisin
Streptomisin merupakan suatu antibiotika aminocyclitol glicoside yang merupaka antibiotika pertama yang digunakan dalam pengobatan TB. Streptomisin pertama kali diisolasi dari mikroorganisme tanah, Streptomyces griseus (Da Silva dan Palomino, 2011). Streptomisin menghambat sintesa protein dengan mengikat 30S subunit ribosom bakteri, menyebabkan kesalahan membaca pesan mRNA selama translasi. Resistensi streptomisin disebabkan oleh mutasi pada S12 protein yang dikode oleh gen rpsL dan 16S rRNA yang dikode gen rrs (Zhang dan Yew, 2009).
Mutasi pada rpsL (50%) dan rrs (20%) merupakan mekanisme utama pada resistensi streptomisin (Zhang dan Yew, 2009; Da Silva dan Palomino, 2011). Mutasi utama pada rpsL adalah subsitusi pada kodon 43 dari lisin ke arginin yang menyebabkan resisten yang tinggi terhadap streptomisin. Mutasi juga terjadi pada kodon 88. Mutasi gen rrs terjadi pada loop 16S rRNA yang terdiri dari 2 region ‘ nukleotida 530 dan 915 (Zhang dan Yew, 2009).
2.6.5 Resistensi Terhadap Etambutol
Etambutol, 2,2’-(1,2-ethanediyldiimino) bis-1-butanol, pertama kali digunakan pada tahun 1966 melawan TB dan bersama isoniazid, rifampisin dan pirazinamid, sebagai obat lini pertama yang digunakan untuk pengobatan TB. Etambutol aktif melawan kuman dengan mengganggu biosintesa arabinogalaktan dinding sel (Zhang dan Yew, 2009; Da Silva dan Palomino, 2011). Etambutol menghambat polymerase dinding sel arabinan dari arabinogalaktan dan lipoarabinomannan dan menyebabkan akumulasi D-arabinofuranosyl-P-decaprenol, perantara dalam biosintesa arabinan (Zhang dan Yew, 2009).
Beberapa tahun yang lalu, resistensi etambutol menunjukkan bahwa dalam M. tuberculosis gen embCAB diatur sebagi 10 kbp operon yang dikode untuk mycobacterial arabinosyl transferase. Pada penelitian isolat M. tuberculosis yang resisten etambutol, menunjukkan bahwa hampir 50% mengalami mutasi pada kodon 306 embB. Penelitian lebih lanjut yang dilakukan Sreevatsan et al menunjukkan adanya hubungan embB dengan resistensi terhadap etambutol (Da Silva dan Palomino, 2011).
2.7 Diagnosis dan Pemeriksaan Laboratorium
Diagnosis TB resisten obat dipastikan berdasarkan uji kepekaan M. tuberculosis baik secara metode konvensional maupun rapid test atau metode cepat (Ditjen PP dan PL, 2013) dan semua metode mempunyai keunggulan dan kelemahan (Ditjen Bina Upaya Kesehatan, 2012).
1. Metode Konvensional
Uji kepekaan obat pada kultur spesimen merupakan metode konvensional yang digunakan untuk mendeteksi resistensi obat lini pertama dan lini kedua
(WHO, 2013a) dengan menggunakan media cair/Mycobacterial Growth Indicator Tube (MGIT) atau media padat/Lowenstein Jensen (Ditjen PP dan PL, 2013). Pasien yang dilakukan uji kepekaan obat pada tahun 2012 hanya terjadi peningkatan sedikit dibandingkan pada tahun 2011 yaitu hanya 5,1% dari kasus baru dan 8,7% dari kasus yang pernah mendapat pengobatan (WHO, 2013a). Biakan M. tuberculosis dilakukan untuk konfirmasi diagnosa, pemantauan terapi, dan penentuan kesembuhan.
Cara proporsi media LJ merupakan salah satu cara yang terstandarisasi (Ditjen Bina Upaya Kesehatan, 2012). Media LJ merupakan modifikasi dari media Lowenstein yang dikembangkan oleh Jensen, yang menggunakan telur segar (Accumedia, 2010; Essaway et al, 2014). Jensen memodifikasi medium dengan mengganti sitrat dan fosfat, mengeliminasi congo red, dan meningkatkan konsentrasi malachite green. Pemakaian media dari telur untuk isolasi primer mycobacteria mempunyai dua keuntungan yaitu media telur dapat digunakan untuk berbagai macam tipe mycobacteria dan pertumbuhan mycobacteria pada media telur dapat digunakan untuk uji niasin (Accumedia, 2010). Medium LJ mengandung gliserol untuk pertumbuhan M. tuberculosis, sedangkan medium LJ tanpa gliserol tetapi mengandung piruvat untuk pertumbuhan Mycobacterium bovis (Ministry of Health and Family Welfare, 2009).
Prinsip prosedur media LJ yaitu: L-Asparagin dan potato meal merupakan sumber nitrogen dan vitamin dalam media LJ. Monopotasium fosfat dan magnesium fosfat meningkatkan pertumbuhan organisme dan bertindak sebagai buffer. Gliserol dan suspensi telur menghasilkan asam lemak dan protein yang dibutuhkan untuk metabolisme mycobacteria. Koagulasi dan albumin telur selama sterilisasi menghasilkan media padat untuk fungsi inokulasi. Sodium sitrat dan malachite green merupakan agen selektif untuk mencegah adanya kontaminasi dan membiarkan pertumbuhan dini mycobacteria (Accumedia, 2010).
Dalam Sjahrurachman (2010) disebutkan bahwa jumlah koloni pada permukaan media yang mengandung obat menandakan jumlah kuman yang resisten. Jumlah koloni pada permukaan media yang mengandung obat dibagi dengan jumlah koloni pada permukaan media yang tanpa obat akan menghasilkan proporsi kuman yang resisten untuk galur tersebut. Dalam Petunjuk Teknis
Pemeriksaan Biakan, Identifikasi dan Uji Kepekaan Mycobacterium tuberculosis pada Media Padat, Ditjen Bina Upaya Kesehatan (2012), disebutkan bahwa jika proporsi kuman terhadap obat tertentu dibawah 1 persen, maka kuman dinyatakan sensitif terhadap obat tersebut. Jika proporsinya ≥ 1 % maka kuman dinyatakan resisten terhadap obat tersebut. Untuk menilai proporsi kuman yang resisten, tetapkan angka tertinggi pada media tanpa obat, baik yang didapat pada hari ke 28 atau hari ke 42. Untuk media yang mengandung obat, pilih pengenceran yang menghasilkan jumlah koloni antara 20-100 sebagai prioritas utama, jika tak ada, pilih pengenceran dengan jumlah koloni 5-19.
Berdasarkan kriteria diatas, proporsi (penetapan resistensi) dapat dihitung sbb:
% resistansi = Jumlah koloni pada media dengan obatJumlah koloni pada media tanpa obat X 100%
Uji kepekaan obat konvensional merupakan gold standar atau baku emas, dengan sensitivitas tinggi yang dapat mengidentifikasi M. tuberculosis dan membedakan antara obat yang sensitif dengan obat yang resisten. Tetapi kultur M. tuberculosis mempunyai banyak keterbatasan, memerlukan waktu lama, menghambat dokter untuk membuat keputusan pengobatan dan kultur juga membutuhkan biosafety infrastruktur yang tidak dapat dilaksanakan dengan mudah pada keadaan dengan sumber daya yang terbatas. Kultur media cair (BACTEC TM MGIT 960 dan MGIT DST [BD Diagnostic Systems, NJ, USA]) telah berkembang dan telah disetujui WHO untuk digunakan pada negara miskin dan negara berkembang. Walaupun lebih cepat, tetapi metode kultur media cair memerlukan keahlian khusus, mahal dan cenderung terkontaminasi (Van Rie et al, 2010).
Penelitian yang dilakukan Yadav et al (2013) di India menunjukkan bahwa kelemahan metode kultur konvensional dengan media LJ adalah adanya kontaminasi sebesar 57% atau hasil kultur yang negatif sebesar 38%. Pada uji kepekaan obat dengan media LJ memerlukan waktu yang lebih lama yaitu 70 hari (28 hari untuk kultur pertumbuhan kuman dan 42 hari untuk uji kepekaan obat).
2. Tes Cepat (Rapid Test)
Dalam Petunjuk Ditjen PP dan PL (2013), disebutkan bahwa tes cepat saat ini dibatasi menggunakan metode yang sudah mendapat persetujuan dari WHO (WRD: WHO Approved Rapid Diagnostic Methods) yaitu metode Line Probe Assay (LPA) dan GeneXpert MTB/RIF test.
1. Line Probe Assay (LPA)
Line Probe Assay merupakan pemeriksaan molekuler berdasarkan Polymerase Chain Reaction (PCR) dan dikenal sebagai Hain test/GenoType MTB DRplus (Ditjen PP dan PL, 2013). Teknologi molekuler LPA sebagai rapid test untuk mendeteksi TB MDR didukung WHO pada tahun 2008 (WHO, 2013d). Teknologi LPA terdiri dari 4 langkah yaitu: ekstraksi DNA dari isolasi M. tuberculosis (uji tidak langsung) atau secara langsung dari spesimen klinik (uji langsung), amplifikasi PCR untuk menentukan region gen dengan menggunakan primer, hibridisasi produk PCR dengan oligonicleotide probe spesifik (WHO, 2013c; Yadav et al, 2013) dan capture hibridisasi yang dideteksi dengan kolorimetri yang memungkinkan deteksi keberadaan M. tuberculosis complex sama baiknya dengan mendeteksi keberadaan wild type dan mutasi probe untuk resistensi (WHO, 2013c).
Line Probe Assay atau MTB DRplus dapat mendeteksi dua resistensi yaitu resistensi rifampisin dan isoniazid (Calligaro et al, 2014; Raizada et al, 2014). Hasil penelitian menunjukkan bahwa sebagian besar dari M. tuberculosis yang resisten terhadap rifampisin ternyata juga resisten terhadap isoniazid sehingga tergolong TB MDR (Ditjen PP dan PL, 2013). Penelitian di India yang membandingkan metode LPA dengan metode uji kepekaan obat konvensional menggunakan media padat LJ menunjukkan bahwa secara keseluruhan hasil tes LPA serupa dengan hasil uji kepekaan obat dengan media LJ dan waktu yang dibutuhkan LPA lebih cepat yaitu 48 jam (Yadav et al, 2013). Beberapa penelitian menunjukkan bahwa LPA mempunyai sensitivitas ≥97% dan spesifisitas ≥99% untuk mendeteksi resistensi rifampisin (Albert et al, 2010; Raizada et al, 2014) dan untuk mendeteksi resistensi isoniazid juga mempunyai sensitivitas dan spesifisitas yang tinggi
yaitu ≥90% dan ≥99% dibandingkan dengan kultur dan hasil uji kepekaan obat konvensional (Albert et al, 2013).
Kebanyakan hasil LPA yang tidak valid ditemukan pada spesimen sputum dengan bacillary load yang rendah (1+) atau sampel kultur negatif, sesuai dengan petunjuk bahwa LPA tidak cocok digunakan pada spesimen dengan apusan dahak negatif (Yadav et al 2013). Kelemahan metode GenoType MTBDRplus adalah biaya yang mahal, memerlukan infrastruktur tepat, pelatihan yang memenuhi syarat dan keahlian petugas laboratorium (Albert et al, 2010; Yadav et al, 2013). Tes LPA juga tidak berguna pada spesimen sputum dengan bacillary load rendah dan spesimen paucibacillary TB ekstra paru. Genexpert MTB/RIF tidak dapat mendeteksi resistensi isoniazid dan hal ini dapat menyebabkan luputnya kasus monoresisten isoniazid. Oleh karena itu dapat disimpulkan bahwa diantara metode molekuler, LPA memberikan profil uji kepekaan obat yang lebih baik dibandingkan dengan Genexpert MTB/RIF. Metode LPA juga berguna pada surveilan pada negara dengan monoresisten isoniazid yang tinggi (Yadav et al, 2013).
2. GeneXpert MTB/RIF
GeneXpert MTB/RIF adalah suatu alat uji yang menggunakan catridge berdasarkan Nucleic Acid Amplification Test (NAAT) secara automatis untuk mendeteksi kasus TB dan resistensi rifampisin, cocok untuk negara endemis, (WHO, 2013a) dan dapat dilakukan walaupun sampel sputum hanya 1 ml (Hakeem et al, 2013). Uji konvensional untuk mendiagnosa TB resisten OAT yang mengandalkan kultur bakteri dan uji kepekaan obat yang telah lama digunakan merupakan proses yang lama dan tidak praktis. Pada saat ada kemungkinan pasien menerima pengobatan yang tidak tepat, strain M. tuberculosis yang resisten obat dapat menyebar dan resistensi dapat menjadi lebih luas (WHO, 2013d).
Meskipun metode molekuler yang telah ada sebelumnya untuk mendiagnosa TB resisten OAT, tetapi alat uji yang ada seperti PCR konvensional atau LPA, memakai metode yang terlalu rumit untuk selalu dilakukan di negara berkembang. Sampel yang selalu diproses dan DNA
yang diekstraksi menambah kesulitan untuk dilakukan karena sumber daya manusia kurang. GeneXpert, suatu perangkat platform, yang diluncurkan oleh Cepheid pada tahun 2004 dan menyederhanakan uji molekuler yang terintegrasi dan automatis dengan 3 proses (persiapan sampel, amplifikasi, dan deteksi) berdasarkan real time PCR (WHO, 2013a). Uji Xpert MTB/RIF dikembangkan oleh Foundation for Inovative New Diagnostic (FIND), Chepeid, University of Medicine and Dentistry of New Jersey yang dipimpin oleh David Alland (Boulware et al, 2013; WHO, 2013d) dengan pembiayaan dari National Institutes of Health (NIH) Amerika Serikat dan the Bill and Melinda Gates Foundation. GeneXpert sebagai alat uji diagnostik TB dan resistensi rifampisin terus mengalami perkembangan diantaranya yaitu:
a. Mei 2006: FIND berkerjasama dengan Chepeid untuk mengembangkan suatu alat uji diagnostik cepat serta praktis dilakukan yang dapat mendeteksi M. tuberculosis dan resistensi rifampisin dari sampel sputum. b. April 2009: uji cepat baru, Xpert MTB/RIF, diterima Conformite
Europeene In Vitro Diagnostic (CE IVD) marking.
c. Mei 2009: berlangsungnya penelitian yang dilakukan oleh FIND.
d. September 2010: New England Journal of Medicine mempublikasi data; Expert Group merekomendasikan kepada WHO berdasarkan bukti ilmiah; WHO’s Strategic and Technical Advisory Group untuk TB melakukan penelaahan bukti lebih lanjut dan membuat rekomendasi kebijakan politik. e. Desember 2010: WHO merekomendasikan Xpert MTB/RIF.
f. Desember 2012: Sejak awal WHO merekomendasikan Xpert MTB/RIF, 77 negara telah tersedia 966 alat GeneXpert dan 1.891.970 catridge Xpert MTB/RIF pada sektor publik dengan harga yang lebih murah (WHO, 2013c).
Teknologi yang didukung oleh WHO ini, pada 30 Juni 2013 total 3,2 juta catridge dan 1402 mesin GeneXpert (yang terdiri dari 7533 modul mesin) telah digunakan pada 88 negara dari 145 negara yang memenuhi syarat untuk memperoleh mesin dan catridge dengan harga yang lebih murah (Boulware, 2013; WHO, 2013a). World Health Organization merekomendasikan pemakaian GeneXpert (Cepheid) untuk mengevaluasi pasien tersangka TB
MDR dan pasien dengan BTA negatif (Boehme et al, 2010; WHO 2013a). Tuberkulosis paru BTA negatif dihubungkan dengan rendahnya hasil pengobatan, termasuk kematian yang disebabkan lamanya diagnosa atau tidak terdiagnosa (Lawn dan Wood, 2011). Teknologi baru seperti GeneXpert memberikan keuntungan untuk diagnosa awal TB (Van Rie et al, 2010; Lawn dan Nicol, 2011) dan penggunaan sistem diagnostik ini dapat meningkatkan diagnosa pasti secara cepat untuk semua pasien dengan TB paru (Small dan Pai, 2010).
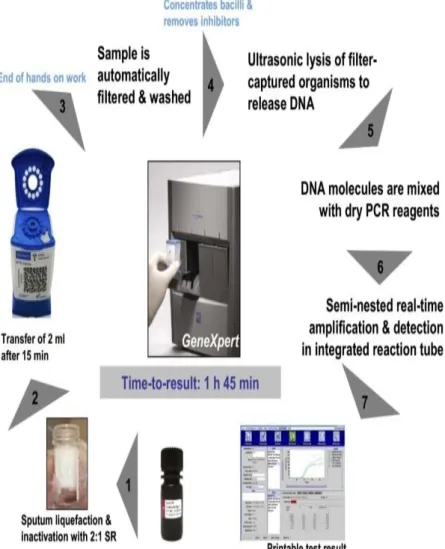
Sistem GeneXpert terdiri dari alat GeneXpert, komputer dan disposible catridge (Boehme, 2009). Alat ini membersihkan, mengkonsentrasi dan mengamplifikasi (dengan cepat, real time PCR) dan mengidentifikasi target asam nukleat dalam gen M. tuberculosis dan memberikan hasil dari sampel sputum yang tidak perlu diproses hanya dalam waktu kurang lebih 2 jam, dengan minimal penggunaan tangan. GeneXpert MTB/RIF menggunakan catridge yang berisi semua elemen yang dibutuhkan untuk reaksi, termasuk reagen lyophilized, liquid buffer serta wash solution (WHO, 2013a) dan bekerja dengan cara menangkap bakteri setelah proses pencucian kemudian DNA bebas dan masuk ke chamber pembuangan (Boehme, 2009). GeneXpert MTB/RIF dirancang dengan sistem tertutup untuk mengurangi atau mengeliminasi resiko kontaminasi amplikon. Sekali tertutup, catridge jangan pernah dibuka kembali (Boehme, 2009) oleh karena itu sebaiknya tidak membuka catridge jika belum siap untuk memulai pemeriksaan GeneXpert MTB/RIF (Halilu et al, 2014).
Masing-masing instrumen GeneXpert berisi 4 modul yang dapat diakses secara individu. Ukuran instrumen yang lain berisi antara 1-72 modul. Masing-masing modul terdiri dari jarum suntik untuk mengambil atau mengeluarkan cairan, sebuah ultrasonik untuk melisiskan sel, sebuah thermocycler, dan optical sign untuk mendeteksi komponen. Single use catridge berisi a) chamber untuk menyimpan sampel dan reagen, b) valve body berisi sebuah plunger dan syringe barrel, c) sebuah sistem rotary valve untuk mengendalikan pergerakan diantara chamber, d) sebuah ruang untuk menangkap, menyatukan, mencuci, dan melisis sel, e) reagen lyophilized
real-time PCR dan buffer pencuci dan f) tabung reaksi PCR yang terintegrasi yang secara automatis diisi instrumen (Boehme, 2009).
Uji GeneXpert MTB/RIF berdasarkan prinsip multipleks, semi-nested quantitative real-time PCR dengan amplifikasi gen target rpoB (Boehme, 2009; Blakemore et al, 2010; WHO, 2011b; Calligaro et al, 2014) dan untuk meningkatkan sensitivitas, GeneXpert MTB/RIF menggunakan molecular beacon dengan target gen rpoB (Boehme, 2009; Blakemore et al, 2010; Calligaro et al, 2014). GeneXpert mendeteksi 81 bp core region dari gen rpoB yang dikode oleh lokasi aktif enzim (Lawn dan Nicol, 2011; Marlow et al, 2011). Core region rpoB terletak di samping M. tuberculosis-urutan DNA spesifik. Oleh karena itu, sangat memungkinkan untuk mendeteksi M. tuberculosis dan resistensi rifampisin secara bersamaan dengan menggunakan teknologi PCR (Lawn dan Nicol, 2011).
Molecular beacon merupakan urutan oligonukleotida yang berisi urutan probe yang terdapat diantara dua tangkai urutan DNA. Molecular beacon digunakan untuk mendeteksi keberadaan M. tuberculosis dan mendiagnosa resistensi rifampisin sebagai tanda pengganti untuk TB MDR secara bersamaan (Boehme, 2009). Molecular beacon menggunakan fluorophor dan quencher untuk mendeteksi hibridisasi pada masing-masing dari lima region target amplifikasi gen (WHO 2011b). Salah satu dari molecular beacon probes dibuat untuk mendeteksi DNA pada sampel kontrol Bacillus globigi (Boehme, 2009; WHO, 2011b), suatu organisme tanah yang berspora, bertindak sebagai penguji kualitas untuk perangkap bakteri, lisis bakteri, ekstraksi DNA, amplifikasi dan deteksi probe (WHO, 2011b). Lima molecular beacon lainnya dibuat untuk hibridisasi pada region core rpoB-amplikon (Boehme, 2009).
Lima warna berbeda yang digunakan pada hibridisasi probe, masing-masing menutup sequence asam nukleat secara terpisah diantara amplifikasi gen rpoB (Steingart et al, 2013). Menurut Piatek dalam Nwokoye et al (2014) probe screen rifampisin adalah untuk mutasi di core region rpoB. Molecular beacon dibuat hanya untuk hibridisasi gen rpoB sequences yang cocok dengan M. tuberculosis wild type. Jika tidak ada mutasi, probe mengikat
target DNA dan menghasilkan fluoresen terang. Tetapi jika ada mutasi pada core region rpoB, menghasilkan fluoresen lambat (partial inhibition) atau tidak menghasilkan fluoresen. Mycobacterium tuberculosis teridentifikasi jika paling sedikit 2 dari 5 probe memberikan sinyal positif dengan ambang batas siklus (Cr) ≤38 siklus atau tidak berbeda jauh dari nilai siklus yang telah ditetapkan (Lawn dan Nicol, 2011). Dasar deteksi resistensi rifampisin adalah adanya perbedaan antara Cr yang pertama dan yang terakhir dari probe M. tuberculosis (ΔCr). Pada Xpert G3, semua deviasi dari wildtype sequencing menghasilkan pembatasan penampakan sinyal melebihi nilai ΔCr yaitu 5 dan disebut resisten rifampisin (Steingart et al, 2013). Uji berakhir sesudah 38 siklus oleh karena itu dapat dipertimbangkan bahwa resisten rifampisin indeterminate adalah jika probe pertama Cr adalah >34,5 siklus dan probe yang terakhir dengan Cr >38 siklus (Lawn & Nicol, 2011).
Prosedur Pemakaian GeneXpert
Pemakaian GeneXpert secara manual sangat mudah: buffer ditambahkan pada sampel sputum dengan perbandingan volume yang telah ditentukan (2:1), masukkan sampel ke dalam catridge chamber kemudian catridge dimasukkan ke dalam GeneXpert. Setelah itu, semua proses yang terjadi adalah secara automatis: GeneXpert pada awalnya menangkap organisme M. tuberculosisdari sampel sputum pada filter membran. Inhibitor mencuci sel organisme yang ditangkap dengan buffer kemudian dilisiskan dengan sumber energi ultrasonik dan DNA yang terlepas dielusi (dialirkan) melalui saringan membran. Solusi DNA akhirnya dicampur dengan reagen PCR kering kemudian dipindahkan ke dalam tabung PCR untuk real-time PCR dan dideteksi. Hasilnya dapat dapat diketahui dalam waktu kurang lebih 2 jam. Adanya semua lima sinyal fluoresensi menunjukkan rifampisin sensitif terhadap DNA M. tuberculosis. Jika 2-<5 sinyal fluoresensi diindikasikan bahwa M. tuberculosis resisten rifampisin. Jika sinyal fluoresensi tidak ada atau hanya 1 mengindikasikan tidak adanya DNA M. tuberculosis (Boehme, 2009).
Sensitivitas GeneXpert MTB/RIF lebih baik daripada pemeriksaan mikroskopis (WHO, 2013a; Hakeem et al, 2013) dan sensitivitasnya sama
dengan kultur media padat (WHO, 2013a). Hal ini dibuktikan pada saat sesudah dilakukan penyempurnaan pada Xpert kemudian dilakukan validasi klinis pada pasien di daerah Afrika Selatan, India, Peru, Jerman dan Azerbaijan. Ada sekitar 4.500 spesimen sputum dari 1.500 suspek TB. Hasilnya Xpert mempunyai spesifisitas dan sensitivitas tinggi untuk mendeteksi DNA M.tuberculosis pada hampir semua apusan sputum positif dan kultur positif. Sedangkan resisten rifampisin dideteksi dengan akurasi yang tinggi (Boehme, 2009).
Gambar 2.2 Prosedur Pemakaian GeneXpert MTB/RIF (Sumber: Boehme, 2009)
Uji GeneXpert MTB/RIF merupakan uji diagnostik TB yang memiliki banyak kelebihan diantaranya: mudah dipakai, mengurangi pemakaian biosafety cabinet, hasil diperoleh lebih cepat yaitu kurang lebih 2 jam, dan tidak memerlukan tenaga ahli khusus untuk melakukannya. Tetapi GeneXpert MTB/RIF juga memiliki keterbatasan, diantaranya yaitu: adanya batasan masa pakai catridge, suhu pengoperasian/ kelembaban (Boehme, 2009; Van Rie et al, 2010; Evans, 2011; Trébucq et al, 2011) dibawah 300C sehingga di negara tropis membutuhkan penyejuk udara yang tetap menyala, biaya mahal (Van Rie et al, 2010; Trébucq et al, 2011), ketersediaan aliran listrik, dan memerlukan perawatan tahunan serta kalibrasi tiap mesin (Van Rie et al, 2010; Evans, 2011; Trébucq et al, 2011).
Setelah seseorang didiagnosis sebagai TB MDR maka harus segera dilakukan pelacakan kontak erat pasien. Definisi kontak erat adalah orang yang tinggal dalam satu ruangan selama beberapa jam sehari dengan pasien TB MDR, misalnya anggota keluarga, teman kerja dalam ruangan yang sama, dan lain-lain. Berdasarkan pengalaman, kontak erat pasien TB MDR yang kemudian sakit TB sebagian besar juga sebagai pasien TB MDR (Ditjen PP dan PL, 2013). Resistensi terhadap obat ini biasanya tidak terdeteksi karena kultur dan uji kepekaan obat tidak rutin dilakukan pada klinik TB. Pemakaian OAT lini pertama untuk pengobatan pada pasien meningkatkan resiko resistensi didapat, kambuh, dan pengobatan gagal (Menzies et al, 2009).
2.8 Pengobatan dan Pencegahan
2.8.1 Pengobatan dan Paduan Obat TB MDR di Indonesia
Berdasarkan Petunjuk Teknis Ditjen PP & PL (2013), klasifikasi OAT dibagi atas 5 kelompok pengobatan pasien TB MDR berdasarkan potensi dan efikasinya yaitu:
Tabel 2.1 Pengelompokan OAT
Golongan Jenis Obat
Golongan 1 Obat lini pertama • Isoniazid (H) • Rifampisin (R) • Etambutol (E) • Pirazinamid (Z) • Streptomisin S) Golongan 2 Obat injeksi lini kedua • Kanamisin (Km)
• Amikasin (Am) • Kapreomisin (Cm) Golongan 3 Golongan florokuinolon • Levofloksasin (Lfx)
• Moksifloksasin (Mfx) • Ofloksasin (Ofx) Golongan 4 Obat bakteriostatik lini
kedua
• Etionamid (Eto) • Protionamid (Pto) • Sikloserin (Cs) • Terizidon (Trd)
• Para amino salisilat (PAS) Golongan 5 Obat yang belum terbukti
efikasinya dan tidak direkomendasikan oleh WHO untuk pengobatan rutin TB MDR • Clofazimin (Cfz) • Linezolid (Lzd) • Klaritromisisn (Clr) • Imipenem (Ipm) • Amoksilin/Asam Klavulanat (Amx/Clv)
Sumber: Ditjen PP dan PL (2013)
Pilihan paduan obat TB MDR saat ini adalah paduan standar, yang pada permulaan pengobatan akan diberikan sama kepada semua pasien TB MDR yang sudah terkonfirmasi TB MDR secara laboratoris. Adapun paduan yang akan diberikan adalah:
Paduan OAT juga akan disesuaikan paduan atau dosis obat pada:
a. Hasil uji kepekaan OAT lini kedua menunjukkan resisten terhadap salah satu obat di atas. Etambutol dan pirazinamid tetap digunakan.
b. Ada riwayat penggunaan salah satu obat tersebut di atas sebelumnya sehingga dicurigai ada resistensi, misalnya pasien sudah pernah mendapat kuinolon untuk pengobatan TB sebelumnya.
c. Terjadi efek samping yang berat akibat salah satu obat yang sudah dapat diidentifikasi sebagai penyebabnya dan terjadi perburukan keadaan klinis, sebelum maupun setelah konversi biakan. Hal-hal yang harus diperhatikan adalah kondisi umum, batuk, produksi dahak, demam, dan penurunan berat badan (Nawas, 2010).
a. Pemberian Obat
Pemberian obat pada penderita yang sudah didiagnosa TB MDR yaitu: 1. Pada fase awal adalah tahap pemberian suntikan dengan lama paling
sedikit 6 bulan atau 4 bulan setelah terjadi konversi biakan. Obat peroral ditelan setiap hari (7 hari dalam 1 minggu) dan suntikan diberikan 5 (lima) hari dalam seminggu (Senin – Jum’at). Obat suntikan harus diberikan oleh petugas kesehatan.
2. Pada fase lanjutan adalah pemberian paduan OAT tanpa suntikan setelah menyelesaikan tahap awal. Obat peroral ditelan selama 6 (enam) hari dalam seminggu (hari minggu pasien tidak minum obat).
3. Lama pengobatan tahap awal dan tahap lanjutan paling sedikit 18 bulan setelah terjadi konversi biakan.
4. Pada pengobatan TB MDR dimungkinkan terjadinya pemberian obat dengan dosis naik bertahap atau ramping dose/ incremental dose yang bertujuan untuk meminimalisasi kejadian efek samping obat. Tanggal pertama pengobatan adalah hari pertama pasien mendapatkan obat dengan dosis penuh.
5. Pemberian obat oral selama periode pengobatan tahap awal dan tahap lanjutan menganut prinsip Directly Observed Treatment (DOT) dengan Pengawas Minum Obat (PMO) diutamakan adalah tenaga kesehatan terlatih (Ditjen PP dan PL, 2013).
b. Dosis Obat
Tabel 2.2 Perhitungan dosis OAT MDR
OAT Berat Badan (BB)
< 33 kg 33-50 kg 51-70 kg >70 kg Pirazinamid 20-30 mg/kg/hari 750-1500 mg 1500-1750 mg 1750-2000 mg Kanamisin 15-20 mg/kg/hari 500-750 mg 1000 mg 1000 mg Etambutol 20-30 mg/kg/hari 800-1200 mg 1200-1600 mg 1600-2000 mg Kapreomisin 15-20 mg/kg/hari 500-750 mg 1000 mg 1000 mg
OAT Berat Badan (BB)
< 33 kg 33-50 kg 51-70 kg >70 kg Levofloksasin (dosis standar) 7,5-10 mg/kg/hari 750 mg 750 mg 750-1000 mg Levofloksasin (dosis tinggi) 1000 mg 1000 mg 1000 mg 1000 mg Sikloserin 15-20 mg/kg/hari 500 mg 750 mg 750-1000 mg Etionamid 15-20 mg/kg/hari 500 mg 750 mg 750-1000 mg PAS 150 mg/kg/hari 8 g 8 g 8 g
Sumber Ditjen PP dan PL ( 2013)
Penelitian meta-analisis yang dilakukan oleh Ahuja et al (2012) menunjukkan bahwa keberhasilan pengobatan TB MDR dan bertahan hidupnya penderita berhubungan dengan pemakaian obat florokuinolon, etionamid atau protionamid dan jumlah obat yang efektif. Hasil penelitian yang dilakukan Johnston et al (2009) secara systemic review dan meta-analisis menunjukkan bahwa faktor yang berhubungan dengan outcome pengobatan yang lebih buruk adalah laki-laki, pemakaian alkohol, body mass index (BMI) rendah, apusan dahak positif pada saat diagnos,a dan resisten florokuinolon. Sedangkan faktor yang berhubungan dengan outcome yang baik adalah adanya tindakan pembedahan, tidak ada riwayat OAT sebelumnya, dan pemakaian florokuinolon.
Obat Baru untuk TB MDR
Pada Desember 2012, Food and Drug Administration (FDA) Amerika Serikat menyetujui diarylquinoline sebagai obat baru untuk TB MDR. Obat baru TB MDR yang lain yaitu delamanid telah sampai pada uji coba klinis fase kedua (Shim dan Jo, 2013).
2.8.2 Pencegahan
Pencegahan resitensi OAT, khususnya TB MDR, merupakan bagian yang penting dari program kontrol TB (Nathanson et al, 2010). Hasil penelitian di Cina menunjukkan bahwa lebih dari 40% penderita TB MDR adalah penderita yang telah mendapat pengobatan sebelumnya tetapi tidak lengkap. Usaha yang langsung dalam mencegah dan mengobati TB MDR secara efektif serta resistensi OAT lainnya diperlukan untuk menurunkan jumlah prevalensi kasus dan mengurangi transmisi TB MDR (WHO, 2013a).
Untuk mencegah TB MDR pada pasien yang diobati di klinik TB, sebaiknya tes untuk resistensi obat harus dilakukan sebelum pengobatan dilakukan dan pilihan pengobatan sebaiknya berdasarkan hasil tes itu (Zhao et al 2012).