Fenotipe Virus Avian Influenza (AI) Subtipe H5N1 Berbeda Karakter Genetik di Indonesia
(Phenotype of Avian Influenza H5N1 Subtype with Different Genetic Characters in Indonesia)
NLP Indi Dharmayanti1, Risa Indriani1, Risza Hartawan1, & Atik Ratnawati1 1Balai Besar Penelitian Veteriner-JL RE Martadinata 30, Bogor. Email: nlpdharmayanti@yahoo.com
Memasukkan: Maret 2014, Diterima: Juli 2014
ABSTRACT
In Indonesia, data on the phenotype of AI virus subtype H5N1 is very limited, due to the facilities for such testing should be performed in a laboratory Biosafety level III. Additionally influenza virus has a high error rate during transcription of their genome has low RNA polymerase. High error rates generate quasispecies. In this study, we did some H5N1 viruses infection with different genetic variations and conducted DNA sequencing in several organs. To determine the possible emergence detection of quasispecies in different organs and until the virus was excreted. We tested the hypothesis that the quasispecies might arise from virus that was infected to the experimental animals. The results of this study showed that the AI virus subtype H5N1 had different phenotypes in animal depending on their genetic character. AI virus subtype H5N1 killed chickens within 48-72 hours depending on the genetic character of the virus. New AI viruses of subtype H5N1 caused more severe organ damage severe than the character of the old AI viruses. Adaptation of virus in each organ also proved that the virus likely create variations/quasispecies, which was different from the viral origin.
Keywords: Phenotypes, avian influenza, H5N1, genetic character, quasispecies ABSTRAK
Di Indonesia, data tentang fenotipe virus AI subtipe H5N1 sangat terbatas, dikarenakan fasilitas yang digunakan untuk pengujian tersebut harus di laboratorium berkeamanan tingkat III (Biosafety Level III). Selain itu virus influenza memiliki tingkat kesalahan yang tinggi selama transkripsi genom mereka karena mempunyai RNA polimerase yang rendah. Tingkat kesalahan tinggi menghasilkan quasispecies/variasi virus. Pada penelitian ini kami melakukan infeksi beberapa virus H5N1 dengan variasi genetik yang berbeda. Selanjutnya beberapa organ disekuen untuk mengetahui kemungkinan munculnya/terdeteksinya quasispecies pada organ yang berbeda dan juga sampai virus tersebut diekskresikan. Kami menguji hipotesis bahwa quasispecies mungkin muncul dari virus yang kita infeksikan pada hewan coba. Hasil penelitian menunjukkan bahwa virus AI subtipe H5N1 mempunyai fenotipe yang berbeda pada hewan coba tergantung dari karakter genetiknya. Virus AI subtipe H5N1 dapat membunuh ayam dalam waktu 48-72 jam tergantung dari karakter genetik virus. Karakter virus AI subtipe H5N1 yang baru, mampu me nimbulkan kerusakan organ yang lebih parah dibandingkan dengan karakter virus AI lama. Adaptasi virus disetiap organ juga membuktikan bahwa kemungkinan akan menciptakan quasispecies, yang berbeda dengan virus asalnya.
Kata Kunci: Fenotipe, avian influenza, H5N1, karakter genetik, quasispecies
PENDAHULUAN
Virus HPAI H5N1 telah menyebar ke Asia sampai Asia Tengah, Eropa dan Afrika, menyebabkan wabah penyakit dan kematian pada unggas domestik dan burung liar (Guan et al. 2004; Peiris et al. 2007). Infeksi virus H5N1 asal unggas ke manusia tercatat sekitar 630 orang dan sebanyak 375 kasus
fatal, namun tanpa adaptasi atau penularan antar manusia (WHO, 2013). Virus Influenza A termasuk H5N1 merupakan virus RNA dalam keluarga Orthomyxoviridae dengan genom sebesar 13,5 - kilobasa dan terdiri dari delapan segmen RNA beruntai tunggal dan mengkode 11 protein (Ghedin et al. 2005). Terdapat 144 kemungkinan kombinasi dua glikoprotein permukaan, hemagglutinin dan
neuraminidase, yang menentukan sifat antigenik dan klasifikasi subtipe virus. Virus influenza A bersifat zoonosis dan sebagai kelompok virus, mereka memiliki kisaran inang yang luas termasuk manusia, setidaknya 105 spesies burung, babi, kuda, anjing, kucing, musang, cerpelai dan mamalia laut (Katz et al. 2009).
Virus influenza memiliki tingkat kesalahan yang tinggi selama transkripsi genom mereka karena mempunyai RNA polimerase yang rendah (Stech et al. 1999). Tingkat kesalahan tinggi meng-hasilkan quasispecies, yaitu fenomena genotipe virus berbeda yang beredar di host, dengan masing-masing subtipe virus mempunyai potensi berkaitan dengan beberapa tingkat kecocokan dari inang (Domingo et al. 1985). Seperti yang disebutkan oleh Domingo et al, '' virus quasispecies adalah mutan yang berdekatan (tapi tidak identik) dan rekombinasi virus genom dikenakan terus menerus adanya variasi genetik, kompetisi, dan seleksi ''(Domingo et al. 1998). Di Indonesia, data tentang fenotipe virus AI subtipe H5N1 sangat terbatas, dikarenakan fasilitas yang digunakan untuk pengujian tersebut harus di laboratorium berkeamanan tingkat III (Biosafety Level III). Pada penelitian ini kami melakukan infeksi beberapa beberapa virus H5N1 dengan variasi genetik yang berbeda dan mensekuensing di beberapa organ untuk mengetahui kemungkinan munculnya/ terdeteksinya quacispecies pada organ yang berbeda dan juga sampai virus tersebut diekskresikan. Kami menguji hipotesis bahwa quasispecies mungkin muncul dari dari virus yang kita infeksikan pada hewan coba.
BAHAN DAN CARA KERJA
Penelitian pada hewan coba dilakukan di laboratorium dengan fasilitas Biosafety Level III (BSL-3) milik BBLitvet yaitu di laboratorium zoonosis dan Moduler BSL-3. Semua personil yang melakukan penelitian di BSL-3 telah mendapatkan pelatihan Biosafety dan Standar
Oparational Procedure (SOP) sebelum bekerja di BSL-3. Personil menggunakan baju Personal Protective Equipment (PPE) lengkap dan mandi setelah keluar dari BSL-3. Selama percobaan ayam dipelihara di isolator BSL-3 yang sangat aman sehingga sangat kecil kemungkinan organisme/virus AI akan mencemari personil atau pun lingkungan.
Isolat virus IA/H5N1, yang digunakan pada penelitian ini adalah virus AI/H5N1 yaitu empat virus AI yang telah diisolasi pada penelitian sebelumnya. Hewan coba yang digunakan adalah ayam Specific Pathogen Free (SPF) berumur 4 minggu. Ayam SPF dibagi menjadi lima kelompok perlakuan. Tiap kelompok perlakuan terdiri dari 6 ekor ayam yang terbagi menjadi 3 ekor ayam diinfeksi dan sisanya diinfeksikan secara kontak. Kelompok 1 diinfeksi dengan virus AI (A/Ck/East Java/BL- IPA/03), Kelompok 2 diinfeksi oleh virus (A/Ck/East Java/ BwiI2/10), Kelompok 3 diinfeksi dengan virus A/Bird/ Bali/1/11, Kelompok 4 diinfeksi dengan virus A/ Env/West Java/Krw54/12 dan Kelompok 5 sebagai kelompok kontrol. Hewan kontak tidak diinfeksi tapi dipelihara bersama dengan hewan yang diinfeksi virus H5N1. Dosis virus AI subtipe H5N1 yang diinfeksikan secara intranasal adalah 106EID/ml.
Hewan coba akan diamati gejala klinis yang muncul dari mulai diinfeksi sampai terjadinya kematian hewan coba, selain itu virus shedding akan amati dan diidentifikasi dengan RT-PCR dan dikultur di telur berembrio SPF. Spesimen dari hewan coba dikoleksi dari swab nasal dan kloaka serta serum darah. Jika hewan mati, maka spesimen yang diambil selain swab nasal, kloaka dan serum darah, organ (trakea, lambung, usus, paru, jantung dan limpa) dikoleksi untuk pemeriksaan patologis. Organ dari virus AI/ H5N1 tertentu akan dititrasi untuk mengetahui konsentrasi virus pada masing-masing organ (Reed and Muench, 1938). Selain itu juga diidentifikasi kemungkinan terjadinya mutasi/variasi/quasispecies
virus ketika bereplikasi diorgan, sehingga akan diketahui kemungkinan populasi virus yang muncul.
Dua puluh empat jam setelah ayam diinfeksi, gejala klinis diamati dan dilakukan deteksi shedding virus dengan cara mengambil swab kloaka dan trakea setiap hari. Swab kloaka/trakea dideteksi keberadaan virus AI melalui RT-PCR menggunakan primer H5 (Lee et al., 2001). Organ dari ayam mati dikoleksi untuk dititrasi konsentrasi virus pada setiap organ, dan selanjutnya dilakukan sekuensing DNA.
Sekuensing DNA dilakukan pada gen HA virus AI/H5N1 untuk mengetahui adanya perubahan sekuen nukloetida pada virus. Primer dan DNA sekuensing gen HA dilakukan sesuai dengan Hoffman et al (2001). Hasil sekuensing diverifikasi dan dianalisis dengan software bioinformatika (Bioedit, Finch TV, MEGA 5.2). Hasil analisis dapat menentukan/ memprediksi mutasi virus AI/H5N1.
HASIL
Infeksi Virus AI subtipe H5N1 pada Ayam Specific Pathogen Free (SPF).
Lima kelompok ayam SPF Kelompok tersebut adalah : Kelompok IPA, Kelompok BwiI2, Kelompok Krw54, Kelompok Bali dan Kelompok kontrol. Masing-masing kelompok merupakan representasi
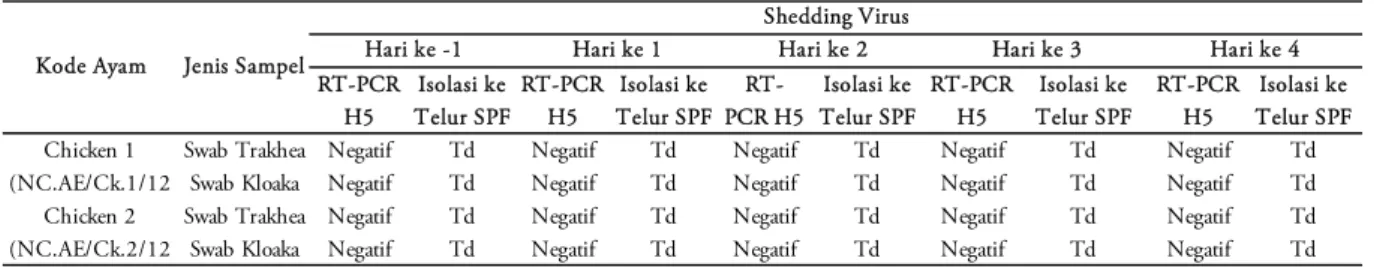
dari evolusi virus yaitu Kelompok IPA di infeksi dengan virus IPA yang merupakan virus pertama H5N1 yang di isolasi pada tahun 2003; Kelompok BwiI2 diinfeksi virus yang mengalami genetic drift sedangkan kelompok Krw54 dan Bali1 diinfeksi dengan virus yang disolasi disekitar kasus manusia terinfeksi H5N1. Setelah diinfeksi setiap kelompok diamati gejala klnis dan shedding virus setiap hari. Shedding virus setiap kelompok hewan coba dapat dilihat pada Tabel 1-5.
Hasil penelitian menunjukkan bahwa gejala klinis ayam yang diinfeksi virus AI/H5N1 semua jenis isolat yang digunakan pada penelitian ini menggambarkan penyakit AI mempunyai onset of action yang sangat pendek, sehingga gejala klinis tidak teramati dengan jelas karena ayam telah mati pada hari kedua (virus BwiI2, Krw54), hari ketiga dan keempat (virus IPA, Bali1); shedding virus AI/H5N1 umumnya belum dapat terdeteksi pada 24 jam post infeksi (hari pertama) dan baru dapat dideteksi pada hari kedua post infeksi.
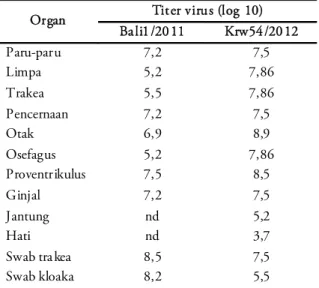
Selain shedding virus, juga diukur nilai konsentrasi virus di setiap organ yang dikoleksi hanya untuk kelompok Bali1 dan Krw54. Tabel 6 berikut menunjukkan organ yang dititrasi virusnya, untuk mengetahui titer virus masing-masing organ. Hasil penelitian menunjukkan bahwa organ otak asal
Tabel 1. Shedding virus dari kelompok ayam kontrol tidak diinfeksi virus.
Isolasi ke Isolasi ke Isolasi ke Isolasi ke Isolasi ke Telur SPF Telur SPF Telur SPF Telur SPF Telur SPF Swab Trakhea Negatif Td Negatif Td Negatif Td Negatif Td Negatif Td
Swab Kloaka Negatif Td Negatif Td Negatif Td Negatif Td Negatif Td Swab Trakhea Negatif Td Negatif Td Negatif Td Negatif Td Negatif Td Swab Kloaka Negatif Td Negatif Td Negatif Td Negatif Td Negatif Td Chicken 1 (NC.AE/Ck.1/12 Chicken 2 (NC.AE/Ck.2/12 RT-PCR H5 RT-PCR H5 RT-PCR H5 RT-PCR H5 Kode Ayam Jenis Sampel
Shedding Virus
Hari ke -1 Hari ke 1 Hari ke 2 Hari ke 3 Hari ke 4 RT-PCR
H5
Isolasi ke Isolasi ke Isolasi ke Isolasi ke Isolasi ke Telur SPF Telur SPF Telur SPF Telur SPF Telur SPF Swab Trakhea Negatif Td Negatif Td Negatif Td Negatif Td Negatif Td
Swab Kloaka Negatif Td Negatif Td Negatif Td Negatif Td Negatif Td Swab Trakhea Negatif Td Negatif Td Negatif Td Negatif Td Negatif Td Swab Kloaka Negatif Td Negatif Td Negatif Td Negatif Td Negatif Td Chicken 1 (NC.AE/Ck.1 Chicken 2 (NC.AE/Ck.2 RT-PCR H5 RT-PCR H5 RT-PCR H5 RT-PCR H5 Kode Ayam Jenis Sampel
Shedding Virus
Hari -1 Hari ke1 Hari ke 2 Hari ke 3 Hari ke 4
RT-PCR H5
Organ Titer virus (log 10) Ba li1 /20 11 Krw54 /20 12 Paru-paru 7,2 7,5 Limpa 5,2 7,86 Trakea 5,5 7,86 Pencernaan 7,2 7,5 Otak 6,9 8,9 Osefagus 5,2 7,86 Proventrikulus 7,5 8,5 Ginjal 7,2 7,5 Jantung nd 5,2 Hati nd 3,7
Swab tra kea 8,5 7,5
Swab kloaka 8,2 5,5
Tabel 6. Titer virus AI di tiap-tiap organ: (Reed & Muench 1938).
ayam yang diinfeksi virus Krw 54 mempunyai titer tertinggi (8,5log10), sedangkan organ hati yang diinfeksi virus Krw 54 mempunyai titer terendah (3,7log10). Titer virus pada organ yang diinfeksi virus Bali adalah sekitar 5,2log10-7,5log10.
Gambaran kerusakan organ pada setiap organ yang dikoleksi selengkapnya dapat dilihat pada Tabel 7. Dari gambaran histopatologi tersebut menunjukkan bahwa trakea merupakan satu-satunya organ yang dirusak oleh hampir semua jenis virus. Sedangkan kerusakan organ lainnya dari gambaran histopatologi memperlihatkan bahwa setiap virus mempunyai kespesifikan tertentu dalam merusak organ. Sebagai contoh virus IPA
Isolasi ke Isolasi ke Isolasi ke Isolasi ke Isolasi ke Telur SPF Telur SPF Telur SPF Telur SPF Telur SPF Swab Trakhea Negatif Td Negatif Negatif Positif Positif
Swab Kloaka Negatif Td Negatif Negatif Positif Positif
Swab Trakhea Negatif Td Negatif Negatif Positif Negatif Negatif Negatif Positif Negatif Swab Kloaka Negatif Td Negatif Negatif Positif Positif Positif Positif Positif Positif Chicken 1 (Bali.AE/Ck.1 /12) Chicken 2 (Bali.AE/Ck.2 /12)
Kode Ayam Jenis Sampel
Shedding Virus
3 d-pre-i 1 dpi 2 dpi 3 dpi 4 dpi
RT-PCR H5 RT-PCR H5 RT-PCR H5 RT-PCR H5 RT-PCR H5 Ayam mati
Isolasi ke Isolasi ke Isolasi ke
Telur SPF Telur SPF Telur SPF
Swab Trakhea Negatif Td Positif Positif Positif Positif
Swab Kloaka Negatif Td Positif Positif Positif Positif
Swab Trakhea Negatif Td Positif Positif Positif Positif
Swab Kloaka Negatif Td Positif Positif Positif Positif
Chicken 1 (Krw.AE/Ck.1/ 12) Chicken 2 (Krw.AE/Ck.2/ 12)
Kode Ayam Jenis Sampel
Shedding Virus
3 d-pre-i 1 dpi 2 dpi
RT-PCR H5 RT-PCR H5 RT-PCR H5
Tabel 3. Shedding virus dari kelompok ayam yang diinfeksi virus Bali1.
Tabel 4. Shedding virus dari kelompok ayam yang diinfeksi virus Krw54.
Isolasi ke Isolasi ke Isolasi ke Isolasi ke Isolasi ke Telur SPF Telur SPF Telur SPF Telur SPF Telur SPF Swab Trakhea Negatif Td Negatif Positif Negatif Positif Positif Positif Negatif Positif
Swab Kloaka Negatif Td Negatif Negatif Negatif Positif Positif Positif Negatif Positif Swab Trakhea Negatif Td Negatif Positif Negatif Positif Positif Positif Negatif Positif Swab Kloaka Negatif Td Negatif Negatif Negatif Negatif Positif Positif Negatif Positif Chicken 1 (IPA. AE/Ck.1/12) Chicken 2 (IPA. AE/Ck.2/12) RT-PCR H5 RT-PCR H5 RT-PCR H5 RT-PCR H5 Kode Ayam Jenis Sampel
Shedding Virus
1 d-pre-i 1 dpi 2 dpi 3 dpi 4 dpi
RT-PCR H5
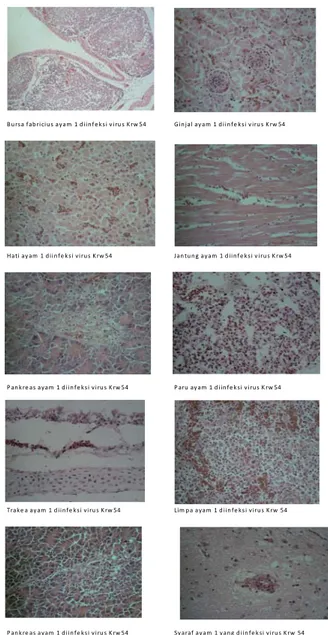
cenderung merusak organ limpa karena ditemukannya deplesi pulpa putih yang sangat hebat disertai nekrosis, sedangkan virus lainnya cenderung merusak ke saluran pernapasan termasuk trakea (Tabel 7). Gambar 1 memperlihatkan gambaran histopatologi dari organ yang diinfeksi virus Krw54. Ayam kontak merupakan ayam yang tidak diinfeksi virus Krw 54 namun dipelihara bersama dalam satu kandang (infeksi kontak) tampak perubahan organ secara signifikan.
Identifikasi quasispecies pada swab kloaka Dipilih kelompok organ ayam yang dinfeksi oleh virus BwiI2 untuk mengetahui apakah disetiap virus bereplikasi di organ telah melakukan mutasi dengan melakukan direct sequencing. Hasil analisis virus BwiI2 memperlihatkan bahwa organ trakea, pencernaan, otak, osephagus yang mengandung virus tersebut tidak menunjukkan perubahan nukleotida pada gen HA virus. Virus di proventrikulus mengalami variasi di posisi 81-82 dimana TT (Timin-Timin) digantikan CC (Sitosin-sitosin). Virus di limpa menunjukkan satu variasi yaitu pada posisi 448 G/A. Virus yang dieksresikan pada feses ditemukan adanya variasi yang lebih banyak pada urutan nukleotidanya yaitu pada urutan nukleotida sekitar 284-471, yaitu 383 (G/ A), 408 (T/A), 412 (C/A), 420 (T/C), 443 (G/A), 455 (C/T), 465 (A/C), 471 (C/T). Hal ini memperlihatkan kemungkinan adanya virus AI quacispecies pada proventrikulus dan limpa serta ekskreta (feses) yang disekresikan oleh ayam. Homologi virus disetiap organ yang diinfeksikan dengan virus (asal) yang di infeksikan sekitar 99-100% (Gambar 2). PEMBAHASAN
Timbulnya gejala klinis pada ayam yang terinfeksi HPAI pada ayam, virus HPAI biasanya menyebabkan multisistemik penyakit yang berhubungan dengan morbiditas dan mortalitas yang tinggi (Hooper & Selleck, 1998; Swayne & Pantin-Jackwood 2006; Swayne 2007). Sebenarnya sulit untuk menggambarkan satu set tanda-tanda klinis yang merupakan indikator yang konsisten dari wabah HPAI, tanda-tanda klinis umumnya tidak spesifik, dan frekuensi dan jenis mereka bervariasi tergantung dengan virus (Elbers et al. 2004b, Swayne 2007). Pada penelitian ini menunjukkan bahwa gejala klinis ayam yang diinfeksi virus AI/ H5N1 semua jenis isolat yang digunakan pada penelitian ini menggambarkan penyakit AI
B u rsa fab ri ci u s ayam 1 d ii n f e ks i v iru s K rw 54 Gi n jal ay am 1 d i in fe k si v iru s K rw 54
Hati ay am 1 d ii n fe k si vi ru s K rw 54 Jan tu n g ayam 1 d ii n f e ks i v iru s K rw 54
P an k re as ayam 1 d ii n fe ks i v i ru s K rw 54 P aru ay am 1 d i in fe k si v i ru s K rw 54
Trake a ay am 1 d ii n fe k si vi ru s K rw 54 Lim p a ayam 1 d ii n fe ks i v iru s K rw 54
P an k re as ayam 1 d ii n fe ks i v i ru s K rw 54 Sy araf ay am 1 y an g d i in fe k si v iru s K rw 54
Gambar 1. Perubahan histopathologi organ ayam yang diinfeksi virus Krw54
Organ
Perubahan Histopatologi
Dinfeksi virus Bali1 Diinfeksi virus Krw54 Diinfeksi virus IPA
Trakhea Infiltrasi limfosit multifokus
pada mukosa, disertai nekrosis
Atrofi mukosa Tidak ditemukan perubahan spesifik
Pa ru-paru Multifokus infiltrasi limfosit (minimal)
Kongesti, infiltrasi minimal limfosit pada bronkhiolus
Pembendungan
Jantung Tidak ditemukan perubahan
spesifik
Kongesti Tidak ditemukan perubahan spesifik
Hati Multifokus infiltrasi limfosit disertai nekrosis dan reksis
Kongesti Ditemukan focus-focus infliltrasi
limfosit disertai nekrosis Limpa,
proventrikulus, osefafus, gizzard, usus
Tidak ditemukan perubahan spesifik
Td Tidak ditemukan perubahan
spesifik
Pankreas Tidak ditemukan perubahan
spesifik
Degenerasi-nekrosis pulau Langerhans
Tidak ditemukan perubahan spesifik
Oviduct Infiltrasi limfosit yang cukup signifikan, disertai nekrosis
Tidak ditemukan perubahan spesifik
Tidak ditemukan perubahan spesifik
Ginjal Tidak ditemukan perubahan
spesifik
Kongesti Tidak ditemukan perubahan
spesifik
Bursa Fabricius Deplesi folikel limfoid Deplesi folikel limfoid Deplesi folikel limfoid terjadi sangat hebat
Otak Edema perivaskular Nd Nd
mempunyai onset of action yang sangat pendek, sehingga gejala klinis tidak teramati dengan jelas karena ayam telah mati pada hari kedua (virus BwiI2, Krw54), hari ketiga dan keempat (virus IPA, Bali); shedding virus AI subtipe H5N1 umumnya belum dapat terdeteksi pada 24 jam post infeksi (hari pertama) dan baru dapat dideteksi pada hari kedua post infeksi.
Virus avian influenza yang membunuh unggas dengan cepat cenderung menyebabkan tanda-tanda klinis lebih sedikit dari pada ketika strain virus atau dosis yang diinfeksikan memungkinkan unggas untuk bertahan hidup lebih lama (Alexander et al. 1978; Bean et al. 1985; Perkins & Swayne 2001). Ayam terinfeksi virus HPAI kadang-kadang ditemukan mati dengan sedikit atau tidak ada tanda-tanda sebelumnya (Alexander et al. 1978, 1986, Bean et al. 1985; Forman et al.
1986; Elbers et al. 2004a; Nakatani et al. 2005; Swayne 2007; Tsukamoto et al. 2007).
Dalam eksperimen ayam yang terinfeksi dan diinokulasi oleh alam (misalnya rute pernapasan), maka tanda-tanda awal yang terlihat adalah depresi, mengacak-acak bulu penurunan konsumsi pakan, diare, peningkatan cairan feses dan urat, haematochezia, dyspnea dan, pembengkakan dan sianosis dari kepala dan kaki (Alexander et al. 1978; Westbury et al. 1979; Forman et al. 1986; Brown et al. 1992; Perkins & Swayne 2001; Jones & Swayne 2004; Tsukamoto et al. 2007). Dengan pengecualian depresi, yang secara konsisten hadir, pola tanda-tanda klinis bervariasi tergantung virus yang digunakan (Alexander et al. 1978; Westbury et al. 1979; Forman et al. 1986, Brown et al. 1992; Perkins & Swayne 2001; Jones & Swayne 2004; Tsukamoto et al. 2007). Inokulasi
Gambar 2. Multiple sequence alignment virus BwiI2 (origin) dibandingkan dengan virus BwiI2 setelah diinfeksikan dan dilakukan direct sequencing dari organ ayam
Gambar 2. Lanjutan
intranasal pada unggas akan menimbulkan tanda-tanda klinis atau waktu kematian yang bervariasi tergantung dengan isolat dan dosisnya. Ayam diinokulasi intranasal dengan isolat H5N1 Asia sering mati dalam beberapa hari pertama (Shortridge et al. 1998; Suarez et al. 1998; Cauthen et al. 2000; Perkins & Swayne, 2001; Tumpey et al. 2002; . Lee et al. 2005a; Nguyen et al. 2005; Tian et al. 2005; Swayne et al. 2006 ; Swayne & Pantin - Jackwood 2006; Swayne 2007; Tsukamoto et al, 2007). Tanda-tanda klinis jarang bisa ditentukan pada unggas dalam satu penelitian, ayam umur 4-6 minggu dilaporkan menjadi depresi dan telah mengacak-acak bulu pada hari 1 post-inokulasi (pi), dan sudah mati hari 2 (Tsukamoto et al. 2007). Seperti contohnya pada ayam yang diinokulasi intranasal dengan Virus H5N1 yang diisolasi pada tahun 1959 (A/chicken/Scotland/59 ) jatuh sakit, rata-rata pada 3,8 hari pi. dan mati pada 4,6 hari pi, dan menunjukkan beberapa tanda-tanda klinis sebelum kematian (Alexander et al. 1986). Hal ini sesuai dengan hasil dari penelitian kami, yaitu gejala klinis tidak tampak secara jelas, hanya ayam nampak lemah dan lesu serta kematian terjadi sekitar hari kedua sampai keempat.
Selain patogenesitas, dalam penelitian ini juga diteliti kemungkinan adanya quacispecies atau varian yang mungkin muncul akibat kesalahan replikasi selama virus di tubuh hewan. Tingkat
kesalahan dalam replikasi dikatakan sebagai pedang bermata dua di satu sisi meningkatkan kemampuan virus untuk cepat beradaptasi dengan inang yang baru melalui perubahan genetik yang membantu dalam replikasi, dan di sisi yang lain adalah efisiensi transmisi berperan untuk menghasilkan subtipe yang cacat sehingga mengurangi adaptasi pada inang. Beberapa atau sebagian besar quasispecies ini atau campuran subtipe mungkin terlewatkan selama kultur virus karena adanya tekanan adaptasi '' tuan rumah '' seperti misalnya pada chicken embrio atau kultur sel (Wang et al. 2008), sehingga yang diperoleh adalah populasi virus yang dominan. Pada penelitian ini, beberapa virus dari organ menunjukkan adanya variasi genetik, serta kelompok virus yang diekskresikan pada feses menunjukkan adanya kemungkian virus mengalami quasispecies, sehingga virus yang diekskresikan tidak sama dengan virus yang diinfeksikan atau adanya genetic drift. Hal ini kemungkinan karena kesalahan pembacaan blue print virus pada saat replikasi yang akan menghasilkan quasispecies yang merupakan fenomena dimana beberapa genotipe viral yang berbeda co-sirkulasi pada inang (Domingo et al. 1985). Data pada penelitian ini membuktikan bahwa virus yang diinfeksikan tidak identik 100% dengan virus yang diekskresikan oleh ayam. Data ini membuktikan adanya kemampuan virus dalam melakukan variasi genetik meskipun tanpa adanya
tekanan imunologis seperti misalnya vaksinasi dari luar.
KESIMPULAN
Virus AI subtipe H5N1 mempunyai fenotipe yang berbeda pada hewan coba tergantung dari karakter genetiknya. Virus AI subtipe H5N1 dapat membunuh ayam dalam waktu 48-72 jam tergantung dari karakter genetik dari virus. Karakter virus AI subtipe H5N1 yang baru, mampu menimbulkan kerusakan organ yang lebih parah dibandingkan dengan karakter virus AI lama. Adaptasi virus di setiap organ juga membuktikan bahwa kemungkinan akan menciptakan variasi virus/quasispecies, yang berbeda dengan virus asalnya.
UCAPAN TERIMAKASIH
Penulis mengucapkan terima kasih kepada Bapak Nana Suryana, Teguh Suyatno dan Ace Endan S. atas bantuan teknis yang telah diberikan selama penelitian ini berlangsung. Ucapan terima kasih juga diucapkan kepada semua pihak baik langsung maupun tidak langsung telah berkontribusi terhadap penelitian ini.
DAFTAR PUSTAKA
Alexander, DJ., G. Parsons & RJ. Manvell. 1986. Experimental assessment of the pathogenicity of eight avian influenza viruses of H5 subtype for chickens, turkey, ducks, and quails. Avian Pathology. 15 : 647-662. Alexander, DJ., WH. Allan, D. Parsons & G.
Parsons. 1978. The pathogenicity of four avian influenza viruses for fowls, turkeys and ducks. Research in Veterinary Science. 24 : 242-247.
Bean, WJ., Y. Kawaoka, JM. Wood, JE. Pearson & RG. Webster. 1985. Characterization of virulent and avirulent
A/chicken/Pennsyl-vania/83 influenza A viruses: potential role of defective interfering RNAs in nature. Journal of Virology. 54 : 151-160.
Brown, CC., HJ. Olander & DA. Senne. 1992. A pathogenesis study of highly pathogenic avian influenza virus H5N2 in chickens, using immunohistochemistry. Journal of Comparative Pathology. 107 : 341-348. Cauthen, AN., DE. Swayne, S. Schultz-Cherry,
ML. Perdue & DL. Suarez. 2000. Continued circulation in China of highly pathogenic avian influenza viruses encoding the hemagglutinin gene associated with the 1997 H5N1 outbreak in poultry and humans. Journal of Virology. 74. 6592-6599.
Domingo, E., E. Baranowski, CM. Ruiz-Jarabo, AM. Martin-Hernandez, JC. Saiz & C. Escarmis. 1998. Quasispecies structure and persistence of RNA viruses. Emerg Infect Dis. 4: 521–527.
Domingo, E., E. Martinez-Salas, F. Sobrino, JC. de la Torre, A. Portela, J. Ortin, C. Lopez-Galindez, P. Perez-Brena, N. Villanueva, R. Najera, S. VandePol, D. Steinhauer, N. De Polo, & JJ. Holland. 1985. The quasispecies (extremely heterogeneous) nature of viral RNA genome populations: biological relevance-a review. Gene 40: 1–8.
Elbers, AR., THF. Fabri, TS. de Vries, JJ. de Wit, A. Pijpers & G. Koch. 2004a. The highly pathogenic avian influenza A (H7N7) virus epidemic in the Netherlands in 2003. Lessons learned from the first five outbreaks. Avian Diseases. 48 : 691-705.
Elbers, AR., B. Kamps & G. Koch. 2004b. Performance of gross lesions at postmortem for the detection of outbreaks during the avian influenza Avirus (H7N7) epidemic in The Netherlands in 2003. Avian Pathology. 33 : 418-422.
Forman, AJ., IM. Parsonson & WJ. Doughty. 1986. The pathogenicity of an avian influenza
virus isolated in Victoria. Australian Veterinary Journal. 63 : 294-296.
Ghedin, E., NA. Sengamalay, M. Shumway, J. Zaborsky, T. Feldblyum, V. Subbu, DJ. Spiro, J.Sitz, H. Koo, P. Bolotov, D. Dernovoy, T. Tatusova, Y. Bao, K. St George, J. Taylor, D.J. Lipman, C.M. Fraser, J.K.Taubenberger & S.L. Salzberg. 2005. Large-scale sequencing of human influenza reveals the dynamic nature of viral genome evolution. Nature. 437: 1162–1166.
Guan Y, LL. Poon, CY. Cheung, TM. Ellis, W. Lim, AS. Lipatov, KH. Chan, KM. Sturm-Ramirez, CL. Cheung, YH. Leung, KY. Yuen, RG. Webster, JS. Peiris. 2004. H5N1 influenza: a protean pandemic threat. Proc. Natl. Acad. Sci. U. S. A. 101:8156–8161. Hoffmann, E., J. Stech, Y. Guan, RG. Webster,
& DR. Perez. 2001. Universal primer set for the full-length amplification of all influenza A viruses. Arch. Virol. 146: 2275-2289. Hooper, P. & P. Selleck. 1998. Pathology of low
and high virulent influenza virus infections. In DE. Swayne & RD. Slemons (Eds.), Proceedings of the Fourth International Symposium on Avian Influenza of the US Animal Health Association (pp. 134-141). Richmond, VA, USA
Jones, YL & DE Swayne. 2004. Comparative pathobiology of low and high pathogenecity H7N3 Chilean avian influenza viruses in chickens. Avian Diseases. 48 :119-128 Katz, JM., V. Veguilla, JA. Belser, TR. Maines,
N. Van Hoeven, C. Pappas, K. Hancock & TM. Tumpey. 2009. The public health impact of avian influenza viruses. Poult Sci . 88, 872–879.
Lee, CW., DL. Suarez, TM. Tumpey, HW. Sung, YK. Kwon, Y.J. Lee, J.G. Choi, SJ. Joh, MC. Kim, EK. Lee, JM. Park, X. Lu, JM. Katz, E. Spackman, DE. Swayne & JH. Kim.
2005. Characterization of highly pathogenic H5N1 avian influenza A viruses isolated from South Korea. Journal of Virology. 79 : 3692-3702.
Lee, MS., PC. Chang, JH. Shien, MC. Cheng and HP. Shieh. 2001. Identification and subtyping of avian influenza viruses by reverse transcription-PCR. Journal of Virology. Methods. 97: 13-22.
Nakatani, H., K. Nakamura, Y. Yamamoto, M. Yamada & Y. Yamamoto. 2005. Epidemiology, pathology, and immunohistochemistry of layer hens naturally affected with H5N1 highly pathogenic avian influenza in Japan. Avian Diseases. 4 : 436-441.
Nguyen, DC., TM. Uyeki, S. Jadhao, T. Maines, M. Shaw, Y. Matsuoka, C. Smith, T. Rowe, X. Lu, H. Hall, X. Xu, A. Balish, A. Klimov, TM. Tumpey, DE. Swayne, LP. Huynh, HK. Nghiem, HH. Nguyen, LT. Hoang, NJ. Cox. & JM. Katz. 2005. Isolation and characterization of avian influenza viruses, including highly pathogenic H5N1, from poultry in live bird markets in Hanoi, Vietnam, in 2001. Journal of Virology. 79 : 4201-4212.
Peiris JS., MD. de Jong & Y. Guan. 2007. Avian influenza virus (H5N1): a threat to human health. Clin. Microbiol. Rev. 20:243–267. Perkins, LE. & DE. Swayne. 2001. Pathobiology
of A/chicken/HongKong/220/97 (H5N1) avian influenza virus in seven gallinaceous species. Veterinary Pathology. 38 : 149-164. Reed, LJ & Muench, H. 1938. A sample meyhod
of estimating 50 percent end points. Ame. J. Hyg. 27 : 493
Shortridge, KF., NN. Zhou, Y. Guan, P. Gao, T. Ito, Y. Kawaoka, S. Kodihalli, S. Krauss, D. Markwell, KG. Murti, M. Norwood, D. Senne, L. Sims, A. Takada & RG. Webster. 1998. Characterization of avian
H5N1 influenza viruses from poultry in Hong Kong. Virology. 252. 331-342. Spiro,DJ. J. Sitz, H. Koo, P. Bolotov, D. Dernovoy,
T. Tatusova, Y. Bao, K. St George, J. Taylor, DJ. Lipman, CM. Fraser, JK. Taubenberger & SL. Salzberg. 2005. Large -scale sequencing of human influenza reveals the dynamic nature of viral genome evolution. Nature. 437, 1162–1166.
Stech, J., X. Xiong, C. Scholtissek & RG. Webster. 1999. Independence of evolutionary and mutational rates after transmission of avian influenza viruses to swine. Journal of Virology. 73: 1878–1884.
Suarez, DL., ML. Perdue, N. Cox, T. Rowe, C. Bender, J. Huang & DE. Swayne. 1998. Comparisons of highly virulent H5N1 influenza A viruses isolated from humans and chickens from Hong Kong. Journal of Virology. 72 : 6678-6688.
Swayne, DE. & M. Pantin-Jackwood. 2006. Pathogenicity of avian influenza viruses in poultry. Developments in Biologicals. 124 : 61-67.
Swayne, DE. 2007. Understanding the complex pathobiology of high pathogenicity avian influenza viruses in birds. Avian Diseases. 51 : 242-249.
Tian, G., S. Zhang & Y. Li. 2005. Protective efficacy in chickens, geese and ducks of an H5N1-inactivated vaccine developed by reverse genetics. Virology. 341 : 153-162.
Tsukamoto, K., T. Imada, N. Tanimura, M. Okamatsu, M. Mase, T. Mizuhara, DE. Swayne, & S. Yamaguchi. 2007. Impact of different husbandry conditions on contact and airborne transmission of H5N1 highly pathogenic avian influenza virus to chickens. Avian Diseases. 51 : 129-132. Tumpey, TM, DL. Suarez, LE. Perkins, DA.
Senne, JG. Lee, YJ. Lee, IP. Mo, HW. Sun & DE. Swayne. 2002. Characterization of a highly pathogenic H5N1 avian influenza Avirus isolated from duck meat. Journal of Virology. 76 : 6344-6355.
Wang R., L. Soll, V. Dugan, J. Runstadler, G. Happ, RD. Slemons, & JK. Taubenberger. 2008 Examining the hemagglutinin subtype diversity among wild duck-origin influenza A viruses using ethanol-fixed cloacal swabs and a novel RT-PCR method. Virology. 375: 182–189.
Westbury, HA., AJ. Turner & L. Kovesdy. 1979. The pathogenicity of three Australian fowl plague viruses for chickens, turkeys and ducks. Veterinary Microbiology. 4 : 223-234. WHO. 2013. Cumulative number of confirmed
human cases for avian influenza A(H5N1) reported to WHO, 2003–2013.
http://www.who.int/influenza/human_animal_ interface/EN_GIP_20130604Cumulative NumberH5N1cases.pdf.