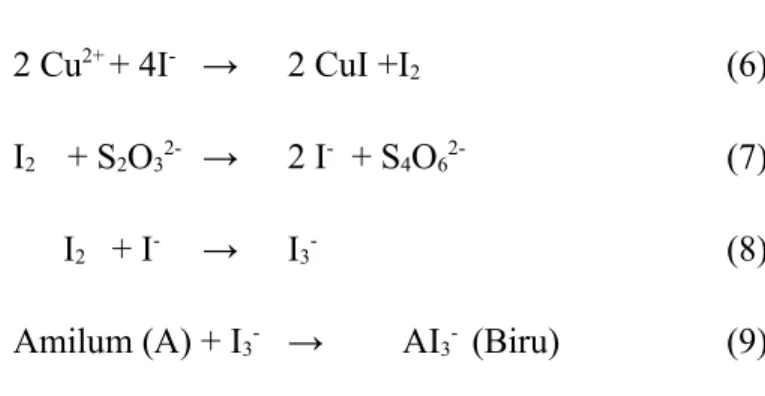BAB I PENDAHULUAN
1.1. Latar Belakang
Elektrokimia memiliki banyak kegunaan yang penting untuk kehidupan sehari-hari. Diantaranya membuat senyawa lain, seperti unsur logam, halogen, gas hidrogen, dan gas oksigen. Contohnya pada elektrolisa larutan NaCl. Cara itu untuk mengetahui konsentrasi ion logam dalam larutan. Kegunaan lainnya yaitu melapisi permukaan suatu logam dengan logam yang lain.
Mahasiswa teknik kimia harus memahami teori yang berkaitan dengan proses elektrolisis. Banyak aplikasi elektrolisis seperti elektroplating, elektrorefining, dan juga elektrowinning. Oleh karena itu, mahasiswa teknik kimia perlu melakukan percobaan elektrolisis, seperti menentukan berat Cu yang menempel pada katoda setelah proses elektrolisis.
1.2. Tujuan Percobaan
1. Menentukan berat Cu,Fe yang menempel pada katoda setelah proses elektrolisis.
2. Menentukan kadar Cu2+ ,Fe2+ dalam larutan sisa elektrolisis dengan menggunakan metode
titrasi iodometri.
3. Mengetahui pengaruh waktu terhadap besarnya konversi massa dan konversi volume. 4. Mengetahui pengaruh beda anoda terhadap besarnya konversi massa dan konversi volume 5. Mengetahui pengaruh beda katoda terhadap besarnya konversi massa dan konversi
volume
6. Mengetahui pengaruh kuat arus pada elektrolisa terhadap besarnya konversi massa.
1.3. Manfaat Percobaan
1. Mahasiswa mampu menentukan berat Cu dan Fe yang menempel pada katoda setelah proses elektrolisis.
2. Mahasiswa mampu menentukan kadar Cu2+, Fe2+ dalam larutan sisa elektrolisis dengan
menggunakan metode titrasi iodometri.
3. Mahasiswa mampu pengaruh waktu terhadap besarnya konversi massa dan konversi volume.
4. Mahasiswa mampu pengaruh beda anoda terhadap besarnya konversi massa dan konversi volume
5. Mahasiswa mampu pengaruh beda katoda terhadap besarnya konversi massa dan konversi volume
6. Mahasiswa mampu pengaruh kuat arus pada elektrolisa terhadap besarnya konversi massa.
BAB II
TINJAUAN PUSTAKA 2.1. Pengertian Elektrokimia
Elektrokimia mempelajari reaksi-reaksi yang disertai perpindahan elektron. Pada proses ini energi kimia diubah menjadi energi listrik atau sebaliknya. Elektrokimia secara umum terbagi dalam dua kelompok, yaitu sel galvani dan sel elektrolisis. Sel Galvani (sel Volta) merupakan sel elektrokimia yang dapat menghasilkan energi listrik yang disebabkan oleh terjadinya reaksi redoks yang spontan. Sedangkan elektrolisa adalah proses peruraian suatu elektrolit yang disebabkan oleh adanya arus listrik searah. Dalam percobaan ini digunakan larutan CuSO4.5H2O
sebagai elektrolitnya. Pada larutan CuSO4.5H2O tidak terbentuk endapan tembaga sulfit sehingga
proses ini menunjukan proses pengolahan yang bersih, sederhana dan sangat baik untuk mengambil kembali tembaga yang mempunyai kemurnian tinggi yaitu sekitar 99%.
Pada sel elektrolisa terjadi proses pelucutan ion-ion bermuatan. Selama proses berlangsung, arus listrik mengalir melalui elektrolit, memberikan energi yang cukup untuk menjalankan reaksi oksidasi dan reduksi. Ion-ion yang bermuatan bergerak, setelah arus listrik mengalir dalam elektrolit. Ion positif bergerak ke elektroda negatif (katoda) dan ion negatif bergerak ke elektroda positif (anoda). Saat ion-ion bermuatan saling bersinggungan dengan elektroda akan terjadi reaksi elektrokimia. Pada elektroda positif, ion negatif melepaskan elektron dan teroksidasi. Pada elektroda negatif, ion positif menangkap elektron dan tereduksi.
2.2. Reaksi pada proses Elektrolisis
Reaksi reaksi pada proses elektrolisis merupakan reaksi reversibel dan merupakan reaksi redoks. Pada katoda berlangsung reaksi reduksi dan pada anoda berlangsung reaksi oksidasi. Pada percobaan ini, sebagai katoda digunakan batang tembaga dan sebagai anoda digunakan grafit. Elektrolitnya adalah larutan CuSO4.5H2O.
Reaksi yang terjadi:
CuSO4 ↔ Cu2+ + SO42- (1) 2H2O ↔ 2H+ + 2OH- (2) Anoda 2OH- ↔ H 2O + ½ O2 +2e-(3) Katoda Cu2+ + 2e- ↔ Cu (4) CuSO4 +H2O ↔ Cu + 2H+ + SO42- + ½ O2 (5)
Berdasarkan persamaan reaksi diatas, pada larutan akan tinggal asam sulfat, pada anoda akan terbentuk gas O2 dan logam Cu akan menempel pada katoda.
Untuk analisa larutan sisa elektrokimia digunakan metode titrasi iodometri. Metode ini dilakukan untuk mengetahui kadar Cu2+ yang masih tersisa dalam larutan.
Reaksi :
2 Cu2+ + 4I- → 2 CuI +I
2 (6)
I2 + S2O32- → 2 I- + S4O62- (7)
I2 + I- → I3- (8)
Amilum (A) + I3- → AI3- (Biru) (9)
2.3. Faktor - faktor yang mempengaruhi proses elektrokimia
Arus listrik
Semakin besar arus listrik maka elektrokimia akan berlangsung lebih cepat karena proses penghantaran ion-ion dalam larutan ke katoda lebih cepat.
Konsentrasi larutan
Konsentrasi larutan akan mempengaruhi jumlah ion-ion yang terdapat dalam larutan, sehingga konsentrasi yang semakin tinggi akan mempercepat proses elektrokimia.
Suhu
Semakin tinggi suhu menyebabkan konduktivitas larutan semakin besar sehingga dapat mempercepat hantaran arus listrik dari anoda menuju katoda sehingga akan mempercepat proses elektrokimia.
Waktu
Semakin lama waktu untuk melakukan proses elektrokimia maka semakin banyak pula kation yang akan tereduksi dan menempel pada katoda.
2.4. Deret Volta
Susunan unsur-unsur logam berdasarkan potensial elektroda standarnya disebut deret elektrokimia atau deret volta.
Li K Ba Ca Na Mg Al Mn Zn Cr Fe Cd Co Ni Sn Pb (H) Cu Ag Hg Pt Au Mudah mengalami oksidasi (Reduktor) Mudah mengalami reduksi (oksidator)
Gambar 2.1 Deret Volta
Semakin ke kiri sifat reduktor semakin kuat artinya logam mampu mereduksi ion-ion di sebelah kanannya tetapi tidak mampu mereduksi ion di sebelah kirinya dan logam semakin reaktif (semakin mudah melepas elektron).
2.5. Aplikasi Proses Elektrokimia
Elektroplating
Yaitu proses pelapisan suatu logam dengan logam lain dengan cara elektrolisis Prinsipnya:
1. Katoda sebagai logam yang dilapisi 2. Anoda sebagai logam pelapis
3. Menggunakan elektrolit garam dari logam anoda Contohnya :
- Pelapisan Tembaga-Nikel-Khrom
Elektrorefining
Yaitu cara mendapatkan logam dengan kemurnian yang tinggi dari bijih logam dengan kemurnian yang sudah cukup tinggi.
Elektrowinning
Yaitu untuk mendapatkan logam dengan kemurnian yang tinggi dari logam yang kadarnya rendah.
2.5. Pembuatan Elektrokimia
Elektrokimia digunakan untuk menyalakan generator. Kebanyakan senyawa anorganik lebih beracun daripada senyawa organik. Unsur organik terkadang bisa berada di beberapa sampel yang berbeda. Contohnya As bisa berada di air, udara, senyawa biologi, seperti darah dan urine. Untuk memisahkan senyawa-senyawa tersebut dilakukan dengan mengklasifikasikan sesuai jenisnya dan dipisahkan dengan metode masing – masing. Contohnya untuk As dapat dipisahkan dari senyawa lain dengan vapor generation (VG) dan berpasangan dengan absorption spektrometri (AAS). VG dan AAS memiliki ketepatan dan ketelitian yang cukup dalam meneliti As. Cara yang palimg tepat untuk menganalisis pembuatan elektrokimia dari AsH3 adalah
dengan Electro Chemical Hydride Generation (EcHG) (Andrea Caiminagua dkk,2015).
2.7 Electrochemical Hydride Generation(EcHG)
Metode EcHG ini digunakan untuk pembuatan hidrida. EcHG telah dijadikan sebagai alternatif cara kimia. EcHG terdiri dari reduki elemen dalam permukaan katoda dalam sel elektrolit diikuti dengan reaksi dari elemen logam dengan hidrogen yang dihasilkan dalam sel atau masuk dalam media reaksi. Berdasarkan katodanya,EcHG dikelompokkan menjadi 2,pertama sesuai absorpsi hydrogen yang tinggi dan sel volta yang tinggi. Katoda dengan tegangan tinggi lebih dapat mengurangi berbagai hibrida yang membentuk elemen. Hydrogen dengan tegangan tinggi lebih rentan untuk gangguan tetapi lebih efisien dan lebih fleksibel dalam hal pembentukan hibrida. Sayangnya,beberapa dari katoda ini menunjukkan mekanik rendah oleh karena itu haru diganti secara berkala. (Andrea Caiminagua dkk,2015).
BAB III
METODE PRAKTIKUM
3. 1. Bahan dan Alat yang Digunakan 3.1.1. Bahan 1. CuSO4.5H2O 0.5M 500ml 2. KI 5.364gr 3. Na2S2O3 0.15M 250ml 4. Amilum 5. Aquadest 3.1.2. Alat: 1. Tangki elektrokimia 2. Batang tembaga 3. Grafit 4. Voltmeter/ Amperemeter 5. Adaptor 6. Magnetic stirrer
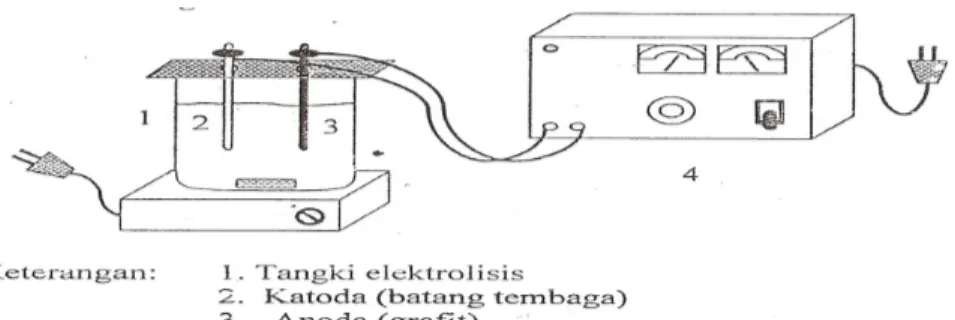
3. 2. Gambar Rangkaian Alat
Gambar 3.1. Rangkaian Alat Elektrolisis Keterangan: 1. Tangki elektrolisis
2. Katoda (batang tembaga) 3. Anoda (grafit)
4. Adaptor, Amperemeter, Voltmeter
Gambar 3.2. Rangkaian Alat Titrasi
Data Yang Diperlukan
1. Konsentrasi larutan CuSO4.5H2O
2. Volume titran Na2S2O3 sebelum dan sesudah proses elektrolisa
3. Berat katoda sebelum dan sesudah proses elektrolisa
3.3. Prosedur Percobaan
1. Isi tangki elektrolisis dengan 500 ml larutan CuSO4.5H2O
2. Letakkan katoda dan anoda pada tangki dengan posisi yang permanen. Hubungkan anoda dengan kutub positif dan katoda dengan kutub negatif penyearah arus
3. Alirkan 60 mA arus bertegangan rendah (besar arus bisa divariasi) dan jalankan pengadukan dengan perlahan-lahan.
4. Ketika mencapai waktu 0,3,6,9 hentikan pengadukan dan arus listrik, ambil katoda. Selanjutnya cuci katoda, keringkan dan timbang. Analisa cairan sisa elektrolisa dengan metode titrasi iodometri untuk mengetahui kandungan Cu2+ yang masih tersisa
5. Lakukan langkah 1s/d 4 dengan variasi arus 60mA,80mA serta wakti yang bebeda-beda yaitu 0,3,6,9 menit sesuai variabel I,II,III dan IV yang telah di tentukkan.
3.4. Analisa Hasil
Ambil 5 ml cairan sisa hasil elektrolisis, masukkan dalam erlenmeyer dan selanjutnya tambahkan 3 ml larutan KI 10% berat. Tutup mulut labu erlenmeyer dengan gelas arloji kecil dan biarkan selama 5 menit di tempat yang gelap agar reaksi berlangsung dengan sempurna. Selanjutnya cuci tutup gelas arloji dengan aquadest dan masukkan air cucian dalam erlenmeyer, kemudian titrasi larutan tersebut dengan larutan Na2S2O3 sampai warna larutan berubah menjadi kuning.
Selanjutnya tambahkan 3 tetes indikator amilum ke dalam campuran dan dititrasi lagi dengan Na2S2O3 sampai warna biru tepat hilang (putih susu).
3.5. Cara Perhitungan 1. X1 = M−M0 MCu Keterangan : 1. Klem 2. Statif 3. Buret 4. Erlenmeyer
Keterangan :
X1 = konversi massa
M = berat katoda setelah proses elektrolisa M0 = berat katoda sebelum proses elektrolisa
MCu = berat tembaga dalam cairan mula mula
2. X2 = V0.N−V . N V0. N = V0−V V0 Keterangan : X2 = konversi volume
V0 = volume larutan Na2S2O3 sebelum dielektrolisis
V = volume larutan Na2S2O3 setelah dielektrolisis
N = normalitas larutan Na2S2O3
DAFTAR PUSTAKA
Badger, W.Z. dan Bachero, J.F., ”Introduction to chemical Engineering” ,International student edition, Mc Graw Hill Book Co.,
Kogakusha, Tokyo. Daniels, F.,1961, “Experimental Physical Chemistry”,6thed., Mc Graw Hill