KLONING GEN
PROTEINASE INHIBITOR
DARI KULIT
BUAH KAKAO PADA VEKTOR EKSPRESI DENGAN
METODE GATEWAY
YANTHI WIDYANTHI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2010
ABSTRAK
YANTHI WIDYANTHI. Kloning Gen
Proteinase Inhibitor
dari Kulit
Buah Kakao pada Vektor Ekspresi dengan Metode Gateway. Dibimbing oleh
AKHMAD ENDANG ZAINAL HASAN dan TETTY CHAIDAMSARI.
Kakao (
Theobroma cacao
L.) merupakan salah satu tanaman perkebunan
yang mempunyai nilai ekonomi tinggi sebagai komoditi ekspor. Adanya serangan
hama utama kakao, yaitu
Conopomorpha cramerella
Snellen, menyebabkan
kehilangan produksi kakao hingga 80% dan biji kakao yang terserang, mutunya
menurun bahkan tidak laku dijual. Gen
proteinase inhibitor (PIN)
merupakan gen
yang dapat menghasilkan senyawa antinutrisi yang dapat menghambat kerja
enzim proteolitik di dalam perut serangga. Gen
PIN
terdapat pada biji kakao dan
berukuran 21 kDa dengan homologi yang cocok dengan inhibitor tripsin pada
kedelai. Penelitian ini bertujuan melakukan kloning gen
PIN
pada vektor ekspresi
dengan menggunakan metode Gateway. Tahapan metode Gateway meliputi
desain primer Gateway, amplifikasi gen
PIN
dengan primer Gateway,
rekombinasi gen
PIN
pada vektor Entri dan vektor Destinasi, transformasi pada
Escherichia coli XL-1 Blue
, konfirmasi gen
PIN
pada vektor Entri dan vektor
Destinasi, dan transformasi gen
PIN
pada
E.coli
ke
Agrobacterium tumefaciens
.
Hasil penelitian menunjukkan bahwa gen
PIN
dengan ukuran 850 bp berhasil
disisipkan ke dalam vektor ekspresi dengan metode Gateway secara mudah dan
cepat. Transformasi DNA rekombinan ke dalam
Agrobacterium tumefaciens
ABSTRACT
YANTHI WIDYANTHI. Cloned
Proteinase Inhibitor
Gene of Cacao Pod
Wall on Expression Vector by Gateway Method. Under the direction of
AKHMAD ENDANG ZAINAL HASAN and TETTY CHAIDAMSARI
Cacao (
Theobroma cacao
L.) is one of a high economical value estate
crops as an export commodity. Eighty percent of cacao production loss was
caused by Cocoa Pod Borer (CPB),
Conopomorpha cramerella
Snellen. Thus,
cacao seed were not soldable due to its low quality.
Proteinase Inhibitor (PIN)
is
an antinutrition substances which able to inhibit proteolytic enzyme from insect
gut. A 21 kDa of cacao seed
PIN
gene was known of having high homology to
soybean trypsin inhibitor. This research was aimed to clone
PIN
gene on
expression vector by Gateway method. Gateway method step include design
Gateway primer, amplification
PIN
gene with Gateway primer, recombination
PIN
gene on Entry and Destination vector, transformation on
Escherichia coli
XL-1 Blue
, confirmation
PIN
gene on Entry and Destination vector, and
transformation
PIN
gene on
E.coli
into
Agrobacterium tumefaciens
. Result of
research indicate that
PIN
gene have a measurement of 850 bp succeed inserted
into expression vector with Gateway method easy and quickly. The recombinant
DNA was successfully transformed into
Agrobacterium tumfaciens
AGL-0 strain.
KLONING GEN
PROTEINASE INHIBITOR
DARI KULIT
BUAH KAKAO PADA VEKTOR EKSPRESI DENGAN
METODE GATEWAY
YANTHI WIDYANTHI
Skripsi
sebagai salah satu syarat memperoleh gelar
Sarjana Sains pada
Departemen Biokimia
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2010
Judul Skripsi : Kloning Gen
Proteinase Inhibitor
dari Kulit Buah Kakao pada
Vektor Ekspresi dengan Metode Gateway
Nama
: Yanthi Widyanthi
NIM
: G84062616
Disetujui
Komisi Pembimbing
Diketahui,
Dr. Ir. I Made Artika, M.App.Sc.
Ketua Departemen Biokimia
Tanggal Lulus:
Ir. A.E. Zainal Hasan, M.Si
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Allah SWT atas karunia dan
hidayah-Nya sehingga penulis dapat menyelesaikan penelitian ini dengan baik.
Penelitian dengan judul “Kloning Gen
Proteinase Inhibitor
dari Kulit Buah Kakao
pada Vektor Ekspresi dengan Metode Gateway”, dilaksanakan mulai bulan Maret
2010 sampai dengan Juli 2010 di Laboratorium Biologi Molekuler dan Rekayasa
Genetika, Balai Penelitian Bioteknologi Perkebunan Indonesia, Jalan Taman
Kencana No.1, Bogor.
Penulis mengucapkan terima kasih kepada semua pihak yang telah
membantu selama penyusunan skripsi dan pelaksanaan penelitian antara lain.
Bapak Ir. Akhmad Endang Zainal Hasan, M.Si selaku pembimbing utama, dan
Ibu Dr. Tetty Chaidamsari, M.Si selaku pembimbing lapangan yang telah
memberikan saran, kritik, dan bimbingannya, serta Mba Herti dan Mba Nina atas
peran, kerjasama, dan bantuannya selama kegiatan penelitian di Laboratorium
Biologi Molekuler dan Rekayasa Genetika, Balai Penelitian Bioteknologi
Perkebunan serta teman-teman Biokimia angkatan 43 atas dukungan dan
kebersamaannya. Tak lupa penulis menyampaikan ucapan terima kasih yang tak
terhingga kepada orang tua dan keluarga yang senantiasa mendidik, mendukung,
dan mendoakan penulis. Akhir kata penulis berharap semoga penelitian ini
bermanfaat demi kemajuan ilmu pengetahuan.
Bogor, Oktober 2010
RIWAYAT HIDUP
Penulis dilahirkan di Kuningan pada tanggal 28 April 1987 dari pasangan
Djadja Sutedjo dan Maemunah. Penulis merupakan anak ketujuh dari delapan
bersaudara.
Pada tahun 2006 penulis lulus dari SMA Negeri 2 Kuningan dan pada
tahun yang sama lulus seleksi masuk IPB melalui Seleksi Penerimaan Mahasiswa
Baru (SPMB). Penulis memilih jurusan Biokimia, Departemen Biokimia, Fakultas
Matematika dan Ilmu Pengetahuan Alam sebagai pilihan studi di IPB.
Pengalaman kerja penulis diantaranya menjadi pengajar matematika dan kimia
pada bimbingan belajar Heksagonal pada tahun 2009. Penulis melakukan praktek
kerja lapang di Pusat Studi Satwa Primata (PSSP)-LPPM IPB, Jalan Lodaya II
No.5 Bogor dengan judul Uji Toleransi Glukosa Intravena pada Monyet Ekor
Panjang (
Macaca fascilularis
) yang Diinduksi Streptozotosin.
DAFTAR ISI
Halaman
DAFTAR GAMBAR ...
v
PENDAHULUAN ...
1
TINJAUAN PUSTAKA ...
2
Kakao (
Theobroma cacao
L.) ...
2
Penggerek Buah Kakao (PBK) ...
3
Gen
Proteinase Inhibitor
...
3
Kloning DNA ...
4
Metode Gateway ...
4
Polymerase Chain Reaction
(PCR) ...
5
BAHAN DAN METODE ...
6
Bahan dan Alat ...
6
Metode ...
6
HASIL DAN PEMBAHASAN ...
8
Amplifikasi Gen
PIN
dengan Primer Gateway ...
9
Ekstraksi dan Purifikasi Fragmen Gen
PIN
...
9
Rekombinasi Gen
PIN
pada Vektor Entri... 10
Rekombinasi Gen
PIN
pada Vektor Destinasi ... 11
Transformasi ke
Agrobacterium tumefaciens
strain AGL-0 ... 12
SIMPULAN DAN SARAN ... 13
DAFTAR PUSTAKA ... 13
DAFTAR GAMBAR
Halaman
1 Bagian buah kakao ...
2
2 Ngengat penggerek buah kakao ...
3
3 Buah yang terserang PBK ...
3
4 Reaksi Metode Gateway ...
5
5 Hasil amplifikasi PCR dengan primer Gateway pada
annealing
50
oC, 55
oC,
dan 60
oC ... 9
6 Pemurnian produk PCR gen
PIN
... 10
7 Duplikat koloni hasil rekombinasi gen
PIN
pada vektor Entri ... 10
8 Hasil PCR koloni rekombinasi gen
PIN
pada vektor Entri... 10
9 Contoh transformasi koloni gen
PIN
dengan vektor Destinasi ke dalam sel
kompeten (
E. Coli XL-1 Blue
)... 11
10 Hasil PCR koloni rekombinasi gen
PIN
pada vektor Destinasi... 11
11 Hasil elektroforesis isolasi DNA plasmid gen
PIN
dengan vektor Destinasi
atau vektor Ekspresi ... 11
12 Hasil PCR koloni transformasi gen
PIN
dengan vektor Destinasi ke dalam
Agrobacterium tumefaciens
strain AGL-0... 13
1
PENDAHULUAN
Kakao (Theobroma cacao L.) merupakan salah satu komoditas andalan perkebunan yang peranannya cukup penting bagi perekonomian nasional, khususnya sebagai penyedia lapangan kerja, sumber pendapatan dan devisa negara. Perkebunan kakao di Indonesia mengalami perkembangan pesat dalam kurun waktu 20 tahun terakhir dan pada tahun 2002 areal perkebunan kakao Indonesia tercatat seluas 914.051 ha (Depperin 2007).
Indonesia berhasil menempatkan diri sebagai produsen kakao terbesar kedua dunia setelah Pantai Gading (Cote d’lvoire) pada tahun 2002, walaupun kembali tergeser ke posisi ketiga oleh Ghana pada tahun 2003 (International Cocoa Organization 2003). Tergesernya posisi Indonesia tersebut disebabkan oleh turunnya harga kakao dunia dan turunnya produktivitas tanaman karena kondisi iklim yang kurang menguntungkan dan meluasnya serangan hama penggerek buah kakao (PBK) serta penyakit di wilayah sentra produksi. Pada saat ini teridentifikasi serangan hama PBK sudah mencapai 40% dari total areal kakao khususnya di pusat utama produksi kakao dengan kerugian sekitar US$ 150 juta per tahun.
Serangan hama PBK merupakan ancaman yang serius bagi kelangsungan usaha petani kakao karena belum ditemukan pengendalian hama yang efektif dan efisien (Santoso et al 2004). Pengendalian hama PBK secara konvensional sudah sering dilakukan, seperti pemangkasan, pemupukan, sanitasi, dan kontinuitas pemanenan. Penelitian yang telah dilakukan antara lain dengan kultur teknis, secara kimia dengan penyemprotan insektisida, dan secara biologis menggunakan jamur
Beauveria bassiana. Pengendalian tersebut dapat dikatakan kurang efektif karena lebih dari 50 % dari siklus hidup hama PBK berada di dalam buah (Depparaba 2004).
Cara yang lebih efisien untuk mengatasi masalah tersebut adalah dengan menggunakan penanda molekuler. Penanda yang demikian dapat dikembangkan atas dasar sekuen gen yang menentukan gen ketahanan hama. Berdasarkan penelitian yang telah dilakukan terhadap perakitan tanaman kakao unggul dapat diketahui beberapa gen teruji efektif terhadap larva PBK (Chaidamsari 2005 dan Santoso et al
2004).
Rekayasa genetik dengan mengekspresikan gen ketahanan hama Bt
sedang diupayakan (Chaidamsari 2005). Namun, adanya penolakan terhadap produk pangan transgenik karena menggunakan gen dari bakteri, telah melemahkan upaya rekayasa genetik tersebut, meskipun gen cry
maupun protein yang disandinya aman dikonsumsi manusia (de Maagd et al 2001). Berdasarkan hal ini maka perlu dicari metode yang lain untuk mengendalikan PBK dengan menggunakan gen lain. Salah satu metode lain itu adalah memanfaatkan gen pertahanan alami pada tanaman kakao itu sendiri, yaitu gen proteinase inhibitor(PIN).
Proteinase inhibitor (PIN) merupakan protein berukuran kecil yang mampu menghambat aktifitas proteinase dalam sistem pencernaan serangga (Fritz 2000).
Menurut Isda et al. (2008) bahwa
TcPINkulit buah kakao penyandi protein ini memiliki tingkat homologi cukup tinggi yaitu 56% dengan gen PINpenyandi protein berukuran 21 kDa pada biji kakao. Gen PIN
diduga memiliki fungsi pertahanan buah kakao terhadap serangan PBK. Adanya keterbatasan klon kakao tahan PBK yang mengandung gen PIN menyebabkan perbanyakan gen PINsangat diperlukan agar gen PIN dapat ditransformasikan ke semua tanaman kakao. Adanya gen PIN pada buah kakao diharapkan dapat mengatasi serangan hama PBK. Oleh karena itu, pada penelitian ini dilakukan perbanyakan gen PIN yang terdapat pada kulit buah kakao dengan metode kloning Gateway.
Isolasi dan penyisipan gen PIN pada vektor ekspresi dengan metode Gateway merupakan fokus utama penelitian ini. Tahapan penelitian yang dilakukan antara lain desain primer untuk Gateway, amplifikasi gen PIN dengan primer Gateway, rekombinasi gen PINpada vektor Entri dan vektor ekspresi (vektor Destinasi), transformasi pada Escherichia coli (E.coli)
XL-1 Blue, konfirmasi gen PIN pada vektor Entri dan vektor Destinasi, dan transformasi gen PIN pada E.coli ke Agrobacterium tumefaciens.
Tahapan yang pernah dilakukan pada penelitian sebelumnya adalah isolasi RNA total dari kulit buah kakao (Farieh 2007; Isda et al. 2008), sintesis utas pertama (first strand), isolasi dan amplifikasi fragmen gen
PIN, ekstraksi dan purifikasi DNA hasil RT-PCR, kloning fragmen gen dengan pGEM-T
Easy (Isda et al. 2008), konfirmasi koloni transforman yang membawa fragmen
2
sisipan, dan sekuensing fragmen gen terklon (Jaya et al. 2004; Farieh 2007).
Penelitian ini bertujuan menyisipkan gen PIN pada vektor ekspresi dengan metode Gateway. Hipotesis pada penelitian ini adalah plasmid rekombinan yang membawa gen PIN dapat disisipkan pada vektor ekspresi dengan metode Gateway. Metode Gateway dapat dimanfaatkan untuk mengklon gen dengan mudah, cepat. Selain itu, gen PIN yang telah disisipkan pada vektor ekspresi dapat ditransformasikan ke tanaman untuk mempelajari peran dan fungsinya terhadap hama PBK.
TINJAUAN PUSTAKA
Kakao (Theobroma cacaoL.)
Kakao (Theobroma cacao L.) merupakan tanaman yang berasal dari Amerika Selatan. Biji tanaman ini menghasilkan produk olahan yang dikenal sebagai cokelat. Biji buah kakao yang telah difermentasi dijadikan serbuk yang disebut sebagai coklat bubuk. Coklat ini dipakai sebagai bahan untuk membuat berbagai macam produk makanan dan minuman. Buah kakao tanpa biji dapat difermentasi untuk dijadikan pakan ternak.
Kakao merupakan satu-satunya di antara 22 jenis genus Theobroma, famili Sterculiaceae yang diusahakan secara komersial. Menurut Tjitrosoepomo (1988) sistematika tanaman ini, yaitu divisi Spermatophyta, subdivisi Angioospermae, kelas Dicotyledoneae, subkelas Dialypetalae, ordo Malvales, famili Sterculiaceae, genus Theobroma, dan spesies Theobroma cacao L. Kakao merupakan tumbuhan tahunan (perennial) berbentuk pohon, di alam dapat mencapai ketinggian 10 m. Meskipun demikian, dalam pembudidayaan tingginya dibuat tidak lebih dari 5m tetapi dengan tajuk menyamping yang meluas. Hal ini dilakukan untuk memperbanyak cabang produktif.
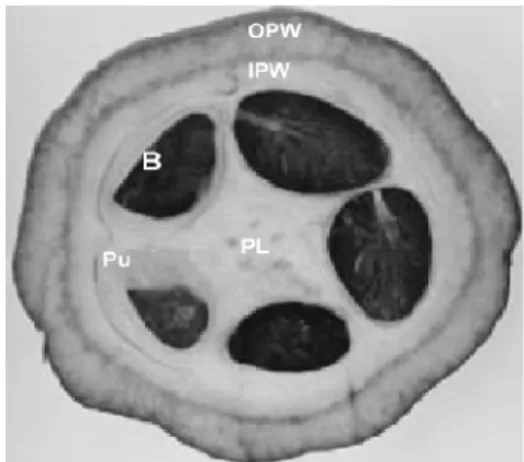
Menurut Chaidamsari (2005) bahwa bila buah kakao dibelah akan tampak seperti Gambar 1, dengan karakterisasi sebagai berikut yaitu OPW (outer pod wall)
merupakan bagian kulit terluar dari kakao, IPW (inner pod wall) bagian kulit lapisan kedua yang berada di dalam buah, Pu (pulp)
daging buah dari kakao, B (beans) biji kakao, dan PL (placenta) bagian tengah dari kakao.
Gambar 1 Bagian buah kakao (Chaidamsari 2005).
Kakao tebagi atas 3 varietas, yaitu
criolo, forastero, dan trinitario / hibrida. Jenis varietas Criolo(fine cocoaatau kakao mulia) mendominasi pasar kakao hingga pertengahan abad 18, akan tetapi saat ini hanya beberapa saja pohon Criolo yang masih ada. Varietas Forastero(kakao curah) merupakan kelompok varietas terbesar yang diolah dan ditanami. Trinitario / Hibrida merupakan hasil persilangan antara jenis
Forasterodan Criolo(Depperin 2007). Kakao diproduksi oleh lebih dari 50 negara yang berada di kawasan tropis yang secara geografis dapat dibagi dalam tiga wilayah yaitu Afrika, Asia Oceania dan Amerika Latin. Pada tahun 2002/2003, produksi kakao dunia tercatat sebesar 3.102 ribu ton. Wilayah Afrika memproduksi biji kakao sebesar 2.158 ribu ton atau 69,6% produksi dunia. Sementara Asia Oceania dan Amerika Latin masing masing memproduksi 528 ribu ton dan 416 ribu ton atau 17,0% dan 13,4% produksi dunia (Depperin 2007).
Bagi Indonesia, kakao saat ini merupakan salah satu komoditas perkebunan yang perlu mendapatkan perhatian serius karena peranannya cukup penting dalam perekonomian Indonesia. Hal ini terlihat dari areal pertanamannya yang setiap tahun meningkat. Komoditas kakao mempunyai peranan penting sebagai sumber pendapatan dan penyerapan tenaga kerja. Produksi Indonesia 456 ribu ton biji kakao, diekspor dalam bentuk biji 365 ribu ton dan sisanya 121 ribu ton diolah di dalam negeri. Produksi coklat olahan sebanyak 96 ribu ton meliputi cocoa butter dan cocoa powder
(Depperin 2007).
Perbaikan harga kakao dunia akhir-akhir ini tidak bisa dimanfaatkan secara optimal oleh para petani kakao karena ada
3
beberapa permasalahan yang dihadapi antara lain: makin mengganasnya serangan hama penggerek buah kakao (PBK), mutu produk yang relatif rendah dan fluktuasi harga yang cukup tajam. Serangan hama PBK merupakan ancaman yang serius bagi kelangsungan usaha perkebunan kakao karena belum ditemukan pengendalian hama yang efektif. Sejarah telah mencatat bahwa hama PBK telah tiga kali menghancurkan perkebunan kakao di Indonesia yaitu tahun 1845 di daerah Minahasa, tahun 1886 di sepanjang pantai Utara Jawa Tengah hingga Malang, Kediri dan Banyuwangi serta tahun 1958 di beberapa perkebunan kakao di Jawa (Roesmanto 1991).
Keseriusan ancaman serangan hama PBK sudah terbukti di Malaysia yang pada saat ini perkebunan kakaonya berada diambang kepunahan. Akibat mengganasnya serangan hama PBK, produksi kakao Malaysia menurun dari 247 ribu ton tahun 1990 menjadi 200 ribu ton tahun 1993. Penurunan produksi kakao terus berlanjut hingga tinggal 25 ribu ton pada tahun 2002 atau 10% dari produksi tahun 1990 (Sulistyowati et al. 1995; ICCO 2003).
Penggerek Buah Kakao (PBK)
Penggerek Buah Kakao (PBK), memiliki klasifikasi ilmiah yakni spesies
Conopomorpha cramerella Snellen, berasal dari famili Grcillariidae, ordo Lepidoptera. Hama kakao ini sangat merugikan, saat ini PBK menyerang hampir seluruh perkebunan kakao di Indonesia dan sangat merugikan petani. Penggerek Buah Kakao (PBK) dapat menyerang buah sekecil 3 cm, tetapi umumnya lebih menyukai buah yang berukuran 8 cm. Hama ini memakan plasenta yang merupakan saluran makanan menuju ke biji sehingga mengakibatkan penurunan hasil dan mutu biji (Wardojo 1996).
Penggerek Buah Kakao (PBK) adalah ngengat kecil (Gambar 2). Kenampakan PBK adalah sebagai larva (seperti cacing) dalam fase muda dan sebagai ngengat pada fase dewasa. Panjang ngengat sekitar 1 cm. Serangan penggerek buah kakao dapat dikenali dari pemasakan buah yang tidak sempurna dan dari lubang kecil pada kulit buah yang dibuat serangga untuk masuk dan keluar. Larva penggerek buah kakao akan terlihat jika buah dibuka (Konam et al. 2009).
Buah yang terserang lebih awal akan berwarna kuning, dan jika digoyang tidak
berbunyi. Biasanya lebih berat dari buah yang sehat. Biji-bijinya saling melekat, berwarna kehitaman serta ukuran biji lebih kecil (Gambar 3). Hal ini menurut Wardojo (1996) kerugian yang ditimbulkan oleh PBK dapat menimbulkan penurunan berat, mutu biji, dan meningkatnya biaya panen karena pemisahan biji pada buah terserang memerlukan waktu yang lama.
Gambar 2 Ngengat penggerek buah kakao. (http://database.deptan.go.id)
Gambar 3 Buah yang terserang PBK. (http://database.deptan.go.id)
Gen Proteinase Inhibitor (PIN) Gen adalah serangkaian molekul DNA yang berfungsi sebagai penyandi genetik dalam pembentukan protein (poli asam amino) (Muladno 2002). Gen merupakan bagian dari genom yang berperan dalam proses ekspresi gen (Jusuf 2001). Gen
proteinase inhibitor (PIN) merupakan gen yang dapat menghasilkan senyawa antinutrisi yang dapat menghambat kerja enzim proteolitik (proteinase) di dalam perut serangga (Ryan 1990). Apabila termakan oleh hama PBK, GenPIN akan berinteraksi dengan protease yang ada di dalam usus hama tersebut, terikat dan terkunci pada situs aktif (active site) protease (Terra et al. 1996). Hama PBK menjadi kekurangan nutrisi karena tidak ada asam amino yang diserap, sehingga pertumbuhan dan perkembangan menjadi terhambat.
Proteinase inhibitor merupakan protein yang berhubungan dengan ketahanan tanaman terhadap hama terutama serangga-serangga yang mengunyah. Biasanya terdapat dalam jaringan organ penyimpanan (misalnya buah, umbi, dan biji). Gen yang
4
menyandi protein ini akan terinduksi akibat adanya perlukaan yang disebabkan oleh lingkungan luar. Gen proteinase inhibitor
selain sebagai sistem proteksi alami bagi tanaman juga mempunyai fungsi sebagai regulasi endogen proteinase dan sebagai protein penyimpanan (Koiwa et al1997).
Proteinase inhibitormerupakan protein yang berukuran 4 kDa sampai 85 kDa terutama pada kisaran 8-20 kDa. Pada kakao, protein ini berukuran 21 kDa dengan homologi yang cocok dengan inhibitor tripsin pada kedelai (kumitz) dari proteinase inhibitor. Hal ini terlihat seperti yang telah dilaporkan oleh Tai et al (1991) bahwa protein tersebut diakumulasi selama perkembangan biji dan tidak didegradasi selama perkecambahan benih pada kakao. Gen PIN pada kakao merupakan golongan
serine proteinase inhibitor (tripsin dan kemotripsin inhibitor) yang akan menyerang sisi aktif proteinase serin dalam tubuh hama serangga dan telah menunjukkan keefektifannya menghambat perkembangan larva beberapa jenis lepidoptera. Keberhasilan penggunaan gen proteinase inhibitordalam transformasi antara lain pada ubi jalar (Newell et al 1995), dan tembakau (Jhonson et al1989).
Kloning DNA
Kloning DNA adalah proses penggandaan jumlah DNA rekombinan melalui perkembangbiakan sel bakteri (biasanya E.coli). Proses kloning dilakukan dengan memasukkan DNA rekombinan ke dalam sel E.coli. Selanjutnya sel ini diinkubasi pada suhu optimal sehingga sel dapat berkembang biak secara eksponensial. DNA rekombinan merupakan gabungan antara DNA vektor yang merupakan molekul DNA yang dapat mereplikasi diri dan DNA asing yang biasanya berupa gen dari suatu makhluk hidup (Muladno 2002). Penggabungan DNA vektor dan DNA asing ini biasanya dibantu oleh enzim ligase sehingga disebut proses ligasi (Nasution 1999). Molekul DNA yang masuk ke dalam sel akan mengubah fenotip sel tersebut, sehingga proses ini disebut transformasi. Sel yang digunakan dalam proses transformasi biasanya disebut dengan sel kompeten (Muladno 2002).
Konfirmasi keberhasilan terbentuknya DNA rekombinan dan penggandaan jumlah gen yang disisipkan ke dalam plasmid sel kompeten melalui kloning DNA dilakukan dengan melihat perubahan yang terjadi pada
koloni yang ditumbuhkan pada media padat. Koloni yang berwarna putih dapat dipastikan merupakan sel yang membawa DNA rekombinan. Langkah berikutnya yaitu isolasi DNA rekombinan dari sel E.coli, pemotongan DNA dengan enzim restriksi yang digunakan dalam pembuatan DNA rekombinan, pemisahan DNA melalui gel elektroforesis dan visualisasi DNA (Muladno 2002).
Metode Gateway
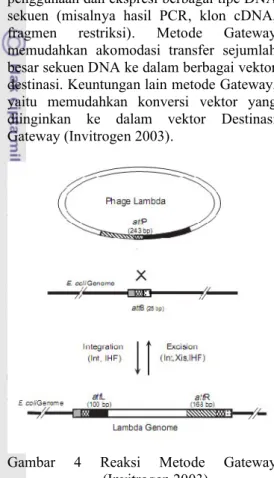
Metode Gateway adalah metode kloning universal berdasarkan pada daerah situs rekombinasi spesifik lambda bakteriofage (Invitrogen 2003). Sistem pengklonan Gateway site-specific recombination (SSR) dikomersialisasikan oleh Invitrogen. Sistem ini mengonstruksi gen sisipan yang terlebih dahulu diklon ke dalam vektor Entri (pENTR) dan kemudian ditransfer ke dalam vektor Destinasi dengan rekombinasi situs spesifik. Pengerjaannya menggunakan protein rekombinasi integrase
(Int) dan excisionase (Xis) yang mengenali situs attL dan attR di dalam vektor Entri dan vektor Destinasi yang akan menggabungkannya ke situs attB (Gambar 4). Gen sisipan dimasukkan ke dalam vektor Entri menggunakan SSR dengan BP klonase atau dengan pengklonan ke dalam multiple cloning site (MCS) tersusun di antara situs
attL1 dan attL2 dengan enzim restriksi dan ligase (REaL) kloning (Dubinet al. 2008).
Vektor biner Gateway telah terbukti berguna untuk mempelajari transformasi tanaman dengan metode kloning tradisional REaL, akan tetapi akan menghabiskan waktu. Bagaimanapun penggunaan dari vektor ini mempunyai kerugian. Contohnya keberadaan situs rekombinasi attB di antara tag dan gen sisipan dalam vektor Destinasi menghasilkan rantai asam amino yang panjang (sedikitnya 8 dan terkadang lebih dari 20 asam amino) dan muatan sekuens sering kali tinggi yang mempunyai kemampuan dari hasil sintesis non fungsional atau fusi protein-tag yang tidak larut dan juga efek tingkat ekspresi protein dari gen yang disisipkan.
Tujuan utama dari modifikasi pengklonan Gateway adalah untuk memperkirakan open reading frame (ORF) yang menyandi protein dalam vektor Entri untuk mencegah keberadaan atau penambahan muatan sekuens yang sering kali tinggi setelah rekombinasi yang dapat
5
mempengaruhi fungsi protein (Dubin et al. 2008).
Keuntungan dari metode Gateway adalah kloning berlangsung cepat dengan efisiensi yang tinggi dalam mentransfer sekuen DNA ke berbagai sistem vektor selama ekspresi protein dan analisis protein. Metode Gateway memungkinkan penggunaan dan ekspresi berbagai tipe DNA sekuen (misalnya hasil PCR, klon cDNA, fragmen restriksi). Metode Gateway memudahkan akomodasi transfer sejumlah besar sekuen DNA ke dalam berbagai vektor destinasi. Keuntungan lain metode Gateway, yaitu memudahkan konversi vektor yang diinginkan ke dalam vektor Destinasi Gateway (Invitrogen 2003).
Gambar 4 Reaksi Metode Gateway (Invitrogen 2003).
Polymerase Chain Reaction(PCR)
Polymerase Chain Reaction (PCR) merupakan suatu reaksi in vitro untuk menggandakan jumlah molekul DNA pada target tertentu dengan cara mensintesis molekul DNA baru yang berkomplemen dengan molekul DNA target tersebut dengan bantuan enzim dan oligonukleotida sebagai
primerdalam suatu thermocycler. Teknik ini dirintis oleh Kary Mullis tahun 1983. Panjang target DNA berkisar antara puluhan sampai ribuan nukleotida yang posisinya diapit sepasang primer. Primer yang berada sebelum daerah target disebut sebagai
primer forward dan yang berada setelah daerah target disebut primer reverse. Enzim yang digunakan sebagai pencetak rangkaian molekul DNA baru dikenal sebagai enzim
polymerase. Untuk dapat mencetak
rangkaian tersebut dalam teknik PCR, diperlukan juga dNTPs yang mencakup dATP (nukleotida berbasa Adenine), dCTP (Cytosine), dGTP (Guanine), dan dTTP (Thymine) (Muladno 2002).
Reaksi PCR membutuhkan suatu bufer yang mengandung MgCl2 karena aktivitas
enzim polimerase dipengaruhi oleh konsentrasi ion Mg2+. Ion Mg2+ akan menyetimulasi aktivitas enzim secara maksimal pada konsentrasi 2 mM jika konsentrasinya lebih tinggi, maka dapat bersifat inhibitor (Sambrook & Russell 2001).
Prinsip teknik PCR meliputi reaksi denaturasi DNA, penempelan primer (annealing), dan pemanjangan DNA (ekstensi). Pada suhu 95oC, molekul DNA
mengalami denaturasi sehingga strukturnya berubah dari untai ganda menjadi untai tunggal. Pada suhu annealingberkisar antara (biasanya) 50oC sampai dengan 60oC, primer forward yang runutan nukleotidanya berkomplemen dengan salah satu untai tunggal akan menempel pada posisi komplemennya, demikian juga primer reverse-nya akan menempel pada untai tunggal lainnya. Setelah kedua primer tersebut menempel pada posisinya masing-masing, enzim polymerase mulai mensintesis molekul DNA baru yang dimulai dari ujung 3’ sampai ujung 5’ masing-masing primer. Sintesa molekul DNA baru ini terjadi pada suhu 72oC. Proses
ini disebut proses pemanjangan DNA (ekstensi) (Muladno 2002). Proses PCR berlangsung dalam beberapa siklus. Kisaran siklus optimum dalam proses PCR adalah 30-40 siklus, bergantung pada enzim polimerase, jumlah cetakan, dan sebagainya.
Teknik PCR dapat digunakan untuk analisis maupun untuk sintesis nukleotida. Salah satu kegunaan PCR adalah untuk identifikasi suatu gen atau DNA yang spesifik. Identifikasi keberadaan suatu gen dapat dilakukan dengan mudah bila daerah pengapit (flanking region) telah diketahui. Daerah pengapit yang spesifik ini digunakan sebagai primer. Penggunaan PCR untuk identifikasi adanya suatu pathogen penyebab suatu penyakit telah banyak dilakukan, seperti hepatitis B, TBC, AIDS, atau kelainan lainnya. Perbanyakan gen untuk berbagai keperluan, pengurutan DNA, ataupun kajian keragaman molekuler dapat pula dilakukan dengan PCR (Suharsono 2000).
6
BAHAN DAN METODE
Bahan dan Alat
Proses amplifikasi menggunakan kit dari Fermentas yang memerlukan bahan-bahan seperti primer GTW PIN F, primer GTW PINR, primer M13 F, primer M13 R,
TcPINEkspresi F, primer TcPINEkspresi R,
buffer complete, dNTPs, Taq polimerase, dan molecular water (MW). Berbagai bahan yang digunakan dalam elektroforesis yaitu gel agarosa, bufer Tris-Borate-EDTA(TBE) 0.5x, Etidium bromida (EtBr) 5 µg/100mL,
loading bufer (Bromfenol biru 2.5%, sukrosa 40%), dan marker 1 kb plus DNA
ladder (Invitrogen). Tahap transformasi dibutuhkan bahan-bahan seperti sel kompeten E.coli XL-1 Blue, media Luria Agar (LA) selektif yang telah ditambahkan Kanamisin 50ppm dan rifampisin 50 ppm, media Luria Bertani (LB) cair, berbagai vektor Gateway, dan proteinase-K. Ekstraksi dan purifikasi fragmen DNA menggunakan kit dari Qiagen. Bahan isolasi plasmid menggunakan kit dari Fermentas.
Alat yang digunakan untuk elektroforesis adalah sisir dan cetakan agar, bak elektroforesis, mikropipet, tabung mikro, microwave, adaptor 100 Volt, transluminator ultraviolet (UV) T2201. Selain itu alat lain yang digunakan adalah mesin PCR, DNA speed vacuum110 savant, inkubator bergoyang (shacker incubator),
laminar air flow cabinet, autoklaf, eppendorf sentrifus 5417R, neraca analitik, dan peralatan-peralatan gelas seperti cawan petri, gelas piala, labu Erlenmeyer, dan gelas ukur.
Metode
Amplifikasi Gen PIN dengan Primer Gateway
Amplifikasi gen PIN menggunakan primer Gateway. Proses amplifikasi dimulai dengan memasukkan ke dalam tabung mikro 18 µL molecular water (MW), 2.5 µL buffer complete, 1 µL dNTPs, 1µL DNA plasmid, 1 µL forward primer atau primer GTW PIN-F, 1 µL reverse primer atau primer GTW PIN-R, dan 0.5 µL Taq
polimerase. Gen PIN diamplifikasi dengan mesin PCR selama ± 3 jam sebanyak 35 siklus dengan program PCR: predenaturasi pada suhu 940C selama 7 menit, denaturasi
pada suhu 940C selama 45 detik,
penempelan primer (annealing) dilakukan secara gradien pada suhu 500C, 55oC, dan
60oC selama 45 detik, pemanjangan primer
(extension) pada suhu 720C selama 2 menit,
dan pasca pemanjangan pada suhu 720C
selama 5 menit.
Hasil PCR diverifikasi pada gel agarosa 1%. Sebanyak 5 µL hasil PCR dilarutkan dengan 1 µL loading buffer dan dimasukkan ke dalam sumur yang terbentuk dalam gel. Gel diletakkan dalam bak elektroforesis yang telah diisi dengan bufer TBE 0,5x. lalu dihubungkan dengan adaptor dengan potensial listrik sebesar 75 volt. Setelah selesai, gel diletakkan di bawah sinar UV (perangkat gel doc) untuk melihat ada tidaknya pita yang terbentuk. Tujuannya adalah untuk memastikan bahwa fragmen gen yang didapat sesuai dengan perkiraan ukuran produk yang dilakukan pada proses rancang primer.
Ekstraksi dan Purifikasi Fragmen Gen
PIN (QIAquick Gel Extraction Kit)
Gel agarosa dipotong, kemudian ditambahkan 3x volume bufer QG. Inkubasi 10 menit pada 50oC, dikocok setiap 2-3 menit. Setelah semua potongan gel larut, larutan dipindahkan ke dalam spin kolom dan disentrifugasi selama 1 menit pada 12000 rpm, suhu ruang. Supernatan dibuang dan ditambahkan 0,5 mL bufer QG dan disentrifugasi selama 1 menit pada 12000 rpm, suhu ruang. Supernatan dibuang dan spin kolom disentrifugasi dalam keadaan kosong selama 1 menit pada 12000 rpm, suhu ruang. Kolom dipindahkan ke dalam 1,5 mL tabung eppendorf. Selanjutnya ditambahkan 30 µL bufer elusi, diinkubasi selama 2 menit dan kemudian disentrifugasi 2 menit pada 12000 rpm, suhu ruang. Hasilnya diverifikasi pada gel agarosa 1 %.
Rekombinasi GenPINpada Vektor Entri dan Vektor Destinasi
Rekombinasi gen PIN pada vektor Entri dimulai dengan menyiapkan sebanyak 1,0 µL (150 ng) hasil elusi, 1,0 µL (150 ng/µL) vektor Entri (pDONR 221) kemudian ditambahkan 6,0 µL bufer TE pH 8,0. Setelah itu, ditambahkan sebanyak 2 µL BP ClonaseTM II dan diinkubasi selama 2 jam pada suhu 250C. Setelah inkubasi selesai larutan ditambahkan sebanyak 1 µL Proteinase-K dan diinkubasi lagi pada suhu 370C selama 15 menit. Hasil rekombinasi
gen PIN pada vektor Entri kemudian ditransformasikan ke Escherichia coli.
Sebanyak 1,0 µL (150 ng) hasil rekombinasi pada vektor Entri dimasukkan
7
ke dalam tabung mikro kemudian ditambahkan 150 ng vektor Destinasi. Setelah itu ditambahkan bufer TE hingga volume larutan mencapai 8 µL. Ke dalam tabung mikro ditambahkan sebanyak 2 µL
LR ClonaseTMII kemudian diinkubasi pada
suhu 250C selama 2 jam. Setelah inkubasi,
larutan kemudian ditambahkan 1 µL proteinase-K yang selanjutnya diinkubasi kembali pada suhu 370C selama 15 menit.
Hasil rekombinasi pada vektor Destinasi kemudian ditransformasikan ke dalam
Escherichia coli(E. coli).
Transformasi Gen PIN ke Escherichia coli
Sebanyak 5 µL hasil rekombinasi ditransformasikan ke dalam 200 µL sel kompeten E. coli XL-1 Blue atau E.coli DH5α secara perlahan dikocok perlahan hingga tercampur rata kemudian diinkubasi di dalam es selama 30 menit. Larutan hasil rekombinasi dan sel kompeten diberi kejut panas (heat shock) pada suhu 420C selama
50 detik yang selanjutnya segera dimasukkan ke dalam es selama 10 menit. Larutan hasil rekombinasi dan kompeten sel ditambahkan 800 µL Luria Bertani (LB) + glukosa 20 mM kemudian diinkubasi ke dalam inkubator bergoyang (shacker incubator) selama ± 1.5 jam pada suhu 37oC
dengan kecepatan 200 rpm. Setelah dikocok dengan inkubator bergoyang, sebanyak 100 µL larutan diratakan dengan segitiga penyebar di atas permukaan media LA yang terdiri atas tripton 10 g/L, yeast extract 5 g/L, NaCl 5 g/L dan bakto agar 15 g/L yang ditambahkan 50 µg/mL kanamisin. Sebanyak 900 µL larutan sisa disentrifugasi pada 3500 rpm selama 5 menit pada suhu 25oC. Supernatan dibuang ± 800 µL sedangkan sisa supernatan ± 100 µL dan pelet diresuspensi kemudian diratakan di atas permukaan media LA + kanamisin. Media diinkubasi dalam kondisi 370C
selama 16-20 jam kemudian dilihat koloni yang tumbuh.
Seleksi transforman dilakukan dengan pengamatan terhadap koloni yang terbentuk. Koloni yang terbentuk adalah selE.coliyang berhasil ditransformasi, sedangkan yang tidak berhasil ditransformasi akan mati akibat penambahan antibiotik kanamisin. Koloni yang terbentuk pada cawan petri menunjukkan sel yang mengandung plasmid yang berhasil disisipi. Setiap koloni yang terbentuk diberi nomor dan ditandai. Koloni yang terbentuk kemudian dengan tusuk gigi
steril diambil sedikit untuk PCR koloni dan sedikit dipindahkan ke medium LB padat dalam cawan petri (duplikat koloni).
Konfirmasi Koloni Transforman yang Membawa Fragmen Sisipan Gen PIN
Koloni bakteri yang tumbuh dari hasil rekombinasi dianalisis dengan metode PCR. Koloni yang tumbuh dipindahkan ke media padat yang baru untuk dibuat duplikatnya sehingga koloni yang benar-benar positif (membawa fragmen gen sisipan) tidak hilang. Apabila tidak diduplikasi kemungkinan koloni akan mengalami kontaminasi dengan koloni negatif dan terjadi pertumbuhan yang bertumpuk. Koloni diambil dengan menggunakan tusuk gigi steril dan dipindahkan ke dalam tabung eppendorf yang telah berisi 10 µL MW.. Pemindahan koloni dilakukan secara steril dalam laminar air flow cabinet. Persiapan PCR koloni dengan komponen mix yang terdiri atas 2, 75 µLmolecular water(MW), 1,5 µLbuffer complete, 0,3 µL dNTPs, 0,15 µL primer, dan 0,15 µL Taq polimerase. Primer untuk konfirmasi hasil rekombinasi pada vektor entri menggunakan primer M13 F dan M13 R. Sedangkan primer untuk konfirmasi hasil rekombinasi pada vektor destinasi menggunakan primer Tc PIN
Ekspresi-F dan Tc PINEkspresi-R.
Tahap pertama dilakukan PCR untuk melisiskan dinding sel dengan program lisis 960C selama 5 menit, 500C selama 1 menit 30 detik, 960C selama 1 menit 30 detik, 450C
selama 1 menit 30 detik, 960C selama 1
menit, 400C selama 1 menit. Program dihentikan sejenak untuk penambahan sebanyak 5 µL komponen mix ke dalam masing-masing tabung. Kemudian program PCR dilanjutkan kembali dengan program PCR yakni, 940C selama 30 detik, 550C
selama 1 menit, 720C selama 2 menit.
Setelah perbanyakan koloni transforman dengan teknik PCR selesai, sebanyak 15 µL hasil PCR koloni dan 3 µL loading buffer
dielektroforesis bersama 0,8 µL marker 1 kb plus DNA ladder pada gel agarosa 1 % untuk mengetahui hasilnya.
Isolasi DNA Plasmid (Kit Fermentas)
Isolasi DNA plasmid dilakukan berdasarkan hasil PCR DNA koloni yang diketahui mengandung plasmid terinsersi fragmen yang diinginkan. Koloni tersebut dikulturkan dalam media Luria Bertani (LB) yang mengandung kanamisin kemudian diinkubasi selama 16 jam pada suhu 37oC,
8
150 rpm. Kultur bakteri yang telah tumbuh kemudian dibuat pelet dengan disentrifugasi selama 3 menit pada 8000 rpm, suhu ruang. Supernatan dibuang dan pelet ditambahkan 250 µL larutan resuspensi dan divortex. Larutan lisis ditambahkan sebanyak 250 µL, kemudian tabung dibolak-balik 4-6 kali. Sebanyak 350 µL neutralization solution
ditambahkan dan tabung dibolak-balik 4-6 kali. Selanjutnya disentrifugasi 5 menit pada 12000 rpm, suhu ruang.
Supernatan dipindahkan ke spin kolom dan disentrifugasi 1 menit pada 12000 rpm, suhu ruang. Supernatan dibuang dan ditambahkan 500 µL wash solution, disentrifugasi 30-60 detik pada 12000 rpm, suhu ruang. Hal ini dilakukan sebanyak 2 kali. Kemudian tabung spin kolom disentrifugasi dalam keadaan kosong selama 1 menit pada 12000 rpm, suhu ruang. Kolom dipindahkan pada tabung eppendorf 1,5 mL. Bufer elusi sebanyak 30 µL ditambahkan , diinkubasi 2 menit, dan disentrifugasi selama 2 menit pada 12000 rpm, suhu ruang. Hasil DNA plasmid dikumpulkan dalam tabung eppendorf 1,5 mL.
Transformasi Gen PIN ke Agrobacterium tumefaciens Strain AGL-0
Setelah hasil elektroforesis pada agarosa sesuai dengan yang diharapkan sehingga gen PIN sudah masuk ke dalam vektor Destinasi, tahap selanjunya akan ditransformasikan ke dalam Agrobacterium. Transformasi gen PIN ke Agrobacterium
dilakukan dengan cara sebanyak 5-10 μL DNA plasmid dimasukkan ke dalam 500 μL sel kompeten, didiamkan di dalam es selama 15 menit. Setelah itu, diinkubasi di dalam es, diinkubasi kembali selama 5 menit di dalam nitrogen cair dan setelahnya 5 menit pada suhu 37oC. Kemudian sebanyak 1 mL YEP
(Yeast Extract Pepton) ditambahkan kedalamnya dan dikocok selama 3 jam pada 200 rpm, suhu 28oC. Setelah dikocok,
larutan tersebut disentrifugasi dengan kecepatan 6000 rpm selama 3 menit.
Supernatan yang dihasilkan sebagian dibuang dan sebanyak 200 μL supernatan yang tersisa diresuspensikan dengan pelet yang terbentuk lalu dituang ke dalam cawan petri (plate). Setelah itu sebanyak 200 μL larutan tersebut dipipet dan dimasukkan ke dalam media LA yang telah berisi antibiotik kanamisin 25 ppm dan rifampisin 50 ppm. Inkubasi selama 2 hari pada suhu 28oC
dalam kondisi gelap.
Setelah diinkubasi selama 2 hari, hasilnya adalah terbentuknya koloni berwarna putih. Koloni yang terbentuk kemudian diambil dengan tusuk gigi steril dan diberi nomor lalu dimasukkan ke dalam media agar untuk dibuat duplikatnya dan dikulturkan dalam media LB yang mengandung kanamisin 25 ppm dan rifampisin 50 ppm. Selanjutnya dikocok selama 2 malam dengan kecepatan 200 rpm dan dilakukan isolasi DNA plasmid. Tahap selanjutnya dari penelitian ini akan dilanjutkan oleh peneliti yang lain. Hasil transformasi yang didapatkan akan ditransformasikan melalui Agrobacteriumke eksplan tanaman kakao.
HASIL DAN PEMBAHASAN
Penelitian ini merupakan lanjutan dari penelitian sebelumnya yang telah melakukan isolasi gen PIN dari kulit buah kakao dan mengkloningnya dengan cara biasa (Isda et al. 2008). Melalui kloning cara biasa, gen
PIN belum berhasil disisipkan pada vektor ekspresi. Ketidakberhasilan ini disebabkan oleh tidak adanya enzim restriksi pada vektor pGEM-T yang sesuai dengan enzim restriksi yang ada pada vektor ekspresi untuk memotong gen PIN sehingga dapat disisipkan pada vektor ekspresi. Oleh karena itu, pada penelitian ini dilakukan kembali kloning gen PINdari kulit buah kakao pada vektor ekspresi dengan metode Gateway.
Keuntungan dari metode Gateway adalah kloning berlangsung cepat dengan efisiensi yang tinggi dalam mentransfer sekuen DNA ke berbagai sistem vektor selama ekspresi protein dan analisis protein. Metode Gateway memungkinkan penggunaan dan ekspresi berbagai tipe DNA sekuen (misalnya hasil PCR, klon cDNA, fragmen restriksi). Metode Gateway memudahkan akomodasi transfer sejumlah besar sekuen DNA ke dalam berbagai vektor destinasi. Keuntungan lain metode Gateway, yaitu memudahkan konversi vektor yang diinginkan ke dalam vektor destinasi Gateway (Invitrogen 2003).
Kloning dengan cara biasa memiliki beberapa kelemahan. Hasil verifikasi pada gel agarosa tidak jelas karena terdapat beberapa pita. Kesalahan pengambilan dapat menyebabkan hasil yang didapat tidak sesuai dengan yang diharapkan. Enzim restriksi yang digunakan tidak ada yang cocok sehingga harus dilakukan sekuensing terlebih dahulu untuk mengetahui pemetaan
9
enzim restriksi dengan desain primer yang mengandung enzim restriksi yang sesuai.
Tahapan kloning dengan metode Gateway meliputi desain primer Gateway, amplifikasi gen PIN dengan primer Gateway, rekombinasi gen PIN pada vektor Entri dan vektor Destinasi, transformasi pada Escherichia coli (E.coli) XL-1 Blue, konfirmasi gen PIN pada vektor Entri dan vektor Destinasi, dan transformasi gen PIN
pada E.colike Agrobacterium tumefaciens. Desain yang benar dari primer attB untuk amplifikasi, pengklonan, dan ekspresi gen dalam Gateway membutuhkan pertimbangan penempatan yang tepat dari unsur ekspresi protein (pengenalan sekuens ribosom, start kodon, stop kodon, reading frame consideration) ke situs rekombinasi. Posisi yang tepat dari unsur ekspresi ditentukan oleh bentuk dari protein (native, N-terminal fusion, C-terminal fusion) (Heo 2003). Kriteria lainnya dalam merancang suatu primer antara lain ukuran primer sekitar 17-28 bp dan kandungan G+C sekitar 50-60%. Secara umum, primer Gateway yang digunakan dalam penelitian telah mempertimbangkan semua unsur yang telah disebutkan sebelumnya.
Hasil sekuen primer yang telah didesain untuk primer Gateway PIN forward dengan arah sekuen dari 5’ ke 3’ adalah GGGG CC AAC TTT GTA CAA
AAA AGC AGG CTATG CTT CGC GTT
AAC AAC TT. Sedangkan, untuk primer Gateway PIN reverse dengan arah sekuen dari 5’ ke 3’, yaitu GGGG CC AAC TTT
GTA CAA GAA AGC TGG GT TAT
AGA ATA CTC AAG CTA TG. Sekuen primer reverse telah dikomplemen terlebih dahulu. Sekuen yang digarisbawahi merupakan situs attyang akan mengarahkan gen saat proses amplifikasi sehingga arah penempelan primer akan benar, sedangkan sekuen yang tidak digarisbawahi merupakan bagian dari gen PIN itu sendiri. Sekuen GGGG pada situs att adalah untuk efisiensi saat amplifikasi gen agar primer dapat melekat kuat pada gen target.
Amplifikasi Gen PIN dengan Primer Gateway
Amplifikasi fragmen gen PIN
dilakukan dengan proses PCR menggunakan primer Gateway yang telah dirancang sebelumnya dengan suhu annealing 50oC,
55oC, dan 60oC. PCR dengan suhu annealing yang berbeda dilakukan agar dapat dihasilkan ekspresi gen pada suhu
yang sesuai. Hasil amplifikasi fragmen gen
PIN ditunjukkan pada Gambar 5. Berdasarkan hasil yang didapat, terlihat bahwa pada semua sumur terdapat pita yang cukup tebal. Hal ini berarti bahwa gen PIN
terekspresi dengan baik pada suhu annealing
50oC, 55oC, dan 60oC. Dengan didapatnya
hasil ini maka tahap selanjutnya dapat diteruskan.
Penentuan suhu annealing dapat diperkirakan dari nilai melting temperature
(Tm), yaitu sebesar 5oC di bawah nilai Tm (Rybicki 2001). Meskipun demikian, suhu
annealing yang tepat biasanya didapatkan secara empiris (Darmawan 2004). Hasil isolasi yang berupa pita tunggal menunjukkan bahwa spesifitas primer dan suhu penempelannya sudah cukup baik. Apabila suhu penempelan yang digunakan terlalu rendah, maka primer tidak hanya menempel pada target tetapi juga pada bagian gen yang lain. Suhu penempelan yang terlampau tinggi akan menghasilkan produk yang sedikit karena kecenderungan primer untuk menempel pada target menjadi berkurang. Oleh karena itu, optimasi suhu penempelan perlu dilakukan untuk menghindari bias hasil dari proses PCR (Ishii & Fukui 2001).
1 2 3 M 850 bp
Gambar 5 Hasil amplifikasi PCR dengan primer Gateway padaannealing
50oC, 55oC, dan 60oC (1,2,3)
dan marker (M).
Ekstraksi dan Purifikasi Fragmen Gen
PIN
Fragmen hasil amplifikasi yang diverifikasi pada gel agarosa (Gambar 5), dipotong dari gel dan dimurnikan untuk digunakan pada tahap kloning metode Gateway selanjutnya. Gen dimurnikan terlebih dahulu untuk menghilangkan komponen-komponen yang dapat menghambat proses kloning. Hasil pemurnian gen PIN ditunjukkan pada Gambar 6. Berdasarkan hasil yang didapat, terlihat pita tunggal dengan ukuran yang sesuai dengan pita marka 850 bp. Marka
10
DNA yang digunakan adalah 1 kb plus DNA
ladder. bp 1000 850 850 bp 650 400 200 100 M PIN
Gambar 6 Pemurnian produk PCR gen PIN. (M) marker 1 kb plus DNA ladderdan gen PIN.
Rekombinasi GenPINpada Vektor Entri
Hasil elusi yang telah dimurnikan kemudian direkombinasikan pada vektor Entri. Pada tahap ini, terjadi reaksi antara
attB yaitu sisi fragmen DNA dan attP yaitu sisi yang mengandung donor vektor yang akan dijadikan klon entri. Rekombinasi gen
PINpada vektor entri dibantu oleh enzim BP ClonaseTM yang akan aktif pada suhu
optimum 25oC sehingga reaksi ini
dinamakan Reaksi BP. Hasil rekombinasi kemudian ditransformasikan ke dalam sel kompeten E. coliXL-1 Blue.
Transformasi dilakukan dengan pemberian kejut panas (heat shock) pada suhu 42oC selama 50 detik. Prinsip utama
dari proses tersebut adalah terjadi lonjakan suhu dari 0oC ke 42oC terhadap sel yang telah diberi perlakuan dengan CaCl2. Garam
CaCl2 akan mempengaruhi struktur dan
muatan dari membran sel. Oleh karena itu, pada saat terjadi lonjakan suhu membran menjadi tidak selektif terhadap molekul asing sehingga hasil rekombinasi dapat masuk ke dalam sel (Tarigan 2008). Sel kemudian dikultur dalam media tumbuh (LB + glukosa) selama 1,5 jam untuk memperbanyak jumlah sel. Setelah itu, sel disebar pada media LA yang mengandung antibiotik dan diinkubasi semalaman pada suhu 37oC. Suhu ini merupakan suhu
optimum bagi bakteri E. coli tumbuh yang sama dengan suhu tubuh manusia, tempat asal bakteri tersebut.
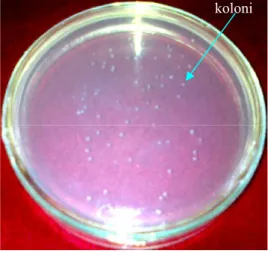
Koloni putih akan tumbuh pada permukaan media agar dalam cawan petri dan merupakan koloni yang membawa fragmen gen sisipan (Gambar 7). Fragmen gen sisipan yang terdapat pada plasmid akan menghambat sintesis α-peptida yang berperan sebagai aktivator terhadap kerja enzim β-galaktosidase (Reece 2004).
Penyisipan fragmen DNA ke Multiple Cloning Site (MCS) akan merusak susunan basa gen Lac Z’ sehingga ekspresi gen yang menghasilkan enzim fungsional tidak terjadi. Hal ini mengakibatkan koloni menjadi berwarna putih (Novianthy 2009).
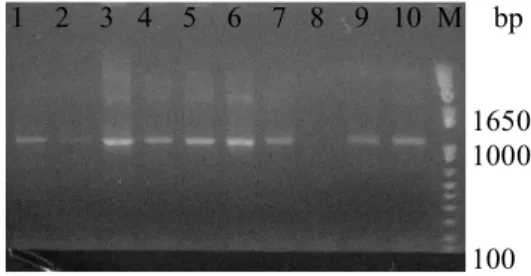
Koloni yang berwarna putih kemudian dengan tusuk gigi steril diambil sedikit untuk PCR koloni. Tujuan utama dari PCR koloni adalah untuk mengkonfirmasi koloni transforman yang membawa fragmen gen sisipan (Nurhaimi 2006). Hasil dari PCR koloni disajikan pada Gambar 8 yang menunjukkan bahwa koloni nomor 3, 5, dan 6 merupakan koloni positif dengan terang pita maksimum. Koloni tersebut selanjutnya dikultur dalam media LB cair + ampisilin 100 ppm selama semalam pada suhu 37oC.
Selanjutnya, dilakukan isolasi DNA plasmid dari setiap kultur yang diperoleh menggunakan GeneJETTMPlasmid Miniprep Kit (Fermentas). Hasil isolasi plasmid diverifikasi pada gel agarosa 1 %.
koloni
Gambar 7 Duplikat koloni hasil rekombinasi gen PINpada vektor Entri. 1 2 3 4 5 6 7 8 9 10 M bp
1650 1000 100 Gambar 8 Hasil PCR koloni rekombinasi
gen PINpada vektor Entri. (M) marker 1 kb plus DNA
ladder, (No. 1-10) nomor koloni yang digunakan sebagai cetakan.
11
Rekombinasi Gen PIN pada Vektor
Destinasi
Hasil isolasi plasmid dari proses rekombinasi pada vektor Entri kemudian direkombinasikan pada vektor Destinasi. Rekombinasi pada tahap ini merupakan tahap penyisipan fragmen gen PIN dari vektor Entri ke dalam vektor Destinasi. Tahap ini akan memfasilitasi rekombinasi subtrat attL (klon entri) dengan subtrat attR (vektor destinasi) untuk membuat klon ekspresi yang mengandung attB. Reaksi ini dibantu oleh enzim LR ClonaseTMyang akan
aktif pada suhu optimum 25oC sehingga
reaksi ini dinamakan Reaksi LR. Hasil rekombinasi kemudian ditransformasikan ke dalam sel kompeten E. coliXL-1 Blue.
Transformasi merupakan proses memasukkan DNA asing, biasanya plasmid, ke dalam suatu organisme. Transformasi ke sel bakteri biasanya dilakukan dengan perlakuan Ca2+ sehingga membuat bakteri
tersebut kompeten untuk dimasuki DNA plasmid (Turner et al. 2000). Transformasi ke E. coli dilakukan untuk memperbanyak jumlah DNA plasmid rekombinan. Sel kemudian disebarkan di atas medium LA agar yang telah ditambahkan dengan kanamisin 25 ppm. Setelah itu diinkubasi semalam pada suhu 37oC.
Hasil transformasi berupa koloni berwarna putih yang mengandung plasmid rekombinan (Gambar 9). Koloni yang terbentuk diduplikat dan dikultur untuk memperbanyak jumlah plasmid rekombinan. Selanjutnya koloni hasil duplikat yang terbentuk kemudian diambil dengan menggunakan tusuk gigi untuk PCR koloni.
Hasil perbanyakan koloni transforman dengan teknik PCR kemudian dielektroforesis dengan gel agarosa 1%. Gambar 10 yang menunjukkan bahwa koloni nomor 5 dan 7 merupakan koloni positif dengan terang pita maksimum. Koloni nomor 5 dan 7 selanjutnya dikultur semalam dan dilakukan isolasi DNA plasmid. Hasil isolasi DNA plasmid dielektroforesis pada gel agarosa sehingga pita-pita DNA yang berbeda ukurannya dapat terpisah. Elektroforesis DNA plasmid yng mengandung sisipan gen PINdisajikan pada Gambar 11.
Isolasi DNA plasmid pada penelitian ini menggunakan GeneJETTM Plasmid Miniprep Kit (Fermentas). Isolasi DNA plasmid dengan menggunakan kit ini pada prinsipnya sama dengan pemisahan plasmid
berdasarkan ukurannya dimulai dengan pembuatan ekstrak sel. Jika sel dipecah secara perlahan pada kondisi terkendali, maka hanya sebagian kecil DNA kromosom yang putus.
koloni
Gambar 9 Contoh transformasi koloni gen
PIN dengan vektor Destinasi ke dalam sel kompeten (E. coli
XL-1 Blue).
1 2 3 4 5 6 7 8 9 M
300bp Gambar 10 Hasil PCR koloni rekombinasi
gen PIN pada vektor Destinasi. (M) marker 1 kb plus DNA ladder, (No. 1-9) nomor koloni yang digunakan sebagai cetakan.
1 2 M
2000 bp
Gambar 11 Hasil elektroforesis isolasi DNA plasmid gen PIN dengan vektor Destinasi atau vektor Ekspresi. (M) marker 1 kb plus DNA ladder, (1,2) DNA plasmid yang mengandung gen PIN.
12
Fragmen DNA kromosom yang berukuran jauh lebih besar dari ukuran plasmid dapat dipisahkan dari plasmid dengan cara mengendapkan DNA kromosom bersama serpihan melalui sentrifugasi. Cara ini dapat meminimalkan kerusakan DNA kromosom dan selanjutnya dari proses sentrifugasi akan menghasilkan larutan jernih yang mengandung DNA yang hampir seluruhnya berupa DNA plasmid.
Prinsip dari elektroforesis gel agarosa, yaitu dapat memisahkan DNA linear berdasarkan perbedaan ukuran melalui migrasi DNA pada sebuah matriks dalam pengaruh medan listrik karena setiap nukleotida dalam sebuah molekul asam nukleat membawa sebuah muatan negatif. Elektroforesis juga bisa digunakan untuk mendeterminasi organisasi molekul plasmid (Turner et al. 2000). Jika gel ditempatkan dalam tangki elektroforesis yang mengandung larutan bufer dan tangki tersebut dialiri arus listrik, maka molekul DNA yang bermuatan negatif pada pH netral akan bergerak ke arah positif (anoda). Kecepatan migrasi DNA dapat ditentukan oleh beberapa faktor, diantaranya ukuran molekul DNA, konsentrasi agarosa, konformasi DNA, voltase yang digunakan, adanya etidium bromida di dalam gel dan komposisi larutan bufer (Muladno 2002). Etidium bromida merupakan senyawa polisiklik aromatik bermuatan positif yang akan berikatan dengan DNA yang bermuatan negatif dengan menginsersikan dirinya diantara pasangan basa (interkalasi). Interkalasi menyebabkan DNA heliks melonggar sekitar 26oC (Turner et al. 2000).
Transformasi Gen PIN ke Agrobacterium tumefaciens Strain AGL-0
Hasil isolasi DNA plasmid yang mengandung gen PIN dengan vektor ekspresi selanjutnya akan ditransformasikan ke dalam Agrobacterium tumefaciens
dengan menggunakan sel kompeten kimia strain AGL-0. Transformasi gen PIN ke dalam Agrobacterium tumefaciensdilakukan dengan pemberian kejut panas (heat shock). Prinsip utama dari proses tersebut adalah terjadi lonjakan suhu dari 0oC ke 37oC
terhadap sel. Pada saat terjadi lonjakan suhu tersebut membran menjadi tidak selektif terhadap molekul asing dan produk dapat masuk ke dalam sel.
Sel yang telah ditransformasi selanjutnya diinkubasikan dalam medium
yeast ekstrak pepton (YEP) dan dikocok
selama 3 jam dengan kecepatan 200 rpm pada suhu 28oC. Pengocokan ini berfungsi
memberikan kesempatan bagi sel untuk mengekspresikan gen marka pada plasmid. Setelah itu, sel disebar dalam medium selektif yang telah ditambahkan dengan kanamisin 25 ppm dan rifampisin 50 ppm.
Antibiotik yang digunakan dalam transformasi ke dalam Agrobacterium ini adalah kanamisin dan rifampisin. Kedua antibiotik ini digunakan karena karena plasmid vektor destinasi membawa marka seleksi berupa gen resistensi terhadap antibiotik kanamisin sedangkan antibiotik rifampisin digunakan dalam transformasi melalui Agrobacterium ini berfungsi untuk membunuh E. coliagar plasmid rekombinan yang terdapat di dalam E. coli dapat dimasukkan ke dalam Agrobacterium. Sel yang mengalami transformasi (membawa plasmid vektor destinasi) bersifat resisten terhadap kanamisin maupun rifampisin, sedangkan sel yang tidak mengalami transformasi akan sensitif terhadap kedua antibiotik tersebut. Seleksi transforman dapat dilakukan dengan cara menumbuhkan sel yang ditransformasi dalam medium yang mengandung rifampisin dan kanamisin. Sel transforman akan tumbuh dan membentuk koloni, sedangkan sel yang bukan transforman akan mati.
Setelah disebar dalam medium selektif, sel transforman yang mengandung gen PIN
diinkubasi selama 2 hari dalam kondisi gelap. Hal ini bertujuan menyamakan kondisi tempat tinggal Agrobacterium yang hidup di dalam tanah yaitu dalam keadaan gelap. Sehingga sel transforman dapat bertahan hidup saat ditumbuhkan dalam medium selektif.
Koloni positif, koloni transforman yang berhasil ditumbuhkan, kemudian dikultur dalam media yang telah ditambahkan antibiotik. Selanjutnya, dilakukan isolasi DNA plasmid dari setiap kultur yang diperoleh. Konfirmasi kebenaran transformasi gen PIN ke dalam vektor ekspresi melalui Agrobacterium ini, maka dilakukan PCR koloni terhadap koloni yang tumbuh. Hasil PCR koloni disajikan pada Gambar 12. Hasil PCR tersebut menunjukkan bahwa gen PINtelah berhasil ditransformasikan ke dalam Agrobacterium tumefaciensstrain AGL-0.
Hasil transformasi plasmid vektor Destinasi yang mengandung gen PIN
selanjutnya akan ditransfer pada tanaman kakao melalui sistem Agrobacterium
13
tumefaciens. Dengan demikian, kloning gen
PIN pada vektor ekspresi (vektor Destinasi) dengan metode Gateway dapat dimanfaatkan untuk menanggulangi penyakit yang diakibatkan penggerek buah kakao (PBK). Sehingga dengan orientasi kloning gen ini,, gen-gen yang akan disisipkan diharapkan dapat diekspresikan secara terus-menerus sepanjang hidup tanaman kakao terutama pada bagian buah kakao.
Proses kloning gen dapat dilakukan dengan mudah dan cepat dengan metode Gateway. Pada metode kloning biasa, terdapat tahap ligasi, sekuensing untuk mengetahui enzim restriksi yang terdapat dalam vektor dan pemotongan oleh enzim restriksi. Setelah proses kloning selesai hingga seleksi transforman, kemudian dilakukan konfirmasi dengan melakukan pemotongan kembali oleh enzim restriksi yang sama. Hal ini memerlukan waktu yang lama dan arah proses ligasi bisa salah karena arah proses kloning biasa belum tentu. Pada kloning menggunakan metode Gateway hal itu tidak akan terjadi. Metode Gateway memiliki arah yang jelas karena adanya situs
att yang akan mengarahkan gen dengan benar.
300 bp
300 bp
1 2 M
Gambar 12 Hasil PCR koloni transformasi gen PIN dengan vektor Destinasi ke dalam
Agrobacterium tumefaciens
strain AGL-0. (M) marker 1 kb plus DNA ladder, (No. 1-2) nomor koloni yang digunakan sebagai cetakan.
SIMPULAN DAN SARAN
Simpulan
Kloning gen proteinase inhibitor (PIN)
yang berukuran 850 bp telah berhasil disisipkan ke dalam vektor ekspresi dengan metode Gateway. Metode Gateway dapat digunakan untuk mengkloning gen dengan mudah dan cepat. Transformasi DNA rekombinan yang mengandung gen PIN ke
dalam Agrobacterium tumefaciens telah berhasil dilakukan dengan menggunakan sel kompeten kimia strain AGL-0 dengan prinsip kejut panas (heat shock) yang dapat dilihat keberhasilannya dari hasil PCR koloni dengan ukuran 300 bp.
Saran
DNA rekombinan yang telah berhasil ditransformasikan ke dalam sel
Agrobacterium tumefaciens strain AGL-0 sebaiknya dilanjutkan dengan mengintegrasikan ke dalam sel tanaman. Penelitian lanjutan perlu dilakukan untuk mengetahui peran dan fungsi gen PIN pada buah dan biji tanaman kakao terhadap serangan hama serangga.
DAFTAR PUSTAKA
Chaidamsari T. 2005. Biotechnology for Cacao Pod Borer Resistance in Cacao. Plant Research International. The Netherlands: Wagenigen University.
Darmawan N. 2004. Isolasi, kloning, dan sekuensing gen putatif enzim PQQ glukosa dehidrogenase dari
Agrobacterium tumefaciens
[skrpsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor. de Maagd R A, Bravo A, Crickmore N.
2001. How Bacillus thuringiensis has evolved specific toxins to colonize the insect world. Trends Genet.17:193-199.
Depparaba F. 2002. Penggerek buah kakao (Conopomorpha cramerella Snellen) dan penanggulangannya.
Jurnal Litbang Pertanian. 21:2. [Depperin] Departemen Perindustrian. 2007.
Gambaran Sekilas Industri Kakao. Jakarta: Depperin.
[Deptan] Departemen Pertanian. 2010. Pertemuan pemantapan agens hayati OPT tanaman semusim, rempah, dan penyegar. [terhubung berkala].
http://database.deptan.go.id/ditlinbu n/WebPages/Info_Terkini_Files/inf o_terkini.htm#toppage [15 Agu 2010]
14
Dubin MJ, Bowler C, Benvenuto G. 2008. A modified Gateway cloning strategy for overexpressing tagged proteins in plants. Plant methods4:1-11. Farieh Y. 2007. Isolasi dan uji ekspresi gen
proteinase inhibitor (PIN) dari buah kakao (Theobroma cacao L.) [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor. Fritz H. 2000. Foreword. In K. Von der
Helm et al. Protease as targets for therapy. Springer-Verlag. V-VI. Heo WD. 2003. Primer design for the
Gateway attB primers. [terhubung berkala].
http://www.stanford.edu/teruel1/Pr otocols/pdf/Primer design for the gateway system.pdf [3 Agustus 2010].
Invitrogen. 2003. Gateway® Technology. A universal technology to clone DNA sequences for functional analysis and expression in multiple systems. User Manual. Carlsbad: Invitrogen Corporation.
International Cocoa Organization (ICCO). 2003. Quarterly Bulletin of Cocoa Statistics. Vol: XXIX.
Isda MN, Kasim M, Mansyurdin, Chaidamsari T, Santoso D. 2008. Kloning dan karakterisasi gen penyandi inhibitor proteinase dari kulit buah kakao. Menara Perkebunan76:83-92.
Jaya AMS, Aswidinnoor H, Santoso D. 2004. Deteksi dan analisis sekuen gen inhibitor proteinase pada beberapa klon kakao harapan tahan penggerek buah kakao dari Sulawesi Selatan. Menara Perkebunan72:1-10.
Johnson R, Narvaez J, Ang, Ryan CA. 1989. Expression of proteinase inhibitors I and II in transgenic tobacco plant: effects on natural defense against man-duga sexta larvae. Proc. Natl. Acad. Sci. USA. 86: 9871-9875. Jusuf M. 2001. Genetika I Struktur dan
Ekspresi Gen. Jakarta : Sagung Seto.
Koiwa H, Bressan RA, Hasegawa PM. 1997. Regulation of protease inhibitors
and plant defense. Trends Plant Sci. 2: 379-384.
Konam J, Namaliu Y, Daniel R, Guest DI. 2009. Pengelolaan Hama dan Penyakit Terpadu untuk Produksi Kakao Berkelanjutan; Panduan Pelatihan untuk Petani dan Penyuluh. Canberra : Pusat Penelitian Internasional Australia (ACIAR).
Muladno. 2002. Seputar Teknologi Rekayasa Genetika. Bogor: Pustaka Wirausaha Muda.
Nasution H. 1999. Konstruksi plasmid rekombinan untuk menghasilkan padi tahan hama penggerek batang (steam borer) [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Newell CA, Lowe JM, Merryweather A, Rooke LM, Hamilton WDO. 1995. Transformation of sweet potato (Ipomea batatas Lam.) with
Agrobacterium tumifaciens and regeneration of plants expressing cowpea trypsin inhibitor and snowdrop lectin. Plant Sci.
107:215-227.
Novianthy D. 2009. Kontruksi gen Kitinase
untuk ketahanan terhadap
Ganoderma pada vektor ekspresi pCambia 1303 [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Nurhaimi. 2006. Ekspresi gen-gen responsif terhadap Corynespora cassiicola
pada tanaman karet (Hevea brasiliensisMuell. Arg.) [disertasi]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Park S, Thornburg RW. 1996. Loss of specific sequences in a natural variant of potato proteinase inhibitor II gene results in a loss of wound-inducible gene expression.
Agric. Chem. Biotech39:104-111. Reece RJ. 2004. Analyses of Genes and
Genomes. England: John Willey & Sons.