ABSTRAK
IBRAHIM FEBRIZKY. Konstruksi Gen Stilbena Sintase pada Vektor Ekspresi
dengan Metode Gateway dan Transformasi pada
Agrobacterium
sp. Dibimbing
oleh MARIA BINTANG dan TETTY CHAIDAMSARI.
ABSTRACT
IBRAHIM FEBRIZKY. Construction of Stilbene Synthase Gene in Expression
Vector using The Gateway Method and Transformation to
Agrobacterium
sp.
Under the direction of MARIA BINTANG and TETTY CHAIDAMSARI.
PENDAHULUAN
Bioteknologi merupakan suatu bidang ilmu dalam biologi terapan yang melibatkan penggunaan organisme hidup dan bioproses untuk menciptakan suatu produk demi kepentingan manusia. Bioteknologi modern, atau sering disebut juga rekayasa genetika, telah berkembang sangat pesat dalam dua dasawarsa terakhir ini. Teknik rekayasa genetika telah banyak diaplikasikan dalam berbagai bidang, misalnya penelitian, medis, rekayasa genetika hewan, dan rekayasa genetika tanaman (Smith 2004).
Rekayasa genetika tanaman adalah suatu teknik untuk memindahkan gen spesies asing ke dalam suatu sel tanaman, yang diikuti dengan regenerasi dari sel-sel tanaman tersebut sehingga menjadi tanaman lengkap. Teknik ini telah diterapkan pada berbagai tanaman pangan dan nonpangan. Rekayasa genetika sebenarnya merupakan kelanjutan dari pemuliaan tanaman yang telah dilakukan oleh petani secara tradisional. Rekayasa genetika memungkinkan pemindahan satu atau beberapa gen yang dikehendaki dari satu tanaman ke tanaman lainnya yang tidak mungkin terjadi dalam pemuliaan tanaman secara tradisional.
Prinsip rekayasa genetika sama dengan pemuliaan tanaman, yaitu memperbaiki sifat-sifat tanaman dengan menambahkan sifat-sifat-sifat-sifat ketahanan terhadap gangguan hama maupun lingkungan yang kurang menguntungkan. Proses rekayasa genetika telah berhasil mengembangkan berbagai spesies tanaman baru dengan ketahanan terhadap organisme pengganggu, seperti serangga, penyakit, dan gulma yang sangat merugikan tanaman (Winarno & Agustinah 2007). Contoh tanaman yang telah berhasil direkayasa adalah jagung, kapas, kedelai, tomat, dan kelapa sawit.
Kelapa sawit merupakan salah satu komoditas perkebunan yang sangat penting di Indonesia dan produksinya meningkat setiap tahun. Salah satu kendala yang cukup berarti dalam usaha peningkatan produksi kelapa sawit adalah penyakit busuk pangkal batang yang disebabkan oleh cendawan Ganoderma sp. Penyakit ini dapat merusak sangat banyak tanaman kelapa sawit dalam suatu area (PPKS 2009). Pengendalian terhadap penyakit ini telah dilakukan baik secara mekanis, kimiawi, maupun hayati (Lubis 1992), namun belum ada yang dapat dianggap efektif sehingga perlu dilakukan pengendalian yang tepat.
Pengendalian yang paling tepat dilakukan untuk masalah Ganoderma pada tanaman kelapa sawit adalah melalui pemuliaan tanaman dengan rekayasa genetika, yaitu untuk menemukan gen yang dapat membuat kelapa sawit tahan terhadap Ganoderma. Gen tersebut dapat berasal dari spesies kelapa sawit sendiri maupun dari spesies lain. Gen stilbena sintase (STS) yang berasal dari anggur (Vitis vinifera) merupakan gen penghasil senyawa yang berfungsi sebagai anti jamur (SIB 2007), sehingga dapat dilakukan upaya penyisipian gen STS ke dalam kelapa sawit agar dapat meningkatkan ketahanan terhadap Ganoderma.
Upaya konstruksi gen STS agar dapat disisipkan ke dalam kelapa sawit sebelumnya sudah pernah dilakukan dengan menggunakan metode pengklonan biasa dengan prosedur yang cukup rumit dan waktu yang cukup lama. Konstruksi gen pada penelitian ini menggunakan teknologi Gateway. Teknologi Gateway adalah suatu metode kloning universal yang berdasarkan rekombinasi situs spesifik pada bakteriofag lambda (Landy 1989). Teknologi Gateway memungkinkan pemindahan secara cepat dan efisien sekuen DNA ke dalam beberapa vektor untuk dilakukan analisis fungsional dan ekspresi protein (Hartley at al. 2000).
Penelitian ini bertujuan mengonstruksi gen STS pada vektor ekspresi dengan metode yang lebih cepat dan terarah, yaitu metode Gateway. Gen STS yang telah tersisipkan dalam vektor ekspresi selanjutnya ditransformasikan ke dalam Agrobacterium tumefaciens. Hipotesis penelitian ini adalah gen STS yang telah dikonstruksi pada vektor ekspresi dengan metode Gateway bisa disisipkan ke dalam Agrobacterium tumefaciens agar dapat diekspresikan pada tanaman. Hasil penelitian ini diharapkan dapat menghasilkan Agrobacterium tumefaciens yang memiliki gen STS, serta memberikan informasi mengenai metode Gateway sebagai teknologi rekombinasi gen yang cepat dan mudah.
TINJAUAN PUSTAKA
Stilbena Sintase
PENDAHULUAN
Bioteknologi merupakan suatu bidang ilmu dalam biologi terapan yang melibatkan penggunaan organisme hidup dan bioproses untuk menciptakan suatu produk demi kepentingan manusia. Bioteknologi modern, atau sering disebut juga rekayasa genetika, telah berkembang sangat pesat dalam dua dasawarsa terakhir ini. Teknik rekayasa genetika telah banyak diaplikasikan dalam berbagai bidang, misalnya penelitian, medis, rekayasa genetika hewan, dan rekayasa genetika tanaman (Smith 2004).
Rekayasa genetika tanaman adalah suatu teknik untuk memindahkan gen spesies asing ke dalam suatu sel tanaman, yang diikuti dengan regenerasi dari sel-sel tanaman tersebut sehingga menjadi tanaman lengkap. Teknik ini telah diterapkan pada berbagai tanaman pangan dan nonpangan. Rekayasa genetika sebenarnya merupakan kelanjutan dari pemuliaan tanaman yang telah dilakukan oleh petani secara tradisional. Rekayasa genetika memungkinkan pemindahan satu atau beberapa gen yang dikehendaki dari satu tanaman ke tanaman lainnya yang tidak mungkin terjadi dalam pemuliaan tanaman secara tradisional.
Prinsip rekayasa genetika sama dengan pemuliaan tanaman, yaitu memperbaiki sifat-sifat tanaman dengan menambahkan sifat-sifat-sifat-sifat ketahanan terhadap gangguan hama maupun lingkungan yang kurang menguntungkan. Proses rekayasa genetika telah berhasil mengembangkan berbagai spesies tanaman baru dengan ketahanan terhadap organisme pengganggu, seperti serangga, penyakit, dan gulma yang sangat merugikan tanaman (Winarno & Agustinah 2007). Contoh tanaman yang telah berhasil direkayasa adalah jagung, kapas, kedelai, tomat, dan kelapa sawit.
Kelapa sawit merupakan salah satu komoditas perkebunan yang sangat penting di Indonesia dan produksinya meningkat setiap tahun. Salah satu kendala yang cukup berarti dalam usaha peningkatan produksi kelapa sawit adalah penyakit busuk pangkal batang yang disebabkan oleh cendawan Ganoderma sp. Penyakit ini dapat merusak sangat banyak tanaman kelapa sawit dalam suatu area (PPKS 2009). Pengendalian terhadap penyakit ini telah dilakukan baik secara mekanis, kimiawi, maupun hayati (Lubis 1992), namun belum ada yang dapat dianggap efektif sehingga perlu dilakukan pengendalian yang tepat.
Pengendalian yang paling tepat dilakukan untuk masalah Ganoderma pada tanaman kelapa sawit adalah melalui pemuliaan tanaman dengan rekayasa genetika, yaitu untuk menemukan gen yang dapat membuat kelapa sawit tahan terhadap Ganoderma. Gen tersebut dapat berasal dari spesies kelapa sawit sendiri maupun dari spesies lain. Gen stilbena sintase (STS) yang berasal dari anggur (Vitis vinifera) merupakan gen penghasil senyawa yang berfungsi sebagai anti jamur (SIB 2007), sehingga dapat dilakukan upaya penyisipian gen STS ke dalam kelapa sawit agar dapat meningkatkan ketahanan terhadap Ganoderma.
Upaya konstruksi gen STS agar dapat disisipkan ke dalam kelapa sawit sebelumnya sudah pernah dilakukan dengan menggunakan metode pengklonan biasa dengan prosedur yang cukup rumit dan waktu yang cukup lama. Konstruksi gen pada penelitian ini menggunakan teknologi Gateway. Teknologi Gateway adalah suatu metode kloning universal yang berdasarkan rekombinasi situs spesifik pada bakteriofag lambda (Landy 1989). Teknologi Gateway memungkinkan pemindahan secara cepat dan efisien sekuen DNA ke dalam beberapa vektor untuk dilakukan analisis fungsional dan ekspresi protein (Hartley at al. 2000).
Penelitian ini bertujuan mengonstruksi gen STS pada vektor ekspresi dengan metode yang lebih cepat dan terarah, yaitu metode Gateway. Gen STS yang telah tersisipkan dalam vektor ekspresi selanjutnya ditransformasikan ke dalam Agrobacterium tumefaciens. Hipotesis penelitian ini adalah gen STS yang telah dikonstruksi pada vektor ekspresi dengan metode Gateway bisa disisipkan ke dalam Agrobacterium tumefaciens agar dapat diekspresikan pada tanaman. Hasil penelitian ini diharapkan dapat menghasilkan Agrobacterium tumefaciens yang memiliki gen STS, serta memberikan informasi mengenai metode Gateway sebagai teknologi rekombinasi gen yang cepat dan mudah.
TINJAUAN PUSTAKA
Stilbena Sintase
2
katalis reaksi sintesis substrat malonil KoA dan p-koumaroil KoA (Rolfs & Kindl 1984) menjadi 3,5,4’-trihidroksistilbena atau resveratrol. Stilbena sintase terdapat secara spesifik pada daun, terekspresi di jaringan palisade dan parenkim. Stilbena sintase bukan merupakan bagian permanen dari suatu tanaman, protein ini terinduksi pada saat beberapa kondisi tertentu seperti saat stres, terpapar sinar ultraviolet (UV), atau saat kehadiran patogen seperti Botrytis cinerea (Schubert et al. 1997).
Resveratrol merupakan suatu senyawa fitoaleksin polifenolik. Senyawa ini termasuk dalam golongan stilbenoid, yaitu derivat stilbena, yang diproduksi dalam beberapa tanaman dengan bantuan enzim stilbena sintase untuk melindungi tanaman tersebut dari infeksi jamur (Breuil et al. 1999). Anggur, kacang, dan beberapa spesies tanaman lainnya memiliki kandungan resveratrol yang terakumulasi di daun mencapai 400 µg/g berat segar. Konsentrasi sebesar itu menunjukkan korelasi dengan resistensi tanaman tersebut terhadap jamur (Sbaghi et al. 1995). Tanaman seperti tembakau, tomat, dan alfalfa yang sebelumnya rentan menunjukkan peningkatan resistensi terhadap jamur patogen setelah disisipkan gen stilbena sintase (Hain et al. 1993).
Pengklonan & Metode Pengklonan Gateway
Klon adalah sekumpulan individu atau bahan identik yang diperbanyak dari individu atau bahan yang sama, sedangkan pengklonan adalah proses perbanyakan bahan tersebut sehingga menghasilkan bahan yang identik dengan bahan asalnya (Triastuti 2007). Pengklonan gen, atau dapat disebut juga kloning gen dan teknologi DNA rekombinan, merujuk pada suatu proses yaitu pemindahan fragmen DNA yang diinginkan dari satu organisme ke dalam suatu vektor, misalnya plasmid. Fragmen DNA dan vektor yang telah bergabung disebut molekul DNA rekombinan. DNA rekombinan tersebut kemudian dapat diperbanyak dalam suatu sel inang (HGP 2009).
Tahap awal yang umum dilakukan dalam pengklonan gen adalah isolasi fragmen DNA dan vektor, misalnya dari bakteri, dan setelah diisolasi fragmen DNA dan vektor dipotong dengan enzim restriksi yang sama. Tahap selanjutnya adalah menggabungkan fragmen DNA dengan vektor yang dibantu oleh enzim
ligase, sehingga disebut juga tahap ligasi, menghasilkan molekul DNA rekombinan.
Molekul DNA rekombinan kemudian ditransformasikan ke bakteri. Transformasi adalah proses memasukkan DNA asing (DNA rekombinan) ke dalam sel inang. Sel inang yang telah mengalami transformasi (mengandung DNA rekombinan) kemudian diseleksi berdasarkan gen penanda yang dibawa oleh plasmid. Gen penanda, atau selectable marker, biasanya berupa gen yang tahan terhadap suatu antibiotik. Sel inang yang telah diseleksi selanjutnya ditransformasi ke sel target. Tahap terakhir adalah meneliti gen yang diklon, yaitu dengan mendapatkan informasi mengenai lokasi gen, cara gen ditranskripsi, hasil translasi yang dikode oleh gen, dan struktur gen (Brown 1991).
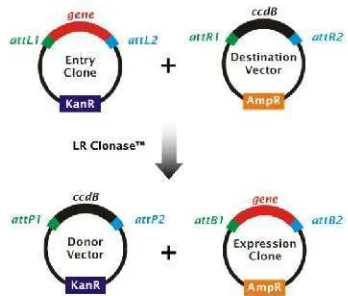
Metode pengklonan Gateway, yang ditemukan dan dikembangkan oleh Invitrogen sejak akhir tahun 1990-an, adalah suatu metode biologi molekular yang memungkinkan peneliti untuk memindahkan fragmen DNA dari suatu plasmid ke plasmid lain secara efisien dengan menggunakan suatu set sekuen rekombinasi yang disebut situs “att Gateway”, dan dua mix enzim yang disebut enzim BP klonase dan LR klonase. B merupakan singkatan dari bacterial dan P (phage), sedangkan L (left) dan R (right). Metode ini dapat secara efektif menggantikan fungsi dari enzim restriksi endonuklease dan ligase pada metode pengklonan biasa (Hartley et al. 2000).
Metode pengklonan Gateway sebenarnya memanfaatkan reaksi rekombinasi situs spesifik yang memungkinkan bakteriofag lambda untuk berintegrasi ke dalam kromosom bakteri atau sebaliknya. Protokol
3
Gateway sangat bergantung pada reaksi BP dan LR klonase. Reaksi BP (Gambar 1) dikatalisis oleh mix enzim BP klonase yang terdiri atas enzim integrase fage (Int) dan protein IHF (Integration Host Factor). Enzim BP klonase memindahkan suatu fragmen DNA yang diinginkan, misalnya produk PCR, yang diapit oleh dua situs bacterial attachment (attB) ke dalam vektor donor (pDONR) yang membawa dua situs phage attachment(attP). Rekombinasi terjadi antara situs attB dan attP yang cocok, selanjutnya fragmen DNA disisipkan ke dalam vektor donor, menghasilkan suatu klon entri (pENTR) yang diapit oleh dua situs left attachment (attL). Klon entri juga dapat dirakit oleh restriksi dan ligasi fragmen DNA dalam vektor yang mana situs pengklonan jamaknya diapit oleh situs attL (Karimi et al. 2007).
Klon entri merupakan substrat kunci dalam reaksi LR (Gambar 2) yang dikatalisis oleh mix enzim LR klonase yang terdiri atas enzim integrase (Int), exsisionase fage (Xis), dan protein IHF. Enzim LR klonase memindahkan fragmen DNA yang diinginkan yang diapit oleh dua situs attL (di dalam klon entri) ke dalam vektor destinasi (pDEST) yang membawa dua situs right attachment (attR). Rekombinasi terjadi antara situs attL dan attR yang cocok, selanjutnya fragmen DNA disisipkan ke dalam klon ekspresi (pEXPR) dan diapit lagi oleh situs attB (Karimi et al. 2007).
Hasil rekombinasi dapat diseleksi dengan kombinasi seleksi positif (resisten terhadap antibiotik) dan seleksi negatif (gen sitotoksik ccdB). Gen sitotoksik ccdB (Control of Cell Death B) terdapat pada vektor donor dan vektor destinasi. Saat rekombinasi pada reaksi
Gambar 2 Reaksi LR dalam metode Gateway (Kolpack & Loschelder 2008).
BP terjadi, gen ccdB akan bertukar dengan fragmen DNA yang diinginkan sehingga vektor yang tidak disisipi DNA tersebut akan mati karena gen ccdB. Begitu juga pada reaksi LR, fragmen DNA yang telah diapit oleh situs attL akan bertukar dengan gen ccdB yang telah diapit oleh situs attR pada vektor destinasi (Bernard & Couturier 1992).
Polymerase Chain Reaction(PCR)
Teknik Polymerase Chain Reaction(PCR) merupakan salah satu teknik yang digunakan secara luas dalam bidang biologi molekular dan dikembangkan pertama kali oleh Kary Mullis pada tahun 1984. Teknik ini disebut polymerase chain reaction karena mengacu pada enzim DNA polimerase yang digunakan untuk mengamplifikasi (replikasi berulang kali) suatu DNA secara in vitro. Instrumen PCR dapat mereplikasi molekul DNA yang asli dengan bantuan enzim DNA polimerase sehingga jumlahnya menjadi dua kali lipat. Molekul-molekul DNA tersebut kemudian direplikasi lagi pada replikasi “siklus” kedua, sehingga jumlahnya menjadi empat kali lipat. DNA direplikasi lagi pada siklus ketiga dan seterusnya, proses ini yang disebut “reaksi berantai” (chain reaction) dimana DNA cetakan diamplifikasi secara eksponensial. Proses PCR memungkinkan amplifikasi satu utas DNA menjadi beberapa juta kopi melalui beberapa siklus, sehingga dapat digunakan dalam manipulasi genetik atau penggunaan yang lain (Kennedy & Oswald 2011).
Proses PCR membutuhkan empat komponen utama agar dapat berjalan, yaitu (1) DNA cetakan, adalah fragmen DNA yang akan diamplifikasi, (2) oligonukleotida primer, yaitu suatu sekuen oligonukleotida pendek (15-25 basa nukleotida) yang digunakan untuk mengawali sintesis rantai DNA, (3) deoksiribonukleotida trifosfat (dNTP), terdiri atas dATP, dCTP, dGTP, dTTP, dan (4) enzim DNA polimerase, yaitu enzim yang melakukan katalisis reaksi sintesis rantai DNA. Komponen lain yang juga penting adalah senyawa buffer (Yuwono 2006).
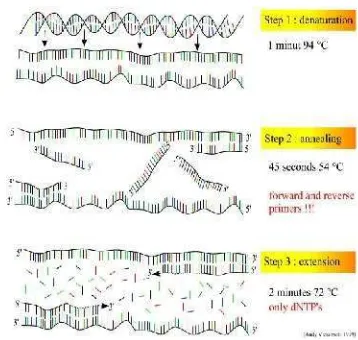
PCR pada prinsipnya adalah menggunakan perbedaan temperatur untuk tiga tahap reaksi (Gambar 3), yaitu denaturasi (denaturation), penempelan (annealing), dan pemanjangan (extension). Suhu yang tinggi, biasanya 94-95 o
4
primer kepada sekuen basa yang komplementer pada utas cetakan, suhu annealing tersebut berbeda-beda bergantung pada primer yang digunakan. Suhu annealing memegang peranan penting untuk memastikan tingkat spesifitas reaksi, biasanya semakin tinggi suhu annealing maka reaksi akan semakin spesifik. Suhu annealing yang digunakan umumnya 55 oC. Akhirnya, untuk sintesis DNA yang efisien, suhu diatur agar optimal untuk aktivitas DNA polimerase, yaitu sekitar 72 oC. Ketiga siklus tahap reaksi tersebut biasanya dilalui berulang kali untuk mendapatkan hasil amplifikasi DNA yang baik (biasanya sekitar 25-40 siklus) atau agar hasilnya dapat dilihat secara langsung melalui elektroforesis gel agarosa (McPherson & Moller 2006).
Keberhasilan PCR sangat bergantung pada penggunaan primer yang didesain dengan benar. Sepasang primer yang didesain dengan benar dapat mengamplifikasi suatu fragmen DNA yang cocok dengan daerah target dari molekul DNA tersebut. Primer didesain agar tepat komplementer dengan DNA cetakan. Syarat-syarat desain primer yang baik secara ringkas adalah: (1) Panjang primer, memegang peranan penting karena suhu annealingbergantung kepada panjang primer. Panjang primer yang ideal berkisar antara 18-30 basa; (2) Komposisi primer, komposisi basa primer sebaiknya sekitar 45-60% terdiri atas G+C; (3) Primer sebaiknya tidak memiliki struktur sekunder; (4) Primer yang ideal tidak mengandung sekuen yang saling komplementer satu sama lain; (5) Sekuen palindrom harus dihindari; (6) Suhu melting (Tm) primer yang optimum berkisar antara 52-58 oC, dapat dihitung dengan rumus Tm = 2(A+T) + 4(G+C); dan (7) Posisi produk,
Gambar 3 Tahapan reaksi PCR.
lokasi primer bisa di dekat ujung 5’, ujung 3’, atau dimana saja selama tidak melebihi panjang yang ditetapkan. Posisi ujung 3’ telah diketahui dapat menghindari mispriming atau kesalahan peng-awal-an (Donepudi 2011).
Elektroforesis Gel Agarosa
Elektroforesis adalah suatu teknik pemisahan molekul selular berdasarkan ukurannya, dengan menggunakan medan listrik yang dialirkan pada suatu medium yang mengandung sampel yang akan dipisahkan. Teknik ini dapat digunakan dengan memanfaatkan muatan listrik yang ada pada makromolekul, misalnya DNA yang bermuatan negatif. Molekul yang bermuatan negatif jika dilewatkan melalui suatu medium, misalnya gel agarosa, kemudian dialiri arus listrik dari suatu kutub ke kutub yang berlawanan muatannya, maka molekul tersebut akan bergerak dari kutub negatif ke kutub positif. Kecepatan gerak molekul tersebut bergantung pada rasio muatan terhadap massanya, serta bergantung juga pada bentuk molekulnya (Yuwono 2005).
Teknik elektroforesis dapat digunakan untuk analisis DNA, RNA, maupun protein. Elektroforesis DNA dilakukan misalnya untuk menganalisis fragmen-fragmen DNA hasil pemotongan dengan enzim restriksi. Fragmen molekul DNA yang telah dipotong-potong dapat ditentukan ukurannya dengan cara membuat gel agarosa, yaitu suatu bahan semi-padat berupa polisakarida yang diekstraksi dari rumput laut atau alga yang ditemukan di California dan Asia bagian timur (Rothman 2011). Gel agarosa dibuat dengan melarutkannya dalam suatu buffer, dan dicetak sehingga membentuk sumur-sumur saat kondisinya masih panas (cair). Larutan buffer yang dapat digunakan misalnya tris-asetat-EDTA (TAE) dan tris-borat-EDTA (TBE). Teknik elektroforesis DNA juga memerlukan loading buffer selain larutan buffer elektroforesis, yang berfungsi meningkatkan densitas sampel sehingga fragmen sampel tersebut berada di dasar sumur gel dan tidak menyebar (Sambrook & Russell 2001).
sebaliknya. Standar konsentrasi gel agarosa 1% dapat memisahkan DNA yang memiliki panjang antara 0.2-30 Kb (Rothman 2011). Pengamatan hasil elektroforesis dapat dilakukan secara visual dengan menambahkan etidium bromida (EtBr) pada gel. EtBr akan menyisip ke dalam DNA sehingga dapat berpendar jika dipaparkan sinar UV. Citra berupa pita-pita pada gel akan tampak jika gel disinari dengan sinar UV dari bawah. Pita-pita tersebut adalah molekul-molekul DNA yang bergerak sepanjang gel setelah dielektroforesis (Yuwono 2005).
Agrobacterium tumefaciens
Agrobacterium tumefaciens merupakan bakteri golongan Gram negatif yang memiliki sifat aerob dan mampu hidup dengan baik sebagai saprofit maupun parasit. A. tumefaciensberbentuk batang, berukuran 0.6-10 µm sampai 1.5-3.0 µm dalam bentuk tunggal atau berpasangan (Gambar 6). Bakteri ini mudah bergerak (motil), tidak berspora, tidak memiliki pigmen, dan tumbuh optimal pada suhu 25-28 oC (Biotek UnUd 2008). Sebagian besar genus Agrobacterium bertanggung jawab terhadap penyakit tumor pada tanaman dikotil dan beberapa tanaman monokotil yang disebut penyakit Crown Gall (McCullen & Binns 2006).
Penyakit tumor Crown Gall adalah jaringan tanaman yang pertumbuhannya terdiferensiasi akibat adanya interaksi antar tanaman yang rentan dengan galur virulen A. tumefaciens. Galur AGL0 yang digunakan dalam penelitian ini telah terbukti sebagai galur yang virulen (Jones et al. 2005). Karakterisasi molekular dari induksi Crown Gall ini menunjukkan bahwa Agrobacterium bisa dipakai untuk mengantarkan materi genetik ke dalam tanaman (Deacon 2002). Materi genetik tersebut berupa potongan DNA yang disebut sebagai T-DNA (DNA transfer). Bakteri ini dikenal sebagai parasit genetik karena memindahkan materi genetiknya ke dalam mekanisme genetik sel inang. Sistem transfer DNA dari Agrobacteriumke tanaman dimanfaatkan secara meluas untuk penelitian biologi molekular dan rekayasa genetika pada tanaman (Nester 2008).
Pembentukan tumor pada tanaman melibatkan tiga komponen genetik. Pertama, gen virulen kromosom (chromosomal virulence atau chv) yang terdapat pada kromosom A. tumefaciens. Gen ini berfungsi dalam pelekatan bakteri pada sel tanaman. Kedua, sekelompok gen virulen (vir). Gen vir
terdapat dalam plasmid Ti dan berperan dalam menginduksi transfer dan integrasi T-DNA. Ketiga, daerah T-DNA yang mengandung gen penting bagi A. tumefaciens. Daerah ini dibatasi oleh LB (Left border) dan RB (Right Border). Proses pembentukan tumor inilah yang mendasari konsep transformasi genetik atau penyisipan gen ke dalam tanaman menggunakan A. tumefaciens (Escobar & Dandekar 2003).
Gambar 4 Agrobacterium tumefaciens.
BAHAN DAN METODE
Bahan dan Alat
sebaliknya. Standar konsentrasi gel agarosa 1% dapat memisahkan DNA yang memiliki panjang antara 0.2-30 Kb (Rothman 2011). Pengamatan hasil elektroforesis dapat dilakukan secara visual dengan menambahkan etidium bromida (EtBr) pada gel. EtBr akan menyisip ke dalam DNA sehingga dapat berpendar jika dipaparkan sinar UV. Citra berupa pita-pita pada gel akan tampak jika gel disinari dengan sinar UV dari bawah. Pita-pita tersebut adalah molekul-molekul DNA yang bergerak sepanjang gel setelah dielektroforesis (Yuwono 2005).
Agrobacterium tumefaciens
Agrobacterium tumefaciens merupakan bakteri golongan Gram negatif yang memiliki sifat aerob dan mampu hidup dengan baik sebagai saprofit maupun parasit. A. tumefaciensberbentuk batang, berukuran 0.6-10 µm sampai 1.5-3.0 µm dalam bentuk tunggal atau berpasangan (Gambar 6). Bakteri ini mudah bergerak (motil), tidak berspora, tidak memiliki pigmen, dan tumbuh optimal pada suhu 25-28 oC (Biotek UnUd 2008). Sebagian besar genus Agrobacterium bertanggung jawab terhadap penyakit tumor pada tanaman dikotil dan beberapa tanaman monokotil yang disebut penyakit Crown Gall (McCullen & Binns 2006).
Penyakit tumor Crown Gall adalah jaringan tanaman yang pertumbuhannya terdiferensiasi akibat adanya interaksi antar tanaman yang rentan dengan galur virulen A. tumefaciens. Galur AGL0 yang digunakan dalam penelitian ini telah terbukti sebagai galur yang virulen (Jones et al. 2005). Karakterisasi molekular dari induksi Crown Gall ini menunjukkan bahwa Agrobacterium bisa dipakai untuk mengantarkan materi genetik ke dalam tanaman (Deacon 2002). Materi genetik tersebut berupa potongan DNA yang disebut sebagai T-DNA (DNA transfer). Bakteri ini dikenal sebagai parasit genetik karena memindahkan materi genetiknya ke dalam mekanisme genetik sel inang. Sistem transfer DNA dari Agrobacteriumke tanaman dimanfaatkan secara meluas untuk penelitian biologi molekular dan rekayasa genetika pada tanaman (Nester 2008).
Pembentukan tumor pada tanaman melibatkan tiga komponen genetik. Pertama, gen virulen kromosom (chromosomal virulence atau chv) yang terdapat pada kromosom A. tumefaciens. Gen ini berfungsi dalam pelekatan bakteri pada sel tanaman. Kedua, sekelompok gen virulen (vir). Gen vir
terdapat dalam plasmid Ti dan berperan dalam menginduksi transfer dan integrasi T-DNA. Ketiga, daerah T-DNA yang mengandung gen penting bagi A. tumefaciens. Daerah ini dibatasi oleh LB (Left border) dan RB (Right Border). Proses pembentukan tumor inilah yang mendasari konsep transformasi genetik atau penyisipan gen ke dalam tanaman menggunakan A. tumefaciens (Escobar & Dandekar 2003).
Gambar 4 Agrobacterium tumefaciens.
BAHAN DAN METODE
Bahan dan Alat
6
TE, kanamisin 100.000 ppm, rifampisin 25.000 ppm, media Luria Bertani (LB) cair + glukosa 20 mM, nitrogen cair, dan gliserol.
Alat yang digunakan untuk elektroforesis adalah sisir, cetakan agar, bak elektroforesis (BioRad), pipet mikro, tabung mikro, microwave, adaptor 100 volt (Sigma), dan transluminator UV T2201 (Sigma). Alat lainnya yang digunakan adalah DNA speed vacuum110 savant, mesin PCR (ESCO Swift Maxi), Eppendorf Cenrifuge5417R, inkubator Certomat® HK, inkubator Thermolyne type 41900, shaker incubator (Environmental Shaker-Incubator ES-20 BIOSAN), shaker water bath(Techne SB-16), laminar air flow cabinet, neraca analitik, tusuk gigi, alumunium foil, scalpel, dan peralatan gelas seperti segitiga penyebar, cawan Petri, gelas piala, labu Erlenmeyer, dan gelas ukur.
Metode
Amplifikasi Gen Stilbena Sintase dengan Primer Gateway (Invitrogen 2010)
Gen STS yang telah diisolasi dari tanaman anggur (Vitis vinifera) pada penelitian sebelumnya diamplifikasi dengan menggunakan kit dari Invitrogen. Amplifikasi tersebut menggunakan sepasang primer spesifik Gateway, yaitu Gateway STS-Forward dan Gateway STS-Reverse. Amplifikasi dimulai dengan menyiapkan campuran reaksi (reaction mix) yang terdiri atas 2.5 µL larutan bufer PCR 10x, 1 µL MgCl2, 1 µL dNTPs, 0.2 µL Taqpolimerase 5 unit, dan 14.3 µL molecular water (MW). DNA cetakan (template) dimasukkan ke dalam tabung mikro sebanyak 1 µL, selanjutnya primer F (STS-Forward) dan primer R (STS-Reverse) ditambahkan ke dalam tabung sebanyak masing-masing 1 µL lalu ditambahkan juga 3 µL MW. Reaction mix yang telah dipersiapkan sebelumnya kemudian ditambahkan ke dalam tabung mikro. Gen STS diamplifikasi dengan mesin PCR sebanyak 35 siklus dengan program PCR: predenaturasi pada suhu 94 oC selama 7 menit, denaturasi pada suhu 94 oC selama 45 detik, penempelan primer (annealing) pada suhu 55 oC selama 45 detik, pemanjangan primer (extension) pada suhu 70 oC selama 2 menit, dan pascapemanjangan pada suhu 70 o
C selama 5 menit.
Elektroforesis DNA
Serbuk agarosa ditimbang sebanyak 0.3 g, lalu dilarutkan dalam 30 mL larutan TBE
0.5x. Larutan tersebut dipanaskan dengan microwave selama ± 60 detik sampai larut. Larutan didiamkan sampai cukup hangat (± 50 o
C), lalu ditambahkan EtBr sebanyak 1.5 µL. Larutan agarosa kemudian dituang ke dalam cetakan dan sisir yang telah dipersiapkan sebelumnya, lalu dibiarkan hingga mengeras membentuk agar atau gel. Gel agarosa tersebut digunakan untuk elektroforesis hasil amplifikasi.
Gen yang telah diamplifikasi dengan PCR selanjutnya dielektroforesis untuk identifikasi gen. Gel agarosa yang sudah dibuat diletakkan di dalam bak elektroforesis, kemudian ditambahkan larutan bufer TBE 0.5x sampai gel terendam. Hasil amplifikasi diambil sebanyak 5 µL, kemudian dicampurkan dengan loading buffer sebanyak 1 µL. Campuran tersebut kemudian dimasukkan ke dalam sumur gel agarosa, sebanyak 0.8 µL marker 1 Kb Plus juga ditambahkan ke dalam salah satu sumur. Elektroforesis dijalankan pada tegangan 75 volt selama ± 1 jam.
Pita DNA visualisasi hasil elektroforesis kemudian ditentukan dengan tiga cara, yaitu dibandingkan ukuran pita tersebut dengan marker, dihitung dengan menggunakan rumus log (M) = log (Mo) –KRT (Ferguson 1964), dan dianalisis dengan software Photo-CaptMw.
Ekstraksi dan Purifikasi DNA dari Gel Agarosa (Invitrogen 2010)
7
pada kecepatan 12000 rpm selama 1 menit pada suhu ruang. Wash tube dibuang dan kolom dipindahkan ke tabung pemulih (recovery tube), selanjutnya ditambahkan 30 µL larutan bufer elusi tepat di tengah kolom lalu diinkubasi selama 1 menit. Kolom beserta recovery tube disentrifus pada kecepatan 12000 rpm selama 2 menit pada suhu ruang, kemudian buang kolom. Supernatan dalam recovery tubedisimpan dan diberi label.
Rekombinasi Gen STS pada Vektor Donor dan Vektor Destinasi (Invitrogen 2003)
Gen STS yang telah diekstraksi dan dipurifikasi selanjutnya direkombinasikan ke vektor donor dan vektor destinasi secara berurutan dengan metode Gateway. Rekombinasi STS pada vektor donor dimulai dengan menyiapkan sebanyak 2 µL DNA hasil purifikasi, 1 µL vektor donor (pDONRTM 221), dan ditambahkan larutan bufer TE sampai volumenya menjadi 8 µL. Enzim BP ClonaseTM ditambahkan terakhir sebanyak 2 µL, kemudian diinkubasi pada suhu 25 oC selama 2 jam. Setelah inkubasi selesai ditambahkan enzim proteinase K sebanyak 1 µL, lalu diinkubasi pada suhu 37 oC selama 15 menit. Hasil rekombinasi pada vektor donor tersebut diambil sebanyak 5 µL kemudian ditransformasikan ke E. coli untuk menggandakan plasmid yang telah membawa gen STS. Koloni bakteri E. coliyang tumbuh pada media LA dikonfirmasi dengan metode PCR koloni. DNA plasmid koloni bakteri rekombinan tersebut selanjutnya diisolasi untuk direkombinasikan ke vektor destinasi.
Plasmid rekombinan sebanyak 2 µL dimasukkan ke dalam tabung mikro dan ditambahkan 1 µL vektor destinasi (pGD625, pARC983, dan pDEST), kemudian larutan bufer TE ditambahkan sampai volume menjadi 8 µL. Enzim LR ClonaseTM ditambahkan terakhir sebanyak 2 µL, kemudian diinkubasi pada suhu 25 oC selama 2 jam. Setelah inkubasi selesai ditambahkan enzim proteinase K sebanyak 1 µL, lalu diinkubasi pada suhu 37 oC selama 15 menit. Hasil rekombinasi pada vektor destinasi tersebut diambil sebanyak 5 µL untuk kemudian ditransformasikan ke E. coli. DNA plasmid koloni bakteri yang tumbuh kemudian diisolasi lalu dikonfirmasi dengan metode PCR. Plasmid rekombinan selanjutnya ditransformasikan ke A. tumefaciens.
Transformasi Gen Stilbena Sintase ke
Escherichia coli
Gen STS yang telah direkombinasikan ke vektor donor maupun vektor destinasi ditransformasi ke E. coliuntuk menggandakan sel yang membawa plasmid rekombinan. Hasil rekombinasi sebanyak 5 µL dicampurkan ke dalam 200 µL sel kompeten E. coli XL1-Blue kemudian diinkubasi di dalam es selama 30 menit. Campuran tersebut kemudian diberi perlakuan kejut panas (heat shock) pada suhu 42 oC selama 50 detik menggunakan water bath, kemudian segera dimasukkan lagi ke dalam es selama 10 menit. Setelah itu ditambahkan 800 µL LB cair + glukosa 20 mM dan diinkubasi pada suhu 37 o
C selama 90 menit menggunakan shaker incubatorpada kecepatan 150 rpm.
Setelah dikocok dengan shaker incubator, sebanyak 100 µL hasil kultur dituang ke media LA yang telah ditambahkan kanamisin 50 ppm dan disebar dengan segitiga penyebar. Sisa kultur sebanyak 900 µL disentrifus pada kecepatan 3500 rpm selama 5 menit pada suhu ruang. Supernatan yang terbentuk dibuang sebanyak ± 800 µL, sedangkan sisa supernatan sebanyak 100 µL dan pelet diresuspensi kemudian disebar ke media LA yang lain. Media diinkubasi selama 16-20 jam pada suhu 37 oC kemudian koloni yang tumbuh diamati.
Konfirmasi Koloni Transforman dengan Metode PCR Koloni
Koloni yang tumbuh dipindahkan ke media LA yang baru untuk membuat duplikat koloni. Koloni tersebut setelah diduplikasi juga dipindahkan ke dalam tabung mikro yang berisi 10 µL MW dengan menggunakan tusuk gigi untuk persiapan PCR koloni. Pemindahan koloni harus dilakukan secara steril di dalam laminar air flow cabinet. PCR koloni dimulai dengan menyiapkan reaction mixyang terdiri atas 1.5 µL larutan bufer 10x dream Taq (Fermentas), 0.3 µL dNTPs, 0.15 µL primer F, 0.15 µL primer R, 0.15 µL Taqpolimerase, dan 2.75 µL MW. Konfirmasi koloni pada vektor donor menggunakan primer M13-F dan M13-R, sedangkan pada vektor destinasi menggunakan primer Gateway STS-For dan Gateway STS-Rev.
PCR koloni dilakukan dalam 30 siklus. Tahap pertama PCR koloni adalah melisis dinding sel koloni, yaitu dengan program lisis koloni PCR: 96 oC selama 5 menit, 50 oC selama 90 detik, 96 oC selama 90 detik, 45 oC selama 90 detik, 96 oC selama 1 menit, dan 40 o
reaction mix pada tabung mikro, kemudian program PCR dilanjutkan kembali dengan program PCR biasa: 94 oC selama 30 detik, 55 o
C selama 1 menit, dan 72 oC selama 2 menit. Hasil konfirmasi dicek dengan elektroforesis gel agarosa 1%.
Isolasi DNA Plasmid Rekombinan (Fermentas 2006)
Isolasi DNA plasmid menggunakan GeneJETTM Plasmid MiniPrep Kit dari Fermentas. Koloni bakteri yang tumbuh pada media LA dikulturkan ke media LB cair yang telah ditambahkan antibiotik kanamisin 50 ppm. Kultur diinkubasi dengan menggunakan shaker incubator pada suhu 37 oC selama semalam dengan kecepatan 220 rpm.
Kultur bakteri yang telah tumbuh kemudian dipindahkan ke tabung mikro sebanyak 2 mL, dan disentrifus pada 8000 rpm, 25 oC, selama 3 menit. Pelet yang terbentuk diambil dan dilarutkan dengan penambahan 250 µL larutan resuspensi. Pelet yang telah larut kemudian ditambahkan 250 µL larutan lisis, lalu tabung dibolak-balik sebanyak 6 kali. Sebanyak 350 µL larutan netralisasi kemudian ditambahkan ke dalam larutan tersebut dan tabung dibolak-balik lagi 6 kali, lalu disentrifus pada 12000 rpm, 25 oC, selama 5 menit.
Supernatan dipindahkan ke GeneJETYM Spin Column (kolom) dan disentrifus pada 12000 rpm selama 1 menit. Sebanyak 500 µL larutan pencuci ditambahkan ke dalam kolom dan disentrifus pada 12000 rpm selama 1 menit (dilakukan dua kali). Tabung beserta kolom dalam keadaan kosong kemudian disentrifus lagi pada 12000 rpm selama 1 menit. Kolom dipindahkan ke dalam tabung baru, kemudian ditambahkan 30 µL larutan bufer elusi tepat di tengah kolom, lalu diinkubasi selama 2 menit dan disentrifus pada 12000 rpm selama 2 menit. Hasil isolasi dicek dengan elektroforesis gel agarosa 1%.
Transformasi ke dalam Agrobacterium tumefaciens galur AGL0
Transformasi ke A. tumefaciensdilakukan dengan sebanyak 10 µL hasil rekombinasi pada vektor destinasi dimasukkan ke dalam 500 µL sel kompeten A. tumefaciens galur AGL0 lalu didiamkan di dalam es selama 15 menit. Campuran tersebut kemudian diinkubasi di dalam nitrogen cair selama 5 menit, dilanjutkan diinkubasi pada suhu 37 oC selama 5 menit di dalam water bath. Sebanyak 1 mL media Yeast Extract Pepton
(YEP) ditambahkan ke dalamnya kemudian dibungkus dengan koran sampai tidak terpapar cahaya. Campuran tersebut diinkubasi pada suhu 28 oC selama 3 jam di dalam shaker incubator. Hasil inkubasi kemudian disentrifus pada kecepatan 6000 rpm selama 3 menit. Supernatan yang terbentuk dibuang sebagian, dan sebanyak ± 100 µL supernatan yang tersisa diresuspensikan dengan pelet lalu disebar ke media LA yang telah ditambahkan antibiotik kanamisin 50 ppm dan rifampisin 50 ppm. Media diinkubasi selama 2 hari pada suhu 28 oC dalam kondisi gelap.
HASIL DAN PEMBAHASAN
Hasil Amplifikasi Gen Stilbena Sintase dengan Primer Gateway
Langkah awal yang dilakukan dalam konstruksi gen STS pada vektor ekspresi adalah mendesain primer Gateway yang spesifik. Primer tersebut dirancang berdasarkan sekuen gen STS yang telah diperoleh pada penelitian sebelumnya. Primer yang digunakan, yaitu Gateway STS-Forward dan Gateway STS-Reverse, dirancang khusus untuk metode Gateway (Lampiran 3). Rancangan tersebut adalah empat basa nukleotida guanin (GGGG), diikuti situs attB (pada ujung Forwarddan Reverse), kemudian ditambahkan 18-25 urutan basa nukleotida spesifik gen STS (Invitrogen 2003). Situs attB disebut sebagai tempat pengikatan lambda (lambda attachment site), yaitu tempat integrasi DNA lambda ke dalam kromosom E. coli(Yuwono 2005).
reaction mix pada tabung mikro, kemudian program PCR dilanjutkan kembali dengan program PCR biasa: 94 oC selama 30 detik, 55 o
C selama 1 menit, dan 72 oC selama 2 menit. Hasil konfirmasi dicek dengan elektroforesis gel agarosa 1%.
Isolasi DNA Plasmid Rekombinan (Fermentas 2006)
Isolasi DNA plasmid menggunakan GeneJETTM Plasmid MiniPrep Kit dari Fermentas. Koloni bakteri yang tumbuh pada media LA dikulturkan ke media LB cair yang telah ditambahkan antibiotik kanamisin 50 ppm. Kultur diinkubasi dengan menggunakan shaker incubator pada suhu 37 oC selama semalam dengan kecepatan 220 rpm.
Kultur bakteri yang telah tumbuh kemudian dipindahkan ke tabung mikro sebanyak 2 mL, dan disentrifus pada 8000 rpm, 25 oC, selama 3 menit. Pelet yang terbentuk diambil dan dilarutkan dengan penambahan 250 µL larutan resuspensi. Pelet yang telah larut kemudian ditambahkan 250 µL larutan lisis, lalu tabung dibolak-balik sebanyak 6 kali. Sebanyak 350 µL larutan netralisasi kemudian ditambahkan ke dalam larutan tersebut dan tabung dibolak-balik lagi 6 kali, lalu disentrifus pada 12000 rpm, 25 oC, selama 5 menit.
Supernatan dipindahkan ke GeneJETYM Spin Column (kolom) dan disentrifus pada 12000 rpm selama 1 menit. Sebanyak 500 µL larutan pencuci ditambahkan ke dalam kolom dan disentrifus pada 12000 rpm selama 1 menit (dilakukan dua kali). Tabung beserta kolom dalam keadaan kosong kemudian disentrifus lagi pada 12000 rpm selama 1 menit. Kolom dipindahkan ke dalam tabung baru, kemudian ditambahkan 30 µL larutan bufer elusi tepat di tengah kolom, lalu diinkubasi selama 2 menit dan disentrifus pada 12000 rpm selama 2 menit. Hasil isolasi dicek dengan elektroforesis gel agarosa 1%.
Transformasi ke dalam Agrobacterium tumefaciens galur AGL0
Transformasi ke A. tumefaciensdilakukan dengan sebanyak 10 µL hasil rekombinasi pada vektor destinasi dimasukkan ke dalam 500 µL sel kompeten A. tumefaciens galur AGL0 lalu didiamkan di dalam es selama 15 menit. Campuran tersebut kemudian diinkubasi di dalam nitrogen cair selama 5 menit, dilanjutkan diinkubasi pada suhu 37 oC selama 5 menit di dalam water bath. Sebanyak 1 mL media Yeast Extract Pepton
(YEP) ditambahkan ke dalamnya kemudian dibungkus dengan koran sampai tidak terpapar cahaya. Campuran tersebut diinkubasi pada suhu 28 oC selama 3 jam di dalam shaker incubator. Hasil inkubasi kemudian disentrifus pada kecepatan 6000 rpm selama 3 menit. Supernatan yang terbentuk dibuang sebagian, dan sebanyak ± 100 µL supernatan yang tersisa diresuspensikan dengan pelet lalu disebar ke media LA yang telah ditambahkan antibiotik kanamisin 50 ppm dan rifampisin 50 ppm. Media diinkubasi selama 2 hari pada suhu 28 oC dalam kondisi gelap.
HASIL DAN PEMBAHASAN
Hasil Amplifikasi Gen Stilbena Sintase dengan Primer Gateway
Langkah awal yang dilakukan dalam konstruksi gen STS pada vektor ekspresi adalah mendesain primer Gateway yang spesifik. Primer tersebut dirancang berdasarkan sekuen gen STS yang telah diperoleh pada penelitian sebelumnya. Primer yang digunakan, yaitu Gateway STS-Forward dan Gateway STS-Reverse, dirancang khusus untuk metode Gateway (Lampiran 3). Rancangan tersebut adalah empat basa nukleotida guanin (GGGG), diikuti situs attB (pada ujung Forwarddan Reverse), kemudian ditambahkan 18-25 urutan basa nukleotida spesifik gen STS (Invitrogen 2003). Situs attB disebut sebagai tempat pengikatan lambda (lambda attachment site), yaitu tempat integrasi DNA lambda ke dalam kromosom E. coli(Yuwono 2005).
M a
Gambar 5 Elektroforegram ampl STS dengan primer (M) marker 1 Kb Plu
Ladder, (a) gen STS berukura 1500 pb.
Hasil Ekstraksi dan Purifikasi Gel Agarosa (Elusi Gel)
Ekstraksi dan purifikasi menggunakan kit PureLink Extractiondari Invitrogen. Gel mengandung hasil elektrofor sebelumnya diletakkan di atas UV untuk melihat pita yang Pita DNA yang terlihat dipoton scalpelkemudian diekstraksi da Gel agarosa mengandung berba yang dapat menghambat perlakuan selanjutnya terhadap tidak dihilangkan. Ekstraksi bertujuan memurnikan DNA pengotor lain yang tidak diinginkan komponen PCR, sehingga efisien terhadap DNA selanjutnya dapat (Lewis 2001).
Ukuran pita DNA hasil purifikasi seharusnya tidak dengan ukuran pita hasil am hanya menghilangkan pengotor Hasil ekstraksi dan purifikasi dengan gel agarosa 1% dan men berukuran sekitar 1500 pb (G ekstraksi dan purifikasi direkombinasikan ke dalam dengan menggunakan metode Gate
Hasil Rekombinasi Gen Stilbena pada Vektor Donor dan Vektor Destinasi
Rekombinasi gen STS pada dan vektor destinasi pada merupakan teknik pengklonan.
regram amplikon gen STS dengan primer Gateway;
ker 1 Kb Plus DNA , (a) gen STS berukuran
Purifikasi DNA dari
purifikasi DNA dari gel PureLinkTM Quick Gel Gel agarosa yang elektroforesis dari tahap di atas transluminator pita yang akan dipotong. terlihat dipotong dengan diekstraksi dan dimurnikan. gandung berbagai pengotor menghambat reaksi dalam terhadap DNA jika Ekstraksi dan purifikasi DNA dari gel dan tidak diinginkan seperti gga efisiensi perlakuan njutnya dapat meningkat
DNA hasil ekstraksi dan tidak berbeda jauh hasil amplifikasi karena
pengotor dari DNA. purifikasi dielektroforesis dan menghasilkan pita pb (Gambar 6). Hasil purifikasi kemudian dalam vektor donor akan metode Gateway.
Gen Stilbena Sintase or dan Vektor Destinasi
STS pada vektor donor destinasi pada prinsipnya
gklonan. Pengklonan
bertujuan memperbanyak dan meng DNA yang diklon. Pengklonan metode Gateway terdiri atas dua yaitu rekombinasi BP dan rekombinasi Hasil elusi gel disisipkan ke dalam donor pada tahap rekombinasi BP. hasil amplifikasi yang telah memiliki attB1 (pada bagian forward) dan (pada bagian reverse) direaksika vektor donor yang memiliki situs situs attP2 sebagai tempat rekombinasi. rekombinasi tersebut memungkinkan adanya kesalahan orientasi
direkombinasikan. Reaksi rekombinasi dikatalisis oleh enzim BP Clonase
dalam metode Gateway reaksi rekombina pada donor vektor disebut juga rea
reaction). Reaksi BP menghasilkan entri (pENTR) yang diapit oleh dua (Lampiran 4).
Hasil rekombinasi gen STS pada donor kemudian ditransformasikan kompeten Escherichia coli galur dengan perlakuan kejut panas ( Sel kompeten adalah sel y mengalami perlakuan fisik atau sedemikian rupa sehingga menin kemampuannya untuk mengambil dapat dibuat kompeten biasanya perlakuan garam CaCl2 atau RbCl. CaCl2 menyebabkan presipitasi permukaan luar sel dan men perubahan tertentu pada dinding meningkatkan pengikatan DNA. DNA menuju ke dalam sel distimulasi menaikkan temperatur sampai 42
waktu singkat atau kejut panas (Brown 1991).
M a
Gambar 6 Elektroforegram hasil ekstrak dan purifikasi gen STS dari (M) marker 1 Kb Plus DNA
Ladder, (a) gen STS berukur 1500 pb.
9
dan mengisolasi gklonan dengan atas dua tahapan, rekombinasi LR. ke dalam vektor nasi BP. Gen STS telah memiliki situs ) dan situs attB2 direaksikan dengan memiliki situs attP1 dan rekombinasi. Situs memungkinkan tidak ntasi gen yang rekombinasi ini ClonaseTMsehingga reaksi rekombinasi juga reaksi BP (BP menghasilkan suatu klon oleh dua situs attL
STS pada vektor ormasikan ke sel galur XL1-Blue panas (heat shock).
sel yang telah fisik atau kimiawi sehingga meningkatkan ngambil DNA. Sel biasanya dengan atau RbCl. Garam presipitasi DNA pada dan menyebabkan ing sel yang DNA. Gerakan distimulasi dengan
ai 42 oC dalam nas (Brown 1991).
oregram hasil ekstraksi en STS dari gel;
E. coli merupakan mikroorganisme paling umum digunakan
bioteknologi dan dalam sebagian eksperimen kloning gen. E. coli beberapa alasan, yaitu memiliki genom yang relatif kecil, pertumbuha sangat cepat, relatif aman, sifat telah banyak diketahui, dan mampu inang bagi DNA asing (Wea 1989).
Hasil transformasi ditumbuhkan media LA (Luria Agar) ditambahkan antibiotik kanamisin Penambahan kanamisin dil vektor donor yang digunakan 221) memiliki marka seleksi resiste antibiotik tersebut (Lampira transforman dilakukan denga koloni yang tahan terhadap sehingga tumbuh pada media ditambahkan kanamisin 50 diinkubasi. Koloni yang tumb berwarna putih (Gambar 7 dipastikan merupakan klon membawa gen STS, sedangkan (by product) tidak akan tumb koloni putih. Hal tersebut disebabka ccdB yang mengganggu kerja gyrase pada E. colisehingga pertumbuha terhambat (Bernard & Couturi Koloni yang tumbuh diduplik untuk memperbanyak jumlah rekombinan. Hasil duplikasi dengan metode PCR
membuktikan plasmid rekombina tersisipi gen STS.
Koloni yang terbukti me rekombinan kemudian diisol plasmidnya untuk direkombinasikan vektor destinasi melalui tahap LR. Plasmid rekombinan (pENTR) diapit oleh situs attL1 dan direaksikan dengan vektor memiliki situs attR1 dan situs ini dikatalisis oleh enzim LR Clonase
Gambar 7 Koloni yang tumbuh setelah re BP pada metode Gatewa
mikroorganisme yang digunakan dalam industri dalam sebagian besar E. colidipilih karena u memiliki ukuran ecil, pertumbuhannya , sifat genetiknya diketahui, dan mampu menjadi asing (Weaver & Hedrick
ditumbuhkan pada Agar) yang telah k kanamisin 50 ppm. kanamisin dilakukan karena digunakan (pDONRTM seleksi resisten terhadap
Lampiran 6). Seleksi kukan dengan mengamati terhadap kanamisin media LA yang telah kanamisin 50 ppm setelah g tumbuh semuanya (Gambar 7) dan hampir kan klon entri yang sedangkan hasil samping akan tumbuh sebagai ut disebabkan oleh gen ggu kerja enzim DNA ngga pertumbuhannya Couturier 1992). diduplikasi dan dikultur ak jumlah plasmid duplikasi kemudian diuji PCR koloni untuk plasmid rekombinan telah
kti membawa plasmid udian diisolasi DNA kombinasikan ke dalam melalui tahap rekombinasi inan (pENTR) yang telah L1 dan situs attL2 vektor destinasi yang dan situs attR2. Reaksi nzim LR ClonaseTMyang
g tumbuh setelah reaksi BP pada metode Gateway.
disebut juga reaksi LR (LR reaction LR menghasilkan suatu klon (pEXPR) yang diapit oleh dua (Lampiran 5).
Hasil rekombinasi gen STS pada destinasi kemudian ditransformasi kekanamisin sehingga seleksi transf juga dilakukan dengan melihat koloni yang dapat tumbuh pada media (Gambar 8). Koloni yang tumbuh sedikit disebabkan oleh sel kompeten digunakan telah berkurang keefektifan Koloni yang tumbuh diduplikasi menyimpan koloni yang membawa sisipan agar tidak terkontaminasi
juga dilakukan pengujian plasmid rekombina dengan metode PCR koloni.
Gambar 8 Koloni yang tumbuh sete reaksi LR pada metode Gateway.
Hasil Konfirmasi Koloni Transf Reaksi BP dengan Metode PCR Kolo Isolasi DNA Plasmid Rekombinan
PCR koloni dilakukan untuk memastika bahwa koloni bakteri yang tumbuh transformasi ke dalam E. coli plasmid rekombinan. Metode PCR yang dilakukan setelah reaksi menggunakan sepasang primer universal karena peta vektor donor (pDONR menunjukkan bahwa amplifikasi denga koloni memerlukan primer M13-Forward primer M13-Reverse (Lampiran Elektroforegram PCR koloni setela menunjukkan bahwa ada 7 dari yang diujikan mengandung gen STS. ditunjukkan dengan adanya pita sekitar 1500 pb setelah elektroforesis. dari 7 koloni hanya 2 koloni saja y benar bersih dari pengotor, yaitu koloni 2 dan nomor 14 (Gambar 9).
Koloni bakteri yang telah plasmid rekombinan selanjutnya ke dalam media Luria Bertani (LB) berisi sumber nutrisi untuk pertumbuhan bakteri. Media LB mer
10
reaction). Reaksi klon ekspresi dua situs attB
STS pada vektor ditransformasikan juga seleksi transforman melihat koloni putih ada media tersebut tumbuh relatif sel kompeten yang keefektifannya. diduplikasi untuk membawa gen kontaminasi, selanjutnya plasmid rekombinan
tumbuh setelah da metode
Koloni Transforman PCR Koloni dan mbinan
untuk memastikan tumbuh setelah mengandung Metode PCR koloni setelah reaksi BP primer universal M13
(pDONRTM 221) plifikasi dengan PCR Forward dan Lampiran 6). CR koloni setelah reaksi BP 7 dari 14 koloni gen STS. Hal ini nya pita berukuran elektroforesis. Namun koloni saja yang
benar-aitu koloni nomor
12000 pb
1650 pb 1000 pb
100 pb
M 1 2 3 4
Gambar 9 Elektroforegram PCR rekombinasi gen S vektor donor; (M) 1 Kb Plus DNA koloni bakteri.
media kompleks karena terd ekstrak yeast (ragi), dan berfungsi sebagai sumber asam peptida, sedangkan ekstrak yeast kebutuhan nitrogen, gula, organik dan anorganik (Brown kultur koloni dalam media diisolasi DNA plasmidnya direkombinasikan pada vektor destinas
Isolasi DNA plasmid, y dengan kit GeneJETTM Plasmid Fermentas, pada prinsipnya dengan isolasi DNA Perbedaannya adalah ukuran lebih kecil dari DNA k konformasi keduanya berbeda. elektroforesis isolat DNA menghasilkan suatu pita, yan bahwa DNA plasmid telah berhasil Elektroforesis hasil isolasi sebenarnya bertujuan untuk mengece kualitatif keberhasilan isolasi plasmid yang telah diisolasi direkombinasikan ke dalam vekt
Hasil Konfirmasi Koloni Reaksi LR dengan Metode PCR Kol Isolasi DNA Plasmid Rekombinan
Metode PCR koloni juga mengecek koloni bakteri yang transformasi ke dalam E. coli rekombinasi LR. Metode PCR dilakukan setelah reaksi LR sepasang primer spesifik Gatewa Gateway STS-Forward dan Reverse. Vektor destinasi y
2 3 4 5 ... 14
regram PCR koloni inasi gen STS pada vektor donor; (M) marker
us DNA Ladder, (1-14) koloni bakteri.
na terdiri atas tripton, dan NaCl. Tripton mber asam amino dan yeastmenyediakan gula, serta nutrien (Brown 1991). Hasil media LB kemudian plasmidnya untuk pada vektor destinasi.
plasmid, yang dilakukan Plasmid MiniPrepdari prinsipnya hampir sama DNA kromosom. ukuran DNA plasmid DNA kromosom, dan
a berbeda. Hasil DNA plasmid pita, yang menunjukkan telah berhasil diisolasi. isolasi plasmid untuk mengecek secara isolasi plasmid. DNA diisolasi selanjutnya ke dalam vektor destinasi.
Koloni Transforman ode PCR Koloni dan mid Rekombinan
koloni juga dilakukan untuk bakteri yang tumbuh setelah E. coli pada tahap Metode PCR koloni yang si LR menggunakan spesifik Gateway, yaitu dan Gateway STS-destinasi yang digunakan
pada tahap rekombinasi LR ini ada pGD625, pARC983, dan pDEST PCR koloni ini memungkinkan koloni bakteri yang tumbuh amplifikasi gen STS yang disisipka vektor destinasi dengan primer spesifik.
Elektroforegram PCR koloni setelah LR pada gen STS yang disisipka pGD625 menunjukkan bahwa 3 dari 3
M 1 2 3
Gambar 10 Elektroforegram PCR koloni rekombinasi gen ST vektor destinasi pGD6 marker 1 Kb Plus, (1 bakteri.
M 1 2 3
Gambar 11 Elektroforegram PCR rekombinasi gen ST vektor destinasi pARC9
(M) marker 1 Kb Plus, (1 koloni bakteri.
11
ini ada tiga, yaitu DEST. Tahapan mungkinkan konfirmasi tumbuh sekaligus disisipkan dalam gan primer spesifik.
koloni setelah reaksi disisipkan dalam jukkan bahwa 3 dari 3 koloni
oforegram PCR koloni rekombinasi gen STS pada vektor destinasi pGD625; (M) marker 1 Kb Plus, (1-3) koloni
4
12
1500 pb
1 2 3 4 5 M
Gambar 12 Elektroforegram PCR koloni rekombinasi gen STS pada vektor destinasi pDEST; (1-5) koloni bakteri, (M) marker 1 Kb Plus.
yang diujikan semuanya mengandung gen STS. Hal ini ditunjukkan dengan pita yang berukuran sekitar 1500 pb pada elektroforegram (Gambar 10).
Ukuran pita sekitar 1500 pb tersebut juga digunakan sebagai acuan untuk konfirmasi koloni bakteri yang mengandung gen STS pada vektor destinasi pARC983 dan pDEST. Elektroforegram menunjukkan bahwa 3 dari 4 koloni yang diujikan pada vektor destinasi pARC983 (Gambar 11) dan 5 dari 5 koloni yang diujikan pada vektor destinasi pDEST (Gambar 12) positif mengandung gen STS.
Isolasi DNA plasmid kemudian dilakukan terhadap koloni bakteri yang positif mengandung gen STS. Hasil elektroforesis isolat DNA plasmid menunjukkan bahwa DNA plasmid telah berhasil diisolasi. DNA plasmid yang telah diisolasi selanjutnya ditransformasikan ke dalam Agrobacterium tumefaciens.
Hasil Transformasi Klon Ekspresi ke dalam Agrobacterium tumefaciens galur AGL0
Transformasi ke dalam Agrobacterium tumefaciensdilakukan untuk menguji ekspresi pengaruh gen sisipan pada tanaman. Sel Agrobacterium digunakan sebagai wahana yang membawa plasmid rekombinan untuk menginfeksi sel tanaman.Agrobacteriumyang digunakan adalah galur AGL0 karena memiliki virulensi yang tinggi dibandingkan galurAgrobacteriumlainnya.
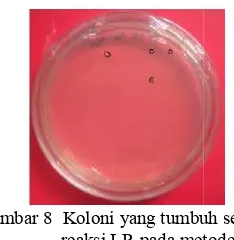
Transformasi klon ekspresi ke dalam A. tumefaciens menggunakan metode kejut dingin (cool shock) lalu dilanjutkan dengan metode kejut panas (heat shock). Lonjakan suhu dari sekitar -196 oC (inkubasi dalam N2 cair) ke suhu 37 oC (inkubasi dalam water bath) menyebabkan membran sel Agrobacteriummenjadi tidak selektif terhadap molekul asing sehingga plasmid rekombinan yang berisi gen sisipan dapat masuk. Campuran sel kompeten AGL0 dan klon ekspresi kemudian disebar ke media LA yang mengandung antibiotik kanamisin dan rifampisin lalu diinkubasi dalam kondisi gelap. Kanamisin digunakan karena vektor destinasi yang digunakan memiliki marka seleksi berupa resistensi terhadap antibiotik kanamisin, sedangkan rifampisin digunakan untuk membunuh E. coli. Inkubasi dalam keadaan gelap dilakukan karena A. tumefaciens merupakan bakteri tanah yang sensitif terhadap cahaya, sehingga perlu dikondisikan seperti habitat aslinya.
Hasil transformasi menunjukkan terbentuknya koloni berwarna putih pada media LA yang mengandung kanamisin 50 ppm dan rifampisin 50 ppm (Gambar 13). Koloni yang tumbuh berjumlah masing-masing 1 koloni untuk setiap vektor destinasi yang digunakan. Koloni yang tumbuh merupakan koloni yang mengandung klon ekspresi, yaitu klon yang membawa gen STS. Jumlah koloni yang tumbuh di media saat transformasi ke A. tumefaciens lebih sedikit dibandingkan saat transformasi ke E. coli. Hal ini terjadi karena A. tumefaciens memiliki jumlah salinan (copy number) yang lebih sedikit dibandingkan dengan E. coli (Brown 1991).
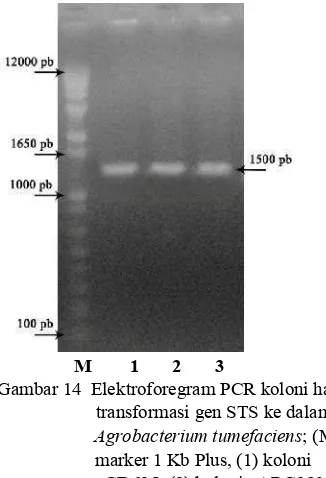
Koloni bakteri yang tumbuh kemudian diuji dengan metode PCR koloni untuk memastikan bahwa koloni tersebut mengandung klon ekspresi. Primer yang digunakan adalah primer spesifik Gateway.
M 1 2 3
Gambar 14 Elektroforegram PCR koloni hasil transformasi gen STS ke dalam Agrobacterium tumefaciens; (M)
marker 1 Kb Plus, (1) koloni pGD625, (2) koloni pARC983, (3) koloni pDEST.
Elektroforegram PCR koloni menunjukkan bahwa setiap koloni yang diujikan mengandung gen STS yang disisipkan karena pita yang dihasilkan berada pada kisaran 1500 pb (Gambar 14). A. tumefaciens yang telah mengandung gen STS selanjutnya disimpan dalam stok gliserol pada suhu sekitar -70 oC untuk kemudian ditransfer ke dalam tanaman pada penelitian selanjutnya.
SIMPULAN DAN SARAN
Simpulan
Gen stilbena sintase (STS) telah berhasil disisipkan pada vektor ekspresi dengan menggunakan metode Gateway. Hal tersebut ditunjukkan oleh hasil konfirmasi gen STS setelah reaksi BP maupun reaksi LR yang menunjukkan hasil sekitar 1500 pb. DNA plasmid dalam vektor ekspresi juga telah berhasil ditransformasikan ke dalam Agrobacterium tumefaciens sehingga siap ditransfer ke dalam tanaman.
Saran
Penelitian lebih lanjut tentang transformasi Agrobacterium tumefacienske dalam tanaman perlu dilakukan untuk mengetahui keberhasilan ekspresi gen stilbena sintase (STS) dalam hal membuat tanaman resisten terhadap penyakit busuk pangkal batang.
DAFTAR PUSTAKA
Bernard P, Couturier M. 1992. Cell killing by the F plasmid ccdB protein involves poisoning of DNA-topoisomerase II complexes. J. Mol. Biol. 226:735-745.
[Biotek UnUd] Bioteknologi Universitas Udayana. 2008. Mekanisme molekuler induksi tumor crown gall oleh Agrobacterium tumefaciens. [terhubung berkala]. http://fp.unud.ac.id/. [4 April 2011].
Breuil AC et al. 1999. Characterization of a pterostilbene dehydrodimer produced by laccase of Botrytis cinerea. Phytopathology89:298-302.
Brown TA. 1991. Pengantar Kloning Gena. Muhammad SA, penerjemah; Praseno, editor. Yogyakarta: Yayasan Essentia Medica. Terjemahan dari: Gene Cloning an Introduction.
Deacon J. 2002. Biology and control of crown gall (Agrobacterium tumefaciens). [terhubung berkala]. http://helios.bto.ed.ac.uk/. [4 April 2011].
Donepudi A. 2011. What is a PCR? [terhubung berkala]. http://protocolpedia.com/. [2 April 2011].
Escobar MA, Dandekar AM. 2003. Agrobacterium tumefaciensas an agent of disease. Plant Scie.8:380-386.
Ferguson KA. 1964. Starch-gel electrophoresis-application to the classification of pituitary proteins and polypeptides. Metabolism 13(10):985-1002.
Fermentas. 2006. GeneJETTM Plasmid MiniPrep Kit. Canada: Life Science.
Hain R et al. 1993. Disease resistance results from foreign phytoalexin expression in a novel plant. Nature361:153-156.
Hartley JL, Temple GF, Brasch MA. 2000. DNA cloning using in vitro site-spesific recombination. Genome Research 10:1788-95.
M 1 2 3
Gambar 14 Elektroforegram PCR koloni hasil transformasi gen STS ke dalam Agrobacterium tumefaciens; (M)
marker 1 Kb Plus, (1) koloni pGD625, (2) koloni pARC983, (3) koloni pDEST.
Elektroforegram PCR koloni menunjukkan bahwa setiap koloni yang diujikan mengandung gen STS yang disisipkan karena pita yang dihasilkan berada pada kisaran 1500 pb (Gambar 14). A. tumefaciens yang telah mengandung gen STS selanjutnya disimpan dalam stok gliserol pada suhu sekitar -70 oC untuk kemudian ditransfer ke dalam tanaman pada penelitian selanjutnya.
SIMPULAN DAN SARAN
Simpulan
Gen stilbena sintase (STS) telah berhasil disisipkan pada vektor ekspresi dengan menggunakan metode Gateway. Hal tersebut ditunjukkan oleh hasil konfirmasi gen STS setelah reaksi BP maupun reaksi LR yang menunjukkan hasil sekitar 1500 pb. DNA plasmid dalam vektor ekspresi juga telah berhasil ditransformasikan ke dalam Agrobacterium tumefaciens sehingga siap ditransfer ke dalam tanaman.
Saran
Penelitian lebih lanjut tentang transformasi Agrobacterium tumefacienske dalam tanaman perlu dilakukan untuk mengetahui keberhasilan ekspresi gen stilbena sintase (STS) dalam hal membuat tanaman resisten terhadap penyakit busuk pangkal batang.
DAFTAR PUSTAKA
Bernard P, Couturier M. 1992. Cell killing by the F plasmid ccdB protein involves poisoning of DNA-topoisomerase II complexes. J. Mol. Biol. 226:735-745.
[Biotek UnUd] Bioteknologi Universitas Udayana. 2008. Mekanisme molekuler induksi tumor crown gall oleh Agrobacterium tumefaciens. [terhubung berkala]. http://fp.unud.ac.id/. [4 April 2011].
Breuil AC et al. 1999. Characterization of a pterostilbene dehydrodimer produced by laccase of Botrytis cinerea. Phytopathology89:298-302.
Brown TA. 1991. Pengantar Kloning Gena. Muhammad SA, penerjemah; Praseno, editor. Yogyakarta: Yayasan Essentia Medica. Terjemahan dari: Gene Cloning an Introduction.
Deacon J. 2002. Biology and control of crown gall (Agrobacterium tumefaciens). [terhubung berkala]. http://helios.bto.ed.ac.uk/. [4 April 2011].
Donepudi A. 2011. What is a PCR? [terhubung berkala]. http://protocolpedia.com/. [2 April 2011].
Escobar MA, Dandekar AM. 2003. Agrobacterium tumefaciensas an agent of disease. Plant Scie.8:380-386.
Ferguson KA. 1964. Starch-gel electrophoresis-application to the classification of pituitary proteins and polypeptides. Metabolism 13(10):985-1002.
Fermentas. 2006. GeneJETTM Plasmid MiniPrep Kit. Canada: Life Science.
Hain R et al. 1993. Disease resistance results from foreign phytoalexin expression in a novel plant. Nature361:153-156.
Hartley JL, Temple GF, Brasch MA. 2000. DNA cloning using in vitro site-spesific recombination. Genome Research 10:1788-95.
KONSTRUKSI GEN STILBENA SINTASE PADA VEKTOR
EKSPRESI DENGAN METODE GATEWAY DAN
TRANSFORMASI PADA
Agrobacterium
sp.
IBRAHIM FEBRIZKY
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
M 1 2 3
Gambar 14 Elektroforegram PCR koloni hasil transformasi gen STS ke dalam Agrobacterium tumefaciens; (M)
marker 1 Kb Plus, (1) koloni pGD625, (2) koloni pARC983, (3) koloni pDEST.
Elektroforegram PCR koloni menunjukkan bahwa setiap koloni yang diujikan mengandung gen STS yang disisipkan karena pita yang dihasilkan berada pada kisaran 1500 pb (Gambar 14). A. tumefaciens yang telah mengandung gen STS selanjutnya disimpan dalam stok gliserol pada suhu sekitar -70 oC untuk kemudian ditransfer ke dalam tanaman pada penelitian selanjutnya.
SIMPULAN DAN SARAN
Simpulan
Gen stilbena sintase (STS) telah berhasil disisipkan pada vektor ekspresi dengan menggunakan metode Gateway. Hal tersebut ditunjukkan oleh hasil konfirmasi gen STS setelah reaksi BP maupun reaksi LR yang menunjukkan hasil sekitar 1500 pb. DNA plasmid dalam vektor ekspresi juga telah berhasil ditransformasikan ke dalam Agrobacterium tumefaciens sehingga siap ditransfer ke dalam tanaman.
Saran
Penelitian lebih lanjut tentang transformasi Agrobacterium tumefacienske dalam tanaman perlu dilakukan untuk mengetahui keberhasilan ekspresi gen stilbena sintase (STS) dalam hal membuat tanaman resisten terhadap penyakit busuk pangkal batang.
DAFTAR PUSTAKA
Bernard P, Couturier M. 1992. Cell killing by the F plasmid ccdB protein involves poisoning of DNA-topoisomerase II complexes. J. Mol. Biol. 226:735-745.
[Biotek UnUd] Bioteknologi Universitas Udayana. 2008. Mekanisme molekuler induksi tumor crown gall oleh Agrobacterium tumefaciens. [terhubung berkala]. http://fp.unud.ac.id/. [4 April 2011].
Breuil AC et al. 1999. Characterization of a pterostilbene dehydrodimer produced by laccase of Botrytis cinerea. Phytopathology89:298-302.
Brown TA. 1991. Pengantar Kloning Gena. Muhammad SA, penerjemah; Praseno, editor. Yogyakarta: Yayasan Essentia Medica. Terjemahan dari: Gene Cloning an Introduction.
Deacon J. 2002. Biology and control of crown gall (Agrobacterium tumefaciens). [terhubung berkala]. http://helios.bto.ed.ac.uk/. [4 April 2011].
Donepudi A. 2011. What is a PCR? [terhubung berkala]. http://protocolpedia.com/. [2 April 2011].
Escobar MA, Dandekar AM. 2003. Agrobacterium tumefaciensas an agent of disease. Plant Scie.8:380-386.
Ferguson KA. 1964. Starch-gel electrophoresis-application to the classification of pituitary proteins and polypeptides. Metabolism 13(10):985-1002.
Fermentas. 2006. GeneJETTM Plasmid MiniPrep Kit. Canada: Life Science.
Hain R et al. 1993. Disease resistance results from foreign phytoalexin expression in a novel plant. Nature361:153-156.
Hartley JL, Temple GF, Brasch MA. 2000. DNA cloning using in vitro site-spesific recombination. Genome Research 10:1788-95.
14
Invitrogen. 2003. Gateway® Technology: A universal technology to clone DNA sequence for functional analysis and expression in multiple systems. California: Life Technologies.
Invitrogen. 2010. Platinum® Taq DNA Polymerase. California: Life Technologies.
Invitrogen. 2010. PureLinkTM Quick Gel Extraction Kit. California: Life Technologies.
Jones HD, Doherty A, Wu H. 2005. Review of methodologies and a protocol for the Agrobacterium-mediated transformation of wheat. Plant Methods. 1:5-14.
Karimi M, Depicker A, Hilson P. 2007. Recombinational cloning with plant gateway vectors. Plant Physiol. 145:1144-54.
Kennedy S, Oswald N. 2011. PCR Troubleshooting and Optimization: The essential guide. Norwich: Caister Academic Pr.
Kolpack A, Loschelder H. 2008. Gateway-Technologie: potenzial und anwendungen in der molekularen pflanzenforschung. [terhubung berkala]. http://www.ruhr-uni-bochum.de/. [14 April 2011].
Landy A. 1989. Dynamic, structural, and regulatory aspects of lambda site-spesific recombination. Ann. Rev. Biochem. 58:913-949.
Lewis M. 2001. DNA extraction from agarose gels (basic method). [terhubung berkala]. http://www.methodbook.net/. [14 Agustus 2011].
Lilis E. 2009. Konstruksi DNA rekombinan pCAMBIA 1303-stilbena sintase pencegah busuk akar kelapa sawit [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Lubis AU. 1992. Kelapa Sawit di Indonesia. Sumatera Utara: Pusat Penelitian Perkebunan Marihat.
McCullen CA, Binns AN. 2006. Agrobacterium tumefaciens and plant cell interactions and activities required for
interkingdom macromolecular transfer. Annu. Rev. Cell Dev. Biol.22:101-127.
McPherson M, Moller S. 2006. PCR. Second Edition. Abingdon: Taylor & Francis Group.
Nester E. 2008. Agrobacterium: the natural genetic engineer 100 years later. [terhubung berkala]. http://www.apsnet.org/. [4 April 2011].
[PPKS] Pusat Penelitian Kelapa Sawit. 2009. Penyakit busuk pangkal batang kelapa sawit (Ganoderma boninense) dan pengendaliannya. [terhubung berkala]. http://pustaka.litbang.deptan.go.id/. [24 Desember 2010].
Rolfs C, Kindl H. 1984. Stilbene synthase and chalcone synthase. Plant Physiol. 75:489-492.
Rothman B. 2011. Agarose gel electrophoresis. [terhubung berkala]. http://people.rit.edu/. [3 April 2011].
Sambrook J, Russell DW. 2001. Molecular Cloning: A laboratory manual. Third Edition. New York: Cold Spring Harbor Laboratory.
Sbaghi M, Jeandet P, Faivre B, Bessis R, Fournioux JC. 1995. Development of methods using phytoalexin (resveratrol) assessment as a selection criterion to screen grapevine in vitro cultures for resistance to grey mould (Bortrytis cinerea). Euphytica86:41-47.
Schubert R et al. 1997. An ozone-responsive region of the grapevine resveratrol synthase promoter differs from the basal pathogen-responsive sequence. Plant. Mol. Biol.34:417-426.
[SIB] Swiss Institute of Bioinformatics. 2007. Stilbene synthase. [terhubung berkala]. http://www.expasy.org/. [25 Januari 2011].
Smith JE. 2004. Biotechnology. Fourth Edition. Inggris: Cambridge University Pr.
Triastuti J. 2007. Pengklonan gen. [terhubung berkala]. http://fpk.unair.ac.id/. [31 Maret 2011].
15
Winarno FG, Agustinah W. 2007. Pengantar Bioteknologi. Edisi Revisi. Bogor: M-BRIO Pr.
Xu W et al. 2011. Expression pattern, genomic structure, and promoter analysis of the gene encoding stilbene synthase from Chinese wild Vitis pseudoreticulata. J. Exp. Bot. 62(8):2745-61.
Yuwono T. 2005. Biologi Molekular. Jakarta: Erlangga.
Gambar


Dokumen terkait
Simulasi yang dilakukan untuk melihat kinerja sistem proteksi relai OCR dari gangguan 3 fasa yang diberikan, dengan luas penampang yang digunakan pada feeder Singapure Gardu Induk
Segala puji dan syuur penulis panjatkan atas kehadirat Allah SWT yang telah memberikan rahmat dan hidayah, sehingga penulis dapat menyelesaikan penyusunan
Equity Ratio, Return of Investment, Harga Emas, Harga Minyak, Indeks DJIA, dan Kurs sebagai variabel-variabel fundamental dan teknikal, variabel manakah yang
Berdasarkan hasil penelitian tersebut, reaktor sistem constructed wetland yang digunakan dalam penelitian ini belum efektif dalam mengolah air limbah laundry
Maka peneliti menghubungkan antara pendekatan mengajar dengan minat belajar matematika siswa kelas VIII B MTs Assafi’iyah Gondang Tulungagung,
Beberapakarakteristik individu yang diduga menjadi faktor yang mempengaruhi tingkat kepuasan pasien adalah; pendidikan, umur, jenis kelamin, pekerjaan, kondisi ekonomi
Udio pouzdanosti izvora kod SDP-a iznosi u promatranom razdoblju približno 0,8 a kod MOST-a 0,9 a najveće izvore prihoda također čine prihodi po posebnim propisima iz
Berdasarkan pada permasalahan yang ter- ungkap dalam wawancara, maka penting untuk dilakukan penelitian guna melihat pengaruh workplace spirituality dan