1 BAB I
PENDAHULUAN
A. Latar Belakang
Kimia Analisis adalah bagian dari ilmu kimia yang bertujuan untuk mengetahui komponen atau komposisi suatu zat atau senyawa anorganik, organik, hasil sintesis maupun biosintesis di dalam campurannya. Kimia analisis dibagi dalam 2 bidang yaitu Analisa Kualitatif dan Kuantitatif. Analisa kualitatif adalah suatu kegiatan yang bertujuan untuk mengetahui jenis/ identitas sedangkan Analisa kuantitatif bertujuan untuk mengetahui jumlah dan komposisi zat. (Harmita, 2006)
Berdasarkan pengukuran, analisa kuantitatif dibagi atas 3 bagian yaitu analisa titrimetri, analisa gravimetrik dan analisa instrumental. Analisa titrimetri melibatkan pengukuran volume suatu larutan dengan konsentrasi yang diketahui yang diperlukan untuk bereaksi dengan analit.
Nitrimetri merupakan cara analisa volumetri yang berdasarkan pada reaksi pembentukan garam diazonium. Garam diazonium itu terbentuk dari hasil reaksi antara senyawa yang mengandung gugus amin aromatis bebas, pada suhu di bawah 15°C dalam senyawa asam. Titrasi diazotasi berdasarkan pada pembentukan garam diazonium dari gugus amin aromatis bebas yang direaksikan dengan asam nitrit, dimana asam nitrit ini diperoleh dengan cara mereaksikan natrium nitrit dengan suatu asam. (Harmita, 2006)
Senyawa-senyawa yang dapat ditentukan dengan metode nitrimetri antara lain golongan sulfonamida seperti sulfamerazin, sulfadiazin dan sulfanilamid. Senyawa-senyawa ini dalam dunia farmasi sangat bermanfaat seperti sulfanilamid sangat berguna sebagai obat antimikroba. Selain senyawa-senyawa tersebut, pemanis buatan seperti natrium siklamat
2 bisa ditetapkan kadarnya menggunakan metode nitrimetri. Melihat kegunaannya maka nitrimetri merupakan salah satu metode analisis yang diperlukan untuk menganalisis senyawa-senyawa tersebut.
B. Tujuan Penulisan
1. Mengenal metode analisis kuantitatif secara nitrimetri 2. Mengetahui persyaratan titrasi secara nitrimetri
3 BAB II
TINJAUAN PUSTAKA
A. Pengertian Nitrimetri
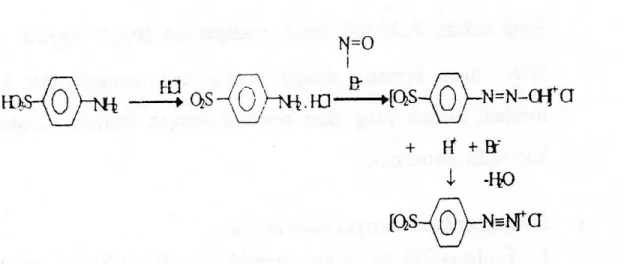
Nitrimetri adalah metode titrasi yang menggunakan NaNO2 sebagai pentiter dalam suasana asam. Pada suasana asam, NaNO2 berubah menjadi HNO2 (asam nitrit) yang akan bereaksi dengan sampel yang dititrasi dan membentuk garam diazonium. Pembentukan garam diazonium berjalan lambat, oleh karena itu untuk mempercepatnya dapat ditambahkan KBr sebagai katalis. Reaksi pembentukan garam diazonium adalah sebagai berikut :
NaNO2 + HCl → NaCl + HONO
Ar-NH2 + HONO + HCl → Ar-N2Cl (garam diazonium) + H2O
Gambar 1. Reaksi pembentukan garam diazonium pada amin aromatik primer Titrasi nitrimetri merupakan titrasi yang dipergunakan dalam analisa senyawa-senyawa organik, khususnya untuk persenyawaan amina primer. Penetapan kuantitas zat didasari oleh reaksi antara fenil amina primer (aromatik) dengan natrium nitrit dalam suasana asam yang membentuk garam diazonium dan dikenal sebagai reaksi diazotasi. Untuk membuat suasana asam umumnya digunakan asam klorida.
Dalam nitrimetri, berat ekivalen suatu senyawa sama dengan berat molekulnya karena 1 mol senyawa bereaksi dengan 1 mol asam nitrit dan menghasilkan 1 mol garam
4 diazonium. Dengan alasan ini pula, untuk titrasi nitrimetri konsentrasi larutan baku sering dinyatakan dengan molaritas, karena molaritasnya sama dengan normalitasnya.
Titrasi nitrimetri umum digunakan untuk penetapan sebagian besar obat sulfonamida dalam Farmakope dan sediaannya, juga obat-obat lain jika titrasi nitrimetri ini sesuai untuk digunakan.
B. Prinsip Nitrimetri
Prinsip titrasi nitrimetri adalah reaksi diazotasi, yaitu :
1. Pembentukan garam diazonium dari gugus amin aromatik primer (amin aromatik sekunder dan gugus nitro aromatik). Contoh zat yang memiliki gugus amin aromatik primer adalah benzokain. Contoh zat yang memiliki gugus amin aromatis sekunder adalah parasetamol dan fenasetin. Contoh zat yang memiliki gugus nitroaromatik adalah kloramfenikol.
2. Pembentukan senyawa nitrosamine dari amin alifatik sekunder. Contoh zat yang mempunyai gugus amin alifatis adalah Na siklamat.
3. Pembentukan senyawa azo dari gugus hidrazida. Contoh zat yang memiliki gugus hidrazida adalah INH.
4. Pemasukan gugus nitro yang jarang terjadi karena sulitnya titrasi dengan menggunakan asam nitrit dalam suasana asam.
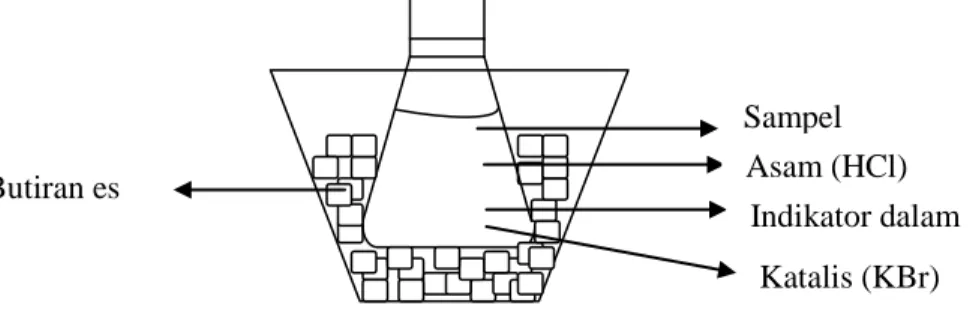
Reaksi diazotasi tidak stabil dalam suhu kamar,karena garam diazonium yang terbentuk mudah terdegradasi membentuk senyawa fenol dan gas nitrogen. Sehingga reaksi dilakukan pada suhu dibawah 15°C. Untuk mendapatkan suhu dibawah 15°C dapat dilakukan dengan merendam erlenmeyer yang berisi sampel dalam bejana berisi batu es.
Gambar 2. Proses pendinginan sampel sebelum titrasi Sampel
Asam (HCl) Indikator dalam
Katalis (KBr) Butiran es
5 C. Syarat-syarat Titrasi Nitrimetri
Hal-hal yang perlu diperhatikan dalam titrasi nitrimetri adalah : 1. Suhu
Pada saat melakukan titrasi, suhu harus berada antara 5-15° C, walaupun sebenarnya pembentukan garam diazonium berlangsung pada suhu yang lebih rendah yaitu 0-5° C. Pada temperatur 5-15° C digunakan KBr sebagai stabilisator. Titrasi tidak dapat dilakukan pada suhu tinggi karena :
HNO2 yang terbentuk akan menguap pada suhu tinggi Garam diazonium yang terbentuk akan terurai menjadi fenol 2. Keasaman
Titrasi ini berlangsung pada pH ± 2 hal ini dibutuhkan untuk : Mengubah NaNO2 menjadi HNO2
Pembentukan garam diazonium 3. Kecepatan Reaksi
Reaksi diazotasi berlangsung lambat sekali, sehingga agar reaksi sempurna maka titrasi harus dilakukan perlahan-lahan dan dengan pengocokan yang kuat. Frekuensi tetesan pada awal titrasi kira-kira 1 ml/menit, lalu menjelang titik akhir menjadi 2 ml/menit. Untuk menentukan titik akhir nitrimetri dapat digunakan 2 macam indikator, yaitu :
Indikator dalam
Yaitu indikator yang digunakan dengan cara memasukkan indikator tersebut kedalam larutan yang akan dititrasi, contohnya tropeolin O.O dan metilen blue (5:3).
Indikator Luar
Yaitu indikator yang dipakai tidak dengan memasukkan ke dalam larutan yang dititrasi tetapi hanya dengan menggunakan larutan yang akan diperiksa pada indikator ini pada saat titik akhir hampir dicapai. Contohnya pasta kanji Iodida. D. Larutan Titer, Baku Primer dan Pembakuan
Sebelum menetapkan kadar karena NaNO2 yang digunakan sebagai titran bahan baku primer, maka perlu dilakukan pembakuan terhadap NaNO2 terlebih dahulu. Sebagai bahan
6 baku primer untuk pembakuan NaNO2 digunakan asam sulfanilat. Asam sulfanilat ditimbang seksama sebanyak 50 mg, lalu dilarutkan dalam amonia 25% karena asam sulfanilat sukar larut dalam air. Amonia disini hanya digunakan untuk melarutkan jangan terlalu banyak, karena dapat mempengaruhi pH.
Untuk mengakali masalah ini, maka pada saat memasukkan asam sulfanilat kedalam erlenmeyer usahakan terlokalisasi pada satu titik, agar tidak diperlukan banyak ammonia untuk melarutkan. Setelah seluruh asam sulfanilat larut, larutan kemudian diasamkan dengan HCl 25% sampai pH 2, karena asam nitrit terbentuk pada suasana asam, kemudian tambahkan KBr yang pada titrasi nitrimetri diperlukan sebagai :
1. Katalisator, yaitu untuk mempercepat reaksi, karena KBr dapat mengikat NO2 membentuk nitrosobromid, yang akan meniadakan reaksi tautomerasi dari bentuk keto dan langsung membentuk enol.
2. Stabilisator, yaitu untuk mengikat NO2 agar asam nitrit tidak terurai atau menguap.
Cara Kerja Pembakuan Natrium nitrit :
a. Timbang seksama ± 50 mg asam sulfanilat, masukkan kedalam labu erlenmeyer 100 ml
b. Tambahkan 1-2 tetes ammonia 25% kocok sampai larut c. Tambahkan 20 ml air
d. Tambahkan 5 ml HCl P
e. Tambahkan ± 0,5 g serbuk KBr
f. Masukkan 5 tetes tropeolin OO 0,1% dan 3 tetes metilen blue 0,1%
g. Titrasi dengan NaNO2 0,1 M sambil diaduk kuat sampai terjadi perubahan warna dari ungu kebiru (dengan indikator dalam) dan terjadi goresan warna biru pada pasta kanji iodida yang terulang lagi setelah digunakan 1 menit kemudian (dengan indikator luar).
Reaksi yang terjadi pada pembakuan NaNO2 adalah NaNO2 + HCl HNO2 + NaCl
H2O + HCl H2O+ + Cl
-HNO2 + H3O + Br- N=O + 2H2O Br
7 Setelah KBr ditambahkan lalu ditambahkan indikator dalam yang berupa campuran treopilin OO dan metilen blue dengan perbandingan 5:3 digunakan campuran indikator, karena perubahan warna tropeolin OO dari warna merah menjadi kuning. Karena warna kuning tidak jelas, maka untuk memperoleh titik akhir diperlukan metilen blue agar pada titik akhir terlihat warna biru. Sehingga dengan mencampur kedua indikator ini akan terjadi perubahan warna dari violet menjadi biru.
Reaksi dari indikator adalah :
E. Indikator
Pada titrasi nitrimetri penetuan titik akhir titrasi dapat menggunakan indikator luar, indikator dalam dan secara potensiometri.
Indikator Luar
Indikator luar yang digunakan adalah pasta kanji-iodida atau dapat pula menggunakan kertas kanji-iodida. Ketika larutan digoreskan pada pasta atau kertas, adanya kelebihan asam nitrit akan mengoksidasi iodida menjadi iodium dan dengan adanya kanji atau amylum akan menghasilkan warna biru segera. Indikator kanji-iodida
8 ini peka terhadap kelebihan 0,05 – 0,10 ml natrium nitrit dalam 200 ml larutan. Reaksi yang terjadi dapat dituliskan sebagai berikut :
NaNO2 + HCl HNO2 + NaCL KI + HCL KCL + HI
2 HI + 2 HONO I2 + 2 NO + 2 H2O I2 + kanji kanji iod (biru)
Titik akhir titrasi tercapai apabila pada penggoresan larutan yang dititrasi pada pasta kanji–iodida atau kertas kanji–iodida akan terbentuk warna biru segera sebab warna biru juga terbentuk beberapa saat setelah dibiarkan di udara. Hal ini disebabkan karena oksidasi iodida oleh udara (O2) menurut reaksi :
4 KI + 4 HCL + O2 2H2O + 2 I2 +4 KCL I2 + kanji kanji iod (biru)
Untuk meyakinkan apakah benar – benar sudah terjadi titik akhir titrasi, maka pengujian seperti diatas dilakukan lagi setelah dua menit. Dengan indikator luar, dengan pasta kanji-KI mempunyai kelebihan dan kekurangan yaitu sebagai berikut :
Kelebihan :
a. Untuk beberapa zat lebih tepat dipakai karena perubahan warna lebih jelas. Kekurangan :
a. Cara kerja tidak praktis
b. Terlalu sering menguap menyebabkan adanya kemungkinan zat terbuang. c. Titrasi harus dilakukan pada suhu dibawah 150 C
d. Harus diketahui jumlah volume titran yang dibutuhkan. Bila tidak, titrasi akan berlangsung sangat lama yang berarti makin banyak larutan yang dititrasi hilang (karena digoreskan pada pasta kanji iodida untuk mengetahui titik akhir titrasi).
9 Dengan Indikator Dalam (Visual)
Dengan indikator dalam, terdiri atas campuran tropeolin OO dan Metilen Blue. Tropeolin OO merupakan indikator asam–basa yang berwarna merah dalam suasana asam dan berwarna kuning bila dioksidasikan oleh adanya kelebihan asam nitrit, sedangkan metilen blue sebagai pengkontras titik akhir titrasi akan terjadi perubahan warna sehingga pada titik akhir titrasi akan terjadi perubahan dari ungu menjadi biru sehingga hijau tergantung senyawa yang dititrasi.
Pada pemakaian Indikator dalam ini ternyata mempunyai kelebihan dan kekurangan yaitu sebgai berikut :
Kelebihan :
a. Cara kerja cepat dan praktis. b. Dapat dilakukan pada suhu kamar. Kekurangan :
a. Penggunaan terbatas hanya untuk beberapa zat saja, untuk beberapa zat lainnya perubahannya tidak jelas.
b. Perubahan warna yang terjadi pada titik akhir titrasi berbeda-beda untuk sampel yang berbeda.
Metode Potensiometri
Metode yang baik untuk menetapkan titik akhir titrasi nitrimetri adalah secara potensiometri, dengan menggunakan elektroda platina yang dicelupkan kedalam larutan titran. Pada saat tercapai titik akhir, akibat adanya asam nitrit yang bebas akan terjadi depolarisasi elektroda sehingga terjadi perubahan-perubahan arus yang mendadak diamati pada galvanometer.
Pada saat titik akhir titrasi (adanya kelebihan asam nitrit), akan terjadi depolarisasi elektroda sehingga akan terjadi perubahan arus yang sangat tajam sekitar + 0,80 Volt
10 sampai + 0,90 Volt. Metode ini sangat cocok untuk sampel dalam bentuk sedian sirup yang berwarna.
F. Sampel
Senyawa-senyawa yang dapat dianalisis menggunakan titrasi nitrimetri, antara lain :
1. Penetapan kadar senyawa-senyawa yang mempunyai gugus amin aromatis primer bebas seperti sulfanilamid.
2. Penetapan kadar senyawa-senyawa yang mana gugus amin aromatik terikat dengan gugus lain seperti suksinil sulfatiazol, ftalil sulfatiazol dan parasetamol. Pada penetapan kadar senyawa yang mempunyai gugus aromatik yang terikat dengan gugus lain seperti suksinil sulfatiazol harus dihidrolisis lebih dahulu sehingga diperoleh gugus amin aromatis bebas untuk selanjutnya bereaksi dengan natrium nitrit dalam suasana asam membentuk garam diazonium.
3. Senyawa – senyawa yang mempunyai gugus nitro aromatis seperti kloramfenikol. Senyawa – senyawa nitro aromatis dapat ditetapkan kadarnya secara nitrimetri setelah direduksi terlebih dahulu untuk menghasilkan senyawa amin aromatis primer. Kloramfenikol yang mempunyai gugus nitro aromatis direduksi terlebih dahulu dengan Zn / HCl untuk menghasilkan senyawa amin aromatis primer yang bebas yang selanjutnya bereaksi dengan asam nitrit untuk membentuk garam diazonium.
Dalam Farmakope Indonesia, titrasi nitrimetri digunakan untuk menetapkan kadar : benzokain; primakuin fosfat dan sediaan tabeltnya ; prokain HCl ; sulfasetamid ; natrium sulfasetamid ; sulfametazin ; sulfadoksin ; sulfametoksazol ; tertrakain ; dan tetrakain HCl.
11 H. Prosedur Kerja/Skema Kerja
Prosedur Kerja
1. Timbang seksama lebih kurang 500 mg sulfonamid atau sejumlah tertera pada masing-masing monografi
2. Masukkan kedalam gelas piala yang sesuai
3. Tambahkan 20 ml asam klorida P dan 50 ml air, aduk hingga larut, dinginkan hingga suhu lebih kurang 150C
4. Titrasi secara perlahan dengan natrium nitrit 0,1 M LV yang sebelumnya telah dibakukan terhadap Sulfonamida BPFI
5. Tetapkan titik akhir secara elektrometrik menggunakan elektrode yang sesuai (Platina-Kalomel atau Platina-Platina)
6. Tempatkan ujung buret dibawah permukaan larutan untuk menghindari oksidasi oleh udara terhadap natrium nitrit dan aduk perlahan dan pertahankan suhu lebih kurang 150C
Pada titrasi manual tambahkan titran hingga 1 ml mendekati titik akhir, kemudian tambahkan setiap kali 0,1 ml titran dengan selang waktu tidak kurang dari 1 menit.
12 Skema Kerja Titrasi Nitrimetri :
Timbang seksama ± 500 mg sulfonamid /sesuai yang tertera pada monografi
Tambah 20 ml HCl P + 50 ml air --> aduk
hingga larut
Dinginkan pada suhu
± 150C
Titrasi perlahan
dengan NaNO2
0,1 M LV Titik akhir ditetapkan
dengan elektrode yang sesuai (platinakalomel/ Platina-platina)
13 BAB III
PEMBAHASAN
Salah satu senyawa yang dapat ditetapkan kadarnya dengan metode nitrimetri adalah natrium sulfasetamida (C8H9NO3S.H2O). Sulfasetamida adalah senyawa golongan sulfonamide yang digunakan sebagai antibakteri.
Struktur kimianya dapat dilihat pada gambar berikut.
Gambar 3. Struktur kimia Sulfasetamida
Dari struktur kimianya, sulfasetamida memiliki gugus amin aromatik primer sehingga bisa ditetapkan kadarnya menggunakan metode nitrimetri.
Proses penetapan kadar sulfasetamida menggunakan titrasi nitrimetri adalah sebagai berikut :
1. Pembuatan larutan NaNO2 0,1 N
Timbang seksama 7,5 g natrium nitrit P dalam air secukupnya hingga 1000,0 ml 2. Pembakuan larutan NaNO2 0,1 N
Timbang saksama 500 mg sulfanilamida PK yang sebelumnya telah dikeringkan pada suhu 105° selama 3 jam
Masukkan ke dalam gelas kimia, tambahkan 50 ml air dan 5 ml HCl P aduk hingga larut.
Dinginkan hingga suhu 15°, tambahkan 25 g pecahan es.
Titrasi perlahan-lahan dengan larutan NaNO2, aduk kuat-kuat hingga pengaduk kaca yang dicelupkan ke dalam larutan tirasi dan disentuhkan pada kertas kanji iodide P memberikan warna biru seketika.
14 Titik akhir dicapai jika larutan titrasi setelah dibiarkan selama 1 menit, dan pengaduk kaca dimasukkan ke dalam larutan kemudian disentuhkan pada kertas kanji iodide P memberikan warna biru seketika.
Hitung normalitas larutan.
1 ml natrium nitrit 0,1 N ~ 17, 22 mg sulfanilamida 3. Penyiapan sampel
Timbang saksama 500 mg
Larutkan dalam campuran 75 ml air dan 10 ml asam klorida P Dinginkan hingga suhu 15°
4. Titrasi dan Penetapan Titik Akhir
Titrasi perlahan-lahan dengan NaNO2 0,1 N, aduk kuat
Menjelang titik akhir, celupkan pengaduk kaca ke dalam larutan titrasi
Sentuhkan/gores pengaduk pada kertas kanji iodida, terjadi warna biru seketika
Titik akhir dicapai apabila larutan titrasi setelah 1 menit dan pengaduk kaca dimasukkan ke dalam larutan ketika disentuhkan pada kertas kanji iodida terjadi warna biru seketika Kesetaraan : 1 ml NaNO2 0,1 N ~ 23,62 mg Sulfasetamida
15 BAB IV
PENUTUP
A. Kesimpulan
1. Titrasi nitrimetri adalah salah satu metode analisis kuantitatif dengan prinsip pembentukan garam diazonium
2. Titrasi nitrimetri digunakan untuk menganalisis sampel senyawa amin primer contohnya senyawa sulfonamida.
3. Titrasi nitrimetri harus dilakukan pada suhu dingin (15°), suasana asam dan reaksinya berlangsung lambat sehingga bisa ditambahkan katalisator berupa KBr
4. Titrasi nitrimetri menggunakan larutan NaNO2 sebagai larutan pentiter dengan indikator dalam tropeolin O.O dan metilen blue (5:3) dan indikator luar pasta kanji iodida.
B. Saran
1. Sebaiknya ditambahkan reaksi antara sulfasetamida dengan natrium nitrit saat titrasi 2. Sebaiknya penjelasan tentang indikator menggunakan gambar atau skema agar lebih
16 DAFTAR PUSTAKA
Cahyadi, W. 2005, Analisis dan Aspek Kesehatan Bahan Tambahan Pangan (hal.68-85). Bumi Aksara. Bandung.
Departemen Kesehatan RI. 1979. Farmakope Indonesia edisi III. Jakarta
Gandjar, I. Rohman, A. 2007. Kimia Farmasi Analisis (hal.164-167). Pustaka Pelajar. Yogyakarta.
Harmita. 2006. Analisis Kuantitatif Bahan Baku dan Sediaan Farmasi edisi I (hal 98-101). Departemen Farmasi FMIPA Universitas Indonesia. Depok.
Jeffrey,G.dkk. 1989. Vogel’s : Textbook of quantitative chemical analysis Fifth edition. Longman Scientific and Technical. New York.
Raymond,S. 2005. Frame of Chemical Analysis. Fakultas Farmasi Universitas Hasanuddin. Makassar.