VARIASI DNA KLOROPLAS Shorea leprosula Miq.
DI INDONESIA MENGGUNAKAN
PENANDA PCR-RFLP
RURI SITI RESMISARI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2006
PERNYATAAN
Dengan ini saya menyatakan bahwa tesis berjudul “Variasi DNA Kloroplas
Shorea leprosula Miq. di Indonesia Menggunakan Penanda PCR-RFLP ” adalah karya
saya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka dibagian akhir tesis ini.
Bogor, Agustus 2006
Ruri Siti Resmisari E051020291
ABSTRAK
RURI SITI RESMISARI. Variasi DNA Kloroplas Shorea leprosula, Miq di
Indonesia Menggunakan Penanda PCR-RFLP . Dibimbing oleh ISKANDAR
ZULKARNAEN SIREGAR and ULFAH JUNIARTI SIREGAR
Shorea leprosula, salah satu jenis dari famili Dipterocarpaceae yang mendominasi
hutan hujan tropis di Asia Tenggara. Dalam tesis ini Dipterocarpaceae terdiri dari banyak jenis yang mempunyai nilai ekonomis dan ekologis yang penting. Penanda PCR-RFLP digunakan untuk mencari variasi cpDNA Shorea leprosula di Indonesia. Sampel daun dikumpulkan dari 13 populasi yang berasal dari pulau Jawa, Sumatera dan Kalimantan. Penelitian dimulai dengan melakukan uji polimorfisme DNA untuk mencari variasi cpDNA dengan menggunakan kombinasi 4 primer dan 10 enzim restriksi. Hasil pengujian menujukkan bahwa hanya kombinasi rbcL – Alu I yang menghasilkan pita yang polimorfik. Kombinasi ini menghasilkan dua haplotipe, yaitu haplotipe 1 dan haplotipe 2. Haplotipe 1 merupakan haplotipe dominan yang ditemukan seluruh populasi, sedangkan haplotipe 2 hanya ditemukan di Bukit Tigapuluh dan PT Asialog di Sumatera, PT. ITCIKU di Kalimantan.
ABSTRACT
RURI SITI RESMISARI. Chloroplast DNA Variation of Shorea leprosula, Miq in
Indonesia assesed by PCR-RFLP Marker. Supervised by ISKANDAR
ZULKARNAEN SIREGAR and ULFAH JUNIARTI SIREGAR
Shorea leprosula is a member of Dipterocarpaceae that occurs predominately
in tropical rain forests of Southeast Asia. Dipterocarps consists of many economical and ecologically important species. In this paper PCR-RFLP markers were used to observe cpDNA variation of Shorea leprosula in Indonesia. Leaf samples from individual plants were collected from 13 populations in Java, Sumatra and Kalimantan islands. cpDNA polymorphism was assessed using combination of 4 primers and 10 enzyme restrictions. The result showed that only rbcL-Alu I combination gave polymorphic band s. From these polymorphic bands, two haplotypes were identified, namely haplotype 1 as dominant haplotype in all populations and haplotype 2 , which was found only at Bukit Tigapuluh National Park and Concession Asialog in Sumatra, and Concession ITCIKU in Kalimantan.
© Hak cipta milik Ruri Siti Resmisari, Iskandar Zulkarnaen Siregar, Ulfah Juniarti Siregar, tahun 2006
Hak cipta dilindungi
Dilarang mengutip dan memperbanyak tanpa izin tertulis dari Institut Pertanian Bogor, sebagian atau seluruhnya dalam bentuk apapun, baik cetak, fotocopy, mikrofilm dan sebagainya
VARIASI DNA KLOROPLAS Shorea leprosula Miq.
DI INDONESIA MENGGUNAKAN
PENANDA PCR-RFLP
RURI SITI RESMISARI
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains
Pada Program Studi Ilmu Pengetahuan Kehutanan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2006
Judul Tesis : Variasi DNA Kloroplas Shorea leprosula Miq. di Indonesia Menggunakan Penanda PCR-RFLP
Nama : Ruri Siti REsmisari
NIM : E051020291
Disetujui Komisi Pembimbing
Dr. Ir. Iskandar Z. Siregar, M.For.Sc Ketua
Dr. Ir. Ulfah Juniarti Siregar, M.Agr Anggota
Diketahui Ketua Program Studi
Ilmu Pengetahuan Kehutanan
Dr. Ir. Dede Hermawan, M.Sc
Dekan
Sekolah Pascasarjana
Dr. Ir. Khairil Anwar Notodiputro, MS
PRAKATA
Puji dan syukur penulis panjatkan kep ada Allah SWT atas segala rahmat dan hidayah-Nya sehingga penulis dapat menyelesaikan karya ilmiah yang berjudul Variasi DNA Kloroplas Shorea leprosula Miq. di Indonesia Menggunakan Penanda PCR-RFLP. Penelitian ini dilakukan mulai Maret 2005 hingga September 2005.
Tesis ini di bagi dalam 5 bab, pada bab I d iuraikan latar belakang, tujuan, serta ruang lingkup penelitian. Pada bab II disajikan tinjauan pustaka dengan tujuan untuk memberikan gambaran singkat tentang S. leprosula, keragaman genetik , DNA kloroplas dan penanda genetik. Bab III memberikan informasi mengenai metodologi yang digunakan dalam penelitian termasuk waktu, tempat, bahan dan alat yang digunakan serta metode analisis data yang digunakan. Hasil dan pembahasan disajikan pada Bab IV, pada bab ini dijelaskan tentang variasi cpDNA S. leprosula di Indonesia, kesimpulan dan saran disajikan pada Bab V.
Penulis menyampaikan banyak terima kasih kepada Dr. Ir. Iskandar Z. Siregar, M.For.Sc dan Dr. Ir. Ulfah Juniarti Siregar, M.Agr sebagai komisi pembimbing yang telah banyak membantu dan mengarahkan penulis dalam penulisan tesis ini. Ucapan terima kasih juga disampaikan kepada Departemen Silvikultur Institut Pertanian Bogor, Inst. of Forest Genetics and Forest Tree Breeding Faculty of Forest Sciences and Forest Ecology University of Goettingen Germany dan AUNP (Asean-Eu University Network Programe) yang telah memfasilitasi penulis dalam penelitian ini. Ungkapan terimakasih juga kami sampaikan kepada bapak, ibu, serta suami tercinta serta seluruh keluarga atas segala doa dan kasih sayangnya, serta semua pihak yang telah ikut membantu penulis mulai dari persiapan hingga selesainya tesis ini.
Semoga tesis ini bermanfaat.
Bogor, Agustus 2006
DAFTAR ISI
DAFTAR ISI...i
DAFTAR GAMBAR ...ii
DAFTAR TABEL...iii
DAFTAR LAMPIRAN ...iv
PENDAHULUAN ...1 Latar Belakang ...1 Permasalahan...4 Tujuan...4 Hipotesis ...4 Manfaat...4 TINJAUAN PUSTAKA...5
Shorea leprosula Miq...5
Keragaman Genetik ...6
DNA Kloroplas ...7
PCR (Polymerase Chain Reaction)...10
PCR-RFLP ...14
(Polymerase Chain Reaction - Restriction Fragment Length Polymorphisms).14 METODE PENELITIAN ...16
Tempat dan waktu penelitian ...16
Bahan dan Alat Penelitian...16
Prosedur Penelitian...16
HASIL DAN PEMBAHASAN ...25
Ekstraksi DNA ...25
Amplifikasi denga n PCR...27
Uji Polimorfisme ...28
Keragaman intra populasi...33
Konservasi Genetik Shorea leprosula...39
SIMPULAN DAN SARAN ...41
Simpulan...41
Saran...41
DAFTAR GAMBAR
Gambar 1. Rantai DNA ...9
Gambar 2. Letak cpDNA pada sel ...10
Gambar 3. Prinsip reaksi RCR ...12
Gambar 4. Proses amplifikasi PCR...13
Gambar 5. Bagan alur penelitian di laboratorium ...17
Gambar 6. Peta pengambilan contoh S. leprosula ...18
Gambar 7. Letak petB, psaA, trnLF dan rbcL pada peta plasmid cpDNA Nicotiana tabacum ...21
Gambar 8. Hasil Ekstraksi DNA S . leprosula ...25
Gambar 9. Elektrophoresisis cpDNA dengan berbagai pengenceran DNA dari S . leprosula ...26
Gambar 10. Elektroforegram hasil PCR cpDNA dengan berbagai primer : (a) petB, (b) psaA, (c) trnLF, (d) rbcL, M = marker bond ...28
Gambar 11. Elektroforegram hasil uji polimorfisme : (a) psaA-pst I (monomorfik), (b) petB-Hinf I (monomorfik), (d) rbcL-Alu I (polimorfik), M= marker bond...30
Gambar 12. Elektroforegram hasil pemotongan cpDNA dengan menggunakan kombinasi perlakuan rbcL-Alu 1 ...32
Gambar 13. Penyebaran cpDNA S. leprosula di Indonesia berdasarkan penanda PCR-RFLP dengan menggunakan rbcL-Alu1 ...35
Gambar 14. Dendogram populasi S. leprosula di Indonesia dengan penanda RFLP ...38
DAFTAR TABEL
Tabel 1. Lokasi pengambilam contoh S. leprosula ...18 Tabel 2. Komposisi bahan-bahan yang digunakan untuk PCR...22 Tabel 3. Pengkondisian suhu dan waktu pada mesin PCR untuk primer petB,
psaA, trnLFdan rbcL ...22
Tabel 4. Jenis enzim restrksi yang digunakan utuk memotong DNA...23 Tabel 5. Hasil uji polimorphisme ...31 Tabel 6. Haplotipe yang teridentifikasi pada 65 individu S. leprosula
berdasarkan PCR-RFLP terdapat dua haplotipe...33 Tabel 7. Frekuensi haplotipe dari 13 populasi ...34 Tabel 8. Hasil perhitungan AMOVA berdasarkan 65 individu yang berasal
dari 13 populasi...35 Tabel 9. Matrik signifikasi nilai (P value) pada level 0.05 ...36 Tabel 10. Jarak genetik S. leprosula berdasarkan analisis GSED...37
DAFTAR LAMPIRAN
Lampiran 1. Tahapan ekstraksi DNA...45 Lampiran 2. Elektroforegram S. leprosula di 13 populasi dengan rbcL-Alu I...46 Lampiran 3. Transformasi data dari hasil analisis cpDNA Shorea leprosula...51
PENDAHULUAN
Latar Belakang
Laju kerusakan hutan di Indonesia, berdasarkan data WALHI (Wahana Lingkungan Hidup Indonesia) tahun 2004, berada dalam situasi krisis dan kondisi yang sangat mengkhawatirkan. Pembalakan hutan, baik yang legal maupun ilegal, telah menyebabkan kerusakan hutan yang sudah tidak terkendali di hampir seluruh kawasan hutan Indonesia. Tingkat deforestasi saat ini telah mencapai 3,8 juta hektar per tahun (tahun 2004). Hal ini menunjukan bahwa Indonesia telah kehilangan hutannya seluas 7,2 hektar setiap menitnya. Berdasarkan data WWF (World Wildlife Fund) tahun 2002, pemerintah Indonesia mengakui bahwa kerusakan hutan Indonesia selama 50 tahun terakhir sekitar 40% dari tutupan hutannya (Harsono, 2004).
Tuntutan kebutuhan bahan baku kayu cenderung terus meningkat terutama jenis kayu keras seperti Jati (Tectona grandis) dan Meranti (Shorea spp.) (Handadhari, 2002). Laju pembalakan yang dilakukan sekarang kurang diikuti oleh rehabilitasi lahan yang seimbang. Selain itu, kegiatan pembalakan hutan juga tidak hanya menyebabkan hilangnya keanekaragaman hayati, hancurnya habitat-habitat satwa endemik, juga menyebabkan semakin merosotnya kualitas sumber daya alam Indonesia. Pengembangan skema pengalihan lapangan kerja penebangan hutan sebaiknya dialihkan ke dalam program rehabilitasi hutan dengan menggunakan dana rehabilitasi hutan. Hasil penelitian South-Central
Kalimatan Production Forest Project (SCKFP) kerjasama Dephut-Uni Eropa di
Kalimantan Selatan merekomendasikan rehabilitasi hutan yang dilakukan diantaranya dengan menanam Meranti (Shorea spp.).
Shorea leprosula merupakan salah satu jenis Meranti Merah yang tumbuh
di hutan hujan dataran rendah. Kayunya mudah dikerjakan dan tidak mudah mengkerut. Banyak digunakan sebagai bahan baku meubel, kayu lapis dan vinir. Termasuk ke dalam kelas awet dan kuat III – IV. Meranti jenis ini merupakan kayu unggulan yang memiliki nilai ekonomis tinggi, tetapi dengan eksploitasi yang terus menerus dan upaya pembudidayaan yang tidak seimbang, kayu jenis
meranti ini akan semakin langka pada masa mendatang. Budidaya meranti dalam skala besar (pola HTI) mempunyai kendala dalam pengadaan bibitnya (Murjahid, 2003). Ditambahkan oleh Sudarmonowati et al. (2004), bahwa kurang majunya pembangunan sektor kehutanan di Indonesia, karena kurang ketersediaan bibit yang bermutu. Dua diantara faktor penting yang berpengaruh pada penyediaan bibit bermutu adalah sumber bibit yang unggul dan teknik propagasi yang mapan. Untuk mewujudkan faktor penting ini, diperlukan satu penelitian untuk mengetahui potensi genetik yang ada, mengingat aspek genetik meranti masih sedikit keterangannya. Penelusuran variasi genetik penting dilakukan, sehingga sebelum dilakukan suatu program konservasi dan perbaikan genetik dalam upaya penyediaan bibit bermutu, informasi yang dibutuhkan sudah tersedia. Berdasarkan pada fenomena tersebut, mutlak tersedianya kondisi genetik yang memadai sehingga tercipta suatu sistem konservasi genetik yang mapan.
Analisis genetik merupakan cara yang dapat digunakan untuk menduga karakteristik genetik mengkonfirmasi sifat unggul yang telah diamati berdasarkan pengamatan morfologi di lapangan. Manfaat dari analisis genetik ini, antara lain selain dapat mendeteksi sifat unggul pada saat kecambah atau bahkan fase embrio untuk program pemuliaan bibit, juga menunjang program konservasi karena dapat mendeteksi tingkat kepunahan jenis di suatu lokasi jauh hari sebelum penurunan populasi tersebut jelas terlihat. Aplikasi nyata lainnya dari analisis genetik adalah hubungan anak, tetua, dan kerabatnya yang ditanam di lain tempat dapat diketahui, sehingga gambaran asal individu tersebut dapat diketahui. Teknik analisis genetik ini, juga lebih menghemat tenaga dan biaya karena dapat mencegah penanaman bibit yang tidak unggul. Manfaat lain dari analisis genetik ini adalah dapat mengetahui evolusi dari suatu jenis tanaman, mendeteksi keragaman atau keseragaman genetik suatu populasi, mendeteksi variasi somaklonal (terutama pada tananaman hasil kultur jaringan), sertifikasi tanaman tetua, identitas benih murni, dapat melakukan studi tentang genetik yang tahan hama dan atau penyakit, pemetaan genetik yang memberi informasi letak gen pada kromosom-kromosom yang mengatur sifat-sifat tertentu, sehingga dapat di introduksi atau di solasi untuk perbaikan mahluk hidup.
Teknik analisis yang banyak dikembangkan sekarang adala h berdasarkan markapenanda isozim dan markapenanda DNA. Pendugaan variasi genetik dengan teknik isozim merupakan teknik yang paling awal dikembangkan dan di aplikasikan pada tanaman. Masing- masingBerbagai teknik yang dikembangkann, masing- masing mempunyai kelemahan dan kelebihannya, hal ini disesuaikanjika dikaikan dengan tujuan dan biaya yang tersedia. MarkaPenanda DNA merupakan dasar untuk melihat adanya suatu perubahan sifat dengan mendeteksi perubahan urutan basa dan basa nukleotida DNA khas untuk setiap jenis protein atau enzim. MarkaPenanda DNA yang di maksud dapat berupaadalah markapenanda dominan dan ko-dominan. MarkaPenanda dominan adalah penanda berdasarkan ada atau tidaknya pita DNA yang muncul setelah elektroforesis, yang termasuk ke dalam markapenanda ini adalah RAPD (random amplified polymorphic DNAdna) dan RFLP (restriction fragment length polymorphism). Sedangkan markapenanda kodominan adalah penanda yang menghasilkan pita heterozigot dan homozigot. MarkaPenanda yang termasuk co-dominan adalah Mikrosatelit dan IsozimAFLP (amplified fragment length polymorphism). .
Menurut Finkeldey (2003), sumber DNA yang diteliti dengan markapenanda genetik ini sebagian besar terdapat dalam nukleus (99,9%). Sisanya yang 0,1% terdapat dalam organel tertentu. Organel yang mengandung DNA ialah terdapat pada plastida yang terdiri dari mitokondria dan kloroplas. Material genetik yang di analisis dari plastida biasanya hanya berasal dari sifat satu tetuanya, kalau tidak dari tetua jantannya saja atau hanya dari betinanya, sedangkan dengan material genetik yang diambil dari inti, analisis genetiknya bisa menunjukan dua tetuanya. Pada DNA kloroplas material genetik diturunkan dari tetua betina, tetapi bisa mendeteksi tetua genetik jantannya.
Melihat kondisi di atas dalam usaha melengkapi data mengenai keragaman genetik Meranti maka perlu dilakukan suatu penelitian yang dapat memberikan infomasi mengenai hal tersebut. Penulis memilih DNA kloroplas (cpDNA) sebagai bahan untuk analisis keragaman genetik Meranti dan teknik PCR–RFLP sebagai markapenanda genetik. Teknik ini sangat sederhana, cepat dan ekonomis, memiliki kisaran 50-3000 bp yang dapat dibedakan dan lebih sesuai bagi individu yang ditangani dalam jumlah banyak (Hillis et al, 1996).
Permasalahan
Kerusakan hutan dipterokarpa yang diakibatkan oleh deforestrasi seperti pembalakan hutan secara liar, kebakaran dan lainnya dapat berdampak pada penurunan populasi S. leprosula. Penurunan populasi ini menyebabkan terjadi penurunan sumberdaya genetik dari S. leprosula, oleh karena itu perlu segera dilakukan program konservasi genetik jenis ini. Penelitian tentang keragaman genetik S. leprosula sangat diperlukan untuk memberikan landasan ilmiah dalam penggunaan stategi konservasi genetik.
Tujuan
Tujuan dari penelitian ini adalah untuk :
1. Mengetahui variasi keragaman cpDNA S. leprosula, yaitu jumlah haplotiype berdasarkan PCR-RLFP, yaitu titik potong (restriction site) pada DNA fragmen hasil PCR dengan menggunakan enzim restriksi 2. Mengetahui variasi cpDNA di dalam dan antar populasi S. leprosula
Hipotesis
Hipotesis yang diuji adalah bahwa cpDNA S. leprosula di Indonesia memiliki variasi yang rendah, dimana pola yang dijumpai dapat digunakan untuk melacak atau membedakan populasi antar pulau.karena diwariskan secara maternal.
Manfaat
1. Hasil dari penelitian ini diharapkan dapat memberikan informasi tetang variasi genetik S. leprosula yang ada di Indonesia untuk kepentingan suatu program konservasi genetik yang berkesinambungan, dan pada akhirnya dapat digunakan untuk mendukungsuatu program pemuliaan dari jenis ini
2. Variasi cpDNA S. leprosula dapat digunakan untuk menentukan asal usul, serta aliran gen berupa migrasi benih dari jenis ini
TINJAUAN PUSTAKA
Shorea leprosula Miq. Aspek Botanis
Shorea leprosula termasuk ke dalam famili Dipterocarpaceae, Kelas
Dicotyledone, dan sub-divisi angiospermae. Pohon jenis ini mempunyai tinggi total mencapai 60 m, dan tinggi bebas cabang 45 m, diameter batang umumnya mencapai 2 m dengan banir mencapai 5 m (Heyne, 1987). Samingan (1973) menambahkan, pohon jenis ini memiliki batang yang lurus, besar, bersih dan berbanir. Kulitnya mempunyai garis-garis halus dan lurus. Sering terlihat ada damar yang keluar dari kulitnya, warnanya coklat sampai kuning. Bunganya berwarna merah, kuning atau agak putih. Buah keras dengan sayap berjumlah lima yang terdiri dari 3 sayap panjang dan 2 sayap pendek, serta bentuk buahnya berbentuk bulat. Pada umumnya meranti menduduki strata tajuk lapisan paling atas (strata A) atau lapisan ke-2 (strata B). Pada umumnya meranti termasuk jenis semitoleran.
Berdasarkan keadaan dan sifat kayunya S. leprosula termasuk ke dalam kelompok meranti merah. Jenis meranti merah terdiri dari pohon besar dan berbanir besar, batang merah atau bersisik, pada umumnya berdamar, kulit luar dan kulit dalam tebal, berurat- urat, warnanya merah atau kemerah- merahan, gubalnya kuning pucat, serta isi kayu berwarna merah (Al Rasyid, et al., 1991).
Penyebaran dan Tempat Tumbuh
Shorea leprosula secara alami menyebar mulai dari Semenanjung
Thailand dan Malaysia, Sumatera dan Kalimantan Utara, biasanya ditemukan di hutan dipterokarpa di bawah 700 m menempati ruang terbuka di hutan yang mengalami gangguan. Tumbuh pada berbagai jenis tanah tetapi tidak toleran terhadap genangan. Curah hujan 1500-3500 mm pertahun, dan musim kemarau pendek perlu untuk pertumbuhan dan regenerasi. Jarang ditemukan di punggung bukit. S. leprosula merupakan meranti merah yang pertumbuhannya paling cepat jika dibandingkan dengan meranti jenis yang lain, namun kondisi ini hanya sampai umur 20 tahun, selanjutnya akan terkejar oleh meranti lain. Jenis ini mengalami penurunan populasi yang disebabkan oleh adanya penebangan liar, dan menurut daftar IUCN S. leprosula tergolong langka.
Pembungaan
Pembungaan S. leprosula terjadi setiap 3 hingga 5 tahun sekali. Pada saat mengalami pembungaan, hampir semua pohon berbunga lebat dan serempak, bunga tersebut akan merekah pada malam hari. Jika terjadi kekeringan selama periode ini, gugur buah tertunda dan buah tidak berkembang sempurna. Pada sebaran alami, pengumpulan benih dilakukan pada bula Maret-Juli, terutama pada bulan setelah musim kemarau.
Pemanenan Buah
Untuk mengurangi kerusakan oleh serangga, sebaiknya buah dipetik di atas pohon. Pengumpulan hendaknya dilakukan ketika periode utama gugur buah, sebab sebelum ini biasanya belum masak dan terserang serangga.
Kegunaan
Kayunya ringan, merupakan kayu berharga dan sangat baik untuk (joinery), (meubel), panel, lantai, langit- langit dan juga untuk kayu lapis. Mengha silkan resin yang dikenal dengan damar daging, yang dapat digunakan obat. Kulitnya digunakan untuk produksi tannin.
Keragaman Genetik
Keragaman genetik suatu spesies adalah hasil dari perkembangbiakan secara seksual. Pada proses perkembangbiakan seksual, terjadi peristiwa meiosis yang mereduksi jumlah kromosom diploid (2n) dalam sel tetua menjadi haploid (n) dalam gamet, mengikuti hukum segregasi bebas seperti diungkapkan oleh Mendel (Hukum Mendel 1). Selanjutnya diperjelas lagi pada Hukum Mendel 2 meiosis kromosom homolog juga akan mengalami pindah silang dan kadang-kadang terjadi perubahan susunan genetik karena mutasi yang akan menambah keturunan (Crowder, 1986). Selain perkawinan dan mutasi, ditambahkan oleh Finkeldey (2003) bahwa migrasi, aliran ge netik, penyimpangan genetik, dan proses seleksi. Keragaman genetik adalah suatu besaran yang mengukur variasi
fenotipe yang disebabkan oleh faktor- faktor genetik. Fenotipe salah satu tanaman akan berbeda dengan tanaman yang lainnya dalam satu atau beberapa hal.
Keragaman genetik merupakan landasan bagi pemulia untuk memulai suatu kegiatan perbaikan tanaman. Besarnya keragaman genetik dapat menjadi dasar untuk menduga keberhasilan perbaikan genetik di dalam program pemuliaan (Comstock dan Moll, 1963 dalam Rachmadi 1999). Allard (1961) mengungkapkan bahwa, keragaman genetik yang luas merupakan syarat berlangsungnya proses seleksi yang efektif karena memberikan keleluasaan dalam proses pemilihan suatu genotipe. Selain itu populasi dengan keragaman genetik yang lebih luas akan memberikan peluang yang lebih besar diperolehnya karakter-karakter yang diinginkan (Simonds, 1979).
Soerjanegara dan Djamhuri (1979) mempertegas bahwa dalam satu jenis pohon dapat dijumpai keragaman geografis (antar provenan), keragaman lokal (antar tempat tumbuh), dan keragaman dalam pohon serta keragaman antar pohon. Ada dua sebab yang menimbulkan keragaman, yaitu perbedaan lingkungan dan perbedaaan susunan genetik. Keragaman lingkungan biasanya disebabkan oleh keadaan perbedaan tempat tumbuh, sifat tanah, atau jarak tanam. Namun adapula keragaman yang tidak dapat diterangkan dengan perbedaan tempat tumbuh, misalnya perbedaan bentuk batang, tebang batang, tebal cabang, dan berat jenis kayu dari pohon-pohon dalam suatu tegakan. Dalam hal ini keragaman dipengaruhi oleh perbedaaan genetik yang diturunkan tetua kepada keturunannya (keragaman genetik). Adanya keragaman dalam suatu jenis perlu diketahui lebih dahulu sebelum memulai dengan pemuliaan pohon, karenakeragaman genetik merupakan syarat mutlak dalam pemuliaan, yaitu untuk memungkinkan seleksi dan untuk mencegah dihasilkannya tanman yang tidak bermutu.
DNA Kloroplas
Yatim (2003) mengungkapkan bahwa unit fungsional materi genetik ialah gen, berasal dari kata genos, artinya asal- usul. Sedangkan unit struktural atau unit kimiawi gen ialah DNA (deoxyribo-nucleic acid, asam deoksiribo- nukleat). Gen atau DNA itu berderet secara linier pada kromatin atau kromosom. Satu benang kromatin dibina atas nukleoprotein, yaitu gabungan asam nukleat (DNA) dan protein. DNA-nya, membentuk super- lilitan sepanjang kromatin, sedangkan
protein bertindak sebagai tempat melilit, protein yang jadi tempat melilit DNA disebut histon. Protein lain dalam kromatin ada yang bertindak sebagai penyekat, penyalut, unsur regulator, atau sebagai enzim bagi aktivitas DNA, mereka disebut protein nonhiston. Gen menumbuhkan dan memelihara aktivitas seharian berbagai karakter dalam tubuh. Jumlah karakter dalam satu individu ada ribuan macam. Contoh karakter: Batang (tebal, gepeng/pipih), daun (bulat, lonjong, jarum), buah (bulat/kriput).
Di antara gen yang banyak itu, ada karakter yang pengatur utamanya satu gen, disebut karakter monogenik. Ada pula karakter yang diatur oleh banyak gen, disebut karakter poligenik. Satu gen dibina atas satu molekul DNA. Antara gen bersebelahan dalam satu kromosom ada urutan DNA seling (intervening
sequences), tidak berperan dalam menumbuhkan suatu karakter.
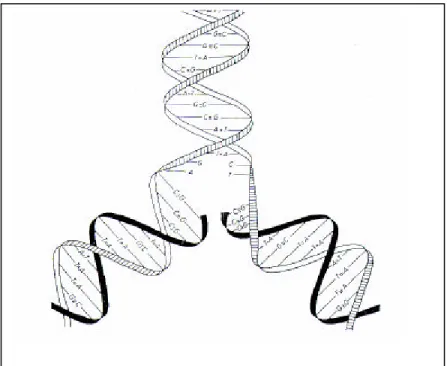
DNA semacam bahan organik yang memiliki BM (berat molekul) yang terbesar dalam sel, yaitu dalam ukuran juta. Monomer DNA ialah nukleotida. Satu gen dibina atas satu molekul DNA, dan satu molekul DNA dibina atas ribuan sampai puluhan ribu nukleotida. Satu nukleotida terdiri dari tiga gugus senyawa: 1) gula deoksiribosa; 2) fosfat; 3) basa-N. Gula yang membina DNA tergolong gula pentosa, yaitu gula yang atom karbonnya lima. Glukosa yang membina sebagian besar gula dalam tubuh kita dan yang menjadi sumber utama energi, tergolong gula heksosa, artinya gula yang atom karbonnya enam, gugus fosfat ialah -PO4-3. Basa-N terdiri dari dua kelompok dan tiap kelompok dibina atas dua macam basa: 1) purin; adenin (A) dan guanim (G); 2) pirimidin: timin (T) dan citosin (C). Satu molekul DNA terdiri untaian linear nukleotida, sehingga disebut juga satu utas. Agar sifat kimianya stabil maka DNA itu bersusun berpasangan, disebut utas double. Kedua utas DNA yang berpasangan (double) itu berpilin sejajar (helix) sesama, tapi arahnya berlawanan (anti-paralel). Maksudnya bagian kepala satu utas berpasangan dengan bagian ekor utas pasangan.
Tegasnya DNA dalam inti sel disebut dalam susunan double helix anti-paralel. Kedua utas diikat oleh ikatan hidrogen antar basa masing- masing. Perikatan antara basa itu tertentu dan tetap, yaitu antara A dari satu utas berikatan dengan T utas pasangan, dan antara G dari satu utas berikatan dengan C utas
sepasang utas DNA yang double helix membentuk semacam tangga spiral. Induk tangganya yang sejajar tapi berpilin ialah untaian G-P. Jadi B dari satu utas berikatan dengan B dari utas pasangan B-B. Urutan nukleotida yang membina satu molekul DNA membentuk semacam tangga spiral. Induk tangganya ialah ikatan S-P dari kedua utas, sedangkan anak tangganya ialah ikatan B-B, tangga itu berbentuk spiral, maka pegangannya kiri-kanan ialah untaian S-P, sedangkan anak tangga yang diinjak ialah pasangan B-B.
Suatu gen diberi simbol dalam buku atau majalah menurut urutan pasangan basa nukleotiodanya: A-T, G-C. Alasannya ia lah: 1) P (fosfat) semua nukleotida tetap; 2) S (sugar, gula) semua nukleotida tetap, yaitu deoksiribosa; 3) variasi antara nukleotida hanya pada basa yang empat macam; 4) mutasi yang terjadi pada suatu gen sehingga menyebabkan kelainan atau penyakit, sela lu terjadi pada basa nukleotida saja. Susunan DNA disajikan seperti pada Gambar 1.
Gambar 1. Rantai DNA (Hattemer et al., 1993 dalam Finkeldey, 2003)
Finkeldey (2003) menambahkan, sampai saat ini masih diyakini bahwa genetik merupakan hal yang mampu mengenali dan memberikan informasi suatu organisme, hal ini di karenakan dalam gen terdapat suatu material yang berbeda
dengan material yang la in yaitu DNA (deoxyribonucleic acid). Materi genetik gen ialah DNA-nya. Asam ini disebut juga asam nukleat, berasal dari kata asam yang terdapat dalam nukleus, karena sebagian besar (99,9 persen) asam ini terdapat dalam inti, sisanya yang 0,1 persen terdapat dalam organel tertentu. Organel yang mengandung DNA ialah plastida yang terdiri dari mitokondria dan kloroplas. Material genetik yang di analisis dari plastida biasanya hanya berasal dari sifat satu tetuanya, kalau tidak dari tetua jantannya saja atau hanya dari betinanya saja, lain halnya dengan material genetik yang diambil dari inti analisis genetiknya, bias menunjukan dua tetuanya. Pada DNA kloroplas material genetik diturunkan dari induk betina nya saja.
Gambar 2. Letak cpDNA pada sel
PCR (Polymerase Chain Reaction)
Polimerase chain reaction (PCR) merupakan teknik yang mulai
berkembang pesat sekitar tahun 1987. Pada dasarnya PCR mampu mengenali dan memperbanyak (amplifikasi) segmen DNA sasaran walupun dalam
oligonukleotida. Reaksi amplifikasi sangat tergantung dari keberadaan enzim polimerase sebagai katalisator, terutama yang tahan pana s. Enzim yang paling terkenal dan banyak digunakan adalah polimerase DNA Taq yang diisolasi dari bakteri yang tahan panas Thermus aquaticus. Bahan utama lain yang diperlukan adalah deoxynukleotide triphospates (dNTPa).
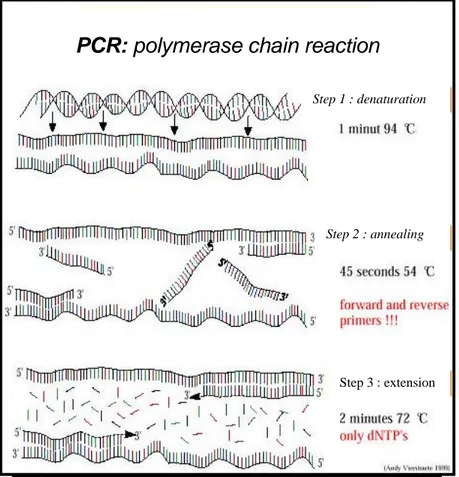
PCR adalah suatu metode untuk menggandakan atau mengamplifikasi DNA yang diisolasi pada sebuah tabung reaksi kecil dengan melalui replikasi berulang (Gambar 3). Titik awal dari reaksi (primers) adalah oligonukleotida, yakni potongan kecil DNA yang dihasilkan secara buatan (biasanya terdiri antara 10-25 nukleotida). Sekuensi basa dari primer dapat dipilih secara bebas. DNA teramplifikasi dalam reaksi campuran mengunakan enzim thermostabil (enzim tahan panas) yakni DNA polimerase dari titik awal seperti ditunjukkan oleh sekuensi pada primer. Reaksi dikendalikan oleh perubahan suhu pada
thermocycler. PCR memungkinkan penggandaan potongan pendek. DNA dari
semua organisme (lebih dari 2000 hingga 3000bps). Dari satu tabung reaksi tunggal dapat dihasilkan jutaan tiruan potongan DNA identik seperti pada Gambar 3 (Newbury dan Fordllyoyd, 1993 dalam Finkeldey, 2003).
PCR merupakan salah satu tahapan proses dalam penentuan keanekaragaman genetik, PCR ini berfungsi untuk mendapatkan sekuensi-sekuensi DNA dari genom DNA. Akan tetapi menurut Gupta e t al. (2002) penanda genetik ini tidak hanya PCR, penandaan lain yang biasa digunakan adalah; (i) hibridisasi berdasarkan penanda, (ii) penanda molekuler berdasarkan PCR yang dilanjutkan dengan hibridisasi, (iii) sekuensing dan chip DNA berdasarkan penanda
Seiring dengan kemajuan dalam teknologi DNA, analisis PCR-RFLP dapat dilakukan tanpa menggunakan pelacak DNA dan proses hibridisasi DNA. Penemuan program PCR (polymerase chain reaction) dapat membantu mendapatkan sekuensi-sekuensi DNA tertentu dari genom DNA, kemudian dilakukan pemotongan dengan enzim restriksi, atau dengan kata lain analisis PCR-RFLP dapat dilakukan terhadap sekuensi-sekuensi DNA spesifik yang telah diisolasi dengan menggunakan primer spesifik dalam program PCR
Gambar 3. Prinsip reaksi RCR (Rabouam et al, 1999 dalam finkeldey, 2005)
.
Dalam analisis PCR, digunakan primer spesifik yang mampu mengklon sekuensi DNA tertentu yang dapat digunakan sebagai pengganti pelacak DNA dalam analisis PCR-RFLP. Sekuensi DNA yang sudah diisolasi dipotong dengan berbagai enzim restriksi, guna melihat keragaman melalui keberadaan
recognition site yang memberikan ukuran potongan DNA yang berbeda-beda.
Taq Polymerase
DNA
Primer
Nukleotida
Untuk genotif 1 Untuk genotif 2
Tabung reaksi yang berisi larutan penyangga
Elektroforesis pada agarose gel
keragaman genetik berdasarkan sekuen DNA yang diisolasi pada berbagai jenis tanaman yang dianalisis.
Pada saat media contoh dipanaskan hingga suhu 94o C, atau pH media dibuat alkalis, maka DN A tersebut menjadi asam, sehingga pHnya dibawah 7, jika ditambahkan basa (NaoH) maka media itu menjadi alkalis dan DNA mengalami denaturasi. Pada saat suhu diturunkan hingga ke 50 oC atau pH diturunkan menjadi asam, maka kedua utas DNA kembali berpasangan. Peristiwa ini disebut renaturasi (re = kembali). Jika dalam media terdapat DNA lain atau RNA, dan urutan basa mereka komplemen, maka akan terjadi perpasangan atau hibrid.
Adapun proses amplifikasi PCR adalah seperti pada Gambar 4.
Gambar 4. Proses amplifikasi PCR (www.users.ugent.be/~avierst/principle/seq.htm)
(Gailing et al., 2003 )
Step 3 : extension
PCR: polymerase chain reaction
Step 1 : denaturation
PCR-RFLP
(Polymerase Chain Reaction - Restriction Fragment Length Polymorphisms)
PCR-RFLP adalah penanda dominan yang merestriksi DNA secara spesifik pada lokasi tertentu yang dikenalnya dengan enzim restriksi endonuklease (Park dan Moran, 1995). Enzim Restriksi ini akan mengenali sekuen tertentu dan memutus DNA jika bertemu dengan situs yang dikenalnya dan menghasilkan sejumlah fragmen DNA.
Polimorfisme PCR-RFLP muncul karena adanya basa yang mengalami substitusi, penambahan, pengurangan dan perpindahan (translokasi) pada genom DNA. Perubahan tersebut menyebabkan perbedaan ukuran dari fragmen restriksi yang dicerna oleh enzim restriksi tertentu. Fragmen yang dihasilkan oleh enzim restriksi dapat dipilah-pilah dengan elektroforesis.
DNA genom yang dipotong oleh enzim restriksi, akan menghasilkan beratus-ratus atau beribu-ribu potongan DNA. Untuk mempelajari pola pemotongan DNA yang berasal dari lokus tertentu dalam kromosom, maka ratusan atau ribuan potongan tersebut harus :
(a) Dipisahkan berdasarkan ukuran dengan elektroforesis gel agarose
(b) Potongan DNA tertentu yang diinginkan harus dapat dibedakan dari populasi potongan DNA dengan ukuran yang sama dengan melakukan hibridisasi menggunakan pelacak DNA (DNA probe).
Pelaksanaan analisis PCR-RFLP memerlukan penggunaan bahan radioaktif atau bahan non-radioaktif tertentu untuk memberi label pada pelacak DNA. Bahan ini harganya masih relatif mahal. Selain itu, bahan radioaktif juga merupakan polutan yang berbahaya bagi lingkungan. Sebaliknya, bahan non-radioaktif walaupun tidak berbahaya, tetapi kemampua n dan sensitifitasnya untuk mendeteksi sekuensi DNA kopi tunggal masih belum efisien. Pemberian label pada pelacak DNA dilakukan dengan teknik nick translation atau dengan teknik random priming DNA labelling. Dengan teknik nick translation, salah satu untaian dari DNA yang akan dilabel diputus diberbagai titik dengan menggunakan enzim DNaseI. Untaian DNA yang baru, akan disintesis kembali
proses sintesis DNA yang baru terjadi, nukleotida yang telah diberi label ikut bergabung dalam untaian DNA baru yang disintesis.
Pelacak DNA yang dipakai dalam penelitian PCR-RFLP dapat berupa DNA yang berasal dari sekerabat dengan spesies tanaman yang diteliti (pelacak homolog), atau berasal dari tanaman yang tidak sekerabat (pelacak heterolog). pelacak heterolog biasanya lebih sulit dalam pemakaiannya karena biasanya ada homologi sekuensi pelacak DNA dengan DNA tanaman relatif kecil. Akibatnya, penggunaan pelacak DNA heterolog akan memberikan komplementasi yang kurang stabil antara DNA tanaman dan pelacak DNA. Pelacak heterologous dari DNA yang bersifat sangat konservatif (selalu sama untuk berbagai spesies tanaman) misalnya bagian gen small sub unit dari RUBISCO (Ribulosa Bifosfat Karboksilasi), gen major klorofil a/b binding protein atau gen RNA ribosomal.
METODE PENELITIAN
Tempat dan waktu penelitian
Pengambilan contoh daun dilakukan pada populasi S. leprosula di 13 lokasi di Indonesia (Tabel 1). Penelitian elektroforesis dan analisis DNA dilakukan di Laboratorium Silvikultur Fakultas Kehutanan Institut Pertanian Bogor. Penelitian dilaksanakan pada bulan Maret-Juni 2005 untuk pengambilan data primer selanjutnya bulan Juli-September 2005 untuk studi pustaka dan analisis data.
Bahan dan Alat Penelitian
Bahan yang digunakan untuk penelitian ini berupa daun S. leprosula yang telah kering. Selain itu juga digunakan silika gel, nitrogen cair, bahan-bahan kimia untuk membuat buffer untuk proses ekstraksi DNA, PCR, dan pemotongan DNA, agaros, serta ethidium bromida (EtBr).
Alat-alat yang digunakan untuk pengambilan contoh di lapangan meliputi:
tally sheet, label, alat tulis, plastik klip, gunting. Alat-alat yang digunakan untuk
elektroforesis dan analisis DNA di laboratorium meliputi: mortar dan pestel, sarung tangan, pipet, pipet mikro, sentrifugasi, vortex, spatula, gelas piala, gelas ukur, koleksi tabung, cetakan gel, bak elektroforesis, tray, microwave, power
supply, pH meter, gelas piala, gelas ukur, timbangan analitik, pengaduk magnet,
lemari pendingin, water bath, mesin PCR, ultraviolet transiluminator, kamera digital.
Prosedur Penelitian Optimasi metode
Tahapan optimasi metode dilakukan untuk menjamin munculnya pita dengan resolusi yang tinggi. Tahapan optimasi metode ini meliputi 3 proses utama, yaitu ekstraksi DNA, amplifikasi PCR dan pemotongan cpDNA. Optimasi ekstraksi DNA dari daun dimulai dari penentuan ukuran daun yang diekstrak, komposisi bahan ekstraksi, suhu dan kepekatan gel agaros pada proses elektroforesis, termasuk pengenceran DNA hasil ekstraksi. Optimasi pada proses
cpDNA serta primer yang akan digunakan, pengaturan suhu pada thermocycler sesuai dengan primer yang digunakan, suhu dan kepekatan gel agaros pada proses elektroforesis. Optimasi pada proses pemotongan DNA yang dilakukan adalah mencari komposisi bahan yang digunakan untuk pemotongan DNA serta mencari jenis enzim restriksi yang akan digunakan, kondisi arus, tegangan dan persentase agaros pada elektroforesis. Skema prosedur penelitian menggunakann penanda PCR-RFLP dapat dilihat pada Gambar 5.
Gambar 5. Bagan alur penelitian di laboratorium
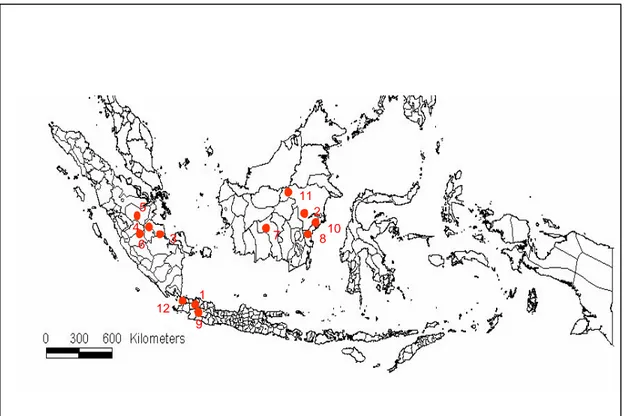
Pengambilan Contoh
Pengambilan contoh dilakukan di 13 populasi S. leprosula (Tabel 1), dimana pada masing- masing populasi diambil 5 contoh (Gambar 6). Pengambilan contoh daun dilakukan dengan mengambil daun ke 2 atau ke 3 dari pucuk dengan jumlah sekitar 5 daun yang berada di lokasi dan dimasukkan ke dalam plastik klip, kemudian dalam plastik tersebut dimasukkan silika gel dengan perbandingan berat daun contoh dan silika gel sebesar 1 : 5. Silika gel yang sudah berubah warna diganti dengan silika gel yang baru sampai contoh daun menjadi kering. Pada plastik klip diberi label yang meliputi: nomor pohon diameter, tinggi pohon dan
Ekstraksi DNA
Ya Tidak
PCR
Ya Tidak
lokasi. Selain itu juga dilakukan pengambilan daun yang digunakan untuk herbarium untuk keperluan identifikasi jenis.
Tabel 1. Lokasi pengambilam contoh S. leprosula
Perkiraan Lokasi No
Batch Lokasi Provinsi Garis Bujur Garis Lintang 1 Haurbentes, Bogor Jawa Barat 106041’ - 107042’ BT 6054’-7054’ LU 2 Tering Kalimantan Timur 115022’ – 116038’ BT 000 – 00010’ LS 3 Asialog, Jambi Sumatra 103015’ – 103033’ BT 2002’ – 2022’ LU
4 Pasir Mayang, Jambi Sumatra 101019’ – 103020’ BT 0008’ – 0309’ LU
5 TNBT, Riau Sumatra 102013’ – 103014’ BT 0105’ - 0206’ LU 6 Nanjak Makmur, Jambi Sumatra 101040’ BT 10022’ LU
7 Sari Bumi Kusuma Kalimantan Selatan 111018’ - 114042’ BT 01059’ - 00036’ LU
8 PT ITCI Kartika Utama Kalimantan Timur 116017’ - 11706’ BT 00020’ - 01018’ LU 9 Kebun Percobaan Darmaga,
Bogor
Jawa Barat 106050’ – 1070 50’ BT 6036’ – 7040’ LU 10 Bukit Bangkirai, Balikpapan Kalimantan Timur 117032’ – 118035’ BT 00014’ – 01015’ LU 11 Sumalindo, Samarinda Kalimantan Timur 115018’ – 116036’ BT 00055’ – 00056’ LS 12 Carita I Banten 105°15' – 106011’ BT 6°21' - 7°10' LU 13 Carita II Banten 105°15' – 106011’ BT 6°21' - 7°10' LU 810 11 7 6 3 12 1 9 2 4 5 4
Ekstraksi DNA
Metode yang digunakan untuk ekstraksi DNA mengikuti prosedur yang dikeluarkan oleh QIAGEN dengan menggunakan DNeasy Plant Mini Kit untuk isolasi jaringan tanaman. Ekstraksi DNA ini meliputi tiga tahapan, yaitu tahapan prespitasi, pencucian dan elusi (Lampiran 1).
Tahap pertama yaitu tahapan prespitasi dimulai dengan menggerus contoh daun meranti berukuran 2 x 1 cm yang ditambahkan nitrogen cair dengan menggunakan mortar dan pestel untuk mendapatkan serbuk. Serbuk kemudian dipindahkan ke dalam tabung yang berkuran 2 ml. Tambahkan 400 µl buffer AP1 dan 4 µl RNAse A (100 mg/ml) yang berfungsi untuk menghilangkan RNA dalam larutan. Larutan tersebut kemudian di kocok dengan menggunakan vortex. Larutan diinkubasi di dalam water bath selama 10 menit dengan suhu 65oC, kemudian dikocok 2 - 3 kali selama inkubasi dengan membalikkan tabung. Ditambahkan 130 µl buffer AP2, vortex, kemudian diinkubasikan ke dalam es selama 5 menit, kemudian di sentrifugasi selama 5 menit dengan kecepatan penuh. dimasukkan cairan ke dalam QIAShedder spin column yang terdapat pada koleksi tabung 2 ml dan dilakukan sentrifugasi selama 2 menit denga n kecepatan maksimum. Larutan yang mengalir lewat fraksi dari dipindahkan ke tabung yang baru (tanpa penambahan). 1,5 volume buffer AP3/E (buffer sebelumnya ditambahkan dengan etanol) pada larutan bersih ditambahkan dan dicampur dengan pemipetan. dimasukkan 650 µl larutan ke DNeasy mini spin column yang di letakkan di koleksi tabung 2 ml, dilakukan sentrifugasi dengan kecepatan 8000 rpm kemudian cairan yang melewati fraksi dibuang.
Tahapan kedua yaitu tahapan pencucian (washing) dimulai dengan menempatkan DNeasy column pada tabung koleksi 2 ml yang baru , kemudian ditambahkan 500 µl buffer AW pada DNeasy column dan sentrifugasi selama 1 menit pada kecepatan 8000 rpm. Cairan yang melewati fraksi dibuang, kegiatan ini dilakukan dua kali, kemudian disentrifugasi selama 2 menit dengan kecepatan maksimal.
Tahapan ketiga yaitu tahapan elution dilakukan dengan menyimpan
DNeasy column pada 1,5 atau 2 ml tabung sentrifugasi dan pipet 100 µl buffer AE
hangat (65oC) ke dalam membran Dneasy dan dilakukan inkubasikan selama 5 menit pada suhu ruangan, kemudian disentrifugasi selama 1 menit dengan kecepatan 8000 rpm, tahapan ini dilakukan dua kali, sehingga akan dihasilkan DNA hasil ekstraksi sebanyak 200 µl.
DNA hasil ekstraksi kemudian dilakukan uji kualitas dengan menggunakan teknik elektroforesis agaros 1%. Gel ini dibuat dengan melarutkan agaros sebanyak 2,5 µl ke dalam 250 µl larutan TAE (tris acetate with EDTA). Kemudian larutan dipanaskan di dalam microwave sampai mendidih. Larutan gel dibiarkan sampai hangat (± 50oC) kemudian dituangkan ke dalam cetakan gel dengan ketebalan 5 mm. Cetakan gel tersebut telah dipasang sisir/comb yang berfungsi untuk membuat cetakan sumur gel/well elektroforesis. Gel didinginkan sampai membeku. Kemudian sisir/comb dicabut dan gel beserta cetakannya dimasukkan ke dalam bak elektroforesis yang berisi buffer elektroforesis yaitu
buffer TAE sebanyak 2300 ml. DNA hasil ekstraksi sebanyak 15 µl ditambah
3,75 µl bahan pewarna (blue juice) dimasukkan ke dalam sumur-sumur elektroforesis. Setelah itu bak elektroforesis ditutup dan dialiri listrik dengan tegangan 25 volt selama 3 jam.
Gel yang sudah dielektroforesis dilakukan pewarnaan dengan merendamkan gel di dalam larutan ethidium bromida (EtBr) 25 µl dan aquadest 500 ml selama 1 jam. Kemudian dideteksi dengan mengunakan ultraviolet transiluminator.
Amplifikasi PCR
DNA hasil ekstraksi diamplifikasi dengan menggunakan mesin PCR MJ
Reseach PTC-100 Peltier Thermal cycler. Primer yang digunakan adalah primer
universal (hampir terdapat di semua tumbuhan) yaitu petB, psaA, psbA, rbcL dan
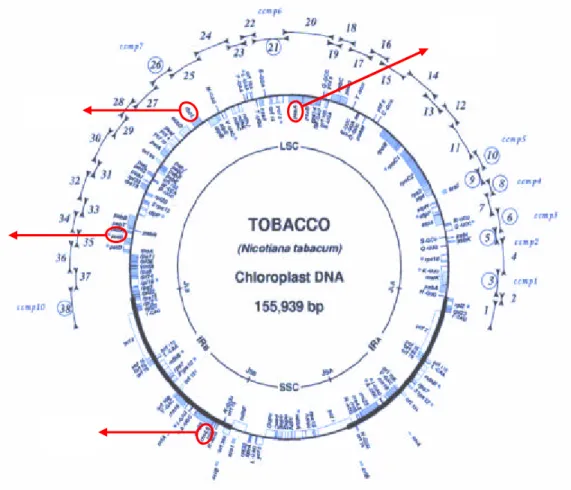
Gambar 7. Letak petB, psaA, trnLF dan rbcL pada peta plasmid cpDNA N icotiana
tabacum
Urutan nukleotida dari masing- masing primer adalah sebagai berikut :
petB : 5’-TGGGGAACTACTCCTTTGAT-3’ 5’-CCCGAAATACCTTGCTTACG-3’ psaA : 5’-AAGAATGCCCATGTTGTGGC-3’ 5’-TTCGTTCGCCGGAACCAGAA-3’ rbcL : 5’-TGTCACCAAAAACAGAGACT-3’ 5’-TTCCATACTTCACAAGCAGC-3’ trnLF : 5’-CGAAATCGGTAGACGCTACG-3’ 5’-ATTTGAACTGGTGACACGAG-3’
Primer yang akan digunakan sebelumnya dilakukan pengenceran terlebih dahulu. Pengenceran dilakukan dengan cara mengambil primer pekat dengan konsentrasi 50 µM sebanyak 20 µl kemudian ditambahkan H2O sebanyak 180 µl. Konsentrasi akhir primer akan menjadi 5 µM. Komposisi bahan-bahan yang digunakan dalam proses amplifikasi ini tersaji pada tabel 2.
Tabel 2. Komposisi bahan-bahan yang digunakan untuk PCR
Komponen Volume
Template DNA 2,0 µl
Forward primer (5 pM) 1,8 µl
Reverse primer (5 pM) 1,8 µl
Destilled water 1,9 µl
HotStar Taq® Master Mix Kit (Qiagen, Hilden) 7,5 µl
Lautan PCR untuk setiap contoh merupakan campuran dari dari berbagai komponen seperti pada Tabel 2. kemudian ditambahkan 1,9 µl destilled water hingga volume larutan mencapai 15 µl. Larutan kemudian diaduk dengan menggunakan vortex kemudian disentrifugasi. Larutan tersebut kemudian di masukan kedalam mesin PCR yang sudah di program dengan pengkondisian suhu dan waktu. Seperti pada Tabel 3.
Tabel 3. Pengkondisian suhu dan waktu pada mesin PCR untuk primer petB,
psaA, trnLFdan rbcL Tahapan Suhu (o C) Waktu (menit) Jumlah siklus Pemanasan Awal - Denaturasi - Annealing - Extension Pemanasan akhir Penyimpanan 95 94 50 & 56 72 72 8 15 1 1 2 10 Selamanya 1 35 1 1
Hasil PCR kemudian di uji dengan menggunakan gel agaros dengan kepekatan 2%, yang dibuat dengan melarutkan 0,4 mg agaros dalam 40 ml TAE. Larutan hasil PCR sebanyak 3 µl dicampurkan dengan larutan pewarna (brom phenol) sebanyak 3 µl dimasukkan ke dalam sumur gel. Larutan tersebut
sedikit atau sama dengan hasil ekstraksi maka harus dilakukan PCR ulang dengan komposisi DNA yang lebih encer. Pengenceran ini dilakukan karena sifat DNA dari Meranti memiliki kadar fenol yang tinggi. Kadar fenol yang tinggi ini dapat menghambat daya kerja primer.
Analisis PCR - RFLP
Analisis polimorfik dilakukan dengan teknik PCR-RFLP untuk melihat jumlah basa antar fragmen. DNA kloroplas hasil PCR dipotong dengan menggunakan enzim restriksi untuk analisis keragaman genetik. Dibawah ini adalah jenis-jenis enzim restriksi yang digunakan dalam penelitian ini.
Tabel 4. Jenis enzim restrksi yang digunakan utuk memotong DNA
No Nama Sumber Situs
pemotongan
Temperatur Inkubasi (oC)
1 Alu I Anthrobacter loteus AG↓CT
TC↑GA 37
2 Taq I Thermus aquticus T↓CGA
AGC↑T 65
3 Hinf I Haemophilus influenzae G↓ANTC
CTNA↑G 37
4 Rsa I Rhodopseudomonas
sphaeroides
GT↓AC
CA↑TG 37
5 Cfo I Clostridium formicoaceticum GCG↓C
C↑GCG 37
6 Msp I Moraxella sp. C↓CGG
GGC↑C 37
7 Dra I Deinococcus radiopilus TTT↓AAA
AAA↑TTT 37
8 BamH I Bacillus amyloliquefaciens H. C↓GATC
CTAG↑G 37
9 Hind III Haemophilus influenzae A↓AGCT
TCGA↑G 37 10 Pst I Providensia stuartii TGCA↓G
G↑ACGT 37
Larutan yang digunakan untuk pemotongan ini adalah 0,5 µl enzim restriksi, 1µl bufer, 5µl bidest steril, 5 µl DNA hasil PCR. Larutan ini kemudian diinkubasi di dalam waterbath pada suhu 370C selama 1 jam. Hasil pemotongan dengan enzim restriksi kemudian diuji dengan elektroforesis agaros dengan kepekatan 3%, artinya 0,8 gr dalam 40 µl TAE. Elektroforesis dilakukan dengan
tegangan 100 volt selama 45 menit untuk memastikan fragmen DNA terpisah dengan sempurna. Hasil pemotongan ini kemudian dideteksi dengan menggunakan ultraviolet transiluminator dan difoto dengan menggunakan kamera digital untuk dinalisis dikomputer.
Uji polimorfisme
Pengujian polimorfisme dilakukan dengan menggunakan teknik PCR-RFLP. Pengujian ini dilakukan untuk mencari variasi DNA kloroplas pada S.
leprosula yang didasarkan pada pola pemotongan pita yang dihasilkan dari
penggunaan beberapa kombinasi perlakuan. Komb inasi perlakuan yang diuji dalam penelitian ini menggunakan 4 macam primer dan 10 macam enzim restriksi.
Hasil pengujian pada cpDNA dikatakan polimorfik apabila mempunyai pola pita yang dihasilkan mempunyai sekurang-kurangnya lebih dari satu variasi, Sedangkan cpDNA dikatakan monomorfik jika tidak memperlihatkan adanya variasi pada pemotongan pola pita. Selanjutnya, untuk kombinasi perlakuan yang memberikan hasil polimorfik dilakukan analisis lebih lanjut untuk melihat variasi genetik pada level inter dan intra populasi, sekaligus untuk melihat kekerabatannya.
Analisis Data
Data analisis hasil elektroforesis yaitu situs restriksi yang berupa pola pita DNA yang digunakan untuk menghitung haplotipe. Pola pita yang muncul (positif) diberi nilai 1 (satu) dan pola pita yang tidak muncul (negatif) diberi nilai 0 (nol). Hasil perhitungan kemudian dianalisis untuk mengetahui frekuensi dan keragaman haplotype dalam jenis dan antar populasi S. leprosula dengan menggunakan sofware ARLEQUIN Ver 2.000 (Schneider et al 2000), untuk mengetahui jarak genetik antar populasi sofware GSED ver 1.1 (Gillet, 2002). Situs restriksi digunakan juga untuk melihat kemiripan (similiarity) antar haplotipe serta untuk melihat dendogram dengan menggunakan metoda UPGMA (Unweighted Pair-Group Method with Averaging) dengan sofware NTSYS Ver 2.0 (Rohlf 1998).
HASIL DAN PEMBAHASAN
Ekstraksi DNA
Analisis DNA dimulai dengan melakukan ekstraksi DNA yang berasal dari jaringan daun. Alasan pemilihan jaringan daun, karena jaringan ini lebih mudah diekstrak dibandingkan dengan jaringan yang lain, seperti akar, kayu dan jaringan lainnya. Ekstrasi DNA dilakukan berdasarkan prosedur yang dikeluarkan oleh Qiagen dengan menggunakan metode Dneasy Plant Mini Kit. Ekstraksi DNA ini meliputi 3 tahapan penting, yaitu presipitasi (presipitation), pencucian (washing) dan ellution. Contoh hasil ekstraksi DNA ditunjukkan pada agaros gel yang dapat divisualisasi di bawah sinar ultraviolet (Gambar 8).
Gambar 8. Hasil Ekstraksi DNA S . leprosula
DNA hasil ekstraksi merupakan DNA total, yang terdiri dari DNA inti, DNA mitokondria dan DNA kloroplas. Untuk menganalisis cpDNA maka dilakukan proses amplifikasi PCR dengan menggunakan primer universal kloroplas yang hanya dapat mengamplifikasi secara spesifik fragmen- fragmen di cpDNA saja. CpDNA dipelajari karena lebih kecil, lebih mudah diisolasi dan strukturnya lebih sederhana dibandingkan dengan DNA mitokondria (mtDNA) (Banks dan Birky,1985).
DNA ekstraksi digunakan sebagai cetakan template dalam reaksi PCR. Sebelum dilakukan amplifikasi PCR, dilakukan pengenceran DNA hasil ekstraksi
terlebih dahulu. Hal ini dilakukan karena DNA S. leprosula mempunyai kandungan fenol yang tinggi. Kandungan fenol yang tinggi ini dapat menyebabkan terhambatnya kerja primer, sehingga hasil amplifikasi kurang maksimal bahkan tidak berhasil (tidak ada pita). Pengenceran dilakukan berdasarkan pengamatan visual dari terang tidaknya pita DNA hasil ekstraksi. Berdasarkan hasil optimasi, pita yang terang dilakukan pengenceran sebanyak 40 kali, artinya 1 µl DNA ekstraksi diencerkan dengan menambahan H2O steril sebanyak 39 µl. Sedangkan untuk DNA yang kurang terang dilakukan pengenceran sebanyak 20 kali (1 µl DNA ekstrasi ditambah 19 µl H2O steril) dan 10 kali (1 µl DNA ekstraksi ditambah 9 µl H2O steril) (Gambar 7). DNA hasil pengenceran ini yang akan dijadikan sebagai template dalam proses amplifikasi PCR.
Gambar 9. Elektrophoresisis cpDNA dengan berbagai pengenceran DNA dari
S . leprosula
Amplifikasi dengan PCR
Keberhasilan amplifikasi dengan PCR lebih didasarkan pada kesesuaian primer yang digunakan, efisiensi dan optimasi pelaksanaan PCR. Primer yang tidak spesifik dapat menyebabkan teramplifikasinya daerah lain dalam genom yang tidak dijadikan sasaran, atau sebaliknya tidak ada daerah genom yang teramplifikasi. Optimasi PCR juga diperlukan untuk menghasilkan karakter yang diinginkan. Optimasi ini menyangkut suhu denaturasi dan annealing DNA dalam mesin PCR. Suhu denaturasi yang rendah, dapat menyebabkan belum terbukanya DNA utas ganda sehingga tidak dimungkinkan terjadinya polimerisasi DNA baru. Proses penempelan primer pada utas DNA yang sudah terbuka memerlukan suhu optimum, sebab suhu yang terlalu tinggi dapat menyebabkan amplifikasi tidak terjadi, atau sebaliknya suhu yang terlalu rendah menyebabkan primer menempel pada sisi lain genom yang bukan sisi homolognya. Akibatnya dapat teramplifikasi banyak daerah tidak spesifik dalam genom tersebut. Suhu penempelan ini ditentukan berdasarkan primer yang digunakan dan dipengaruhi oleh panjang dan komposisi primer. Faktor- faktor yang mempengaruhi jalannya amplifikasi PCR diantaranya adalah karakter individual contoh DNA, komposisi premiks PCR, kotoran, suhu dan waktu masing- masing fase, pemilihan primer spesifik dan jumlah siklus amplifikasi.
Penggunaan primer universal petB, psaA, trnLF dan rbcL dapat mengamplifikasi cpDNA S. leprosula dengan baik (Indrioko, 2005). Panjang fragmen hasil amplifikasi PCR berkisar 1700 bp dengan menggunakan primer
petB, 2100 bp dengan primer psaA, 1100 bp dengan primer trnLF dan 1300
dengan menggunakan primer rbcL yang ditunjukkan melalui elektroforesis gel agaros (Gambar 8)
Gambar 10. Elektroforegram hasil PCR cpDNA dengan berbagai primer : (a) petB, (b) psaA, (c) trnLF, (d) rbcL, M = marker bond
Uji Polimorfisme
Uji polimorfisme bertujuan untuk mencari kombinasi perlakuan dari primer dan enzim restriksi yang menghasilkan pola pemotongan yang beragam (variasi). Dalam uji ini cpDNA hasil amplifikasi PCR dipotong dengan menggunakan enzim restriksi yang dikenal sebagai teknik PCR-RFLP. Teknik ini sangat sederhana, cepat dan ekonomis, memiliki kisaran 50-3000 bp yang dapat dibedakan dan lebih sesuai bagi individu yang ditangani dalam jumlah banyak 2.642 bp
1.700 bp 1.500 bp 1.000 bp
500 bp
M Haur Bentes Tering Asialog Pasir Mayang Bukit Tigapuluh Nanjak Makmur Sari Bumi Kusuma ITCI Darmaga Bukit Bangkirai Sumalindo Carita 1 Carita 2
2.642 bp 2.100 bp 1.500 bp 1.000 bp 500 bp
M Haur Bentes Tering Asialog Pasir Mayang Bukit Tigapuluh Nanjak Makmur Sari Bumi Kusuma ITCI Darmaga Bukit Bangkirai Sumalindo Carita 1 Carita 2
500 bp 1.300 bp 1.500 bp 2.642 bp
M Haur Bentes Tering Asialog Pasir Mayang Bukit Tigapuluh Nanjak Makmur Sari Bumi Kusuma ITCI Darmaga Bukit Bangkirai Sumalindo Carita 1 Carita 2
(a) (b)
(d) 500 bp
M Haur Bentes Tering Asialog Pasir Mayang Bukit Tigapuluh Nanjak Makmur Sari Bumi Kusuma ITCI Darmaga Bukit Bangkirai Sumalindo Carita 1 Carita 2
(c) 1.100 bp
2642 bp 1.000 bp
Pada prinsip penggunaan primernya, PCR-RFLP mirip dengan RAPD (random amplied polymorphic DNA). Namun perbedaannya untuk melihat polimorfisme dalam genom organisme, pada PCR-RLFP digunakan juga enzim pemotong tertentu. Enzim ini bersifat spesifik, sehingga enzim ini akan memotong situs tertentu yang dikenali sesuai dengan urutan basanya. Situs enzim pemotong dari genom suatu kelompok organisme yang kemudian berubah karena mutasi titik atau berpindah karena penyusunan kembali gentiknya (genetic
rearrangement) dapat menyebabkan situs tersebut tidak dikenali lagi oleh enzim,
atau enzim restriksi akan memotong daerah lain yang berbeda. Proses ini menyebabkan terbentuknya fragmen- fragmen DNA yang berbeda ukurannya dari satu organisme ke organisme lainnya. Polimorfisme ini selanjutnya digunakan untuk membuat dendrogram untuk melihat kekerabatan kelompok.
RFLP dapat diamati bila sebagian besar dari DNA dipotong (dicerna) menjadi fragmen- fragmen atau potongan-potongan kecil. Potongan-potongan tersebut dapat dipisahkan secara elektroforesis. Variasi cpDNA ini ditunjukkan oleh ada tidaknya situs pengenal (recognition sites) untuk enzim spesifik (Finkeldey, 2005).
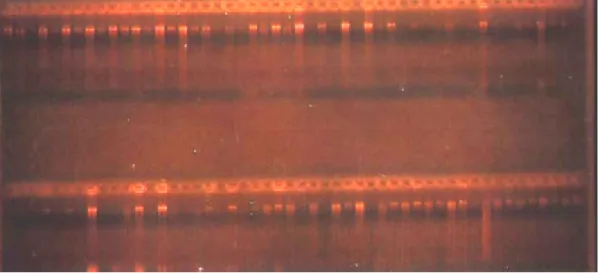
cpDNA dihasilkan dari amplifikasi PCR dengan menggunakan 4 macam primer. Hasil amplifikasi tersebut kemudian dipotong dengan menggunakan 10 macam enzim restriksi. Enzim restriksi yang digunakan dalam penelitian ini adalah Alu I, HinF I, Rsa I, Taq I, Cfo I, Msp I, Dra I, BamH I, Hind III dan Pst I. Hasil pemotongan kemudian diinterpretasikan pada gel agaros melalui teknik elektroforesis (Gambar 9).
Gambar 11. Elektroforegram hasil uji polimorfisme : (a) psaA-pst I (monomorfik), (b) petB-Hinf I (monomorfik), (d) rbcL-Alu I (polimorfik), M= marker
bond
Gambar 11a menujukkan bahwa dari hasil analisis dengan menggunakan primer psaA dan dipotong dengan enzim restriksi Pst I tidak terjadi pemotongan. Hal ini disebabkan tidak ada urutan basa TGCA↓G yang dikenali oleh enzym
Pst I sehingga tidak terjadi pemotongan. Keadaan dimana tidak adanya
pemotongan dan tidak ada variasi dinamakan monomorfik. Pada Gambar 11b yang menggunakan primer petB dan dipotong oleh Hinf I, telah terjadi pemotongan, karena terdapat urutan basa G↓ANTC, namun dari hasil pemotongan tersebut tidak menunjukkan adanya variasi cpDNA, dimana pola potongan yang
290 bp 210 bp 150 bp 2.642 bp 1.000 bp 650 bp 500 bp 2.642 bp 2.100 bp 1.500 bp 1.000 bp 500 bp
M Haur Bentes Tering Asialog Pasir Mayang Bukit Tigapuluh Nanjak Makmur Sari Bumi Kusuma ITCI Darmaga Bukit Bangkirai Sumalindo Carita 1 Carita 2
(a)
M Haur Bentes Tering Asialog Pasir Mayang Bukit Tigapuluh Nanjak Makmur Sari Bumi Kusuma ITCI Darmaga Bukit Bangkirai Sumalindo Carita 1 Carita 2
(b) 2.642 bp 1.500 bp 1.000 bp 350 bp 120 bp 180 bp 220 bp 250 bp 450 bp 500 bp
M Haur Bentes Tering Asialog Pasir Mayang Bukit Tigapuluh Nanjak Makmur Sari Bumi Kusuma ITCI Darmaga Bukit Bangkira
i
Sumalindo Carita 1 Carita 2
dinamakan monomorfik. Gambar 11b yang menggunakan primer rbcL dan enzim restriksi Alu I menghasilkan pola pita yang polimorfik, selain ada pemotongan juga ada variasi dari pola potongan tersebut. Hasil uji polimorfisme secara keseluruhan dari kombinasi perlakuan yang diuji disajikan pada Tabel 5
Tabel 5. Hasil uji polimorphisme
Primer Enzim
Restriksi petB psaA trnL rbcL
Alu I - - - + HinF I - - - - Rsa I - - - - Taq I - - - - Cfo I - - - - Msp I - - - - Dra I - - - - BamH I - - - - Hind III - - - - Pst I - - - - Keterangan : - monomorfik + polimorfik
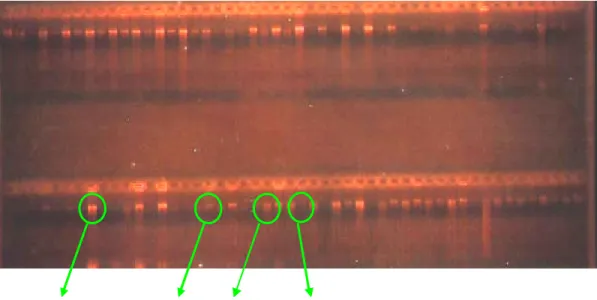
Hasil uji polimorfik melalui pemotongan dengan menggunakan sepuluh enzim restriksi menunjukkan bahwa hampir di semua perlakuan mempunyai pola pita yang sama (monomorfik). Pola pita yang sama tersebut menunjukkan tidak terdapatnya variasi DNA dengan menggunakan perlakuan tersebut. Tidak terdapatnya pemotongan, berarti tidak ditemukannya urutan basa yang dapat dikenali oleh enzim restriksi tertentu. Hal ini menujukkan tidak adanya variasi cpDNA. Pola pita yang bervariasi (polimorfik) ditemukan dengan mengunakan kombinasi perlakuan primer rbcL yang dipotong dengan menggunakan enzim restriksi Alu1 yang mengenali situs AG↓CT dan menghasilkan dua tipe pemotongan (polimorf), yaitu menjadi 3 potongan dan 4 potongan (Gambar 12). Variasi pemotongan oleh enzim restriksi ini menghasilkan haplotipe.
2.642 bp 1.500 bp 1.000 bp 500 bp 450 bp 350 bp 250 bp 220 bp 180 bp 130 bp Haploti pe 2 Haploti pe 1
M Haur Bentes Tering Asialog Pasir Manyang Bukit Tigapuluh Nanjak Makmur Sari Bumi Kusuma ITCI Darmaga Bukit Bangkirai Sumalindo Carita 1 Carita 2
M Haur Bentes Tering Asialog Pasir Manyang Bukit Tigapuluh Nanjak Makmur Sari Bumi Kusuma ITCI Darmaga Bukit Bangkirai Sumalindo Carita 1 Carita 2
Gambar 12. Elektroforegram hasil pemotongan cpDNA dengan menggunakan kombinasi perlakuan rbcL-Alu 1
Haplotipe yang ditemukan pada kombinasi rbcL- Alu 1 dalam suatu populasi maupun antar populasi dapat disebabkan akibat terjadinya pergantian, penambahan atau hilangnya basa tertentu pada urutan basa cpDNA S. leprosula sehingga tidak memotong pada situs yang sama. Hal ini menyebabkan terjadinya
2.642 bp 1.500 bp 1.000 bp 500 bp 450 bp 350 bp 250 bp 220 bp 180 bp 120 bp
perbedaan urutan pasangan basa pada ind ividu yang mempunyai tipe pemotongan basa yang berbeda. Fenomena ini mengindikasikan terdapatnya keragaman genetik di dalam populasi dan antar populasi.
Setelah dilakukan uji polimorfik, maka dilakukan uji lanjutan pada perlakuan yang mempunyai pola pita yang bervariasi, yaitu pada kombinasi perlakuan rbcL dan Alu I, karena kombinasi perlakuan ini mampu membedakan individu S. leprosula. Uji lanjutan berupa pengecekan ulang untuk memastikan bahwa contoh yang diteliti adalah S. leprosula. Pengecekan ini menggunakan herbarium dan dilakukan di Herbarium Bogoriense. Apabila hasil pengecekan menyatakan bahwa contoh tersebut adalah S. leprosula, kemudian dilakukan analisis. Analisis dimulai dengan memberikan nilai pada situs pemotongan yang berupa pita-pita DNA berdasarkan ada tidaknya situs pemotongan. Hasil analisis kemudian ditransformasikan dengan menggunakan angka biner, hasil transformasi tertera pada Lampiran 3. Nilai tersebut kemudian diolah dengan bantuan program komputer untuk mencari variasi cpDNA S. leprosula di Indonesia.
Keragaman intra populasi
Tabel 6. menunjukkan hasil dari pemotongan cpDNA dengan menggunakan rbcL-Alu I yang teridentifikasi berdasarkan PCR-RFLP pada 65 contoh di 13 populasi yang menghasilkan 2 haplotipe Tabel 6. Keseluruhan elektroforegram hasil analisis PCR dengan menggunakan primer rbcL dan pemotongan dengan Alu I tertera pada Lampiran 2.
Tabel 6. Haplotipe yang teridentifikasi pada 65 individu S. leprosula berdasarkan PCR-RFLP terdapat dua haplotipe.
rbcL-Alu 1 Tipe haplotipe 1 2 3 4 1 1 1 0 1 2 1 1 1 1
Perbedaan situs restriksi dapat diasumsikan sebagai kejadian mutasi titik (point mutation) yang menyebabkan berubahnya urutan DNA sehingga tidak dikenali oleh enzim. Dari Gambar 12 dapat diketahui bahwa haplotipe 2 berasal dari haplotipe 1 yang telah mengalami mutasi titik dan dikenali oleh rbcL-Alu 1.
Dimana fragmen dengan panjang 350 bp pada haplotipe 1, terpotong menjadi 2 fragmen pada haplotipe 2, yaitu menjadi 220 bp dan 130 bp. Adapun komposisi penyebaran haplotipe (relatipe frequencies) tersaji pada Tabel 7
Tabel 7. Frekuensi haplotipe dari 13 populasi
Haplotipe Hb Tr As Pm Bt Nm Sb It Dr Bb Sm C1 C2
1 1.0 1.0 0.4 1.0 0.8 1.0 1.0 0.4 1.0 1.0 1.0 1.0 1.0 2 0.0 0.0 0.6 0.0 0.2 0.0 0.0 0.6 0.0 0.0 0.0 0.0 0.0 Ket : Hb (Haur Bentes), Tr (Tering), As (asialog), Pm (Pasir Mayang), Bt (Bukit Tigapuluh), Nm
(Nanjak Makmur), Sb (Sari Bumi Kusuma), It (PT. ITCI), Dr (Darmaga), Bb (Bukit bangkirai), Sm (Sumalindo), C1 (Carita 1) dan C2 (Carita 2)
Ditinjau dari kondisi penyebaran haplotipe S. leprosula dari tiap populasi (Tabel 7 ) diketahui bahwa Haplotipe 1 merupakan haplotipe yang dominan dan tersebar di seluruh populasi, sedangkan Haplotipe 2 hanya ditemukan di tiga populasi, yaitu di PT. Asialog dan TN. Bukit Tigapuluh di pulau Sumatera, serta PT. ITCI Karya Utama di pulau Kalimatan, sedangkan di pulau Jawa tidak ditemukan Haplotipe 2. Hal ini menujukkan adanya keragaman dalam populasi (intra populasi) di ketiga populasi tersebut yang ditunjukkan oleh adanya variasi situs pemotongan pada deretan nukleotida yang teramplifikasi.
Terdapatnya Haplotipe 2 di Kalimantan dan Sumatera diduga terjadi karena pada jaman sebelum glasial pulau Kalimantan dan Sumatera merupakan satu daratan. Setelah terjadinya glasial (pencairan es) daratan ini terpisah menjadi pulau Kalimantan dan Sumatra, kejadian ini menurut Polunin (1990) terjadi pada jaman Pleistosen sekitar 1 juta tahun yang lalu.
Hasil pene litian menunjukkan tidak ditemukannya haplotipe spesifik yang dapat dijadikan sebagai penanda (fingerprint) yang dapat diasosiasikan sebagai asal-usul geografis tertentu di Indonesia. Haplotipe 2 tidak dapat dijadikan sebagai penanda karena terdapat di 3 populasi di pulau Sumatera dan Kalimantan. Khusus untuk pulau Kalimatan, rbcL-Alu I dapat dijadikan sebagai penanda, karena hanya ditemukan di satu populasi, yaitu di PT. ITCIKU.
Keragaman haplotipe pada intra spesies yang terdeteksi cukup rendah. Hal ini menunjukkan bahwa cpDNA sangat konservatif. Sifat konservatif cpDNA ini terjadi karena pada angiospermae hanya diturunkan oleh induk betina saja, sehingga menyebabkan aliran gen berupa migrasi benih yang terjadi sangat rendah dan mutasi yang terjadi juga sangat rendah. Sesuai dengan penelitian yang dilakukan Indrioko (2005) tidak menemukan perbedaan variasi cpDNA pada S.
Gambar 13. Penyebaran cpDNA S. leprosula di Indonesia berdasarkan penanda PCR-RFLP dengan menggunakan rbcL-Alu1
Keragaman inter populasi
Berdasarkan data keragaman situs restriksi kemudian dilakukan analisis variasi molekuler (Analysis of Molekular Variance, AMOVA) untuk melihat keragaman akibat sumber-sumber keragaman dalam populasi dengan bantuan program komputer Arlequin dari Schneider et al. (2000)
Tabel 8. Hasil perhitungan AMOVA berdasarkan 65 individu yang berasal dari 13 populasi Sumber ragam db Jumlah kuadrat Komponen ragam Persentase ragam Indeks fiksasi P Antar pulau 2 0.406 -0.00283 -2.85 FCT=0.02851 0.14663ns Antar populasi dalam pulau 10 2.640 0.04049 40.82 FSC=0.39686 0.00391* Dalam populasi 52 3.200 0.06154 62.03 FST=0.37967 0.00098* Total 64 6.246 0.09920
Keterangan: Derajat bebas (db), korelasi random pairs allel didapat dari nilai relatif grup dengan seluruh populasi (FCT), korelasi random pairs allel didapat dari nilai relatif populasi dengan seluruh grup (FSC), korelasi random pairs allel didapat dari nilai relatif populasi dengan seluruh populasi (FST), tidak berbeda nyata (ns) dan berbeda nyata (*) 810 11 7 6 3 12 1 9 2 c 4 5 Haplotipe 1 Haplotipe 2
Keragaman antar pulau memberikan hasil yang tidak berbeda nyata, sedangkan keragaman antar populasi dalam pulau dan keragaman dalam pulau memberikan hasil yang berbeda nyata.
Hasil analisis ragam molekuler (Tabel 8) menunjukkan bahwa ragam dalam populasi menyumbangkan persentase ragam tertinggi (62.03%) terhadap total ragam dan berbeda nyata, kemudian diikuti dengan persentase ragam pada level antar populasi dala m pulau (40.82%) dan antar pulau (-2.85%). Nilai negatif yang teramati pada level antar pulau mengindikasikan contoh populasi pada tiap-tiap pulau tidak berbeda.
Tabel 9. Matrik signifikasi nilai (P value) pada level 0.05
Hb As Tr Pm Bt Nm Sb It Dr Bb Sm C1 C2 Hb - - - + - - - - As - - - + - - - - Tr - - - - - - Pm - - - + - - - - Bt + + - + + + - + + + + + Nm - - - - + - - - - Sb - - - - + - - - - - It - - - - - - - - Dr - - - - + - - - - - - - Bb - - - - + - - - - - - - Sm - - - - + - - - - - C1 - - - - + - - - - C2 - - - - + - - - Ket : Hb (Haur Bentes), Tr (Tering), As (asialog), Pm (Pasir Mayang), Bt (Bukit Tigapuluh), Nm
(Nanjak Makmur), Sb (Sari Bumi Kusuma), It (PT. ITCI), Dr (Darmaga), Bb (Bukit bangkirai), Sm (Sumalindo), C1 (Carita 1) dan C2 (Carita 2), berbeda nyata antar populasi (+) dan tidak berbeda nyata antar populasi (-)
Pengelompokan genetik didasarkan pada jarak genetik. Jarak genetik digunakan untuk mengukur perbedaan struktur genetik antar dua populasi. Semakin kecil jarak genetik, semakin dekat kekerabatan genetiknya. Sebaliknya, semakin besar jarak genetik, maka semakin jauh kekerabatan genetiknya. Nilai jarak genetik berkisar antara 0 sampai 1. Nilai 0 dihasilkan dari perbandingan dua populasi yang mempunyai variasi genetik yang sama (identik). Nilai maksimum 1 dicapai jika dua populasi tersebut tidak membagi apa pun tipe genetik.
Pengukuran jarak genetik pada penelitian ini dilakukan dengan bantuan
sofware GSED ver 1.1i (Gillet, 2002). Jarak genetik S. leprosula berdasarkan