19
IV. HASIL DAN PEMBAHASAN
A. Pengaruh Perlakuan Terhadap Komponen Bioaktif Buah Takokak
Metode penelitian yang dilakukan diawali dengan tahap pemberian perlakuan terhadap sampel segar buah takokak dengan membagi sampel menjadi dua perlakuan, yaitu perlakuan buah utuh atau tanpa penghancuran dan hancuran buah. Tujuan pemberian perlakuan untuk mengidentifikasi dan memperoleh komponen bioaktif buah takokak dengan memberikan pengaruh penghancuran pada sebagian sampelnya, sehingga dapat diketahui dampaknya dan perbedaannya terhadap kandungan komponen bioaktif dengan buah yang tidak mengalami proses penghancuran. Komponen bioaktif yang diperoleh ini salah satunya berperan sebagai antioksidan.
Tahap persiapan sampel diawali dengan proses penimbangan sampel segar buah takokak yang telah dipisahkan dari tangkainya sebanyak 1-2 kg. Sampel mengalami pencucian dan penirisan untuk selanjutnya dibagi menjadi dua perlakuan. Proses penghancuran buah takokak dilakukan secara bertahap atau sedikit demi sedikit, yaitu sekitar 500 gram setiap proses penghancuran selama ± 10-15 menit tanpa penambahan air hingga keseluruhan bentuk hancuran sampel yang diperoleh relatif sama (homogen) untuk setiap kali proses penghancurannya.
Sampel buah utuh dan hancuran buah takokak yang diperoleh dimasukkan ke dalam plastik HDPE (bening) ukuran 1 kg, dimana ¾ bagian plastik diisi oleh sampel. Kemudian, sampel-sampel tersebut secara bersamaan dimasukkan ke dalam freezer selama satu malam dan dikeringkan dengan alat freeze dryer pada keesokan harinya selama + 48 jam. Setiap sampel diukur pula kadar air segarnya, sehingga dapat diketahui kadar air buah segar dan hancuran buah segar takokak.
Berdasarkan hasil analisis kadar air, buah takokak segar memiliki kadar air sebesar 80.94% bahan basah, sedangkan hancuran buah takokak segar memiliki kadar air sebesar 84.32% bahan basah. Perhitungan kadar air sampel segar secara lengkap dapat dilihat pada Lampiran 1. Menurut penelitian Rahmat (2009) dan Apriady (2010), kadar air buah takokak segar yang dianalisis sebesar 89.20% bahan basah dan 79.89% bahan basah. Hal ini menunjukkan, bahwa kandungan air pada buah dan hancuran buah segar takokak yang diperoleh relatif tinggi sebagai bahan pangan segar.
Nilai kadar air kedua sampel tersebut relatif tidak berbeda jauh. Pada buah segar takokak, analisis kadar air diawali dengan proses pemotongan atau pengirisan sampel. Hal ini untuk mempermudah dan mempercepat proses pengeringan. Sementara itu, untuk hancuran buah segar takokak, analisis kadar air diperoleh dari sampel buah takokak yang telah dihancurkan. Proses pemotongan atau pengirisan dan penghancuran akan berpengaruh terhadap luas permukaan bahan yang dikeringkan. Permukaan bahan yang luas ketika pengeringan akan memudahkan bahan berhubungan dengan medium pemanasan atau udara panas dan mengurangi jarak gerak panas untuk sampai ke bahan yang dikeringkan (Muchtadi 2008). Sebagai tambahan, air bebas pada bahan segar banyak yang terikat di jaringan matriks bahan, seperti kapiler, membran, serat, dan lain-lain. Air bebas ini mudah diuapkan dan sering dimanfaatkan sebagai media pertumbuhan mikroba dan media reaksi-reaksi kimiawi (Winarno 1980).
Sebelumnya telah dijelaskan bahwa buah takokak mengalami pengeringan terlebih dahulu dengan menggunakan alat pengering beku (freeze dryer) selama ± 48 jam. Salah satu tujuan pengeringan beku dilakukan untuk mengurangi tingkat kerusakan sampel pada senyawa metabolit sekunder, khususnya senyawa flavonoid (Sandrasari 2008). Tingkat kerusakan bahan pangan yang dikeringkan dengan cara pengeringan beku menjadi lebih minimum karena prinsipnya berupa penghilangan air melalui sublimasi yakni perubahan wujud padat (es) langsung menjadi gas (uap)
20 dengan suhu pengeringan di bawah titik beku dan tekanan vakum (di bawah tekanan triple) (Fellows 2000). Proses ini dapat menghambat dan tidak memungkinkan aktivitas enzim mendegradasi senyawa di dalam bahan pangan (Chan 2009). Selain itu, pengeringan beku (freeze-drying) memiliki efisiensi ekstraksi yang tinggi daripada pengeringan udara (air-drying) karena kristal es yang terbentuk di dalam matriks bahan sebagai hasil pengeringan beku dapat memecah struktur sel yang memungkinkan keluar dari komponen seluler dan larut baik dalam pelarut, akibatnya proses ekstraksi pun akan menjadi lebih baik. Sementara itu, pengeringan udara hanya akan menyebabkan pecahnya sel sedikit saja atau bahkan tidak pecah dan adanya pengaruh pemberian panas yang dapat menyebabkan bahan yang dikeringkan kehilangan senyawa fenolik dan asam askorbat (Asami et al. 2003).
Setelah proses pengeringan beku, sampel dihancurkan dengan cara diblender kering dan diayak dengan ayakan berukuran 20 mesh untuk memperoleh bubuk takokak dengan kehalusan yang cukup tinggi dan seragam. Sampel dalam bentuk bubuk akan mempermudah kontak antara bahan dan pelarutnya, sehingga proses ekstraksi lebih optimal. Hasil warna bubuk hancuran buah dan buah takokak dapat dilihat pada Gambar 8.
Warna bubuk buah takokak yang diperoleh berwarna hijau muda, sedangkan bubuk hancuran buah takokak berwarna kecoklatan. Hal ini disebabkan pigmen atau warna bahan pangan sangat sensitif terhadap perubahan kimia dan fisika selama pengolahan, seperti proses penghancuran. Peningkatan aktivitas beberapa enzim akibat proses penghancuran disebabkan sel-sel tenunan dan pigment body tempat pigmen itu berada telah pecah, sehingga pigmen keluar (Muchtadi 2008). Kemudian, pigmen tersebut menjadi rusak dan teroksidasi karena kontak dengan udara yang dikatalisasi oleh enzim, seperti enzim peroksidase (POD) dan polifenol oksidase (PPO). Enzim POD dan PPO dapat mengkatalisasi berbagai proses oksidatif pada reaksi perubahan warna dan cita rasa (Gardjito et al. 2006). Dengan demikian, secara fisik terlihat sampel hancuran buah takokak mengalami perubahan warna dari hijau muda menjadi kecoklatan.
Gambar 8. Warna bubuk hancuran buah dan buah takokak (kiri ke kanan)
Bubuk buah dan hancuran buah takokak hasil pengeringan beku ditentukan kadar airnya seperti pada Lampiran 2. Berdasarkan hasil analisis, kadar air bubuk buah takokak sebesar 7.72% bahan basah dan kadar air bubuk hancuran buah takokak sebesar 8.50% bahan basah. Menurut penelitian Rahmat (2009), kadar air bubuk buah takokak yang diperoleh sebesar 4.36% bahan basah dan Apriady (2010) menyebutkan bahwa kadar air buah takokak segar yang dianalisis sebesar 13.16% bahan basah. Adanya perbedaan antara hasil kadar air bubuk buah takokak pada penelitian ini dengan penelitian sebelumnya dapat disebabkan oleh faktor kondisi keragaman buah atau sampel yang diuji, seperti sumber atau buah berasal dari pohon yang berbeda dan tingkat kematangan buah yang kemungkinan bervariasi (Tanudjaja 1999). Kemudian, suatu bahan yang kadar airnya berkisar 3-7% akan mencapai kestabilan optimum, terutama pada bahan-bahan yang mengandung lemak tak jenuh yang lebih mudah mengalami oksidasi (Winarno 1980). Oleh karena itu, kadar air yang diperoleh pada bubuk buah dan hancuran buah takokak yang diuji akan membuat bahan menjadi lebih stabil selama penyimpanan, karena tingkat perubahan bahan secara biologis dan kimiawi relatif rendah.
21 Sampel bubuk buah dan hancuran buah takokak dianalisis untuk diketahui kandungan total antosianin, total asam askorbat, dan aktivitas Phenylalanine Ammonia Lyase (PAL) termasuk kandungan proteinnya dengan metode protein Lowry. Alasan penggunaan sampel bubuk untuk beberapa analisis ini karena ingin diketahui pengaruh penghancuran terhadap komponen-komponen kimia tersebut.
1. Kandungan Antosianin Buah Takokak
Antosianin memiliki cincin aromatik bergugus polar (hidroksil, karboksil, metoksil) dan residu glikosil yang menghasilkan molekul polar. Maka dari itu, pigmen antosianin dilarutkan dengan menggunakan pelarut polar, seperti etanol, metanol, dan air (Bridle dan Timberlake 1997). Namun biasanya proses ekstraksi pun menggunakan pelarut asam untuk mendenaturasi dan merusak membran sel atau jaringan tanaman, sehingga pigmen antosianin lebih mudah keluar dari sel. Hal ini karena, antosianin senyawa yang tidak stabil dalam suasana netral atau basa (Jackman dan Smith 1996).
Cara ekstraksi antosianin secara sederhana dan sering digunakan adalah dengan maserasi, yaitu merendam bahan yang diekstrak dalam alkohol, suhu rendah, dan dengan penambahan sedikit asam seperti HCl. Berdasarkan penelitian oleh Raharja dan Dianawati (2001), bahwa ekstraksi antosianin pada daun erpa dengan menggunakan tiga jenis pelarut, yaitu aquades, etanol, dan metanol yang masing-masing mengandung HCl, maka ditemukan bahwa aquades yang mengandung HCl (HCl 5% dalam aquades) cukup asam untuk memecah dinding sel vakuola dimana pigmen antosianin berada. Namun pelarut ini tidak terlalu asam untuk membuat kerusakan pigmen. Pemilihan jenis pelarut HCl 5% dalam aquades untuk penelitian ini pun diperkuat dengan penelitian yang dilakukan oleh Kurniasih (2010), bahwa penelitian kandungan antosianin pada 24 sampel sayuran indigenous menunjukkan nilai yang relatif tinggi, khususnya pada buah takokak.
Beberapa metode untuk mengetahui kandungan antosianin suatu bahan, antara lain metode dengan larutan yang memiliki nilai satu pH dan metode dengan menggunakan dua larutan dengan dua nilai pH yang berbeda. Salah satu metode dengan menggunakan satu nilai pH dalm penelitian ini, yaitu metode Lees dan Francis (1972). Total antosianin dihitung berdasarkan absorbansi ekstrak yang dilarutkan dalam etanol 95%:HCl 1.5 N (85:15) pada panjang gelombang 535 nm. Nilai serapan molar yang digunakan adalah 98.2, yaitu nilai E (1%, 1 cm, 535 nm) untuk pelarut etanol yang diasamkan. Nilai tersebut merujuk pada absorpsi campuran antosianin buah cranberry di dalam etanol asam yang diukur di dalam celah selebar 1 cm pada panjang gelombang 535 nm dengan konsentrasi 1% (w/v).
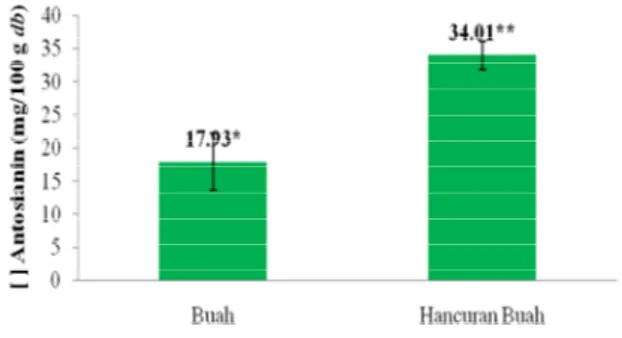
Hasil nilai total antosianin buah dan hancuran buah takokak ini dihitung dalam berat segar (fresh weight) yang secara berurutan sebesar 3.42 mg/100 gram fresh weight dan 5.33 mg/100 gram fresh weight atau dalam basis keringnya (dry basis) sebesar 17.93 mg/100 gram dry basis dan 34.01 mg/100 gram dry basis. Perhitungan total antosianin takokak secara lengkap dapat dilihat pada Lampiran 3.
Pengolahan data nilai total antosianin buah dan hancuran buah takokak menggunakan uji t-test dengan output seperti pada Lampiran 4. Hasil uji statistik menunjukkan adanya perbedaan yang nyata terhadap nilai kandungan antosianin kedua sampel dalam basis kering sampel (dry basis) seperti pada Gambar 9. Hal ini terlihat dari nilai signifikansi sampel yang dihasilkan, yaitu lebih kecil dari taraf α (0.05).
22
Keterangan : Tanda * dan ** menunjukkan berbeda nyata (p<0.05) dengan uji t-test
Gambar 9. Total antosianin buah takokak berdasarkan dry basis
Perbedaan nilai total antosianin buah dan hancuran buah karena pigmen antosianin buah berwarna lebih kehijauan dan hancuran buah takokak berwarna lebih merah kecoklatan. Pada sampel buah takokak, antosianin kurang terlarut baik dalam pelarut ekstrak karena membran sel tempat pigmen antosianin berada tidak terdenaturasi secara baik. Di samping itu, pigmen klorofil (zat hijau) buah takokak lebih mendominasi daripada pigmen antosianin. Aktivitas pembentukan antosianin pada bagian-bagian tanaman (termasuk buah) dapat terjadi secara bersamaan dengan pembentukan klorofil. Kemudian, pigmen antosianin pada hancuran buah takokak lebih terlarut baik pada pelarut ekstrak karena pada awal persiapan sampel, sampel mengalami penghancuran, sehingga membran sel tempat pigmen antosianin berada sudah terdegradasi lebih awal.
Nilai total antosianin buah takokak yang diuji, baik yang dalam kondisi buah utuh atau pun hancuran buah lebih rendah daripada buah terong (Solanum melongena) sebesar 45.01 mg/100 gram fresh weight (Sadilova et al. 2006). Namun, nilai total antosianin buah takokak yang diuji pada penelitian ini masih berada atau dekat hasilnya dengan.nilai total antosianin buah takokak penelitian Kurniasih (2010), yaitu sebesar 22.09 mg/100 gram dry basis.
2. Kandungan Asam Askorbat (Vitamin C) Buah Takokak
Analisis vitamin C dalam penelitian ini menggunakan pelarut air untuk mengekstrak dan membantu melarutkan vitamin C dari bubuk buah dan hancuran buah takokak. Hal ini disebabkan asam askorbat atau vitamin C merupakan salah satu vitamin yang tergolong larut air disamping vitamin-vitamin B kompleks (Winarno 1997). Metode yang digunakan untuk mengetahui total asam askorbat sampel menggunakan metode titrasi dengan iodium. Ekstrak sampel yang diperoleh direaksikan dengan larutan amilum (soluble starch) 1%. Larutan ini merupakan indikator perubahan warna ekstrak setelah dititrasi dengan 0.01 N iodium, menjadi warna semburat biru. Sebanyak 1 ml 0.01 N iodium setara dengan 0.88 mg asam askorbat, sehingga hasil titrasi yang diperoleh dapat dikalkulasikan menjadi seberapa banyak asam askorbat (vitamin C) dalam sampel tersebut.
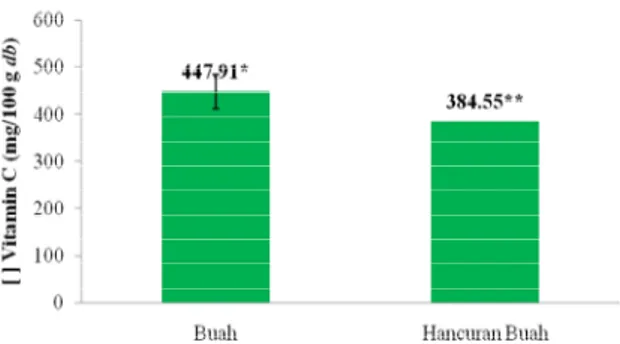
Perhitungan total asam askorbat dapat dilihat pada Lampiran 5. Hasil total asam askorbat (vitamin C) buah dan hancuran buah takokak dalam berat segar (fresh weight) berturut-turut sebesar 85.37 mg/100 gram fresh weight dan 60.30 mg/100 gram fresh weight, sedangkan dalam basis kering sampel (dry basis), nilai total asam askorbat buah takokak sebesar 447.91 mg/100 gram dry basis dan hancuran buah takokak sebesar 384.55 mg/100 gram dry basis. Pengujian secara statistik untuk nilai total asam askorbat (vitamin C) sampel menggunakan uji t-test dengan output seperti pada Lampiran
23 6. Nilai total asam askorbat buah takokak terlihat berbeda nyata (p<0.05) dengan nilai total asam askorbat hancuran buah takokak pada taraf signifikansi 5% setelah di uji t-test dalam dry basis (Gambar 10).
Keterangan : Tanda * dan ** menunjukkan berbeda nyata (p<0.05) dengan uji t-test
Gambar 10. Total asam askorbat (vitamin C) buah takokak berdasarkan dry basis
Nilai total asam askorbat buah takokak lebih tinggi dari hancuran buah takokak dan secara statistik berbeda nyata untuk kedua jenis sampel ini. Hal tersebut dikarenakan buah takokak tidak mengalami penghancuran (perlakuan mekanis) pada persiapan sampel. Vitamin C mudah mengalami kerusakan akibat oksidasi, panas, dan alkali, sehingga pengirisan dan penghancuran yang berlebihan dapat menyebabkan vitamin C pada bahan banyak yang hilang (Winarno 1997). Penurunan kadar vitamin C pada takokak akibat penghancuran akan membuat bahan mudah teroksidasi dan kemungkinan akan memicu pula aktivitas enzim, seperti peroksidase, asam askorbat oksidase, sitokrom oksidase, dan fenolase.
Penelitian Kurniasih (2010) pun menyebutkan, bahwa kandungan asam askorbat buah takokak sebagai salah satu sampel sayuran indigenous dari ke-24 sampel yang diuji sebesar 639.98 mg/100 gram dry basis. Apabila dibandingkan dengan sayuran buah lainnya yang masih satu famili Solanaceae, total asam askorbat buah dan hancuran buah takokak yang diuji relatif masih lebih tinggi. Seperti penelitian Vasco et al. (2008) yang menyebutkan bahwa total asam askorbat dari buah naranjilla (Solanum quitoense Lam.) dan pepino (Solanum muricatum Ait.) hanya sebesar 11-13 mg/100 gram fresh weight dan 20-38 mg/100 gram fresh weight. Begitu pula dengan total asam askorbat buah terong (Solanum melongena) yang hanya mengandung 12.0 mg/100 gram fresh weight (Gopalan et al. 2007) dan 56–129 mg/100 gram dry basis (Hanson et al. 2006) serta total asam askorbat Solanum aethiopicum sebesar 71-98 mg/100 gram dry basis (Hanson et al. 2006). Total asam askorbat buah dan hancuran buah takokak ini sudah dapat mencukupi kebutuhan tubuh akan kebutuhan vitamin C setiap harinya. Kebutuhan tubuh akan vitamin C berdasarkan RDA (Recommended Dietary Allowance) atau AKG (Angka Kecukupan Gizi) untuk pria dewasa dan wanita menurut National Academy of Science (2000) adalah 75-90 mg/hari.
3. Phenylalanine Ammonia Lyase (PAL) Buah Takokak
Phenylalanine Ammonia Lyase (PAL) (E.C. 4.1.1.5) merupakan salah satu enzim yang berperan dalam metabolisme sekunder pada tanaman. Menurut Sadasivam dan Manickam (1996), PAL berperan dalam konversi substrat asam amino aromatik L-fenilalanin menjadi asam
trans-24 sinamat. Aktivitas PAL dalam penelitian ini dinyatakan sebagai jumlah asam trans sinamat (µmol) yang terbentuk per mg protein setiap menit.
Perhitungan nilai protein takokak dengan metode Lowry. Perhitungan kurva standar yang diperoleh untuk standar protein BSA tercantum pada Lampiran 7a dengan persamaan garis yang diperoleh y = 0.0034x + 0.0342 dan R² = 0.9993. Nilai kandungan protein Lowry dapat dilihat pada Lampiran 7b, dimana kandungan protein bubuk buah takokak dan bubuk hancuran buah takokak, yaitu sebanyak 48.83 µg/g sampel dan 55.97 µg/g sampel.
Kemudian, kurva standar aktivitas PAL berupa asam trans sinamat tercantum pada Lampiran 7c dan perhitungan aktivitas PAL buah takokak dapat dilihat pada Lampiran 7d. Persamaan garis standar asam trans sinamat adalah y = 0.1246x - 0.2953 dan R² = 0.9984. Hasil aktivitas PAL (Gambar 11) buah dan hancuran buah takokak yang diperoleh sebesar 1.37 µmol trans cinnamic acid/mg protein/menit dan 0.76 µmol trans cinnamic acid/mg protein/menit. Hasil aktivitas PAL diuji secara statistik dengan uji t-test (Lampiran 8) dan hasilnya menunjukkan adanya perbedaan nyata antara aktivitas PAL buah takokak dengan aktivitas PAL hancuran buah takokak pada taraf signifikansi 5%, karena nilai signifikansi sampel lebih kecil dari 0.05 (p<0.05). Nilai aktivitas PAL buah takokak lebih tinggi dibandingkan aktivitas PAL hancuran buah takokak, karena proses penghancuran bahan akan membuat aktivitas PAL menjadi turun akibat protein dalam bahan mengalami denaturasi dan pada saat itu konformasi enzim tidak berada pada posisi yang sesuai untuk dapat menempel pada substratnya (Tanudjaja 1999).
Aktivitas PAL dibandingkan terhadap protein bahan karena enzim PAL berfungsi untuk mengkatalisis perubahan asam amino aromatik fenilalanin menjadi asam trans sinamat. Fenilalanin yang termasuk asam amino aromatik bercincin benzena ini diidentifikasi dengan metode Lowry. Metode Lowry merupakan salah satu metode untuk mengetahui jumlah protein atau asam amino jenis aromatik, seperti tirosin, triptofan, dan fenilalanin dengan mereduksi Cu2+ menjadi Cu+. Ion Cu+ akan mereduksi reagen Folin-Ciocalteau, kompleks phosphomolibdat-phosphotungstat (phosphomolybdotungstate), menghasilkan heteropolymolybdenum blue akibat reaksi oksidasi gugus aromatik (rantai samping asam amino) terkatalis Cu, yang memberikan warna biru intensif yang dapat dideteksi secara kolorimetri (Lowry 1951). Kandungan protein bahan ini berbeda dengan aktivitas PAL yang ditunjukkan. Hal ini disebabkan, protein yang diperoleh dengan metode Lowry tidak semuanya adalah asam amino jenis fenilalanin. Namun demikian, kandungan asam amino fenilalanin buah takokak kemungkinan lebih banyak daripada asam amino fenilalanin hancuran buah takokak, sehingga aktivitas PAL buah takokak relatif lebih tinggi.
Keterangan : Tanda * dan ** menunjukkan berbeda nyata (p<0.05) dengan uji t-test
25 Penelitian terkait aktivitas PAL relatif masih terbatas, khusunya untuk famili Solanaceae. Nilai aktivitas Phenylalanine Ammonia Lyase (PAL) buah takokak termasuk rendah jika dibandingkan dengan aktivitas PAL dari buah segar seperti buah tomat yang belum diinfeksi larva sebesar 5 µmol trans sinamat/mg protein N (Brueske 1980). Kemudian, aktivitas PAL yang terdeteksi pada kulit buah segar blueberries sebesar 2.3 µmol/mg protein dan cranberries beku (frozen powder) sebesar 0-3.5 µmol/mg protein (Sapers et al. 1987). Namun, aktivitas PAL relatif lebih tinggi dibandingkan host plant Persea bombycina dengan tingkat kematangan medium sebesar 4.14 x 10-3 µmol/mg/menit dan host plant Litsea citrate sebesar 0.96 x 10-3 µmol/mg/menit seperti pada penelitian Neog et al. (2011). Beberapa faktor lain yang mempengaruhi aktivitas PAL adalah cahaya atau sinar, keragaman buah (bahan), perlakuan stress pada tanaman, dan kematangan buah. Total aktivitas PAL setiap buah akan lebih tinggi nilainya saat buah tersebut matang dibandingkan buah yang masih muda (Cheng et al. 1991).
Umumnya, nilai antosianin berkaitan dengan nilai aktivitas PAL, namun kondisi tersebut tidaklah mutlak. Seperti pada penelitian buah takokak ini, nilai total antosianin buah takokak tidak berkorelasi atau tidak mempengaruhi nilai aktivitas PAL-nya. Peningkatan aktivitas PAL tidak selalu bertanggung jawab pada akumulasi antosianin pada suatu bahan. PAL hanya merupakan enzim kunci untuk menghasilkan prekursor zat warna bagi tanaman, salah satunya seperti antosianin. Pengaturan konsentrasi prekursor inilah yang kemungkinan berpengaruh terhadap jumlah antosianin yang dihasilkan. Tetapi, jika jumlah prekursor pada buah telah mencukupi, perubahan aktivitas PAL tidak berkaitan dengan akumulasi antosianin. Kondisi maksimum aktivitas PAL dan antosianin bisa berbeda. Kemudian, penemuan lainnya menemukan bahwa jenis senyawa fenol sederhana lebih erat berkorelasi dengan tingkat PAL daripada antosianin karena fenol sederhana dihasilkan pada awal biosintesis fenolik melalui jalur fenilpropanoid dengan melibatkan enzim PAL (Ju et al. 1995).
B. Kualitatif dan Kuantitatif Komponen Bioaktif Ekstrak Buah Takokak
Tahap penelitian ini selanjutnya adalah tahap pengekstraksian sampel bubuk buah takokak. Tujuannya untuk memperoleh zat atau senyawa kimia (fitokimia) yang berperan sebagai metabolit sekunder dari ekstrak, sehingga dapat diketahui pula perubahan senyawa tersebut dan kadar serta aktivitas antioksidan pada hancuran buah. Tahap ekstraksi sampel bubuk takokak dengan menggunakan metode ekstraksi maserasi. Metode ini merupakan salah satu metode ekstraksi yang cukup sederhana karena dilakukan dengan cara melarutkan sampel menggunakan pelarut, perendaman selama beberapa hari, dilakukan pengadukan, dan proses penyaringan hingga diperoleh cairan (Pandiangan 2008). Pada proses ekstraksi, sampel bubuk buah dan hancuran buah takokak dilarutkan dengan pelarut organik, yaitu metanol (polar), etil asetat (semi polar), dan heksan (non polar). Penggunaan ketiga pelarut organik yang berbeda kepolarannya ini akan menentukan jenis komponen bioaktif (fitokimia) yang terekstrak dari sampel. Oleh karena itu, sampel ekstrak yang diperoleh dianalisis secara kualitatif dan kuantitatif.
Warna ekstrak hasil ekstraksi buah dan hancuran buah takokak dapat dilihat pada Gambar 12. Warna ekstrak bubuk buah takokak dan bubuk hancuran buah takokak yang dilarutkan dalam pelarut metanol, etil asetat, dan heksan tidak berbeda. Warna hijau yang diperoleh dari jenis ekstrak metanol dan etil asetat menunjukkan bahwa kemungkinan buah dan hancuran buah takokak mengandung senyawa klorofil (zat hijau). Sementara itu, warna kuning yang diperoleh dari jenis ekstrak heksan menunjukkan bahwa buah dan hancuran buah diduga mengandung senyawa flavonoid, karotenoid, dan antosianin.
26 Gambar 12. Ekstrak buah takokak pelarut heksan (a), etil asetat (b), dan metanol (c);
Ekstrak hancuran buah takokak pelarut heksan (d), etil asetat (e), dan metanol (f)
1. Kualitatif Fitokimia Ekstrak Buah Takokak
Hasil ekstraksi buah dan hancuran buah takokak dianalisis lanjut secara kualitatif dengan melihat perubahan warna setelah ekstrak ditambahkan zat-zat kimia atau perlakuan tertentu. Perubahan warna atau secara fisik ekstrak menunjukkan bahwa ekstrak mengandung komponen senyawa bioaktif tertentu. Hasil analisis kualitatif komponen bioaktif (fitokimia) ekstrak buah dan hancuran buah dari pelarut metanol, etil asetat, dan heksan secara keseluruhan tidak berbeda. Perbedaan kandungan komponen kimia terdapat pada ekstrak antar pelarut. Ekstrak buah utuh dan hancuran buah untuk jenis pelarut metanol mengandung alkaloid, flavonoid jenis flavon, tanin, dan saponin. Sementara itu, ekstrak buah utuh dan hancuran buah untuk jenis pelarut etil asetat dan heksan mengandung alkaloid, flavonoid jenis flavon, terpenoid, dan saponin.
Perbandingan hasil fitokimia ekstak buah takokak dengan beberapa penelitian lainnya dapat dilihat secara lengkap pada Tabel 2. Menurut Chah et al. (2000), ekstrak metanol buah takokak yang diuji menunjukkan adanya kandungan alkaloid, flavonoid, tanin, dan saponin. Adanya kandungan komponen bioaktif ini ditunjukkan dengan adanya perubahan warna atau endapan (+). Hasil penelitian Rammohan et al. (2011) menunjukkan hasil positif adanya kandungan alkaloid, isoflavonoid, dan tanin pada ekstrak metanol buah takokak. Sementara itu, Stevanie et al. (2007) menyatakan adanya hasil positif terhadap kandungan flavonoid dan terpenoid pada sampel ekstrak n-heksan buah takokak yang diuji. Penelitian Sapkale et al. (2009) menyatakan bahwa adanya kandungan positif terhadap flavonoid, alkaloid, tanin, dan steroid pada ekstrak alkohol buah takokak (Solanum torvum Swartz.). Dengan demikian, secara umum hasil fitokimia ekstrak metanol buah dan hancuran buah takokak yang diuji masih memiliki banyak kesamaan dengan hasil fitokimia ekstrak metanol atau etanol dari sayuran buah lainnya yang masih termasuk famili Solanaceae. Perbedaannya lebih terletak pada jenis flavonoid yang teridentifikasi pada ekstrak metanol buah dan hancuran buah takokak, yaitu jenis flavon, sedangkan jenis flavonoid ekstrak metanol buah takokak pada penelitian Rammohan et al. (2011) adalah jenis isoflavonoid.
27 Tabel 2. Hasil kualitatif komponen bioaktif (fitokimia) ekstrak sayuran buah famili Solanaceae
Keterangan : (+) me
Nama Indonesia Nama Latin Ekstrak Alkaloid Flavonoid Tanin Terpenoid Steroid Saponin Referensi
Dragendorff Mayer Wagner Takokak (buah dan hancuran buah) Solanum torvum Swartz. Metanol + + + + (flavon) + - - +
Etil Asetat - + + + (flavon) - + - +
Heksan - + + + (flavon) - + - +
Takokak Solanum torvum Swartz.
Metanol +* + + + Chah et al. (2000)
Alkohol +* + + + Sapkale et al.
(2009)
Metanol +* +
(isoflavonoid) +
Rammohan et al. (2011)
n-Heksana + + Stevanie et al.
(2007) Solanum
trilobatum Linn. Aqueous + + +
Latha dan Kannabiran (2006)
Solanum gilo Metanol +* + + + Hassan et al.
(2006) Terong Solanum melongena Metanol + - + + + - Tiwari et al. (2009) Aqueous + + + + + + Terong Belanda Solanum betaceum
Cav. Etanol +* + + + + Sinaga (2009)
Leunca Solanum nigrum
Linn. Etanol +* + + +
Karmakar et al. (2010) Solanum
aethiopicum L. Aqueous +* + + + + + Chinedu et al.
(2011) Solanum macrocarpon L. Aqueous +* + + + - + Pepino Solanum muricatum Aiton. Sari buah (air) +* + + Saptarini et al. (2011) Terong hias Solanum
macranthum Metanol +* + + + +
Olayemi et al. (2011) Keterangan : (+) menunjukkan adanya perubahan dalam bentuk warna atau endapan; (+*) menunjukkan bahwa referensi tidak menjelaskan hasil fitokimia alkaloid dengan metode spesifik; (-) tidak menunjukkan adanya perubahan dalam bentuk warna atau endapan
28 Senyawa alkaloid terdapat pada ketiga pelarut, yaitu metanol, etil asetat, dan heksan. Hal ini dikarenakan senyawa alkaloid hanya dapat terlarut baik pada pelarut organik. Senyawa alkaloid merupakan senyawa organik (metabolit sekunder) terbesar diantara senyawa lainnya baik secara jumlah maupun penyebarannya (Astuti et al. 1995). Oleh karena itu, kemungkinan ditemukannya senyawa alkaloid pada ketiga ekstrak buah dan hancuran buah menjadi lebih besar.
Senyawa flavonoid dan tanin merupakan senyawa fenolik yang dapat larut dalam pelarut polar karena adanya gugus hidroksi, sehingga pada ekstrak metanol, senyawa ini dapat terdeteksi. Kemudian, pada pelarut etil asetat yang bersifat semipolar juga ditemukan adanya senyawa flavonoid dan fenol, karena sifat pelarut etil asetat yang mampu mengekstrak senyawa bersifat polar dan non polar. Pada ekstrak buah dan hancuran buah pelarut heksan dapat ditemukan adanya senyawa flavonoid. Hal ini dimungkinkan, struktur senyawa flavonoid pada pelarut heksan merupakan aglikon flavonoid, yaitu flavonoid tanpa gula terikat. Contoh senyawa aglikon flavonoid, seperti isoflavon, flavonon, flavon, dan flavonol yang termetoksilasi yang cenderung lebih mudah larut dalam pelarut non polar (Markham 1988).Senyawa terpenoid, steroid, dan saponin termasuk senyawa yang dapat larut lemak, sehingga dapat terekstrak dengan pelarut non polar, seperti heksan. Saponin pun masih dapat ditemukan pada pelarut polar metanol (Cowan 1999).
Setelah diketahui hasil analisis ekstrak secara kualitatif, sampel ekstrak juga dianalisis secara kuantitatif dengan menganalisis kandungan total fenolnya dalam setiap ekstrak, sehingga dapat dihitung pula nilai total fenol buah dan hancuran buah takokak.
2. Total Fenol dan Yield Ekstrak Buah Takokak
Total fenol ekstrak diperoleh dengan mereaksikan ekstrak sampel dari masing-masing pelarut (metanol, etil asetat, dan heksan) bersama senyawa folin. Senyawa fenol dapat bereaksi dengan gugus kromofor pada fenolik dan dapat diukur dengan spektrofotometer pada panjang gelombang 725 nm. Perhitungan total fenol ekstrak dengan membandingkan fenol pada kurva standar asam galat.
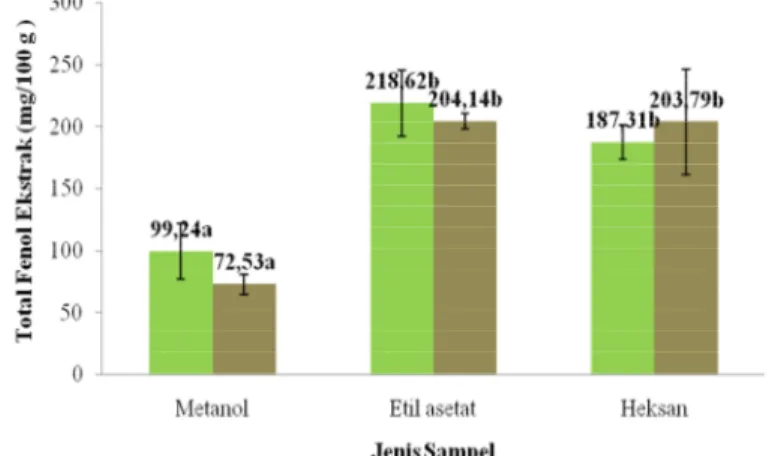
Persamaan garis dari kurva standar asam galat adalah y = 0.0035x - 0.0719 dengan nilai R2 = 0.9985. Konsentrasi asam galat yang dibuat adalah 50, 100, 150, 200, dan 250 mg/L. Kurva standar asam galat dapat dilihat pada Lampiran 9a. Perhitungan total fenol ekstrak dilakukan untuk setiap jenis ekstrak. Perhitungan total fenol ekstrak buah dan hancuran buah dalam satuan mg/100 gram dapat dilihat secara lengkap pada Lampiran 9b dan 9c. Nilai rata-rata total fenol ekstrak metanol, etil asetat, dan heksan buah takokak secara berurutan adalah 99.24 mg/100 gram ekstrak, 218.62 mg/100 gram ekstrak, dan 187.31 mg/100 gram ekstrak. Sementara itu, nilai rata-rata total fenol untuk ekstrak metanol hancuran buah sebesar 72.53 mg/100 gram ekstrak, ekstrak etil asetat dan heksan hancuran buah berturut-turut sebesar 204.14 mg/100 gram ekstrak dan 203.79 mg/100 gram ekstrak.
Hasil uji ANOVA total fenol ekstrak buah takokak berbeda nyata (p<0.05) pada taraf signifikansi 5% terhadap jenis pelarutnya, namun untuk perlakuan buah dan hancuran buah tidak berbeda nyata pada taraf signifikansi 5% karena nilai signifikansi sampel lebih besar (p>0.05), seperti terlihat pada Lampiran 10a. Perbedaan hasil ANOVA dilanjutkan dengan uji lanjut Duncan pada Lampiran 10b. Hasil uji lanjut Duncan menunjukkan bahwa total fenol ekstrak untuk jenis pelarut antara ekstrak metanol dengan ekstrak etil asetat dan heksan berbeda nyata karena berada pada subset yang berbeda.
Kemudian, hasil uji ANOVA total fenol ekstrak untuk faktor interaksi perlakuan (buah dan hancuran buah) dan jenis pelarut berbeda nyata (p<0.05) pada taraf signifikansi 5%, seperti terlihat pada Lampiran 10c. Hasil perbedaan ini dilanjutkan dengan uji lanjut Duncan yang dapat dilihat di Lampiran 10d. Hasil uji lanjut Duncan menunjukkan bahwa total fenol ekstrak untuk perlakuan buah
29 ekstrak metanol berada pada subset yang sama dengan hancuran buah ekstrak metanol. Namun, kedua sampel tersebut berbeda subset dengan buah atau hancuran buah ekstrak etil asetat dan buah atau hancuran buah ekstrak heksan. Dengan demikian, pengaruh perlakuan berupa buah dan hancuran buah tidak menyebabkan perbedaan secara signifikan terhadap nilai total fenol ekstrak. Sementara itu, pengaruh jenis pelarut menyebabkan perbedaan yang signifikan terhadap nilai total fenol ekstrak. Nilai total fenol ekstrak untuk perlakuan (buah dan hancuran buah takokak) dan jenis pelarut dapat dilihat pada Gambar 13.
Keterangan : Huruf yang berbeda menunjukkan berbeda nyata (p<0.05) dengan uji lanjut Duncan
Gambar 13. Total fenol ekstrak buah takokak untuk perlakuan (buah dan hancuran buah) dan jenis pelarut
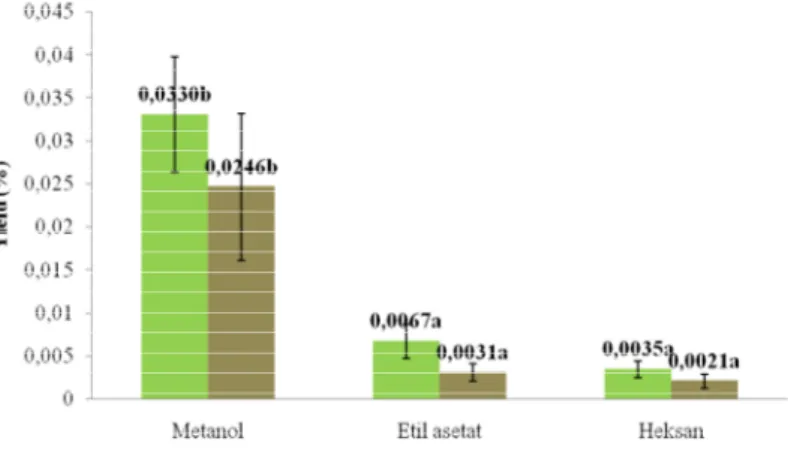
Perhitungan yield ekstrak dilakukan untuk mengetahui berat fenol tiap ekstrak terhadap berat kering bahan yang diekstrak. Berat fenol dalam tiap ekstrak diperoleh dari total fenol ekstrak dengan berat ekstrak dari masing-masing pelarut. Yield yang diperoleh dari ekstrak metanol, etil asetat, dan heksan buah takokak secara berturut-turut sebesar 0.0330%, 0.0067%, dan 0.0035%. Sementara itu, yield yang diperoleh dari ekstrak metanol, etil asetat, dan heksan hancuran buah takokak secara berturut-turut sebesar 0.0246%, 0.0031%, dan 0.0021%. Perhitungan yield secara lengkap dapat dilihat di Lampiran 11.
Hasil uji ANOVA yield ekstrak buah takokak berbeda nyata (p<0.05) pada taraf signifikansi 5% terhadap jenis pelarutnya, namun untuk perlakuan buah dan hancuran buah tidak berbeda nyata pada taraf signifikansi 5% karena nilai signifikansi sampel lebih besar (p>0.05), seperti terlihat pada Lampiran 12a. Perbedaan hasil ANOVA dilanjutkan dengan uji lanjut Duncan pada Lampiran 12b. Hasil uji lanjut Duncan menunjukkan bahwa yield ekstrak untuk jenis pelarut antara ekstrak metanol dengan ekstrak etil asetat dan heksan berbeda nyata karena berada pada subset yang berbeda.
Kemudian, hasil uji ANOVA yield ekstrak untuk faktor interaksi perlakuan (buah dan hancuran buah) dan jenis pelarut berbeda nyata (p<0.05) pada taraf signifikansi 5%, seperti terlihat pada Lampiran 12c. Hasil perbedaan ini dilanjutkan dengan uji lanjut Duncan yang dapat dilihat di Lampiran 12d. Hasil uji lanjut Duncan menunjukkan bahwa yield ekstrak untuk perlakuan buah ekstrak metanol berada pada subset yang sama dengan hancuran buah ekstrak metanol. Namun, kedua sampel tersebut berbeda subset dengan buah atau hancuran buah ekstrak etil asetat dan buah atau hancuran buah ekstrak heksan. Dengan demikian, pengaruh perlakuan berupa buah dan hancuran buah
30 tidak menyebabkan perbedaan secara signifikan terhadap nilai yield ekstrak. Sementara itu, pengaruh jenis pelarut menyebabkan perbedaan yang signifikan terhadap nilai yield ekstrak. Nilai yield ekstrak untuk perlakuan (buah dan hancuran buah takokak) dan jenis pelarut dapat dilihat pada Gambar 14.
\
Keterangan : Huruf yang berbeda menunjukkan berbeda nyata (p<0.05) dengan uji lanjut Duncan
Gambar 14. Yield ekstrak buah takokak untuk perlakuan (buah dan hancuran buah) dan jenis pelarut
Hasil yield ekstrak buah takokak terbaik diperoleh dari ekstrak metanol buah dan hancuran buah takokak, sedangkan nilai total fenol ekstrak tertinggi diperoleh dari ekstrak etil asetat buah takokak sebesar 218.62 mg/100 gram ekstrak dan diikuti oleh ekstrak etil asetat hancuran buah takokak sebesar 204.14 mg/100 gram ekstrak. Hasil total fenol ekstrak dan yield ekstrak tidak berbanding lurus. Hal ini dikarenakan yield ekstrak ditentukan oleh berat akhir ekstrak yang diperoleh dari tiap jenis pelarut terhadap berat awal bubuk (bahan), dimana hasil berat akhirnya berbeda-beda. Rata-rata berat akhir ekstrak dari pelarut metanol untuk bubuk buah dan bubuk hancuran buah lebih banyak diperoleh dibandingkan dengan ekstrak dari jenis pelarut lainnya, yaitu etil asetat dan heksan.
Komponen-komponen kimia pada buah dan hancuran buah relatif lebih banyak terlarut di pelarut metanol. Komponen tersebut bukan hanya komponen fenolik (-OH) atau komponen bermolekul kecil saja, akan tetapi juga komponen lainnya yang bermolekul besar dan komponen non fenolik yang kemungkinan bersifat polar. Penggunaan pelarut metanol yang bersifat polar untuk memperoleh komponen yang juga bersifat polar, seperti gula, asam amino, dan glikosida (Houghton dan Raman 1998), terpenoid, saponin, alkaloid, dan kuasinoid. Oleh karena itu, pelarut metanol dapat mengekstrak komponen atau senyawa bioaktif lebih banyak. Kemudian, pelarut heksan biasanya dapat mengekstrak senyawa non polar lainnya seperi lilin, lemak, dan minyak atsiri (Houghton dan Raman 1998) dan senyawa fenolik yang ikut terlarut atau bergabung dengan senyawa non polar, seperti terpenoid dan steroid. Pelarut etil asetat sendiri dapat mengekstrak senyawa yang bersifat polar dan juga non polar karena sifatnya yang semi polar.
Total fenol ekstrak terlarut baik pada pelarut etil asetat daripada metanol karena kemungkinan senyawa fenolik pada ekstrak etil asetat lebih banyak jumlahnya ketika terukur oleh spektrofotometer. Sementara itu, ekstrak metanol yang memiliki berat akhir ekstrak lebih banyak, ternyata hanya memiliki sedikit senyawa fenolik yang terlarut atau terukur. Komponen-komponen molekul besar, seperti protein dan gula (karbohidrat) lebih banyak yang terekstrak. Seperti penelitian Adawiyah (1998) yang menyatakan bahwa pelarut etil asetat bersifat semipolar dan memiliki kelarutan yang
31 tinggi terhadap zat antimikroba biji buah atung dibandingkan dengan pelarut etanol (polar) yang hanya sedikit larut dan pelarut heksan (non polar) yang sama sekali tidak larut. Zat antimikroba ini dapat bersifat sebagai antioksidan juga karena biasanya mengandung senyawa fenol yang mampu menghambat pertumbuhan suatu mikroba. Dengan demikian, total fenol ekstrak etil asetat memiliki nilai yang tinggi karena pelarut ini memiliki dua sifat kelarutan, yaitu hidrofilik dan hidrofobik, sehingga mampu juga untuk mengekstrak senyawa yang bercincin benzena dengan gugus hidroksi. Menurut Harborne (1987), salah satu senyawa kurang polar yang mampu larut dengan baik dalam etil asetat adalah flavonon. Senyawa ini merupakan kelompok flavonoid aglikon.
Hasil yield ekstrak buah takokak lebih tinggi daripada yield ekstrak hancuran buah, karena ekstrak buah takokak tidak mengalami proses penghancuran (perlakuan mekanis) di awal persiapannya. Oleh karena itu, komponen bioaktif pada ekstrak buah relatif masih lebih banyak daripada ekstrak hancuran buah. Perlakuan mekanis tersebut mengakibatkan terjadinya kerusakan integritas pada jaringan tanaman (Cheng dan Crisosto 1995). Kemudian, nilai total fenol ekstrak buah dan hancuran buah takokak yang diuji ini relatif lebih rendah jika dibandingkan dengan ekstrak buah lainnya yang masih satu famili Solanaceae seperti yang ditunjukkan pada Tabel 3. Hal ini kemungkinan dapat disebabkan oleh varietas buah, kondisi keseragaman buah, proses ekstraksi (pelarut, suhu, dan metode), kondisi lingkungan (habitat) tanaman, dan sebagainya.
3. Total Fenol Buah Takokak
Perhitungan total fenol dilakukan terhadap berat segar (fresh weight) dan basis kering (dry basis) untuk buah dan hancuran buah takokak. Perhitungan dilakukan berdasarkan nilai total fenol ekstrak metanol dan yield ekstrak metanol terhadap 100 gram berat segar buah takokak (mg/100 gram fresh weight) atau terhadap 100 gram basis kering sampel buah takokak (mg/100 gram dry basis). Perhitungan total fenol buah dan hancuran buah takokak ini dapat dilihat secara lengkap pada Lampiran 13.
Nilai total fenol buah dan hancuran buah takokak bertutut-turut adalah 6.30 mg/100 gram fresh weight dan 3.86 mg/100 gram fresh weight atau 33.04 mg/100 gram dry basis dan 24.63 mg/100 gram dry basis. Uji statistik nilai total fenol buah takokak dalam dry basis dilakukan dengan uji t-test (Lampiran 14). Pada Gambar 15 dapat dilihat tidak adanya perbedaan signifikan antara total fenol buah takokak dan total fenol hancuran buah takokak pada taraf signifikansi 5% karena nilai signifikansi sampel lebih besar (p>0.05). Hal ini disebabkan sebelum proses ekstraksi, kedua sampel mengalami pengeringan beku, sehingga kemungkinan kehilangan senyawa fenol setelah pengeringan tidak signifikan. Seperti yang disampaikan oleh Sandrasari (2008), bahwa tujuan pengeringan beku dilakukan untuk mengurangi terjadinya kerusakan sampel pada senyawa metabolit sekunder, khususnya senyawa flavonoid yang termasuk salah satu senyawa fenol. Proses pengeringan beku tidak mengalami pemanasan dengan suhu tinggi, sehingga komponen volatil atau bioaktif bahan masih baik. Namun demikian, secara kuantitatif terlihat bahwa total fenol buah takokak relatif lebih tinggi daripada total fenol hancuran buah takokak karena kedua jenis sampel mengalami perbedaan perlakuan secara mekanis pada tahap persiapan sampel berupa penghancuran untuk sampel hancuran buah saat akan dikering bekukan. Dengan demikian, kandungan komponen fenol buah takokak yang tidak dihancurkan lebih banyak dan proses oksidasinya menjadi lebih lambat karena kerja enzim polifenol oksidase pun lambat.
32 Gambar 15. Total fenol buah takokak berdasarkan dry basis
Hasil penelitian Rahmat (2009) menyebutkan, bahwa nilai total fenol takokak yang diperoleh sebesar 860.29 mg/100 gram dry basis dan memiliki kandungan flavonol berupa quarcetin dengan konsentrasinya sebesar 6.1 mg/100 gram dry basis dan myricetin sebesar 21.3 mg/100 gram dry basis, sehingga total flavonol atau flavonoid pada takokak sebesar 27.4 mg/100 gram dry basis. Flavonol merupakan senyawa flavonoid dan juga termasuk golongan senyawa fenol. Penelitian Apriady (2010) menyatakan, bahwa nilai total fenol buah takokak yang diuji sebanyak 790.12 mg/100 gram dry basis dan mengandung asam fenolat berupa asam klorogenat 164.76 mg/100 gram dry basis, asam kafeat 12.74 mg/100 gram dry basis, dan asam ferulat 1.60 mg/100 gram dry basis, sehingga total asam fenolat buah takokak berdasarkan perhitungan kurva standar campuran sebesar 179.11 mg/100 gram dry basis. Nilai total fenol yang diperoleh merupakan nilai yang berasal dari keseluruhan jumlah atau total senyawa fenol pada sampel yang diekstrak, bukan jenis senyawa fenol spesifik atau tertentu. Maka dari itu, nilai total fenol pada suatu sampel belum tentu mengandung flavonoid atau asam fenolat saja sebagai senyawa fenolnya.
Nilai total fenol buah takokak hasil penelitian ini berbeda dengan penelitian sebelumnya, karena secara langsung Rahmat dan Apriady menganalisis sampel bubuk buah takokak tersebut untuk diketahui total fenolnya. Sementara itu, nilai total fenol buah takokak yang diperoleh pada penelitian kali ini berdasarkan hasil perhitungan total fenol ekstrak metanol dan yield ekstrak metanol buah takokak. Dengan kata lain, sampel yang digunakan untuk analisis total fenol pada penelitian ini berupa sampel ekstrak dari pelarut organik metanol, sehingga komponen fenol yang terekstrak pada penelitian ini kemungkinan lebih sedikit dan nilainya menjadi lebih rendah. Oleh karena itu, kandungan senyawa yang diperoleh dari nilai total fenol ekstrak metanol buah takokak pun kemungkinan hanya mengandung beberapa jenis senyawa fenol.
C. Aktivitas Antioksidan Ekstrak Buah Takokak
Berdasarkan nilai yield, ekstrak metanol memiliki yield tertinggi daripada ekstrak etil asetat dan heksan. Maka dari itu, sampel ekstrak metanol dipilih untuk analisis aktivitas antioksidan ekstrak buah takokak ini. Selain itu, diasumsikan bahwa nilai aktivitas antioksidan yang terukur merupakan senyawa antioksidan yang sebagian besar berasal dari senyawa fenolik yang cenderung bersifat polar, sehingga larut baik pada pelarut metanol (polar). Metode yang digunakan untuk mengetahui aktivitas antioksidan suatu bahan cukup banyak, salah satunya adalah metode pengujian DPPH (1,1-diphenyl-2-picrylhidrazyl). Metode DPPH merupakan metode yang murah, sederhana, dan cepat dalam mengukur aktivitas antioksidan suatu bahan pangan dengan melibatkan penggunaan radikal bebas
1,1-33 diphenyl-2-picrylhidrazyl (DPPH). Metode ini pun dapat digunakan untuk sampel padat atau cair dan tidak spesifik untuk komponen antioksidan tertentu, akan tetapi berlaku untuk aktivitas antioksidan seluruh sampel (Prakash et al. 2012). Maka dari itu, metode pengujian DPPH digunakan dalam penelitian ini untuk mengetahui aktivitas antioksidan pada takokak dengan menggunakan vitamin C (ascorbic acid) sebagai salah satu standar antioksidan murni atau aslinya. Aktivitas antioksidan bahan dapat dinyatakan dalam persen penghambatan (% inhibisi) radikal bebas DPPH (Sandrasari 2008, Andarwulan et al. 2010) dan dalam AEAC (Ascorbic acid Equivalen Antioxidant Capacity) (Prangdimurti et al. 2010).
Perhitungan aktivitas antioksidan ekstrak takokak berdasarkan % inhibisi terdapat pada Lampiran 15. Ekstrak buah yang diuji dibuat dalam konsentrasi 200 ppm berdasarkan nilai total fenolnya. Nilai % inhibisi untuk aktivitas antioksidan ekstrak metanol buah takokak dan ekstrak metanol hancuran buah takokak masing-masing sebesar 84.18% dan 87.37%. Hasil nilai aktivitas antioksidan ekstrak takokak yang dinyatakan dengan % inhibisi pada Gambar 16a diolah secara statistik dengan uji t-test (Lampiran 16). Uji statistik t-test menujukkan bahwa % inhibisi ekstrak metanol buah takokak tidak berbeda nyata (p>0.05) dengan ekstrak metanol hancuran buah takokak pada taraf signifikansi 5%.
Nilai aktivitas antioksidan ekstrak metanol buah takokak dan ekstrak metanol hancuran buah takokak dibandingkan hasilnya dengan asam askorbat dalam bentuk AEAC. Nilai AEAC diperoleh dari kurva standar asam askorbat. Kurva standar asam askorbat yang diperoleh dan hasil perhitungan AEAC dapat dilihat pada Lampiran 17 dan 18. Persamaan garis yang diperoleh dari kurva standar asam askorbat yaitu y = 1.6686x + 0.0065 dengan R² = 0.9943. Nilai AEAC ekstrak metanol buah takokak dan ekstrak metanol hancuran buah takokak sebesar 0.23 mg/ml dan 0.24 mg/ml. Aktivitas antioksidan ekstrak takokak yang dinyatakan dalam AEAC pada Gambar 16b diolah secara statistik dengan uji t-test (Lampiran 19). Uji statistik t-test menujukkan bahwa nilai AEAC ekstrak metanol buah takokak tidak berbeda nyata dengan ekstrak metanol hancuran buah takokak pada taraf signifikansi 5%, karena nilai signifikansi sampel lebih dari 0.05.
Gambar 16. Aktivitas antioksidan ekstrak buah takokak berdasarkan % inhibisi (a) dan AEAC (b) Persentase inhibisi dan AEAC ekstrak metanol buah takokak tidak berbeda nyata dengan hancuran buah takokak, artinya senyawa antioksidan secara keseluruhan pada sampel mampu menghambat radikal bebas DPPH yang ditandai dengan indikator perubahan warna larutan dari ungu tua menjadi kuning terang atau tidak berwarna. Perubahan warna ini dapat diukur dengan spektrofotometer pada panjang gelombang 517 nm. Hal tersebut terjadi akibat interaksi senyawa antioksidan bahan dengan elektron atau atom hidrogen pada radikal bebas DPPH, sehingga radikal bebas DPPH menjadi netral dan membentuk DPPH tereduksi (DPPH-H) (Sharma dan Bhat 2009).
34 Semakin pudar warna ungu yang dihasilkan dari larutan uji akan menunjukkan selisih nilai absorbansi yang tinggi pula, dan nilai aktivitas antioksidan sampel uji akan semakin besar.
Seperti yang telah dijelaskan sebelumnya, bahwa penggunaan ekstrak metanol dalam uji aktivitas antioksidan buah takokak karena diasumsikan komponen bioaktif antioksidannya sebagian besar bersifat polar. Senyawa antioksidan di dalam tanaman tingkat tinggi selain senyawa protein, senyawa bernitrogen, karotenoid, dan vitamin C adalah senyawa fenolik (Larson 1988). Senyawa fenolik yang berfungsi sebagai antioksidan primer ini dalam tanaman bersifat polar, dapat berupa vitamin E, flavonoid, asam fenolat, dan senyawa fenol lainnya (Andarwulan et al. 1996). Senyawa-senyawa fenolik tersebut dapat terlarut secara baik dalam pelarut polar, yaitu metanol.
Berdasarkan penelitian yang dilakukan oleh Sandrasari (2008) bahwa sampel uji dikatakan memiliki aktivitas antioksidan yang sangat kuat jika sampel mampu menghambat perkembangan radikal bebas lebih dari 80%, dikatakan sedang jika mampu menghambat sebesar 50-80%, dan dikatakan lemah jika kemampuan penghambatan kurang dari 50%. Hasil data % inhibisi ekstrak metanol buah dan hancuran buah takokak menunjukkan nilai yang tinggi, yaitu lebih dari 80%. Hal ini berarti ekstrak metanol buah dan hancuran buah takokak mempunyai aktivitas antioksidan yang sangat kuat dan dapat dijadikan sebagai sumber antioksidan alami. Proses penghancuran pada sampel menujukkan tidak adanya perbedaan secara signifikan dalam nilai aktivitas antioksidan buah takokak, sebab diduga senyawa-senyawa antioksidan, seperti senyawa fenol pada bahan tetap aktif sebagai antioksidan. Akan tetapi, secara kuantitas, jumlah senyawa-senyawa antioksidan pada ekstrak metanol buah dan hancuran buah tetap berbeda.
Senyawa fenol merupakan senyawa yang memiliki satu atau lebih gugus hidroksil (-OH) yang menempel pada cincin aromatik (benzena). Benzena merupakan cincin aromatik yang dibentuk oleh enam buah atom karbon yang terikat secara semi rangkap (terkonjugasi). Struktur benzena terdiri atas ikatan kovalen tunggal (σ) dan ikatan kovalen rangkap dua (π). Ikatan kovalen rangkap dua pada benzena membuat ikatan tersebut tidak selalu berada pada tempat yang sama akibat adanya pergerakan elektron (delokalisasi). Delokalisasi elektron menyebabkan senyawa aromatik mempertahankan kearomatisannya dengan mengalami reaksi substitusi (penggantian atom), seperti senyawa fenol yang merupakan substitusi benzena dengan gugus –OH. Senyawa fenol yang aktif sebagai antioksidan dikarenakan atom hidrogen yang terdapat pada gugus –OH fenol mengalami ikatan hidrogen. Ikatan hidrogen lebih lemah daripada ikatan kovalen, sehingga ikatan hidrogen lebih mudah lepas. Secara umum, senyawa fenolik merupakan asam lemah, namun lebih asam daripada alkohol alifatis (Andarwulan et al. 2012).
Dengan demikian, aktivitas antioksidan suatu bahan tidak selalu ditentukan oleh total fenol. Namun, kemungkinan ditentukan oleh kemampuan gugus hidroksil (-OH) pada senyawa fenol untuk melepaskan elektron atau atom hidrogen (radikal fenol) dan berikatan dengan radikal bebas lainnya, sehingga menjadi stabil akibat adanya delokalisasi elektron tidak berpasangan ke bagian cincin aromatik. Faktor-faktor yang mempengaruhi keefektifan antioksidan terhadap kecepatan atau tingkat otoksidasi, antara lain struktur antioksidan, kondisi oksidasi, dan sampel yang teroksidasi (Andarwulan et al. 1996).
Kemudian, perubahan kandungan vitamin C pada buah (vegetable fruit) kurang memberikan pengaruh yang berbeda nyata tehadap aktivitas antioksidannya dibandingkan dengan sayur berdaun hijau, seperti bayam. Kestabilan asam askorbat pada buah dan produk turunannya diakibatkan keberadaan senyawa askorbat dan fenolik pada kompartemen intraseluller, dimana vitamin C akan dilokalisasi dalam vakuola, atau sitosol, atau kloroplas yang tidak dilindungi oleh senyawa fenolik. Sementara itu, senyawa fenolik seperti flavonoid hampir dilokalisasi pada vakuola dengan pH lingkungan yang rendah dan hampir menempati semua sel.
35 Beberapa hasil analisis terkait senyawa dan aktivitas antioksidan buah dan ekstrak buah takokak (Solanum torvum Swartz.) dapat dibandingkan dengan beberapa jenis sayuran buah lainnya yang masih dalam satu famili Solanaceae (terung-terungan). Berikut hasil beberapa rekapitulasi nilai total fenol, total antosianin, dan total asam askorbat sayuran buah dari famili Solanaceae yang dapat dilihat pada Tabel 3.
36 Tabel 3. Rekapitulasi nilai total fenol, total antosianin, dan total asam askorbat sayuran buah dari famili Solanaceae
Nama
Indonesia Nama Latin
Total Fenol Total Antosianin Total Asam Askorbat
Referensi Fresh Weight (mg/100g) Dry Basis (mg/100g) Ekstrak (mg/100g) Fresh Weight (mg/100g) Dry Basis (mg/100g) Ekstrak (mg/100g) Fresh Weight (mg/100g) Dry Basis (mg/100g) Ekstrak (mg/100g) Takokak (buah) Solanum torvum Swartz. 6.30* 33.04* Metanol: 99.24 Etil asetat: 218.62 Heksan: 187.31 3.42 17.93 85.37 447.91 Takokak (hancuran buah) Solanum torvum Swartz. 3.86* 24.63* Metanol: 72.53 Etil asetat: 204.14 Heksan: 203.79 5.33 34.01 60.30 384.55 Takokak Solanum torvum Swartz. 860.28a, 790.12b 22.09 c 639.98c a Rahmat (2009) b Apriady (2010) c Kurniasih (2010) Solanum aethiopicum 71-98 Hanson et al. (2006) Solanum quitoense Lam. 91 11-13 Vasco et al. (2008) 36
37 Nama
Indonesia
Nama Latin
Total Fenol Total Antosianin Total Asam Askorbat
Referensi Fresh Weight (mg/100g) Dry Basis (mg/100g) Ekstrak (mg/100g) Fresh Weight (mg/100g) Dry Basis (mg/100g) Ekstrak (mg/100g) Fresh Weight (mg/100g) Dry Basis (mg/100g) Ekstrak (mg/100g) Pepino Solanum muricatum Ait.. 56 20-38 Vasco et al. (2008) Terong Solanum melongena Metanol : 739.36-1116.13c 45.01d 12e 56 – 129f c Akanitapichat et al. (2010); d Sadilova et al. (2006) e Gopalan et al. (2007) f Hanson et al. (2006); Leunca Solanum nigrum L. Metanol: 573 8.43 Veeru et al. (2009) Terong Belanda Solanum betaceum Cav. Jelly : 2511 Peeling: 1369 Hurtado et al. (2009) Keterangan : *dihitung berdasarkan total fenol ekstrak metanol dan yield ekstrak metanol
Tabel 3. (Lanjutan)
3