ii
ANTIOXIDANT ACTIVITY OF TURKEY BERRY FRUIT EXTRACT
(Solanum torvum Swartz.)
Reisa Astri Kusuma, Nuri Andarwulan
Departement of Food Science and Technology, Faculty of Agricultural Technology, Bogor Agricultural University, IPB Darmaga Campus, PO Box 220, Bogor, West Java, Indonesia.
Phone: 62 856 94307442, e-mail: reisaastri@gmail.com
ABSTRACT
Turkey berry fruit (Solanum torvum Swartz.) is one of indigenous fruit vegetables that widely used in traditional medicine. Because, it has some functional properties such as antioxidant, antibacterial, antifungal, and antiviral. The functional properties come from the activity of some phytochemicals compound that Turkey berry fruit contents, such as phenolics and non phenolics. This research was designed to identify the chemical content of Turkey berry fruit, change content, and antioxidant activity of crushed form. The research method consisted of treatment phase of fresh Turkey berry fruit through the destruction process and extraction phase of Turkey berry fruit powder with organic solvents (methanol, etil acetat, and hexane). The results showed that methanol extract of both whole and crushed Turkey berry fruit, contains alkaloids, flavons, tannins, and saponins. The etil acetat and hexan extracts of both whole and crushed form, contains alkaloids, flavons, terpenoids, and saponins. Thus, the presence of phenolic compounds in Turkey berry fruit can be affected by Phenylalanin Ammonia Lyase (PAL) activity, but not always influenced by the total anthocyanin. In addition, the antioxidant activity (DPPH assay) between whole and crushed Turkey berry fruit extracts is not significantly different (p>0.05) by t-test. It was demonstrated that the destruction process has a little affecting to the presence of phenolic compounds that act as antioxidants, such as anthocyanin. However, the antioxidant activity of extracts is not always determined from total phenolic, but depending on the ability of -OH group to donate H atoms and to bind with free radicals rapidly. The antioxidant activity of Turkey berry fruit extract was slightly be affected by ascorbic acid (vitamin C) compound.
1
I.
PENDAHULUAN
A.
Latar Belakang
Antioksidan merupakan suatu senyawa yang dapat menghambat terjadinya proses oksidasi pada tahap inisiasi dan propagasi (Velioglu et al. 1998). Senyawa antioksidan ini dapat mencegah penyakit kanker maupun penyakit degeneratif lainnya. Sumber antioksidan dapat diperoleh dari antioksidan alami. Sumber antioksidan alami dapat berasal dari tumbuhan, salah satunya adalah berasal dari sayuran indigenous. Menurut Somantri (2006) dalam Soetiarso (2010), secara alamiah definisi sayuran indigenous atau sayuran lokal adalah sayuran yang beradaptasi di suatu daerah dan dapat tumbuh dengan baik, dalam arti potensi dari tanaman tersebut dapat terekspresi secara penuh.
Sayuran indigenous merupakan jenis sayuran atau pangan esensial yang kaya akan kandungan zat gizi mikro berupa vitamin dan mineral, serat pangan, dan zat non gizi (fitokimia). Hasil penelitian Andarwulan et al. (2010) dan Andarwulan et al. (2012) menyebutkan bahwa dari sejumlah sayuran
indigenous yang diteliti telah diketahui mengandung senyawa fenolik termasuk di dalamnya senyawa
flavonoid, yaitu flavonol (quercetin, kaempferol, dan myricetin) dan flavon (apigenin dan luteolin). Selain itu, sayuran indigenous pun memiliki aktivitas antioksidan yang relatif tinggi.
Adanya kandungan-kandungan tersebut menjadikan sayuran indigenous memiliki banyak manfaat bagi kesehatan tubuh, seperti fungsinya sebagai antioksidan. Namun, hingga saat ini perhatian masyarakat terhadap sayuran indigenous masih saat kurang bahkan hampir terlupakan, sehingga perlu adanya usaha pembudidayaan dan penyampaian informasi ilmiah secara luas dan lengkap mengenai kandungan senyawa kimia yang bermanfaat untuk kesehatan ini. Dengan demikian, secara tidak langsung akan mendukung penyelamatan sumber daya alam sayuran indigenous sebagai salah satu sumber pangan sehat.
Salah satu contoh sayuran indigenous adalah buah takokak. Buah takokak (Solanum torvum
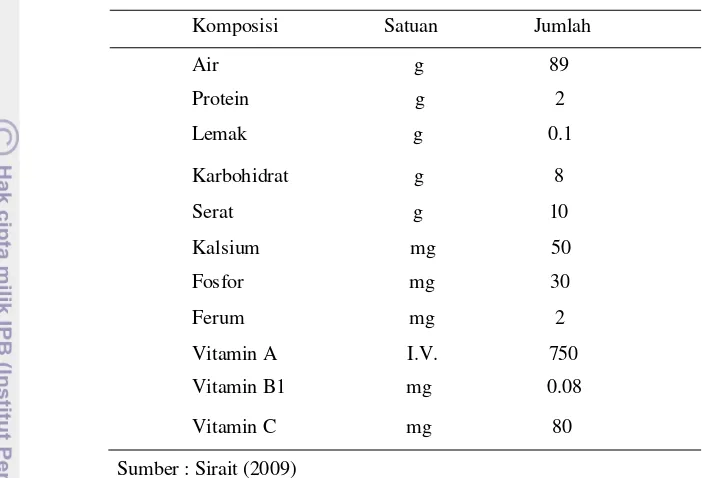
Swartz.) merupakan salah satu bagian dari tanaman takokak yang biasanya dapat dimakan (edible portion). Bagian tanaman ini diketahui mengandung glukoalkaloid, solasonine, sterolin (sitosterol-D glucoside), protein, lemak, dan mineral (Yuanyuan et al. 2009). Buah takokak pun mengandung berbagai jenis vitamin, seperti vitamin A, vitamin B1, dan vitamin C (Sirait 2009). Adanya kandungan komponen-komponen bioaktif itulah, buah takokak dapat berfungsi sebagai antioksidan, kardiovaskuler, aktivitas agregasi anti-platelet, aktivitas antimikroba manusia dan isolat klinik dan sedatif, digestif, hemostatik, serta aktivitas diuretik (Agrawal et al. 2010).
2 Buah takokak sebagai salah satu jenis sayuran indigenous dapat digunakan sebagai bahan pangan maupun obat tradisional. Sebagai bahan pangan, buah takokak biasanya dimakan mentah (lalapan) atau ditambahkan pada jenis masakan lainnya. Begitu pula jika buah takokak digunakan sebagai obat tradisional, yaitu dapat dimakan langsung dalam kondisi mentah, direbus, atau dibalut langsung pada bagian yang terluka. Berdasarkan kegunaannya itulah, hal ini akan berkaitan dengan bentuk bahan yang diperoleh dan diinginkan, seperti dalam bentuk hancuran, kering (bubuk), dan ekstrak, sehingga berpengaruh juga terhadap daya simpan bahan itu sendiri.
Dengan demikian, penelitian ini diharapkan mampu mengidentifikasi beberapa kandungan senyawa kimia dalam buah takokak yang diuji dan mengetahui perubahan kadar serta aktivitas antioksidan buah takokak yang mengalami proses penghancuran berdasarkan manfaat buah takokak sebagai bahan pangan sehat dan sekaligus sebagai obat tradisional. Kemudian, adanya perbedaan bentuk bahan yang diperoleh akibat suatu perlakuan akan memberikan informasi mengenai kandungan senyawa bioaktif yang relatif masih terkandung baik di bahan tersebut.
B.
Tujuan Penelitian
3
II.
TINJAUAN PUSTAKA
A.
Takokak (Solanum torvum Swartz.)
Takokak termasuk tanaman kelas Dicotyledonae, famili Solanaceae, genus Solanum, dan spesies Solanum torvum Swartz. Beberapa wilayah Indonesia memiliki nama lain dari tanaman takokak, seperti terong pipit (Sumatera), terong rimbang (Melayu), takokak (Jawa Barat) dan terong cepoka, atau poka, cong belut atau cokowana (Jawa Tengah).
Takokak berasal dari kepulauan Antilles yang penyebarannya sampai ke negara-negara tropika termasuk Indonesia. Tanaman ini tumbuh di daerah pulau Sumatera, Jawa, dataran rendah yang ketinggiannya sekitar 1-1.600 meter di atas permukaan laut (dpl), di tempat yang tidak terlalu berair, agak ternaungi dengan sinar matahari sedang dan tumbuh secara tersebar. Tanaman takokak merupakan tanaman perdu yang tumbuh tegak dan tinggi tanaman sekitar 3 m. Bentuk batang bulat, berkayu, bercabang, berduri jarang dan percabangannya simpodial dengan warna putih kotor. Daun takokak tunggal, berwarna hijau, tersebar, berbentuk bulat telur, bercangap, tepi rata, ujung meruncing dan panjangnya sekitar 27-30 cm dan lebar 20-24 cm, dengan bentuk pertulangan daunnya menyirip dan ibu tulang berduri.
Ciri-ciri bunga takokak, antara lain majemuk, bentuk bintang, kelopak berbulu, bertajuk lima, runcing, panjang bunga kira-kira 5 mm, benang sari lima, tangkai panjang kira-kira 1 mm dan kepala sari panjangnya kira-kira 6 mm berbentuk jarum, berwarna kuning, tangkai putik kira-kira 1 cm yang berwana putih, dan kepala putik kehijauan (Sirait 2009). Buah takokak berbentuk buni, bulat, licin, dan bergaris tengah 12-15 mm, ketika masih muda buah berwarna hijau (Gambar 1) dan setelah tua warnanya menjadi jingga.
Gambar 1. Buah takokak (Solanum torvum Swartz.)
Takokak mengandungberbagai bahan kimia (Tabel 1). Kandungan kimia yang terdapat pada buah dan daun mengandung alkaloid steroid yaitujenis solasodine 0.84%, sedangkankandungan buah kuning mengandung solasonine 0.1%. Kemudian, buah mentahnya pun mengandung chlorogenin,
sisologenenone, torvogenin, vitamin A, neo-chlorogenine, dan panicolugenine, serta akarnya mengandung jurubine (Sirait 2009). Buah takokak ini pun diketahui mengandung glukoalkaloid,
4 juga sebagai alat kontrasepsi karena buah dan daunnya mengandung solasodine 0.84%, yang merupakan bahan baku hormon seks untuk kontrasepsi (Sirait 2009).
Tabel 1. Komposisi kimia buah takokak dalam tiap 100 g
Sumber : Sirait (2009)
B.
Komponen Bioaktif
Komponen-komponen bioaktif pada suatu bahan, khususnya tanaman sayuran indigenous dapat berasal dari senyawa fenolik dan senyawa non fenolik. Beberapa komponen bioaktif yang termasuk senyawa fenolik adalah fenol, flavonoid termasuk antosianin dan tanin. Sementara itu, beberapa komponen bioaktif yang termasuk senyawa non fenolik adalah asam askorbat (vitamin C), alkaloid, terpenoid/steroid, dan saponin.
1.
Senyawa Fenolik
Menurut Suradikusumah (1989), senyawa fenol mencakup sejumlah banyak senyawa yang umumnya mempunyai sebuah cincin aromatik dengan satu atau lebih gugus hidroksil. Senyawa fenol cenderung untuk larut dalam air karena paling sering bergabung dengan gula glikosida. Selain itu, senyawa fenol dapat bergabung juga dengan protein, alkaloid, dan terpenoid yang terdapat dalam rongga sel. Struktur umum senyawa fenol seperti pada Gambar 2.
Gambar 2. Senyawa umum fenol Komposisi Satuan Jumlah
Air g 89
Protein g 2
Lemak g 0.1 Karbohidrat g 8
Serat g 10
Kalsium mg 50
Fosfor mg 30
Ferum mg 2
Vitamin A I.V. 750
5 Senyawa fenol dalam bahan pangan dapat dikelompokkan menjadi tiga, antara lain fenol sederhana dan asam fenolat (p-kresol, 3-etil fenol, 3,4-dimetil fenol, hidroksiquinon, vanillin, asam galat), turunan asam hidroksisinamat (p-kumarat, kafeat, asam ferulat, dan asam klorogenat), dan flavonoid (katekin, proantosianin, antosianidin, flavon, flavonol, dan glikosida) (Ho 1992).
Flavonoid ditemukan pada tumbuhan tingkat tinggi, dimana senyawa ini yang menyebabkan tumbuhan berwarna merah, ungu, biru, dan kuning.Terdapat sepuluh golongan flavonoid yang telah diketahui, yaitu antosianin, leukoantosianidin, flavonol, flavan, glikoflavon, biflavonil, kalkon, auron, flavon, dan isoflavon (Suradikusumah 1989). Menurut Pratt (1992), flavonoid adalah senyawa alami hasil fotosintesis yang mengandung cincin aromatik yang dapat diganti gugus hidroksi atau alkoksinya. Senyawa ini terdapat pada semua bagian tumbuhan, seperti daun, buah, kayu, dan kulit kayu.
Biosintesis senyawa fenol dan flavonoid saling berhubungan, dimana biosintesis diawali oleh jalur sikimat untuk kemudian menghasilkan senyawa-senyawa yang berfungsi sebagai prekursor atau substrat senyawa lainnya. Rangkaian jalur sikimat akan menghasilkan penta-O-galloll-glukosa untuk selanjutnya akan menghasilkan senyawa-senyawa golongan tanin yang terhidrolisis, yaitu golongan gallotanin dan ellagitanin (Crozier et al. 2006, Dewick 2009). Selain itu, jalur sikimat ini pun nantinya akan menghasilkan salah satu senyawa, seperti p-koumaril-CoA yang bekerja sinergis dengan senyawa malonil Co-A menghasilkan senyawa turunan flavonoid lainnya, antara lain isoflavon, antosianin, proantosianidin (tanin terkondensasi), flavon, dan flavonol (Winkel BSJ 2006).
Antosanin berasal dari bahasa Yunani, yaitu “anthos” yang berarti bunga dan “kyanos” yang berarti biru gelap dan termasuk salah satu senyawa flavonoid. Antosoanin merupakan zat warna kemerahan yang mudah larut air dan banyak ditemukan di dunia tumbuhan. Pigmen antosianinlah yang menyebabkan bagian tumbuhan (daun, bunga, buah, dan sayur) berwarna merah, jingga, ungu, dan biru (Bridle dan Timberlake 1997, Elbe dan Schwartz 1996). Secara kimia, semua antosianin merupakan turunan dari kation flavilium (3,5,7,4’ tetrahidroksiflavilium) yang merupakan struktur dasar dari antosianidin (Bridle dan Timberlake 1997). Struktur dasar kation flavilium dapat dilihat pada Gambar 3.
Gambar 3. Struktur dasar kation flavilium
6 Menurut Markakis (1982), molekul antosianin disusun dari sebuah aglikon (antosianidin) yang teresterifikasi dengan satu atau lebih gula (glikon). Beberapa faktor utama yang menyebabkan keragaman adalah sifat gulanya (biasanya glukosa, dapat juga galaktosa, ramnosa, xilosa atau arabinosa), jumlah unit gula (mono, di, atau triglikosida), dan posisi gula (biasanya pada 3-hidroksil atau 3- dan 5-hidroksil) (Suradikusumah 1989). Sebagai glikosida, antosianin larut dalam air, tetapi setelah mengalami hidrolisis maka bentuk non glikosidanya (antosianidin) kurang larut dalam air (Wijaya et al. 2001). Jenis pigmen yang terdapat dalam bunga dan buah sebagian besar tidak berada dalam bentuk antosianidin, melainkan dalam bentuk glikosilasi, sehingga pigmen antosianin menjadi lebih stabil dan larut dalam air.
Faktor yang mempengaruhi kestabilan antosianin dalam bahan pangan adalah suhu, cahaya, pH, oksigen, asam askorbat, gula dan produk turunannya, logam, kondensasi, dan sulfur dioksida (Markakis 1982). Antosianin akan lebih stabil pada larutan yang bersifat asam daripada larutan yang bersifat netral atau basa (Jackman dan Smith 1996). Dalam larutan (medium) asam tampak berwarna merah dan ketika pH meningkat akan menjadi lebih berwarna biru.
Komponen senyawa fenol biasanya bersifat polar dan memiliki fungsi sebagai penangkap radikal bebas dan peredam terbentuknya oksigen singlet (Kumalaningsih 2006). Menurut Gordon (1990), senyawa fenol jika berdiri sendiri bersifat tidak aktif sebagai antioksidan. Aktivitas antioksidan senyawa fenol dipengaruhi oleh beberapa faktor, antara lain agen pengkelat, pH lingkungan sekitar, kelarutan, ketersediaan senyawa fenol dalam suatu bahan, dan stabilitas senyawa fenol itu sendiri (Tang 1991).
Berbagai macam metode pengukuran aktivitas antioksidan telah banyak dilakukan untuk melihat dan membandingkan aktivitas antioksidan pada berbagai macam sumber antioksidan. Salah satu metode pengukuran aktivitas antioksidan yang dapat digunakan, yaitu metode DPPH. Metode DPPH merupakan metode yang murah, sederhana, dan cepat dalam mengukur aktivitas antioksidan suatu bahan pangan dengan melibatkan penggunaan radikal bebas 1,1-diphenyl-2-picrylhydrazyl
(DPPH). Metode ini pun dapat digunakan untuk sampel padat atau cair dan tidak spesifik untuk komponen antioksidan tertentu, akan tetapi berlaku untuk aktivitas antioksidan seluruh sampel (Prakash et al. 2012).
DPPH merupakan senyawa radikal bebas yang bersifat stabil sehingga dapat bereaksi dengan atom hidrogen yang berasal dari suatu antioksidan membentuk DPPH tereduksi (Molyneux 2004). Prinsip metode DPPH adalah atom hidrogen dari suatu senyawa antioksidan akan membuat larutan DPPH berubah warna dari ungu menjadi tidak berwarna yang dapat diukur menggunakan spektrofotometer pada panjang gelombang 517 nm akibat dari terbentuknya DPPH tereduksi (DPPH-H) (Gambar 4) (Sharma dan Bhat 2009). Semakin tinggi kemampuan suatu senyawa antioksidan dalam meredam radikal DPPH, maka warna yang dihasilkan akan semakin kuning dan mendekati jernih yang ditandai dengan semakin kecilnya nilai absorbansi yang terukur.
7 Aktivitas antioksidan dapat dinyatakan dengan persentase penghambatan (inhibisi) yang diperoleh dari nilai absorbansi blanko dikurangi dengan absorbansi sampel (Sandrasari 2008, Andarwulan et al. 2010). Selain itu, aktivitas antioksidan dapat dinyatakan dengan nilai AEAC (AscorbicAcid Equivalen Antioxidant Capacity) (Prangdimurti et al. 2010). AEAC merupakan nilai kapasitas atau aktivitas antioksidan bahan dalam mereduksi radikal bebas DPPH yang setara dengan kemampuan radikal bebas asam askorbat atau vitamin C.
2.
Senyawa Non Fenolik
a.
Asam Askorbat (Vitamin C)
Sumber vitamin C sebagian besar berasal dari sayuran dan buah-buahan, terutama buah-buahan segar. Karena itu vitamin C sering kali disebut fresh food vitamin. Buah yang dikonsumsi dalam kondisi segar mengandung asam askorbat (vitamin C) yang lebih tinggi dan kehilangan kapasitas antioksidan dalam buah lebih rendah dibandingkan buah yang telah mengalami pemanasan atau proses pengolahan (Kalt et al. 1999).Maka dari itu, vitamin C merupakan vitamin yang mudah larut air, dan mudah rusak oleh oksidasi, panas, sinar, enzim, alkali, oksidator, dan katalis tembaga dan besi. Oksidasi dapat dihambat dengan membiarkan vitamin C dalam kondisi asam atau pada suhu rendah (Winarno 1997).
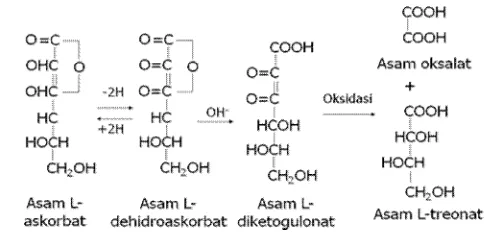
Struktur kimia vitamin C terdiri dari rantai enam atom C dan kedudukannya tidak stabil (C6H8O6), karena mudah bereaksi dengan oksigen di udara (teroksidasi) secara reversibel. Bentuk
asam askorbat yang ada di alam adalah L-asam askorbat. Asam L-askorbat dengan adanya enzim asam askorbat oksidase akan teroksidasi menjadi asam L-dehidroaskorbat. Asam ini secara kimia juga sangat labil dan mengalami perubahan lebih lanjut menjadi asam L-diketogulonat yang tidak lagi memiliki keaktifan sebagai asam askorbat. Suasana basa menyebabkan asam L-diketogulonat teroksidasi menjadi asam oksalat dan asam L-treonat (Safaryani et al. 2007). Reaksi metabolisme asam askorbat (vitamin C) dapat dilihat pada Gambar 5.
Vitamin C merupakan zat antioksidan yang tangguh, karena berfungsi menjaga kesehatan sel, meningkatkan penyerapan asupan zat besi, dan memperbaiki sistem kekebalan tubuh. Selain itu, fungsi vitamin C sebagai penjaga dan pemelihara kesehatan pembuluh-pembuluh kapiler, kesehatan gigi dan gusi, menghambat produksi nitrosamin yang merupakan zat pemicu kanker, dan membantu penyembuhan luka (Kumalaningsih 2006).
8
b.
Alkaloid
Alkaloid merupakan salah satu golongan senyawa organik yang utama. Alkaloid dapat ditemukan pada tumbuhan dan hewan. Namun dalam dunia tumbuhan, senyawa alkaloid merupakan golongan senyawa organik (metabolit sekunder) terbesar diantara senyawa lainnya baik secara jumlahnya maupun penyebarannya (Astuti et al. 1995). Alkaloid pada tumbuhan telah diketahui pada 40 suku dari tumbuhan berbunga. Umumnya, suku tumbuhan itu termasuk kelas dikotil dan hanya sedikit pada monokotil.
Alkaloid sering bersifat racun bagi manusia dan memiliki banyak kegiatan fisiologi yang menonjol, sehingga digunakan secara luas dalam bidang pengobatan (Harborne 1996). Berdasarkan strukturnya, jenis alkaloid sangatlah banyak dan beragam. Hanya saja sebagian besar alkaloid memiliki kerangka polisiklik dengan kandungan atom karbon, oksigen, nitrogen, hidrogen, dan substituen yang tidak begitu beragam. Umumnya, alkaloid tidak berwarna walaupun masih ada yang berwarna, bersifat basa sehingga jika ditambahkan asam akan membentuk garam, dan larut dalam pelarut organik.
c.
Terpenoid/Steroid
Terpenoid terdapat dalam senyawa tumbuhan, memiliki struktur siklik dan satu gugus fungsi atau lebih (hidroksil, karbonil, dan lain-lain). Umumnya, terpenoid larut lemak dan berada di dalam sitoplasma sel tumbuhan. Penggolongan senyawa terpenoid, berdasarkan kemudahannya dalam menguap dibagi menjadi tiga golongan, yaitu : mudah menguap (monoterpen dan seskuiterpen sebagai minyak atsiri), sulit menguap (diterpenoid), dan tidak menguap (triterpenoid dan steroid) (Direja 2007).
Triterpenoid merupakan senyawa berkerangka karbon dari enam satuan isoprene dan secara biosintesis diturunkan dari hidrokarbon asiklik, yaitu skualena. Triterpenoid dibagi menjadi empat golongan senyawa, yaitu triterpena, steroid, saponin, dan glikosida jantung. Sterol adalah triterpena yang kerangka dasarnya sistem cincin siklopentana penhidrofenantrena.
d.
Saponin
Saponin adalah senyawa glikosida triterpena dan sterol yang tersebar luas pada tumbuhan tingkat tinggi. Saponin merupakan senyawa aktif permukaan dan bersifat seperti sabun serta dapat dideteksi dengan kemampuannya membentuk busa yang mantap (tahan lama) ketika diekstraksi dan menghemolisis darah. Saponin memiliki sifat antimikroba, baik triterpen maupun steroidal (Naidu 2000). Saponin memiliki rasa pahit menusuk dan menyebabkan bersin serta iritasi pada selaput lendir.
C.
Aktivitas Phenylalanine Ammonia Lyase (PAL)
Phenylalanine Ammonia Lyase (PAL) (E.C. 4.1.1.5) merupakan salah satu enzim yang
9
acid. Chorismic acid merupakan prekursor terbentuknya senyawa aromatik asam amino fenilalanin, tirosin, dan triptofan. Pada proses pembentukan fenilalanin membutuhkan perubahan chorismic acid
menjadi prephenic acid yang dikatalisis oleh chorismate mutase dan mengalami perubahan lanjut secara reversibel menjadi L-arogenic acid. Kemudian, L-arogenic acid berubah menjadi L-fenilalanin dengan dikatalisis oleh arogenate dehydratase (Dewick 2009).
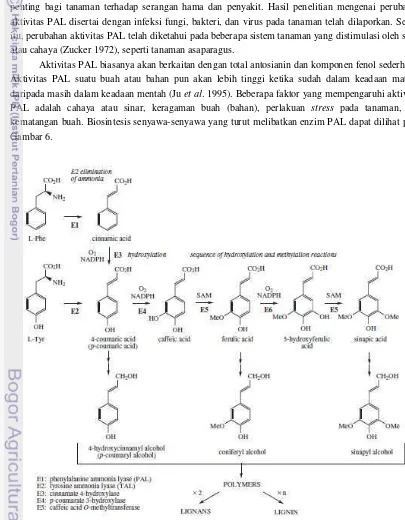
PAL adalah enzim kunci di dalam sintesa berbagai senyawa fenolik (Higuchi 1990). Asam sinamat yang dihasilkan dari deaminasi fenilalanin akan dimetabolisme lebih lanjut menjadi asam kumarat, kafeat, ferulat, dan sinapat. Dengan kata lain, asam sinamat berfungsi sebagai prekursor untuk biosintesis senyawa, seperti senyawa koumarin, isoflavonoid, dan lignin. Senyawa tersebut penting bagi tanaman terhadap serangan hama dan penyakit. Hasil penelitian mengenai perubahan aktivitas PAL disertai dengan infeksi fungi, bakteri, dan virus pada tanaman telah dilaporkan. Selain itu, perubahan aktivitas PAL telah diketahui pada beberapa sistem tanaman yang distimulasi oleh sinar atau cahaya (Zucker 1972), seperti tanaman asaparagus.
Aktivitas PAL biasanya akan berkaitan dengan total antosianin dan komponen fenol sederhana. Aktivitas PAL suatu buah atau bahan pun akan lebih tinggi ketika sudah dalam keadaan matang daripada masih dalam keadaan mentah (Ju et al. 1995). Beberapa faktor yang mempengaruhi aktivitas PAL adalah cahaya atau sinar, keragaman buah (bahan), perlakuan stress pada tanaman, dan kematangan buah. Biosintesis senyawa-senyawa yang turut melibatkan enzim PAL dapat dilihat pada Gambar 6.
10
III.
METODOLOGI PENELITIAN
A.
Bahan dan Alat
1.
Bahan
Bahan utama yang digunakan dalam penelitian ini adalah buah takokak segar yang diperoleh dari Desa Benteng Gunung Leutik dan salah satu pasar tradisional di kota Bogor. Bahan-bahan lain yang digunakan dalam ekstraksi, antara lain pelarut metanol Pro Analysis (PA) (Merck), pelarut etil asetat (Merck), dan pelarut heksan (Merck), aquades, dan gas nitrogen (N2). Bahan-bahan yang
digunakan untuk mengukur total fenol adalah etanol PA (Merck), etanol 95%, pereaksi Folin Ciocalteau 50%, Na2CO3 5%, standar asam galat (Sigma-Aldrich), dan aquades. Bahan-bahan yang
digunakan dalam analisis kualitatif komponen bioaktif (fitokimia), yaitu FeCl3 5%, kloroform,
Pb-asetat, gelatin 1%, amoniak, larutan H2SO4 2N, H2SO4 pekat, asam asetat glacial PA (Merck), larutan
HCl 2N, HgCl2, KI (Merck), bismuth subnitrat, iodium (Merck), etanol 95%, dan aquades.
Kemudian, bahan-bahan untuk menguji total antosianin, yaitu larutan HCl 5%, aquades, etanol 95%, dan HCl 1.5 N. Bahan-bahan yang digunakan untuk menguji total asam askorbat (vitamin C), antara lain aquades, KI (Merck), I2 (Merck), dan larutan amilum 1%. Bahan-bahan yang digunakan
untuk mengukur aktivitas Phenylalanine Amonnia Lyase (PAL), antara lain larutan buffer borat-HCl pH 8.8 (25 mM), larutan buffer borate ph 8.7 (0.2 M), NaOH 0.2 M, larutan mercaptoethanol 5 mM, larutan KOH 0.1 N, reagen A (0.81 M Na2CO3 dalam 500 ml NaOH 1 N, 7 mM K-Na Tartrate.4H2O,
H2O sampai 1 L ), reagen B (70 mM K-Na Tartrate.4H2O, 40 mM CuSO4.4 H2O dalam 10 ml NaOH 1
N, H2O sampai 100 ml), reagen C (1 ml Folin Ciocalteau dalam 15 ml H2O), larutan L-Phenylalanine
100 mM, dan larutan Tri Cloroacetic Acid (TCA) 1 M. Bahan yang digunakan untuk menguji aktivitas antioksidan, antara lain asam askorbat (vitamin C), metanol PA (Merck), larutan DPPH 1 mM, dan aquades.
2.
Alat
Alat-alat yang digunakan dalam penelitian ini adalah alat untuk perlakuan sampel dan ekstraksi buah takokak, serta alat untuk analisis. Alat-alat yang digunakan untuk perlakuan sampel segar dan ekstraksi bubuk buah takokak, antara lain blender basah dan kering, baskom, freezer, freeze dryer, plastik HDPE (bening), kemasan alumunium foil, ayakan 20 mesh, alat pengayak, botol-botol kaca gelap, shaker, penyaring vakum, Buchi rotavapor, cawan alumunium, oven, timbangan, neraca analitik, alat pengaduk gelas, sudip, gelas piala, gelas ukur, corong gelas, alumunium foil, dan kertas saring Whatman No.1. Alat-alat untuk analisis total fenol adalah neraca analitik, gelas piala, gelas ukur, tabung reaksi bertutup, labu takar, alat pengaduk gelas, sudip, pipet mohr, mikropipet 10-100 µL dan 500-5000 µL, tabung sentrifuse, vortex, sentrifuse, kuvet, dan spektrofotometer UV-VIS.
11 labu takar, corong gelas, erlenmeyer, pipet mohr, pompa vakum, kertas saring Whatman No.1, dan buret mikro. Alat-alat yang digunakan untuk analisis aktivitas Phenylalanine Amonnia Lyase (PAL), yaitu neraca analitik, alat pengaduk gelas, sudip, gelas piala, gelas ukur, tabung reaksi, labu takar, pipet tetes, mikropipet (10-100 µL, 100-1000 µL, 500-5000 µL, dan 1000-10000 µL), corong gelas, penangas air (inkubator), microtube, sentrifuse, kuvet, dan spektrofotometer UV-VIS. Alat-alat yang digunakan untuk analisis aktivitas antioksidan, antara lain neraca analitik, alat pengaduk gelas, sudip, gelas piala, gelas ukur, tabung reaksi bertutup, labu takar, pipet tetes, pipet Mohr, mikropipet (10-100
µL dan 100-1000 µL), corong gelas, alumunium foil, kuvet, dan spektrofotometer UV-VIS.
B.
Metode Penelitian
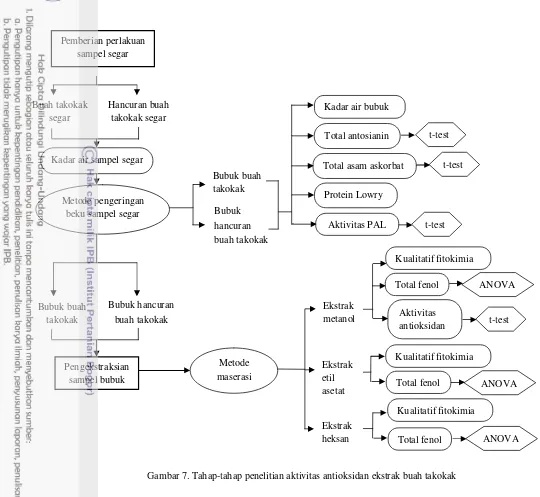
Metode penelitian yang dilakukan terdiri atas tahap pemberian perlakuan terhadap sampel segar dan tahap pengekstraksian sampel bubuk buah takokak. Tahap pemberian perlakuan sampel segar bertujuan untuk mengidentifikasi dan memperoleh komponen bioaktif buah takokak dengan memberikan pengaruh penghancuran pada sebagian sampelnya, sehingga dapat diketahui dampaknya dan perbedaannya terhadap kandungan komponen bioaktif dengan buah yang tidak mengalami proses penghancuran. Tahap ini dilakukan dengan membagi sampel menjadi dua perlakuan, yaitu sebagian sampel dalam kondisi buah takokak segar yang tidak dihancurkan dan sebagian lagi dalam kondisi buah takokak segar yang dihancurkan. Lalu, kedua sampel tersebut dianalisis kadar air segarnya. Selanjutnya, sampel buah takokak segar dan hancuran buah takokak segar mengalami proses pengeringan beku menjadi sampel bubuk dan dilakukannya beberapa analisis, seperti analisis kadar air sampel bubuk, total antosianin, total asam askorbat, protein Lowry, dan aktivitas PAL. Hasil analisis yang diperoleh ini untuk selanjutnya dianalisis secara statistik dengan uji t-test, sehingga diketahui perbedaan antara buah dan hancuran buah terhadap total antosianin, total asam askorbat, dan aktivitas PAL-nya.
12
1.
Pemberian Perlakuan Sampel Segar
Kondisi awal sampel buah takokak yang digunakan adalah sampel segar. Kemudian, sampel segar ini dibuat menjadi dua perlakuan berupa buah utuh atau tanpa proses penghancuran dan hancuran buah. Tujuannya untuk mengidentifikasi dan memperoleh komponen bioaktif buah takokak dengan memberikan pengaruh penghancuran pada sebagian sampelnya, sehingga dapat diketahui dampaknya dan perbedaannya terhadap kandungan komponen bioaktif dengan buah yang tidak mengalami proses penghancuran.
Tahap ini diawali dengan penimbangan sampel segar buah takokak yang telah dipisahkan dari tangkainya sebanyak 1-2 kg, lalu sampel dicuci bersih dan ditiriskan. Selanjutnya, buah takokak dibagi menjadi dua perlakuan, yaitu sebagian dalam keadaan buah utuh dan sebagian lagi dihancurkan dengan blender basah menjadi hancuran buah. Proses penghancuran buah takokak dengan menghancurkan sampel secara bertahap atau sedikit demi sedikit, yaitu sekitar 500 gram sampel
Gambar 7. Tahap-tahap penelitian aktivitas antioksidan ekstrak buah takokak Buah takokak segar Pemberian perlakuan sampel segar Hancuran buah takokak segar
Kadar air sampel segar
Metode pengeringan beku sampel segar
Bubuk buah takokak Bubuk hancuran buah takokak Metode maserasi Pengekstraksian sampel bubuk Total fenol Kualitatif fitokimia Aktivitas antioksidan Total fenol Kualitatif fitokimia Total fenol Kualitatif fitokimia Bubuk buah takokak Bubuk hancuran buah takokak
Total asam askorbat Kadar air bubuk
Total antosianin Protein Lowry Aktivitas PAL t-test t-test t-test ANOVA Ekstrak metanol Ekstrak etil asetat Ekstrak
heksan ANOVA
13 dihancurkan selama ± 10-15 menit tanpa penambahan air hingga keseluruhan bentuk hancuran sampel yang diperoleh relatif sama (homogen) untuk setiap kali proses penghancurannya.
Sampel buah utuh dan hancuran buah yang telah diperoleh dimasukkan ke dalam plastik HDPE (bening) ukuran 1 kg, dimana hingga ¾ bagian plastik diisi oleh sampel. Khusus sampel hancuran buah dibuat rata atau pipih sesaat setelah dimasukkan ke dalam plastik agar pembekuan sampel nantinya lebih merata. Setelah semua sampel dimasukkan ke dalam masing-masing plastik, secara bersamaan sampel lalu dimasukkan ke dalam freezer dan posisi sampel diletakkan dalam keadaan horizontal (mendatar). Selanjutnya, setiap sampel diukur pula kadar air segarnya, sehingga dapat diketahui kadar air buah segar dan hancuran buah segar takokak.
Sampel buah segar dan hancuran buah segar takokak dibekukan terlebih dahulu selama satu malam dalam freezer dan keesokan harinya dikeringkan dengan alat freeze dryer selama ± 48 jam. Sampel kering hasil pengeringan beku ini dihancurkan dengan blender kering untuk mendapatkan sampel bubuk takokak dan dimasukkan ke dalam kemasan alumunium foil. Lalu, sampel ini disimpan dalam freezer hingga diperoleh jumlah sampel yang relatif dapat mencukupi proses analisis sampel selanjutnya. Dengan kata lain, sampel diperoleh secara kumulatif dari hasil beberapa kali proses pengeringan beku. Sampel kering diayak dengan ayakan berukuran 20 mesh, sehingga diperoleh bubuk takokak berukuran homogen. Kemudian, sampel bubuk takokak dimasukkan kembali dalam kemasan alumunium foil dan disimpan dalam freezer, sehingga sampel lebih awet selama penyimpanan.
Sampel bubuk buah dan hancuran buah takokak ditentukan kadar airnya. Selain itu, beberapa analisis lainnya yang dilakukan dengan menggunakan sampel bubuk buah dan hancuran buah, antara lain analisis total antosianin, total asam askorbat, protein Lowry, dan aktivitas Phenylalanine
Ammonia Lyase (PAL).
2.
Pengekstraksian Sampel Bubuk
Tahap berikutnya adalah tahap pengekstraksian sampel bubuk takokak dengan beberapa pelarut organik. Hal ini bertujuan untuk memperoleh zat atau senyawa kimia (fitokimia) yang berperan sebagai metabolit sekunder dari ekstrak, sehingga dapat diketahui pula perubahan senyawa tersebut dan kadar serta aktivitas antioksidan pada hancuran buah. Tahap ekstraksi sampel dilakukan dengan melarutkan bubuk buah dan hancuran buah takokak dalam pelarut organik dengan perbandingan sampel dan pelarutnya 1:10 (Batubara et al. 2009 yang dimodifikasi).
Sampel bubuk ditimbang sebanyak ± 10 gram, lalu dimasukkan ke dalam labu erlenmeyer dan ditambahkan pelarut yang berbeda, yaitu metanol PA, etil asetat, dan heksan, sebanyak 100 ml sehingga sampel terendam sempurna dan ditutup dengan aluminium foil dan disimpan di dalam
14
C.
Metode Analisis
1.
Analisis Kadar Air (AOAC 1984)
Penetapan kadar air merupakan cara untuk mengukur banyaknya air yang terdapat di dalam suatu bahan pangan. Analisis kadar air dilakukan pada sampel buah segar takokak (awal) dan pada sampel takokak setelah dikering bekukan. Penentuan kadar air ini dilakukan dengan metode pengeringan dengan oven biasa. Prinsip dari metode ini adalah air dikeluarkan dari sampel dengan cara menguapkan air yang terdapat dalam bahan pangan. Persiapan yang perlu dilakukan adalah cawan alumunium yang akan digunakan terlebih dahulu dikeringkan dalam oven pada suhu 1000C selama 15 menit kemudian didinginkan dalam desikator selama 10 menit. Selanjutnya cawan ditimbang dengan menggunakan neraca analitik. Sampel ditimbang sebanyak kurang lebih 2 gram kemudian dikeringkan dalam oven selama kurang lebih 6 jam. Setelah itu, didinginkan dalam desikator kemudian ditimbang. Pengeringan sampel kembali ke dalam oven hingga diperoleh berat kering yang relatif konstan (tetap). Berikut perhitungan kadar air berdasarkan % bb (basis basah), yaitu:
dimana: W = bobot contoh sebelum dikeringkan (g)
W1 = bobot (contoh + cawan) sesudah dikeringkan (g) W2 = bobot cawan kosong (g)
2.
Analisis Total Antosianin
a.
Ekstraksi Antosianin (Raharja dan Dianawati 2001)
Sebanyak ± 1 gram sampel bubuk diekstraksi dengan larutan HCl 5% dalam aquades. Ekstraksi dilakukan dengan merendam bahan didalam wadah botol kaca yang berwarna gelap dengan larutan HCl 5% tersebut (1:10), kemudian campuran disimpan di dalam lemari pendingin bersuhu 40C selama semalam. Setelah itu campuran tersebut disaring dengan kertas saring Whatman No.1 dengan menggunakan penyaring vakum dan filtrat yang diperoleh dianalisis kandungan antosianinnya dengan metode Less dan Francis (1972).
b.
Penentuan Konsentrasi Total Antosianin (Less dan Francis 1972 yang
dimodifikasi)
Sebanyak 0.5 ml filtrat hasil ekstraksi diencerkan hingga 5 ml dengan etanol 95 %: HCl 1.5 N (85:15). Filtrat kemudian diukur absorbansinya dengan spektrofotometer pada panjang gelombang 535 nm.
Total antosianin dihitung dengan rumus :
[ ] Antosianin (mg/ 100 g sampel) = (Absorbansi x Faktor Pengenceran) x 100 98.2 x Wsampel (g)
15 Faktor 98.2 adalah nilai ε (serapan molar) dari pigmen antosianin dalam pelarut etanol 95%:HCl 1.5 N (85:15).
3.
Analisis Total Asam Askorbat (Jacobs 1951 yang dimodifikasi)
a.
Ekstraksi Sampel
Sebanyak ± 5 gram sampel bubuk dimasukkan dalam labu takar 50 ml dan ditambahkan aquades sampai tera, kemudian disaring dengan penyaing vakum untuk memisahkan filtrat.
b.
Pembuatan Larutan Iodium
Larutan iodium 0.01 N dibuat dengan cara mencampurkan 2 gram KI dan 1.269 gram I2,
kemudian dilarutkan sampai volume 1 liter dengan aquades selama semalam untuk melarutkan iod secara sempurna.
c.
Penentuan Konsentrasi Asam Askorbat
Sebanyak 1 ml filtrat hasil ekstraksi diencerkan ke dalam 10 ml air dan diambil 2 ml filtrat hasil pengenceran yang dimasukkan ke dalam erlenmeyer, lalu ditambahkan dengan 0.4 ml larutan amilum (soluble starch) 1%. Larutan kemudian dititrasi dengan 0.01 N iodium. Titik akhir titrasi ditandai dengan perubahan warna larutan menjadi semburat biru. 1 ml 0.01 N iodium setara dengan 0.88 mg asam askorbat.
Konsentrasi asam askorbat dihitung dengan rumus:
[ ] vitamin C (mg/ 100 g sampel) = (titer (ml) x 0.88 mg x Faktor Pengenceran) x 100 Wsampel (g)
4.
Analisis Protein Lowry (Waterborg 2002 yang dimodifikasi)
a.
Ekstraksi
Homogenisasi 100 mg jaringan tumbuhan dengan 1 ml buffer. Sentrifuse sampai homogen pada kecepatan pada kecepatan 12000 g selama 20 menit, kemudian ambil bagian supernatannya. Buffer yang digunakan sama dengan buffer untuk analisis PAL.
b.
Pengukuran
Sebanyak 5-200 µl supernatan ditambahkan air sampai dengan 1 ml, lalu tambahkan sebanyak 0.90 ml reagen A dan kocok hingga homogen. Inkubasi larutan selama 10 menit dalam suhu 500 C dan dinginkan sejenak. Sebanyak 0.10 ml reagen B ditambahkan ke dalam larutan tersebut dan dikocok untuk kemudian diinkubasi selama 10 menit pada suhu ruang. Terakhir, larutan ditambahkan dengan 3 ml reagen C dan dikocok serta diinkubasi kembali selama 10 menit pada suhu 500 C. Larutan tersebut
16 Perhitungan protein dinyatakan dalam satuan µg per gram, seperti berikut ini:
Protein (µg/gram) = Protein ekstrak (µg/ml) x Volume ekstrak (ml) x Faktor Pengenceran
Bobot contoh (g)
5.
Analisis Aktivitas
Phenylalanine Ammonia Lyase
(PAL) (Sadasivam dan
Manickam 1996)
a.
Ekstraksi Enzim
Homogenisasi 500 mg bahan sampel (plant material) dalam 5 ml buffer borat-HCl 25 mM pH 8.8 dingin yang mengandung 5 mM mercaptoethanol (0.4 mL/L). Sentrifuse sampai homogen pada kecepatan 12000 g selama 20 menit. Supernatan digunakan sebagai sumber enzim.
b.
Penentuan Aktivitas Phenylalanine Ammonia Lyase (PAL)
Pencampuran 0.5 ml buffer borat, 0.2 ml larutan enzim (enzyme solution), dan 1.3 ml air dalam tabung uji. Reaksi dimulai dengan penambahan 1 ml larutan L-Phenylalanine. Inkubasi larutan selama 30-60 menit pada suhu 320C. Hentikan reaksi dengan menambahkan 0.5 ml Tricholoro Acetic
Acid 1 M. Sementara itu, untuk perlakuan kontrol dilakukan dengan menambahkan L-Phenylalanine
setelah penambahan Tricholoro Acetic Acid. Pengukuran absorbansi sampel dilakukan pada 290 nm. Larutan standar yang digunakan adalah asam trans-cinnamic.
6.
Analisis Kualitatif Fitokimia
Tujuan tahap analisis kualitatif komponen bioaktif (fitokimia) untuk mengetahui jenis komponen bioaktif sampel ekstrak takokak secara kualitatif sebagai senyawa metabolit sekundernya. Sampel ekstrak yang diuji adalah ekstrak buah takokak (metanol PA, etil asetat, dan heksan) dan ekstrak hancuran buah takokak (metanol PA, etil asetat, dan heksan), sehingga total sampel ada enam jenis.
a.
Golongan Alkaloid (Houghton dan Raman 1998 yang dimodifikasi)
Sebanyak 1 ml ekstrak ditambahkan 10 ml kloroform dan beberapa tetes amoniak, lalu diasamkan dengan beberapa tetes asam sulfat 2 M. Hasilnya akan terbentuk 2 fase, fase asam diambil dan dibagi ke dalam 3 buah tabung reaksi. Tabung reaksi pertama ditambahkan 3 tetes pereaksi Dragendorf, tabung kedua ditambahkan 3 tetes pereaksi Mayer, dan tabung ketiga ditambahkan 3 tetes pereaksi Wagner. Hasil uji positif untuk peraksi Dragendorf jika terdapat endapan berwarna jingga. Hasil uji positif dengan pereaksi Mayer jika terdapat endapan berwarna putih. Hasil uji positif dengan pereaksi Wagner jika terdapat endapan berwarna merah kecoklatan.
Pembuatan pereaksi Mayer dengan melarutkan 1.36 g HgCl2 dalam 60 ml air suling. Pada
17 glacial dan 40 ml air suling. Kedua larutan dicampurkan. Pereaksi ini disimpan dalam botol berwarna coklat. Untuk penggunaannya satu larutan ini diencerkan dengan 2/3 bagian larutan 20 ml asam asetat glacial dalam 100 ml air suling. Pereaksi Wagner dibuat dari 1.27 g iodium dan 2 g KI yang dilarutkan dalam 5 ml air suling. Kemudian larutan ini diencerkan menjadi 100 ml dengan air suling. Jika terdapat endapan dilakukan penyaringan dan disimpan dalam botol yang berwarna coklat.
b.
Golongan Tanin (Harborne 1996)
Sebanyak 1 ml ekstrak (2 mg dalam 5 ml etanol) ditambahkan 2 tetes larutan FeCl3 5%.
Terbentuknya warna hijau atau hijau biru menunjukkan adanya senyawa fenol dalam bahan. Kemudian ditambahkan gelatin 1%. Jika terdapat endapan putih berarti positif tanin.
c.
Golongan Flavonoid (Harborne 1996)
Sebanyak 1 mg sampel dilarutkan dalam 2 ml kloroform, kemudian sebanyak 1 ml sampel cair ditetesi Pb-asetat. Hasil uji positif untuk flavon bila terbentuk warna jingga atau krem. Kalkon bila terbentuk warna jingga tua dan auron bila terbentuk warna merah.
d.
Golongan Terpenoid dan Steroid (Uji Lie-Bermann-Burchard) (Harborne
1996)
Sebanyak 1 ml ekstrak dilarutkan dalam 2 ml kloroform, lalu ditambahkan 10 tetes asam asetat glacial dan 3 tetes asam sulfat pekat. Larutan dikocok perlahan dan dibiarkan beberapa menit. Hasil uji positif terpenoid jika terbentuk warna merah atau ungu. Hasil uji positif steroid jika tebentuk warna merah yang lalu mengalami perubahan warna menjadi biru atau hijau.
e.
Golongan Saponin (Harborne 1996)
Sebanyak 1 ml ekstrak ditambahkan 10 ml air panas lalu didinginkan dan di-vorteks selama 10 detik. Apabila terbentuk buih yang mantap selama sekitar 10 menit, artinya ekstrak mengandung senyawa saponin. Buih yang mantap jika tingginya 1-10 cm dan tidak hilang jika ditambahkan HCl 2N.
7.
Analisis Total Fenolik (Folin Ciocalteau) (Shetty
et al. 1995 yang
dimodifikasi)
18 dan 2.5 ml reagen Folin Ciocalteau 50%. Campuran tersebut didiamkan selama 5 menit, lalu ditambahkan 0.5 ml Na2CO3 5% dan divortex. Sampel kemudian disimpan di ruang gelap selama 1
jam. Pengukuran absorbansi sampel dilakukan pada 725 nm dengan larutan standar yang digunakan adalah asam galat dengan variasi konsentrasi 50, 100, 150, 200, dan 250 mg/L.
8.
Analisis Aktivitas Antioksidan Metode DPPH (Andarwulan et al. 2010 yang
dimodifikasi)
Sampel yang diuji berupa ekstrak metanol buah dan hancuran buah yang dibuat dalam konsentrasi 200 ppm berdasarkan nilai total fenolnya. Sebanyak 100 µl larutan sampel atau standar dimasukan ke dalam tabung reaksi, lalu ditambahkan 4 ml metanol (sebagai blanko adalah 4 ml metanol). Suspensi tersebut kemudian ditambahkan 1 ml larutan DPPH 0.5 mM dan dihomogenkan dengan menggunakan vortex. Seluruh reaksi dilakukan pada ruang gelap. Campuran tersebut diinkubasi selama 30 menit pada suhu ruang, kemudian diukur absorbansinya pada panjang gelombang 517 nm. Aktivitas antioksidan dinyatakan dalam bentuk persentase penghambatan (% inhibisi) terhadap radikal DPPH dengan perhitungan sebagai berikut:
(%) inhibisi = (Absorbansi blanko - Absorbansi sampel) x 100%
Absorbansi blanko
Aktivitas antioksidan dinyatakan dalam bentuk AEAC (Ascorbic Acid Equivalent Antioxidant Capacity), yaitu dengan menggunakan asam askorbat sebagai standar antioksidan. Nilai selisih absorbansi blanko dan absorbansi sampel disubstitusikan pada persamaan kurva standar asam askorbat untuk menentukan AEAC (Ascorbic Acid Equivalent Antioxidant Capacity). Nilai yang diperoleh menunjukkan jumlah mg asam askorbat yang ekivalen dengan 1 ml sampel.
9.
Analisis Data Statistik
Perhitungan data analisis total antosianin, total asam askorbat, dan total fenol buah takokak dinyatakan dalam buah segar (mg/100 gram fresh weight) danbasis kering sampel (mg/100 gram dry basis). Kemudian, beberapa data analisis terhadap total antosianin, total asam askorbat, aktivitas
19
IV.
HASIL DAN PEMBAHASAN
A.
Pengaruh Perlakuan Terhadap Komponen Bioaktif Buah Takokak
Metode penelitian yang dilakukan diawali dengan tahap pemberian perlakuan terhadap sampel segar buah takokak dengan membagi sampel menjadi dua perlakuan, yaitu perlakuan buah utuh atau tanpa penghancuran dan hancuran buah. Tujuan pemberian perlakuan untuk mengidentifikasi dan memperoleh komponen bioaktif buah takokak dengan memberikan pengaruh penghancuran pada sebagian sampelnya, sehingga dapat diketahui dampaknya dan perbedaannya terhadap kandungan komponen bioaktif dengan buah yang tidak mengalami proses penghancuran. Komponen bioaktif yang diperoleh ini salah satunya berperan sebagai antioksidan.
Tahap persiapan sampel diawali dengan proses penimbangan sampel segar buah takokak yang telah dipisahkan dari tangkainya sebanyak 1-2 kg. Sampel mengalami pencucian dan penirisan untuk selanjutnya dibagi menjadi dua perlakuan. Proses penghancuran buah takokak dilakukan secara bertahap atau sedikit demi sedikit, yaitu sekitar 500 gram setiap proses penghancuran selama ± 10-15 menit tanpa penambahan air hingga keseluruhan bentuk hancuran sampel yang diperoleh relatif sama (homogen) untuk setiap kali proses penghancurannya.
Sampel buah utuh dan hancuran buah takokak yang diperoleh dimasukkan ke dalam plastik HDPE (bening) ukuran 1 kg, dimana ¾ bagian plastik diisi oleh sampel. Kemudian, sampel-sampel tersebut secara bersamaan dimasukkan ke dalam freezer selama satu malam dan dikeringkan dengan alat freeze dryer pada keesokan harinya selama + 48 jam. Setiap sampel diukur pula kadar air segarnya, sehingga dapat diketahui kadar air buah segar dan hancuran buah segar takokak.
Berdasarkan hasil analisis kadar air, buah takokak segar memiliki kadar air sebesar 80.94% bahan basah, sedangkan hancuran buah takokak segar memiliki kadar air sebesar 84.32% bahan basah. Perhitungan kadar air sampel segar secara lengkap dapat dilihat pada Lampiran 1. Menurut penelitian Rahmat (2009) dan Apriady (2010), kadar air buah takokak segar yang dianalisis sebesar 89.20% bahan basah dan 79.89% bahan basah. Hal ini menunjukkan, bahwa kandungan air pada buah dan hancuran buah segar takokak yang diperoleh relatif tinggi sebagai bahan pangan segar.
Nilai kadar air kedua sampel tersebut relatif tidak berbeda jauh. Pada buah segar takokak, analisis kadar air diawali dengan proses pemotongan atau pengirisan sampel. Hal ini untuk mempermudah dan mempercepat proses pengeringan. Sementara itu, untuk hancuran buah segar takokak, analisis kadar air diperoleh dari sampel buah takokak yang telah dihancurkan. Proses pemotongan atau pengirisan dan penghancuran akan berpengaruh terhadap luas permukaan bahan yang dikeringkan. Permukaan bahan yang luas ketika pengeringan akan memudahkan bahan berhubungan dengan medium pemanasan atau udara panas dan mengurangi jarak gerak panas untuk sampai ke bahan yang dikeringkan (Muchtadi 2008). Sebagai tambahan, air bebas pada bahan segar banyak yang terikat di jaringan matriks bahan, seperti kapiler, membran, serat, dan lain-lain. Air bebas ini mudah diuapkan dan sering dimanfaatkan sebagai media pertumbuhan mikroba dan media reaksi-reaksi kimiawi (Winarno 1980).
20 dengan suhu pengeringan di bawah titik beku dan tekanan vakum (di bawah tekanan triple) (Fellows 2000). Proses ini dapat menghambat dan tidak memungkinkan aktivitas enzim mendegradasi senyawa di dalam bahan pangan (Chan 2009). Selain itu, pengeringan beku (freeze-drying) memiliki efisiensi ekstraksi yang tinggi daripada pengeringan udara (air-drying) karena kristal es yang terbentuk di dalam matriks bahan sebagai hasil pengeringan bekudapat memecah struktur sel yang memungkinkan keluar dari komponen seluler dan larut baik dalam pelarut, akibatnya proses ekstraksi pun akan menjadi lebih baik. Sementara itu, pengeringan udara hanya akan menyebabkan pecahnya sel sedikit saja atau bahkan tidak pecah dan adanya pengaruh pemberian panas yang dapat menyebabkan bahan yang dikeringkan kehilangan senyawa fenolik dan asam askorbat (Asami et al. 2003).
Setelah proses pengeringan beku, sampel dihancurkan dengan cara diblender kering dan diayak dengan ayakan berukuran 20 mesh untuk memperoleh bubuk takokak dengan kehalusan yang cukup tinggi dan seragam. Sampel dalam bentuk bubuk akan mempermudah kontak antara bahan dan pelarutnya, sehingga proses ekstraksi lebih optimal. Hasil warna bubuk hancuran buah dan buah takokak dapat dilihat pada Gambar 8.
Warna bubuk buah takokak yang diperoleh berwarna hijau muda, sedangkan bubuk hancuran buah takokak berwarna kecoklatan. Hal ini disebabkan pigmen atau warna bahan pangan sangat sensitif terhadap perubahan kimia dan fisika selama pengolahan, seperti proses penghancuran. Peningkatan aktivitas beberapa enzim akibat proses penghancuran disebabkan sel-sel tenunan dan
pigment body tempat pigmen itu berada telah pecah, sehingga pigmen keluar (Muchtadi 2008). Kemudian, pigmen tersebut menjadi rusak dan teroksidasi karena kontak dengan udara yang dikatalisasi oleh enzim, seperti enzim peroksidase (POD) dan polifenol oksidase (PPO). Enzim POD dan PPO dapat mengkatalisasi berbagai proses oksidatif pada reaksi perubahan warna dan cita rasa (Gardjito et al. 2006). Dengan demikian, secara fisik terlihat sampel hancuran buah takokak mengalami perubahan warna dari hijau muda menjadi kecoklatan.
Gambar 8. Warna bubuk hancuran buah dan buah takokak (kiri ke kanan)
21 Sampel bubuk buah dan hancuran buah takokak dianalisis untuk diketahui kandungan total antosianin, total asam askorbat, dan aktivitas Phenylalanine Ammonia Lyase (PAL) termasuk kandungan proteinnya dengan metode protein Lowry. Alasan penggunaan sampel bubuk untuk beberapa analisis ini karena ingin diketahui pengaruh penghancuran terhadap komponen-komponen kimia tersebut.
1.
Kandungan Antosianin Buah Takokak
Antosianin memiliki cincin aromatik bergugus polar (hidroksil, karboksil, metoksil) dan residu glikosil yang menghasilkan molekul polar. Maka dari itu, pigmen antosianin dilarutkan dengan menggunakan pelarut polar, seperti etanol, metanol, dan air (Bridle dan Timberlake 1997). Namun biasanya proses ekstraksi pun menggunakan pelarut asam untuk mendenaturasi dan merusak membran sel atau jaringan tanaman, sehingga pigmen antosianin lebih mudah keluar dari sel. Hal ini karena, antosianin senyawa yang tidak stabil dalam suasana netral atau basa (Jackman dan Smith 1996).
Cara ekstraksi antosianin secara sederhana dan sering digunakan adalah dengan maserasi, yaitu merendam bahan yang diekstrak dalam alkohol, suhu rendah, dan dengan penambahan sedikit asam seperti HCl. Berdasarkan penelitian oleh Raharja dan Dianawati (2001), bahwa ekstraksi antosianin pada daun erpa dengan menggunakan tiga jenis pelarut, yaitu aquades, etanol, dan metanol yang
masing-masing mengandung HCl, maka ditemukan bahwa aquades yang mengandung HCl (HCl 5%
dalam aquades) cukup asam untuk memecah dinding sel vakuola dimana pigmen antosianin berada. Namun pelarut ini tidak terlalu asam untuk membuat kerusakan pigmen. Pemilihan jenis pelarut HCl 5% dalam aquades untuk penelitian ini pun diperkuat dengan penelitian yang dilakukan oleh Kurniasih (2010), bahwa penelitian kandungan antosianin pada 24 sampel sayuran indigenous
menunjukkan nilai yang relatif tinggi, khususnya pada buah takokak.
Beberapa metode untuk mengetahui kandungan antosianin suatu bahan, antara lain metode dengan larutan yang memiliki nilai satu pH dan metode dengan menggunakan dua larutan dengan dua nilai pH yang berbeda. Salah satu metode dengan menggunakan satu nilai pH dalm penelitian ini, yaitu metode Lees dan Francis (1972). Total antosianin dihitung berdasarkan absorbansi ekstrak yang dilarutkan dalam etanol 95%:HCl 1.5 N (85:15) pada panjang gelombang 535 nm. Nilai serapan molar yang digunakan adalah 98.2, yaitu nilai E (1%, 1 cm, 535 nm) untuk pelarut etanol yang diasamkan. Nilai tersebut merujuk pada absorpsi campuran antosianin buah cranberry di dalam etanol asam yang diukur di dalam celah selebar 1 cm pada panjang gelombang 535 nm dengan konsentrasi 1% (w/v).
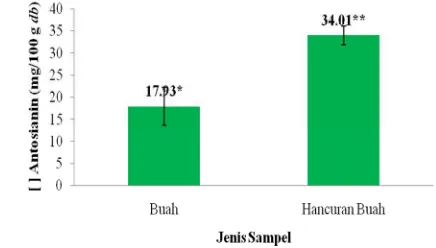
Hasil nilai total antosianin buah dan hancuran buah takokak ini dihitung dalam berat segar (fresh weight) yang secara berurutan sebesar 3.42 mg/100 gram fresh weight dan 5.33 mg/100 gram
fresh weight atau dalam basis keringnya (dry basis) sebesar 17.93 mg/100 gram dry basis dan 34.01 mg/100 gram dry basis. Perhitungan total antosianin takokak secara lengkap dapat dilihat pada Lampiran 3.
Pengolahan data nilai total antosianin buah dan hancuran buah takokak menggunakan uji t-test dengan output seperti pada Lampiran 4. Hasil uji statistik menunjukkan adanya perbedaan yang nyata terhadap nilai kandungan antosianin kedua sampel dalam basis kering sampel (dry basis) seperti pada
Gambar 9. Hal ini terlihat dari nilai signifikansi sampel yang dihasilkan, yaitu lebih kecil dari taraf α
22
Keterangan : Tanda * dan ** menunjukkan berbeda nyata (p<0.05) dengan uji t-test
Gambar 9. Total antosianin buah takokak berdasarkan dry basis
Perbedaan nilai total antosianin buah dan hancuran buah karena pigmen antosianin buah berwarna lebih kehijauan dan hancuran buah takokak berwarna lebih merah kecoklatan. Pada sampel buah takokak, antosianin kurang terlarut baik dalam pelarut ekstrak karena membran sel tempat pigmen antosianin berada tidak terdenaturasi secara baik. Di samping itu, pigmen klorofil (zat hijau) buah takokak lebih mendominasi daripada pigmen antosianin. Aktivitas pembentukan antosianin pada bagian-bagian tanaman (termasuk buah) dapat terjadi secara bersamaan dengan pembentukan klorofil. Kemudian, pigmen antosianin pada hancuran buah takokak lebih terlarut baik pada pelarut ekstrak karena pada awal persiapan sampel, sampel mengalami penghancuran, sehingga membran sel tempat pigmen antosianin berada sudah terdegradasi lebih awal.
Nilai total antosianin buah takokak yang diuji, baik yang dalam kondisi buah utuh atau pun hancuran buah lebih rendah daripada buah terong (Solanum melongena) sebesar 45.01 mg/100 gram
fresh weight (Sadilova et al. 2006). Namun, nilai total antosianin buah takokak yang diuji pada penelitian ini masih berada atau dekat hasilnya dengan.nilai total antosianin buah takokak penelitian Kurniasih (2010), yaitu sebesar 22.09 mg/100 gram dry basis.
2.
Kandungan Asam Askorbat (Vitamin C) Buah Takokak
Analisis vitamin C dalam penelitian ini menggunakan pelarut air untuk mengekstrak dan membantu melarutkan vitamin C dari bubuk buah dan hancuran buah takokak. Hal ini disebabkan asam askorbat atau vitamin C merupakan salah satu vitamin yang tergolong larut air disamping vitamin-vitamin B kompleks (Winarno 1997). Metode yang digunakan untuk mengetahui total asam askorbat sampel menggunakan metode titrasi dengan iodium. Ekstrak sampel yang diperoleh direaksikan dengan larutan amilum (soluble starch) 1%. Larutan ini merupakan indikator perubahan warna ekstrak setelah dititrasi dengan 0.01 N iodium, menjadi warna semburat biru. Sebanyak 1 ml 0.01 N iodium setara dengan 0.88 mg asam askorbat, sehingga hasil titrasi yang diperoleh dapat dikalkulasikan menjadi seberapa banyak asam askorbat (vitamin C) dalam sampel tersebut.
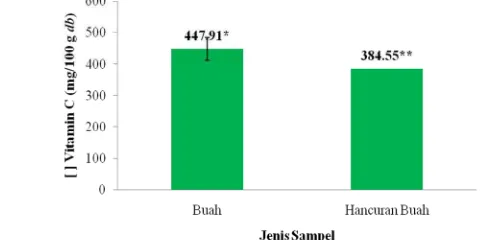
23 6. Nilai total asam askorbat buah takokak terlihat berbeda nyata (p<0.05) dengan nilai total asam askorbat hancuran buah takokak pada taraf signifikansi 5% setelah di uji t-test dalam dry basis
(Gambar 10).
Keterangan : Tanda * dan ** menunjukkan berbeda nyata (p<0.05) dengan uji t-test
Gambar 10. Total asam askorbat (vitamin C) buah takokak berdasarkan dry basis
Nilai total asam askorbat buah takokak lebih tinggi dari hancuran buah takokak dan secara statistik berbeda nyata untuk kedua jenis sampel ini. Hal tersebut dikarenakan buah takokak tidak mengalami penghancuran (perlakuan mekanis) pada persiapan sampel. Vitamin C mudah mengalami kerusakan akibat oksidasi, panas, dan alkali, sehingga pengirisan dan penghancuran yang berlebihan dapat menyebabkan vitamin C pada bahan banyak yang hilang (Winarno 1997). Penurunan kadar vitamin C pada takokak akibat penghancuran akan membuat bahan mudah teroksidasi dan kemungkinan akan memicu pula aktivitas enzim, seperti peroksidase, asam askorbat oksidase, sitokrom oksidase, dan fenolase.
Penelitian Kurniasih (2010) pun menyebutkan, bahwa kandungan asam askorbat buah takokak sebagai salah satu sampel sayuran indigenous dari ke-24 sampel yang diuji sebesar 639.98 mg/100 gram dry basis. Apabila dibandingkan dengan sayuran buah lainnya yang masih satu famili
Solanaceae, total asam askorbat buah dan hancuran buah takokak yang diuji relatif masih lebih tinggi. Seperti penelitian Vasco et al. (2008) yang menyebutkan bahwa total asam askorbat dari buah naranjilla (Solanum quitoense Lam.) dan pepino (Solanum muricatum Ait.) hanya sebesar 11-13 mg/100 gram fresh weight dan 20-38 mg/100 gram fresh weight. Begitu pula dengan total asam askorbat buah terong (Solanum melongena) yang hanya mengandung 12.0 mg/100 gram fresh weight
(Gopalan et al. 2007) dan 56–129 mg/100 gram dry basis (Hanson et al. 2006) serta total asam askorbat Solanum aethiopicum sebesar 71-98 mg/100 gram dry basis (Hanson et al. 2006). Total asam askorbat buah dan hancuran buah takokak ini sudah dapat mencukupi kebutuhan tubuh akan kebutuhan vitamin C setiap harinya. Kebutuhan tubuh akan vitamin C berdasarkan RDA
(Recommended Dietary Allowance) atau AKG (Angka Kecukupan Gizi) untuk pria dewasa dan wanita
menurut National Academy of Science (2000) adalah 75-90 mg/hari.
3.
Phenylalanine Ammonia Lyase (PAL) Buah Takokak
Phenylalanine Ammonia Lyase (PAL) (E.C. 4.1.1.5) merupakan salah satu enzim yang
trans-24 sinamat. Aktivitas PAL dalam penelitian ini dinyatakan sebagai jumlah asam trans sinamat (µmol) yang terbentuk per mg protein setiap menit.
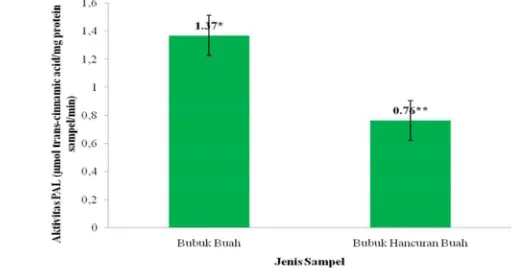
Perhitungan nilai protein takokak dengan metode Lowry. Perhitungan kurva standar yang diperoleh untuk standar protein BSA tercantum pada Lampiran 7a dengan persamaan garis yang diperoleh y = 0.0034x + 0.0342 dan R² = 0.9993. Nilai kandungan protein Lowry dapat dilihat pada Lampiran 7b, dimana kandungan protein bubuk buah takokak dan bubuk hancuran buah takokak, yaitu sebanyak 48.83 µg/g sampel dan 55.97 µg/g sampel.
Kemudian, kurva standar aktivitas PAL berupa asam trans sinamat tercantum pada Lampiran 7c dan perhitungan aktivitas PAL buah takokak dapat dilihat pada Lampiran 7d. Persamaan garis standar asam trans sinamat adalah y = 0.1246x - 0.2953 dan R² = 0.9984. Hasil aktivitas PAL (Gambar 11) buah dan hancuran buah takokak yang diperoleh sebesar 1.37 µmol trans cinnamic acid/mg protein/menit dan 0.76 µmol trans cinnamic acid/mg protein/menit. Hasil aktivitas PAL diuji secara statistik dengan uji t-test (Lampiran 8) dan hasilnya menunjukkan adanya perbedaan nyata antara aktivitas PAL buah takokak dengan aktivitas PAL hancuran buah takokak pada taraf signifikansi 5%, karena nilai signifikansi sampel lebih kecil dari 0.05 (p<0.05). Nilai aktivitas PAL buah takokak lebih tinggi dibandingkan aktivitas PAL hancuran buah takokak, karena proses penghancuran bahan akan membuat aktivitas PAL menjadi turun akibat protein dalam bahan mengalami denaturasi dan pada saat itu konformasi enzim tidak berada pada posisi yang sesuai untuk dapat menempel pada substratnya (Tanudjaja 1999).
Aktivitas PAL dibandingkan terhadap protein bahan karena enzim PAL berfungsi untuk mengkatalisis perubahan asam amino aromatik fenilalanin menjadi asam trans sinamat. Fenilalanin yang termasuk asam amino aromatik bercincin benzena ini diidentifikasi dengan metode Lowry. Metode Lowry merupakan salah satu metode untuk mengetahui jumlah protein atau asam amino jenis aromatik, seperti tirosin, triptofan, dan fenilalanin dengan mereduksi Cu2+ menjadi Cu+. Ion Cu+ akan
mereduksi reagen Folin-Ciocalteau, kompleks phosphomolibdat-phosphotungstat
(phosphomolybdotungstate), menghasilkan heteropolymolybdenum blue akibat reaksi oksidasi gugus aromatik (rantai samping asam amino) terkatalis Cu, yang memberikan warna biru intensif yang dapat
dideteksi secara kolorimetri (Lowry 1951). Kandungan protein bahan ini berbeda dengan aktivitas PAL yang ditunjukkan. Hal ini disebabkan, protein yang diperoleh dengan metode Lowry tidak semuanya adalah asam amino jenis fenilalanin. Namun demikian, kandungan asam amino fenilalanin buah takokak kemungkinan lebih banyak daripada asam amino fenilalanin hancuran buah takokak, sehingga aktivitas PAL buah takokak relatif lebih tinggi.
Keterangan : Tanda * dan ** menunjukkan berbeda nyata (p<0.05) dengan uji t-test
25 Penelitian terkait aktivitas PAL relatif masih terbatas, khusunya untuk famili Solanaceae.Nilai aktivitas Phenylalanine Ammonia Lyase (PAL) buah takokak termasuk rendah jika dibandingkan dengan aktivitas PAL dari buah segar seperti buah tomat yang belum diinfeksi larva sebesar 5 µmol trans sinamat/mg protein N (Brueske 1980). Kemudian, aktivitas PAL yang terdeteksi pada kulit buah segar blueberries sebesar 2.3 µmol/mg protein dan cranberries beku (frozen powder) sebesar 0-3.5
µmol/mg protein (Sapers et al. 1987). Namun, aktivitas PAL relatif lebih tinggi dibandingkan host
plant Persea bombycina dengan tingkat kematangan medium sebesar 4.14 x 10-3µmol/mg/menit dan
host plant Litsea citrate sebesar 0.96 x 10-3 µmol/mg/menit seperti pada penelitian Neog et al. (2011). Beberapa faktor lain yang mempengaruhi aktivitas PAL adalah cahaya atau sinar, keragaman buah (bahan), perlakuan stress pada tanaman, dan kematangan buah. Total aktivitas PAL setiap buah akan lebih tinggi nilainya saat buah tersebut matang dibandingkan buah yang masih muda (Cheng et al. 1991).
Umumnya, nilai antosianin berkaitan dengan nilai aktivitas PAL, namun kondisi tersebut tidaklah mutlak. Seperti pada penelitian buah takokak ini, nilai total antosianin buah takokak tidak berkorelasi atau tidak mempengaruhi nilai aktivitas PAL-nya. Peningkatan aktivitas PAL tidak selalu bertanggung jawab pada akumulasi antosianin pada suatu bahan. PAL hanya merupakan enzim kunci untuk menghasilkan prekursor zat warna bagi tanaman, salah satunya seperti antosianin. Pengaturan konsentrasi prekursor inilah yang kemungkinan berpengaruh terhadap jumlah antosianin yang dihasilkan. Tetapi, jika jumlah prekursor pada buah telah mencukupi, perubahan aktivitas PAL tidak berkaitan dengan akumulasi antosianin. Kondisi maksimum aktivitas PAL dan antosianin bisa berbeda. Kemudian, penemuan lainnya menemukan bahwa jenis senyawa fenol sederhana lebih erat berkorelasi dengan tingkat PAL daripada antosianin karena fenol sederhana dihasilkan pada awal
biosintesis fenolik melalui jalur fenilpropanoid dengan melibatkan enzim PAL (Ju et al. 1995).
B.
Kualitatif dan Kuantitatif Komponen Bioaktif Ekstrak Buah Takokak
Tahap penelitian ini selanjutnya adalah tahap pengekstraksian sampel bubuk buah takokak. Tujuannya untuk memperoleh zat atau senyawa kimia (fitokimia) yang berperan sebagai metabolit sekunder dari ekstrak, sehingga dapat diketahui pula perubahan senyawa tersebut dan kadar serta aktivitas antioksidan pada hancuran buah. Tahap ekstraksi sampel bubuk takokak dengan menggunakan metode ekstraksi maserasi. Metode ini merupakan salah satu metode ekstraksi yang cukup sederhana karena dilakukan dengan cara melarutkan sampel menggunakan pelarut, perendaman selama beberapa hari, dilakukan pengadukan, dan proses penyaringan hingga diperoleh cairan (Pandiangan 2008). Pada proses ekstraksi, sampel bubuk buah dan hancuran buah takokak dilarutkan dengan pelarut organik, yaitu metanol (polar), etil asetat (semi polar), dan heksan (non polar). Penggunaan ketiga pelarut organik yang berbeda kepolarannya ini akan menentukan jenis komponen bioaktif (fitokimia) yang terekstrak dari sampel. Oleh karena itu, sampel ekstrak yang diperoleh dianalisis secara kualitatif dan kuantitatif.
26 Gambar 12. Ekstrak buah takokak pelarut heksan (a), etil asetat (b), dan metanol (c);
Ekstrak hancuran buah takokak pelarut heksan (d), etil asetat (e), dan metanol (f)
1.
Kualitatif Fitokimia Ekstrak Buah Takokak
Hasil ekstraksi buah dan hancuran buah takokak dianalisis lanjut secara kualitatif dengan melihat perubahan warna setelah ekstrak ditambahkan zat-zat kimia atau perlakuan tertentu. Perubahan warna atau secara fisik ekstrak menunjukkan bahwa ekstrak mengandung komponen senyawa bioaktif tertentu. Hasil analisis kualitatif komponen bioaktif (fitokimia) ekstrak buah dan hancuran buah dari pelarut metanol, etil asetat, dan heksan secara keseluruhan tidak berbeda. Perbedaan kandungan komponen kimia terdapat pada ekstrak antar pelarut. Ekstrak buah utuh dan hancuran buah untuk jenis pelarut metanol mengandung alkaloid, flavonoid jenis flavon, tanin, dan saponin. Sementara itu, ekstrak buah utuh dan hancuran buah untuk jenis pelarut etil asetat dan heksan mengandung alkaloid, flavonoid jenis flavon, terpenoid, dan saponin.
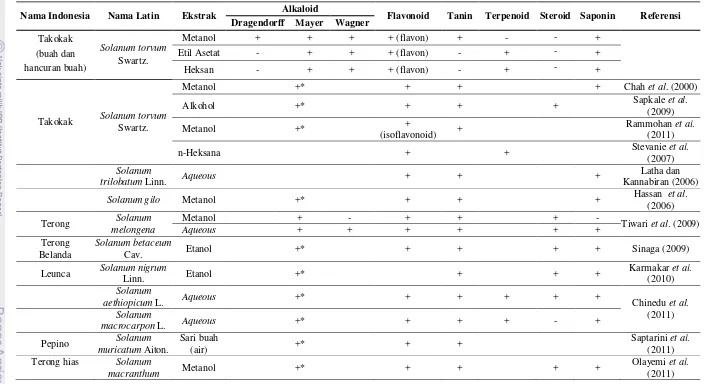
Perbandingan hasil fitokimia ekstak buah takokak dengan beberapa penelitian lainnya dapat dilihat secara lengkap pada Tabel 2. Menurut Chah et al. (2000), ekstrak metanol buah takokak yang diuji menunjukkan adanya kandungan alkaloid, flavonoid, tanin, dan saponin. Adanya kandungan komponen bioaktif ini ditunjukkan dengan adanya perubahan warna atau endapan (+). Hasil penelitian Rammohan et al. (2011) menunjukkan hasil positif adanya kandungan alkaloid, isoflavonoid, dan tanin pada ekstrak metanol buah takokak. Sementara itu, Stevanie et al. (2007) menyatakan adanya hasil positif terhadap kandungan flavonoid dan terpenoid pada sampel ekstrak n-heksan buah takokak yang diuji. Penelitian Sapkale et al. (2009) menyatakan bahwa adanya kandungan positif terhadap flavonoid, alkaloid, tanin, dan steroid pada ekstrak alkohol buah takokak (Solanum torvum Swartz.). Dengan demikian, secara umum hasil fitokimia ekstrak metanol buah dan hancuran buah takokak yang diuji masih memiliki banyak kesamaan dengan hasil fitokimia ekstrak metanol atau etanol dari sayuran buah lainnya yang masih termasuk famili Solanaceae. Perbedaannya lebih terletak pada jenis flavonoid yang teridentifikasi pada ekstrak metanol buah dan hancuran buah takokak, yaitu jenis flavon, sedangkan jenis flavonoid ekstrak metanol buah takokak pada penelitian Rammohan et al. (2011) adalah jenis isoflavonoid.
27 Tabel 2. Hasil kualitatif komponen bioaktif (fitokimia) ekstrak sayuran buah famili Solanaceae
Keterangan : (+) me
Nama Indonesia Nama Latin Ekstrak Alkaloid Flavonoid Tanin Terpenoid Steroid Saponin Referensi
Dragendorff Mayer Wagner
Takokak (buah dan hancuran buah)
Solanum torvum
Swartz.
Metanol + + + + (flavon) + - - +
Etil Asetat - + + + (flavon) - + - +
Heksan - + + + (flavon) - + - +
Takokak Solanum torvum
Swartz.
Metanol +* + + + Chah et al. (2000)
Alkohol +* + + + Sapkale et al.
(2009)
Metanol +* +
(isoflavonoid) +
Rammohan et al. (2011)
n-Heksana + + Stevanie et al.
(2007) Solanum
trilobatum Linn. Aqueous + + +
Latha dan Kannabiran (2006)
Solanum gilo Metanol +* + + + Hassan et al.
(2006)
Terong Solanum
melongena
Metanol + - + + + -
Tiwari et al.(2009)
Aqueous + + + + + +
Terong Belanda
Solanum betaceum
Cav. Etanol +* + + + + Sinaga (2009)
Leunca Solanum nigrum
Linn. Etanol +* + + +
Karmakar et al. (2010)
Solanum
aethiopicum L. Aqueous +* + + + + + Chinedu et al.
(2011)
Solanum
macrocarpon L. Aqueous +* + + + - +
Pepino Solanum
muricatum Aiton.
Sari buah
(air) +* + +
Saptarini et al. (2011)
Terong hias Solanum
macranthum Metanol +* + + + +
Olayemi et al. (2011)
Keterangan : (+) menunjukkan adanya perubahan dalam bentuk warna atau endapan; (+*) menunjukkan bahwa referensi tidak menjelaskan hasil fitokimia alkaloid dengan metode spesifik; (-) tidak menunjukkan adanya perubahan dalam bentuk warna atau endapan
28 Senyawa alkaloid terdapat pada ketiga pelarut, yaitu metanol, etil asetat, dan heksan. Hal ini dikarenakan senyawa alkaloid hanya dapat terlarut baik pada pelarut organik. Senyawa alkaloid merupakan senyawa organik (metabolit sekunder) terbesar diantara senyawa lainnya baik secara jumlah maupun penyebarannya (Astuti et al. 1995). Oleh karena itu, kemungkinan ditemukannya senyawa alkaloid pada ketiga ekstrak buah dan hancuran buah menjadi lebih besar.
Senyawa flavonoid dan tanin merupakan senyawa fenolik yang dapat larut dalam pelarut polar karena adanya gugus hidroksi, sehingga pada ekstrak metanol, senyawa ini dapat terdeteksi. Kemudian, pada pelarut etil asetat yang bersifat semipolar juga ditemukan adanya senyawa flavonoid dan fenol, karena sifat pelarut etil asetat yang mampu mengekstrak senyawa bersifat polar dan non polar. Pada ekstrak buah dan hancuran buah pelarut heksan dapat ditemukan adanya senyawa flavonoid. Hal ini dimungkinkan, struktur senyawa flavonoid pada pelarut heksan merupakan aglikon flavonoid, yaitu flavonoid tanpa gula terikat. Contoh senyawa aglikon flavonoid, seperti isoflavon, flavonon, flavon, dan flavonol yang termetoksilasi yang cenderung lebih mudah larut dalam pelarut non polar (Markham 1988).Senyawa terpenoid, steroid, dan saponin termasuk senyawa yang dapat larut lemak, sehingga dapat terekstrak dengan pelarut non polar, seperti heksan. Saponin pun masih dapat ditemukan pada pelarut polar metanol (Cowan 1999).
Setelah diketahui hasil analisis ekstrak secara kualitatif, sampel ekstrak juga dianalisis secara kuantitatif dengan menganalisis kandungan total fenolnya dalam setiap ekstrak, sehingga dapat dihitung pula nilai total fenol buah dan hancuran buah takokak.
2.
Total Fenol dan Yield Ekstrak Buah Takokak
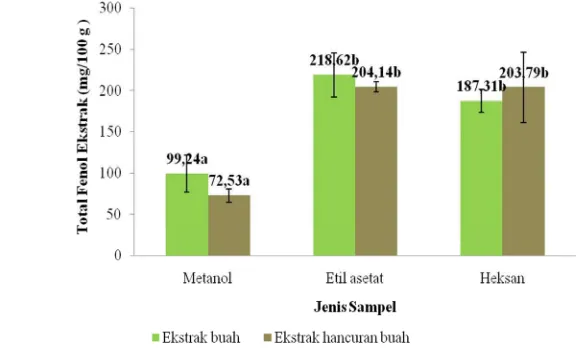
Total fenol ekstrak diperoleh dengan mereaksikan ekstrak sampel dari masing-masing pelarut (metanol, etil asetat, dan heksan) bersama senyawa folin. Senyawa fenol dapat bereaksi dengan gugus kromofor pada fenolik dan dapat diukur dengan spektrofotometer pada panjang gelombang 725 nm. Perhitungan total fenol ekstrak dengan membandingkan fenol pada kurva standar asam galat.
Persamaan garis dari kurva