PEMERIKSAAN ANGKA LEMPENG TOTAL DAN ANGKA KAPANG KHAMIR PADA SAUS CABAI YANG DIJUAL
DI PASAR BERSAMA KOTA MEDAN
TUGAS AKHIR
Oleh:
NIKITA ZAHRA LUBIS NIM 182410028
PROGRAM STUDI DIPLOMA III ANALIS FARMASI DAN MAKANAN
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
2021
iii
KATA PENGANTAR
Puji dan syukur kehadirat Allah SWT yang senantiasa melimpahkan rahmat dan karunia-Nya, serta Shalawat dan Salam kepada Nabi Muhammad SAW sehingga penulis dapat menyelesaikan Tugas Akhir yang berjudul “Pemeriksaan Angka Lempeng Total dan Angka Kapang Khamir pada Saus Cabai yang Dijual di Pasar Bersama Kota Medan”. Penulisan Tugas Akhir ini diajukan sebagai salah satu syarat untuk memperoleh gelar ahlimadya Analis Farmasi dan Makanan pada Fakultas Farmasi Universitas Sumatera Utara.
Salah satu parameter mutu saus cabai adalah angka lempeng total dan angka kapang khamir. Tujuan penelitian ini adalah untuk mengetahui apakah jumlah angka lempeng total dan angka kapang khamir yang terdapat pada saus cabai yang dijual di Pasar Bersama Kota Medan memenuhi syarat mutu saus cabai yang sesuai persyaratan yang ditetapkan dalam SNI 01-2976-2006. Ternyata bahwa saus cabai yang dijual di Pasar Bersama Kota Medan tidak memenuhi syarat mutu saus cabai.
Selama menyusun tugas akhir ini, penulis banyak mendapat bantuan dan bimbingan dari berbagai pihak, untuk itu penulis mengucapkan terima kasih yang sebesar-besarnya kepada:
1. Ibu Khairunnisa, S.Si., M.Pharm., Ph.D, Apt., selaku Dekan Fakultas Farmasi Universitas Sumatera Utara.
2. Bapak Popi Patilaya, S.Si., M.Sc., Apt., selaku Ketua Program Studi Diploma III Analis Farmasi dan Makanan Fakultas Farmasi Universitas Sumatera Utara.
3. Bapak Bayu Eko Prasetyo, S.Farm., M.Sc., Apt., selaku Dosen Pembimbing yang telah membimbing dan mengarahkan penulis dalam penyusunan tugas akhir ini.
4. Ibu Yuandani, M.Si., Ph.D., Apt., selaku Dosen Pembimbing Akademik yang telah memberikan arahan, nasihat dan bimbingan kepada penulis selama menempuh pendidikan di Program Studi Diploma III Analis Farmasi dan Makanan.
5. Bapak dan Ibu Dosen beserta seluruh staf di Fakultas Farmasi Universitas Sumatera Utara.
6. Ibu Rossi Evana, Ibu Nauba Pardede dan Ibu Rahmyuti yang telah membimbing dan memfasilitasi penulis dalam menjalankan penelitian dalam penyelesaian tugas akhir ini.
7. Teristimewa kepada keluarga, Ayahanda Ihsan Iskandar Lubis, SE dan Ibunda Dra. Wahida Rani, Tulang Muhammad Husin dan Nenek Hj. Maliani Lubis yang telah membesarkan dan mendidik penulis dengan penuh kasih sayang dan cinta dari kecil hingga saat ini, memberikan motivasi dan restu serta materi yang tidak ternilai harganya.
8. Abang Irwansyah Jul Nasution dan Yusril Arsjah Meidana Nasution, dan Adik Tasya Ishwara Lubis. M. Fachrurozy Hakim Lubis, Aan Kriswana Fasha dan M.
Irfan yang telah memberikan motivasi dan semangat untuk dapat menyelesaikan tugas akhir ini.
iv
9. Teman-teman mahasiswa dan mahasiswi Program Studi Diploma III Analis Farmasi dan Makanan 2018, yang telah banyak memberikan bantuan dan dukungan dalam penulisan tugas akhir ini.
Penulis menyadari bahwa tugas akhir ini jauh dari sempurna. Penulis mengharapkan kritik dan saran yang bersifat membangun. Semoga tugas akhir ini berguna bagi pembaca secara umum dan penulis khususnya. Akhir kata penulis mengucapkan terima kasih.
Medan, Agustus 2021 Penulis,
Nikita Zahra Lubis NIM 182410028
v
Pemeriksaan Angka Lempeng Total dan Angka Kapang Khamir pada Saus Cabai yang Dijual di Pasar Bersama Kota Medan
ABSTRAK
Latar Belakang : Saus cabai adalah saus yang diperoleh dari pengolahan cabai yang matang dan berkualitas baik dengan tambahan bahan-bahan lain yang digunakan sebagai bahan pembantu. Saus cabai diminati banyak masyarakat untuk dijadikan sebagai bahan penyedap makanan, namun standar nasional indonesia yang ada belum diversifikasi produk saus cabai yang beredar di pasaran maka perlu dilakukan pemeriksaan angka lempeng total dan angka kapang khamir untuk mengetahui kualitas dan keamanan saus cabai untuk dapat dikonsumsi masyarakat.
Tujuan : Penelitian ini bertujuan untuk mengetahui apakah jumlah angka lempeng total dan angka kapang khamir yang terdapat pada saus cabai yang dijual di Pasar Bersama Kota Medan memenuhi syarat mutu saus cabai yang sesuai persyaratan yang ditetapkan dalam SNI 01-2976-2006 tentang Saus Cabai.
Metode : Metode yang digunakan pada pemeriksaan angka lempeng total dan angka kapang khamir adalah metode hitungan cawan yang sesuai dengan prosedur Standar Nasional Indonesia 19-2897-1992 dan peralatan kerja yang digunakan di Balai Riset dan Standardisasi Industri Medan.
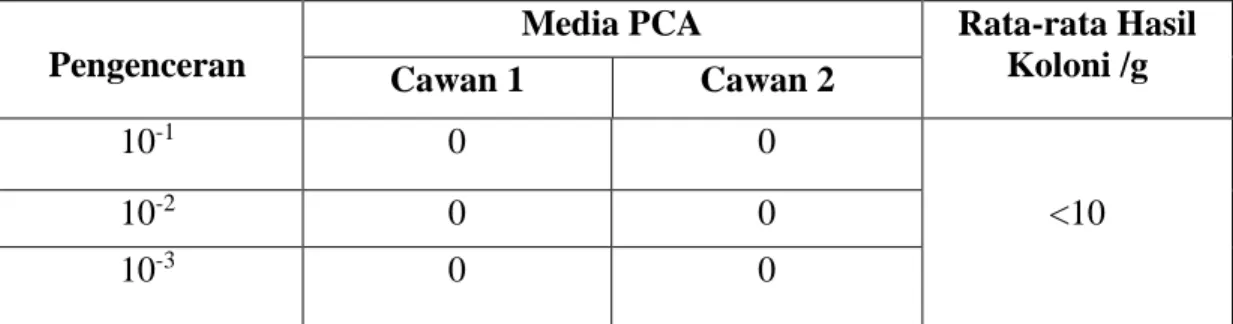
Hasil : Hasil penelitian menunjukkan bahwa saus cabai yang diperiksa mengandung
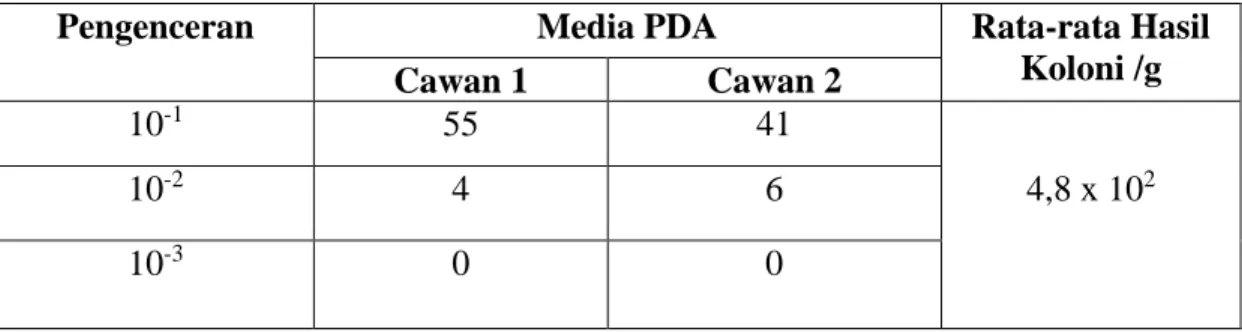
<10 koloni/g pada pemeriksaan angka lempeng total. Angka lempeng total ini belum melewati batas yang diperbolehkan menurut SNI 01-2976-2006 yaitu maksimal 1 x 104 koloni/g. Sedangkan hasil penelitian angka kapang khamir pada saus cabai yang diperiksa mengandung 4,8 x 102 koloni/g. Angka kapang khamir ini melewati batas yang diperbolehkan menurut SNI 01-2976-2006 yaitu maksimal 50 koloni/g.
Kesimpulan : Hasil uji yang diperoleh dapat disimpulkan bahwa angka lempeng total memenuhi persyaratan, namun angka kapang khamir tidak memenuhi persyaratan SNI 01-2976-2006.
Kata kunci : Saus Cabai, Angka Lempeng Total, Angka Kapang Khamir
vi DAFTAR ISI
HALAMAN PENGESAHAN TUGAS AKHIR ... i
SURAT PERNYATAAN ORISINALITAS ... ii
KATA PENGANTAR ... iii
ABSTRAK ... v
DAFTAR ISI ... vi
DAFTAR TABEL ... x
DAFTAR GAMBAR ... xi
DAFTAR LAMPIRAN ... xii
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Tujuan ... 3
1.3 Manfaat ... 3
BAB II TINJAUAN PUSTAKA ... 5
2.1 Saus Cabai ... 5
2.1.1 Bahan-Bahan Pembuatan Saus Cabai ... 6
2.1.2 Proses Pembuatan Saus Cabai ... 6
2.1.3 Syarat Mutu Saus Cabai ... 8
2.2 Bakteri ... 9
2.2.1 Morfologi Bakteri... 9
2.2.2 Struktur Sel Bakteri ... 11
2.3 Fungi ... 16
vii
2.4 Kapang ... 18
2.4.1 Morfologi Kapang ... 19
2.4.2 Sistem Reproduksi Kapang ... 19
2.4.3 Mikotoksin Kapang ... 20
2.5 Khamir ... 21
2.5.1 Morfologi Khamir ... 21
2.5.2 Sistem Reproduksi Khamir ... 22
2.5.3 Penggunaan Khamir dalam Kehidupan Sehari-hari ... 23
2.6 Media ... 23
2.6.1 Sterilisasi Media Pertumbuhan ... 24
2.7 Sterilisasi ... 25
2.7.1 Cara Pemanasan ... 26
2.7.2 Cara Kimiawi ... 29
2.7.3 Penggunaan Saringan ... 29
2.7.4 Pengeringan ... 30
2.7.5 Pembekuan ... 30
2.7.6 Sterilisasi dengan Sinar Matahari... 30
2.7.7 Radiasi ... 30
2.7.8 Energi Suara : Ultrasonik ... 31
2.8 Teknik Biakan Murni ... 31
2.8.1 Cara Pengenceran ... 31
2.8.2 Cara Penuangan ... 32
2.8.3 Cara Penggesekan/Penggoresan ... 33
viii
2.8.4 Cara Penyebaran (Agar Sebar) ... 34
2.8.5 Cara Pengucilan Satu Sel (single cell isolation) ... 35
2.8.6 Cara Inokulasi pada Hewan ... 35
2.9 Angka Lempeng Total... 36
2.10 Angka Kapang Khamir ... 37
2.11 Teknik dan Metode Hitungan Cawan ... 38
2.11.1 Metode Tuang/Penuangan (Pour Plate)... 39
2.11.2 Metode Sebar/Permukaan (surface spread plate) ... 42
BAB III METODE PENELITIAN... 43
3.1 Tempat Penelitian... 43
3.2 Alat ... 43
3.3 Sampel ... 43
3.4 Bahan... 44
3.5 Prosedur Kerja ... 44
3.5.1 Uji Angka Lempeng Total (SNI 19-2897-1992) ... 44
3.5.1.1 Pembuatan Media ... 44
3.5.1.2 Cara Kerja Uji Angka Lempeng Total ... 45
3.5.2 Uji Angka Kapang Khamir (SNI 19-2897-1992)... 45
3.5.2.1 Pembuatan Media ... 45
3.5.2.2 Cara Kerja Uji Angka Kapang Khamir ... 46
3.6 Rumus Perhitungan Data (SNI 2332.3:2015) ... 47
BAB IV HASIL DAN PEMBAHASAN ... 48
4.1 Hasil Pengujian Angka Lempeng Total pada Saus Cabai ... 48
ix
4.2 Hasil Pengujian Angka Kapang Khamir pada Saus Cabai... 49
BAB V KESIMPULAN DAN SARAN ... 54
5.1 Kesimpulan ... 54
5.2 Saran ... 54
DAFTAR PUSTAKA ... 55
x
DAFTAR TABEL
Tabel
2.1 Syarat Mutu Saus Cabai ... 8 4.1 Hasil Pengujian Angka Lempeng Total pada Saus Cabai ... 48 4.2 Hasil Pengujian Angka Kapang Khamir pada Saus Cabai... 49
xi
DAFTAR GAMBAR
Gambar
2.1 Berbagai Morfologi Bakteri ... 10
2.2 Berbagai Tempat Kedudukan Flagel ... 11
2.3 Struktur Spora Bakteri... 16
2.4 Berbagai Bentuk Sel Khamir ... 22
2.5 Teknik Penggesekan... 34
xii
DAFTAR LAMPIRAN
Lampiran
1. Alat-alat yang Digunakan ... 57
2. Bahan-bahan yang Digunakan ... 59
3. Preparasi Sampel Saus Cabai ... 61
4. Hasil Pengujian Angka Lempeng Total pada Sampel Saus Cabai ... 62
5. Hasil Pengujian Angka Kapang Khamir pada Sampel Saus Cabai... 63
6. Syarat Mutu Saus Cabai (SNI 01-2976-2006) ... 64
7. Rumus Perhitungan Koloni pada Cawan Petri (SNI 2332.3:2015)... 65
8. Perhitungan Uji Angka Kapang Khamir ... 66
1 BAB I PENDAHULUAN 1.1 Latar Belakang
Cabai merupakan salah satu komoditas pertanian yang penting dan banyak dibudidayakan di Indonesia. Cabai memiliki aroma, rasa, dan warna yang spesifik, sehingga banyak digunakan oleh masyarakat sebagai rempah dan bumbu masakan.
Seiring dengan bertambahnya penduduk, kebutuhan cabai di Indonesia pun semakin meningkat (Suherman dkk., 2018).
Salah satu produk olahan cabai yang akhir-akhir ini semakin memasyarakat adalah saus cabai. Hal ini disebabkan karena semakin berkembangnya jenis makanan yang membutuhkan saus cabai sebagai penyedap seperti mie bakso, mie ayam, ayam goreng, dan jenis makanan lainnya, dan ini sudah berkembang sampai kepelosok pedesaan (Asni dan Novalinda, 2012).
Saus cabai adalah saus yang diperoleh dari pengolahan cabai yang matang dan berkualitas baik dengan tambahan bahan-bahan lain yang digunakan sebagai bahan pembantu. Bahan-bahan tambahan yang digunakan sangat bervariasi, tetapi yang umum ditambahkan ialah garam, gula, bawang putih, dan bahan pengental (pati jagung atau maizena dapat juga tapioka). Pati digunakan sebagai bahan pengikat dan memberikan penampakan yang mengkilap. Rasa dan mutu saus cabai sangat tergantung mutu dan varietas cabai yang digunakan sebagai bahan baku utamanya. Jenis cabai yang digunakan dalam pembuatan saus cabai antara lain jatilaba, tit super dan tit paris (Koswara, 2009).
2
Jumlah mikroba dapat ditentukan dengan cara menghitung jumlah sel-sel atau kumpulan (masa) sel. Penentuan jumlah mikroba dengan cara menghitung jumlah sel mikroba terutama sangat berguna dalam menghitung organisme bersel tunggal seperti bakteri dan khamir. Penentuan atas dasar jumlah masa (koloni-koloni) sel dapat digunakan untuk seluruh jenis mikroba, termasuk jenis yang berfilamen panjang (seperti kapang) yang tidak dapat ditentukan jumlahnya dengan cara menghitung jumlah sel (Muhardianti, 2017).
Metode yang digunakan dalam penentuan jumlah mikroba adalah metode angka lempeng total dan angka kapang khamir. Metode ini didasarkan pada metode hitungan cawan, dimana metode ini didasarkan pada anggapan bahwa setiap sel yang dapat hidup akan berkembang menjadi suatu koloni. Jumlah koloni yang muncul pada cawan merupakan suatu indeks jumlah mikroba yang hidup terkandung dalam sampel. Hal yang perlu dikuasai dalam hal ini adalah teknik pengenceran. Setelah inkubasi, jumlah koloni masing-masing cawan diamati. Untuk memenuhi persyaratan tersebut harus melakukan sederetan pengenceran dan pencawanan. Jumlah mikroba dalam sampel ditentukan dengan mengalikan jumlah koloni dengan faktor pengenceran pada cawan yang bersangkutan (Waluyo, 2010).
Penelitian yang dilakukan oleh Monica dkk. (2013) dalam jurnalnya yang berjudul “Uji Mikrobiologis Beberapa Produk Saos Cabai Kiloan Produksi Lokal yang beredar di Beberapa Pasar Kota Padang”, mengatakan bahwa pengujian dilakukan hanya untuk menentukan bakteri coliform dan jenis kapang khamir yang terdapat di dalam saus cabai yang beredar di beberapa Pasar Kota Padang. Hasil penelitian yang
3
dilakukan oleh Monica dkk., didapatkan 2 sampel yang mengandung coliform serta terdapat 5 jenis kapang khamir pada 4 sampel saus cabai tersebut.
Berdasarkan hal tersebut diatas maka penulis tertarik untuk menguji angka lempeng total dan angka kapang khamir pada saus cabai yang dijual di Pasar Bersama Kota Medan. Adapun penelitian dilakukan di Balai Riset Standardisasi Industri Medan.
Metode angka lempeng total dan angka kapang khamir dipilih karena keduanya termasuk ke dalam parameter uji cemaran mikroba dalam pangan yang telah ditetapkan oleh Standar Nasional Indonesia (SNI).
1.2 Tujuan
Tujuan dari penelitian ini adalah :
a. Untuk mengetahui apakah jumlah angka lempeng total yang terdapat pada saus cabai yang dijual di Pasar Bersama Kota Medan memenuhi syarat mutu saus cabai yang sesuai persyaratan yang ditetapkan dalam SNI 01-2976-2006.
b. Untuk mengetahui apakah jumlah angka kapang khamir yang terdapat pada saus cabai yang dijual di Pasar Bersama Kota Medan memenuhi syarat mutu saus cabai yang sesuai persyaratan yang ditetapkan dalam SNI 01-2976-2006.
c. Untuk mengetahui apakah kedua parameter yang diteliti memenuhi syarat mutu saus cabai yang sesuai persyaratan yang ditetapkan dalam SNI 01-2976- 2006.
1.3 Manfaat
Penelitian ini diharapkan dapat memberikan informasi mengenai cemaran mikroba dalam pangan dengan menggunakan parameter angka lempeng total dan
4
angka kapang khamir pada saus cabai yang dijual di Pasar Bersama Kota Medan apakah memenuhi syarat mutu saus cabai yang sesuai persyaratan SNI 01-2976-2006.
5 BAB II
TINJAUAN PUSTAKA 2.1 Saus Cabai
Saus adalah cairan kental (pasta) yang terbuat dari bubur buah berwarna menarik (biasanya merah), mempunyai aroma dan rasa yang merangsang (asam dengan tanpa rasa pedas). Walaupun mengandung air dalam jumlah besar, saus mempunyai daya simpan panjang karena mengandung asam, gula, garam dan seringkali diberi pengawet (Koswara, 2009).
Sambal telah lama dikenal sebagai penggugah dan penambah selera makan.
Sejalan dengan kemajuan zaman, sambal sekarang tidak hanya dibuat di rumah tangga dengan alat sederhana berupa cobet dan mutu, tetapi juga telah tersedia dalam bentuk sambal yang sudah jadi keluaran pabrik (Koswara, 2009).
Saus cabai adalah saus yang diperoleh dari pengolahan cabe yang matang dan berkualitas baik dengan tambahan bahan-bahan lain yang digunakan sebagai bahan pembantu. Rasa dan mutu saus cabe sangat tergantung mutu dan varietas cabe yang digunakan sebagai bahan baku utamanya. Jenis cabe yang digunakan dalam pembuatan saus cabe antara lain jatilaba, til super dan til paris. Cabe jatilaba adalah cabe lokal Indonesia yang berwarna merah agak gelap, lurus, berkerut-kerut, tahan pecah dan ujungnya runcing. Tit paris dan tit super mempunyai ciri yang sama yaitu berwarna merah menyala, ujungnya runcing dan agak bengkok (Koswara, 2009).
6 2.1.1 Bahan-Bahan Pembuatan Saus Cabai
Bahan yang digunakan dalam pembuatan saus cabai antara lain cabai merah segar yang merupakan bahan terbanyak yang digunakan, bawang putih, garam, tomat, gula, asam cuka, tepung maizena, air dan natrium benzoat sebagai bahan pengawet.
Misalnya untuk 1,5 kg cabai merah yang digunakan, diperlukan sekitar 0,5 kg bawang putih, 70 g garam, 0,5 kg tomat, 60 g gula, sekitar 40 ml asam cuka, 50 g tepung maizena, 200 ml air dan 2 g natrium benzoat (Koswara, 2009).
2.1.2 Proses Pembuatan Saus Cabai A. Persiapan Bahan
Untuk menghasilkan saus cabai berkualitas tentu diawali dengan pemilihan bahan yang berkualitas pula. Cabai segar merupakan bahan baku utama untuk pembuatan saus cabai. Cabai segar yang digunakan adalah cabai yang matang dan merah merata, masih dalam keadaan segar, tidak busuk, tidak cacat atau rusak dan bebas hama penyakit.
Menurut Deptan (2009) kondisi matang penuh dan berstruktur bagus diperlukan agar saus cabai yang dihasilkan mempunyai aroma yang kuat dan tekstur yang baik.
Penggunaan cabai yang belum matang (masih berwarna hijau) akan menghasilkan saus cabai yang berwarna kecokelatan. Syarat mutu cabai mengacu pada SNI 01-4480-1998 (Asni dan Novalinda, 2012).
B. Proses Pengolahan
Sortasi (pemilihan) dilakukan untuk memilih cabai merah yang baik, yaitu tingkat kemasakan yang optimal diatas 60%, sehat dan fisiknya mulus (tidak cacat dan tidak busuk). Pemilihan dilakukan untuk memilih cabai merah yang benar-benar bagus
7
fisiknya, besar, berwarna merah segar, sehat dan mulus (tidak cacat). Jika cacat atau busuk, cabai akan menghasilkan saus cabai yang berwarna suram, untuk itu diperlukan cabai yang cukup masak agar nantinya menjadi saus cabai yang berwarna merah cerah (Asni dan Novalinda, 2012).
Setelah pemilihan cabai dibuang tangkainya dan setelah itu dicuci bersih.
Pencucian bertujuan untuk menghilangkan kotoran dan sisa-sisa pestisida yang masih ada, dan kemudian ditiriskan sampai kering. Kemudian dikukus pada suhu sekitar 70- 80 °C selama 3-5 menit, dan digiling sampai halus dengan blender. Masukkan bahan pengikat tepung maizena yang sudah dilarutkan dalam air dengan perbandingan maizena : air = 1 : 3. Bahan tersebut dicampurkan secara merata dengan cabai yang sudah digiling sehingga membentuk bubur cabai (Asni dan Novalinda, 2012).
Bubur cabai dipanaskan dan ditambahkan bumbu yang dihaluskan (bawang putih, garam, merica, dan gula), aduk sambil dipanaskan dengan api sedang sampai mendidih dan mencapai kekentalan yang dikehendaki (Asni dan Novalinda, 2012).
C. Proses Pengemasan
Tahap proses lain yang menentukan untuk menjaga kualitas produk adalah tahapan pembotolan/pengemasan. Botol yang dipergunakan sebelumnya sudah dibersihkan dan disterilkan. Sterilisasi dilakukan dengan merebus botol dan tutupnya dalam air mendidih selama 1 jam. Botol dalam keadaan panas masukkan saus cabai.
Mulut botol segera ditutup, untuk menghindari terjadinya kontaminasi didalam produk.
Kemudian disterilisasi lagi dalam air mendidih selama 30 menit. Angkat dan biarkan botol dalam keadaan terbalik selama 5-15 menit. Pembalikan botol pada akhir proses
8
harus dilihat, jangan sampai ada gelembung udara, agar nantinya saus yang dihasilkan tidak ditumbuhi jamur (kapang) (Asni dan Novalinda, 2012).
2.1.3 Syarat Mutu Saus Cabai
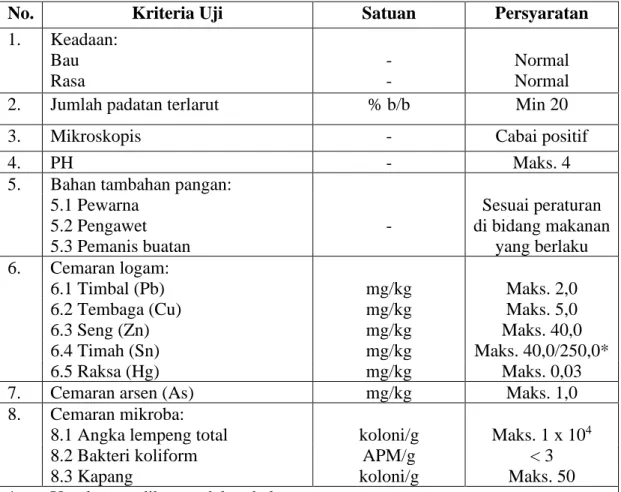
Syarat mutu saus cabai menurut SNI 01-2976-2006 meliputi nilai gizi, keamanan mikroba dan cemaran logam dapat dilihat pada tabel 2.1 dibawah ini:
Tabel 2.1 Syarat Mutu Saus Cabai
No. Kriteria Uji Satuan Persyaratan
1. Keadaan:
Bau Rasa
- -
Normal Normal
2. Jumlah padatan terlarut % b/b Min 20
3. Mikroskopis - Cabai positif
4. PH - Maks. 4
5. Bahan tambahan pangan:
5.1 Pewarna 5.2 Pengawet 5.3 Pemanis buatan
-
Sesuai peraturan di bidang makanan
yang berlaku 6. Cemaran logam:
6.1 Timbal (Pb) mg/kg Maks. 2,0
6.2 Tembaga (Cu) mg/kg Maks. 5,0
6.3 Seng (Zn) mg/kg Maks. 40,0
6.4 Timah (Sn) mg/kg Maks. 40,0/250,0*
6.5 Raksa (Hg) mg/kg Maks. 0,03
7. Cemaran arsen (As) mg/kg Maks. 1,0
8. Cemaran mikroba:
8.1 Angka lempeng total koloni/g Maks. 1 x 104
8.2 Bakteri koliform APM/g < 3
8.3 Kapang koloni/g Maks. 50
* Untuk yang dikemas dalam kaleng
(BSN, 2006).
9 2.2 Bakteri
Mikroorganisme ini, pertama kali ditemukan oleh Leeuwenhoek, adalah salah satu bentuk kehidupan yang paling tersebar luas. Lebih dari 1.700 spesies yang diketahui saat ini, ditemukan di udara, air, lapisan atas tanah, bagian dalam dan luar tubuh manusia, dan di bagian bawah hewan dan tumbuhan. Singkatnya, mikroorganisme ini ada di mana-mana. Bakteri hampir sepenuhnya bergantung pada lingkungannya. Suhu, keasaman (pH) ketersediaan nutrisi yang sesuai, dan keberadaan zat beracun sangat mempengaruhi kelangsungan hidup mikroorganisme ini dan lainnya (Wistreich dan Lechtman, 1973).
Nama bakteri berasal dari bahasa Yunani “bacterion” yang berarti batang atau tongkat. Sekarang nama itu dipakai untuk menyebut sekelompok mikroorganisme bersel satu, tubuhnya bersifat prokariotik, yaiu tubuhnya terdiri atas sel yang tidak mempunyai pembungkus inti. Bakteri berkembang biak dengan membelah diri, dan karena begitu kecil maka hanya dapat dilihat dengan menggunakan mikroskop. Bakteri walaupun bersel satu tetapi mempunyai beberapa organel yang dapat untuk melaksanakan beberapa fungsi hidup (Waluyo, 2007).
2.2.1 Morfologi Bakteri A. Ukuran Bakteri
Pada umumnya ukuran tubuh bakteri sangat kecil, umumnya bentuk tubuh bakteri baru dapat dilihat dengan menggunakan mikroskop dengan pembesaran 1.000 X atau lebih. Satuan ukuran tubuh bakteri adalah mikrometer atau mikron. Satu mikron
10
sama dengan 1/1.000 milimeter. Lebar tubuh umumnya antara 1 sampai 2 mikron, sedang panjangnya antara 2 sampai 5 mikron (Waluyo, 2007).
B. Bentuk Bakteri
Secara garis besar tubuh (morfologi) bakteri dapat dikelompokkan ke dalam 3 golongan, yaitu :
A. Basil (bacillus)
Basil dari bacillus, merupakan bakteri yang mempunyai bentuk tongkat pendek/batang kecil dan silindris. Sebagian bakteri berbentuk basil. Basil dapat bergandeng-gandengan panjang, bergandengan dua-dua, atau terlepas satu sama lain.
B. Kokus (coccus)
Kokus adalah bakteri yang mempunyai bentuk bulat seperti bola-bola kecil.
Kelompok ini ada yang bergerombol dan bergandeng-gandengan membentuk koloni.
C. Spiril (spirillum)
Spiril merupakan bakteri yang berbentuk bengkok atau berbengkok-bengkok seperti spiral. Golongan ini merupakan golongan yang paling kecil jika dibandingkan dengan golongan basil dan golongan kokus(Waluyo, 2007).
Gambar 2.1 Berbagai Morfologi Bakteri (Waluyo, 2007).
11 2.2.2 Struktur Sel Bakteri
Sel pada mikrobe juga mempunyai ciri-ciri morfologis dan anatomi yang unik dibandingkan dengan sel jasad hidup lainnya. Sehingga bila membicarakan sifat dan kehidupan sel mikrobe harus merupakan satu kesatuan yang tidak terpisahkan. Pada umumnya para ahli menggolongkan struktur sel bakteri menjadi dinding luar, sitoplasma, dan bahan inti.
A. Struktur Luar
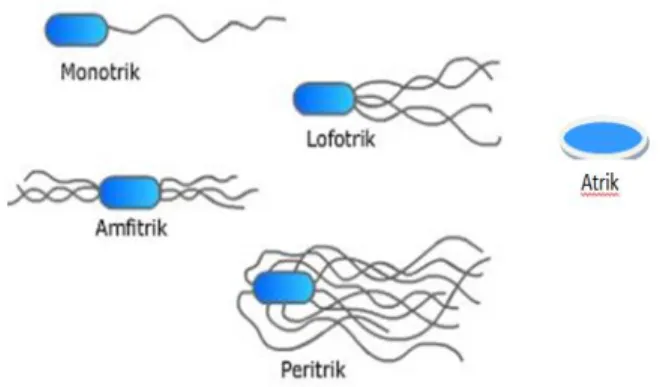
A. Flagel atau Bulu Cambuk
Bakteri dapat bergerak kemana-mana dengan menggunakan flagel (dari kata flagellum, yang berarti bulu cambuk). Pada umumnya lebar (diameter) flagel kurang dari 0,1 μ, dan hanya dapat dilihat dengan mikroskop elektron atau dengan suatu pewarnaan yang khusus. Mikroskop elektron menunjukkan, bahwa flagel itu merupakan benang-benang protoplasma yang berpangkal pada titik tepat di bawah membran sel; pangkal tersebut dinamakan rizoblast. Flagel terdiri dari protein yang disebut flagellin, yakni semacam miosin (Waluyo, 2007).
Gambar 2.2 Berbagai Tempat Kedudukan Flagel (Waluyo, 2007).
12 B. Pili atau Fimbriae
Pili merupakan benang-benang halus yang keluar atau menonjol dari dinding sel, dan hanya diketemukan pada bakteri berbentuk batang bersifat Gram negatif.
Benang-benang halus tidak berlekuk-lekuk dan lebih halus daripada flagel. Benang- benang disebut pili (pilus = rambut), dan jumlahnya ratusan (Waluyo, 2007).
C. Kapsula atau Lapisan Lendir
Lapisan lendir menyelubungi dinding sel seluruh bakteri. Bila lapisan lendir cukup tebal maka bungkus itu disebut kapsula. Lapisan lendir terdiri atas karbohidrat.
Lendir ini bukan suatu bagian integral dari sel melainkan hasil pertukaran zat. Kapsula berfungsi untuk melindungi sel terhadap kehadiran faktor luar yang tidak menguntungkan, sedangkan bagi manusia digunakan untuk mengenal spesies yang berguna untuk identifikasi (Waluyo, 2007).
D. Dinding Sel
Berfungsi memberikan bentuk tertentu pada bakteri, untuk mengatur keluar masuknya zat kimia, serta memegang peranan dalam pembelahan sel. Dinding sel bakteri sangat tipis, sifatnya elastis, terletak diantara kapsula dan membran sitoplasma dengan susunan kimia kompleks. Dinding sel bakteri, terdiri dari berbagai macam bahan organik seperti selulosa, hemiselulosa, dan khitin (yaitu karbohidrat yang mengandung unsur N), hal ini tergantung spesies bakteri (Waluyo, 2007).
13 B. Susunan Dalam Sel Bakteri
A. Membran Sitoplasma
Bagian ini merupakan bungkus dari sitoplasma, terletak di bagian bawah dinding sel tetapi tidak terikat. Nama lain membran sitoplasma adalah plasmolema atau lapisan hialin. Membran sitoplasma tersusun oleh senyawa protein, lipida, serta asam nukleat. Membran sitoplasma yang terdiri dari protein ini mudah sekali menghisap warna yang bersifat alkalis. Sifat selektif membran ini diperlukan sebagai mekanisme pengangkutan nutrien dan sisa metabolisme, yang dilakukan dengan bantuan enzim permease (Waluyo, 2007).
B. Protoplasma
Protoplasma merupakan isi sel yang disebut juga sitoplasma atau plasma sel.
Protoplasma merupakan koloid yang mengandung karbohidrat, protein, enzim, belerang, kalsium karbonat, dan volutin yaitu suatu zat yang banyak mengandung asam ribonukleat (ARN) dan yang mudah menghisap zat warna tertentu, yang bersifat basa (Waluyo, 2007).
C. Inti atau Nukleus
Nukleus merupakan lokasi utama bahan genetik, dan berfungsi sebagai pusat pengendalian sel. Bakteri mempunyai inti yang terdiri atas AND (asam deoksiribonukleat) atau DNA (deoxribonucleic acid) dan ARN (asam ribonukleat) atau RNA (ribonucleic acid). Inti dari bakteri tidak mempunyai membran atau selaput inti.
Inti yang tidak bermembran inilah yang dinamakan prokarion, sedangkan inti yang bermembran disebut eukarion (Waluyo, 2007).
14 D. Organel-Organel yang Lain
Organel adalah struktur-struktur yang terbatasi oleh membran di dalam sitoplasma (organel artinya organ kecil) yang melakukan fungsi-fungsi khusus di dalam sel. Bakteri tidak mempunyai organel nucleolus (anak inti), tidak mempunyai retikulum endoplasma, tidak mempunyai mitokondria, dan tidak mempunyai tubuh- tubuh golgi, seperti lazimnya sel-sel makhluk berderajat tinggi. Pada bakteri Gram positif terdapat lipatan-lipatan plasmolema yang disebut mesosom; inilah yang disangka berfungsi sebagai mitokondria. Banyak spesies bakteri-bakteri yang mempunyai struktur-struktur kecil yang terdiri dari ADN. Satuan kecil ini disebut plasmid.
Substansi lain yang ditemukan di daerah sitoplasma pada bakteri, sebagai sel prokariotik adalah:
a. Ribosom, yakni partikel kecil yang terdiri dari protein dan ARN yang berfungsi dalam sintesis protein baru.
b.Badan Inklusi. Secara umum, kepingan-kepingan kecil material yang tidak menjadi bagian utuh dari struktur sel dinamakan inklusi sel. Kepingan ini berupa butiran glikogen, tetesan asam polihidroksibutirat, metafosfat anorganik, belerang, atau senyawa yang mengandung nitrogen (Waluyo, 2007).
C. Spora Bakteri
Istilah spora biasanya dipakai untuk menyebut alat perkembangbiakan pada jamur, ganggang, lumut, dan tumbuhan paku-pakuan. Pada bakteri mempunyai istilah yang lain, yaitu bentuk bakteri yang sedang dalam usaha melindungi (mengamankan) diri
15
dari pengaruh yang buruk dari luar. Spora bakteri mempunyai fungsi yang sama seperti kista amoeba, sebab spora ini merupakan suatu fase, dimana mikroorganisme berubah bentuk untuk melindungi diri terhadap faktor-faktor luar yang tidak menguntungkan (Waluyo, 2007).
Menurut Knaysi, proses sporulasi (pembentukan atau terjadinya spora) dibagi menjadi 4 tahap, yakni:
- Tahap permulaan, dimana koloni menunjukkan pertumbuhan yang sangat lambat.
- Selama beberapa jam kelihatan adanya bahan-bahan lipoprotein yang mengumpul ke salah satu ujung sel, sehingga ujung itu tampak memadat.
- Timbul bungkus yang menyelubungi calon spora. Selubung terdiri dari 2 lapis, yakni kulit luar (eksin) dan kulit dalam (intin). Pada beberapa spesies, intin menjadi dinding sel, bila spora melanjutkan pertumbuhan menjadi bakteri biasa. Dinding spora bersifat impermeable terhadap zat-zat yang dapat mengganggu kehidupan bakteri.
- Pada tahap yang terakhir, maka spora tampak berubah bentuk dan volume. Endospora dapat tetap tinggal di salah satu ujung atau di tengah-tengah sel. Sel dapat pecah karena perkembangan endospora. Pecahan ini kemudian luluh menjadi satu dengan medium (Waluyo, 2007).
Bakteri dalam bentuk spora lebih tahan terhadap disinfektan, sinar, dan terutama terhadap kekeringan, panas, dan kedinginan. Hal ini karena dinding spora lebih bersifat impermeable dan spora mengandung sangat sedikit air, sehingga keadaan ini menyebabkan spora tidak mudah mengalami perubahan temperatur (Waluyo, 2007).
16
Gambar 2.3 Struktur Spora Bakteri (Waluyo, 2007).
2.3 Fungi
Diantara tumbuhan rendah, maka golongan ganggang (alga) dan golongan fungi merupakan kelanjutan dari golongan bakteri. Peninjauan secara morfologi dan fisiologi menemukan suatu golongan bakteri, yaitu ordo Chlamydobacteriales, yang dapat dipandang sebagai pangkal pertumbuhan golongan ganggang. Hal ini dapat diketahui dari sifat-sifat mengenai adanya lapisan lendir yang menyelubungi tubuh organisme tersebut, akan tetapi perkembangbiakannya dengan menggunakan konidia dan hal ini lebih mendekati sifat-sifat fungi (Waluyo, 2007).
Meskipun fungi adalah kelompok besar dan agak beragam, hanya tiga jenis fungi yang secara praktis penting, dan ini relatif mudah untuk diidentifikasi. Ketiganya adalah jamur, ragi, dan jamur. Fungi dapat dibedakan dari alga karena jamur tidak memiliki klorofil sehingga tidak berwarna hijau. Fungi dapat dibedakan dari bakteri dengan fakta bahwa sel jamur jauh lebih besar, dan vakuola, nukleus, dan organel intraseluer lainnya biasanya dapat dilihat di dalam, bahkan dengan mikroskop cahaya biasa (Brock, 1978).
17
Kebanyakan fungi dapat bereproduksi secara aseksual dan seksual. Faktor-faktor seperti susunan genetik, ketersediaan sel yang matang secara seksual dalam jumlah yang cukup, dan berbagai faktor lingkungan menentukan apakah reproduksi seksual akan berlangsung. Namun, organisme seperti yang dikelompokkan ke dalam Deuteromyces atau Fungi Imperfecti hanya bereproduksi secara aseksual. Spora adalah unit reproduksi dasar untuk fungi dan terdiri dari dua jenis seksual dan aseksual (Wistreich dan Lechtman, 1973).
Fungi tingkat tinggi maupun tingkat rendah mempunyai ciri yang khas, yakni berupa benang tunggal atau bercabang-cabang yang disebut dengan hifa. Kumpulan dari hifa-hifa akan membentuk miselium. Fungi merupakan organisme eukariotik yang mempunyai ciri-ciri sebagai berikut: (1) Mempunyai spora, (2) Memproduksi spora, (3) Tidak mempunyai klorofil sehingga tidak berfotosintesis, (4) Dapat berkembang biak secara seksual dan aseksual, (5) Tubuh berfilamen dan dinding sel mengandung kitin, glukan, selulosa, dan manan (Waluyo, 2007).
Fungi dibedakan menjadi dua golongan yakni: kapang dan khamir. Kapang merupakan fungi yang berfilamen atau mempunyai miselium, sedangkan khamir merupakan fungi bersel tunggal dan tak berfilamen. Fungi merupakan organisme menyerupai tanaman, tetapi mempunyai beberapa perbedaan, yakni:
a. Tidak mempunyai klorofil.
b. Mempunyai dinding sel dengan komposisi berbeda.
c. Berkembang biak dengan spora.
d. Tidak mempunyai batang, cabang, akar, dan daun.
18
e. Tidak mempunyai sistem vaskuler seperti pada tanaman.
f. Bersifat multiseluler tidak mempunyai pembagian fungsi masing-masing bagian seperti pada tanaman (Waluyo, 2007).
Fungi ada yang bersifat parasit dan ada pula yang bersifat saprofit. Parasit apabila dalam memenuhi kebutuhan makannya dengan mengambil dari benda hidup yang ditumpanginya, sedangkan bersifat saprofit apabila memperoleh makanan dari benda mati dan tidak merugikan benda itu sendiri. Fungi dapat mensintesis protein dengan mengambil sumber karbon dari karbohidrat (misalnya glukosa, sukrosa, atau maltosa), sumber nitrogen dari bahan organik atau anorganik, dan mineral dari substratnya. Ada juga beberapa fungi yang dapat mensintesis vitamin-vitamin yang dibutuhkan untuk pertumbuhan dan perkembangbiakan sendiri, tetapi ada juga yang tidak dapat mensintesis sendiri sehingga harus mendapatkan dari substrat, misalkan thiamin dan biotin (Waluyo, 2007).
2.4 Kapang
Tergantung pada spesies jamur, filamen kapang dapat dibagi menjadi rantai sel oleh dinding melintang-melintang yang disebut septa (tunggal, septum); hifa yang menunjukkan pembagian seperti itu dikenal sebagai septate. Pada spesies yang hifa nonseptate, isi hifa dapat melewati filamen dengan bebas. Gerakan bebas ini disebut keadaan coenocytic, dan merupakan ciri khas Zygomycetes (Wistreich dan Lechtman, 1973).
19
Ketika kapang terus tumbuh pada substrat yang sesuai, baik alami (roti dan buah) atau buatan (media laboratorium), cabang hifa, bercampur, dan sering bergabung untuk akhirnya membentuk agregasi yang terlihat dari struktur ini yang disebut miselium, analog dengan koloni bakteri. Munculnya massa hifa ini umumnya kering dan berbentuk tepung. Ini seringkali merupakan hasil dari sporulasi, pembentukan berbagai jenis spora (Wistreich dan Lechtman, 1973).
2.4.1 Morfologi Kapang
Fungi multiseluler atau kapang mempunyai miselium atau filamen, dan pertumbuhannya dalam bahan makanan mudah sekali dilihat, yakni seperti kapas.
Pertumbuhan fungi mula-mula berwarna putih, tetapi bila telah memproduksi spora maka akan terbentuk berbagai warna tergantung dari jenis kapang. Sifat-sifat kapang baik penampakan mikroskopik ataupun makroskopik digunakan untuk identifikasi dan klasifikasi kapang (Waluyo, 2007).
Kapang dapat dibedakan menjadi dua kelompok berdasarkan struktur hifa, yaitu hifa tidak bersekat atau nonseptat dan hifa bersekat atau septat yang membagi hifa dalam mangan-mangan, dimana setiap mangan mempunyai inti (nukleus) satu atau lebih. Dinding penyekat pada kapang disebut dengan septum yang tidak tertutup rapat sehingga sitoplasma masih dapat bebas bergerak dari satu ruang ke ruang yang lainnya (Waluyo, 2007).
2.4.2 Sistem Reproduksi Kapang
Secara alamiah kapang berkembang biak dengan berbagai cara, baik aseksual dengan pembelahan, penguncupan, atau pembentukan spora, dapat pula secara seksual
20
dengan peleburan nukleus dari ke dua induknya. Pada pembelahan, suatu sel membagi diri untuk membentuk dua sel anak yang serupa. Pada penguncupan, suatu sel anak tumbuh dari penonjolan kecil pada sel inang (Waluyo, 2007).
Perkembangbiakan secara generatif atau seksual dilakukan dengan isogamet atau heterogamete. Pada beberapa spesies perbedaan morfologi antara jenis kelamin belum nampak sehingga semua disebut isogamet. Tapi pada beberapa spesies mempunyai perbedaan gamet besar dan kecil sehingga disebut mikrogamet (sel kelamin jantan) dan makrogamet (sel kelamin betina). Dalam kondisi serta optimum, maka jamur akan berkembang biak dengan cepat, tetapi apabila dalam keadaan kering maka tidak akan dapat berkembang sehingga kekeringanlah sebagai faktor pembatas pertumbuhan (Waluyo, 2007).
Spora seksual dan aseksual dikelilingi oleh suatu pelindung yang disebut tubuh buah. Tubuh buah aseksual antara lain, aservulus dan piknidium. Sedangkan tubuh buah seksual yang umum yakni peritesium dan apotesium (Waluyo, 2007).
2.4.3 Mikotoksin Kapang
Seperti halnya bakteri, fungi juga menimbulkan penyakit yang dibedakan menjadi dua golongan, yakni: 1. Mikosis, infeksi kapang, dan 2. Mikotoksikosis yaitu gejala keracunan yang disebabkan tertelannya suatu hasil metabolisme beracun dari kapang atau jamur. Dari kedua golongan tersebut umumnya disebarkan melalui makanan pada mikotoksikosis, sedangkan mikosis merupakan infeksi yang menyerang kulit, rambut, kuku, dan sebagainya (Waluyo, 2007).
21
Senyawa racun yang diproduksi oleh fungi disebut mikotoksin. Toksin ini dapat menimbulkan gejala sakit yang kadang-kadang fatal dan beberapa diantaranya mempunyai sifat karsinogenik, yakni dapat menimbulkan kanker (Waluyo, 2007).
2.5 Khamir
Khamir termasuk cendawan, tetapi berbeda dengan kapang karena bentuknya yang terutama uniseluler. Reproduksi vegetatif terjadi dengan cara pertunasan. Sebagai sel tunggal khamir tumbuh dan berkembang biak lebih cepat dibanding kapang yang tumbuh dengan pembentukan filamen. Khamir juga lebih efektif dalam memecah komponen kimia dibanding kapang, karena mempunyai perbandingan luas permukaan dengan volume yang lebih besar. Khamir lebih besar ukurannya dan morfologinya berbeda dengan bakteri (Waluyo, 2007).
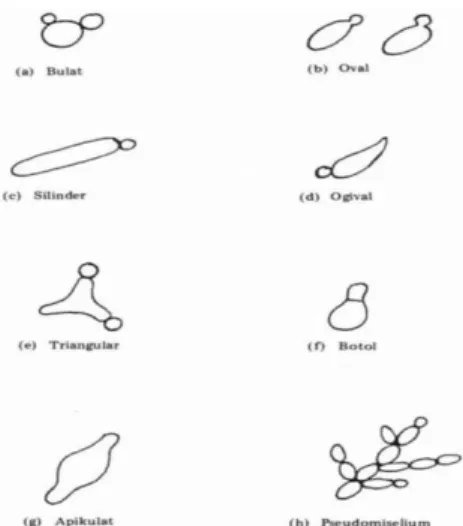
2.5.1 Morfologi Khamir
Sel khamir mempunyai ukuran yang bervariasi, yaitu dengan panjang 1-5 mm sampai 20-50 mm, dan lebar 1-10 mm. Bentuk khamir bermacam-macam, yaitu bulat, oval, silinder, ogival yaitu bulat panjang dengan salah satu ujung runcing, segitiga melengkung (triangular), berbentuk botol, bentuk apilukat atau lemon, membentuk pseudomiselium, dan sebagainya (Waluyo, 2007).
22
Gambar 2.4 Berbagai Bentuk Sel Khamir (Waluyo, 2007).
Ukuran dan bentuk sel khamir dalam kultur yang sama mungkin berbeda karena pengaruh perbedaan umur dan kondisi lingkungan selama pertumbuhan. Sel muda mungkin berbeda bentuknya dari yang tua karena adanya proses ontogeni, yaitu perkembangan individu sel. Sel-sel yang sudah tua dan telah mengalami pertunasan berkali-kali, mungkin mempunyai bentuk yang berbeda-beda (Waluyo, 2007).
2.5.2 Sistem Reproduksi Khamir
Khamir dapat melakukan reproduksi dengan beberapa cara, yaitu 1. Pertunasan, 2. Pembelahan, 3. Pembelahan tunas dengan kombinasi antara pertunasan dan pembelahan, 4. Sporulasi atau pembentukan spora, dengan spora aseksual dan spora seksual. Reproduksi dengan cara pertunasan, pembelahan, pembelahan tunas, dan pembentukan spora aseksual dinamakan reproduksi vegetatif, sedang pembentukan spora seksual disebut reproduksi seksual (Waluyo, 2007).
23
2.5.3 Penggunaan Khamir dalam Kehidupan Sehari-hari
Khamir biasanya digunakan dalam pembuatan berbagai minuman beralkohol dan pembuatan kue. Pentingnya organisme ini dalam proses tersebut terletak pada kemampuannya untuk memfermentasi gula. Dalam produksi minuman beralkohol, karbondioksida merupakan produk sampingan. Namun dalam memanggang, senyawa ini merupakan bahan yang esensial. Untuk persiapan berbagai produk roti, khamir dicampur dengan adonan di mana mereka berkembang biak dan menghasilkan enzim pemfermentasi gula. Kegiatan fermentasi selanjutnya dari mikroorganisme ini menghasilkan produksi alkohol dan karbondioksida, yang mengisi adonan dan menyebabkannya mengembang. Setelah dipanggang, gas mengembang dan alkohol keluar (Wistreich dan Lechtman, 1973).
Selain kemampuan fermentasinya, khamir tertentu juga berfungsi sebagai sumber impotan vitamin B kompleks dan ergosterol. Senyawa terakhir digunakan dalam produksi vitamin D (Wistreich dan Lechtman, 1973).
2.6 Media
Mikroorganisme dibiakkan dalam air yang telah ditambahkan nutrisi yang sesuai, biasanya dalam bentuk terlarut. Larutan air yang mengandung nutrisi yang diperlukan disebut media kultur (jamak: media). Bahan makanan yang ada dalam media kultur menyediakan sel mikroba dengan bahan-bahan yang dibutuhkan untuk menghasilkan lebih banyak sel seperti dirinya. Ada berbagai macam bahan makanan yang menyediakan bahan dasar ini, tetapi tidak semua organisme membutuhkan bahan yang
24
sama. Juga tidak ada satu organisme yang menggunakan semua jenis. Keterampilan seorang ahli mikrobiologi terletak pada pemilihan komponen yang tepat yang akan membentuk media kultur yang memadai untuk organisme tertentu (Brock, 1978).
Dengan adanya media pertumbuhan, mikroorganisme dapat diisolasi menjadi kultur tunggal dan juga dimanipulasi untuk kepentingan tertentu. ISO 11133-1 (2009) menerangkan bahwa medium pertumbuhan adalah formulasi substansi, dalam bentuk cairan, semi-padat atau padat yang mengandung bahan alami atau buatan yang dimaksudkan untuk mendukung penggandaan (dengan atau tanpa penghambatan terhadap beberapa mikroorganisme), identifikasi atau penyimpanan viabilitas dari mikroorganisme (Pradhika, 2018).
2.6.1 Sterilisasi Media Pertumbuhan
Media yang telah siap disterilisasi (15 Psi/1 atm, 121 °C selama 15 menit) harus dibuka sedikit tutupnya (jika menggunakan wadah tutup berulir) atau harus dilubangi plastiknya supaya tekanan yang dihasilkan autoklaf dapat masuk ke dalam media. Jika hal ini tidak dilakukan maka tekanan dalam wadah lebih rendah dari chamber autoklaf dan menyebabkan sterilisasi menjadi tidak efisien. Menurut Barker (1998) jika media yang disterilisasi dengan autoklaf sebanyak 1 L pada erlenmeyer 2 L maka sebaiknya waktu sterilisasi diperpanjang menjadi 30 menit (Pradhika, 2018).
Menurut Barrow dan Feltham (1993), dampak pemanasan terhadap komposisi media dimulai sejak suhu 60 °C yang berdampak pada dekomposisi growth factor, karamelisasi gula (reaksi Maillard antara gula dan asam amino) dan perubahan pH.
APHA, AWWA, & WEF SM 9020 (2005) memberikan petunjuk bahwa jangan
25
mensterilisasi media yang mengandung karbohidrat dengan suhu yang dinaikkan dengan waktu tidak melebihi 45 menit. Waktu ini dihitung dari saat pemaparan pertama terhadap panas sampai keluar dari autoklaf. Pemanasan yang berlebih dapat mendegradasi nutrisi yang terkandung di dalamnya. Atlas (2010) menyarankan bahwa media yang mengandung karbohidrat disterilisasi dengan autoklaf pada suhu 116-118
°C untuk mencegah dekomposisi karbohidrat dan pembentukan formasi senyawa toksik yang menghambat mikroba. Sedangkan untuk media yang tidak tahan terhadap sterilisasi autoklaf (seperti media yang mengandung protein telur) sebaiknya disterilisasi menggunakan teknik inspisasi (inspissation). Cara ini dapat dilakukan dengan cara memanaskan pada Arnold steam sterilizer dengan suhu 75-80 °C selama 2 jam dan dilakukan pada tiga hari yang berurutan (jeda hari ditujukan untuk memberikan kesempatan mikroba kontaminan untuk tumbuh). Bahan yang tidak tahan panas seperti larutan antibiotik, vitamin atau karbohidrat disterilisasi menggunakan teknik filtrasi membran yang kemudian ditambahkan ke dalam media setelah didinginkan sampai 50 °C (Pradhika, 2018).
2.7 Sterilisasi
Sterilisasi adalah proses atau kegiatan membebaskan suatu bahan atau benda dari semua bentuk kehidupan (termasuk virus). Semua material sebagai subjek proses ini disebut sebagai bahan yang steril. Istilah steril tidak menggambarkan suatu bahan mutlak steril namun lebih tepatnya hampir tidak terdapat kehidupan karena status steril tidak dapat dipastikan. Ketika sejumlah mikroorganisme terpapar terhadap suatu
26
perlakuan sterilisasi seperti panas atau sinar UV, mereka tidak akan mati secara langsung spontan melainkan akan mati secara bertahap. Secara teoretis dampak sterilisasi terhadap jumlah mikroorganisme yang homogen yaitu akan memastikannya secara eksponensial dengan kecepatan yang seragam (Pradhika, 2018).
Bahan atau peralatan yang dipergunakan dalam bidang mikrobiologi harus dalam keadaan steril. Steril artinya tidak didapatkan mikroba yang tidak diharapkan kehadirannya, baik yang mengganggu atau merusak media atau mengganggu kehidupan dan proses yang sedang dikerjakan. Setiap proses baik fisika, kimia dan mekanik yang membunuh semua bentuk hidup terutama mikroorganisme disebut dengan sterilisasi (Waluyo, 2007).
Sterilitas berarti tidak adanya semua mikroba hidup. Tes sterilitas dilakukan pada makanan dan banyak produk yang digunakan dalam pengobatan, seperti obat dan larutan suntik, kain kasa, dan perban, serta jahitan. Pengujian sterilitas produk untuk penggunaan manusia dan hewan dilakukan dengan prosedur khusus yang biasanya ditentukan oleh peraturan pemerintah. Biasanya dilakukan pengujian terhadap keberadaan bakteri, jamur, dan khamir (Brock, 1978).
2.7.1 Cara Pemanasan
Sterilisasi dengan cara pemanasan dapat dilakukan dengan cara pembakaran, pemanasan kering, pemanasan basah, dan pasteurisasi. Cara-cara sterilisasi dengan pemanasan diuraikan dibawah ini:
a. Pembakaran
27
Cara pembakaran adalah cara sterilisasi yang paling mudah dilakukan dan sangat sederhana. Tetapi hanya terbatas pada alat-alat yang tahan api. Misalnya, sterilisasi alat ose (yaitu alat untuk untuk menanam bakteri/kuman). Alat ose ini mesti dibakar, diatas api misalnya dengan lampu bunsen, supaya tidak menyebabkan kontaminasi pada biakan saat dipergunakan (Hasyimi, 2010).
b.Pemanasan kering
Cara pemanasan kering dilakukan dengan menggunakan oven yang suhunya antara 150-160 °C. Cara ini memerlukan waktu minimal 1 jam. Cocok untuk sterilisasi barang-barang yang terbuat dari bahan gelas, alat-alat logam, bahan powder, minyak dan sebagainya (Hasyimi, 2010).
c. Pemanasan basah
Pemanasan basah dapat dilakukan dengan cara merebus alat atau bahan yang akan disterilkan. Misalnya alat suntik, atau alat-alat lain yang terbuat dari logam. Waktu yang diperlukan untuk sterilisasi kira-kira 30 menit setelah mendidih, sedangkan untuk mematikan spora bakteri bisa memerlukan waktu antara 1 sampai 2 jam (Hasyimi, 2010).
Selain pemanasan basah dengan merebus, dapat pula dengan cara dengan dikukus, dengan cara ini alat yang disterilkan tidak langsung terkena oleh air.
Cara lain yang masih termasuk pemanasan basah, ialah dengan cara penguapan tekanan tinggi, yaitu 2 atmosfer. Alat yang dipergunakan dinamakan autoclave.
Alat ini suhunya 120 °C, dan waktu yang diperlukan selama 4 menit saja (Hasyimi, 2010).
28 d.Cara tindalisasi
Tyndallization atau tindalisasi adalah istilah untuk cara sterilisasi dengan uap air panas yang dapat mencapai suhu 100 °C pada wadah tanpa tekanan. Barrow dam Felthman (1993) menjelaskan bahwa tindalisasi menggunakan uap air panas dapat dilakukan sekali atau tiga kali (tahap) dengan hari yang berlainan dengan memanaskannya pada 80 °C selama satu jam. Sedangkan menurut Hogg (2005) tindalisasi dilakukan pada suhu 90-100 °C selama 30 menit secara bertahap 3 kali. Selama jeda antar tahap ini, media diinkubasi pada 37 °C semalam. Inkubasi ini dimaksudkan untuk memberi kesempatan endospore berkecambah sehingga akan mati pada tahap pemanasan selanjutnya (Pradhika.
2018).
e. Cara Pasteurisasi
Pasteurization atau pasteurisasi adalah proses yang hampir sama dengan tindalisasi tetapi lebih tepat digunakan untuk susu dan produk susu. Pasteurisasi tidak membunuh semua mikroba yang terdapat pada susu, namun menguranginya sehingga akan lebih tahan lama disimpan. Prescot et al. (2002) menyatakan bahwa pasteurisasi dapat dilakukan dengan dua cara yaitu dengan memanaskan susu pada 63 °C selama 30 menit (metode lama yang dikembangkan oleh Louis Pasteur) atau dengan flash pasteurisasi (HTST-High Temperature Short-Term) yaitu pemanasan cepat pada 72 °C selama 15 detik kemudian didinginkan dengan cepat (Pradhika, 2018).
29 2.7.2 Cara Kimiawi
Sterilisasi secara kimia dilakukan dengan memaparkan alat atau bahan yang mengandung mikroba terhadap suatu senyawa kimia sehingga dengan reaksi tertentu dapat membunuh atau menghentikan pertumbuhan mikroba tersebut tanpa merusak bahan atau alat yang disterilisasi (Pradhika, 2018).
Sterilisasi secara/menggunakan kimia sudah sering kita aplikasikan dalam kehidupan sehari-hari. Misalnya, ketika seorang petugas medis/paramedis akan menyuntik atau mengambil darah, ia mengusapkan kapas basah alkohol pada daerah yang akan ditusuk. Tidak lain karena ia menghendaki agar lingkungan yang ditusuk steril oleh kuman, sehingga tidak terjadi kontaminasi (Hasyimi, 2010).
Jenis-jenis senyawa kimia yang bersifat disinfektan menurut Hogg (2005), yaitu:
a. Alkohol atau ethanol b.Halogen
c. Senyawa fenol (Phenolics) d.Surfactants
e. Ethylene oxide (Pradhika, 2018).
2.7.3 Penggunaan Saringan
Sterilisasi selain dapat dilakukan dengan cara pemanasan dan cara kimia sebagaimana telah diuraikan di atas dapat dilakukan pula dengan saringan (filtrasi).
Cara ini biasanya dipergunakan untuk bahan-bahan cair tetapi bahan tersebut tidak tahan panas. Pada prinsipnya kerja ini hanyalah menahan kuman dengan saringan.
30
Sterilisasi dengan cara penyaringan ini masih memungkinkan adanya virus, sebab ukuran virus lebih kecil dari molekul protein (Hasyimi, 2010).
2.7.4 Pengeringan
Kuman-kuman vegetatif tidak tahan terhadap kekeringan, dan tingkat ketahanannya sangat tergantung pada jenis kumannya. Misalnya kuman vibrio sebagai penyebab kolera peka terhadap kekeringan (Hasyimi, 2010).
2.7.5 Pembekuan
Proses pembekuan untuk sterilisasi ini dilakukan dengan cara membuat lingkungan menjadi suhu minus 30 °C secara mendadak (Hasyimi, 2010).
2.7.6 Sterilisasi dengan Sinar Matahari
Sterilisasi juga dapat dilakukan dengan menggunakan sinar matahari. Prinsip dasarnya adalah sebagai berikut: makin pendek gelombang sinar maka makin besar pengaruhnya terhadap kuman. Kita dapat menggunakan sinar ultra violet (UV), tetapi UV tidak dapat mematikan kuman yang terletak dibalik kaca atau tabung (Hasyimi, 2010).
2.7.7 Radiasi
Hogg (2005) menjelaskan bahwa radiasi untuk sterilisasi lainnya adalah menggunakan sinar gamma (γ) yaitu radiasi ionisasi. Sinar gamma memiliki panjang gelombang yang lebih pendek dan energi yang lebih besar sehingga memberikannya kekuatan penetrasi yang baik. Efek dari radiasi ionisasi adalah terbentuknya radikal bebas yang sangat reaktif yang akan merusak struktur makromolekul seperti DNA dan protein. Radiasi sinar gamma digunakan dimana saat sterilisasi panas dapat
31
menimbulkan efek pada tekstur, rasa dan penampakan bahan seperti pada buah dan sayur. Sinar gamma juga mampu menembus kemasan produk (Pradhika, 2018).
2.7.8 Energi Suara : Ultrasonik
Getaran suara atau frekuensi suara dapat mematikan kuman, karena timbul gelombang-gelombang gas intraselular sehingga memudahkan pecahnya kuman atau rusaknya struktur intaselulair (Hasyimi, 2010).
2.8 Teknik Biakan Murni
Dalam teknik biakan murni tidak saja diperlukan bagaimana memperoleh suatu biakan murni, tetapi juga bagaimana memelihara serta mencegah pencemaran dari luar.
Medium untuk membiakkan mikroba haruslah steril sebelum digunakan. Pencemaran (kontaminasi) dari luar terutama berasal dari udara yang mengandung banyak mikroorganisme. Teknik biakan murni untuk suatu spesies dikenal dengan beberapa cara, yaitu:
2.8.1 Cara Pengenceran
Cara ini pertama kali dilakukan oleh Lister pada tahun 1865. Lister berhasil memiara murni Streptococcus lactis yang diisolasi dari susu yang sudah masam.
Caranya adalah dengan mengencerkan suatu suspensi yang berupa campuran bermacam-macam spesies kemudian diencerkan dalam suatu tabung tersendiri. Dari pengenceran ini kemudian diambil 1 ml untuk diencerkan lagi. Kalau perlu, dari enceran yang kedua ini diambil 1 ml untuk diencerkan lebih lanjut.
32
Lakukan selanjutnya adalah dari pengenceran yang ketiga di atas, diambil 0,1 ml untuk disebarkan pada suatu medium padat, kemungkinan besar kita akan mendapatkan beberapa koloni tumbuh dalam medium tersebut, tetapi mungkin juga kita memperoleh satu koloni murni, dan selanjutnya spesies ini dapat kita jadikan piaraan murni (biakan murni). Kalau kita belum yakin, bahwa koloni tunggal yang kita peroleh itu murni, kita dapat mengulang pengenceran dengan menggunakan koloni tersebut sebagai sampel (Waluyo, 2010).
2.8.2 Cara Penuangan
Isolasi dengan menggunakan medium cair dengan cara pengenceran, seperti dijelaskan di atas. Prinsip melakukan pengenceran adalah menurunkan jumlah mikroorganisme sehingga suatu saat hanya ditemukan satu sel dalam satu tabung.
Demikian juga dengan cara penuangan.
Metode ini pertama kali dilakukan oleh Robert Koch (1843-1905). Caranya adalah dengan mengambil sedikit sampel campuran bakteri yang sudah diencerkan, dan sampel itu kemudian disebarkan dalam suatu medium dari kaldu dan gelatin encer.
Setelah medium mengental, maka selang beberapa jam kemudian nampaklah koloni yang masing-masing dapat dianggap murni. Dengan mengulang pekerjaan seperti di atas, akhirnya akan diperoleh biakan murni yang lebih terjamin.
Dalam penemuan metode penuangan ini ada dua orang pembantu Koch yang sangat berjasa, yaitu Petri yang menciptakan cawan dengan tutup, yang sekarang dikenal dengan cawan Petri (Petri dish). Orang yang kedua adalah Hesse yang menemukan agar-agar untuk menggantikan gelatin. Hal ini karena agar-agar memiliki
33
sifat yang lebih baik daripada gelatin untuk bahan pengental suatu medium. Agar-agar tidak lekas mencair, karena titik cairnya 95 °C. Sehingga teknik ini sekarang sering disebut dengan teknik agar tuang (Waluyo, 2010).
2.8.3 Cara Penggesekan/Penggoresan
Cara ini lebih menguntungkan bila ditinjau dari sudut ekonomi dan waktu, tetapi memerlukan keterampilan yang diperoleh dari latihan. Penggoresan yang sempurna akan menghasilkan koloni yang terpisah. Tetapi kelemahan cara ini adalah bakteri-bakteri anaerob tidak dapat tumbuh.
Bakteri yang mempunyai flagel seringkali membentuk koloni yang menyebar terutama bila digunakan lempengan agar yang basah. Untuk mendapatkan koloni yang terpisah sewaktu melakukan goresan harus memperhatikan, antara lain:
- Gunakan ose (sengkelit) yang telah dingin untuk menggores permukaan lempengan agar. Sengkelit yang panas akan mematikan mikroorganisme, sehingga tidak terjadi pertumbuhan pada bekas goresan.
- Sewaktu menggores, sengkelit dibiarkan meluncur di atas permukaan lempengan.
Agar yang luka akan mengganggu pertumbuhan mikroorganisme, sehingga sulit diperoleh koloni yang terpisah.
- Sengkelit harus dipijarkan setelah menggores suatu daerah, hal ini dengan tujuan mematikan mikroorganisme yang melekat pada mata ose dan mencegah pencemaran pada penggoresan berikutnya.
- Menggunakan tutup cawan petri untuk melindungi permukaan supaya terhindar dari pencemaran.
34
- Membalikkan lempengan agar untuk mencegah air kondensasi jatuh di atas permukaan sehingga dapat terjadi penyebaran koloni.
Ada beberapa teknik penggesekan/penggoresan, yaitu: goresan T, goresan kuadran, goresan radian dan goresan sinambung (Waluyo, 2010).
Gambar 2.5 Teknik Penggesekan (Waluyo, 2010).
2.8.4 Cara Penyebaran (Agar Sebar)
Pengenceran sampel sama seperti pada cara penuangan. Dengan memipet sebanyak 0,1 ml cairan dari botol pengencer dan biarkan cairan mengalir ke atas permukaan agar. Cairan sampel disebarkan denga penyebar yang terbuat dari gelkas.
Pada teknik ini sterilisasi penyebar dilakukan dengan mencelupkan ke dalam alkohol dan kemudian dipanaskan sehingga alkohol terbakar habis. Penyebar didinginkan dahulu sebelum digunakan untuk menyebarkan cairan sampel pada permukaan agar.
Penyebaran cairan contoh (sampel) dilakukan dengan memutar agar lempengan tersebut (Waluyo, 2010).
35
2.8.5 Cara Pengucilan Satu Sel (single cell isolation)
Cara ini dengan menggunakan suatu alat yang dapat memungut sau bakteri dari sekian banyak bakteri, dengan tanpa ikutnya bakteri yang lain. Alat semacam ini tidak mudah untuk menggunakannya. Alat itu berupa mikropipet yang ditempatkan pada suatu mikromanipulator.
Dengan membuat beberapa tetesan bergantung pada suatu kaca penutup dengan menggunakan mikropipet. Pekerjaan ini dilakukan di bawah kaca obyektif mikroskop.
Bila tampak suatu tetesan yang hanya mengandung satu bakteri, maka dengan lain pipet, tetesan dipindahkan ke suatu medium encer dengan tujuan bakteri tersebut berbiak lebih dahulu. Dari biakan ini akan diperoleh piaraan murni (Waluyo, 2010).
2.8.6 Cara Inokulasi pada Hewan
Metode ini didasarkan pada kenyataan bahwa tidak semua bakteri dapat tumbuh di dalam tubuh seekor hewan. Misalnya, kita ambil bahan pemeriksaan berupa dahak (sputum) dari seseorang yang disangka menderita TBC. Bila dahak disuntikkan ke dalam tubuh tikus putih, maka saprobe akan ikut serta, tetapi tidak dapat bertahan hidup, sehingga kemudian hanya kita dapatkan kuman TBC saja. Biakan murni Pneumococcus dapat diperoleh dengan cara demikian juga.
Bakteri yang ketinggalan dalam tubuh tikus yang sakit atau mati itu akhirnya dapat dipindahkan ke dalam medium yang sesuai. Inokulasi dilakukan di dalam kulit (intracutaneous), di bawah kulit (subcutaneous), di dalam otot (intramuscular), dan dapat juga pada rongga tubuh atau lain-lain tempat lagi (Waluyo, 2010).
36 2.9 Angka Lempeng Total
Angka lempeng total bakteri adalah jumlah koloni bakteri aerob mesofil yang terdapat dalam tiap gram ataupun ml sample uji. Bakteri mesofil merupakan bakteri yang tumbuh pada temperatur minimal 10-20 °C, optimal pada suhu 20-40 °C dan maksimal pada suhu 40-45 °C. Uji ALTB mengandung prinsip yaitu pertumbuhan koloni bakteri aerob mesofil setelah cuplikan diinokulasikan pada lempeng agar dengan cara tuang dan diinkubasi pada suhu yang sesuai. Pengujian dilakukan secara duplo. Untuk mendapatkan ALTB representatif dilakukan terhadap beberapa pengenceran sample seperti 10-1; 10-2; 10-3 dan seterusnya. Sample bentuk padat diperlakukan sebagai berikut; sample padat dihancurkan dalam kemasan sebelum dibuka, timbang sebanyak 25 g, larutkan dengan PDF hingga 250 ml. Sample bentuk serbuk seperti jamu, timbang sebanyak 10 g, larutkan dengan PDF hingga 100 ml.
Sample cair seperti minuman ringan tidak perlu diencerkan terlebih dahulu (Yusmaniar dkk., 2017).
Pertumbuhan koloni pada setiap cawan yang mengandung 30-300 koloni dicatat.
Pada setiap pemeriksaan, selalu disertakan media control uji (blanko). Angka lempeng total untuk 1 g atau 1 ml sampel dihitung dengan mengalikan jumlah rata-rata koloni pada cawan dengan faktor pengenceran. ALTB dihitung dari petri dengan jumlah koloni representatif jika tidak terdapat jumlah koloni representatif, ALTB merupakan prakiraan dari pengenceran tertinggi (Yusmaniar dkk., 2017).
37 2.10 Angka Kapang Khamir
AKK adalah jumlah koloni kapang dan khamir yang tumbuh dari cuplikan yang diinokulasikan pada media yang sesuai setelah inkubasi selama 3-5 hari dalam suhu 20-25 °C. Tujuan dilakukannya uji AKK adalah memberikan jaminan bahwa sediaan obat tradisional tidak mengandung cemaran fungi melebihi batas yang ditetapkan karena mempengaruhi stabilitas dan aflatoksin yang berbahaya bagi kesehatan. Prinsip uji AKK yaitu pertumbuhan kapang/khamir setelah cuplikan diinokulasikan pada media yang sesuai dan diinkubasi pada suhu 20-25 °C dan diamati mulai hari ketiga sampai hari kelima. Setelah diinkubasi, kemudian dihitung koloni yang tumbuh dengan colony counter dan dinyatakan dalam koloni/ml (Dewi, 2016).
Jumlah kapang dan khamir pada sampel makanan dapat dihitung dengan metode hitungan cawan menggunakan medium Potato Dekstrosa Agar (PDA). Jika di dalam sampel diduga juga mengandung bakteri dalam jumlah tinggi, maka pertumbuhan bakteri dapat dihambat dengan menambahkan 1 ml HCl 10% steril ke dalam 100 ml PDA yang telah disterilisasi (Hafsan, 2014).
PDA merupakan suatu medium yang mengandung sumber karbohidrat dalam jumlah cukup, sehingga baik untuk pertumbuhan kapang dan khamir tetapi kurang baik untuk pertumbuhan bakteri. Akan tetapi juga memfermentasikan karbohidrat dan menggunakannya sebagai sumber energi, maka beberapa bakteri masih mungkin tumbuh pada medium PDA. Dengan menurunkan pH medium pertumbuhan bakteri akan terhambat karena pada umumnya bakteri tidak dapat tumbuh pada pH yang
38
kurang dari 4,0. PDA yang telah diasamkan tersebut disebut Acidified Potato Dextrose Agar (Hafsan, 2014).
2.11 Teknik dan Metode Hitungan Cawan
Metode hitungan cawan didasarkan pada anggapan bahwa setiap sel yang dapat hidup akan berkembang menjadi suatu koloni. Jumlah koloni yang muncul pada cawan merupakan suatu indeks jumlah mikroba yang hidup terkandung dalam sampel. Hal yang perlu dikuasai dalam hal ini adalah teknik pengenceran. Setelah inkubasi, jumlah koloni masing-masing cawan diamati. Untuk memenuhi persyaratan statistik, cawan yang dipilih untuk dihitung mengandung 30-300 koloni. Untuk memenuhi persyaratan tersebut harus melakukan sederetan pengenceran dan pencawanan. Jumlah mikroba dalam sampel ditentukan dengan mengalikan jumlah koloni dengan faktor pengenceran pada cawan yang bersangkutan. Prinsip dari metode hitungan cawan adalah bila sel mikroba yang masih hidup ditumbuhkan pada medium, maka mikroba tersebut akan berkembang biak dan membentuk koloni yang dapat dilihat langsung, dan kemudian dihitung tanpa menggunakan mikroskop (Waluyo, 2010).
Selanjutnya, koloni yang tumbuh pada cawan petri dari masing-masing pengenceran dihitung, sehingga dapat diketahui jumlah bakteri dalam tiap mililiter atau gram bahan dengan cara mengalikan jumlah koloni dengan kebalikan pengenceran.
Sebagai contoh, apabila pada pengenceran 1:10.000 terdapat 75 koloni bakteri, maka tiap mililiter atau gram bahan mengandung 750.000 bakteri (Retnaningrum dkk., 2017).
39
Metode ini merupakan cara yang paling sensitif untuk menentukan jumlah jasad renik, dengan alasan:
a. Hanya sel mikroba yang hidup yang dapat dihitung.
b.Beberapa jasad renik dapat dihitung sekaligus.
c. Dapat digunakan untuk isolasi dan identifikasi mikroba, karena koloni yang terbentuk mungkin berasal dari mikroba yang mempunyai penampakan spesifik (Waluyo, 2010).
Selain keuntungan-keuntungan tersebut di atas, metode hitungan cawan juga mempunyai kelemahan sebagai berikut:
a. Hasil perhitungan tidak menunjukkan jumlah sel yang sebenarnya, karena beberapa sel yang berdekatan mungkin membentuk koloni.
b.Medium dan kondisi inkubasi yang berbeda mungkin menghasilkan jumlah yang berbeda pula.
c. Mikroba yang ditumbuhkan harus dapat tumbuh pada medium padat dan membentuk koloni yang kompak, jelas tidak menyebar.
d.Memerlukan persiapan dan waktu inkubasi relatif lama sehingga pertumbuhan koloni dapat dihitung (Waluyo, 2010).
Metode hitungan cawan dibedakan atas dua cara, yakni metode tuang (pour plate) dan metode permukaan (surface spread plate).
2.11.1 Metode Tuang/Penuangan (Pour Plate)
Pada metode tuang, sejumlah sampel (1 ml atau 0,1 ml) dari pengenceran yang dikehendaki dimasukkan ke dalam cawan petri, kemudian ditambah agar-agar cair
40
steril yang telah didinginkan (47-50 °C) sebanyak 15-20 ml dan digoyangkan supaya sampelnya menyebar (Waluyo, 2010).
Pada pemupukan dengan metode permukaan, terlebih dahulu dibuat agar cawan kemudian sebanyak 0,1 ml sampel yang telah diencerkan dipipet pada permukaan agar- agar tersebut. Kemudian diratakan dengan batang gelas melengkung yang steril (Waluyo, 2010).
Laporan dari hasil menghitung dengan cara hitungan cawan menggunakan suatu standar yang disebut Standard Plate Counts (SPC) sebagai berikut:
a. Cawan yang dipilih dan dihitung adalah yang mengandung jumlah koloni antara 30-300; jika tidak ada yang memenuhi syarat dipilih yang jumlahnya mendekati 300.
b. Beberapa koloni yang bergabung menjadi satu merupakan satu kumpulan koloni yang besar dimana jumlah koloninya diragukan dapat dihitung sebagai satu koloni.
c. Satu deretan rantai koloni yang terlihat sebagai suatu garis tebal dihitung sebagai satu koloni.
d. Tidak ada koloni yang menutup lebih besar dari setengah luas petri disk; koloni demikian dinamakan spreader.
e. Perbandingan jumlah bakteri hasil pengenceran yang berturut-turut antara pengenceran yang lebih besar dengan pengenceran sebelumnya; jika sama atau lebih kecil dari 2 hasilnya dirata-rata. Tetapi jika lebih besar dari 2 yang dipakai jumlah mikroba dari hasil pengenceran sebelumnya.
41
f. Jika dengan ulangan setelah memenuhi syarat hasilnya dirata-rata (Waluyo, 2010).
Dalam SPC ditentukan cara pelaporan dan perhitungan koloni, sebagai berikut:
a. Hasil yang dilaporkan hanya terdiri dari dua angka yakni angka pertama (satuan) dan angka kedua (desimal), jika angka ketiga sama dengan atau lebih besar daripada 5, harus dibulatkan satu angka lebih tinggi pada angka kedua.
Sebagai contoh, didapatkan 1,7 x 104 unit koloni/ml atau 2,0 x 106 unit koloni/ml.
b. Jika pada semua pengenceran dihasilkan kurang dari 30 koloni per cawan petri, berarti pengenceran yang dilakukan terlalu tinggi. Karena itu, jumlah koloni pada pengenceran yang terendah yang dihitung. Hasilnya dilaporkan sebagai kurang dari 30 dikalikan dengan besarnya pengenceran, tetapi jumlah yang sebenarnya harus dicantumkan di dalam tanda kurung.
c. Jika pada semua pengenceran dihasilkan lebih dari 300 koloni pada cawan petri, berarti pengenceran yang dilakukan terlalu rendah. Karena itu, jumlah koloni pada pengenceran yang tertinggi yang dihitung. Hasilnya dilaporkan sebagai lebih dari 300 dikalikan dengan faktor pengenceran, tetapi jumlah yang sebenarnya harus dicantumkan di dalam tanda kurung.
d. Jika jumlah cawan dari dua tingkat pengenceran dihasilkan koloni dengan jumlah antara 30 dan 300, dan perbandingan antara hasil tertinggi dan terendah dari kedua pengenceran tersebut lebih kecil atau sama dengan dua, dilaporkan rata-rata dari kedua nilai tersebut dengan memperhitungkan faktor
42
pengencerannya. Jika perbandingan antara hasil tertinggi dan terendah lebih besar daripada 2, yang dilaporkan hanya hasil yang terkecil.
e. Jika digunakan dua cawan petri (duplo) per pengenceran, data yang diambil harus dari kedua cawan tersebut, tidak boleh dari satu. Oleh karena itu, harus dipilih tingkat pengenceran yang menghasilkan kedua cawan duplo dengan koloni antara 30 dan 300 (Waluyo, 2010).
2.11.2 Metode Sebar/Permukaan (surface spread plate)
- Mengencerkan 3 tabung PCA (Plate Count Agar) dalam air mendidih.
- Mendinginkan agar dalam penangas air (50 °C) selama 5-10 menit.
- Menuangkan agar ke cawan petri dan membiarkan membeku (10-15 menit).
Tandai cawan dengan kode dan tingkat pengenceran (misal 10-1, 10-2, dan sebagainya).
- Membuat pengenceran dari sampel, mulai dari kecil sampai besar.
- Gunakan alat penyebar untuk meratakan suspensi di atas permukaan lempengan agar.
- Cawan petri dibalik dan dimasukkan almari pengeram dengan suhu tertentu selama 24-48 jam.
- Menghitung koloni pada cawan yang mempunyai jumlah 30-300 koloni.
- Menghitung jumlah mikroba hidup dengan mengalikan faktor pengenceran yang digunakan dikalikan 10 karena hanya 0,1 ml suspensi yang digunakan memperoleh CFU/ml (CFU = colony forming units) (Waluyo, 2010).