TESIS
HUBUNGAN
GLUCAGON LIKE PEPTIDE-1
(GLP-1)
DENGAN LEPTIN PADA OBESITAS ABDOMINAL
I GUSTI NGURAH AGUNG TRESNA ERAWAN
PROGRAM PASCASARJANA
UNIVERSITAS UDAYANA DENPASAR
ii
TESIS
HUBUNGAN
GLUCAGON LIKE PEPTIDE-1
(GLP-1)
DENGAN LEPTIN PADA OBESITAS ABDOMINAL
I GUSTI NGURAH AGUNG TRESNA ERAWAN NIM 1014048211
PROGRAM MAGISTER
PROGRAM STUDI ILMU BIOMEDIK
PROGRAM PASCASARJANA
UNIVERSITAS UDAYANA
DENPASAR
iii
HUBUNGAN
GLUCAGON LIKE PEPTIDE-1
(GLP-1)
DENGAN LEPTIN PADA OBESITAS ABDOMINAL
Tesis untuk Memperoleh Gelar Magister pada Program Magister, Program Combined Degree,
Program Pascasarjana Universitas Udayana
I GUSTI NGURAH AGUNG TRESNA ERAWAN NIM 1014048211
PROGRAM MAGISTER
PROGRAM STUDI ILMU BIOMEDIK
PROGRAM PASCASARJANA
UNIVERSITAS UDAYANA
DENPASAR
iv
Lembar Pengesahan
TESIS INI TELAH DISETUJUI
TANGGAL 18 April 2016………...
Pembimbing I,
Prof.Dr.dr AAG. Budhiarta, Sp.PD- KEMD, FINASIM
NIP. 19441221 197206 1001
Pembimbing II,
Dr.dr. Made Ratna Saraswati, Sp.PD-KEMD, FINASIM NIP. 197006272003122001
Mengetahui
Ketua Program Studi Ilmu Biomedik Program Pascasarjana Universitas
Udayana
Dr. dr. G. N. Indraguna Pinatih,MSc,SpGK NIP. 195805211985031002
Direktur Program Pascasarjana Universitas Udayana
v
Tesis Ini Telah Diuji pada
Tanggal 18 April 2016
Panitia Penguji Tesis Berdasarkan SK Rektor
Universitas Udayana, No :……….,Tanggal……
…………
Ketua : Prof. Dr. dr. AAG. Budiartha, Sp.PD-KEMD, FINASIM
Anggota :
1. Dr. dr. Made Ratna Saraswati, Sp.PD-KEMD,FINASIM
2. Dr. dr. Yenny Kandarini, SpPD-KGH, FINASIM
3. dr. IGP Suka Aryana, SpPD-KGer, FINASIM
vi
UCAPAN TERIMA KASIH
Pertama-tama perkenankanlah penulis memanjatkan puji syukur ke hadapan
Ida Sang Hyang Widhi Wasa/ Tuhan Yang Maha esa, karena hanya atas asung wara
nugraha-Nya/ kurnianya, tesis ini dapat diselesaikan.
Pada kesempatan ini perkenankanlah penulis mengucapkan terimakasih yang
sebesar- besarnya kepada Prof. Dr. dr. AAG. Budiarta SpPD KEMD, FINASIM
pembimbing I yang dengan penuh perhatian telah memberikan dorongan, semangat,
bimbingan, dan saran selama penulis mengikuti program magister, khususnya dalam
penyelesaian tesis ini. Terima kasih sebesar-besarnya pula penulis sampaikan kepada
Dr.dr. Made Ratna Saraswati SpPD KEMD,FINASIM pembimbing II yang dengan
penuh perhatian dan kesabaran telah memberikan bimbingan dan saran kepada
penulis.
Ucapan yang sama juga ditujukan kepada Rektor Universitas Udayana Prof.
Dr. dr. Ketut Suastika SpPD KEMD, FINASIM atas kesempatan dan fasilitas yang
diberikan kepada penulis untuk mengikuti dan menyelesaikan pendidikan Program
Magister di Universitas Udayana. Ucapan terimakasih ini juga ditujukan kepada
Direktur Program Pascasarjana Universitas Udayana yang dijabat Prof. Dr. dr. A.A.
Raka Sudewi, Sp.S (K) atas kesempatan yang diberikan kepada penulis untuk
menjadi mahasiswa Program S2 pada Program Pascasarjana Universitas Udayana.
Tidak lupa penulis ucapkan terimakasih kepada Prof. Dr. dr. Putu Astawa, SpOT,
M.Kes, Dekan Fakultas Kedokteran Universitas Udayana atas ijin yang diberikan
kepada penulis untuk mengikuti pendidikan program magister. Pada kesempatan ini,
penulis juga menyampaikan rasa terimakasih kepada Kepala Program Studi Ilmu
vii
SpPD KHOM selaku Kepala Laboratorium Ilmu Penyakit Dalam RSUP Sanglah
Denpasar. Ungkapan terima kasih penulis sampaikan pula kepada para penguji, yaitu
Dr. dr. Yenny Kandarini, SpPD-KGH, dr. IGP Suka Aryana, SpPD-KGer, dan Dr.dr.
Ida Sri Iswari SpMK.,M.Kes, yang telah memberikan masukan, saran, sanggahan,
dan koreksi sehingga tesis ini dapat terwujud seperti ini.
Pada kesempatan ini ijinkan juga penulis mengucapkan terima kasih dan
penghormatan yang tulus kepada Prof. Dr. dr Tjok Raka Putra, SpPD-KR, sebagai
mantan Kepala Bagian /SMF Ilmu Penyakit Dalam FK Unud/ RSUP Sanglah dan
Prof. Dr. dr Ketut Suwitra, SpPD-KGH sebagai mantan Ketua Program Studi Ilmu
Penyakit Dalam FK Unud/ RSUP Sanglah yang pada masanya telah memberi
kesempatan kepada penulis untuk mengikuti pendidikan spesialisasi. Penulis juga
memberikan ucapan yang sama kepada dr. IGP Suka Aryana, SpPD-KGer sebagai
pembimbing akademik penulis atas arahan dan bimbingan selama mengikuti
pendidikan spesialis Ilmu Penyakit Dalam.
Pada kesempatan ini penulis menyampaikan ucapan terima kasih yang tulus
disertai penghargaan kepada seluruh guru-guru yang telah membimbing penulis,
mulai dari sekolah dasar sampai perguruan tinggi. Juga penulis ucapkan terima kasih
kepada kedua orang tua, Ajung I Gusti Ngurah Agung dan Ibu Cokorda Istri Tirta,
yang senantiasa memberikan dorongan moril dan matriil. Kepada adik saya I Gusti
Istri Agung Widnyani, juga kepada keluarga di Batu-Malang yang telah memberikan
motivasi kepada penulis. Penulis juga mengucapkan terimakasih pada rekan residen
seperjuangan: dr. Mario Steffanus, dr. Aulia Sandjaja, dr. Vika Wirdhani, dr.
Herawati Purba, dr. Agung Istri, dr. Ria, dr. Cindy, dr. Wira Mahadita serta
viii
selama ini. Juga kepada paramedis, staf tata usaha Bagian /SMF Ilmu Penyakit
Dalam FK Unud/ RSUP Sanglah atas segala bantuan serta kerjasama yang baik
selama menjalani pendidikan spesialis Ilmu Penyakit Dalam.
Semoga Ida Sang Hyang Widhi Wasa/ Tuhan Yang Maha Esa selalu
melimpahkan rahmat-Nya kepada semua pihak yang telah membantu pelaksanaan
dan penyelesaian tesis ini, serta kepada penulis sekeluarga.
ix
ABSTRAK
HUBUNGAN GLUCAGON LIKE PEPTIDE-1 (GLP-1) DENGAN LEPTIN
PADA OBESITAS ABDOMINAL
I Gusti Ngurah Agung Tresna Erawan, AA Gede Budhiarta
Bagian SMF Ilmu Penyakit Dalam, Fakultas Kedokteran Universitas Udayana/RSUP Sanglah, Denpasar
Obesitas berkontribusi menempati urutan kelima penyebab kematian di
seluruh dunia. Risiko ini lebih tinggi pada obesitas abdominal. Disregulasi leptin
pada patogenesis obesitas mengakibatkan peningkatan kadar leptin pada pasien
dengan obesitas. Glucagon Like Peptide-1 (GLP-1) adalah hormon inkretin yang
selain berperan terhadap metabolisme glukosa, peptida ini juga berefek pada
pengendalian pusat lapar, kadar GLP-1 diketahui menurun pada obesitas. Leptin
secara in vitro terbukti menstimulasi sekresi GLP-1 pada sel L intestinal tikus
(GLUTag) dan sel L manusia (NCI-H716), tetapi dalam penelitian berikutnya secara
in vitro pada sel L intestinal tikus obesitas dengan resistensi leptin terdapat
penurunan dua kali kadar basal GLP-1 dan kegagalan respon GLP-1 setelah stimulas
glukosa oral. Belum adanya penelitian secara in vivo pada manusia adalah latar
belakang dilakukan penelitian ini, untuk melihat bagaimana korelasi GLP-1 dan
leptin pada dewasa dengan obesitas abdominal. Hipotesis penelitian terdapat korelasi
GLP-1 dengan leptin pada Obesitas Abdominal.
Penelitian ini merupakan studi observasional analitik potong lintang. Kriteria
inklusi yaitu dewasa usia 18-60 tahun, obesitas abdominal dengan lingkar pinggang ≥80cm pada wanita dan ≥90cm pada pria dan bersedia berpartisipasi. Kriteria eksklusi adalah penderita diabetes melitus, infeksi berat, penyakit ginjal kronik
stadium III keatas, gangguan fungsi hati berat, keganasan, kelainan hormon tiroid,
sedang mendapatkan terapi steroid, dan testosterone. Perekrutan sampel dilakukan
secara acak konsekutif yang menjalani General Check Up di Laboratorium Prodia
sejumlah 80 subjek pada bulan Desember 2015 – Januari 2016. Subjek diperiksa
kadar GLP-1 Puasa dan GLP-1 30 menit setelah pembebanan glukosa 75 gram serta
x
Delapan puluh subjek penelitian terdiri dari 39 pria (48,8%) dan 41 wanita
(51,2%). Rerata umur 42,4 ± 9,6 tahun. Median IMT 29,49 kg/m2 dengan IMT
terendah adalah 25,6 kg/m2 dan tertinggi 47,5 kg/m2. Median lingkar pinggang
seluruh sampel adalah 95 cm dengan lingkar pinggang terkecil 82 cm dan yang
terbesar 129 cm. Median (minimal-maksimal) lingkar pinggang pada pria adalah 96
(91-117) cm, sedangkan pada wanita adalah 94 (82-129) cm. Rerata kadar leptin
serum adalah 20,2±15,5 ng/ml, rerata kadar GLP-1 puasa adalah 2,9±1,7 pg/L.
Rerata kadar GLP-1 post prandial adalah 3,2±1,8 pg/L. Dari uji Pearson didapatkan
nilai koefisien korelasi leptin dengan GLP-1 puasa adalah r = -0,34; p = 0,002.
Koefisien korelasi leptin dengan GLP-1 post prandial adalah r = -0,27; p = 0,017.
Hasil dari penelitian ini secara konsisten memperlihatkan adanya hubungan terbalik
yang secara statistik bermakna antara kadar leptin dengan GLP-1, baik puasa
maupun post prandial.
xi
ABSTRACT
CORRELATION BETWEEN GLUCAGON LIKE PEPTIDE-1 (GLP-1) AND
LEPTIN IN PATIENTS WITH ABDOMINAL OBESITY
I Gusti Ngurah Agung Tresna Erawan, AA Gede Budhiarta Department of Internal Medicine,
Faculty of Medicine, Udayana University/Sanglah General Hospital Denpasar
Obesity contributes to the fifth leading cause of mortality worldwide. This
risk is higher in the case of abdominal obesity. The dysregulation of leptin in the
pathogenesis of obesity leads to increased levels of leptin in obese patients. Glucagon
Like Peptide -1 (GLP -1) is an incretin hormone which contributes not only to the
metabolism of glucose but also to the central hunger control, levels of GLP-1 is
known to decrease in obesity. “In vitro” leptin is proven to stimulate secretion of
GLP-1 in the L cell of rat’s intestine (GLUtag) and human’s L-cell (NCI-H716). On
another research done using the in vitro method, obese rat’s intestine with leptin
resistance was found to experience a double decline of basal GLP-1 levels and a
response failure of GLP-1 after oral glucose stimulus. The fact that there has not
been any in vivo research on human is the reason underlying the conduct of this
research. It is to observe the correlation between GLP-1 and Leptin in adults with
abdominal obesity. The hypothesis of the research later suggested that there is.
This research is an analytical observation with cross sectional study. The
inclusion criteria are adults aged between 18 and 60 years old with abdominal
obesity with waist circumference equals to or more than 80cm in women and equals
to or more than 90cm in men and lastly, they are willing to participate. The exclusion
criteria are diabetes mellitus, severe infection, chronic kidney disease at third stage
or above, impaired liver function, malignancies, thyroid hormone abnormalities,
currently undergoing steroid or testosterone therapy. Samples were selected
randomly consecutive from people undergoing General Check Up at Prodia
Laboratorium which totaled to 80 subjects from December 2015 to January 2016. Subject’s GLP-1 level on fasting and GLP-1 were examined 30 minutes post prandial of 75 grams of glucose. The level of serum leptin was also examined.
80 research subjects consist of 39 men (48,8%) and 41 women (51,2%) with
xii
25,6 kg/m2 at the lowest and 47,5 kg/m2 at the highest. The waist circumference
median of all samples was 95cm with 82cm being the smallest and 129cm being the
biggest. The waist circumference median (minimum- maximum) were 96 (91-117)
cm for men and 94 (82-129)cm for women. The mean value of serum leptin level
was 20,2±15,5 ng/ml. The mean value of GLP-1 on fasting levels was 2,9±1,7 pg/L,
and the mean value of post prandial GLP-1 levels was 3,2±1,8 pg/L. Based on the
Pearson test, the coefficient correlation value of leptin levels with GLP-1 (fasting)
was r= -0,34; p= 0,002. Coefficient correlation of leptin with GLP-1 post prandial
was r= -0,27 ; p= 0,017. The research result has consistently showed that there was a
substantial inverse correlation between leptin levels and GLP-1 on both post prandial
and fasting.
xiii
DAFTAR ARTI LAMBANG, SINGKATAN, DAN ISTILAH ... xviii
DAFTAR LAMPIRAN ... xx
BAB I PENDAHULUAN ... 1
1.1.Latar Belakang Penelitian ... 1
1.2.Rumusan Masalah ... 5
2.1.3. Definisi Sindrom Metabolik ... 11
2.1.4 Patogenesitas Obesitas dan Sindrom Metabolik ... 15
xiv
2.3.1 Resistensi Leptin – Defek Transport versus Defek Signal ... 23
2.3.2. Telaah Anatomi Resistensi Leptin ... 25
2.4. Hormon Inkretin ... 26
2.4.1 Penemuan Hormon Inkretin ... 26
2.5. GLP-1 ... 29
2.6. Leptin & GLP1 ... 31
BAB III KERANGKA BERPIKIR, KONSEP DAN HIPOTESIS PENELITIAN ……… 33
3.1.Kerangka Berpikir ... 33
3.2.Konsep Penelitian ... 35
3.3.Hipotesis Penelitian ... 36
BAB IV METODE PENELITIAN ... 37
4.1.Rancangan Penelitian ... 37
4.2.Tempat dan Waktu Penelitian ... 37
4.3.Ruang Lingkup Penelitian……… 37
4.4.Populasi dan Sampel ... 37
4.4.1.Populasi ... 37
4.4.2.Sampel ... 37
4.4.2.1.Kriteria Inklusi ... 37
4.4.2.2.Kriteria Ekslusi………. . 38
4.4.2.3.Besaran Sampel Penelitian……… . 38
xv
4.5.Variabel Penelitian ... 39
4.5.1.Klasifikasi dan Identifikasi Variabel ... 39
4.5.2.Definisi Operasional Variabel ... 39
4.6.Bahan dan Instrumen Penelitian ... 43
4.7.Prosedur Penelitian ... 43
4.8.Alur Penelitian ... 44
4.9.Analisis Data ... 46
HASIL DAN PEMBAHASAN ... 47
SIMPULAN DAN SARAN ... 55
DAFTAR PUSTAKA ... 56
xvi
DAFTAR TABEL
Tabel 1.Prevalensi Sindrom Metabolik pada Populasi Tertentu di Asia ... 9
Tabel 2.Klasifikasi IMT pada Dewasa Ras Eropa ... 10
Tabel 3.Klasifikasi IMT pada Orang Asia Dewasa ... 11
Tabel 4.Definisi Sindrom Metabolik menurut ATP III ... 13
Tabel 5.Kriteria Klinis Sindrom Metabolik Menurut WHO... 14
Tabel 6.Definisi Sindrom Metabolik Menurut IDF ... 15
Tabel 7. Indeks Wayne’s, Diagnosis Hipertiroidsm Berdasarkan Gejala dan Tanda ... 42
Tabel 5.1. Karakteristik Subyek Penelitian……….. 47
xvii
DAFTAR GAMBAR
Gambar 1.Regulasi dan Fungsi Neuroendokrin Leptin ... 22
Gambar 2.Signal LRb ... 25
Gambar 3.1. Konsep Penelitian……… 35
Gambar 4.1.Alur Penelitian ... 46
Gambar 5.1. Perbedaan Rerata Kadar GLP-1 Puasa dan Post Prandial………. 48
Gambar 5.2. Grafik Scatter Plot korelasi antara Kadar Leptin serum dan GLP-1 Puasa pada Obesitas Abdominal………. 51
xviii
DAFTAR ARTI LAMBANG, SINGKATAN, DAN ISTILAH
SINGKATAN
AgRP : Agouti-Related Peptide
aMSH : a-Melanocyte-Stimulating-Hormone
ARC : Arkuata
Bdnf : Brain-Derived Neurotrohic Factor
BBB : Sawar Darah Otak
CVO : Organ Circumventricular
DIO : Diet-induced-obese
DMH : Dorsomedial
DMX : Nukleus Motorik Dorsal Nervus Vagus
DPP-IV : Dipeptidil Peptidase 4
GIP : Gastric Inhibitory Polypeptide
GLP-1 : Glucagon like Peptide-1
GRP : Glucose Related Peptide
HDL-C : High Density Lipoprotein Cholesterol
IDF :International Diabetes Federation
IL :Interleukin
IMT : Indeks Massa Tubuh
Jak2 : Jak kinase
LR : reseptor leptin
ME : Median Eminence
xix MC3R : Melanocortin-3 Receptor
MC4R : Melanocortin-4 Receptor
NHANES : the National Health and Nutrition Examination Survey
NTS : Nukleus Traktus Solitarius
ob : gen obesitas
POMC : Pro-Opiomelanocortin
SM : Sindrom Metabolik
TNF-α : Tumor Necrosis Factor-α
VMH : Ventromedial
WHO : World Health Organization
xx
DAFTAR LAMPIRAN
Lampiran 1. Keterangan Kelaiakan Etik……….. 61
Lampiran 2.Informasi Yang Diberikan Kepada Subyek Penelitian ... 62
Lampiran 3. Perkiraan Biaya……….. . 64
Lampiran 4.Informed Consent ... 65
Lampiran 5.Status Penderita ... 66
Lampiran 6.Rencana dan Jadwal Penelitian ... 67
Lampiran 7. Prosedur Pemeriksaan Kadar GLP-1 ... 68
Lampiran 8. Alur Pemeriksaan Kadar Leptin ... 70
1
BAB I
PENDAHULUAN
1.1. Latar Belakang
Overweight dan obesitas didefinisikan sebagai akumulasi lemak abnormal
atau berlebih yang dapat mengganggu kesehatan. Dahulu obesitas identik dengan
kemakmuran, akan tetapi saat ini kelebihan berat badan dan obesitas sudah
dianggap sebagai suatu masalah global. Di seluruh dunia terjadi peningkatan
prevalensi obesitas.
Obesitas atau kegemukan berkontribusi menempati urutan kelima
penyebab kematian di seluruh dunia. Sedikitnya 2,8 juta orang dewasa meninggal
setiap tahun akibat kondisi tersebut (WHO, 2014).
Berdasarkan distribusi lemak, obesitas dibedakan menjadi dua kategori;
obesitas umum dan obesitas abdominal. Obesitas abdominal adalah kondisi
kelebihan lemak perut atau lemak pusat. Kondisi overweight dan obesitas
merupakan risiko utama bagi sejumlah komorbiditas. Diketahui bahwa 44%
kejadian diabetes, dua puluh tiga persen kejadian penyakit jantung iskemik dan
sekitar 7-41% kejadian kanker meningkat risikonya pada obesitas abdominal
(WHO, 2014).
Prevalensi obesitas di beberapa negara cenderung meningkat, termasuk
Indonesia. Riset Kesehatan Indonesia 2010 menyatakan prevalensi obesitas pada
2
abdominal didalamnya sebesar 18,8% (Riskesdas, 2010). Prevalensi obesitas di
Bali adalah sebesar 26,2% (Dwipayana et al., 2011).
Penyebab fundamental overweight dan obesitas adalah ketidakseimbangan
energi antara kalori yang dikonsumsi dengan kalori yang digunakan. Asupan
kalori berlebih dan aktivitas fisik yang kurang memicu terjadinya penumpukan
jaringan adiposa di subkutan, periviseral dan intraviseral (Petrucelli, 2008).
Selain berperan sebagai tempat penyimpanan energi, jaringan adiposa
diketahui merupakan organ endokrin utama yang mengatur metabolisme tubuh.
Peningkatan massa sel lemak terutama di perut memicu terjadinya
ketidakseimbangan pelepasan hormon dan akhirnya menyebabkan berbagai efek
metabolik. Sel adiposa mensekresikan berbagai molekul yang aktif secara biologis
yang dinamakan adipositokin atau adipokin yang meliputi sejumlah sitokin (misal
Tumor Necrosis Factor (TNF)-α dan Interleukin (IL)-6), Kemokin (misal IL-8
dan Monocyte Chemoattractant Protein (MCP)-1). Selain itu, jaringan adiposa
mensekresikan berbagai hormon yang salah satunya berperan dalam regulasi berat
badan seperti visfatin, apelin, resistin, adiponektin dan leptin (Zhang, 2010).
Leptin diproduksi oleh gen obesitas (ob), 167-asam amino peptide, yang
diekspresikan oleh jaringan adiposa. Defisiensi hormon leptin dalam serum
mengakibatkan rasa lapar berlebih (hiperfagia), menurunnya penggunaan energi,
obesitas abdominal dan resistensi insulin yang akan berkembang menjadi
diabetes. Akan tetapi penelitian terakhir menyebutkan bahwa terjadi disregulasi
leptin pada patogenesis obesitas akibat terjadinya mutasi pada gen ob maupun
3
ditemukannya peningkatan kadar leptin yang tinggi pada pasien dengan obesitas.
Mekanisme yang dapat menjelaskan mengapa terjadi peningkatan leptin serum
pada obesitas adalah keterlibatan mutasi yang terjadi pada gen ob. Pada penelitian
yang dilakukan oleh Considine et al., menemukan bahwa terjadi peningkatan
jumlah ob mRNA pada adiposit dari subjek dengan obesitas dibandingkan dengan
subjek dengan berat badan normal. Akibatnya adalah terjadi peningkatan kadar
serum leptin sampai empat kali nilai normal yang kemungkinan diakibatkan oleh
hipertropi sel adiposit (Considine et al., 1996) .
Kadar rerata leptin pada obesitas adalah sebesar 31,3±24,1 ng/ml,
sedangkan rerata subjek berat badan normal adalah 7,5±9,3 ng/ml. Hasil ini
mengindikasikan bahwa pada kebanyakan orang dengan obesitas adalah tidak
sensitif terhadap produksi leptin endogen. Hal ini berhubungan dengan gangguan
toleransi glukosa serta resistensi insulin yang selanjutnya disebut dengan
resistensi leptin (Considine et al., 1996; Halim, 2003).
Konsep resistensi leptin pada obesitas dicurigai pertama kalinya akibat
efek terbatas pemberian terapi leptin eksogen pada pasien dengan obesitas. Hal ini
diduga disebabkan oleh kemampuan kelarutan leptin untuk melewati sawar darah
otak atau gangguan pada tingkatan reseptor aktivasi atau transduksi signal (Meier
and Gressner, 2004). Mutasi dari gen Bdnf (brain-derived neurotrohic factor)
pada neuron subjek dengan obesitas, adalah salah satu sebab yang dipercaya
berperan pada pathogenesis ini (Liao et al., 2012)
Penemuan inkretin merupakan suatu langkah penting dalam
4
endocrine secretion pertama kali dihipotesiskan tahun 1902 (Marzieh, 2006).
Inkretin merupakan suatu substrat yang dihasilkan oleh saluran pencernaan (sel L)
yang memiliki efek menstimulasi hormon endokrin (pankreas-insulin) (Perfetti
and Merkel, 2000). Saat ini dikenal dua inkretin yaitu Gastric Inhibitory
Polypeptide (GIP) dan Glucagon like Peptide-1 (GLP-1) (Raganath et al., 1996).
Gastric Inhibitory Polypeptide dan GLP-1 merupakan suatu senyawa
inkretin yang memberikan serangkaian efek metabolik yaitu mampu
meningkatkan sekresi insulin. Selain efeknya terhadap metabolisme glukosa,
kedua peptida ini juga berefek pada berbagai organ antara lain pancreas, lemak,
tulang dan otak. Pada pankreas, GIP dan GLP-1 bersama-sama meningkatkan
proliferasi sel B pankreas dan menghambat apoptosis. Gastric Inhibitory
Polypeptide meningkatkan glukagon postprandial dan meningkatkan deposisi
lemak tubuh, sedangkan GLP-1 justru menurunkan kadar glukagon dan
mengendalikan pusat lapar sehingga GLP-1 lebih bermanfaat pada penderita
dengan overweight, obesitas, dyslipidemia dan diabetes (Szayna, 2000; Bello and
Moran, 2008; Hagememann et al., 2007). Pada penelitian in vivo yang dilakukan,
GLP-1 secara cepat disekresikan oleh sel L setelah mendapatkan asupan makanan
baik gula maupun lemak. Pada mekanisme ini diketahui terdapat dua macam efek
langsung maupun tidak langsung yang bekerja untuk merangsang sekresi GLP-1.
Efek langsung berasal dari jumlah makanan, dan efek tidak langsung berasal dari
pengaruh endokrin dan mediator neural termasuk GRP (Rocca et al, 1999;
Persson et al, 2000). Sebagai akibatnya, GLP-1 selanjutnya akan disekresikan
5
menit, dan melalui efek langsung akan disekresikan lebih lambat yaitu pada menit
60-120 postprandial (Anini et al, 1999). Kadar GLP-1 telah diketahui menurun
kadarnya pada pasien dengan obesitas. Penurunan kadar GLP-1 pada obesitas
sampai saat ini masih belum diketahui penyebabnya. (Raganath et al., 1996).
Leptin secara in vitro terbukti menstimulasi sekresi GLP-1 pada sel L
intestinal tikus (GLUTag) dan sel L manusia (NCI-H716), namun penelitian in
vitro pada sel L intestinal tikus obesitas dengan resistensi leptin justru didapatkan
terjadi penurunan dua kali kadar basal GLP-1 dan kegagalan respon GLP-1
setelah stimulas glukosa oral (Anini and Brubaker, 2003). Sampai saat ini korelasi
antara kadar leptin dan GLP-1 secara in vivo pada manusia belum diteliti,
sehingga menarik penulis melakukan penelitian ini.
Mengingat semakin meningkatnya masalah obesitas serta adanya dualisme
dari sifat kadar GLP-1 terhadap kadar leptin pada penelitian in vitro sebelumnya,
penulis ingin membuktikan adanya korelasi kadar GLP-1 dengan kadar leptin
pada orang dewasa dengan obesitas abdominal.
1.2.Rumusan Masalah
Dengan memperhatikan latar belakang di atas, dapat dirumuskan masalah
penelitian sebagai berikut :
Apakah terdapat hubungan antara kadar leptin dengan kadar GLP-1 pada
6
1.3.Tujuan Penelitian
Sehubungan dengan masalah yang diangkat dalam penelitian ini, maka
tujuan penelitian ini adalah:
1.3.1 Tujuan Umum
- Mengetahui peran leptin dan GLP-1 pada patogenesis obesitas abdominal.
1.3.2 Tujuan Khusus
- Membuktikan hubungan kadar leptin dengan GLP-1 pada obesitas
abdominal.
1.4.Manfaat Penelitian
1.4.1.Manfaat Akademik
Penelitian ini merupakan penelitian analitik yang hasilnya dapat menambah
pengetahuan kita tentang korelasi kadar GLP-1 dengan leptin pada obesitas
abdominal. Diharapkan penelitian ini dapat memberikan data dasar dan
bermanfaat memberi penegasan terhadap patogenesis obesitas abdominal dan
hubungannya dengan diabetes mellitus tipe 2, terkait dengan peran leptin dengan
kadar GLP-1 pada manusia dewasa.
1.4.2.Manfaat Praktis
Selama ini diketahui bahwa memberikan terapi leptin eksogen pada
obesitas dewasa dinilai tidak memberikan hasil yang memuaskan terkait kondisi
resistensi leptin. Bila penelitian ini membuktikan hubungan antara kadar GLP-1
dengan leptin pada obesitas abdominal, penelitian lebih lanjut tentang terapi
1
B A B II
KAJIAN PUSTAKA
2.1 Obesitas dan Sindrom Metabolik
2.1.1 Epidemiologi
Tahun 2008, satu setengah milyar orang dewasa diatas 20 tahun termasuk
overweight, dan lebih dari 200 juta pria dan hampir 300 juta wanita termasuk
obesitas. Secara keseluruhan, lebih dari 1 diantara 10 orang dewasa di dunia
termasuk obesitas. Hal ini diperparah dengan kenyataan pada tahun 2010, hampir
43 juta anak-anak dibawah usia 5 tahun mengalami overweight (Ferrari, 2008).
Berdasarkan data The Behavioral Risk Factor Surveillance System, pada
tahun 2005 diperkirakan 60,5% orang Amerika mengalami overweight, 23,9%
obesitas dan 3% tergolong sangat obesitas. Obesitas tidak hanya menyebabkan
masalah kesehatan yang serius namun juga menurunkan angka harapan hidup
(Petrucelli, 2008; Singla et al., 2010).
Peningkatan angka kejadian sindrom metabolik salah satunya disebabkan
oleh peningkatan populasi dan prevalensi obesitas. Obesitas dan sindrom
metabolik memiliki keterkaitan yang erat dan merupakan suatu hubungan kausal.
Berdasarkan data the National Health and Nutrition Examination Survey
(NHANES) tahun 1988-1994 dan 1999-2000 diketahui bahwa 22% orang dewasa
di Amerika Serikat mengalami sindrom metabolik. Disamping itu, terjadi
peningkatan prevalensi sindrom metabolik seiring dengan peningkatan usia
(Ferrari, 2008; Petrucelli, 2008; Singla et al., 2010; Shen et al., 2012).
Peningkatan prevalensi obesitas tidak hanya terjadi di negara Barat, namun
juga di Asia. Dibandingkan dengan ras Kaukasia, orang Asia memiliki Indeks
2
metabolik ternyata lebih tinggi. Data prevalensi sindrom metabolik pada beberapa
populasi diseluruh dunia berdasarkan kriteria diagnostik yang berbeda dapat
dilihat pada tabel 1 (Ferrari, 2008; Huang et al., 2009).
Riset Kesehatan Indonesia 2010 menyatakan prevalensi obesitas pada
penduduk usia diatas 15 tahun adalah 21,7%, dengan prevalensi obesitas
abdominal didalamnya sebesar 18,8% (Riskesdas, 2010). Prevalensi obesitas di
3
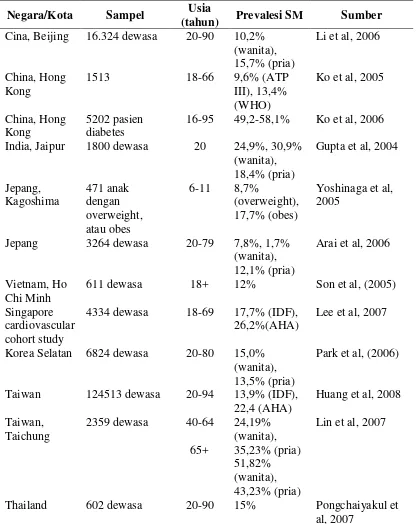
Tabel 1. Prevalensi Sindrom Metabolik pada Populasi Tertentu di Asia (Ferrari, 2008)
Negara/Kota Sampel Usia
(tahun) Prevalesi SM Sumber
Cina, Beijing 16.324 dewasa 20-90 10,2%
Thailand 602 dewasa 20-90 15% Pongchaiyakul et
al, 2007
ATP III : The Adult Treatment Panel III of the National Cholesterol Education Program, AHA :
American Heart Association, IDF : International Dabetes Federation
4
2.1.2 Definisi Obesitas
Overweight dan obesitas didefinisikan sebagai akumulasi lemak abnormal
atau berlebih yang dapat mengganggu kesehatan. Obesitas dibedakan menurut
indeks massa tubuh dan distribusi lemak. Berdasarkan distribusi lemak, obesitas
dibagi menjadi obesitas umum dan obesitas abdominal atau obesitas sentral.
Obesitas abdominal adalah kondisi kelebihan lemak perut atau lemak pusat. Salah
satu indikator pengukuran obesitas abdominal adalah lingkar perut. Indeks Masa
Tubuh (IMT) merupakan indeks sederhana berat dan tinggi badan yang umum
digunakan untuk mengklasifikasikan overweight dan obesitas pada dewasa.
Indeks massa tubuh didefinisikan sebagai berat badan seseorang dalam kilogram
dibagi dengan kuadrat tinggi badannya dalam meter (kg/m2). Untuk penduduk
Barat dikatakan obesitas bila IMTnya ≥ 30 kg/m2 atau lingkar perut ≥ 102 cm
pada pria atau ≥ 88 cm pada wanita, sedangkan untuk penduduk Asia, IMTnya >
25kg/m2atau lingkar perut ≥90 cm pada pria dan ≥ 80cm pada wanita. Berikut ini
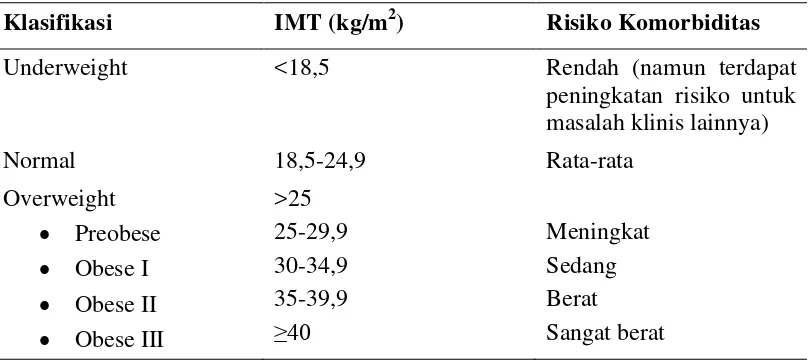
adalah klasifikasi IMT yang ditetapkan oleh World Health Organization (WHO)
pada tahun 1998 (Tabel 2) (WHO, 2014)
Tabel 2. Klasifikasi IMT pada Dewasa Ras Eropa
Klasifikasi IMT (kg/m2) Risiko Komorbiditas
Underweight <18,5 Rendah (namun terdapat
5
Berbeda dengan Eropa, terdapat perbedaan pada distribusi lemak tubuh
khususnya di daerah Asia Pasifik. Sebagai contoh, Asia Selatan (India) memiliki
distribusi lemak tubuh tersentralisasi di mana thick trunk shinfold dan rata-rata
waist-to-hip ratio-nya lebih tinggi pada IMT yang sama dibandingkan ras Eropa.
Pada populasi Asia, morbiditas dan mortalitas terjadi pada individu dengan IMT
yang lebih rendah dan lingkar pinggang yang lebih kecil. Selain itu, mereka
cenderung memiliki lemak intraabdominal tanpa terlihat obesitas secara
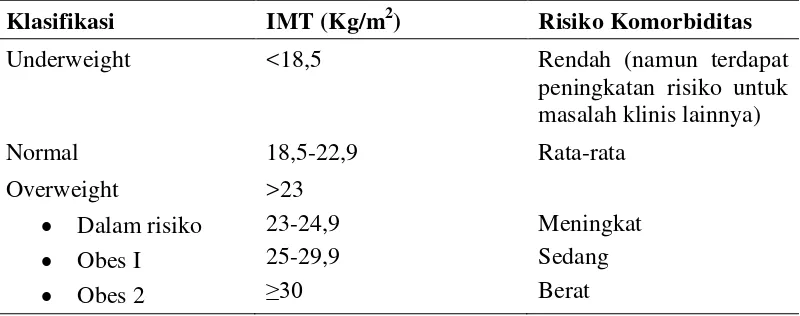
keseluruhan. Berikut ini adalah klasifikasi IMT pada orang Asia dewasa (Tabel 3)
(WHO,2014).
Tabel 3. Klasifikasi IMT pada Orang Asia Dewasa
Klasifikasi IMT (Kg/m2) Risiko Komorbiditas
Underweight <18,5 Rendah (namun terdapat
peningkatan risiko untuk
Kombinasi berbagai gangguan metabolik yang sekarang dikenal dengan
sindrom metabolik pertama kali digambarkan oleh Kylin pada tahun 1920-an
sebagai sekelompok gejala hipertensi, hiperglikemia dan gout. Dua dekade
kemudian, Vague menyatakan bahwa upper body adiposity (android atau male
type obesity) merupakan tipe yang paling berkaitan dengan abnormalitas
metabolik yang terlihat pada diabetes dan penyakit kardiovaskular. Pada tahun
6
klinis yang penting meskipun obesitas tidak termasuk didalamnya. Pada tahun
1989, Kaplan menyebutnya The Deadly Quartet dan lainnya lalu menggunakan
istilah The Insulin Resistance Syndrome. Namun, saat ini istilah sindrom
metabolik diterima secara luas untuk sekumpulan gejala metabolik yang berkaitan
dengan faktor risiko kardiovaskuler serta dapat memprediksi risiko terjadinya
diabetes (Alberti et al., 2006).
Karakteristik umum sindrom metabolik diantaranya: 1) distribusi lemak
tubuh yang abnormal; 2) Resistensi insulin; 3) Dislipidemia aterogenik; 4)
peningkatan tekanan darah; 5) Status proinflamasi; dan 6) Status protrombotik.
Berikut adalah berbagai kriteria yang ditetapkan oleh beberapa organisasi untuk
membantu menetapkan diagnosis klinis sindrom metabolik (Huang et al., 2009;
Alberti et al., 2006);
2.1.3.1 Sindrom Metabolik berdasarkan The Adult Treatment Panel III of the
National Cholesterol Education Program (NCEP ATP III)
Beberapa waktu sebelumnya tidak diketahui hubungan antara
hiperinsulinemia, resistensi insulin, hipertensi, dislipidemia dan diabetes. Saat ini
diketahui bahwa keterkaitan tersebut mengacu pada sindrom metabolik. The Adult
Treatment Panel III of the National Cholesterol Education Program membantu
mengidentifikasi orang dengan sindrom metabolik melalui sejumlah kriteria klinis
dan menetapkan bahwa diagnosis sindrom metabolik dilakukan bila terdapat 3
atau lebih faktor risiko (Tabel 4). Faktor risiko ini termasuk obesitas abdominal,
kadar High Density Lipoprotein Cholesterol (HDL-C) yang rendah dan
peningkatan tekanan darah, glukosa puasa serta kadar Trigliserida (Huang et al.,
7
Tabel 4. Definisi Sindrom Metabolik Menurut ATP III
Faktor Risiko Definisi
Obesitas Abdominal (Lingkar pinggang)
Pria
Wanita
>40 inch >30 inch
Trigliserida ≥150 mg/dl
HDL Cholesterol
Pria
Wanita
<40mg/dl <50mg/dl
Tekanan Darah ≥130/85
Gula darah puasa ≥110 mg/dl
2.1.3.2 Sindrom Metabolik berdasarkan World Health Organization (WHO)
Pada tahun 1999, WHO menetapkan definisi sindrom metabolik. Definisi
WHO ditetapkan berdasarkan asumsi bahwa resistensi insulin merupakan salah
satu kontributor utama sindrom metabolik. Untuk menetapkan diagnosis,
disamping resistensi insulin, sedikitnya dua komponen lain yaitu peningkatan
tekanan darah, peningkatan kadar trigliserida, penurunan kadal HDL-C, obesitas
8
Tabel 5. Krteria Klinis Sindrom Metabolik Menurut WHO (Petrucelli, 2008) Insulin Resisten, memenuhi salah satunya dari;
Diabetes mellitus tipe 2
Glukosa darah puasa terganggu
Tolerasi glukosa terganggu
Hiperinsulinemi, euglikemia dengan ambilan glukosa rendah
Disertai 2 dari kriteria;
Mendapatkan terapi anti hipertensi atau tekanan darah ≥ 140/90 Trigliseride plasma ≥ 150 mg/dl
HDL-C < 35 mg/dl pada pria, atau < 39 mg/dl pada wanita
BMI > 30kg/m2 dan/atau rasio pinggang:pinggul > 0,9 pada pria, >0,85 pada
wanita
Mikroalbuminuria; urine albumin excretion rate ≥ 20 microgram/menit atau
albumin: creatinin ratio ≥ 30 mg/g
2.1.3.3 Sindrom Metabolik berdasarkan International Diabetes Federation (IDF)
Sindrom metabolik mengacu pada sekumpulan abnormalitas metabolik,
termasuk obesitas sentral, toleransi glukosa, tekanan darah tinggi dan
dislipidemia. Berbagai studi menunjukkan bahwa akumulasi lemak
intraabdominal merupakan prediktor risiko metabolik dan penyakit kardiovaskular
yang independen (Huang et al., 2006).
International Diabetes Federation menetapkan alat diagnosis yang
sederhana untuk dapat digunakan dalam praktek klinis dan penelitian di seluruh
dunia. Tujuannya selain membantu identifikasi sindrom metabolik juga
9
Tabel 6. Definisi Sindrom Metabolik Menurut Internasional Diabetes Federation (IDF) (Alberti et al, 2006)
Obesitas Sentral
Lingkar pinggang sesuai etnis, ditambah dua dari kriteria berikut;
< 1,03 mmol/l (40mg/dl) pada pria < 1,29 mmol/l (50mg/dl) pada wanita
Peningkatan tekanan darah
Sistolik: ≥ 130 mmHg Atau
Diastolik: ≥ 85 mmHg
Atau sudah mendapatkan terapi dengan diagnosis hipertensi
Peningkatan glukosa darah puasa
Glukosa darah puasa ≥ 5,6 mol/l (100 mg/dl) atau telah terdiagnosa sebagai diabetes mellitus
Jika > 5,6 mmol/l atau 100 mg/dl, Uji toleransi glukosa sangat direkomendasikan, namun tidak begitu diperlukan untuk membedakannya pada sindrom ini.
2.1.4 Patogenesitas Obesitas dan Sindrom Metabolik
Penyebab fundamental overweight dan obesitas adalah ketidakseimbangan
energi antara kalori yang dikonsumsi dengan kalori yang digunakan. Secara
global, terjadi peningkatan asupan makanan kaya lemak, garam, dan gula namun
rendah vitamin, mineral dan mikronutrien lain. Selain itu juga terjadi penurunan
aktivitas fisik akibat gaya hidup sedenter dan urbanisasi. Asupan kalori berlebih
dan aktivitas fisik yang kurang, memicu terjadinya penumpukan lemak subkutan,
periviseral dan intraviseral (Petrucelli, 2008; Huang et al., 2009)
Obesitas dapat memicu tekanan darah tinggi, peningkatan kolesterol,
penurunan HDL-C dan hiperglikemi. Sel adiposa diketahui mensekresikan sitokin
dan molekul lain yang dapat memicu peningkatan kondisi proinflamasi,
10
sindrom metabolik. Selain itu, diketahui pula bahwa resistensi insulin memicu
faktor risiko metabolik lainnya termasuk hipertensi, hipertrigliseridemia,
hiperglikemia dan dislipidemia (Petrucelli, 2008).
Diperkirakan, setiap peningkatan berat badan sebesar 1 kg berkaitan
dengan peningkatan risiko diabetes tipe 2 sebesar 9%. Obesitas berkaitan erat
dengan risiko stroke iskemik maupun hemoragik. Setiap satuan peningkatan IMT
berkaitan dengan peningkatan risiko stroke sebesar 6% (Ferrari, 2008).
Walaupun etiologinya masih kontroversial, namun diketahui bahwa
sindrom metabolik dipicu oleh obesitas, resistensi insulin dan sejumlah faktor lain
seperti kerentanan genetik dan peningkatan usia. Diketahui pula bahwa sindrom
metabolik dapat terjadi akibat efek samping dari pengobatan termasuk
kortikosteroid, inhibitor protease, antidepresan dan antipsikotik (Petrucelli,2008).
2.1.5 Peran Jaringan Adiposa sebagai Organ Endokrin
Selain berperan sebagai tempat penyimpanan energi, jaringan adiposa
diketahui merupakan organ endokrin utama yang mengatur metabolisme tubuh.
Peningkatan massa sel lemak memicu terjadinya ketidakseimbangan pelepasan
hormon dan akhirnya menyebabkan berbagai efek metabolik. Komplikasi
metabolik obesitas yang dikenal dengan sindrom metabolik ditandai oleh
resistensi insulin yang seringkali menyebabkan kerusakan sel beta pancreas,
gangguan toleransi glukosa dan diabetes tipe 2, dislipidemia, hipertensi dan
penyakit jantung yang terjadi lebih dini. Selain itu, obesitas abdominal,
akumulasi lemak ektopik, steatosis hepatik dan sleep apnea juga termasuk ke
11
Sel Adiposa mensekresikan berbagai molekul yang aktif secara biologis
yang dinamakan adipositokin atau adipokin yang meliputi sejumlah sitokin (misal
Tumor Necrosis Factor (TNF)-α dan Interleukin (IL)-6), Kemokin (misal IL-8
dan Monocyte Chemoattractant Protein (MCP)-1). Selain itu, jaringan adiposa
mensekresikan berbagai hormon yang salah satunya berperan dalam regulasi berat
badan seperti leptin, visfatin, apelin, resistin dan adiponektin (Zhang, 2010).
2.2. Leptin
Hormon leptin diproduksi oleh jaringan lemak. Leptin dalam sirkulasi
dapat menghubungkan antara kondisi energi tubuh dengan sistem saraf pusat
untuk menekan asupan makan dan memicu pemakaian energi (Morton, 1998).
2.2.1 Regulasi Leptin
Leptin dipengaruhi oleh sistem umpan balik dari simpanan energi tubuh
terhadap otak, sesuai dengan definisi oleh Kennedy pada tahun 1953 dimana
kadar leptin dikatakan menurun pada kondisi starvasi saat cadangan lemak tubuh
berkurang untuk mendukung kebutuhan energi dasar organisme dan leptin
meningkat saat re-feeding saat cadangan lemak kembali terkumpul (Morton,
1998).
Demikian pula banyak adaptasi fisiologis yang dicetuskan oleh puasa
berkepanjangan yang dapat dicegah melalui pemberian leptin eksogen saat puasa,
sehingga memberikan signal palsu pada otak seolah cadangan energi telah
tergantikan. Kadar leptin yang cukup akan membuat pemakaian energi yang
cukup untuk proses reproduksi dan pertumbuhan serta pengaturan sistem saraf
12
Leptin Reseptor b (LRb) terdapat pada beberapa jaringan namun paling
banyak pada neuron beberapa nuklei hipotalamus meliputi arkuata (ARC),
dorsomedial (DMH), ventromedial (VMH) dan premamilari serta pada batang
otak yaitu di nukleus traktus solitarius (NTS) dan nukleus motorik dorsal nervus
vagus (DMX), substansi grisea periakuaeduktal dan hipokampus. Terdapat 2
populasi mRNA LRb yang terdeteksi, yaitu yang menghasilkan agouti-related
peptide (AgRP) dan yang menghasilkan pro-opiomelanocortin (POMC) untuk
memproduksi a-melanocyte-stimulating-hormone (aMSH) untuk mensignalkan
anoreksia (penurunan napsu makan) dengan mengaktifkan melanocortin-4
receptor (MC4R) dan melanocortin-3 receptor (MC3R). Leptin Reseptor b
merangsang sintesis POMC dan mengaktifkan/mendepolarisasikan neuron
LRb/POMC. Neuropeptide Y merupakan hormon yang oreksigenik (merangsang
napsu makan) yang juga mensupresi pertumbuhan yang didasari LRb pada sentral
dan aksis reproduksi. Agouti-related peptide adalah antagonis dari aMSH/MC4R
dan inhibitor dari aktivitas MC4R endogen. Leptin bekerja melalui LRb untuk
menghambat NPY/AgRP neuron dan mensupresi ekspresi neuropeptida tersebut.
Dengan demikian, adanya signal LRb merangsang produksi neuropeptida
anorektik dan mensupresi kadar peptida oreksigenik. Sebaliknya, penurunan
aktivitas atau kadar leptin (misal saat starvasi dan pada tikus ob/db) merangsang
napsu makan dengan mensupresi sintesis neuropeptida anorektik (misal POMC)
dan meningkatkan ekspresi peptida oreksigenik (misal NPY dan AgRP). Pada
Arcuata, neuron yang mengekspresikan LRb mRNA dan NPY/AgRP dan/atau
POMC juga mengatur pemakaian energi dan elemen lainnya dari fungsi
13
NPY/AgRP dapat menyebabkan makan yang berlebihan dan peningkatan berat
badan (Münzberg et al., 2005).
2.2.2 Abnormalitas Leptin
Kekurangan leptin akibat mutasi pada leptin (ob) maupun reseptor leptin
(LR) (misalnya db) pada tikus dan manusia menyebabkan peningkatan asupan
makanan dan berkurangnya pemakaian energi sebagai respon neuroendokrin
terhadap starvasi (meliputi hipotiroidisme, berkurangnya pertumbuhan,
infertilitas, dan penurunan fungsi imun) disamping obesitas itu sendiri (Münzberg
et al., 2005; Sobhani et al., 2000). Gaster merupakan organ target dari leptin
(Sobhani et al., 2000). Konsentrasi leptin serum berkaitan dengan persentase
lemak tubuh, mengindikasikan bahwa pada kebanyakan orang dengan obesitas
adalah tidak sensitif terhadap produksi leptin endogen (Considine et al., 1996).
2.2.3 Mekanisme Intraseluler Leptin
Reseptor leptin berasal dari golongan reseptor sitokin kelas 1 interleukin-6
(IL-6) yang terdiri dari daerah pengikat ligan ekstraselular dan sitoplasmik.
Reseptor leptin b tidak memiliki aktivitas enzimatik intrinsik namun memberikan
signal melalui ikatan non-kovalen terkait aktivitas tirosin kinase dari famili Jak
kinase (Jak2). Terikatnya leptin mengubah konformasi dimer LRb dan
memungkinkan terjadinya aktivasi LRb intraseluler yang terkait Jak2. Jak kinase
2 yang teraktivasi kemudian memfosforilasi residu tirosin lainnya pada kompleks
LRb/Jak2 untuk memperantarai signal downstream. Pensignalan yang tergantung
tirosin kinase tersebut pada umumnya berlanjut melalui protein yang mengandung
domain khusus untuk pengikatan fosfotirosin (misal domain SH2).
14
Fosforilasi tirosin berperan sebagai penanda molekular untuk menarik protein
yang mengandung SH2 dengan isoform yang spesifik, dikenali melalui asam
amino penyusunnyan (Münzberg et al., 2005).
2.2.4 Faktor yang Pengaruhi Ekspresi Leptin
Indeks masa tubuh merupakan faktor prediktor terbaik untuk menentukan
kadar leptin dalam darah. Pasien dengan puasa 24 jam akan mengalami penurunan
kadar leptin mencapai 30% dan pasien dengan overfeeding massif akan
meningkatkan 50% kadar leptin dalam darah (Meier and Gressner, 2004). Dengan
meretriksi diet akan menurunkan kadar leptin mencapai 27,2% (CI 95%)
(Campilo et al., 2001; Houseknecht et al., 1998)
Penurunan berat badan 10% pada pasien obesitas akan menurunkan kadar
leptin serum sebesar 53%, sedangkan peningkatan 10% berat badan akan
meningkatkan 30% kadar leptin serum. Injeksi leptin akan menurunkan asupan
makanan, menurunkan berat badan, kehilangan massa lemak, dan peningkatan
metabolisme energi (Houseknecht et al., 1998). Namun pemberian leptin pada
orang dengan obesitas hanya memberikan efek yang terbatas, hal ini diduga
disebabkan oleh kemampuan kelarutan leptin untuk melewati sawar darah otak
atau gangguan pada tingkatan reseptor aktivasi atau transduksi signal (Meier and
Gressner,2004).
Kadar leptin pada perempuan (12,7 µg/L) lebih tinggi dibandingkan
laki-laki (4,6 µg/L). Kadar leptin berhubungan dengan rerata 4 Skinfod thickness (r=
0,74-0,8; p≤0,001), lingkar perut dan panggul (r=0,38;p≤0,001), etnis dan umur
(Ruhl and Everhart., 2001)
Kadar leptin meningkat oleh overfeeding, insulin, glukokortikoid,
15
suhu dingin (Houseknecht et al.,1998; Yang and Barouch., 2007; Pi-Sunyer and
Leferre’re, 1999). Dengan pemberian glukokortikoid secara in vivo dan in vitro
akan meningkatkan ekspresi dari leptin serum. Peningkatan kadar leptin akan
menghambat produksi kortisol dan sel adrenal (Houseknecht et al., 1998;
Pi-Sunyer and Leferre’re., 1999). Selain itu faktor lain yang mempengaruhi kadar
leptin yaitu fungsi hepar. Penelitian yang dilakukan Campilo et al., (2001)
memperlihatkan kadar leptin meningkat sesuai dengan perbaikan fungsi hepar
pada pasien sirosis hepatis akibat alkohol (Campilo et al., 2001).
Thiazolinediones, yang merupakan ligand dari PPARγ, dapat menghambat
dari regulasi mRNA leptin pada adiposit. Dilaporkan canonical DR+1 PPARγ
berikatan di lokasi ikatan pada -3,951 sampai -3,939 pada tikus sekuen 5’
-flanking dari gen leptin. Dalam hal ini PPARγ2 berperan menghambat peranan
dari promoter leptin dengan menghambat mediasi transkripsi dari C/EBP-α
(Houseknecht et al., 1998).
Hubungan antara leptin dengan kadar lipid atau lipoprotein masih
merupakan hal yang diperdebatkan, namun hubungan leptin yang signifikan
ditemukan dengan HDL, HDL-TG, dan HDL-apo (Pi-Sunyer and Leferre’re,
1999). Pada penelitian terhadap pasien hemodialisis ditemukan hubungan
signifikan antara leptin dengan kadar LDL-C (r=-0,29, p=0,09), dan leptin
berhubungan signifikan dengan serum trigliserida (r=0,30, p=0,078) (Nasri et al.,
2006).
2.2.5 Fungsi Neuroendokrin Leptin
Sejauh ini, terdapat 2 jalur pensignalan LRb yang terkait pada kerja leptin,
yaitu STAT3 dan jalur IRS proteinÆPI 3¢-kinase. Protein IRS 1-4 merupakan
16
(misalnya reseptor insulin dan beberapa reseptor sitokin). Pada tikus yang tidak
memiliki IRS-2 (IRS-2 --) terjadi peningkatan makan dan penurunan laju
metabolik terkait dengan peningkatan jaringan lemak dan leptin dalam sirkulasi,
mengindikasikan adanya resistensi leptin fungsional. Sehingga dikatakan bahwa
IRS-2 memiliki peran khusus dalam pensignalan anorektik. Blokade aktivitas PI
3¢-kinase diduga terkait dengan mekanisme leptin dalam menyebabkan
hiperpolarisasi atau penghambatan neuron hipotalamik LRb/NPY/AgRP. Leptin
merangsang IRS-2 terkait dengan aktivitas PI 3¢-kinase pada hipotalamus, dan
secara farmakologis blokade PI 3¢-kinase pada hipotalamus akan menyebabkan
efek anorektik secara in vivo. Aktivitas PI 3¢-kinase juga dibutuhkan untuk fungsi
sistem saraf simpatik yang diatur oleh leptin dan juga untuk fungsi leptin lainnya
pada neuroendokrin dan regulasi imun. Pensignalan LRb melalui STAT3
memperantarai sebagian kerja dari leptin, yaitu penting bagi kerja melanokortin
hipotalamik. Disregulasi pensignalan melanokortin karena perubahan NPY
berkontribusi terhadap terjadinya obesitas. Jalur yang tidak tergantung
LRbÆSTAT3 akan mengatur kontrol gula darah, reproduksi, pertumbuhan, dan
kadar NPY sebagai respon dari leptin. Disimpulkan bahwa jalur Jak2-IRS
protein-PI 3¢-kinase merupakan perantara utama kerja LRb yang tidak tergantung STAT3
(H. Münzberg, 2005). Leptin menghambat sekresi insulin yang diinduksi oleh
17
Gambar 1. Regulasi dan Fungsi Neuroendokrin Leptin (Münzberg et al., 2005)
2.3. Resistensi Leptin
Obesitas telah menjadi masalah kesehatan pada dunia Barat dan menjadi
faktor risiko mayor untuk diabetes tipe 2 dan penyakit kardiovaskuler. Setelah
ditemukannya leptin, memberikan harapan bahwa terapi leptin eksogen dapat
menginduksi rasa kenyang dan penurunan berat badan pada manusia. Hal ini
terlihat dari hasil perlakuan memberikan leptin pada tikus dengan obesitas dengan
defisiensi leptin, dapat menurunkan rasa lapar dan memperbaiki neuroendokrin
yang terganggu. Oleh karenanya leptin telah digunakan sebagai terapi pada
kondisi hiperfagia dan kelainan endokrin terkait dengan defisiensi leptin dalam
tubuh yang menyebabkan obesitas pada penderitanya. Melalui terapi leptin
eksogen, telah terlihat keberhasilannya dalam mengendalikan rasa lapar dan juga
menurunkan berat badan pada manusia. Namun dalam beberapa kasus obesitas,
didapatkan kadar leptin dalam sirkulasi darah yang meningkat, dan tidak berespon
dengan pemberian leptin eksogen. Kondisi obesitas yang tidak respon baik
terhadap leptin endogen dan eksogen ini mengembangkan gagasan adanya kondisi
18
hampir sama dengan kondisi resistensi insulin pada diabetes tipe 2 (Münzberg et
al., 2005).
2.3.1 Resistensi Leptin – Defek Transport versus Defek Signal
Beberapa penelitan yang dilakukan masih memperdebatkan validitas dari
konsep resistensi leptin lebih sebagai kondisi fisiologis dan evolusi dari signal
pencegahan terhadap kurang nutrisi dibanding sebagai kondisi nutrisi berlebih.
Sebagai contoh yang dimaksud adalah kondisi alami leptin resisten yang bersifat
sementara pada perilaku mamalia pada musim tertentu dan kehamilan, dimana
intake makanan yang sangat meningkat menyebabkan deposit lemak dan
peningkatan kadar leptin tubuh (Münzberg et al., 2005).
Penelitian tentang mediator yang krusial dari resistensi leptin saat ini
masih belum jelas, namun pendapat yang paling dapat diterima sampai saat ini
adalah kegagalan leptin dalam sirkulasi untuk mencapai target pada otak melalui
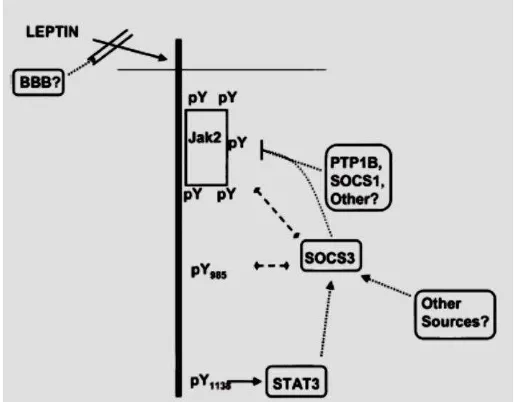
inhibisi kaskade signal LRb. Mekanismenya saat ini masih dalam perdebatan;
beberapa pendapat menyatakan bahwa pergerakan leptin kedalam otak untuk
meregulasi keseimbangan melalui mekanisme transpor spesifik yang melewati
sawar darah otak (BBB) dan atau melalui organ circumventricular (CVO)
contohnya adalah median eminence (ME). Leptin secara langsung ditranspor
melewati BBB sistem transport saturable yang dimediasi oleh LR bentuk pendek.
Pada tikus dengan defisiensi reseptor leptin, didapatkan bahwa terjadi penurunan
transport leptin sirkuler ke dalam otak. Sejalan dengan hal tersebut diatas, pada
penelitian lainnya tikus dengan defisiensi LRb namun memiliki reseptor LRs
memperlihatkan kondisi transport yang normal dari sirkulasi ke dalam otak.
19
pada tikus dengan diet-induced-obese (DIO). Walaupun diketahui signal yang
menginduksi STAT3 adalah menurun terhadap signal leptin perifer pada tikus
dengan DIO, akan tetapi injeksi sentral leptin dapat memperbaiki aktivasi STAT3.
Hal ini semakin menguatkan bahwa sulitnya leptin perifer mencapai untuk
selanjutnya mengaktifkan hipotalamus adalah salah satu faktor penyebab
resistensi leptin. Beberapa investigasi berusaha memeriksa mekanisme penurunan
signal LRb pada sel kultur dan in vivo. Pada akhirnya didapatkan dua data yang
mempengaruhi penghambatan regulasi LRb, yaitu SOCS3 dan protein tyrosine
phospatase, PTP1B (Bjørbæk et al.,1998).
Overekspresi dari masing-masing protein pada kultur sel mempengaruhi
signal leptin. Tikus yang tidak memiliki reseptor PTP1B selain memiliki sifat
insulin sensitif, juga kurus dan bersifat hipofagia tanpa ditemukannya kelainan
neuroendokrin lainnya (Bjørbæk et al.,1998).
Gambar 2. Signal LRb (Münzberg et al., 2005)
Peranan SOCS3 dalam menghambat LRb secara in vivo terlihat dari
beberapa penelitian yang menunjukkan peningkatan kadar SOCS3 pada tikus
20
yang lebih kurus dan sinsitif terhadap leptin pada tikus yang kekurangan SOCS3
dalam system sarap pusatnya. Data menunjukkan bahwa PTP1B dan SOCS3 yang
fisiologis penting untuk mengatur signal LRb, meskipun seberapa kuat potensinya
masih belum diketahui (Van Heek, 1997; Bjørbæk et al.,1998) .
2.3.2. Telaah Anatomi Resistensi Leptin
Distribusi anatomi dari resistensi leptin baru-baru ini diselidiki pada tikus
DIO dengan memeriksa aktivasi signal leptin perifer terhadap STAT3. Baik dari
imunohistokimia maupun pemeriksaan mikroskopis inti hipotalamus, terlihat jelas
bahwa signal leptin dilemahan pada ARC, sedangkan pada hipotalamus dan ekstra
hipotalamus masih tetap sensitif terhadap leptin. Selain itu lokasi resistensi yang
spesifik itu erat hubungannya dengan peningkatan ekspresi SOCS3 pada ARC,
yang semakin menunjukkan peran ekpresi SOCS3 pada pathogenesis resistensi
leptin (Münzberg at al., 2005).
2.4. Hormon Inkretin
2.4.1 Penemuan Hormon Inkretin
Byaliss dan Starling menemukan secretin pada 1902, saat itu berkembang
teori bahwa saluran pencernaan mampu merangsang pelepasan hormon pancreas
melalui sinyal yang dilepaskan sebagai respon adanya nutrisi di saluran
pencernaan. Pada 1906, Moore mencoba menawarkan kemungkinan
menyembuhkan diabetes dengan menggunakan ekstrak duodenum. Zunz dan
Labare menyambut ide ini dengan melakukan serangkaian percobaan dengan
ekstrak usus, yang mampu membuat hewan percobaannya menjadi hipoglikemia.
Mereka memperkenalkan istilah Inkretin untuk substansi kimia yang terkandung
21
dimulai setelah ditemukannya radioummunoassay tahun 1960 oleh Yalow dan
Berson (Girard, 2008). Pada 1969, Uger dan Eisentraut memberikan nama
“Entero Insular Axis” untuk menggambarkan hubungan antara saluran pencernaan
dengan pancreas (Green & Flatt, 2007). Creautzfelt memperkirakan aksis ini
melibatkan beberapa komponen diantaranya nutrisi, serat saraf, dan sinyal yang
signifikan dari usus kepada pancreas yang mampu merangsang pengeluaran
beberapa hormon seperti; insulin, glukagon dan somatostatin. Lebih jauh lagi
Creutzfelt memberikan batas pada aksis entero insular sebagai suatu proses yang
melibatkan nutrisi pada saluran cerna, khususnya karbohidrat. Dimana akan
dilepaskannya suatu sinyal pada taraf fisiologis akan menstimulasi pelepasan
insulin saat kadar gula darah mulai meningkat (Holst et al., 2009).
Mengacu pada batasan Cruetzfelt, saat itu GIP lah yang dapat disebut
inkretin. Gastric Inhibitory Polypeptide saat itu dikenal sebagai enterogastron
oleh karena mampu menghambat pelepasan asam lambung sebagai akibat
kehadiran lemak di lumen saluran pencernaan (Girard, 2008). Dupre pada 1973
mengemukakan pandangan bahwa GIP tidak hanya merupakan suatu
enterogastron tetapi juga suatu inkretin. Hal ini didasarkan pada percobaan yang
dilakukannya, dimana peningkatan aktivitas insulin lebih bermakna pada
pemberian GIP dan glukosa dibandingkan glukosa saja. Lebih jauh lagi ditemukan
bahwa GIP yang timbul sebagai hasil dari konsumsi lemak tidak akan
menimbulkan pengeluaran insulin bila tidak disertai kehadiran glukosa. Kondisi
ini sebenarnya merupakan efek protektif terhadap pelepasan insulin dimana efek
hipoglikemi tidak akan muncul. Kondisi inilah pula yang menyebabkan selain
22
asam lambung. GIP juga dikenal sebagai Glucose-dependent insulinotropic
polypeptide. Sehubungan dengan fungsinya sebagai enterogastron dan inkretin,
GIP banyak ditemukan pada daerah tengah dari villus duodenum, serta sangat
sedikit pada jejunum (Salvatore et al.,2007).
Gastric Inhibitory Polypeptide merupakan inkretin pertama yang
ditemukan. Tetapi para ahli pada tahun 1970, meyakini adanya inkretin kedua
setelah GIP. Hal ini dipertimbangkan dari adanya sekresi hormon pancreas yang
menyerupai respon inkretin pada saluran cerna saat hewan percobaan diberikan
ekstrak usus yang telah dimurnikan dari GIP. Penelitian dilakukan pada anglefish,
dimana ditemukan adanya suatu glucose related peptide (GRP) sebagai glucagon
related peptide yang dikodekan pada gen hewan ini. secara genetik GRP memiliki
homologi yang kuat dengan GIP. Glucose related peptide diyakini merupakan
inkretin berdasarkan analisa mRNA yang sesuai pada pancreas dan saluran
pencernaan Anglefish. Disamping itu ternyata ditemukan bahwa mRNA yang
dikloning dari manusia dan tikus identik dengan mRNA pancreas Anglefish.
Setelah adanya temuan ini para ahli semakin bersemangat mengidentidikasi
adanya inkretin selain GIP. Berdasarkan analisa cDNA preproglucagon pada
mamalia termasuk manusia. Ternyata ditemukan homologi pada cDNA GRP
Anglefish dan produk gen preproglucagon manusia, yang sekarang dikenal
sebagai GLP-1. Maka disimpulkanlah bahwa GLP-1 merupakan inkretin kedua
setelah GIP (Theodorakis et al., 2011).
Gastric Inhibitory Polypeptide merupakan suatu hormon yang dilepaskan
oleh sel K duodenum. Sel K terletak terbanyak pada awal duodenum. Pelepasan
23
disintesis dan dilepaskan oleh sel enteroendokrin, sel L, yang terletak pada distal
ileum dan usus besar. Sel L merupakan suatu sel dengan banyak granula sekretin
pada daerah basal lamina. Sel L merupakan sel terbanyak kedua setelah sel
enterochromafin. Sel L banyak terdapat pada distal jejunum, ileum, colon dan
terbanyak di rectum. Sel L ditemukan pada fetus manusia pada usia gestasi 8
minggu pada ileum serta 12 minggu pada colon (Theodorakis et al., 2011).
Gastric Inhibitory Polypeptide merupakan suatu peptida aktif 42 asam
amino dengan berat molekul 4984 Da. Sedangkan GLP-1 merupakan suatu
peptida non aktif 37 asam amino dengan berat molekul 3298 Da, dimana terdapat
enam asam amino pada akhir N-terminal. Bentuk aktif dari GLP-1 adalah suatu
gugus 17-36 amida. Konsentrasi kedua inkretin ini dalam plasma adalah 5-10
Pmol/L dan meningkat dalam 5-15 menit dari intake glukosa pada makanan.
GLP-1 memiliki dua bentuk molekul beredar yaitu GLP-GLP-17-37 dan GLP-GLP-17-36 amida.
Dalam sirkulasi, GIP dan GLP-1 dapat menurun dengan cepat sebagai akibat
metabolisme serta inaktivasi oleh enzim dipeptidyl peptidase IV (DPP-IV) yang
kemudian dikeluarkan lewat ginjal, meskipun demikian eksresi GLP-1 tidak
mengalami dampak yang bermakna pada penderita gangguan ginjal ringan ( GFR
≥ 60) (Jacobsen et al, 2009). Waktu paruh kedua inkretin ini sekitar 1-2 menit
untuk GLP-1 serta 5-7 menit untuk GIP (Girard, 2008).
2.5. GLP-1
Proglukagon terdiri dari dua Glucagon like peptide (GLP-1 dan GLP-2)
yang disekresi oleh sel enteroendokrin pada usus kecil dan usus besar. Glucagon
like peptide-1 merendahkan kadar glukosa darah pada diabetes mellitus tipe 2 dan
24
inhibisi pengosongan lambung, dan inhibisi sekresi glukagon. Glucagon like
peptide -1 juga mengatur sintesis glikogen pada jaringan adiposa dan otot.
Glucagon like peptide -1 diproduksi pada jaringan otak juga. Durasi kerja GLP-1
adalah singkat dikarenakan adanya enzim dipeptidil peptidase 4 (DPP-IV) yang
menguraikan GLP-1 pada ujung NH2 (Vilsbøll, 2001).
Terdapat penurunan respon GLP-1 postprandial pada orang dengan
obesitas. Dengan penurunan berat badan, respon GLP-1 membaik. Insulin
postprandial dan respon GIP memegang peranan penting pada regulasi napsu
makan jangka pendek (Drucker, 1998).
Semakin banyak bukti yang menunjukkan bahwa GLP-1 disebut bukan
hanya sebagai mediator yang berfungsi memperlambat motilitas usus saja, namun
juga menginduksi rasa puas setelah makan. Memberikan infus GLP-1 pada
manusia memperlihatkan efek meningkatnya rasa kenyang dan puas setelah
makan. Efek ini kemungkinan disebabkan karena memperlambat pengosongan
lambung, ditambah dengan adanya efek ke sistem saraf pusat untuk
mempengaruhi regulasi rasa lapar. Sebelumnya telah terbukti bahwa pada obesitas
terjadi penurunan respon dari GLP-1 postprandial, sejalan dengan hasil penelitian
lainnya yang menyebutkan terjadi penurunan sekresi produk proglukagon pada
subjek dengan obesitas. Efek penurunan berat badan terhadap induksi makanan
setelah diberikan GLP-1 diteliti terbatas pada subjek yang telah melakukan
prosedural pembedahan bypass jejunoileal. Hasil dari penelitian tersebut
memperlihatkan terjadi peningkatan GLP-1 pada subjek tersebut dibandingkan
pada subjek yang kurus. Prosedur bypass jejunoileal dapat mempengaruhi
pelepasan GLP-1, sehubungan dengan tereksposenya ileum terminalis dengan
25
Glucagon like peptide -1 dilepaskan oleh sel L dari usus, merupakan
insulin secretagogue yang potent. Regulasi sekresi GLP-1 telah dideskripsikan
baik secara in vivo dan in vitro pada berbagai spesies binatang, namun sangat
sedikit data dari sel manusia. Salah satu penelitian yang melihat hubungan
regulasi sekresi GLP-1 pada NCI-H716 sel usus halus manusia, menunjukkan
bahwa secara homogeny sel ini memproduksi 16,8 pmol GLP-1/mg protein
dengan pelepasan basal 4,2% setelah periode inkubasi selama 2 jam. Nutrien
seperti asam pamitat, asam oleat dan daging yang terhidrolisat menstimulasi
sekresi GLP-1 pada dosis tertentu, seperti halnya pada agonis charbacol dan
neuromediator gastrin-release peptide. Selama menstimulasi pelepasan GLP-1,
gastrin-releasing peptide, seperti ionomycin, meningkatkan jumlah calcium
intraseluler. Aktifator PKA dan PKC juga dapat meningkatkan sekresi GLP-1
pada sel NCI-H716. (Raylene, 2001)
Hipersekresi faktor insulinotropik seperti GLP-1 dan GIP telah
dipostulatkan sebagai kondisi hiperinsulinemia pada obesitas. Penelitian yang
dilakukan pada enam wanita kurus yang dipasangkan dengan enam wanita gemuk
pada usia yang sama, diperiksa respon kadar hormon inkretin, glukosa plasma,
dan serum trigliserida pada menit ke 180 setelah mendapatkan asupan karbohidrat
oral dan makan berlemak. Hasil dari penelitian ini menunjukkan penurunan
sekresi GLP-1 pada subjek gemuk setelah mendapatkan asupan karbohidrat oral
dibandingkan pada subjek penelitian kurus. Akan tetapi tidak terdapat perbedaan
kadar GLP-1 bermakna pada kedua subjek penelitian setelah mendapatkan asupan
makanan berlemak. Sementara kadar GIP tidak ada perbedaan bermakna pada
kedua subjek penelitian baik dengan asupan makanan berkabohidrat maupun