LAKTAMASE PADA ISOLAT KLINIS YANG TERGOLONG MULTIPLE-DRUG RESISTANT Pseudomonas aeruginosa (MDRPA)
SKRIPSI
MARVELYN CORINTHIA WIJAYA 150805064
PROGRAM STUDI BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
MEDAN 2020
LAKTAMASE PADA ISOLAT KLINIS YANG TERGOLONG MULTIPLE-DRUG RESISTANT Pseudomonas aeruginosa (MDRPA)
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
MARVELYN CORINTHIA WIJAYA 150805064
PROGRAM STUDI BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
MEDAN 2020
DETEKSI GEN RESISTEN KARBAPENEM
blaIMP,
blaNDM-1,
bla
SPM-1,
blaVIM-2 PENYANDI ENZIM METALLO β-
LAKTAMASE PADA ISOLAT KLINIS YANG TERGOLONG MULTIPLE-DRUG RESISTANT Pseudomonas aeruginosa (MDRPA)
SKRIPSI
Saya menyatakan bahwa skripsi ini adalah hasil karya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
DETEKSI GEN RESISTEN KARBAPENEM
blaIMP,
blaNDM-1,
bla
SPM-1,
blaVIM-2 PENYANDI ENZIM METALLO β-
LAKTAMASE PADA ISOLAT KLINIS YANG TERGOLONG MULTIPLE-DRUG RESISTANT Pseudomonas aeruginosa (MDRPA)
ABSTRAK
Pseudomonas aeruginosa merupakan patogen oportunistik yang menyebabkan infeksi pasien yang mengalami immune-compromised, fibrosis sistik, infeksi saluran urinaria, pneumonia, luka bakar, luka pasca operasi, khususnya yang ada di rumah sakit. Penggunaan antibiotik golongan karbapenem sebagai antibiotik terakhir untuk pengobatan infeksi akibat P. aeruginosa secara berlebihan dan menyebabkan Multi- Drug Resistant (MDR). MDR disebabkan karena adanya gen penyandi enzim metallo β-laktamase yang menghidrolisis enzim β-laktamase yaitu IMP, NDM-1, SPM-1 dan VIM-2. Penelitian ini menggunakan jenis penelitian deskriptif kualitatif yaitu untuk mendeteksi gen resisten blaIMP, blaNDM-1, blaSPM-1, blaVIM-2 pada isolat klinis bakteri P. aeruginosa yang resisten terhadap karbapenem dari RS USU Medan dan RSUP H. Adam Malik Medan dengan teknik multipleks PCR dan mengetahui pola resistensi antibiotikanya dengan Vitek 2 Compact. Hasil penelitian menunjukkan bahwa dari total 20 sampel, terdapat 1 sampel (5%) isolat bakteri ESBL, 10 sampel (50%) isolat bakteri penisilinase, 5 sampel (25%) isolat bakteri sefalosporinase dan 4 sampel (20%) isolat bakteri karbapenemase. Isolat bakteri P.
aeruginosa yang dideteksi gen resistennya disertai dengan kontrol positif berupa isolat PU08 dan kontrol negatif berupa P. aeruginosa ATCC 27853 membawa gen
blaIMP ada 19 sampel (95%). Gen blaNDM-1 ada sebanyak 8 sampel (40%), gen
blaSPM-1 ada 14 sampel (70%) dan gen blaVIM-2 ada sebanyak 15 sampel (75%).
Beberapa hasil uji antimikroba menunjukkan data yang berbeda dengan hasil PCR yang diasumsikan bahwa isolat memiliki gen yang multiple dalam rangka melakukan resistensi pada gen yang diekspresikan sehingga menghasilkan protein yang banyak.
Hasil pengujian antibiotik yang memiliki sensitivitas diatas 80% yaitu gentamisin, amikasin, tetrasiklin dan meropenem sehingga dapat digunakan untuk terapi antibiotik.
Kata Kunci : Gen resisten, Karbapenem, Metallo β-laktamase, Pseudomonas aeruginosa
DETECTION OF CARBAPENEM GENE RESISTANT
blaIMP,
bla
NDM-1,
blaSPM-1,
blaVIM-2 ENCODING METALLO β-
LACTAMASE ENZYME IN CLINICAL ISOLATES AND CLASSIFIED AS A MULTIPLE-DRUG RESISTANT Pseudomonas
aeruginosa (MDRPA)
ABSTRACT
Pseudomonas aeruginosa was an opportunistic pathogen that caused infection in immune-compromised patient, cystic fibrosis, urinaria tracts infection, pneumonia, burn wound, post-operation wound, especially in the hospital. Using the carbapenem antibiotic’s group as a last antibiotic line for the treatment that caused by P.
aeruginosa were overused and became Multi-Drug Resistant (MDR). Appearing of MDR were caused by IMP, NDM-1, SPM-1 dan VIM-2 that encoding metallo β- lactamase enzyme. This is a qualitative descriptive type of research for the detection of blaIMP, blaNDM-1, blaSPM-1, blaVIM-2 resistant gene among the carbapenem resistant P. aeruginosa clinical isolates from RS USU Medan and RSUP H. Adam Malik Medan by analysing in a multiplex PCR technique and for the antimicrobial susceptibility pattern by Vitek 2 Compact. The results showed in total of 20 samples, there were 1 sample (5%) categorized as a ESBL isolate, 10 samples (50%) as a penicillinase isolate, 5 samples (25%) as a cephalosporinase isolate and last 4 samples (20%) as a carbapenemase isolate. The detection of P. aeruginosa bacteria isolate resistant gene were accompanied with PU08 isolate as a positive control and P. aeruginosa ATCC 27853 as a negative control that carrying total of 19 samples (95%) blaIMP gene. Eight samples (40%) of blaNDM-1 gene, 14 samples (70%) of
blaSPM-1 gene and 15 samples (75%) of blaVIM-2 gene. Some of the antimicrobial test results shows the different data with the PCR result which are assumed that had a multiple gene that expressing the resistance genes in order to produce a lot of proteins. The antibiotic result that have the excess of 80% sensitivity test results are gentamicin, amikacin, tetracycline and meropenem so they can be used in a antibiotic therapy.
Key Words : Carbapenem, Gene resistant, Metallo β-lactamase, Pseudomonas aeruginosa
PENGHARGAAN
Puji dan syukur penulis panjatkan atas kehadirat Tuhan Yang Maha Esa karena kasih dan anugerah-Nya sehingga penulis dapat menyelesaikan skripsi yang berjudul “Deteksi Gen Resisten Karbapenem blaIMP, blaNDM-1, blaSPM-1, blaVIM- 2 Penyandi Enzim Metallo β-Laktamase pada Isolat Klinis yang Tergolong Multiple-Drug Resistant Pseudomonas aeruginosa (MDRPA)”. Skripsi ini dibuat sebagai salah satu syarat untuk meraih gelar Sarjana Sains pada Fakultas MIPA USU Medan.
Terima kasih penulis sampaikan kepada Bapak Prof. Dr. Dwi Suryanto, M.Sc selaku Dosen Pembimbing yang telah banyak meluangkan waktu, memberikan masukan selama pelaksanaan penelitian hingga penyusunan skripsi ini. Ucapan terima kasih juga penulis ucapkan kepada Bapak Prof. Erman Munir, M. Sc selaku Dosen Penguji I dan Ibu Dr. Saleha Hannum, S. Si., M. Si selaku Dosen Penguji II yang telah banyak memberikan masukan dan arahan dalam penyempurnaan penulisan skripsi ini. Terima kasih juga penulis sampaikan kepada Ibu Dr. Saleha Hannum, S. Si., M. Si selaku Ketua Program Studi Biologi dan juga Dosen Pembimbing Akademik yang telah banyak memberikan saran dan nasehat selama perkuliahan serta Bapak Riyanto Sinaga, S. Si., M. Si selaku Sekretaris Program Studi Biologi FMIPA USU. Kepada seluruh Bapak dan Ibu Dosen Program Studi Biologi FMIPA USU yang telah memberikan banyak ilmu yang sangat bermanfaat bagi penulis. Kepada Bang Ewin, Kak Winda, Kak Siti, Bang Yudha dan Kak Pia selaku staff pegawai Program Studi Biologi FMIPA USU.
Ucapan terima kasih terbesar penulis sampaikan kepada kedua orang tua penulis, Kurniadi Lim dan Frederika Sumiwaty yang telah memberikan doa, dukungan dan pengorbanan yang begitu besar serta segala bantuan baik moril maupun materil hingga skripsi ini selesai. Penulis mengucapkan terima kasih juga kepada kakak dan adik penulis Melva Claribel Wijaya, Devra Christabel Wijaya dan Marvella Cordelia Wijaya atas segala dukungan selama penelitian.
Ucapan terima kasih penulis sampaikan kepada dr. R. Lia Kusumawati, M.S., Sp.MK(K)., Ph.D selaku Kepala Instalasi Mikrobiologi Klinis RS USU Medan
dan dr. Rina Yunita, Sp.MK selaku Kepala Instalasi Mikrobiologi Klinis RSUP H.
Adam Malik yang telah memberikan nasehat dan saran serta Kepada Bang Mirzan Hasibuan, M.Si dan Kak Tina yang telah banyak membantu penulis dalam melaksanakan penelitian di RS USU dan RSUP H. Adam Malik Medan.
Ucapan terima kasih terkhusus kepada teman seperjuangan Ruth Veronika Marpaung yang telah banyak membantu dan juga berbagi suka maupun duka dengan penulis dalam melaksanakan penelitian. Terima kasih Cahjani Olisa yang walaupun sedang long distance friendship tapi tidak pernah bosan mendengarkan setiap keluh kesah dan mendoakan penulis untuk menyelesaikan skripsi ini. Terima kasih juga kepada Juwita Esterina, Betriana, Jesica Simanullang yang sangat membantu penulis dalam pelaksanaan penelitian, kepada PKBKB’15 serta teman-teman satu stambuk Spirit of Youth (SOY’15) yang telah banyak memberikan begitu banyak tawa dan kenangan selama masa perkuliahan dan sulit untuk dilupakan. Selanjutnya kepada abang dan kakak senior Ko Aditiya, Bang Boby, Bang Sahreza, Bang Johannes, Kak Iradani, Bang Irfan, Bang Randi, Ko Robert, Kak Nurmetti, terima kasih atas bantuan selama penelitian dan masa perkuliahan. Kepada rekan-rekan Asisten Laboratorium Mikrobiologi (Ando, Novita, Wita, Jesica, Anna, Edy, Diki, Nusaibah dan Cege), terima kasih atas dukungan dan kerjasamanya. Penulis juga ingin mengucapkan terima kasih kepada kakak asuh Priya Darsini, S. Si yang telah banyak membantu selama perkuliahan, saudara asuh Sry Rahayu “Square” Panjaitan yang lebih dulu S.Si dan selalu men-support penulis dan juga adik asuh terbaik Gitta, Getta, Suri, Theresia dan Noky serta adik-adik 2016 dan 2017.
Tiada gading yang tak retak, tiada hal yang sempurna di dunia ini tanpa kerendahan hati. Penulis menyadari masih banyaknya kekurangan dalam penyusunan skripsi ini. Kritik dan saran yang membangun sangat diharapkan demi kesempurnaan skripsi ini sehingga bisa bermanfaat bagi siapa saja yang membutuhkan. Sabbe Satta Bhavantu Sukhitatta, Semoga Semua Makhluk Hidup Berbahagia.
DAFTAR ISI
Halaman
LEMBAR PENGESAHAN i
ABSTRAK ii
ABSTRACT iii
PENGHARGAAN iv
DAFTAR ISI vi
DAFTAR TABEL viii
DAFTAR GAMBAR ix
DAFTAR LAMPIRAN x
DAFTAR SINGKATAN xi
BAB 1 PENDAHULUAN 1
1.1 Latar Belakang 1
1.2 Permasalahan 3
1.3 Tujuan Penelitian 4
1.4 Manfaat Penelitian 4
BAB 2 TINJAUAN PUSTAKA 5
2.1 Pseudomonas aeruginosa 5
2.2 Multiple-Drug Resistant Pseudomonas aeruginosa 6
2.3 Antibiotik 7
2.4 Resistensi Antibiotik 8
2.5 Extended Spectrum Beta Lactamase 9
2.6 Karbapenemase 11
BAB 3 METODE PENELITIAN 13
3.1 Tempat dan Waktu 13
3.2 Metode Penelitian 13
3.3 Preparasi dan Pengoleksian Sampel Klinis 13 3.4 Identifikasi Bakteri dan Uji Resistensi Tehadap 13
Antibiotik
3.5 Deteksi Gen blaIMP, blaNDM-1, blaSPM-1, blaVIM-2 14
3.5.1 Isolasi Genom DNA 14
3.5.2 Pengukuran Kemurnian DNA 15
3.5.3 Deteksi Gen 15
3.5.4 Elektroforesis 16
3.6 Analisis Data 17
BAB 4 HASIL DAN PEMBAHASAN 18
4.1 Karakteristik Subjek Penelitian 18
4.1.1 Jenis Kelamin Pasien MDRPA di RS USU Medan 18 Dan RSUP H. Adam Malik Medan
4.1.2 Distribusi MDRPA dari Berbagai Spesimen Klinis 19 Di RS USU Medan dan RSUP H. Adam Malik
Medan
4.1.3 Distribusi MDRPA Berdasarkan Lokasi Perawatan 21 Pasien di RS USU Medan dan RSUP H. Adam
Malik Medan
4.2 Uji Fenotipe MDRPA dengan Vitek 2 Compact 22 4.3 Hasil Pengukuran Kemurnian dan Konsentrasi DNA 28
4.4 Uji Genotipe MDRPA dengan PCR 29
4.4.1 Gen blaIMP 31
4.4.2 Gen blaNDM-1, blaSPM-1, blaVIM-2 33
BAB V KESIMPULAN DAN SARAN 34
5.1 Kesimpulan 34
5.2 Saran 34
DAFTAR PUSTAKA 35
LAMPIRAN 41
DAFTAR TABEL
Nomor Tabel
Judul
Halaman
3.1 Primer Spesifik Gen blaIMP, blaNDM-1, blaSPM-1,
blaVIM-2 15
3.2 Optimasi Kondisi Reaksi dan Siklus PCR untuk
Gen blaIMP, blaNDM-1, blaSPM-1, blaVIM-2 16 4.1 Distribusi Subjek Penelitian Berdasarkan Jenis
Kelamin Penderita MDRPA 18
4.2 Asal Spesimen MDRPA 19
4.3 Distribusi MDRPA Berdasarkan Lokasi
Perawatan 21
4.4 Persentase Fenotipe MDRPA 22
4.5 Hasil Fenotipe MDRPA 23
4.6 Pola Data Resistensi terhadap Antibiotik 24 4.7 Persentase Resistensi terhadap Antibiotik 25
4.8 Kemurnian dan Konsentrasi DNA 28
4.9 Hasil Genotipe MDRPA 30
4.10 Persentase Genotipe blaIMP, blaNDM-1, blaSPM-1,
blaVIM-2 30
DAFTAR GAMBAR
Nomor Gambar
Judul Halaman
2.1 Resistensi Antibiotik pada Pseudomonas aeruginosa
6
2.2 Ilustrasi dari Bakteri Konjugasi 9
4.1 Pola Pita DNA Gen blaIMP pada Isolat MDRPA 32 4.2 Pola Pita DNA Gen blaNDM-1, blaSPM-1 dan
blaVIM-2 pada Isolat MDRPA 33
DAFTAR LAMPIRAN
Nomor Lampiran
Judul
Halaman
1. Komposisi Larutan Stok EDTA 0,5 M pH 8.0
dan Buffer TAE 41
2. Data Subjek Penelitian Pasien MDRPA 42
3. Alur Penelitian 43
4. Alur Kerja Alat Vitek 2 Compact 44
5. Alur Kerja Isolasi DNA 45
6. Dokumentasi Isolat Klinis Bakteri Pseudomonas
aeruginosa 46
7. Dokumentasi Alat dan Bahan Penelitian 50 8. Ethical Clearance dan Izin Penelitian 53
DAFTAR SINGKATAN
AK = Amikasin
AMC = Ampisilin AMX = Amoksilin
AST = Antimicrobial Susceptibility Testing AZT = Aztreonam
CAZ = Ceftazidime CIP = Ciprofloxacin CRO = Ceftriaxone CTX = Cefotaxime
DNA = Deoxy Ribonucleic Acid
EDTA = Ethylene Diamine Tetra Acetic Acid ESBL = Extended Spectrum β-lactamase
FEP = Cefepime
FOS = Fosfomisin
GEN = Gentamisin
IMI = Imipenem
IMP = Imipenem- Resistant Pseudomonas
GN = Gram Negative
HCl = Hydrogen Chloride LEV = Levofloxacin
MBL = Metallo β-laktamase
MDRPA = Multiple Drug Resistant Pseudomonas aeruginosa MEM = Meropenem
NaCl = Natrium (Sodium) Chloride NDM = New Delhi Metallo β-Lactamase PCR = Polymerase Chain Reaction
R = Resistant
S = Sensitive
SAM = Sulbaktam + Ampisilin SCF = Sulbaktam + Sefoperazon SPM = Sao Paulo Metallo β-Lactamase TAE = Tris Acetate EDTA
TGC = Tigesiklin UV = Ultra Violet
V = Volt
VIM = Verona Integron-Encoded Metallo β-Lactamase bla = beta-lactamase
bp = base pair
gr = gram
mA = mili-Ampere
ml = mili liter
pH = point of Hidrogen µl = micro liter
BAB 1 PENDAHULUAN
1.1 Latar Belakang
Antibiotik diberikan kepada manusia untuk pengobatan dan pencegahan pada penyakit infeksi. Kehadiran antibiotik bukan hanya digunakan secara berlebihan namun juga digunakan secara tidak tepat yaitu sekitar 20% - 50% dari seluruh antibiotik yang digunakan. Sekitar 70% bakteri yang menyebabkan infeksi pada rumah sakit resisten terhadap sedikitnya satu antibiotik yang biasanya banyak digunakan untuk pengobatan (Bisht et al., 2009).
Bakteri yang resisten terhadap satu atau lebih antibiotik telah dinamakan
“superbugs”. WHO menjelaskan bahwa “resistensi antimikrobial terjadi saat mikroorganisme seperti bakteri, virus, fungi dan parasit yang awalnya bersifat menyembuhkan infeksi, sekarang menjadi tidak efektif. Saat mikroorganisme menjadi resisten pada kebanyakan antimikrobial, mereka akan menjadi “superbugs”
(Fymat, 2017). Menurut Kraker et al (2016), superbugs diprediksi akan membunuh 10 juta orang dalam setahun pada tahun 2050 bila dunia tidak bertindak. Angka tersebut menunjukkan bahwa satu orang akan mati setiap tiga detik.
Menurut National Institute of Allergy and Infectious Disease pada tahun 2011, penyebab resistensi antibiotik adalah mutasi genetik dan transfer genetik antar bakteri, sehingga bakteri menjadi lebih kebal terhadap antibiotik. Beberapa faktor yang menyebabkan bakteri resisten terhadap antibiotik adalah penggunaan antibiotik yang tidak sesuai dari jangka terapi yang dianjurkan, diagnosis yang kurang tepat sehingga antibiotik yang diberikan kurang tepat, serta meningkatnya penggunaan antibiotik di rumah sakit dan kecenderungan antibiotik dibeli bebas atau tanpa resep dokter (Zakharian et al., 2018).
Pada tahun 2006, The Antimicrobial Availability Task Force (AATF) dari The Infectious Disease Society of America memberikan daftar patogen yang resisten terhadap antibiotik. Enam patogen yang telah teridentifikasi sebagai “prioritas utama”
untuk diperhatikan, yaitu Acinetobacter baumanii, Aspergillus sp., Extended Spectrum Beta-Lactamase (ESBL) - Enterobacteriaceae, Vancomycin Resistant
Enterococcus faccium, Pseudomonas aeruginosa dan Methicillin Resistant Staphylococcus aureus (MRSA) (Stockert and Mahfouz, 2012).
Infeksi nosokomial merupakan infeksi yang sumber penyakitnya berasal dari rumah sakit. Umumnya infeksi nosokomial didapatkan setelah 48 jam masa perawatan di rumah sakit. Infeksi nosokomial yang disebabkan oleh P. aeruginosa menyebabkan kematian terbesar akibat munculnya strain Multi-Drug Resistant (MDR) (Moosavian and Rahimzadeh, 2015). Mikroorganisme ini juga merupakan penyebab 10 - 20% infeksi nosokomial. P. aeruginosa merupakan patogen oportunistik yang menyebabkan penyakit serius pada pasien yang mengalami immune-compromised. Kontak fisik merupakan penularan yang paling sering terjadi pada bakteri yang memproduksi Extended Spectrum Beta-Lactamases (ESBLs).
ESBL merupakan sekelompok enzim yang paling banyak diproduksi oleh bakteri basil gram negatif yang bertanggung jawab terhadap resistensi untuk semua antibiotik β-laktam kecuali sefamisin dan karbapenem (Bukhari et al., 2016).
Antibiotik β-laktam merupakan antibiotik utama yang digunakan untuk terapi anti-pseudomonas. Mekanisme dari β-laktam yaitu dengan menempel pada dinding sel transpeptida (Penicillin-Binding Proteins [PBP]) dan menghalangi biosintesis peptidoglikan. Terjadinya resistensi terhadap β-laktam biasanya dikarenakan inaktivasi antibiotik oleh enzim β-laktamase yaitu adanya perubahan permeabilitas dinding sel dan modifikasi PBP. Empat golongan utama antibiotik dari β-laktam yaitu penisilin, sefalosporin, monobaktam dan karbapenem (Alvarez-Ortega et al., 2010).
Antibiotik yang paling efektif yang dapat digunakan untuk mengobati penyakit yang disebabkan oleh P. aeruginosa adalah karbapenem (meropenem, imipenem, doripenem dan ertapenem) yang berspektrum luas. Saat ini, penggunaan antibiotik karbapenem meningkat bersamaan dengan meningkatnya prevalensi bakteri yang MDR. Resistensi terhadap karbapenem sering dikaitkan dengan produksi Metallo β-Laktamase (MBL) (Moosavian and Rahimzadeh, 2015). MBL digolongkan ke dalam Ambler kelas B β-laktamase berdasarkan aktivitas enzimatis yang memerlukan ion Zn sebagai kofaktor untuk menghidrolisis antibiotik β-laktam termasuk karbapenem. Ada lebih dari 9 tipe MBL yang menyandi enzim karbapenemase dimana gen yang telah dilaporkan seluruh dunia adalah Imipenem-
Resistant Pseudomonas (IMP), Verona Integron-Encoded Metallo β-Lactamase (VIM), Sao Paulo Metallo β-Lactamase (SPM) dan New Delhi Metallo β-Lactamase (NDM) (Rios et al., 2018). Penelitian yang dilakukan oleh Latifah (2014) di RSCM Jakarta, yaitu sebanyak 20 isolat klinis P. aeruginosa yang dideteksi gen blaIMP,
blaNDM-1, blaVIM-2. Gen IMP ditemukan sebanyak 4 isolat (20%), gen blaVIM-2 sebanyak 1 isolat (9%) dan gen blaNDM-1 ditemukan sebanyak 2 isolat (10%).
Sedangkan belum ditemukan penelitian mengenai deteksi gen blaSPM-1 di Indonesia.
Pada penelitian yang dilakukan oleh Inacio et al (2014) di Rumah Sakit Belo Horizonte, Brazil bahwa sebanyak 35 isolat klinis P. aeruginosa (87,5%) dari total 40 isolat dideteksi gen blaSPM-1.
Cara untuk mengetahui keberadaan suatu gen diperlukan suatu teknik molekuler dimana salah satunya yaitu Polymerase Chain Reaction (PCR). PCR adalah teknik molekuler yang mengamplifikasi urutan nukleotida yang menjadi target (Jamilah, 2009). Berdasarkan kemampuan teknik PCR dalam mengamplifikasi urutan nukleotida pada gen tertentu sebagai target, maka gen blaIMP, blaNDM-1,
blaSPM-1, blaVIM-2 yang merupakan gen resisten terhadap karbapenemase pada P.
aeruginosa dapat pula dideteksi. Dengan mendeteksi keberadaan gen blaIMP,
blaNDM-1, blaSPM-1, blaVIM-2, maka keputusan mengenai pemilihan antibiotik yang tepat dapat segera dilakukan.
1.2 Permasalahan
Penelitian secara molekuler mengenai gen resisten blaIMP, blaNDM-1,
blaVIM-2 pada isolat klinis bakteri P. aeruginosa yang resisten terhadap karbapenem belum pernah dilakukan sebelumnya pada rumah sakit di kota Medan dan gen resisten blaSPM-1 di Indonesia, sehingga perlu dilakukan penelitian tentang deteksi keberadaan gen blaIMP, blaNDM-1, blaSPM-1, blaVIM-2 khususnya pada isolat klinis bakteri P. aeruginosa yang resisten terhadap karbapenem dan bagaimana pola resistensi antibiotikanya.
1.3 Tujuan Penelitian
Adapun tujuan dari penelitian ini adalah:
1. Untuk mendeteksi adanya gen resisten blaIMP, blaNDM-1, blaSPM-1, blaVIM-2 pada isolat klinis bakteri P. aeruginosa yang resisten terhadap karbapenem.
2. Untuk mengetahui apakah isolat klinis bakteri P. aeruginosa memiliki gen yang multiple atau tidak.
3. Untuk mengetahui pola resistensi antibiotikanya.
1.4 Manfaat Penelitian
Adapun manfaat dari penelitian ini adalah dapat menjadi sumber informasi ilmiah mengenai keberadaan gen resisten blaIMP, blaNDM-1, blaSPM-1, blaVIM-2 dan pola resistensi antimikrobanya pada isolat klinis bakteri P. aeruginosa yang resisten terhadap karbapenem serta dapat dijadikan sebagai antisipasi transmisi bakteri P.
aeruginosa yang resisten terhadap karbapenem dan juga upaya untuk menghindari peningkatan resistensi, sehingga pemberian antibiotika kepada pasien yang terinfeksi bakteri ini dapat diterapi dengan antibiotika yang tepat.
BAB 2
TINJAUAN PUSTAKA
2.1 Pseudomonas aeruginosa
Pseudomonas aeruginosa merupakan bakteri gram negatif dan biasanya berada di lingkungan yang lembab di rumah sakit. Bersifat saprofit karena dapat berkoloni pada manusia yang sehat dan menyebabkan penyakit pada pertahanan tubuh yang lemah. P. aeruginosa berbentuk batang dengan ukuran sekitar 0,6 x 2 µm, motil dan hidup pada suhu 37-42 oC. P. aeruginosa merupakan anaerob obligat dan memiliki pigmen warna pioverdin (hijau yang dapat berpijar [fluoroscent]) dan kadang tidak menghasilkan warna yang berpijar (pigmen piosianin). Beberapa strain menghasilkan pigmen warna piorubin (merah tua) dan pigmen piomelanin (hitam).
Kebanyakan isolat P. aeruginosa yang berasal dari infeksi klinis memproduksi enzim ekstraselular, yaitu elastase, protease dan 2 hemolisin (fosfolipase yang labil terhadap suhu dan glikolipid yang stabil terhadap suhu). P. aeruginosa dapat bersifat patogen jika masuk pada area tanpa perlindungan normal, seperti membran mukosa dan kulit yang diganggu secara langsung oleh kerusakan jaringan pada luka bakar atau saat kemoterapi (Brooks et al., 2013). Enzim elastase dan protease mengakibatkan proteolisis dan mengakibatkan rusaknya jaringan host (Latifah, 2014).
P. aeruginosa menyebabkan infeksi yang dimediasikan oleh biofilm termasuk kateter - infeksi saluran urinaria, ventilator – pneumonia dan infeksi yang berhubungan dengan katup jantung. Fibrosis sistik, luka bakar, luka pasca operasi beresiko bagi P. aeruginosa untuk tumbuh, khususnya yang ada di rumah sakit (Chan et al., 2016). P. aeruginosa dapat ditemukan pada jari kuku dari para medis (Duin and Paterson, 2017). P. aeruginosa menyebabkan infeksi terutama pada orang dengan imunokompromis dan juga termasuk tiga besar penyebab infeksi opportunistik terhadap manusia (Anggraini et al., 2018).
Kemampuan P. aeruginosa untuk tumbuh di tempat yang lembab dengan sedikit nutrisi dikarenakan P. aeruginosa mampu melawan agen antibakterial yang biasanya ditemukan pada berbagai lokasi di rumah sakit, seperti wastafel, matras dan alat pembersih lantai. P. aeruginosa juga mampu berkolonisasi dalam cairan
antiseptik golongan amonium kuartener (cetrimide dan benzalkonium). P.
aeruginosa merupakan patogen yang menyebabkan infeksi nosokomial (Davane et al., 2014). P. aeruginosa dikenal sebagai salah satu spesies penting dari famili Pseudomonadaceae dan tipe umum dari patogen nosokomial dengan tingkat mortalitas yang tinggi, terutama pada pasien dengan imunitas lemah (immunicompromised) (Kazeminezhad et al., 2017).
2.2 Multiple-Drug Resistant Pseudomonas aeruginosa
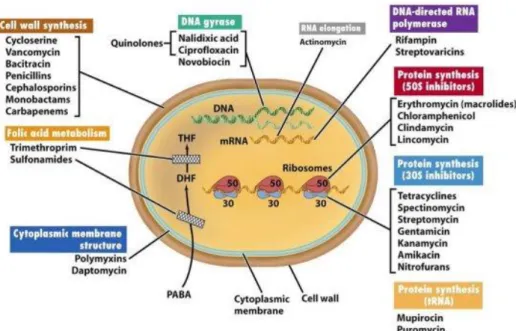
Multiple-Drug Resistant Pseudomonas aeruginosa (MDRPA) terjadi bila ditemukan lebih dari 3 antibiotik yang resisten dari golongan penisilin, sefalosporin, aminoglikosida dan karbapenem. Resistensi P. aeruginosa terhadap antibiotik ditemukan di Pakistan, yaitu resisten terhadap ampisilin 86,4% dan gentamisin 78,6%, sefotaksim 73%, seftazidim 56,51%, seftriason 67% (Rukmono dan Zuraida, 2013). Resistensi antibiotik pada P. aeruginosa pada Gambar 2.1. menunjukkan antibiotik yang umumnya menghambat sintesis dinding sel, DNA dan protein.
Piperasilin aktif melawan P. aeruginosa jika dikombinasikan dengan aminoglikosida (tobramisin); aztreonam, karbapenem (imipenem atau meropenem), fluoroquinolones (ciprofloxacin), sefalosporin, ceftazidime, sefoperazone, cefepime (Brooks et al., 2013).
Gambar 2.1 Resistensi Antibiotik pada Pseudomonas aeruginosa (Sumber: Madigan et al., 2006).
Mekanisme terjadinya resistensi P. aeruginosa terhadap beberapa antibiotik secara umum sama dengan bakteri gram negatif lainnya. Perbedaan mekanisme resistensi P. aeruginosa terjadi pada sistem efluks dimana bakteri ini memiliki permeabilitas membran 10-100 kali lipat lebih rendah dibandingkan dengan bakteri gram negatif lainnya (Setianingsih et al., 2016).
2.3 Antibiotika
Antibiotik adalah agen yang dapat mencegah pertumbuhan bakteri atau membunuh bakteri. Antibiotik dihasilkan oleh mikroorganisme yang bersifat antagonis terhadap pertumbuhan mikroorganisme lain pada dilusi yang tinggi (Hashemi et al., 2013). Antibiotik mempunyai efek menekan atau menghentikan proses biokimiawi di dalam mikroorganisme, khususnya dalam proses infeksi oleh bakteri. Penggunaan antibiotika secara berlebihan dapat menimbulkan tekanan selektif yang mendorong perkembangbiakan bakteri yang resisten (Zeniusa dan Ramadhian, 2017).
Antibiotik mampu menghambat sintesis protein, seperti aminoglikosida, kloramfenikol, streptothrisin dan tetrasiklin atau mampu menghambat sintesis DNA dan RNA, seperti quinolon dan rifampin. Selain itu, antibiotik mampu merusak atau memodifikasi dinding sel bakteri, seperti sulfonamide dan trimethoprim yang merupakan energi untuk metabolisme sel mikrobial. Keefektifan suatu antibiotik yang kurang menyebabkan lebih dominan obat yang bersifat bakteriostatik daripada bakteriosidal. Pengobatan dapat dilakukan dalam jangka waktu yang panjang atau pasien mungkin harus diisolasi sebagai dampak dari infeksi tersebut. Pada akhirnya, obat-obatan akan mahal harganya atau bahkan lebih toksik. Penggunaan antibiotik yang wajar merupakan kunci untuk mengontrol resistensi antibiotik yang meluas (Hoek et al., 2011).
Antibiotik digunakan sebagai obat untuk menanggulangi penyakit infeksi sehingga penggunaannya harus rasional, tepat dan aman. Penggunaan antibiotik dikatakan tepat apabila efek terapi mencapai maksimal sementara efek toksik yang berhubungan dengan obat menjadi minimum, serta perkembangan antibiotik resistensi menjadi seminimal mungkin (Pratiwi, 2017). Antibiotik yang dapat menghambat pertumbuhan mikroba disebut bakteriostatik. Jenis ini akan bekerja
pada pertahanan normal inang untuk membunuh atau mengeliminasi beberapa mikroba setelah menghambat pertumbuhannya. Antibiotik yang dapat membunuh mikroba disebut bakteriosidal. Ketika pertahanan dari inang tidak mampu atau tidak dapat menghancurkan bakteri patogen maka pemberian bakteriosidal dapat membunuh mikroba patogen dengan beberapa kondisi tertentu yang berkaitan, seperti konsentrasi bakteriosidal tersebut (Nester et al., 2009).
2.4 Resistensi Antibiotika
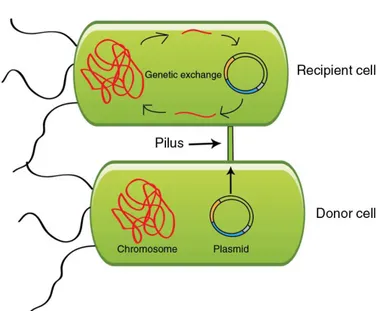
Resistensi antibiotik merupakan resistensi yang terjadi pada antibiotik dimana mikroorganisme mampu bertahan dengan adanya paparan antibiotik. Mutasi genetik pada bakteri dapat menyebabkan resistensi terhadap antibiotik, dimana gen yang menyebabkan resistensi dapat ditransfer antara dua bakteri secara horizontal dengan cara konjugasi, transduksi atau transformasi. Konjugasi bakteri dapat dilihat pada Gambar 2.2. Gen resisten antibiotik berada pada plasmid. Jika bakteri membawa gen resisten, maka dinamakan MDR atau secara informal dikenal dengan
“superbug atau super bacterium” (Jadon and Chauhan, 2011). Bakteri gram positif dan bakteri gram negatif memiliki inaktivasi antibiotik yang berbeda karena bakteri gram negatif memiliki dinding sel yang lebih permeabel dibandingkan dengan bakteri gram positif.
Faktor R merupakan kelas plasmid yang membawa gen resistensi terhadap beberapa antibiotik. Gen plasmid untuk resistensi antibiotik sering mengendalikan pembentukan enzim-enzim yang sanggup merusak obat antimikroba. Bahan genetik dan plasmid dapat dipindahkan melalui mekanisme, seperti transduksi (DNA plasmid terbungkus dalam virus bakteri dan dipindahkan oleh virus tersebut ke bakteri lain dari spesies yang sama), transformasi (DNA berpindah dari satu sel suatu spesies ke sel lain dan mengubah genotipenya), konjugasi (pemindahan unilateral bahan genetik antara bakteri dengan genus yang sama atau berlainan) dan translokasi (pertukaran urutan DNA pendek yang terjadi antara satu plasmid dengan plasmid lain atau antara satu plasmid dengan sebagian kromosom bakteri dalam sel bakteri (Jawetz et al., 1995).
Mekanisme terjadinya resistensi antibiotik di tingkat rumah sakit diduga melalui beberapa hal berikut: (1) terpaparnya populasi bakteri oleh organisme
resisten; (2) ditemukannya resistensi akibat mutasi spontan strain yang sensitif atau melalui transfer genetika; (3) ekspresi resistensi pada mikroba yang sebelumnya telah ada dalam populasi; dan (4) menyebarnya organisme resisten melalui transmisi silang. Meskipun penggunaan antibiotik relatif lebih ekstensif di komunitas, tetapi reservoir mikroorganisme resisten tersebar berada di rumah sakit (Nasution et al., 2018).
Gambar 2.2 Ilustrasi dari Bakteri Konjugasi (Sumber: Latifah, 2014).
Resistensi suatu mikroorganisme terhadap antibiotik disebabkan oleh: (1) mikroorganisme menghasilkan enzim yang merusak obat aktif, (2) mikroorganisme mengubah permeabilitasnya terhadap obat tersebut, (3) mikroorganisme mengembangkan sasaran struktur yang diubah terhadap obat, (4) mikroorganisme mengembangkan jalur metabolisme lain yang memintas reaksi yang dihambat oleh obat, dan (6) mikroorganisme membentuk suatu enzim yang telah mengalami perubahan tetapi enzim tersebut masih dapat menjalankan fungsi metabolismenya serta tidak begitu dipengaruhi oleh obat seperti enzim pada bakteri yang peka (Jawetz et al., 1995).
2.5 Extended-Spectrum Beta-Lactamses
Extended-Spectrum Beta-Lactamses (ESBLs) merupakan enzim yang dapat menghidrolisis beta-laktam lebih baik dan lebih luas dibandingkan dengan resistensi
antibiotik biasanya. ESBL ini mempunyai kemampuan untuk menginaktifkan antibiotik golongan beta-laktam seperti ceftazidime, ceftriaxone, sefotaksim dan golongan oxymino-monobactam seperti aztreonam. Namun ESBL tidak aktif meng- hadapi sefamisin dan karbapenem. Secara umum ESBL dapat menghambat beta- laktamase seperti tazobactam (Zakharian et al., 2018).
Transmisi dari gen pengkode enzim ESBL dapat terjadi dengan munculnya kloning bakteri atau dengan transfer gen secara horizontal. Plasmid yang mengandung gen resisten akan tersebar antara bakteri yang sejenis atau yang berbeda spesies. Mikrobiota pada usus merupakan penyalur yang ideal untuk gen resisten antibiotik, dimana bakteri dengan spesies yang berbeda dapat saling berinteraksi tanpa menyebabkan penyakit dan tidak mengganggu sistem imun. Ketika antibiotik yang digunakan pada strain yang resisten dapat menimbulkan keuntungan yang selektif dan dapat diakumulasikan. Peningkatan probabilitas dari gen yang penting untuk bertahan hidup dapat disebarluaskan. Plasmid mengandung gen yang resisten pada beberapa kelas antibiotik. Ini menyebabkan multiresisten yang sering pada bakteri penghasil ESBL (Brolund, 2014).
Enzim beta laktamase dibagi menjadi 4 kelompok (Dharmawan dan Layanto, 2019; Hong et al., 2015), yaitu:
A. Grup 1 (Ambler Kelas C)
Dikenal sebagai enzim AmpC, yang resisten terhadap inhibitor beta laktamase seperti klavulanat. Enzim ini terutama ditemukan di kromosom, dan enzim ini diinduksi oleh paparan antibiotik beta laktam.
Enzim ini banyak ditemukan pada golongan Enterobacteriaceae dan P.
aeruginosa. Enzim ini dapat berpindah dari kromosom ke plasmid. Grup 1 beta laktamase resisten terhadap kombinasi antibotik golongan beta laktam dengan penghambat beta laksamase, penisilin, sefamisin, sefalosporin generasi 1, 2 dan 3, namun sensitif terhadap sefepim dan karbapenem.
B. Grup 2 (Ambler kelas A)
Grup ini disebut dengan enzim penisilinase. Gen pengkode enzim ini terdapat di plasmid, sehingga mudah ditransmisikan ke bakteri lain, contohnya KPC dan GES. Enzim grup 2 dapat dihambat oleh
penghambat enzim beta laktamase seperti asam klavulanat, sulbaktam dan tazobaktam. Grup 2 ini dapat menghidrolisis ampisilin, sefalosporin generasi 1, 2 dan 3 serta monobaktam Extended Spectrum Beta Lactamase (ESBL).
C. Grup 3 (Ambler kelas B)
Enzim grup ini adalah metallo beta-laktamase karena ion logam seperti Zn2+ yang diperlukan untuk aktivitasnya dan dapat dihambat oleh pelepasan ion logam. MBL dapat menghidrolisis karbapenem dan β- laktam (kecuali monobaktam) dan tidak dihambat oleh inhibitor β- laktamase termasuk asam klavunik atau tazobaktam. IMP-1 merupakan MBL pertama yang ditemukan pada P. aeruginosa serta VIM-, SPM-, GIM-, NDM- dan FIM yang dilaporkan setelahnya. Enzim ini banyak ditemukan pada P. aeruginosa, Bacteroides fragilis dan Stenotrophomonas maltophilia.
D. Grup 4 (Ambler kelas D)
Grup ini merupakan enzim oksasilinase menunjukan kemampuan yang baik dalam menghidrolisis antibiotik oksasilin. Contoh tipe enzimnya adalah OXA-.
2.6 Karbapenemase
Karbapenemase adalah enzim yang mengakibatkan bakteri resisten terhadap banyak antibiotik. Bakteri penghasil karbapenemase tidak hanya menghidrolisis karbapenem, tetapi juga menghidrolisis penisilin spektrum luas, sefalosporin dan sefamisin. Karbapenem merupakan kelompok antibiotik dari golongan β-laktam yang memiliki spektrum sangat luas. Karbapenem memiliki cincin tiazolidin yang dimodifikasi. Mekanisme resistensi karbapenem terdiri dari satu sampai tiga mekanisme: (1) produksi enzim β-Laktamase/karbapenemase yang menghidrolisis karbapenem, (2) pompa efluks melalui membran luar pada bakteri gram negatif dan (3) terjadinya perubahan atau menurunnya afinitas Penicillin-Binding-Protein (PBP) target (Latifah, 2014). Di antara beragam mekanisme resistensi antimikroba, produksi karbapenemase merupakan salah satu mekanisme terpenting oleh P.
aeruginosa yang resisten terhadap karbapenem. Karbapenemase dapat disebut
sebagai β-laktamase yang secara signifikan menghidrolisis setidaknya imipenem dan atau meropenem.
IMP-1 pertama kali diisolasi dari P. aeruginosa di Jepang dan ditemukan pada integron kelas I yang berada pada plasmid konjugasional. Saat ini ada 33 dari total 55 IMP yang telah diidentifikasi dari P. aeruginosa. Enzim IMP dibagi menjadi beberapa subgrup dan persentase asam amino antara subgrup berkisar dari 90% - 99%
yang menunjukkan aktivitas hidrolitik yang sangat mirip antar sesama. Enzim VIM berbagi spektrum hidrolitik dengan enzim IMP, dengan asam amino kurang dari 40%.
VIM-1 pertama kali diidentifikasi pada P. aeruginosa pada tahun 1999. Saat ini, VIM-2 merupakan MBL yang paling luas sebarannya pada P. aeruginosa dan menjadi penyebab wabah yang bermacam. Dua puluh empat dari 46 VIM telah teridentifikasi pada P. aeruginosa. SPM-1 pertama kali diisolasi di Brazil tahun 1997 dari isolat klinis P. aeruginosa yang resisten terhadap semua antibiotik yang ada kecuali kolistin. SPM cukup berbeda dengan VIM dan IMP, yang memiliki asam amino tertinggi dari IMP (35,5%) dan merupakan MBL baru. Gen blaSPM-1 dikode pada kromosom atau plasmid. NDM-1 pertama kali diisolasi dari Klebsiella pneumoniae dan Escherichia coli di New Delhi, India tahun 2009. Setelah itu, 6 varian NDM (NDM-1 – NDM-7) telah diidentifikasi di P. aeruginosa. NDM-1 pada P.
aeruginosa pertama kali di laporkan tahun 2011 dari Serbia. Pada tahun 2012, P.
aeruginosa yang memproduksi NDM-1 diisolasi di Prancis dari pasien yang sebelumnya dirawat di Serbia. Sejak saat itu, P. aeruginosa yang positif NDM-1 telah menyebar ke seluruh dunia termasuk India, Arab dan Slovakia (Hong et al., 2015).
BAB 3
METODE PENELITIAN
3.1 Tempat dan Waktu
Penelitian ini dilaksanakan pada bulan Juni 2019 hingga bulan Desember 2019 yang bertempat di Laboratorium Mikrobiologi Klinis Rumah Sakit USU Medan, Instalasi Laboratorium Mikrobiologi Klinis RSUP H. Adam Malik Medan, Laboratorium Genetika dan Biologi Molekuler Fakultas Matematika dan Ilmu Pengetahuan Alam dan Laboratorium Terpadu Fakultas Kedokteran Universitas Sumatera Utara, Medan.
3.2 Metode Penelitian
Penelitian ini menggunakan jenis penelitian deskriptif kualitatif yaitu mengidentifikasi bakteri yang tergolong MDRPA menggunakan Vitek 2 Compact di RS USU Medan dan RSUP H. Adam Malik Medan (Surat Ethical Clearance Lampiran 9, Hlm 53) secara fenotip dan mendeteksi ada atau tidaknya gen resisten
blaIMP, blaNDM-1, blaSPM-1, blaVIM-2 menggunakan Polymerase Chain Reaction (PCR) secara genotip di Laboratorium Genetika dan Biologi Molekuler FMIPA USU dan Laboratorium Terpadu FK USU. Parameter yang diamati adalah pola sensitivitas antimikroba dan persentase gen resisten blaIMP, blaNDM-1, blaSPM-1, blaVIM-2 pada isolat klinis bakteri Pseudomonas aeruginosa.
3.3 Preparasi dan Pengoleksian Sampel Klinis
Spesimen klinis yang dikirim ke Unit Mikrobiologi Klinik berupa darah, jaringan, pus, sputum, swab dan urin. Spesimen dilanjutkan ke tahap kultivasi pada media Mac-Conkey Agar. Sampel diinkubasi di dalam inkubator dengan suhu 37 oC selama 24 jam dan ditandai dengan pertumbuhan koloni bakteri yang berwarna coklat kehijauan untuk kemudian dilanjutkan pada tahap identifikasi.
3.4 Identifikasi Bakteri dan Uji Resistensi Terhadap Antibiotik
Tahapan awal dari identifikasi bakteri menggunakan alat Vitek 2 Compact
dilakukan dengan mengambil biakan murni pada media Mac-Conkey Agar lalu dilakukan pewarnaan untuk mengetahui bentuk dari bakteri dan mengelompokkan bakteri berdasarkan gram. Koloni bakteri kemudian dimasukkan ke dalam tabung reaksi pertama yang berisi 3 ml NaCl 0,45% pH 5. Suspensi diukur kekeruhannya sesuai dengan standar Mc Farland yaitu 0,5 dengan alat DensiChek. Identifikasi jenis bakteri dilakukan dengan menggunakan kartu identifikasi yaitu Casette GN (Gram Negatif) yang berwarna biru untuk mengidentifikasi secara langsung bakteri gram negatif. Uji resistensi antibiotika dilakukan dengan menggunakan kartu Antimicrobial Susceptibility Testing (AST) yang berwarna abu-abu dimana terdapat 16-20 jenis antibiotik yang terhubung dengan tabung reaksi kedua yang berisi 3 ml 0,45% NaCl dan 145 µl suspensi bakteri dari tabung reaksi pertama. Setiap kartu dilengkapi dengan barcode agar kode sampel muncul pada monitor alat Vitek dan dimasukkan ke dalam Vitek 2 Compact. Hasil akan secara otomatis mengidentifikasi jenis bakteri selama 24 jam (Alur kerja alat Vitek 2 Compact Lampiran 4, Hlm 45).
Isolat yang tergolong MDRPA dengan hasil resistensi terhadap 3 jenis antibiotik atau lebih berdasarkan hasil pemeriksaan Vitek 2 Compact di Unit Mikrobiologi Klinis RS USU dan Instalasi Laboratorium Mikrobiologi Klinis RSUP H. Adam Malik Medan kemudian dilakukan peremajaan isolat. Hasil peremajaan isolat kemudian dibawa ke Laboratorium Terpadu Fakultas Kedokteran USU dan Laboartorium Genetika dan Biologi Molekuler untuk pemeriksaan gen resisten
blaIMP, blaNDM-1, blaSPM-1, blaVIM-2 menggunakan PCR.
3.5 Deteksi Gen Resisten blaIMP, blaNDM-1, blaSPM-1, blaVIM-2 3.5.1 Isolasi Genom DNA
Isolasi genom DNA dilakukan dengan menggunakan Promega Wizard®
Genomic DNA Purification Kit berdasarkan prosedur Wizard® Genomic DNA Purification Quick Protocol (Alur kerja isolasi DNA Lampiran 5, Hlm 46) yang dimulai dengan pengambilan 2 ose bakteri yang kemudian dimasukkan ke dalam tube sentrifuge 1,5 ml yang berisi 600 µl Nuclei Lysis Solution dan dihomogenkan dengan vortex. Tube sentrifuge diinkubasi pada suhu 80 oC selama 5 menit. Sebanyak 200 µl Protein Precipitation Solution dimasukkan ke dalam tube sentrifuge dan diinkubasi di dalam es selama 5 menit. Hasil dari inkubasi kemudian di sentrifugasi
dengan kecepatan 13.000 xg selama 3 menit. Supernatan dari hasil sentrifugasi dituang ke dalam tube sentrifuge baru berisi 600 µl isopropanol untuk kemudian di sentrifugasi kembali selama 2 menit. Pelet dari hasil sentrifugasi kedua kemudian ditambahkan 600 µl etanol 70% dan disentrifugasi kembali selama 2 menit.
Supernatan yang didapatkan dibuang dan kering-anginkan selama 15 menit dan ditambahkan 50 µl DNA Rehydration Solution dan dihomogenkan. RNAse Solution ditambahkan sebanyak 0,5 µl ke dalam hasil ekstraksi DNA dan diinkubasi selama 24 jam pada suhu 4 oC untuk dilanjutkan ke tahapan selanjutnya.
3.5.2 Pengukuran Kemurnian DNA
Kemurnian DNA dibaca dengan nanophotometer dengan menghitung rasio pada panjang gelombang 260 dan 280 nm sampai didapatkan hasil sebesar 1.8-2.0 yang menunjukkan bahwa DNA bakteri memiliki kemurnian tinggi dan dapat dilakukan amplifikasi menggunakan PCR. DNA dapat diaplikasikan sesuai dengan yang diinginkan atau dapat di simpan pada suhu 4 oC apabila digunakan dalam jangka pendek dan -20 oC apabila digunakan dalam waktu jangka panjang.
3.5.3 Deteksi Gen
Ekstrak DNA digunakan sebagai template untuk PCR dengan primer spesifik yang tercantum dalam Tabel 3.1.
Tabel 3.1 Primer Spesifik Gen blaIMP, blaNDM-1, blaSPM-1, blaVIM-2
Primer Sequence (5’-3’) Target Gene Product Size (bp) Daftar Pustaka
blaIMP F GAA GGC GTT TAT
GTT CAT AC bla
IMP 588 Erfani et al
(2017)
blaIMP R GTA TGT TTC AAG AGT GAT GC
blaNDM-1 F
GGT TTG GCG ATC TGG TTT TC bla
NDM-1 621
Poirel et al (2011)
blaNDM-1 R
CGG AAT GGC TCA TCA CGA TC
blaSPM-1 F AAA ATC TGG GTA CGC AAA CG bla
SPM-1 271
blaSPM-1 R ACA TTA TCC GCT GGA ACA GC
blaVIM-2 F GAT GGT GTT TGG
TCG CAT A bla
VIM-2 390
blaVIM-2 R CGA ATG CGC AGC ACC AG
Campuran mastermix, primer forward, primer reverse dan Nuclease Free Water dan DNA bakteri dimasukkan ke dalam tube PCR 0,2 ml. Kontrol positif digunakan isolat PU08 yang resisten terhadap karbapenem dan kontrol negatif digunakan Pseudomonas aeruginosa ATCC 27853. Amplifikasi gen dilakukan dengan kondisi thermocycling gen blaIMP, blaNDM-1, blaSPM-1, blaVIM-2 sesuai dengan Tabel 3.2.
Tabel 3.2 Optimasi Kondisi Reaksi dan Siklus PCR untuk Gen blaIMP, blaNDM-1, blaSPM-1, blaVIM-2
Kondisi Reaksi
blaIMP blaNDM-1, blaSPM-1, blaVIM-2
KAPA2G Fast Multiplex Mix 5 µl 5 µl
Nuclease Free Water 3 µl 3 µl
Primer Forward (masing-
masing Primer) 0,5 µl 0,5 µl
Primer Reverse (masing-
masing Primer) 0,5 µl 0,5 µl
DNA 1 µl 1 µl
Total 10 µl 12 µl
Thermocycling
Pre Denaturasi 1x: 95 oC 4 menit 1x: 95 oC 5 menit
Denaturasi 35x: 95 oC 30 detik 36x: 95 oC 30 detik
Annealing 53,5 oC 30 detik 56,5 oC 40 detik Extension 72 oC 1 menit 72 oC 50 detik Final Extension 72 oC 5 menit 72 oC 5 menit
3.5.4 Elektroforesis
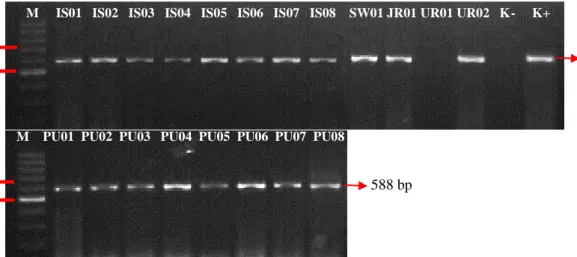
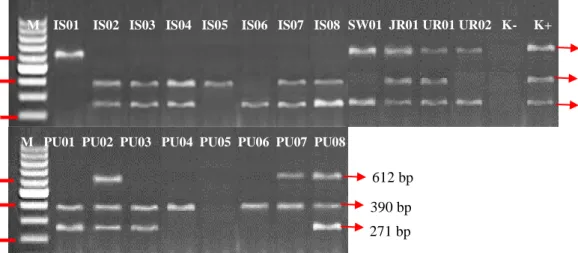
Elektroforesis dimulai dengan pembuatan gel agarose 2% dengan cara mencampurkan 2 g tepung agarose ke dalam 100 ml Buffer TAE 1x (Lampiran 1, Hlm 42) kemudian di didihkan dan setelah hangat, ditambahkan 1 μl ethidium bromida 1%. Campuran tersebut dihomogenkan di atas magnetic stirer dan dituangkan ke dalam cetakan elektroforesis. Setelah gel agarose mengeras, tambahkan Buffer TAE 1x sampai seluruh gel terendam. Pada well 1 dimasukkan Promega BenchTop DNA Markers 100bp sebanyak 2,5 μl dan 10 μl produk hasil PCR ke dalam well selanjutnya. Cetakan kemudian ditutup sesuai kutub negatif dan positif. Elektroforesis dijalankan dengan dialirkan arus listrik pada 75 v dan 400 mA selama 75 menit. Setelah gel agarose dikeluarkan dari cetakan, masukkan ke dalam alat UV Reader/ Gel Documentation System untuk dilihat visualisasi pola pita DNA dari gen blaIMP, blaNDM-1, blaSPM-1, blaVIM-2. Pemeriksaan ini adalah tahap akhir identifikasi gen blaIMP, blaNDM-1, blaSPM-1, blaVIM-2.
3.6 Analisis Data
Data yang diperoleh dari hasil penelitian ini adalah karakteristik pasien MDRPA berdasarkan jenis kelamin, asal spesimen klinis, lokasi perawatan pasien, pola resistensi antibiotik yang meliputi Sensitif (S) dan Resisten (R) dan hasil deteksi gen resisten blaIMP, blaNDM-1, blaSPM-1, blaVIM-2. Berdasarkan data tersebut, maka data deskriptif akan disajikan dalam bentuk tabulasi, persentase dan pola resistensi antibiotik. Gen resisten blaIMP, blaNDM-1, blaSPM-1, blaVIM-2 disajikan berdasarkan pita DNA.
BAB 4
HASIL DAN PEMBAHASAN
Penelitian mengenai deteksi gen resisten blaIMP, blaNDM-1, blaSPM-1, blaVIM- 2 telah dilakukan dan terdapat 20 isolat klinis bakteri P. aeruginosa yang tergolong Multiple-Drug Resistant Pseudomonas aeruginosa (MDRPA) dari hasil pemeriksaan Vitek 2 Compact yang didapatkan dari Laboratorium Mikrobiologi Klinis RS USU Medan dan Instalasi Laboratorium Mikrobiologi Klinis RSUP H. Adam Malik Medan. Pengamatan meliputi uji fenotipe dan genotipe bakteri yang tergolong Multiple-Drug Resistant Pseudomonas aeruginosa. Data subjek penelitian pasien MDRPA dapat dilihat pada Lampiran 2 Hal 42.
4.1 Karakteristik Subjek Penelitian
4.1.1 Jenis Kelamin Pasien MDRPA di RS USU Medan dan RSUP H. Adam Malik Medan
Informasi yang diperoleh menunjukkan bahwa terdapat 6 (30%) pasien MDRPA pada periode Juli – September 2019 di RS USU Medan, sedangkan terdapat 14 (70%) pasien MDRPA pada periode September 2019 di RSUP H. Adam Malik Medan ditunjukkan pada Tabel 4.1.
Tabel 4.1 Distribusi Subjek Penelitian Berdasarkan Jenis Kelamin Penderita MDRPA
Rumah Sakit Jumlah Sampel (n) Persentase
Laki-laki Perempuan Tidak diketahui (%)
RS USU 1 4 1 30
RSUP H. Adam Malik 7 6 1 70
Total 8 10 2 100
Dari data distribusi subjek penelitian berdasarkan jenis kelamin menunjukkan bahwa pasien MDRPA paling banyak diderita oleh pasien perempuan yaitu 10 orang (50%), kemudian pasien laki-laki berjumlah 8 orang (40%) dan yang tidak diketahui jenis kelaminnya 2 orang (10%). Hal ini terjadi karena tidak adanya informasi dari kertas hasil Vitek pasien. Satu isolat dari RS USU Medan yang berasal dari stok isolat yang disimpan, sedangkan satu isolat dari RSUP H. Adam Malik Medan berasal dari seorang bayi. Menurut Bejestani et al (2015), anak-anak merupakan
populasi yang mudah terserang oleh penyakit karena sistem imun yang belum sempurna. Lebih banyaknya pasien perempuan daripada pasien laki-laki disebabkan oleh perbedaan biologis, seperti fungsi reproduksi dan ekspresi gen pada kromosom XY serta perubahan hormon yang fluktuatif pada wanita serta memiliki respon imun yang lebih aktif untuk memerangi patogen yang menyerang tubuh. Namun sistem kekebalan dapat bekerja secara berlebihan dan menyebabkan penyakit autoimun (Zagrosek, 2012).
Hal ini sama dengan penelitian yang dilakukan oleh Peymani et al (2015) di Iran, dimana pasien wanita MDRPA lebih banyak yaitu sejumlah 156 pasien (52%) dan 144 (48%) pasien pria. Penelitian yang dilakukan oleh Matos et al (2016) di Brazil juga menemukan pasien wanita MDRPA lebih banyak (26 pasien) 51,9% dan pria 26 pasien (48,1%).
4.1.2 Distribusi MDRPA dari Berbagai Spesimen Klinis di RS USU Medan dan RSUP H. Adam Malik Medan
Sebanyak 20 isolat terkumpul dari bulan Juli – September 2019 yang diisolasi dari berbagai spesimen klinis yang masuk ke Laboratorium Mikrobiologi Klinis RS USU Medan dan Instalasi Laboratorium Mikrobiologi Klinis RSUP H. Adam Malik Medan dan data asal spesimen ditunjukkan pada Tabel 4.2.
Tabel 4.2 Asal Spesimen MDRPA
No Spesimen Klinis Jumlah Sampel (n) Persentase (%)
1 Jaringan 1 5
2 Pus 8 40
3 Sputum 8 40
4 Swab Tenggorok 1 5
5 Urin 2 10
Total 20 100
Dari data distribusi MDRPA dari sampel klinis di atas menunjukkan bahwa isolat MDRPA yang paling banyak berasal dari spesimen klinis pus dan sputum dengan masing-masing persentase 40%, sedangkan spesimen klinis paling sedikit berasal dari potongan jaringan dan swab tenggorok dengan masing-masing persentase sebesar 1%, kemudian spesimen urin 10%. Sampel MDR P. aeruginosa yang dikoleksi dari RSUD Arifin Achmad di Pekanbaru oleh Anggraini et al (2018) kebanyakan berasal dari pus yaitu 70,2% dan sputum 32,7%. Penelitian yang sama
urin 14,3% dan jaringan 11,6%. Penelitian oleh Nithyalakshmi et al (2016) di India juga menemukan spesimen klinis yang paling banyak dikoleksi pada pus (61), sputum (38). Begitu juga dengan penelitian oleh Ahmad et al (2016) di Pakistan yang menemukan spesimen klinis terbanyak pada pus yaitu 162 sampel (48,5%).
P. aeruginosa dapat ditemukan pada permukaan kulit yang memiliki area kelembapan dan dapat mengkoloni jalur respiratori bagian atas dari pasien di rumah sakit (Hoque et al., 2015). Spesies Pseudomonas ditemukan sebagai bagian dari mikrobiota pada kulit manusia. Hal ini menyebabkan infeksi pada individu yang sehat dan juga menyebabkan infeksi yang serius pada pasien immunokompromis yang memiliki luka bakar atau luka operasi (Shidiki et al., 2019). Bakteri melekat dan mengkoloni pada selaput mukosa atau kulit, menginvasi secara lokal, dan menimbulkan penyakit sistemik. Proses ini dibantu oleh pili, enzim, dan eksotoksin A, suatu transferase ADP-ribosa yang berfungsi menghambat sintesis protein eukariota (Putra dan Kusmiati, 2015). Sebagian besar infeksi P. aeruginosa, gejala dan tandanya tidak spesifik dan berkaitan dengan organ yang terserang. P.
aeruginosa dapat dilihat pada sediaan hapusan yang diwarnai dengan Gram, dan hasil biakan yang positif (Jawetz et al., 2001). Pus merupakan hasil dari proses infeksi bakteri yang terjadi akibat akumulasi jaringan nekrotik, netrofil mati, makrofag mati dan cairan jaringan. Setelah proses infeksi dapat ditekan, pus secara bertahap akan mengalami autolisis dalam waktu beberapa hari, kemudian produk akhirnya akan diabsorpsi ke jaringan sekitar. Pada beberapa kasus, proses infeksi sulit ditekan sehingga mengakibatkan pus tetap diproduksi. Hal tersebut dapat disebabkan bakteri yang menginfeksi mengalami resistensi terhadap antibiotik (Nurmala et al., 2015).
P. aeruginosa merupakan patogen opportunistik yang hanya menyerang pasien yang memiliki gangguan pertahanan pada paru-paru, seperti fibrosis kistik, bronchiectasis (pelebaran jalur udara paru-paru) dan beberapa penyakit kronis dari paru-paru. Pada fibrosis kistik, infeksi P. aeruginosa mengarah pada penurunan fungsi paru-paru dan kegagalan pernafasan dan kematian. Infeksi kronis diasosiasikan dengan penyakit paru-paru yang meluas dan menghambat aliran udara.
P. aeruginosa memiliki afinitas mukus yang tinggi dan memungkinkan penurunan kerja mukosiliari dan pelancaran dahak yang berdampak pada aliran udara pada
bronkus karena sekresi mukus yang berlebihan, meningkatkan kekentalan mukus dan kehilangan silia, dan mempengaruhi kolonisasi (Davies et al., 2006). P. aeruginosa ditemukan sebanyak 5,4% pada sputum berwarna kekuningan, 38,3% pada sputum kehijauan dan 43,2% pada sputum kecoklatan (Allegra et al., 2005).
4.1.3 Distribusi MDRPA Berdasarkan Lokasi Perawatan Pasien di RS USU Medan dan RSUP H. Adam Malik Medan
Distribusi MDRPA berdasarkan lokasi perawatan pasien dapat dilihat pada Tabel 4.3 yang terbagi menjadi 3 ruang perawatan yaitu Ruang Perawatan Intensif, Ruang Perawatan Bedah, dan Ruang Rawat Inap.
Tabel 4.3 Distribusi MDRPA Berdasarkan Lokasi Perawatan
Lokasi Perawatan
RS USU RSUP H. Adam Malik
Jumlah Sampel (n)
Persentase (%)
Jumlah Sampel (n)
Persentase (%) I Ruang Perawatan Intensif
ICU Dewasa - - 1 5
Stroke Corner (SC) - - 1 5
II Ruang Perawatan Bedah
Instalasi Bedah Pusat (IBP) 2 10 - -
III Ruang Rawat Inap
Perinatologi Anak - - 1 5
Ruang Rawat Dewasa 2 10 10 50
Tidak diketahui 2 10 1 5
Berdasarkan Tabel 4.3 yang menunjukkan bahwa distribusi MDRPA pada RS USU Medan berasal dari Instalasi Bedah Pusat (IBP), Ruang Rawat Dewasa, dan yang tidak diketahui distribusinya yaitu masing-masing sebesar 2 sampel (10%).
Distribusi MDRPA pada RSUP H. Adam Malik Medan yang paling banyak berasal dari Ruang Rawat Dewasa yaitu sebanyak 10 sampel (50%), sedangkan distribusi MDRPA yang paling sedikit berasal dari ICU Dewasa, Stroke Corner, Perinatologi Anak, dan yang tidak diketahui distribusinya yaitu masing-masing sebanyak 1 sampel (5%).
Hasil penelitian oleh Ginawi et al (2014) di India memiliki pasien lebih banyak berada di ruang rawat inap (28%) dibandingkan dengan ruang rawat bedah (24,5%). Faktor yang mempengaruhi meningkatnya infeksi pada ruang perawatan adalah adanya pengunjung dengan jumlah yang banyak, kurangnya pengetahuan dan pemantauan yang tepat dari rumah sakit. Sedangkan peningkatan infeksi yang sedikit di rumah sakit kemungkinan dikarenakan rumah sakit memperhatikan proses-proses
yang telah ditetapkan dengan baik untuk membersihkan peralatan yang sudah rusak dan barang-barang lainnya yang kotor dengan menggunakan sterilisasi dan proses disinfeksi tingkat tinggi dan meningkatkan keamanan dalam ruang operasi dan area riskan lainnya dimana dapat terjadi hal yang paling serius, paling sering dan terpapar oleh agen infeksi. Hasil yang sama juga ditemukan pada penelitian Dimatatac et al (2003) di Filipina, yaitu sebanyak 50% pasien yang terinfeksi P. aeruginosa berasal dari ruang perawatan inap dimana paparan dan penggunaan antibiotik tertinggi dibandingan dengan ruangan lain di rumah sakit. Transmisi organisme multi resisten dari satu pasien ke pasien lainnya dapat terjadi secara langsung maupun tidak langsung melalui pegawai medis sebagai vektor. Namun pasien yang berada di ruangan isolasi dan memiliki sedikit kontak dengan lainnya dapat dipertimbangkan (Mudau et al., 2013).
Penelitian yang dilakukan oleh Nouer et al (2005), menunjukkan bahwa pasien yang mengalami MDRPA memiliki riwayat pernah dirawat di rumah sakit sebelumnya atau yang telah dirawat di rumah sakit selama 2 bulan. Hal ini juga dibuktikan oleh penelitian Varaiya et al (2008), yang menunjukkan pasien yang memproduksi metallo β-laktamase (MBL) telah dirawat di rumah sakit selama kurang lebih 2 bulan.
4.2 Uji Fenotipe Multiple-Drug Resistant Pseudomonas aeruginosa dengan Vitek 2 Compact
Hasil uji fenotipe yang telah dilakukan terhadap 20 isolat klinis bakteri P.
aeruginosa dilakukan untuk mengidentifikasi jenis bakteri dan menggolongkan bakteri ke dalam kelompok MDROs. Penggolongan ini berdasarkan hasil uji resistensi terhadap antibiotik menggunakan Vitek 2 Compact yang sesuai dengan standar Clinical Laboratory Susceptibility Institute (CLSI) dengan kinerja semi- otomatis yang memiliki tingkat sensitivitas dan spesifitas tinggi. Adapun persentase fenotipe MDRPA dari total 20 isolat dapat dilihat pada Tabel 4.4 dan hasil fenotipe pada isolat klinis MDRPA dapat dilihat pada Tabel 4.5 berikut.
Tabel 4.4 Persentase Fenotipe MDRPA
Persentase Fenotipe MDRPA dan Jumlah Sampel
ESBL ESBL + Penisilinase ESBL + Sefalosporinase ESBL + Karbapenemase
5% (1) 50% (10) 25% (5) 20% (4)