A
plikasi bioteknologi diharapkan dapat mengatasi berbagai kendala dalam berproduksi yang tidak dapat diatasi melalui cara konvensional. Peningkatan produktivitas, misalnya, dapat dicapai melalui peningkatan potensi genetikPERBAIKAN SIFAT GENOTIPE MELALUI FUSI
PROTOPLAS PADA TANAMAN LADA,
NILAM, DAN TERUNG
Ika Mariska dan Ali Husni
Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik Pertanian, ]alan Tentara Pelajar No.3A Bogor 16111
ABSTRAK
Fusi protoplas dapat digunakan untuk mengatasi masalah dalam persilangan secara seksual, terutama inkompatibilitas dan sterilitas pada turunan F1. Masalah ini umumnya muncul pada persilangan antargenotipe berkerabat jauh, seperti pada tanaman lada, nilam, dan terung untuk memperoleh tanaman yang tahan terhadap penyakit yang disebabkan oleh Phytophthora capsici pada lada, Ralstonia solanacearum pada terung, dan nematoda Pratylenchus
brachyurus pada nilam. Sifat ketahanan terhadap penyakit tersebut terdapat pada kerabat liarnya, tetapi persilangan
secara seksual sering menghadapi hambatan genetik. Hibridisasi juga tidak dapat dilakukan pada tanaman nilam karena tanaman tersebut tidak berbunga. Isolasi protoplas dengan menggunakan kombinasi selulase 2% + macerozim 0,50% (untuk lada) dan selulase 0,50% + pektinase 0,50% (untuk terung dan nilam) menghasilkan protoplas dengan densitas yang tinggi. Fusi protoplas dapat dilakukan dengan menggunakan PEG 6000 konsentrasi 30% selama 20−25 menit untuk menyatukan dua protoplas tanaman budi daya dan kerabat liarnya dalam upaya membentuk hibrida somatik. Mikrokalus lada belum dapat diregenerasikan menjadi tunas adventif, sedangkan untuk nilam telah diperoleh beberapa nomor hibrida somatik dengan kadar fenol dan lignin yang tinggi seperti kerabat liarnya. Pada terung, telah diperoleh beberapa hibrida somatik yang tahan terhadap penyakit layu R.
solanacearum. Kultur anther dari tanaman hasil fusi dapat diperoleh tanaman dihaploid yang selanjutnya disilang
balik dengan tetua hibridanya. Hasil silang balik (back cross 2) mempunyai struktur dan warna buah yang sama dengan terung budi daya.
Kata kunci: Fusi protoplas, Piper nigrum, Pogostemon cablin, Solanum melongena
ABSTRACT
Genetic improvement through protoplast fusion on black pepper, patchouli, and eggplant
Protoplast fusion was conducted to overcome genetic barrier arised in sexual crossing and sterility of F1 hybrid. This generally occurred in interspecific and intergeneric hybridization, such as black pepper (Piper nigrum), patchouli (Pogostemon cablin), and eggplant (Solanum melongena spp.). On those crops, the main problem is disease infection, caused by Phytophthora capsici in pepper, Ralstonia solanacearum in eggplant, and nematodes in patchouli. The resistance genes against those diseases were existed in wild species of the respective crops, so that producing a resistant variety through conventional breeding is almost imposible. Hybridization is also not applicable for patchouli because the plant does not produce flower. The protoplast could be isolated with a combination of cellulase 2% + macerozyme 0.50% (for black pepper) and cellulase 0.50% + pectinase 0.50% (for eggplant and patchouli) which produce high density of protoplast. Protoplast fusion may be conducted by the application of PEG 6000 at a concentration of 30% for 20−25 minutes. By this treatment, the protoplast from cultivated crop could be fused into their wild species. Microcallus of pepper could not be regenerated, therefore somatic hybrids failed to be produced. Meanwhile somatic hybrids of patchouli were produced with high lignin and phenol content, same as wild species. In eggplant, different hybrids were produced and some of which were resistant to R. solanacearum. Anther culture of the hybrids produced dihaploid plant. The haploid plant was back crossed to their parent and the back cross (BC2) had fruit structure and color similar to cultivated eggplant.
Keywords: Protoplast fusion, Piper nigrum, Pogostemon cablin, Solanum melongena
tanaman serta ketahanan terhadap hama, penyakit, dan cekaman lingkungan.
Bioteknologi tanaman pada dasarnya dapat dilakukan melalui dua cara, yaitu kultur in vitro dan rekombinasi DNA. Perbaikan genetik tanaman melalui kultur
in vitro dapat dilakukan melalui beberapa
cara, antara lain peningkatan keragam-an somaklonal, penyelamatkeragam-an embrio, fertilisasi in vitro, kultur haploid, dan fusi protoplas (hibridisasi somatik). Dalam hibridisasi seksual terdapat hambatan
apabila kedua tetua yang disilangkan mempunyai hubungan kekerabatan yang jauh serta sitoplasma hanya berasal dari tetua betina. Salah satu alternatif untuk mengatasi hambatan tersebut adalah melalui fusi protoplas yang dapat memindahkan gen yang belum ter-identifikasi dan sifat yang diwariskan secara poligenik (Millam et al. 1995).
Keragaman tanaman yang dihasil-kan melalui fusi protoplas lebih tinggi dibandingkan melalui persilangan seksual karena: 1) terjadinya segregasi inti dan sitoplasma yang menghasilkan kombinasi unik antara informasi genetik pada inti dan sitoplasma, 2) instabilitas kombinasi inti sel yang menyebabkan hilangnya beberapa informasi genetik, dan 3) variabilitas akibat subkultur relatif tinggi sehingga dapat membentuk keragaman somaklonal (Ammirato et al. 1983). Fusi protoplas dapat dilakukan secara simetris dan asimetris. Fusi simetris didapat dengan menggabungkan dua jenis genom sehingga diperoleh hasil yang bersifat antara (intermediate). Fusi asimetris didapat dengan cara genom inti salah satu tetua dihilangkan (melalui iradiasi) dan tetua yang lain dihilangkan sitoplasma-nya dengan iodoasetomide. Hasil fusi asimetris umumnya disebut dengan nama cybrid.
Penelitian fusi protoplas telah meng-hasilkan hibrida-hibrida somatik yang mempunyai sifat-sifat seperti yang diha-rapkan, antara lain tahan terhadap hama dan penyakit, produktivitas tinggi, dan sifat-sifat kualitatif yang lebih baik, seperti kandungan minyak tinggi. Fusi simetris dapat menghasilkan keragaman genetik yang tinggi yang bermanfaat dalam program pemuliaan. Melalui beberapa kali silang balik (back cross) dilanjutkan dengan seleksi dapat dihasilkan kultivar baru (Serraf 1991; Millam et al. 1995; Nyman dan Waara 1997; Mariska et al. 2002). Tulisan ini menyajikan hasil-hasil penelitian fusi protoplas pada tanaman lada, nilam, dan terung.
FUSI PROTOPLAS
TANAMAN LADA
Lada merupakan komoditas ekspor yang cukup penting untuk dikembangkan dengan nilai devisa yang diperoleh sebesar US$89,197 juta (Direktorat Jenderal Bina Produksi Perkebunan 2004).
Indonesia merupakan pemasok lada terbesar kedua di dunia setelah India.
Salah satu masalah dalam pengem-bangan lada adalah serangan penyakit yang disebabkan oleh Phytophthora
capsici, sementara varietas lada yang
tahan penyakit tersebut belum ditemukan. Sifat ketahanan terhadap penyakit terdapat pada lada liar, seperti Piper
colibrinum, P. hirsutum, P. aurifolium,
dan P. cubeba (Kasim 1997). Pemindahan sifat ketahanan terhadap penyakit dari lada liar ke lada budi daya secara seksual sulit dilakukan. Untuk mengatasi masalah tersebut telah dilakukan fusi protoplas. Melalui fusi protoplas, sel hibrida dapat memanfaatkan gabungan sitoplasma dari kedua tetuanya. Di samping itu, sifat lainnya yang berasal dari sitoplasma tetua jantan ikut diperoleh.
Langkah awal yang menentukan keberhasilan fusi protoplas adalah men-dapatkan protoplas kedua tetua dengan densitas yang tinggi. Penghancuran dinding sel dengan menggunakan enzim selulase dikombinasikan dengan mace-rozim dapat menghasilkan protoplas dengan struktur yang sempurna dan densitas yang tinggi.
Kombinasi selulase R-10 2% dan macerozim 0,50% dalam larutan CPW menghasilkan protoplas yang paling
banyak, baik untuk lada liar maupun lada budi daya (Tabel 1). Untuk fusi digunakan PEG 6000 konsentrasi 30% selama 25 menit. Protoplas yang telah mengalami fusi ditunjukkan dengan volume protoplas yang makin besar. Keberhasilan protoplas yang mengalami fusi masih rendah, yaitu 20%.
Setelah fusi, sel hibrida dikulturkan pada beberapa formulasi media. Koloni mikrokalus dapat diperoleh dengan me-nambahkan sukrosa 3% pada media 1/2 LV + ABA 0,01 mg/l + casein hidrolisat 50 mg/l + BA (4,50 mg/l). Koloni sel tidak terbentuk pada media dengan sukrosa 2% (Tabel 2).
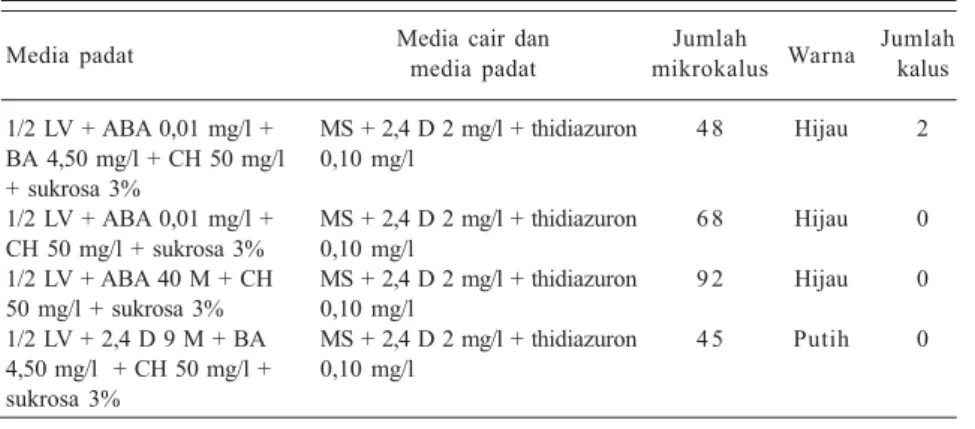
Untuk mendorong pertumbuhan mikrokalus dan regenerasinya maka mikro-kalus disubkultur pada media baru (Tabel 3). Pada media baru tersebut,mikrokalus berhasil tumbuh dan berwarna hijau. Perubahan warna dari putih menjadi hijau menandakan klorofil mulai terbentuk yang dibutuhkan untuk regenerasi koloni mikrokalus. Untuk lebih memacu per-tumbuhan, di atas media padat dapat diberi selapis tipis media cair MS + 2,4 D 2 mg/l + thidiazuron 0,10 mg/l (Tabel 4). Setelah pemberian media tersebut, koloni baru mulai terbentuk dan kalus tumbuh dengan cepat yang ditandai dengan penambahan ukuran koloni.
Tabel 2. Pertumbuhan sel lada hasil fusi pada penambahan sukrosa dan BA pada media kultur.
Sukrosa Komposisi media Jumlah koloni Warna
(%) mikrokalus koloni 2 1/2 LV + ABA 0,01 mg/l + CH 50 mg/l 0 -1/2 LV + ABA 0,01 mg/l + CH 50 mg/l + BA 4,50 mg/l 0 -3 1/2 LV + ABA 0,01 mg/l + CH 50 mg/l 4 Hijau 1/2 LV + ABA 0,01 mg/l + CH 50 mg/l + BA 4,50 mg/l 6 Putih CH = casein hidrolisat.
Sumber: Husni et al. (1997).
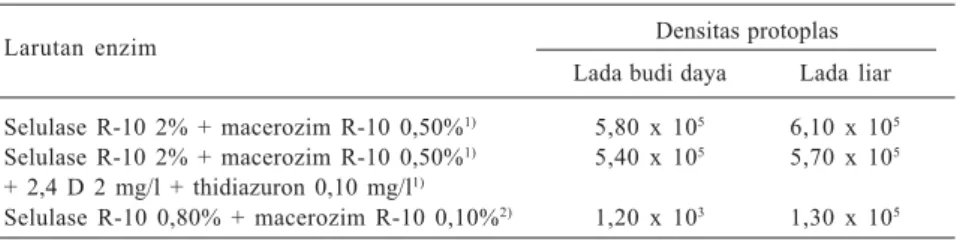
Tabel 1. Isolasi protoplas lada liar dengan lada budi daya pada berbagai komposisi media dengan masa inkubasi 16 jam.
Larutan enzim Densitas protoplas Lada budi daya Lada liar Selulase R-10 2% + macerozim R-10 0,50%1) 5,80 x 105 6,10 x 105
Selulase R-10 2% + macerozim R-10 0,50%1) 5,40 x 105 5,70 x 105
+ 2,4 D 2 mg/l + thidiazuron 0,10 mg/l1)
Selulase R-10 0,80% + macerozim R-10 0,10%2) 1,20 x 103 1,30 x 105 1)Dalam larutan CPW, 2)Dalam larutan MS.
Aceh (budi daya) yang kadar minyaknya tinggi.
Isolasi protoplas menggunakan kom-binasi pektinase 0,50% dengan selulase 0,50% dan 1% selama 16 jam (Tabel 5). Penggunaan selulosa 0,50% dan kom-binasi macerozim 0,50% menghasilkan protoplas dengan densitas yang tinggi. Peningkatan konsentrasi selulosa umum-nya menurunkan densitas protoplas. Densitas protoplas paling tinggi terdapat pada nilam Girilaya dengan selulosa 2% (Tabel 5).
Fusi protoplas antara dua tetua nilam dengan menggunakan PEG 6000 dengan konsentrasi 30% memberikan persentase keberhasilan 5,60% per bidang pandang untuk fusi biner dan 10% untuk multifusi. Untuk PEG 50%, keberhasilan pada fusi biner lebih tinggi yaitu 16,70% dan untuk multifusi 17,60% (Nuryani et al. 1999). Protoplas hasil fusi kemudian dicuci 2−3 kali dan dikulturkan dalam media KM8P dan VKM yang diberi 2,4 D 0,30 mg/l + NAA 1 mg/l. Dari fusi protoplas tersebut diperoleh 30 genotipe baru. Setiap geno-tipe selanjutnya dianalisis kandungan lignin total dan fenol pada akar.
Menurut Dalmaso et al. (1992), mekanisme ketahanan terhadap nema-toda dapat terjadi secara fisik dan kimiawi. Hasil penelitian menunjukkan bahwa tanaman yang tahan nematoda mempunyai kandungan fenol dan lignin yang lebih tinggi daripada tanaman yang rentan. Pada tanaman pisang senyawa fenol dan lignin memiliki hubungan yang sangat erat dengan ketahanan terhadap nematoda R. similis (Volette et al. 1998). Untuk itu, nomor-nomor baru hasil fusi perlu dilakukan analisis kandungan fenol dan lignin serta dibandingkan dengan nilam Jawa yang tahan dan nilam Aceh yang rentan. Kandungan fenol yang tinggi diperoleh dari nomor 9 II 34−0,10 sebesar 97,40 ppm, lebih besar dari tetuanya nilam Jawa. Untuk lignin, terdapat 10 nomor hasil fusi dengan kandungan lignin hampir sama dengan nilam Jawa.
Di samping kandungan fenol dan lignin yang beragam, tanaman hasil fusi juga memperlihatkan keragaman fenotipik terutama nomor 2 IV dan 9 IV yang mem-punyai ukuran daun lebih besar dan jumlah daun lebih banyak dibanding-kan kedua tetuanya (Nuryani et al. 2001). Hasil tersebut menunjukkan bahwa fusi protoplas dapat digunakan untuk me-ningkatkan keragaman genetik pada Tabel 3. Pertumbuhan mikrokalus lada yang disubkultur pada berbagai
media.
Media subkultur Warna koloni Keterangan 1/2 LV + ABA 0,01 mg/l + CH 50 mg/l + sukrosa 3% Hijau Tumbuh 1/2 LV + ABA 0,01 mg/l + CH 50 mg/l + BA 4,50 mg/l + Hijau Tumbuh sukrosa 3%
1/2 LV + ABA 40 M + CH 50 mg/l + sukrosa 3% Hijau Tumbuh 1/2 LV + 2,4 D 9 M + CH 50 mg/l + BA 4,50 mg/l + sukrosa 3% Hijau Tumbuh Sumber: Husni et al. (1997).
Tabel 5. Densitas protoplas pada nilam pada konsentrasi enzim pektinase 0,50% dan berbagai konsentrasi selulase.
Jenis nilam Densitas protoplas
Selulase 0,50% Selulase 1% Selulase 2% Girilaya 3 x 106 1,20 x 106 2,10 x 105
TT 75 4,40 x 105 1,90 x 105 1,40 x 105
Sumber: Nuryani et al. (1999).
Tabel 4. Pembentukan mikrokalus dan kalus dari protoplas lada dengan penambahan selapis tipis media cair.
Media padat Media cair danmedia padat mikrokalusJumlah Warna Jumlahkalus 1/2 LV + ABA 0,01 mg/l + MS + 2,4 D 2 mg/l + thidiazuron 4 8 Hijau 2 BA 4,50 mg/l + CH 50 mg/l 0,10 mg/l
+ sukrosa 3%
1/2 LV + ABA 0,01 mg/l + MS + 2,4 D 2 mg/l + thidiazuron 6 8 Hijau 0 CH 50 mg/l + sukrosa 3% 0,10 mg/l
1/2 LV + ABA 40 M + CH MS + 2,4 D 2 mg/l + thidiazuron 9 2 Hijau 0 50 mg/l + sukrosa 3% 0,10 mg/l
1/2 LV + 2,4 D 9 M + BA MS + 2,4 D 2 mg/l + thidiazuron 4 5 Putih 0 4,50 mg/l + CH 50 mg/l + 0,10 mg/l
sukrosa 3%
Sumber: Husni et al. (1997).
FUSI PROTOPLAS
TANAMAN NILAM
Nilam (Pogostemon cablin) merupakan tanaman penghasil minyak atsiri yang mempunyai nilai ekonomi tinggi. Indo-nesia merupakan pemasok minyak nilam terbesar di pasaran dunia. Ekspor minyak nilam Indonesia pada tahun 2002 sebesar 1.295 ton dengan nilai US$22 juta (Direk-torat Jenderal Bina Produksi Perkebunan 2004).
Tanaman nilam yang dibudidayakan di Indonesia tidak berbunga sehingga sulit mendapatkan genotipe baru me-lalui persilangan seksual. Selain itu, pengembangan nilam menghadapi ma-salah serangan nematoda Pratylenchus
brachyurus. Sifat ketahanan terhadap
nematoda tersebut terdapat pada nilam Jawa (Girilaya) yang produksi minyaknya rendah. Untuk memindahkan sifat ke-tahanan tersebut maka dilakukan fusi protoplas antara nilam Jawa dan nilam
tanaman nilam. Berdasarkan keragaman yang ditimbulkan tersebut kemudian dilakukan uji ketahanan terhadap nematoda.
FUSI PROTOPLAS
TANAMAN TERUNG
Terung (Solanum melongena L.) meru-pakan salah satu jenis sayuran penting di daerah tropis dan subtropis. Salah satu kendala dalam pengembangan terung adalah serangan penyakit layu bakteri yang disebabkan oleh Ralstonia
solana-cearum, jamur Fusarium oxysporum dan F. melongena, serta nematoda Meloi-dogyne sp. Serangan penyakit layu bakteri
di Jawa, Sumatera, Bali, Lombok, dan Sulawesi menyebabkan kehilangan hasil 15−95%.
Sumber ketahanan terhadap penyakit layu pada terung terdapat pada kerabat liarnya, seperti Solanum sanitwongsai, S.
torvum (takokak), S. sysimbrifolium, dan S. aethiopicum (Mariska et al. 2002).
Persilangan seksual antara terung budi daya dan kerabat liarnya sering mengalami kegagalan karena adanya ketidaksesuaian (incompatibility) atau F1 yang dihasilkan sering steril. Untuk mengatasi masalah tersebut dapat digunakan fusi protoplas antara S. melongena dan S. torvum atau
S. aethiopicum dilanjutkan dengan kultur
anther dan hibridisasi silang balik. Proto-plas diisolasi dari daun secara in vitro dengan menggunakan enzim selulase dan pektinase.
Jumlah protoplas paling banyak dihasilkan oleh kultivar Kopek (14,27 x 105
protoplas/g daun), diikuti oleh kultivar Dourga (14,07 x 105) dan Medan (12,91 x
105) (Tabel 6). Jumlah protoplas yang
dihasilkan kultivar Kopek dan Dourga tidak terlalu berbeda, sedangkan rata-rata jumlah protoplas kultivar Medan lebih sedikit dibanding kultivar Kopek dan Dourga.
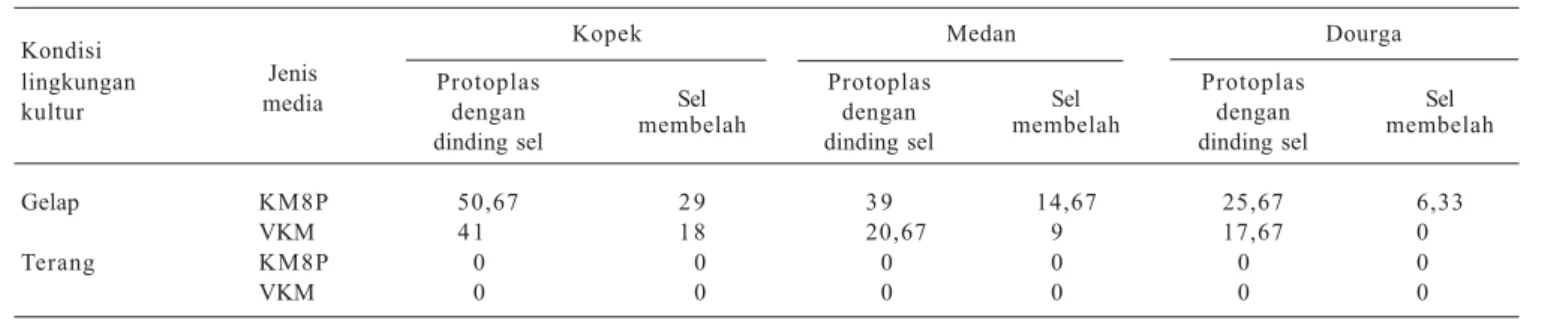
Protoplas hanya dapat membentuk dinding sel pada media yang diinkubasi dalam keadaan tanpa cahaya, baik pada media KM8P maupun VKM dengan penambahan 2,4 D 0,20 mg/l + zeatin 0,50 mg/l + NAA 1 mg/l. Kultur protoplas yang disimpan dengan pemberian cahaya 1.000 lux selama 12 jam/hari tidak dapat membentuk dinding sel (Tabel 7).
Perkembangan protoplas semua kultivar pada media dasar KM8P lebih baik dibanding pada media VKM. Persentase protoplas yang dapat membentuk dinding sel dan melakukan pembelahan tertinggi terdapat pada kultivar Kopek, diikuti oleh kultivar Medan dan Dourga.
Fusi protoplas dilakukan dengan menggunakan PEG 6000 konsentrasi 30% selama 20 menit untuk mendorong pertum-buhan dan perkembangan protoplas membentuk koloni sel. Media KM8P + 2,4 D 0,20 mg/l + zeatin 0,50 mg/l + NAA 1 mg/l memberikan hasil terbaik. Setelah
ter-bentuk koloni sel, penambahan 2,4 D 0,10 mg/l + BAP 2 mg/l pada media pengen-ceran dapat meningkatkan kemampuan protoplas membentuk kalus. Regenerasi kalus membentuk tunas adventif dapat terjadi pada media MS + vitamin Morel Vettmore + IAA 0,10 mg/l + zeatin 2 mg/l. Hibrida somatik yang terbentuk kemudian dikarakterisasi ketahanannya terhadap penyakit.
Karakterisasi ketahanan hibrida somatik terhadap penyakit layu bakteri dilakukan di Kebun Percobaan Pacet (1.000 m dpl) dan Kebun Percobaan Cibadak (1.200 m dpl). Tanaman umur 1 bulan sejak aklimatisasi diinokulasi dengan cara disiram suspensi bakteri R.
solanacearum T926 di sekitar akar
an yang telah dilukai. Selanjutnya tanam- tanam-an diinkubasi selama 2 hari lalu dipindah-kan ke lapangan. Tanaman yang bertahan di lapangan dikarakterisasi pertumbuhan dan produksinya. Karakterisasi genetis dan molekuler meliputi jumlah kromosom, markah spesifik spesies dan isoenzim.
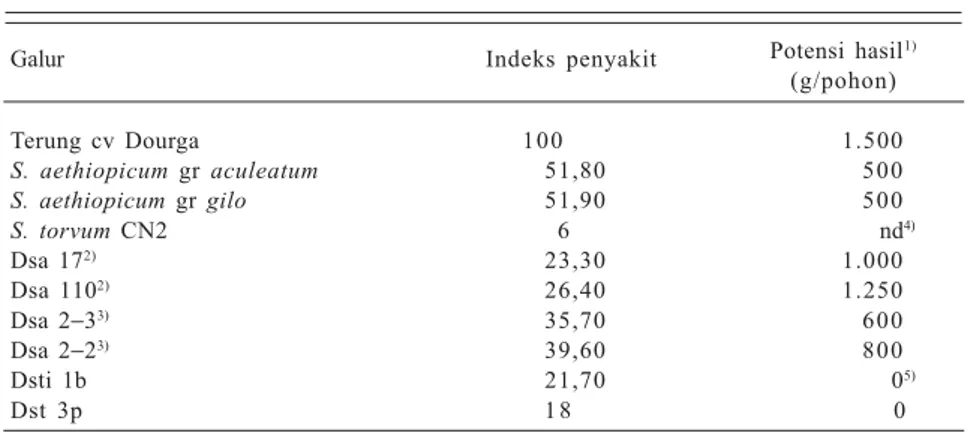
Hasil uji ketahanan menunjukkan bahwa hibrida somatik tahan terhadap infeksi R. solanacearum, bahkan bebe-rapa di antaranya lebih tahan dari kerabat liarnya (Tabel 8). Hal ini terjadi karena hibrida somatik umumnya lebih vigor daripada terung maupun kerabat liarnya, namun potensi hasilnya lebih rendah dari terung. Ukuran dan bentuk buah hibrida berada antara terung budi daya dan kerabat liarnya serta rasanya pahit. Hibrida hasil fusi antara terung dan tako-kak tidak menghasilkan buah karena bunga selalu gugur sebelum mekar. Hal ini diduga karena adanya ketidaksesuaian sehingga fusi asimetris dirintis untuk diterapkan.
Tabel 7. Persentase protoplas terung yang membentuk dinding dan membelah pada satu minggu setelah penaburan pada berbagai kondisi lingkungan kultur dan jenis media.
Kondisi Kopek Medan Dourga
lingkungan Jenis Protoplas
Sel Protoplas Sel Protoplas Sel
kultur media dengan dengan dengan
dinding sel membelah dinding sel membelah dinding sel membelah Gelap KM8P 50,67 2 9 3 9 14,67 25,67 6,33
VKM 4 1 1 8 20,67 9 17,67 0
Terang KM8P 0 0 0 0 0 0
VKM 0 0 0 0 0 0
Sumber: Husni et al. (2003).
Tabel 6. Rata-rata jumlah protoplas terung dari setiap gram da-un setelah inkubasi 16 jam dalam larutan selulosa 0,50% macerozim 0,50%.
Kultivar Densitas protoplas (105)
Kopek 14,27 + 6,34 Medan 12,91 + 2,04 Dourga 14,07 + 3,89 Sumber: Husni et al. (2003).
Tabel 8. Indeks penyakit layu bakteri pada tanaman terung kultivar Dourga,
Solanum aethiopicum, dan hibridanya.
Galur Indeks penyakit Potensi hasil1) (g/pohon) Terung cv Dourga 100 1.500 S. aethiopicum gr aculeatum 51,80 500 S. aethiopicum gr gilo 51,90 500 S. torvum CN2 6 nd4) Dsa 172) 23,30 1.000 Dsa 1102) 26,40 1.250 Dsa 2−33) 35,70 600 Dsa 2−23) 39,60 800 Dsti 1b 21,70 05) Dst 3p 1 8 0
1)Dari tiga kali panen, 2)donor kerabat liar S. aethiopicum gr aculeatum, 3)donor kerabat liar
S. aethiopicum gr gilo, 4)tidak diamati, 5)bunga gugur. Dsa = hibrida somatik.
Sumber: Nuryani et al. (1999).
Tabel 9. Ketahanan galur dihaploid terung terhadap penyakit layu bakteri.
Galur Indeks penyakit Jumlah buah Tetua tahan
S. aethiopicum Sa1 6 4 3 4
Hibrida somatik pembanding
Dsa 110 7 2 1 3 Galur dihaploid Pol 5A 5 0 481) Pol 5B 5 0 2 1 Pol II 6A 2 2 37,50 Dsa E4 2 0 Dsa E5 6,67 0
1)Ukuran buah jauh lebih kecil dari tetua tahan.
Sumber: Mariska et al. (2002).
Sumberdaya Genetik Pertanian (BB-Biogen).
Galur-galur dihaploid yang diper-oleh diuji ketahanannya terhadap R.
solanacearum. Beberapa galur seperti Pol.
5A, Pol 5B, dan Pol II 6A menunjukkan ketahanan terhadap penyakit layu bakteri dan dapat memproduksi buah (Tabel 9).
Hibridisasi silang balik pertama (BC1) antara dihaploid dan terung budi daya menghasilkan 16 individu dari tetua jantan Pol 5A, sedangkan persilangan antara Pol 5B, dan Pol II 6A dengan tetua terung cv Dourga belum mendapatkan hasil. Empat tanaman, yaitu nomor Pol 5A-1, BC1-Pol 5A-2, BC1-BC1-Pol 5A-5, dan BC1-BC1-Pol 5A-6 terbukti tahan terhadap penyakit layu bakteri. Dengan demikian keempat ta-naman BC1 tersebut dapat digunakan untuk mendapatkan nomor-nomor silang balik kedua (BC2). Morfologi warna buah yang berasal dari BC2 - Pol 5A menyerupai tetuanya yaitu terung cv Dourga.
KESIMPULAN
Fusi protoplas dapat memindahkan sifat ketahanan dari kerabat liar ke dalam terung budi daya. Pada tanaman nilam, fusi pro-toplas dapat meningkatkan kandungan fenol dan lignin pada beberapa hibrida somatik seperti halnya kerabat liarnya.
Hibrida somatik tanaman terung yang dihasilkan toleran terhadap penyakit layu bakteri, bahkan beberapa di antaranya lebih tahan dibandingkan kerabat liarnya. Melalui silang balik antara tanaman dihaploid dengan terung dapat dihasilkan genotipe baru dengan morfologi warna dan struktur buah yang menyerupai tetua hibridanya.
DAFTAR PUSTAKA
Ammirato, P.V., D.A. Evans, W.R. Sharp, and Y. Yamada. 1983. Handbook of Plant Cell Culture. MacMillan Publ. Co., New York and London.
Dalmaso, A., P. Castajonom-Sereno, and P. Ahad. 1992. Tolerance and resistance of plants to nematodes, knowledge needs and prospect. Seminar Nematologica 38: 466−472. Direktorat Jenderal Bina Produksi Perkebunan.
2004. Statistik Perkebunan Indonesia 2000−
2003: Nilam. Direktorat Jenderal Bina Produksi Perkebunan, Jakarta. 23 hlm. Husni, A., I. Mariska, dan S. Rahayu. 1997.
Hibridisasi somatik lada liar dengan lada
budi daya. Prosiding Seminar Perhimpunan Bioteknologi Pertanian Indonesia, Surabaya, 12−14 Maret 1997.
Husni, A., G.A. Wattimena, I. Mariska, dan A. Purwito. 2003. Keragaman genetik tanaman terung hasil regenerasi protoplas. Jurnal Bioteknologi Pertanian 8(2): 52−59. Kasim, R. 1997. Ketahanan tujuhspesies lada
terhadap penyakit Phytophthora. Pem-beritaan Penelitian Tanaman Rempah dan Obat (39): 34−38.
Mariska, I., R. Purnamaningsih, Hobir, K. Mulya, A. Husni, S. Rahayu, M. Kosmiatin, and D. Sihachakr. 2002. Improvement of bacterial
wilt resistance of eggplant through protoplast fusion. Jurnal Penelitian dan Pengembangan Pertanian 20(1): 25−31.
Millam, S., L.A. Payne, and G.R. Mackay. 1995. The integration of protoplast fusion-derived material into a potato breeding programme: a review of progress and problem. Euphytica 85: 451−455.
Nuryani, Y., I. Mariska, A. Husni, dan C. Syukur. 1999. Fusi protoplas nilam Jawa dan nilam Aceh. Prosiding Ekspose Hasil Penelitian Bioteknologi Pertanian, Jakarta 31 Agustus−
1 September 1999. Perhimpunan Bio-teknologi Pertanian.
Produksi galur dihaploid dari hasil fusi protoplas antara S. melongena dan S.
aethiopicum yang tahan terhadap R. solanacearum dan F. oxysporum f.sp.
melongenis dilakukan oleh ISO dan
Universitas Paris. Teknik ini sedang dikembangkan oleh Balai Besar Penelitian dan Pengembangan Bioteknologi dan
Nuryani, Y., I. Mariska, C. Syukur, A. Husni, dan S. Utami. 2001. Peningkatan keragaman genetik nilam (Pogostemon sp.) melalui fusi protoplas. Edisi khusus Acta Biochemical Indonesia. Prosiding Seminar Nasional. Per-himpunan Biokimia dan Biologi Molekuler, Cisarua Bogor 4−5 Juli 2001.
Nyman, M. and S. Waara. 1997. Characteri-zation of somatic hybrids between Solanum
tuberosum and its frost-tolerant relative Solanum commersonii. Theor. App. Gen.
95: 1.127−1.132.
Serraf, I. 1991. Evaluation des combination genomiques obtenues por hybridization somatique entre la pomme de terre (Solanum
tuberosum L.) et des Solanaceae de plus ou
moins grandes affinities phytogenetiques.
These Universite de Paris Sud. Centre d’Ousay. France.
Volette, C., C. Andary, J.P. Geiger, J.L. Sarah. and M. Nicole. 1998. Histochemical and cytochemical investigations on phenols in roots of banana infected by the burraucing nematod Randopholis sinilis. The American Phytophatological Society.