4 Hasil Penelitian dan Pembahasan
4.1 Sintesis serta Karakterisasi H
2Sintesis ligan H
SbBP
2SbBP dilakukan dengan mereaksikan MPP dengan sebakoil pada suhu
100-125oC selama 5 jam. Pada sintesis ligan H2SbBP digunakan Ca(OH)2 sebagai sumber OH
-N N O CH3 H H
+
HO- N N O -CH3 Cl Cl O O N N O CH3 Cl O -O Cl N N O -C H3+
+
N N O C H3 O O -Cl N N O CH3 N N O C H3 N N O CH3 O O 6 6 6 6 MPP sebakoil MPP -H2O H N N O C H3 H N N O CH3 O O H2SbBP H+ H+ 6untuk membantu keberlangsungan reaksi.
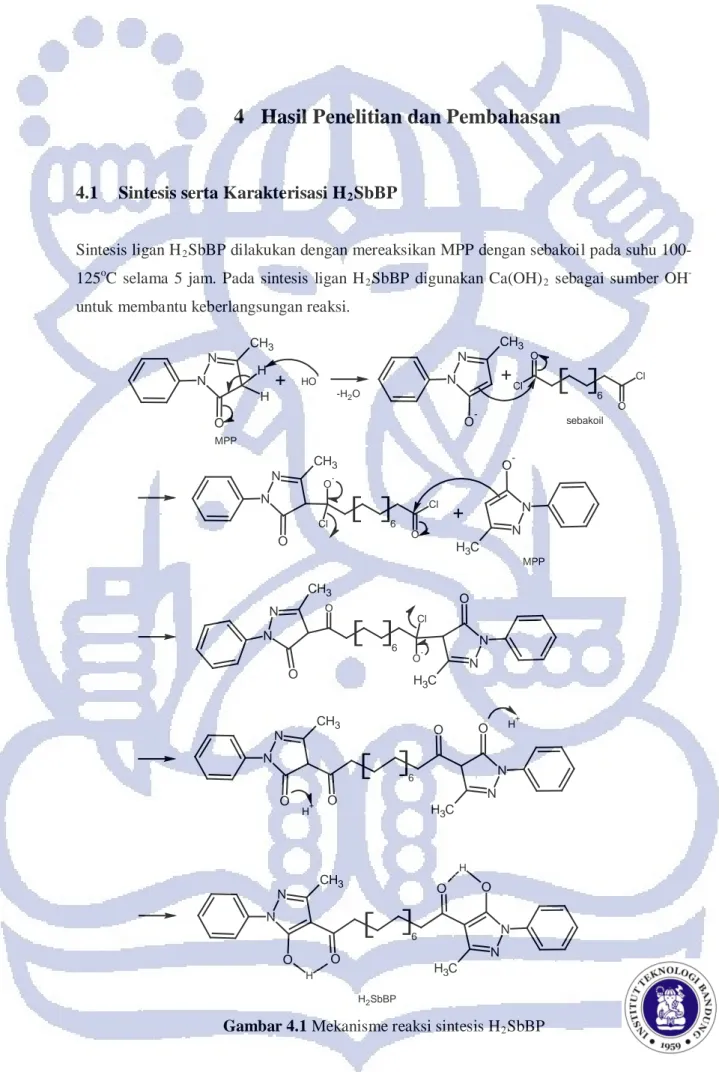
26 Gambar 4.1 menunjukkan mekanisme reaksi yang terjadi selama proses sintesis H2SbBP.
Sintesis dilakukan sesuai dengan prosedur Jensen2. Mula-mula MPP direaksikan dengan basa Ca(OH)2 untuk mengaktifkan MPP. OH
-akan menyerang atom hidrogen pada Cα sehingga
elektron berpindah dan membentuk enolat. Selanjutnya ikatan rangkap yang terbentuk menyerang salah satu gugus karbonil pada sebakoil dan menyebabkan atom Cl pada sebakoil terlepas. Reaksi dilanjutkan dengan penyerangan MPP teraktivasi ke gugus karbonil lainnya
pada sebakoil dengan mekanisme yang sama dan akhirnya membentuk H2SbBP dalam
larutan basa. Dari mekanisme reaksi yang terlihat pada Gambar 4.1, diperkirakan reaksi berjalan agak lambat. Maka, reaksi sintesis dilakukan selama 5 jam untuk memastikan bahwa semua sebakoil telah bereaksi membentuk H2SbBP. Media pelarut yang digunakan
adalah dioksan karena semua reagen dan produk akan larut cukup baik dalam 1,4-dioksan sehingga reaksi dapat berlangsung.
Gambar 4.2 Hasil sintesis H2
Setelah proses sintesis selama 5 jam selesai, ligan H
SbBP setelah ditambah HCl
2SbBP yang terbentuk akan larut dalam
suasana basa. Setelah didinginkan, larutan ditambah HCl 2 M agar H2SbBP yang terbentuk
mengendap dan dapat disaring (Gambar 4.2).
Gambar 4.3 Ligan H2
Ketika ditambah HCl, atom O pada cincin pirazolone akan mengikat H SbBP setelah disaring dan dikeringkan
+
menyebabkan ligan H2SbBP cenderung menjadi bentuk keto enolnya. Endapan yang diperoleh kemudian
27 dengan aqua dm hingga pH larutan pencuci mencapai 7. Tahapan ini bertujuan untuk memastikan bahwa endapan telah terbebas dari kelebihan Ca(OH)2 dan HCl. Gambar 4.3
menunjukkan ligan H2SbBP yang telah dikeringkan. Ligan H2
Secara stoikiometri, reaksi keseluruhan yang terjadi adalah:
SbBP hasil sintesis berwarna kuning dan berjumlah 12,2027 gram.
2MPP + Ca(OH)2 + sebakoil → H2SbBP + 2H2O + Ca 2+ + 2Cl- atau 2C10H10N2O + Ca(OH)2 + C10H16O2Cl2→ C30H34O4N4 + 2H2O + Ca 2+ + 2Cl Maka, menurut perhitungan teoritis jika jumlah MPP adalah 0,0354 mol, Ca(OH)
-
2 0,0281
mol, dan sebakoil 0,0140 mol akan menghasilkan H2
(Pers. 4.1)
SbBP sebanyak 0,0140 mol, yaitu 7,196 gram. Maka rendeman yang diperoleh adalah:
Dari hasil penelitian diperoleh jumlah ligan yang lebih besar dibandingkan hasil perhitungan sehingga rendemannya melebihi 100%. Hal ini dapat disebabkan karena penimbangan dilakukan dalam keadaan sedikit basah atau adanya senyawa pengotor lain dalam endapan yang diperoleh.
Untuk mengetahui apakah H2SbBP hasil sintesis cukup murni, maka dilakukan penentuan
titik leleh. Menurut penelitian yang telah dilakukan, titik leleh H2SbBP adalah 136 o
C.12 Sedangkan ligan yang berhasil kami sintesis memiliki titik leleh 127,8-132o
Sebelum melakukan rekristalisasi, dilakukan pengujian kelarutan untuk menentukan pelarut terbaik yang akan digunakan dalam rekristalisasi. Adapun hasil pengujian kelarutan yang dilakukan:
C. Perbedaan titik leleh yang diperoleh menunjukkan bahwa ligan yang disintesis belum murni dan perlu dilakukan rekristalisasi.
Tabel 4.1 Hasil Uji Kelarutan H2
Senyawa
SbBP
Pelarut
n-heksan metanol CHCl3 H2O Etanol : air
5:1 CHCl3 1:1 : n-heksan MPP + ++++ ++++ x ++++ ++ Sebakoil ++++ ++++ ++++ x ++ ++++ H2SbBP ++ +++ ++++ x ++ +++
28 Dari hasil uji kelarutan yang dilakukan maka dipilih etanol:air = 5:1 sebagai pelarut untuk melakukan rekristalisasi. Setelah dilakukan rekristalisasi, diperoleh endapan yang lebih murni. Hal ini ditunjukkan dengan hasil penentuan titik leleh yang mendekati titik leleh menurut literatur (136oC) yaitu 132,9-135,4o
Tabel 4.2 Data spektrum IR H
C. Namun, rendeman hasil rekristalisasi hanya 56,48%.
2SbBP dan H2AdBP 12
vOH vasC=O Fenil
vC=C Ulur cincin pirazolon vasC=C=C vC=O Vibrasi cincin kelat H2AdBP H2 - SbBP 3350 b 1631 s 1626 s 1594 s 1592 s 1562 s 1552 s 1498 s 1498 s 1364 s 1364 m 632 m 508 m 640 m 508 m
Tabel 4.2 menunjukkan vibrasi-vibrasi gugus utama dari senyawa H2AdBP dan H2SbBP
yang berhasil disintesis oleh Uzuokwu. Puncak-puncak yang diperoleh Uzuokwu ternyata juga terlihat pada spektrum IR H2SbBP yang berhasil disintesis. Hal ini mengindikasikan
bahwa senyawa H2
Pada spektrum IR H
SbBP berhasil disintesis.
2SbBP yang diperoleh (Gambar 4.4), terlihat adanya puncak vibrasi –
OH pada bilangan gelombang 3450,65 cm-1. Adanya puncak –OH ini menandakan bahwa H2SbBP yang disintesis ada dalam bentuk tautomer ketoenol. Sedangkan tautomer diketon
dari senyawa ini tidak akan memberikan puncak –OH. Puncak pada 3072,60 cm-1
menandakan adanya stretching –CH dari gugus benzen. Vibrasi –CH2 alifatik terlihat pada
2939,52 cm-1. Pada daerah 2300-2400 cm-1 terlihat adanya puncak khas CO2 yang
merupakan gangguan dari udara saat pembuatan pellet KBr. Puncak khas lainnya sesuai dengan hasil yang diperoleh Uzuokwu, yaitu vibrasi C=O asimetrik pada 1624,06 cm-1, vibrasi C=O simetrik pada 1363,67 cm-1, vibrasi C=C fenil pada 1591,27 cm-1, stretching cincin pirazolon pada 1556,55 cm-1, vibrasi asimetrik-C=C- pada 1494,83 cm-1, serta daerah sidik jari yang menunjukkan vibrasi cincin kelat pada 640,37 cm-1 dan 507,28 cm-1
Jika dibandingkan dengan spektrum reagen-reagen yang digunakan, yaitu sebakoil dan MPP, terlihat adanya beberapa puncak-puncak khas. Puncak-puncak khas tersebut menandakan bahwa adanya pembentukan senyawa baru, bukan hanya pencampuran fisik dua senyawa.
29 Gambar 4.4 Spektrum IR H2 500 750 1000 1250 1500 1750 2000 2500 3000 3500 4000 4500 1/cm 0 15 30 45 60 75 90 %T 3450. 65 3072. 60 2939. 52 1876. 74 1782. 23 1710. 86 1624. 06 1591. 27 1556. 55 1494. 83 1462. 04 1438. 90 1396. 46 1363. 67 1321. 24 1271. 09 1211. 30 1182. 36 1159. 22 1074. 35 1028. 06 983. 70 908. 47 854. 47 831. 32 775. 38 750. 31 725. 23 686. 66 640. 37 607. 58 507. 28 489. 92 H2SbBP kita SbBP -OH -C-H benzen -CH2- CO2 -C=O -C=C fenil Stretching cincin Pirazolone -C=C=C- -C=O Vibrasi cincin kelat
30
Gambar 4.5 Spektrum IR sebakoil
500 750 1000 1250 1500 1750 2000 2500 3000 3500 4000 4500 1/cm 0 15 30 45 60 75 90 %T 3550. 95 2933. 73 2858. 51 1797. 66 1462. 04 1404. 18 1346. 31 1296. 16 1201. 65 1143. 79 1109. 07 952. 84 821. 68 723. 31 678. 94 569. 00 501. 49 432. 05 Sebacoil -C-H stretching -C=O Cl Cl O O 6
31 Gambar 4.6 Spektrum IR MPP 500 750 1000 1250 1500 1750 2000 2500 3000 3500 4000 4500 1/cm 10 20 30 40 50 60 70 80 90 100 %T 3126. 61 2922. 16 2850. 79 2569. 18 2360. 87 2337. 72 1807. 30 1602. 85 1523. 76 1498. 69 1456. 26 1390. 68 1346. 31 1303. 88 1240. 23 1195. 87 1155. 36 1074. 35 1024. 20 997. 20 916. 19 896. 90 850. 61 802. 39 752. 24 688. 59 653. 87 615. 29 574. 79 MPP -C-H benzen -CH2 -C=O -C=C fenil Stretching cincin Pirazolone -C=C=C- -C=O N N O CH3
32 Pada spektrum IR sebakoil (Gambar 4.5), terlihat dua puncak utama, yaitu pada bilangan gelombang 2933,73 cm-1 yang berasal dari stretching –CH2 alifatik dan pada 1797,66 cm
-1
yang berasal dari vibrasi gugus karbonil. Sedangkan puncak-puncak pada spektrum IR MPP (Gambar 4.6) hampir sama dengan puncak-puncak yang ditunjukkan oleh spektrum IR H2SbBP. Perbedaannya terletak pada puncak –OH dan puncak pada daerah sidik jari yang
berasal dari cincin pengkelat. Selain itu, terlihat adanya pergeseran beberapa puncak, misalnya puncak stretching cincin pirazolon yang bergeser dari 1523,76 cm-1 (pada MPP) menjadi 1556,55 cm-1 (pada H2SbBP). Pergeseran puncak ini menunjukkan bahwa cincin
pirazolon pada MPP tidak sama dengan cincin pirazolon pada H2SbBP. Puncak lainnya yang
bergeser adalah puncak C=O, dari 1602,85 cm-1 (pada MPP) menjadi 1624,06 cm-1
Setalah dilakukan rekristalisasi dengan etanol:air = 5:1, dilakukan penentuan spektrum IR kembali. Spektrumyang diperoleh (Gambar 4.7) menunjukkan puncak-puncak yang relatif sama dengan spectrum IR H
.
2
Selain itu, dilakukan juga penentuan titik leleh H
SbBP sebelum dilakukan rekristalisasi.
2
SbBP yang telah direkristalisasi
untuk mengamati perbedaan ligan sebelum dan sesudah direkristalisasi. Ternyata
H
2SbBP setelah rekristalisasi memiliki titik leleh 132,9-135,4
oC. Hasil ini
menunjukkan adanya perubahan titik leleh, mendekati hasil yang diperoleh
Uzuokwu, yaitu 136
oC. Oleh karena itu, dengan adanya tahapan rekristalisasi,
H
2SbBP menjadi lebih murni. Secara teori, senyawa yang murni memiliki range titik
leleh hanya 1
oC. Range titik leleh yang diperoleh cukup lebar (2,5
oC) menandakan
senyawa tidak murni. Namun, dipertimbangkan juga bahwa H
2SbBP
berkemungkinan ada dalam bentuk tautomer diketon dan ketoenol yang memiliki
titik leleh berbeda. Maka, H
2SbBP hasil rekristalisasi termasuk ligan dengan tingkat
kemurnian tinggi. Namun, dengan mempertimbangkan kecilnya rendeman (56,48%),
kesamaan spektrum IR yang diperoleh, dan fungsi ligan sebagai ekstraktan, maka
ligan yang selanjutnya digunakan dalam penentuan kapasitas sorpsi Ce
3+adalah ligan
H
2
33 Gambar 4.7 Spektrum IR H2 500 750 1000 1250 1500 1750 2000 2500 3000 3500 4000 4500 1/cm 0 15 30 45 60 75 90 %T 3466. 08 3072. 60 2939. 52 2854. 65 1745. 58 1710. 86 1625. 99 1554. 63 1496. 76 1463. 97 1440. 83 1398. 39 1363. 67 1323. 17 1271. 09 1211. 30 1184. 29 1159. 22 1074. 35 1028. 06 1002. 98 983. 70 910. 40 854. 47 831. 32 777. 31 750. 31 725. 23 688. 59 640. 37 607. 58 509. 21 491. 85 H2SbBP SbBP setelah rekristalisasi -OH -C-H benzen -CH2- -C=O -C=C fenil Stretching cincin Pirazolone -C=C=C- -C=O Vibrasi cincin kelat
34
4.2 Sintesis serta Karakterisasi H
2Sintesis ligan H
AdBP
2AdBP dilakukan dengan mereaksikan MPP dengan adipoil pada suhu
100-125oC selama 5 jam. Sama halnya dengan sintesis H2SbBP, pada sintesis ligan H2AdBP
digunakan Ca(OH)2 sebagai sumber OH -N N O CH3 H H
+
HO- N N O -CH3 Cl Cl O O N N O CH3 Cl O -O Cl N N O -C H3+
+
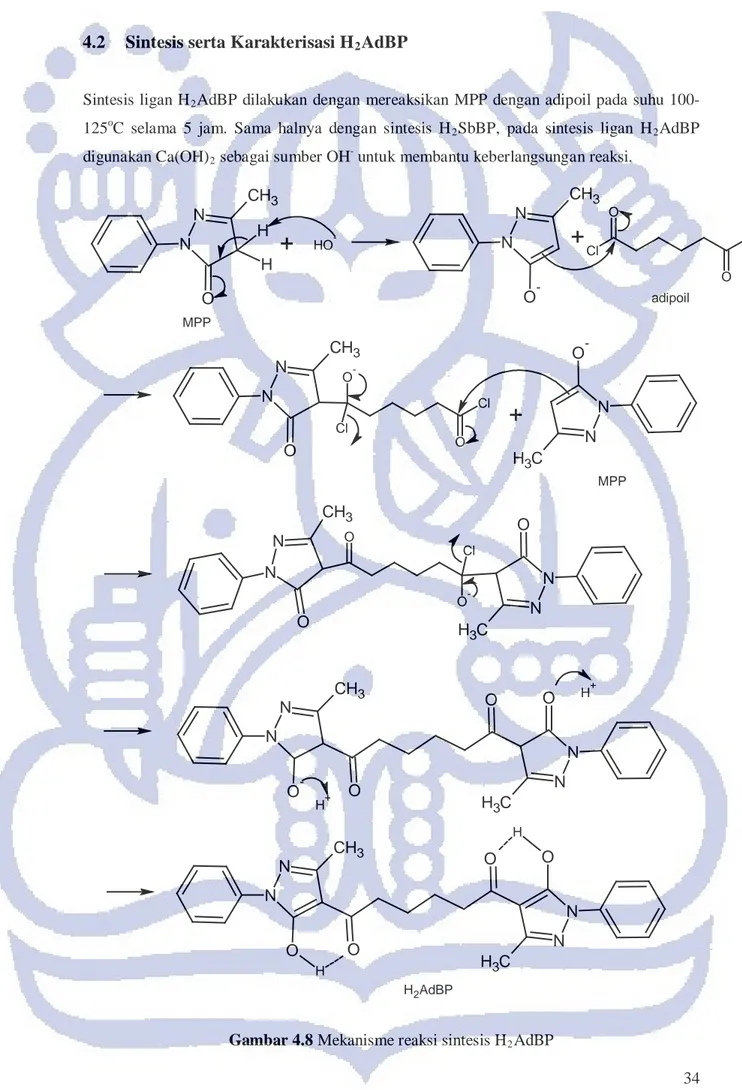
N N O C H3 O O -Cl N N O CH3 H N N O C H3 H N N O CH3 O O MPP adipoil MPP H2AdBP N N O C H3 N N O -CH3 O O H+ H+ untuk membantu keberlangsungan reaksi.35 Mekanisme reaksi sintesis H2AdBP ditunjukkan pada Gambar 4.8. Secara keseluruhan
mekanisme sintesis H2AdBP sama dengan mekanisme reaksi sintesis H2SbBP.
Perbedaannya hanya pada jumlah rantai etilena, dan hal tersebut itu mempengaruhi mekanisme reaksi sintesis. Pada sebakoil jumlah rantai etilena lebih panjang, yaitu 8, sedangkan pada adipoil hanya 4.
Gambar 4.9 Hasil sintesis H2
Walaupun hanya berbeda pada jumlah rantai etilena, secara fisik H AdBP setelah ditambah HCl
2AdBP berbeda dengan
H2SbBP. H2SbBP berwarna kuning sedangkan H2AdBP cokelat dan terlihat seperti endapan
yang lebih halus (Gambar 4.9).
Gambar 4.10 Penyaringan H2AdBP
36 Ketika disaring (Gambar 4.10) diperoleh filtrat hasil sintesis (Gambar 4.11) berwarna coklat karena merupakan sisa reagen atau produk samping yang larut dalam dioksan pada suasana asam. Reagen yang mungkin tersisa adalah MPP dan Ca(OH)2.
Gambar 4.12 H2
Gambar 4.12 menunjukkan ligan H
AdBP setelah dikeringkan
2AdBP yang telah dikeringkan. Ligan H2
Secara stoikiometri, reaksi keseluruhan yang terjadi adalah:
AdBP hasil sintesis berwarna coklat dan berjumlah 3,9106 gram.
2MPP + Ca(OH)2 + adipoil → H2AdBP + 2H2O + Ca 2+ + 2Cl atau -2C10H10N2O + Ca(OH)2 + C6H8O2Cl2→ C26H26O4N4 + 2H2O + Ca 2+ + 2Cl
Maka, menurut perhitungan teoritis dimana jumlah MPP adalah 0,0252 mol, Ca(OH)
-
2
0,0682 mol, dan sebacoyl 0,0123 mol akan menghasilkan H2
Dari hasil penelitian diperoleh jumlah ligan yang lebih kecil dibandingkan hasil perhitungan sehingga rendemannya kurang dari 100%. Hal ini dapat disebabkan karena adanya ligan yang tertinggal saat pemindahan dari suatu wadah ke wadah lain, adanya ligan yang lolos saat penyaringan, atau kurangnya jumlah HCl yang ditambahkan sehingga suasana larutan kurang asam dan ada molekul ligan yang belum mengendap sempurna.
SbBP sebanyak 0,0123 mol, yaitu 5,6334 gram. Sesuai dengan Persamaan 4.1, maka rendeman yang diperoleh adalah:
Untuk mengetahui apakah H2AdBP hasil sintesis cukup murni, maka dilakukan penentuan
titik leleh. Menurut penelitian yang telah dilakukan, titik leleh H2AdBP adalah 193oC untuk
tautomer diketon dan 199oC untuk tautomer ketoenol.12 Sedangkan ligan yang berhasil disintesis memiliki titik leleh 190,3-197,6oC. Besarnya range titik leleh yang diperoleh
37 menunjukkan bahwa ligan yang disintesis belum murni dan perlu dilakukan rekristalisasi. Rekristalisasi dilakukan dengan CHCl3 : n-heksan = 3:2. Namun, karena hasil rekristalisasi
sangat sedikit dan mempertimbangkan kebutuhan karakterisasi selanjutnya, maka rekristalisasi tidak dilakukan pada semua ligan.
Gambar 4.13 Hasil rekristalisasi H2
Pada penentuan spektrum IR, puncak-puncak dari H
AdBP
2AdBP relatif sama dengan spektrum
yang diperoleh Uzuokwu. Pada spektrum IR H2AdBP yang diperoleh (Gambar 4.14), terlihat
adanya puncak vibrasi –OH pada bilangan gelombang 3446,79 cm-1. Adanya puncak –OH ini menandakan bahwa H2AdBP yang disintesis ada dalam bentuk tautomer ketoenol.
Sedangkan tautomer diketon dari senyawa ini tidak akan memberikan puncak –OH. Puncak yang menandakan adanya stretching –CH dari gugus benzen muncul pada bilangan gelombang sekitar 3000 cm-1 namun intensitasnya sangat kecil sehingga kurang terlihat. Vibrasi –CH2 alifatik terlihat pada 2926,01 cm
-1
. Pada daerah 2300-2400 cm-1 terlihat adanya puncak khas CO2 yang merupakan gangguan dari udara saat pembuatan pelet KBr.
Puncak khas lainnya sesuai dengan hasil yang diperoleh Uzuokwu, yaitu vibrasi C=O asimetrik pada 1629,85 cm-1, vibrasi C=O simetrik pada 1363,67 cm-1, vibrasi C=C fenil pada 1593,20 cm-1, stretching cincin pirazolon pada 1560,41 cm-1, vibrasi asimetrik-C=C- pada 1494,83 cm-1, serta daerah sidik jari yang menunjukkan vibrasi cincin pengkelat pada 636,51 cm-1 dan 507,28 cm-1.
38 Gambar 4.14 Spektrum IR H2 500 750 1000 1250 1500 1750 2000 2500 3000 3500 4000 4500 1/cm 0 15 30 45 60 75 90 %T 3446. 79 2926. 01 2858. 51 1951. 96 1743. 65 1629. 85 1593. 20 1560. 41 1494. 83 1458. 18 1442. 75 1388. 75 1363. 67 1292. 31 1205. 51 1168. 86 1074. 35 1006. 84 974. 05 910. 40 812. 03 752. 24 688. 59 636. 51 584. 43 507. 28 H2AdBP AdBP -OH -CH2- -C=O -C=C fenil Stretching cincin Pirazolone -C=C=C- -C=O Vibrasi cincin kelat
39
Gambar 4.15 Spektrum IR adipoil
500 750 1000 1250 1500 1750 2000 2500 3000 3500 4000 4500 1/cm 10 20 30 40 50 60 70 80 90 100 %T 2958. 80 2669. 48 1801. 51 1691. 57 1462. 04 1406. 11 1355. 96 1313. 52 1276. 88 1192. 01 1085. 92 927. 76 734. 88 686. 66 569. 00 513. 07 433. 98 401 19 Adipoil -C-H stretching -C=O Cl Cl O O
40 Jika dibandingkan dengan spektrum reagen-reagen yang digunakan, yaitu adipoil dan MPP, terlihat adanya beberapa puncak-puncak khas. Puncak-puncak khas tersebut menandakan bahwa adanya pembentukan senyawa baru, bukan hanya pencampuran fisik dua senyawa. Pada spektrum IR adipoil (gambar 19), terlihat dua puncak utama, yaitu pada bilangan gelombang 2958,80 cm-1 yang berasal dari stretching –CH2 alifatik serta pada 1801,51 cm-1
dan 1691,57 cm-1 yang berasal dari vibrasi gugus karbonil. Sedangkan puncak-puncak pada spektrum IR MPP (gambar 10) hampir sama dengan puncak-puncak yang ditunjukkan oleh spektrum IR H2AdBP. Perbedaannya terletak pada puncak –OH dan puncak pada daerah
sidik jari yang berasal dari cincin pengkelat. Selain itu, terlihat adanya pergeseran beberapa puncak, misalnya puncak stretching cincin pirazolon yang bergeser dari 1523,76 cm-1 (pada MPP) menjadi 1560,41 cm-1 (pada H2AdBP). Pergeseran puncak ini menunjukkan bahwa
cincin pirazolon pada MPP tidak sama dengan cincin pirazolon pada H2AdBP. Puncak
lainnya yang bergeser adalah puncak C=O, dari 1602,85 cm-1 (pada MPP) menjadi 1629,85 cm-1
4.3 Pembuatan Kurva Kalibrasi Larutan Standar Ce
.
Pembuatan kurva kalibrasi larutan standar Ce (III) dilakukan dengan metoda spektrofotometri UV-Vis. Syarat penggunaan metoda spektrofotometri UV-Vis adalah larutan yang akan diukur absorbansnya memiliki warna yang masuk dalam daerah sinar ultraviolet atau tampak. Oleh karena itu, Ce(III) terlebih dahulu dikomplekan dengan alizarin
red S. Pemilihan alizarin red S sebagai agen pengompleks didasarkan sifat alizarin red S
yang mampu menangkap ion logam dengan baik. Selain itu, alizarin red S adalah agen pengompleks yang ramah lingkungan. Jurnal tahun 2004 telah melaporkan bahwa kompleks yang dibentuk dengan logam tanah jarang cukup stabil dan memiliki energi pengomplekan yang rendah. 3+ 2 O O O OH SO3Na Ce
Gambar 4.16 Struktur kompleks Ce-alizarin red S
Gambar 4.16 adalah salah satu kemungkinan struktur kompleks Ce-alizarin red S yang terbentuk. Kompleks Ce-alizarin yang terbentuk berwarna merah kecoklatan. Jika konsentrasi serium rendah, larutan berwarna coklat, ketika konsentrasi cukup tinggi, larutan
41 berubah menjadi merah hingga ungu, jika sangat pekat. Warna merah meneruskan sinar dengan panjang gelombang 610-750 nm, dan warna komplementernya, yaitu biru-hijau, memiliki panjang gelombang 490-560 nm.4 Oleh karena itu, ketika dilakukan pengukuran panjang gelombang maksimum, diperoleh λmaks
Kompleks serium-alizarin relatif stabil setelah 1 jam pada pH 4-5. adalah 530 nm.
13
Dari data penyerapan diperoleh kurva kalibrasi serium (III) pada Gambar 4.17. Dari kurva kalibrasi serium (III) didapat persamaan garis Y = 0,041 X – 0,021. Berdasarkan hukum Labert Beer, terdapat hubungan linear antara konsentrasi serium (III) dengan absorbans yang diperoleh ketika nilai ekstingsi molar (ε) dan lebar kuvet (b) adalah sama, sehingga Persamaan 2.3 dapat dituliskan kembali sebagai berikut:
Oleh karena itu, ditambahkan buffer asetat pH 4-5 dan setelah penambahan alizarin red S pada larutan serium, campuran didiamkan selama 1 jam. Setelah kompleks cukup stabil (lebih dari 1 jam), pengukuran larutan standar dilakukan pada panjang gelombang 530 nm. Hasil pengukuran penyerapan deret larutan standar serium (III) secara lengkap terdapat pada Lampiran.
A = kc (Pers. 4.2)
Dimana k adalah suatu tetapan. Oleh karena itu, ketika dibuat aluran antara A terhadap konsentrasi larutan Ce (III) akan diperoleh garis linear.
Gambar 4.17 Kurva kalibrasi serium (III)
Persamaan garis yang diperoleh tidak melewati titik (0,0), malainkan memiliki penyimpangan 0,021. Secara teori, seharusnya diperoleh kurva y = mx, yang berarti tidak ada serapan yang terukur apabila tidak terdapat analit dalam larutan yang diukur. Namun, secara eksperimen hal tersebut sulit diperoleh, dapat disebabkan karena pengaruh instrumen yang digunakan. Penyimpangan 0,021 termasuk kecil, dengan r2 = 0,995, maka persamaan
y = 0,041x - 0,021 R² = 0,995 -0,1 0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 0 5 10 15 20 25 A konsentrasi Ce3+ (ppm)
42 garis yang diperoleh dapat digunakan untuk analisis kuantitatif sampel serium (III). Konsentrasi sampel yang ditentukan harus berada dalam rentang daerah linear pengukuran pada kurva kalibrasi, yaitu memiliki nilai absorbans diantara 0,119 dan 0,8014.
4.4 Ekstraksi Cair-Cair Ce
3+dengan Variasi [H
2SbBP], [H
2Prinsip dasar pemisahan dengan ekstraksi cair-cair adalah terdistribusinya suatu solut dari fasa umpan ke fasa pelarut. Fasa umpan dan pelarut harus saling tidak campur. Oleh karena itu, fasa umpan dalam penelitian ini adalah larutan aqua dm yang mengandung solut, yaitu cerium (III), sedangkan fasa pelarut adalah larutan kloroform yang mengandung ligan H
AdBP], dan pH
2SbBP atau H2AdBP. Ligan H2SbBP dan H2AdBP berfungsi sebagai ekstraktan yang
dapat mempermudah distribusi serium ke fasa kloroform.
Gambar 4.18 Skema proses ekstraksi serium (III) Keterangan: L adalah ligan SbBP/AdBP
Dari Gambar 4.18, terlihat beberapa reaksi kesetimbangan yang mungkin mempengaruhi proses ekstraksi dan terjadi dalam fasa air, yaitu:
1. Reaksi pembentukan kompleks antara logam Ce3+ dengan ion OH- yang berasal dari
H2O. Reaksi ini memungkinkan terbentuknya endapan Ce(OH)3. Namun dalam
penelitian yang dilakukan, tidak terlihat adanya endapan putih Ce(OH)3
(Pers. 4.3)
sehingga reaksi pengomplekan ini diasumsikan tidak terjadi.
(Pers. 4.4)
43 2. Reaksi disosiasi ligan dalam fasa air. Ligan H2SbBP maupun H2AdBP adalah ligan
yang bersifat asam organik lemah. Oleh karena itu ada kemungkinan terjadi penguraian menghasilkan H+
(Pers. 4.6)
dalam fasa air. Namun, karena kelarutan ligan sangat kecil dalam fasa air. Maka, reaksi disosiasi ini diasumsikan tidak terjadi.
(Pers. 4.7)
3. Reaksi pembentukan kompleks kelat antara serium (III) dengan ligan. Reaksi ini lebih tepat dikatakan terjadi di antarmuka fasa air-kloroform.
(Pers. 4.8)
Mula-mula ligan di fasa kloroform (LH2)org
(Pers. 4.9)
terdistribusi ke antarmuka kemudian mengikat ion serium yang ada di antarmuka. Kompleks CeLn yang dihasilkan kemudian terdistribusi ke fasa kloroform. Oleh karena itu, konsentrasi logam dalam fasa air akan berkurang karena sebagian terikat ke fasa kloroform. Reaksi distribusi yang terjadi adalah:
(Pers. 4.10)
Agar lebih mudah, untuk selanjutnya penulisan disingkat dengan .
Jika diasumsikan reaksi yang terjadi dalam fasa (air) hanya reaksi pembentukan kompleks, maka:
(Pers. 4.11)
(Pers. 4.12)
Jika maka,
Log D = Log Kd2 – 2nLog [H +
] + Log K + n Log [LH2
Log Kd
] (Pers. 4.13)
44 Log D = K’ + 2n pH + n Log [LH2
Jika pH tetap, aluran log D terhadap log [LH
] (Pers. 4.14)
2] akan menghasilkan garis linear. Titik potong
garis dengan sumbu y akan menghasilkan nilai K’ + 2n pH. Kemiringan garis adalah nilai n. Jika [LH2] tetap, aluran log D terhadap pH akan menghasilkan garis linear. Titik potong
garis dengan sumbu y akan menghasilkan nilai K’ + n log [LH2
Pada penelitian yang dilakukan, mula-mula ekstraksi serium dilakukan pada pH 3,5. Konsentrasi ligan H
]. Kemiringan garis adalah 2n.
2SbBP dan H2AdBP divariasikan dengan mempertimbangkan
perbandingan mol logam dan ligan. Hasil penyerapan logam yang tersisa dalam fasa air terdapat dalam Lampiran. Ketika dibuat aluran log D terhadap log [ligan] diperoleh kurva linear naik. Hal ini menunjukkan bahwa semakin banyak ligan yang digunakan dalam ekstraksi, maka semakin banyak cerium yang terekstraksi ke fasa kloroform. Ketika digunakan ligan H2SbBP, diperoleh persamaan garis Y = 1,386X + 2,254 (Gambar 4.19),
sedangkan ligan H2AdBP menghasilkan persamaan garis Y = 1,275X + 1,289 (Gambar
4.20). Ligan H2SbBP maupun H2AdBP menghasilkan persamaan garis dengan kemiringan
mendekati 1,5. Oleh karena itu, dapat disimpulkan nilai n untuk Pers. 4.8 adalah 1,5.
Gambar 4.19 Kurva hasil ekstraksi serium dengan variasi [H2SbBP]
y = 1,386x + 2,254 R² = 0,994 -1,5000 -1,0000 -0,5000 0,0000 0,5000 1,0000 1,5000 2,0000 2,5000 -3,0000 -2,5000 -2,0000 -1,5000 -1,0000 -0,5000 0,0000 0,5000 log D log [H2SbBP](M)
Ekstraksi serium-variasi [H
2
SbBP]
45
Gambar 4.20 Kurva hasil ekstraksi serium dengan variasi [H2
Dari nilai n yang diperoleh maka dengan mensubstitusikan nilai 1,5 ke Pers. 4.8, diperoleh reaksi pembentukan kompleks:
AdBP]
(Pers. 4.15)
Agar diperoleh koefisien bernilai bulat, maka Pers. 4.16 dikalikan dengan faktor pengali 2, sehingga diperoleh persamaan pembentukan kompleks:
(Pers. 4.16)
Dari Pers. 4.15 diketahui bahwa sebuah ion logam Ce3+berinteraksi dengan 3 sisi donor β-diketon dari ligan H2SbBP maupun H2AdBP. Interaksi yang terjadi terlihat pada Gambar
4.21.
Gambar 4.21 Interaksi antara Ce3+ dengan H2SbBP dan H2AdBP
2 y = 1,275x + 1,289 R² = 0,997 -2,0000 -1,5000 -1,0000 -0,5000 0,0000 0,5000 1,0000 1,5000 -3,0000 -2,5000 -2,0000 -1,5000 -1,0000 -0,5000 0,0000 0,5000 log D log[H2AdBP]
46 Pada tahapan penentuan kinerja ligan dalam berbagai pH, massa ligan dibuat tetap sedangakan pH divariasikan dari 2-5. Hasil penyerapan logam yang tersisa dalam fasa air terdapat dalam Lampiran. Ketika dibuat aluran log D terhadap pH diperoleh kurva linear naik. Hal ini menunjukkan bahwa semakin tinggi pH ekstraksi, maka semakin banyak serium yang terekstraksi ke fasa kloroform. Ketika digunakan ligan H2SbBP, diperoleh persamaan
garis Y = 0,439X + 1,289 (Gambar 4.22), sedangkan ligan H2AdBP menghasilkan
persamaan garis Y = 0,208X + 1,291 (Gambar 4.23). Menurut Pers. 4.14 seharusnya kemiringan dari kurva log D terhadap pH bernilai 2n. Namun hasil penelitian menunjukkan hasil lain. Oleh karena itu, asumsi bahwa reaksi kesetimbangan dalam fasa (air) hanya reaksi pembentukan kompleks tidak berlaku pada ekstraksi variasi pH.
Gambar 4.22 Kurva hasil ekstraksi cerium menggunakan H2SbBP dengan variasi pH
Gambar 4.23 Kurva hasil ekstraksi cerium menggunakan H2AdBP dengan variasi pH
y = 0,439x - 1,289 R² = 0,831 -0,8000 -0,6000 -0,4000 -0,2000 0,0000 0,2000 0,4000 0,6000 0,8000 1,0000 1,2000 0 1 2 3 4 5 6 log D pH
Ekstraksi serium-variasi pH, H
2
SbBP
y = 0,208x - 1,291 R² = 0,895 -0,8 -0,7 -0,6 -0,5 -0,4 -0,3 -0,2 -0,1 0 0 1 2 3 4 5 6 log D pH47 Walaupun untuk rentang pH 2-5 diperoleh kurva linear naik, untuk rentang pH di atas 5 tidak dapat dipastikan bahwa hasil ekstraksi akan terus meningkat dengan naiknya pH. Hal ini dikarenakan adanya pengaruh reaksi-reaksi kesetimbangan lain yang mungkin terjadi saat kondisi pH larutan berubah. Reaksi kesetimbangan yang mungkin mempengaruhi ekstraksi telah dijelaskan di halaman 42, yaitu reaksi pengendapan Ce(OH)3
Dari hasil penentuan kinerja ligan pada ekstraksi cair-cair serium (III) dengan variasi [ligan] (Gambar 4.24) dan variasi pH (Gambar 4.25), dapat disimpulkan bahwa ligan H
dan disosiasi ligan. Kedua reaksi tersebut dapat menurunkan efisiensi ekstraksi. Untuk mengetahui pengaruh reaksi-reaksi tersebut masih perlu dilakukan penelitian dan pengkajian lebih lanjut.
2SbBP
memiliki kinerja yang lebih baik sebagai ekstraktan pada berbagai variasi [ligan] dan variasi pH. Hal ini sesuai dengan hipotesis yang menyatakan bahwa ligan dengan rantai polimetilen yang lebih panjang (untuk n= 4 dan n= 8) akan memiliki efisiensi ekstraksi lebih besar.2
Gambar 4.24 Kurva kinerja ekstraktan sebagai fungsi [ligan]
Gambar 4.25 Kurva kinerja ekstraktan sebagai fungsi pH 0,0000 0,2000 0,4000 0,6000 0,8000 1,0000 1,2000 1,4000 0,0000 0,0050 0,0100 0,0150 0,0200 0,0250 0,0300 D [ekstraktan]
Kinerja ekstraktan-variasi [ligan]
H2SbBP H2AdBP 0,0000 1,0000 2,0000 3,0000 4,0000 5,0000 6,0000 7,0000 0 1 2 3 4 5 6 D pH
Kinerja ekstraktan-variasi pH
H2SbBP H2AdBP48
4.5 Penentuan Faktor Pisah antara Serium dan Itrium
Untuk dapat mengetahui apakah pemisahan suatu ion logam dari logam lainnya dapat dilakukan dengan proses ekstraksi pelarut atau tidak, perlu dilakukan penentuan nilai faktor pemisahan atau selektivitas (α). Selektivitas merupakan suatu perbandingan antara angka banding distribusi logam yang satu dengan logam yang lain. Agar dapat dilakukan pemisahan, nilai α harus melebihi 1.
Dari Gambar 4.26 terlihat bahwa ekstraksi dengan H2SbBP pada pH 3 dan 4 menghasilkan
nilai Dce dan DY yang berbeda. Namun perbedaan paling besar diperoleh ketika kondisi
larutan pada pH 4. Semakin besar perbedaan D dua logam maka semakin besar faktor pisah yang diperoleh.
Gambar 4.26 Kurva perbandingan D Ce-Y dengan H2SbBP sebagai ekstraktan
Gambar 4.27 Kurva perbandingan D Ce-Y dengan H2AdBP sebagai ekstraktan
0 5 10 15 20 25 30 35 40 45 0 1 2 3 4 5 6 D pH
Perbedaan D Ce dan Y-H
2
SbBP
Ce Y 0 2 4 6 8 10 12 14 16 18 0 1 2 3 4 5 6 D pH
Perbedaan D Ce dan Y-H
2
AdBP
Ce Y
49
Dari Gambar 4.27 terlihat bahwa ekstraksi dengan H2AdBP pada pH 3, 4, dan 5
menghasilkan nilai Dce dan DY
Dari kurva yang diperoleh terlihat bahwa ligan H
yang berbeda. Namun perbedaan paling besar diperoleh ketika kondisi larutan pada pH 4.
2SbBP dan juga H2AdBP memiliki kinerja
yang lebih baik dalam mengikat ion itrium. Untuk mengetahui ligan mana yang lebih baik dalam memisahkan ion Ce3+ dan ion Y3+ perlu diketahui nilai selektivitas dengan lebih tepat. Tabel 4.3 menunjukkan nilai faktor pisah Y terhadap Ce menggunakan ligan H2SbBP dan
H2AdBP pada berbagai pH. Pemisahan terbaik diperoleh ketika menggunakan ligan
H2
Tabel 4.3 Faktor pisah Y terhadap Ce pada ekstraksi cair-cair
AdBP dengan pH ekstraksi adalah 4.
H2SbBP H2AdBP pH αY/Ce αY/Ce 2 2,5354 -3 5,0273 20,2124 4 10,0949 40,2399 5 1,3473 6,2562
4.6 Perlindian Pasir Monasit dan Karakterisasi Residu Sisa Perlindian
Pasir monasit yang digunakan dalam perlindian adalah sampel yang berasal dari Bangka. Perlindian dilakukan dengan bantuan NaOH, dimana perbandingan berat NaOH: berat pasir monasit adalah 1:1. Mula-mula NaOH dilarutkan terlebih dahulu dengan sedikit air agar membentuk suatu media peleburan yang baik bagi pasir monasit. Reaksi peleburan akan berlangsung baik jika NaOH dapat bergerak dengan baik dalam wadah pelebur. Oleh karena itu, perlu dilakukan pengontrolan jumlah air dalam cawan porselein. Namun, pada penelitian ini tidak dilakukan pengontrolan air dengan mempertimbangkan bahwa pada suhu 250oC NaOH berada dalam bentuk lelehan.
Gambar 4.28 Hasil perlindian pasir monasit
Setelah peleburan dilakukan selama 2 jam, diperoleh padatan coklat kehijauan (Gambar 4.28). Adapun reaksi yang terjadi selama proses peleburan:
50 Hasil perlindian merupakan campuran Na3PO4 serta logam tanah jarang dan mineral lain
dalam bentuk oksida hidrat. Hasil ini berbeda dengan hasil yang diperoleh Nwe, 2008. Nwe juga melakukan perlindian pasir monasit dengan metoda yang sama, hanya saja perlindian dilakukan pada suhu 140oC selama 3 jam disertai pengontrolan air. Hasil perlindian Nwe bukan berupa padatan melainkan slurry berwarna kuning. Oleh karena itu, terlihat adanya pengaruh pengontrolan air dalam proses perlindian.
Gambar 4.29 Kerak biru didasar cawan porselein
Pada saat dilakukan pemindahan hasil perlindian, terlihat adanya kerak berwarna biru didasar cawan porselein (Gambar 4.29). Setelah dilakukan pengujian peleburan blanko (slurry NaOH), diketahui bahwa kerak biru berasal dari reaksi cawan dengan NaOH. Oleh karena itu, kerak biru ini diasumsikan tidak mempengaruhi hasil perlindian.
Gambar 4.30 Pelarutan hasil perlindian
Padatan coklat kehijauan yang diperoleh kemudian dilarutkan dengan aqua dm (Gambar 4.30) sehingga diperoleh larutan berwarna kuning dan endapan coklat yang tidak larut dalam air. Residu coklat yang diduga merupakan natrium silikat berjumlah 7,8546 gram (Gambar 4.31). Jika memperhitungkan kadar silikat umumnya dalam pasir monasit (3%), natrium silikat yang diperoleh termasuk sangat banyak. Hal ini dapat dikarenakan tidak adanya pengontrolan air sehingga pergerakan molekul NaOH terbatas dan peleburan belum berjalan sempurna. Residu coklat termasuk senyawa yang tidak higroskopis dengan kadar airnya hanya 2,8%.
51
52
53 Pola XRD dari pasir monasit (Gambar 4.32) menunjukkan adanya kristal LTJ-fosfat, terutama serium-fosfat, terlihat dari puncak karakteristik pada 2Ѳ = 26,990o; 28,840o; dan 46,155o. Selain itu, juga terlihat puncak dari difraksi itrium-fosfat dengan intensitas tinggi, yaitu pada 2Ѳ = 25,890o dan 42,050o
Hasil pola XRD residu coklat menunjukkan adanya kristal natrium dari LTJ yang belum terlarut, dan juga ditemukan natrium-kalsium-silikat. Puncak karakteristik pada 2Ѳ = 28,155
.
o
dan 46,655o
Jika pola XRD pasir monasit dan residu coklat dibandingkan, diketahui bahwa LTJ dalam bentuk fosfat telah terdestruksi menjadi bentuk nya. Namun, tidak semua natrium-LTJ berhasil dilarutkan dalam air, terlihat bahwa natrium-yttrium masih banyak tertinggal dalam residu. Lebih rendahnya intensitas pada pola XRD residu coklat menunjukkan bahwa LTJ dari pasir monasit telah berkurang dikarenakan destruksi dan pelarutan dalam air. Oleh karena itu, destruksi perlu dilakukan secara bertahap dan berulang untuk meningkatkan efisiensi destruksi.
menunjukkan masih banyaknya kristal natrium-itrium dalam residu coklat.
Setelah dilakukan pemisahan residu, filtrat kuning dijenuhkan hingga terbentuk kristal berbentuk jarum (Gambar 4.32). Kristal jarum ini diduga merupakan Na2HPO4. Dengan
memisahkan kristal jarum, diperoleh filtrat yang bebas dari Na2HPO4.
Gambar 4.34 Kristal jarum Na2HPO
Filtrat yang telah bebas dari Na
4
2HPO4 ditambah dengan HCl hingga pH larutan menjadi 3,5.
Pada tahapan ini diperoleh endapan putih yang merupakan ThO2 (Gambar 4.33).
54 Setelah dilakukan pemisahan Na2HPO4 dan ThO2 diperoleh filtrat dengan matriks lebih
sederhana (Gambar 4.34). Maka, diharapkan filtrat yang bebas dari Na2HPO4 dan ThO2 ini
dapat mempermudah pemisahan lebih lanjut logam tanah jarang dalam filtrat.
Gambar 4.36 Filtrat bebas Na2HPO4 dan ThO
Pemisahan LTJ dari filtrat dapat dilakukan dengan bantuan H
2
2SbBP dan H2AdBP sebagai
ekstraktan dengan mengacu pada hasil penentuan kinerja ligan. Kondisi ekstraksi yang diperoleh dari penentuan kinerja ligan pada variasi [ligan] dan pH tidak dapat langsung diterapkan pada crude dengan matriks sangat kompleks karena akan terjadi penyimpangan hasil ekstraksi. Oleh karena itu, semakin sederhana matriks hasil perlindian maka semakin minimal penyimpangan hasil ekstraksi. Untuk mengetahui pengaruh matriks pada hasil ekstraksi serta hasil pemisahan masing-masing logam, perlu dilakukan penelitian dan pengkajian lebih lanjut.