BREBES SEBAGAI PENGHAMBAT PERTUMBUHAN Fusarium sp. PENYEBAB PENYAKIT MOLER SECARA IN VITRO
RIA SUCI ANISA
PROGRAM STUDI BIOLOGI FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH JAKARTA
RIA SUCI ANISA ISOLASI DAN KARAKTERISASI KAPANG PADA TANAMAN BAWANG MERAH JAKARTA 11140950000021 (Allium cepa L.) VARIETAS BIMA CURUT ASAL KABUPATEN BREBES 2021 M / 1443 H SEBAGAI PENGHAMBAT PERTUMBUHAN Fusarium sp.
PENYEBAB PENYAKIT MOLER SECARA IN VITRO
BREBES SEBAGAI PENGHAMBAT PERTUMBUHAN Fusarium sp. PENYEBAB PENYAKIT MOLER SECARA IN VITRO
SKRIPSI
Sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana Sains pada Program Studi Biologi Fakultas Sains dan Teknologi
Universitas Islam Negeri Syarif Hidayatullah Jakarta
RIA SUCI ANISA 11140950000021
PROGRAM STUDI BIOLOGI FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH JAKARTA
ISOLASI DAN KARAKTERISASI KAPANG PADA TANAMAN BAWANG MERAH (Allium cepa L.) VARIETAS BIMA CURUT ASAL KABUPATEN
BREBES SEBAGAI PENGHAMBAT PERTUMBUHAN Fusarium sp. PENYEBAB PENYAKIT MOLER SECARA IN VITRO
SKRIPSI
Sebagai Salah Satu Syarat Memperoleh Gelar Sarjana Sains pada Program Studi Biologi Fakultas Sains dan Teknologi
Universitas Islam Negeri Syarif Hidayatullah Jakarta
RIA SUCI ANISA 11140950000021
Menyetujui:
Pembimbing I, Pembimbing II,
Ir. Yadi Suryadi, M.Sc Dr. Nani Radiastuti, M.Si
NIP. 19580925 198503 1 002 NIP. 19650902 200112 2 001
Mengetahui,
Ketua Program Studi Biologi Fakultas Sains dan Teknologi
PENGESAHAN UJIAN
Skripsi berjudul “Isolasi dan Karakterisasi Fungi pada Tanaman Bawang
Merah (Allium cepa L.) Varietas Bima Curut Asal Kabupaten Brebes Sebagai Penghambat Pertumbuham Fusarium sp. Penyebab Penyakit Moler secara In Vitro” yang ditulis oleh Ria Suci Anisa, NIM 11140950000021 telah
diuji dan dinyatakan LULUS dalam sidang Munaqosyah Fakultas Sains dan Teknologi Universitas Islam Negeri Syarif Hidayatullah Jakarta pada tanggal 10 Agustus 2021. Skripsi ini telah diterima sebagai salah satu syarat untuk memperoleh gelar Sarjana Strata Satu (S1) Program Studi Biologi.
Menyetujui:
Penguji I, Penguji II,
Ardian Khairiah, M.Si
NIP. 19901110 201903 2 020
Pembimbing I, Pembimbing II,
Ir. Yadi Suryadi, M.Sc Dr. Nani Radiastuti, M.Si NIP. 19580925 198503 1 002 NIP. 19650902 200112 2 001
Mengetahui,
Dekan Fakultas Sains dan Teknologi Ketua Program Studi Biologi
Nashrul Hakiem, S.Si., M.T.,Ph.D NIP. 19710608 200501 1 005
PERNYATAAN
DENGAN INI SAYA MENYATAKAN BAHWA SKRIPSI INI ADALAH KARYA SAYA SENDIRI YANG BELUM PERNAH DIAJUKAN SEBAGAI SKRIPSI ATAU KARYA ILMIAH PADA PERGURUAN TINGGI ATAU LEMBAGA MANAPUN
Jakarta, Agustus 2021
RIA SUCI ANISA NIM. 11140950000021
i ABSTRAK
Ria Suci Anisa. Isolasi dan Karakterisasi Kapang pada Tanaman Bawang Merah (Allium cepa L.) Varietas Bima Curut Asal Kabupaten Brebes Sebagai Penghambat Pertumbuham Fusarium sp. Penyebab Penyakit Moler secara In Vitro. Skripsi. Program Studi Biologi, Fakultas Sains dan Teknologi, Universitas Islam Negeri Syarif Hidayatullah Jakarta. 2021. Dibimbing oleh Ir. Yadi Suryadi, M.Sc dan Dr. Nani Radiastuti, M.Si.
Penyakit moler atau sering disebut oleh petani sebagai penyakit busuk umbi yang disebabkan oleh Fusarium sp. merupakan salah satu penyakit penting pada tanaman bawang merah (Allium cepa L.). Pengendalian penyakit moler yang ramah lingkungan adalah dengan menggunakan kapang antagonis sebagai agen pengendali hayati. Penelitian dilaksanakan di Laboratorium Konservasi Mikroorganisme, Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumber Daya Genetik, pada bulan Oktober 2019 hingga April 2020. Tujuan penelitian ini adalah untuk mendapatkan isolat kapang asal A. cepa L. yang berpotensi sebagai penghambat pertumbuhan Fusarium sp. dan memiliki persentase daya hambat kuat dalam uji antagonis secara in vitro. Tahapan penelitian ini di antaranya adalah, isolasi dari A. cepa L. varietas Bima Curut asal Kabupaten Brebes, uji antagonis secara in vitro dengan menggunakan Rancangan Acak Lengkap (RAL), uji aktivitas kitinase, dan identifikasi kapang. Dari hasil penelitian diperoleh 21 isolat kapang. Hasil uji antagonis menunjukkan bahwa 10 isolat kapang yang terdiri atas genus Botrytis, Aspergillus, Scopulariopsis,
Trichoderma, Rhizopus, Absidia, dan Mucor berpotensi menghambat
pertumbuhan Fusarium sp. secara in vitro. Isolat kapang UTB5 (Aspergillus
flavus), UTB2 (A. niger), dan DBT4 (A. sclerotiorum) memiliki tingkat aktivitas
antikapang kuat dengan persentase hambatan terhadap Fusarium sp. secara masing-masing 66,40%; 62,59%; dan 49,97%.
ii ABSTRACT
Ria Suci Anisa. In-Vitro Isolation and Characterization of Kapang on Shallots (Allium cepa L.) Bima Curut Variety from Brebes as Growth Inhibitors of Fusarium sp. Cause of Moler Disease. Thesis. Program Study of Biology, Faculty of Science and Technology, Syarif Hidayatullah State Islamic University Jakarta. 2021. Supervised by Ir. Yadi Suryadi, M.Sc, and Dr. Nani Radiastuti, M.Si.
Moler disease also known as rot disease by the farmers caused by Fusarium sp. is one of the important diseases of shallot (Allium cepa L.). To control the disease by using antagonistic fungi is more environmentally as biological control agents. The research was carried out at the Microorganism Conservation Laboratory, Center for Research and Development of Biotechnology and Genetic Resources, from October 2019 to April 2020. The aim of this study have obtained mold isolates from A. cepa L. which have the potential to inhibit the growth of Fusarium sp. and has a strong proportion of inhibition in the in vitro antagonist test. The stages of this research include isolation of A. cepa L. Bima Curut variety from Brebes Regency, in vitro antagonist test using Completely Randomized Design (CRD), chitinase activity test, and mold. From the results of the study obtained 21 isolates of mold. The results of the antagonist test showed that 10 mold isolates consisting of the genera Botrytis, Aspergillus, Scopulariopsis, Trichoderma, Rhizopus,
Absidia, and Mucor possibly inhibited the growth of Fusarium sp. in vitro. The
mold isolates UTB5 (Aspergillus flavus), UTB2 (A. niger), and DBT4 (A.
sclerotiorum) have strong antifungal activity levels with the proportion of
inhibition against Fusarium sp. for each 66.40%; 62.59%; and 49.97%.
iii
KATA PENGANTAR
Bismillahirrahmanirrahim Assalamualaikum Warahmatulahi Wabarakatuh
Segala puji dan syukur bagi Allah SWT karena berkat rahmat dan hidayah-Nya, penulis dapat menyelesaikan skripsi yang berjudul “Isolasi dan
Karakterisasi Kapang pada Tanaman Bawang Merah (Allium cepa L.) Varietas Bima Curut Asal Kabupaten Brebes Sebagai Penghambat Pertumbuhan Fusarium sp. Penyebab Penyakit Moler secara In Vitro” yang
dilaksanakan di Laboratorium Konservasi Mikroorganisme, Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumber Daya Genetik Pertanian (BB Biogen), Bogor, Jawa Barat.
Hal ini merupakan salah satu syarat yang harus dipenuhi oleh mahasiswa biologi guna memenuhi persyaratan untuk memperoleh gelar Sarjana Sains pada Program Studi Biologi, Fakultas Sains dan Teknologi, Universitas Islam Negeri Syarif Hidayatullah Jakarta.
Pada kesempatan ini, dengan segala kerendahan hati, penulis ingin menyampaikan ucapan terima kasih kepada berbagai pihak yang telah membantu dan membimbing penulis dalam pelaksanaan penelitian hingga penulisan skripsi ini, di antaranya kepada:
1. Nashrul Hakiem, S.Si., M.T., Ph.D selaku Dekan Fakultas Sains dan Teknologi UIN Syarif Hidayatullah Jakarta.
2. Dr. Priyanti, M.Si selaku Ketua Program Studi Biologi, penguji seminar proposal dan seminar hasil atas kesediaan dalam memberikan dukungan dan arahan dalam menyelesaikan skripsi.
3. Ir. Yadi Suryadi, M.Sc, selaku pembimbing I skripsi atas kesediaan dalam membimbing dan memberikan arahan secara teknis selama penelitian kepada penulis.
4. Dr. Nani Radiastuti, M.Si selaku pembimbing II skripsi atas kesediaan waktu dalam membimbing dan memberikan nasihat yang membangun kepada penulis.
iv
5. Agustina Senjayani, M.Si selaku penguji seminar proposal dan seminar hasil yang telah memberikan arahan kepada penulis sehingga penulis dapat menyelesaian skripsi.
6. Staff Laboratorium Konservasi Mikroorganisme, BB Biogen yang telah membantu penulis selama melaksanakan penelitian.
7. Keluarga besar penulis terutama kedua orang tua, kakak dan adik penulis karena telah memberikan dukungan penuh serta semangat sehingga penulis dapat menyelesaikan skripsi.
8. Teman-teman Biologi 2014 yang berperan dalam memberi motivasi sehingga penulis mampu menyelesaikan skripsi.
Penulis berharap semoga skripsi ini dapat bermanfaat bagi para pembaca.
Jakarta, Agustus 2021
v DAFTAR ISI
Halaman
ABSTRAK ... i
ABSTRACT ... ii
KATA PENGANTAR ... iii
DAFTAR ISI ... v
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... ix BAB I. PENDAHULUAN 1.1.Latar Belakang ... 1 1.2.Rumusan Masalah ... 4 1.3.Hipotesis ... 4 1.4.Tujuan Penelitian ... 4 1.5.Manfaat Penelitian ... 4 1.6.Kerangka Berfikir ... 5
BAB II. TINJAUAN PUSTAKA 2.1.Tanaman Bawang Merah (Allium cepa L.) ... 7
2.2.Penyakit Moler (Layu Fusarium) ... 11
2.3.Potensi Kapang Sebagai Penghambat Patogen ... 15
2.4.Seleksi In Vitro Kapang Antagonis pada Media PDA ... 16
BAB III. METODOLOGI PENELITIAN 3.1.Waktu dan Tempat ... 17
3.2.Alat dan Bahan ... 17
3.3.Rancangan Penelitian ... 18
3.4.Cara Kerja ... 18
3.4.1. Pembuatan Media ... 18
3.4.2.Isolasi Kapang dari Allium cepa L. ... 20
3.4.3.Pemurnian Isolat Kapang Hasil Isolasi dari Allium cepa L. ... 22
3.4.4.Uji Antagonis Isolat Kapang dengan Fusarium sp. ... 22
3.4.5.Uji Aktivitas Kitinase ... 23
3.4.6.Karakterisasi Kapang Antagonis ... 25
3.4.7. Isolasi DNA Kapang ... 26
3.4.8. Amplifikasi DNA dengan metode (PCR) ... 27
3.4.9. Elektroforesis DNA ... 28
3.4.10. Sekuensing DNA ... 28
3.5.Parameter Pengamatan ... 29
3.6.Analisis Data ... 30
BAB IV. HASIL DAN PEMBAHASAN 4.1. Isolasi Kapang dari Tanaman Bawang Merah (A. cepa L.) ... 31
vi
4.3. Aktivitas Kitinase Kapang Antagonis ... 35
4.4. Identifikasi Kapang Antagonis secara Makroskopis dan Mikroskopis ... 38
4.5. Identifikasi Molekuler DNA Kapang Antagonis ... 47
4.5.1. Amplifikasi PCR Region ITS5 dan ITS4 rDNA... 47
4.5.2. Analisis Sekuens DNA Kapang Antagonis ... 48
BAB V. PENUTUP 5.1. Kesimpulan ... 52
5.2.Saran ... 52
DAFTAR PUSTAKA ... 53
vii
DAFTAR TABEL
Halaman
Tabel 1. Komposisi zat gizi umbi & daun Allium cepa ... 11
Tabel 2. Konsentrasi larutan standar ... 25
Tabel 3.Karakter yang diamati untuk identifikasi kapang ... 26
Tabel 4. Klasifikasi aktivitas antikapang ... 30
Tabel 5. Jumlah isolat kapang pada masing-masing asal isolat ... 31
Tabel 6. Hasil uji independent sample t-test ... 35
Tabel 7. Karakteristik makroskopis isolat kapang antagonis ... 39
Tabel 8. Karakteristik mikroskopis isolat kapang antagonis ... 39
Tabel 9. Isolat kapang antagonis secara makroskopis dan mikroskopis ... 40
Tabel 10. Persentase genus isolat kapang antagonis ... 46
Tabel 11. Panjang sekuen DNA isolat kapang antagonis ... 49
viii
DAFTAR GAMBAR
Halaman
Gambar 1. Kerangka berfikir isolasi dan karakterisasi kapang... 6
Gambar 2. Morfologi Allium cepa L. ... 8
Gambar 3. Gejala penyakit moler pada Allium cepa... 13
Gambar 4. Karakterisasi Fusarium sp. ... 15
Gambar 5. Peletakkan sampel organ tanaman di media PDA ... 21
Gambar 6. Alur pengenceran sampel tanah 10-2 hingga 10-6 ... 21
Gambar 7. Uji antagonis pada media PDA ... 23
Gambar 8. Persentase daya hambat isolat kapang (in vitro) ... 33
Gambar 9. Hifa patogen Fusarium sp. ... 34
Gambar 10. Aktivitas kitinase kapang antagonis secara kualitatif ... 36
Gambar 11. Aktivitas kitinase kapang antagonis secara kuantitatif ... 37
ix
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Pengukuran harian R1 dan R2 pada uji antagonis ... 58
Lampiran 2. Rata-rata diameter Fusarium sp. ... 61
Lampiran 3. Uji antagonis kapang terhadap Fusarium sp. ... 61
Lampiran 4. Persentase diameter zona hambat Fusarium sp. ... 63
Lampiran 5. Diameter pertumbuhan koloni kapang hasil isolasi 7 hari... 64
Lampiran 6. Hasil t-test isolat kapang antagonis ... 65
Lampiran 7. Pengukuran aktivitas kualititif kitinase ... 67
Lampiran 8. Zona bening pada media padat kitin ... 68
Lampiran 9. Pengukuran aktivitas kuantitatif kitinase ... 69
Lampiran 10. Urutan nukleotida dan jenis (% similaritas) isolat kapang antagonis ... 71
1 BAB I
PENDAHULUAN
1.1. Latar Belakang
Tanaman bawang merah (Allium cepa L.) merupakan salah satu komoditas sayuran yang menjadi unggulan di Indonesia. Manfaat A. cepa yang khas yaitu sebagai bahan utama penyedap berbagai masakan (Handayani, 2014). Di Indonesia, A. cepa tergolong sebagai komoditas strategis karena dibutuhkan sebagian besar masyarakat dalam kehidupan sehari-hari, sehingga memiliki peran lainnya yaitu sebagai penyumbang devisa negara serta dapat mempengaruhi tingkat inflasi (BPPP, 2005).
Provinsi Jawa Tengah merupakan salah satu sentra produksi A. cepa terbesar di Indonesia, lebih dari 50% produksi A. cepa nasional berasal dari daerah area sawah di Provinsi Jawa Tengah. Salah satu Kabupaten di Jawa Tengah yang menjadi sentra produksi A. cepa adalah Kabupaten Brebes (Basuki et al., 2018).
Produktivitas A. cepa selama periode 2010-2014 telah terjadi penurunan produktivitas sebesar 1,39%. Menurut data Badan Pusat Statistik (BPS) dan Direktorat Jendral Hortikultura, produktivitas A. cepa di Indonesia selama periode 2015-2019 memiliki penurunan produktivitas dengan kisaran 10,06 menjadi 9,93 Ton/Ha (BPS, 2019).
Sebagai salah satu komoditas yang wajib hadir di rumah tangga masyarakat Indonesia, A. cepa merupakan kelompok rempah yang tidak tergantikan dengan komoditas lain. Sehingga permintaan akan A. cepa cenderung konstan. Fluktuasi A. cepa di pasaran akan muncul ketika hari raya dan hari besar keagamaan. Konsumsi bawang merah selama periode 2010-2020 cenderung mengalami peningkatan dari tahun ke tahun. A. cepa berpengaruh cukup signifikan pada inflasi dikarenakan tingginya permintaan yang tidak dapat diimbangi oleh kecukupan pasokan dari beberapa daerah penghasil A. cepa yang menyebabkan harganya mengalami kenaikan (Manurung, 2020).
Periode 2010-2019 rata-rata pertumbuhan produksi A.cepa menurun 3,93% pertahun. Sedangkan, kebutuhan konsumsi A. cepa di Indonesia dari tahun
ke tahun mengalami peningkatan sebesar 5% (BPS, 2019). Hal ini sejalan dengan bertambahnya jumlah populasi dan daya beli masyarakat di Indonesia yang setiap tahunnya juga mengalami peningkatan. Adanya permintaan dan kebutuhan konsumsi A. cepa yang terus meningkat setiap tahunnya belum dapat diikuti oleh peningkatan produksinya. Hal ini disebabkan oleh keterbatasan dalam hal budidaya tanaman (Sumarni & Hidayat, 2005).
Permasalahan utama usaha tani A. cepa di Indonesia yang banyak dikeluhkan oleh para petani yaitu penyakit yang menyerang A. cepa. Masalah tersebut menyebabkan produktivitas A. cepa di Indonesia rendah karena tingginya risiko kegagalan panen. Penyakit yang sering ditemui pada budidaya A. cepa di antaranya adalah penyakit moler (layu Fusarium) yang disebabkan oleh patogen
Fusarium sp. (Wiyatiningsih, 2011).
Lingkungan Indonesia yang beriklim tropis dan lembab merupakan habitat yang ideal bagi pertumbuhan Fusarium sp., curah hujan yang tinggi juga menjadi salah satu faktor penyebaran patogen menjadi lebih cepat (Wiyatiningsih, 2011). Anomalia cuaca buruk disertai hujan yang turun sepanjang tahun berdampak pada berkurangnya produktivitas A. cepa. Apabila dalam kondisi normal produktivitas
A. cepa bisa mencapai 20 ton/Ha, namun pada periode 2015-2019 turun dan hanya
berkisar 9-10 ton/Ha (BPS, 2019).
Penyakit moler merugikan bagi praktik budidaya A. cepa karena dapat mengakibatkan produksi menurun hingga 50% bahkan gagal panen. Pada musim hujan kerugian bisa mencapai 100%. Keparahan penyakit pada sentra produksi A.
cepa di Kabupaten Bantul, Kabupaten Brebes, dan Kabupaten Nganjuk dilaporkan
sebesar 13,75 – 30% (Wiyatiningsih et al., 2009).
Pengendalian penyakit tanaman yang dilakukan oleh petani saat ini masih bertumpu pada penggunaan bahan agrokimia. Penggunaan bahan kimia yang terus menerus dapat mengakibatkan dampak buruk bagi kesehatan, pencemaran lingkungan, dan perkembangan strain patogen yang resisten, oleh karena itu diperlukan alternatif pengendalian penyakit yang berkelanjutan (Wiyatiningsih, 2009).
Upaya pengendalian penyakit moler pada A. cepa tanpa merugikan ekosistem, salah satu cara yang dapat dikembangkan yaitu dengan menggunakan
3
mikroorganisme antagonis sebagai agen pengendali hayati dalam menginduksi ketahanan tanaman. Kapang dapat berperan sebagai pemacu pertumbuhan tanaman yang dapat meningkatkan ketahanan tanaman inang terhadap penyakit dengan menekan patogen melalui sifat antagonisme (Nugroho, 2013).
Agen pengendali hayati dari kelompok kapang yaitu Aspergillus sp. dan
Trichoderma sp. sudah terbukti berperan sebagai penghambat pertumbuhan Fusarium sp. Penelitian Adhi & Suganda (2020) melaporkan bahwa Aspergillus
sp. memiliki kemampuan menekan pertumbuhan F. oxysporum f.sp. cepae, penyebab penyakit busuk umbi bawang merah secara in vitro. Selanjutnya, dilaporkan bahwa Trichoderma sp. dapat mengendalikan penyakit layu yang disebabkan F. oxysporum pada bibit tanaman apel, melon, kapas, tomat, dan gladiol (Nugroho, 2013).
Menurut Pusat Data dan Sistem Informasi Pertanian (2013), varietas unggul bawang merah adalah varietas Bima Curut. Varietas Bima Curut telah diadopsi luas oleh petani di Kabupaten Brebes. Varietas Bima paling banyak ditanam dikarenakan hasilnya tinggi yaitu ± 10 Ton/Ha, umur panen genjah (55-60 HST), tahan ditanam dimusim hujan, ukuran umbi sedang-besar, warna umbi merah muda-merah tua, dan disukai pasar (Basuki et al., 2018). Hasil penelitian (Basuki et al., 2018) menunjukkan bahwa A. cepa varietas Bima Curut asal Kabupaten Brebes memiliki ketahanan terhadap penyakit moler namun belum banyak dikaji mengenai kapang antagonis dari hasil isolasi A. cepa asal Kabupaten Brebes sebagai agen pengendali hayati.
Penelitian ini menggunakan A. cepa varietas Bima Curut asal Kabupaten Brebes sebagai inang dari kapang antagonis. Isolat yang diperoleh diharapkan dapat dijadikan sebagai alternatif pengendalian penyakit oleh Fusarium sp. Berdasarkan latar belakang maka perlu dilakukan penelitian mengenai isolasi dan karakterisasi kapang antagonis dari A. cepa varietas Bima Curut asal Kabupaten Brebes yang memiliki potensi dalam menghambat pertumbuham Fusarium sp. penyebab penyakit moler secara in vitro.
1.2. Rumusan Masalah
Masalah yang dirumuskan pada penelitian ini adalah:
1. Isolat kapang apa saja hasil isolasi dan karakteristik secara makroskopis dan mikroskopis dari A. cepa varietas Bima Curut asal Kabupaten Brebes yang berpotensi sebagai penghambat pertumbuhan Fusarium sp. secara in
vitro ?
2. Isolat kapang apa saja yang memiliki persentase daya hambat kuat dalam uji antagonis terhadap Fusarium sp. secara in vitro ?
1.3. Hipotesis
Hipotesis yang diajukan pada penelitian ini adalah:
1. Isolat kapang dari hasil isolasi dan karakterisasi A. cepa varietas Bima Curut asal Kabupaten Brebes berpotensi sebagai kapang antagonis penghambat pertumbuhan Fusarium sp.
2. Isolat Trichoderma dan Aspergillus berpotensi sebagai penghambat pertumbuhan Fusarium sp.
1.4. Tujuan Penelitian
Tujuan pada penelitian ini adalah:
1. Memperoleh isolat kapang hasil isolasi dan karakterisasi dari A. cepa varietas Bima Curut asal Kabupaten Brebes yang berpotensi sebagai penghambat pertumbuhan Fusarium sp. secara in vitro.
2. Memperoleh isolat kapang dengan tingkat aktivitas antikapang yang tergolong kuat sesuai standar (Mori et al., 1997).
1.5. Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi dan manfaat ilmiah mengenai isolat kapang yang efektif dalam menghambat pertumbuhan Fusarium sp. serta sebagai data penunjang untuk perbanyakan produksi biofungisida berbasis mikroorganisme antagonis untuk pengendalian penyakit moler.
5
1.6. Kerangka Berfikir
Kerangka berfikir pada penelitian ini adalah:
2.
dari Tanaman bawang merah
(Allium cepa L.) sebagai komuditas sayuran unggul di
Indonesia Pemanfaatan Produktivitas A. cepa Bahan utama penyedap makanan Penyumbang devisa negara Kebutuhan konsumsi A. cepa meningkat 5% setiap tahun Infeksi Fusarium sp. penyebab penyakit moler pada A. cepa
Akar, umbi, daun, dan tanah
yang sehat
Uji antagonis secara
in vitro (media PDA)
Pengamatan diameter koloni, uji daya hambat kapang antagonis terhadap
Fusarium sp., dan uji
kitinase
Pertumbuhan produksi menurun 3,93% per
tahun
Isolasi dan pemurnian isolat kapang antagonis dari A. cepa asal Kabupaten Brebes
Identifikasi molekuler Karakteristik morfologi Makroskopis Mikroskopis Isolasi DNA Sekuensing DNA Elektroforesis DNA Amplifikasi DNA (PCR)
Isolat kapang yang berpotensi efektif menghambat pertumbuhan
Fusarium sp. penyebab penyakit
moler
Gambar 1. Kerangka berfikir isolasi dan karakterisasi kapang pada tanaman bawang merah (Allium cepa L.) varietas Bima Curut asal Kabupaten Brebes sebagai penghambat pertumbuham Fusarium sp. penyebab penyakit moler dari secara in vitro
7 BAB II
TINJAUAN PUSTAKA
2.1. Tanaman Bawang Merah (Allium cepa L.)
Tanaman bawang merah (Allium cepa L.) merupakan tanaman semusim yang membentuk rumpun dan tumbuh tegak dengan tinggi mencapai 15-40 cm (Rahayu & Ali, 2004). A. cepa berasal dari Syiria, sejak seribu tahun lalu sudah dikenal oleh umat manusia sebagai salah satu komoditas hortikultura yang sering digunakan sebagai penyedap masakan. Sekitar abad VIII, A. cepa mulai menyebar ke wilayah Eropa Barat, Eropa Timur dan Spanyol. Kemudian menyebar luas kedaratan Amerika, Asia Timur dan Asia Tenggara. Pada abad XIX, A. cepa menjadi salah satu tanaman komersial di berbagai negara. Negara-negara produsen A. cepa antara lain adalah Indonesia, Jepang, USA, Rumania, Italia, Meksiko dan Texas (Rismunandar, 1986).
Beberapa provinsi di Indonesia sebagai produsen A. cepa (luas panen >1.000 ha/tahun) di antaranya adalah Jawa Tengah, Jawa Timur, Jawa Barat, dan Nusa Tenggara. Provinsi Jawa Tengah merupakan penghasil A. cepa terbesar di Indonesia. Salah satu Kabupaten di Jawa Tengah yang menjadi pusat penghasil A.
cepa varietas Bima Curut adalah Kabupaten Brebes (Wiyatiningsih, 2011).
Bagi Kabupaten Brebes, A. cepa varieas Bima Curut merupakan
trademark mengingat posisinya sebagai penghasil terbesar komoditas tersebut di
tingkat nasional. Pusat produksi A. cepa varietas Bima Curut tersebar di 11 kecamatan (dari 17 kecamatan) yaitu kecamatan Brebes, Wanasari, Bulakamba, Tonjong, Losari, Kersana, Ketanggungan, Larangan, Songgom, Jatibarang, dan Banjarharjo dengan luas panen per tahun 20.000 - 25.000 hektar. Penduduk Brebes yang berjumlah ±1,7 juta, sekitar 70% penduduk bekerja pada sektor pertanian (Wiyatiningsih, 2011)
Tanaman bawang merah (Allium cepa L.) membutuhkan kondisi lingkungan yang baik untuk tumbuh optimal. Beberapa faktor yang dapat mempengaruhi produktivitas A. cepa di antaranya adalah iklim, suhu udara, intensitas cahaya matahari, ketinggian tempat, curah hujan, kelembaban nisbi, angin, persediaan air, perawatan, pemberian pupuk serta pengendalian hama dan
penyakit. Faktor lain yang juga sangat penting di perhatikan adalah faktor tanah, meliputi keadaan fisik dan kimia tanahnya (Sumarni & Hidayat, 2005).
Pertumbuhan dan perkembangan A. cepa akan berlangsung baik pada daerah beriklim kering dengan suhu udara hangat (ideal 25-32 oC). Di bawah suhu udara 22 °C, A. cepa tidak dapat berumbi. A. cepa membutuhkan tempat terbuka dengan penyinaran cahaya matahari yang maksimal (minimal 70% penyinaran), yaitu memperoleh sinar matahari lebih dari 12 jam per hari sehingga umbi yang terbentuk memiliki ukuran besar. Jenis tanah yang baik untuk budidaya A. cepa adalah regosol, grumosol, latosol, dan aluvial dengan derajat keasaman (pH) tanah 5,5-6,5 serta drainase dan aerasi dalam tanah berjalan dengan baik (Sumarni & Hidayat, 2005).
Klasifikasi A. cepa menurut Tjitrosoepomo (2016) termasuk ke dalam kingdom: Plantae, divisi: Spermatophyta, subdivisi: Angiospermae, kelas:
Monocotyledonae, ordo: Liliales, famili: Liliaceae, genus: Allium, spesies: Allium cepa L. Struktur morfologi A. cepa terdiri atas akar, batang, daun, bunga, buah,
biji, dan umbi (Gambar 2).
Gambar 2. Morfologi Allium cepa L. a. Penampang membujur A. cepa; b. Penampang melintang umbi A. cepa yang memperlihatkan bagian: 1. akar serabut, 2. batang pokok rudimeter yang seperti cakram, 3. umbi lapis, 4. tunas lateral, 5. daun muda, 6. titik tumbuh atau calon tunas; c. Bunga A. cepa sebelum dan sesudah mekar (Rahayu & Ali, 2004)
2.1.1. Struktur Morfologi Allium cepa L.
Secara morfologi, akar tanaman bawang merah (Allium cepa L.) tersusun atas rambut akar, batang akar, ujung akar, dan tudung akar. Akar A. cepa termasuk akar serabut dengan sistem perakaran dangkal dan bercabang terpencar,
9
pada kedalaman antara 15-20 cm di dalam tanah. Jumlah akar A. cepa dapat mencapai 20-200 akar. Diameter akar bervariasi antara 2-5 mm. Akar merupakan organ pada tumbuhan yang berfungsi sebagai alat untuk menyerap air dan garam mineral dari dalam tanah, serta untuk menunjang dan memperkokoh berdirinya tanaman di tempat hidupnya (AAK, 2005)
Batang A. cepa memiliki batang sejati atau disebut dengan discus yang berbentuk seperti cakram, tipis, dan pendek sebagai tempat melekatnya perakaran dan mata tunas (titik tumbuh), di atas discus terdapat batang semu yang tersusun dari pelepah-pelepah daun yang saling membungkus. Pelepah-pelepah daun sebelah luar selalu melingkar dan menutupi daun yang ada di dalamnya. Beberapa helai pelepah daun terluar akan mengering tetapi cukup liat. Pelepah daun yang menipis dan kering ini membungkus lapisan pelepah daun yang ada di dalamnya yang membengkak. Di karenakan pelepah daunnya membengkak, bagian ini akan terlihat mengembung sehingga batang semu yang berada di bagian dalam tanah akan berubah bentuk dan fungsi menjadi menebal, lunak, dan berdaging yaitu menjadi umbi lapis (bulbus) (Sumarni & Hidayat, 2005).
Umbi lapis berfungsi sebagai tempat penyimpanan cadangan makanan untuk persediaan makanan bagi tunas yang akan menjadi tanaman baru, sejak mulai bertunas sampai keluar akarnya. Sementara itu, bagian atas umbi yang membengkak akan mengecil kembali dan tetap saling membungkus sehingga membentuk batang semu. Pada pangkal umbi membentuk cakram yang merupakan batang pokok yang tidak sempurna. Bagian bawah cakram ini tumbuh akar-akar serabut yang tidak terlalu panjang. Sedangkan di bagian atas cakram, di antara lapisan pelepah daun yang membengkak, terdapat mata tunas yang dapat tumbuh menjadi tanaman baru (Sumarni & Hidayat, 2005).
Umbi A. cepa berwarna merah keputih-putihan terbentuk dari pangkal daun yang bersatu dan membentuk batang semu yang berubah bentuk dan fungsi, membesar dan membentuk umbi berlapis sehingga bukan merupakan umbi sejati seperti pada tanaman kentang atau talas. Jumlah umbi per rumpun bervariasi antara 7-12 umbi bahkan dapat mencapai 35 umbi. Perbanyakan A. cepa dilakukan dengan menggunakan umbi sebagai bibit dan biji A. cepa. Kualitas bibit
Daun A. cepa berwarna hijau muda atau hijau tua. Setelah tua, daun berubah warna menjadi menguning, layu dan mengering di mulai pada bagian ujung tanaman. Daun A. cepa hanya mempunyai satu permukaan, berbentuk silinder berongga seperti pipa dan memanjang antara 50-70 cm. Bagian ujung daunnya meruncing dan pada bagian bawahnya melebar seperti kelopak serta membengkak. Pelepah-pelepah daun sebelah luar melingkar dan menutup daun yang ada di dalamnya. Letak daun melekat pada tangkai yang ukurannya relatif pendek. Daun A. cepa berfungsi untuk fotosintesis dan respirasi sehingga secara langsung kesehatan daun sangat berpengaruh terhadap kesehatan tanaman (Tjitrosoepomo, 2016).
2.1.2. Manfaat dan Komposisi Gizi Allium cepa L.
Tanaman bawang merah (Allium cepa L.) memiliki banyak manfaat dan bernilai ekonomis tinggi. Umbi A. cepa berfungsi sebagai bahan utama bumbu dapur sehari-hari masakan rumah tangga, restoran, industri makanan di Indonesia pada khususnya maupun masakan yang terdapat di Asia Tenggara pada umumnya. Dengan menambahkan A. cepa sebagai salah satu bahan bumbu maka cita rasa masakan dapat terasa lebih nikmat, kuat, dan khas (Mahendra, 2006).
Umbi A. cepa memiliki manfaat sebagai obat herbal untuk mengatasi berbagai masalah kesehatan, di antaranya untuk sakit perut karena masuk angin, demam, dan penyembuhan luka atau infeksi. Umbi A. cepa mempunyai efek antiseptik yaitu menghambat pertumbuhan mikroorganisme karena memiliki kandungan senyawa sulfur seperti allin. Senyawa allin oleh enzim allisin liase diubah menjadi asam piruvat, ammonia dan allisin anti mikroba yang bersifat bakterisidal (Rukmana, 1994).
Secara tradisional, A. cepa juga dimanfaatkan sebagai pengawet. Menurut Block (1992) sifat pengawet bawang terutama disebabkan adanya sifat antimikroba dari senyawa sulfur yang terkandung di dalamnya. Hasil identifikasi menunjukkan bahwa seperlima kandungan minyak netral bawang merupakan senyawa sulfur. Umbi A. cepa dapat disimpan lama dalam keadaan kering apabila tanpa dikupas, hal ini dapat diduga bahwa kulit A. cepa pun mempunyai senyawa aktif yang melindungi umbinya. Komponen sulfur pada A. cepa tidak hanya
11
memberikan flavor khas bawang tetapi juga memiliki beberapa sifat sebagai senyawa biologis aktif.
Bagian lain dari A. cepa seperti daun dan tangkai bunga dapat bermanfaat untuk membantu melancarkan pencernaan, penyembuhan wasir, serta mampu membuang zat racun sehingga memperkuat organ hati. Manfaat lain dari A. cepa yaitu untuk kesehatan organ jantung. Manfaat A. cepa ini telah terbukti secara medis, yaitu A. cepa mampu menurunkan potensi terkena serangan jantung koroner. Konsumsi teratur A. cepa juga dapat menormalkan tekanan darah tinggi, menghambat penumpukan trombosit, meningkatkan aktifitas fibrinolitik sehingga dapat memperlancar aliran darah serta membuka arteri yang sedang dalam keadaan tersumbat (Wibowo, 2009).
Berdasarkan data dari the National Nutrient Database dapat di lihat pada Tabel 1. bahwa A. cepa memiliki komposisi gizi cukup tinggi yang dibutuhkan oleh tubuh manusia.
Tabel 1. Komposisi zat gizi umbi & daun Allium cepa per 100 g bagian yang
dapat dimakan (Waluyo & Sinaga, 2015)
Komposisi Bagian umbi A. cepa Bagian daun A. cepa
Air (g) 81 91 Energi (kal) 67 30 Protein kasar (g) 1,9 1,8 Lemak kasar (g) 0,3 0,9 Karbohidrat (g) 15 5 Serat kasar (g) 0,7 1,6 Kalsium (mg) 36 86 Fosfor (mg) 45 25 Besi (mg) 0,8 3,7 Vitamin A (mg) - 945 Viatmin B1 (mg) 0,04 0,07
2.2. Penyakit Moler (Layu Fusarium)
Penyakit pada tanaman merupakan suatu keadaan dimana bagian tanaman tertentu tidak dapat menjalankan fungsi fisiologis dengan baik akibat suatu penyebab yang menggangu secara terus menerus dalam waktu yang lama. Fungsi fisiologis tersebut mencakup pembelahan sel, diferensiasi, penyerapan air dan hara dari tanah, translokasi air dan hara ke seluruh bagian tanaman, serta fotosintesis dan reproduksi. Penyakit dapat disebabkan oleh kapang, bakteri, virus dan nematoda. Penyakit moler (layu Fusarium) atau sering disebut juga oleh para
petani sebagai penyakit busuk pangkal umbi merupakan penyakit yang disebabkan oleh serangan patogen Fusarium sp. pada A. cepa (Wiyatiningsih, 2003).
Penyakit moler merupakan penyakit yang menurut para petani saat ini menjadi pengganggu paling mematikan pada budidaya A. cepa dan sangat sulit dikendalikan. Penyakit moler selalu dapat ditemukan di setiap pertanaman A. cepa dengan intensitas penyakit yang bervariasi yang berkaitan dengan faktor musim tanam, kondisi cuaca, varietas yang ditanam, dan jumlah inokulum patogen di dalam tanah (Wiyatiningsih, 2003).
Dampak serangan Fusarium sp. di musim hujan pada lahan pertanaman A.
cepa bisa mencapai kerugian 100%. Luas serangan Fusarium sp. dilaporkan
mencapai 48,2 ha dan meluas hingga 404,9 ha. Serangan Fusarium sp. terjadi saat tanaman berumur 30-45 hari. Pengaruh curah hujan dan air yang mengalir merupakan faktor penting dalam penyebaran propagul patogen. Pada musim hujan, aliran air hujan dapat menjadi media yang efektif untuk penyebaran inokulum Fusarium sp. di lahan pertanaman A. cepa (Wiyatiningsih, 2011).
Serangan penyakit moler pada A. cepa memiliki gejala serangan yang khas dan dapat diamati secara visual yaitu tanaman akan mendadak layu, tulang-tulang daun terlihat pucat, warna daun kekuning-kuningan terutama daun-daun sebelah atas dan cenderung mengkerut atau terpelintir, kemudian diikuti dengan merunduknya batang. Umbi A. cepa akan membusuk yang berawal dari dasar umbi lalu meluas ke atas dan ke samping, terlihat koloni kapang keputih-putihan pada dasar umbi, tanaman tampak seperti akan roboh, dan akhirnya tanaman A.
cepa mati (Wiyatiningsih, 2009).
Fusarium sp. juga dapat menginfeksi akar, terutama melalui luka-luka lalu
menetap dan berkembang di berkas pembuluh. Luka pada akar dapat disebabkan karena pemindahan bibit, luka karena serangga dan nematoda. Namun, Fusarium sp. juga dapat menginfeksi akar yang sehat (tidak adanya luka). Adapun gejala penyakit moler pada A. cepa dapat dilihat pada Gambar 3.
13
Gambar 3. Gejala penyakit moler pada Allium cepa. A. Gejala penyakit moler pada daun; B. Gejala penyakit moler pada umbi & akar
Pada tanaman muda, penyakit moler dapat menyebabkan tanaman mati secara mendadak karena pada pangkal batang terjadi kerusakan. Sedangkan, pada tanaman dewasa yang terinfeksi sering dapat bertahan dan membentuk buah tetapi hasilnya sangat sedikit dan kecil-kecil. Fusarium sp. dapat bertahan lama dalam tanah, sehingga tanah yang sudah terinfeksi sukar dibebaskan kembali dari patogen ini. Penyakit moler menyebabkan dampak utama terhadap terganggunya proses absorbsi unsur hara dan mineral di dalam tanah sehingga dapat mengakibatkan kegagalan panen (Sastrahidayat, 2011).
Allah Subhanahu Wa Ta’ala berfirman di dalam Al Qur’an Surat Yunus ayat 24: َ ْلا ُتاَبًَ َِِب َطَلَت ْخاَف ِءا َوَّسلا َي ِه ٍُاٌَْل َصًَْأ ٍءا َوَك اَيًُّْدلا ِةاَي َحْلا ُلَث َه ا َوًَِّإ ُلُكْأَي ا َّو ِه ِض ْز َىّ ُز ِداَق ْنًََُِّأ اَُِلَُْأ َّيَظ َّ ْتٌََّي َّشا َّ اََِف ُس ْخ ُش ُض ْزَ ْلا ِتَر َخَأ اَذِإ ٰىَّت َح ُماَعًَْ ْلا َّ ُضاٌَّلا َِْيَلَع َٰرَك ۚ ِط ْهَ ْلاِب َيْغَت ْنَل ْىَأَك اادي ِص َح اَُاٌَْلَع َجَف ا ازاًََِ َّْأ الًْيَل اًَ ُس ْهَأ اَُاَتَأ ا ُل ِّصَفًُ َكِل َىّ ُسَّكَفَتَي ٍم َْْقِل ِتاَي ْلْا Artinya: sesungguhnya perumpamaan kehidupan duniawi itu, adalah seperti air (hujan) yang Kami turunkan dari langit, lalu tumbuhlah dengan suburnya karena air itu tanam-tanaman bumi, di antaranya ada yang dimakan manusia dan binatang ternak. Hingga apabila bumi itu telah sempurna keindahannya, dan memakai (pula) perhiasannya, dan pemilik-permliknya mengira bahwa mereka pasti menguasainya, tiba-tiba datanglah kepadanya azab Kami di waktu malam atau siang, lalu Kami jadikan (tanam-tanamannya) laksana tanam-tanaman yang sudah disabit, seakan-akan belum pernah tumbuh kemarin. Demikianlah Kami menjelaskan tanda-tanda kekuasaan (Kami) kepada orang-orang berfikir.
2.2.1. Patogen Fusarium sp. Penyebab Penyakit Moler
Jenis patogen pada tanaman yang paling banyak ditemukan pada penelitian sebelumnya adalah Fusarium sp. yang menjadi penyebab penyakit moler (layu Fusarium). Klasifikasi Fusarium sp. menurut Semangun (2000) termasuk ke dalam kingdom: Mycetaceae, divisi: Amastigomycota, subdivisi:
Deuteromycotyna, kelas: Deutomycetes, subkelas: Hyphomycetidae, famili: Moniales, genus: Fusarium, spesies: Fusarium sp.
Fusarium sp. merupakan mikroorganisme eukariot, memiliki spora, tidak
mempunyai klorofil, memiliki dinding sel yang sebagian besar tersusun atas polisakarida dan kitin. Tubuh Fusarium sp. terdiri atas benang-benang yang disebut hifa yang saling berhubungan dan membentuk miselium. Fusarium sp. disebut organisme heterotrofik karena memanfaatkan senyawa karbon organik sebagai sumber nutrient dari organisme lain ataupun media tertentu melalui penyerapan. Fusarium sp. akan mensekresikan enzim ekstraseluler untuk mengurai molekul yang bersifat kompleks menjadi bentuk yang lebih sederhana sehingga dapat diserap melalui hifa (Gandjar et al., 1999).
Fusarium sp. dapat menyebabkan penyakit pada tanaman yang dapat
menyerang satu atau banyak jenis tanaman. Fusarium sp. memiliki kemampuan bertahan hidup di dalam tanah dalam jangka waktu yang lama. Fusarium sp. menginfeksi jaringan A. cepa melalui penetrasi langsung ke bagian cakram umbi lapis, atau melalui luka-luka pada jaringan akar dan bagian dasar umbi lapis (Nugroho, 2013). Fusarium sp. dapat menyebar melalui tanah yang mengandung propagul yang menempel pada peralatan tanam, sisa-sisa tanaman terinfeksi, umbi benih terinfeksi, atau aliran air. Menurut Semangun (2008) Fusarium sp. masih dapat bertahan hidup di dalam tanah meskipun tanpa inang.
Penelitian (Wiyatiningsih, 2003) telah membuktikan bahwa Fusarium sp. merupakan patogen penyebab penyakit layu dan busuk bagian korteks pada lebih dari 100 tanaman pertanian. Fusarium sp. yang ditumbuhkan pada media Potato
Dextrose Agar (PDA) dapat menunjukkan pertumbuhan yang cepat yaitu dengan
diameter koloninya mencapai lebih dari 2-5 cm setelah 4 hari. Isolat Fusarium sp. secara makroskopis memiliki koloni melingkar dan menyebar ke segala arah. Pada awal pertumbuhan koloni Fusarium sp. berwarna putih seperti kapas,
15
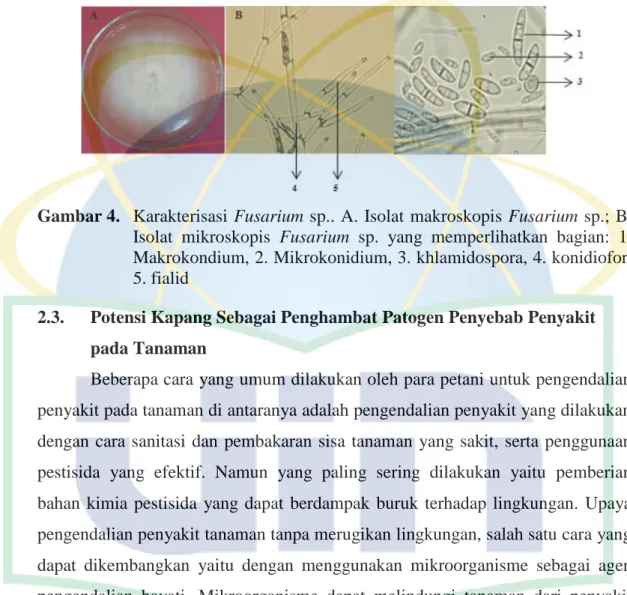
kemudian berubah menjadi putih agak kekuningan atau krem. Fusarium sp. mempunyai 3 alat reproduksi, yaitu makrokonidium (3-5 septa) berbentuk bulan sabit, mikrokonidium (1-2 septa) berbentuk bulat telur, dan klamidospora (pembengkakan pada hifa). Morfologi koloni Fusarium sp. secara makroskopis dan mikroskopis dapat dilihat pada Gambar 4.
Gambar 4. Karakterisasi Fusarium sp.. A. Isolat makroskopis Fusarium sp.; B. Isolat mikroskopis Fusarium sp. yang memperlihatkan bagian: 1. Makrokondium, 2. Mikrokonidium, 3. khlamidospora, 4. konidiofor, 5. fialid
2.3. Potensi Kapang Sebagai Penghambat Patogen Penyebab Penyakit pada Tanaman
Beberapa cara yang umum dilakukan oleh para petani untuk pengendalian penyakit pada tanaman di antaranya adalah pengendalian penyakit yang dilakukan dengan cara sanitasi dan pembakaran sisa tanaman yang sakit, serta penggunaan pestisida yang efektif. Namun yang paling sering dilakukan yaitu pemberian bahan kimia pestisida yang dapat berdampak buruk terhadap lingkungan. Upaya pengendalian penyakit tanaman tanpa merugikan lingkungan, salah satu cara yang dapat dikembangkan yaitu dengan menggunakan mikroorganisme sebagai agen pengendalian hayati. Mikroorganisme dapat melindungi tanaman dari penyakit dengan menekan patogen melalui sifat antagonisme (Fokkema & Meulen, 1976).
Kapang berpotensi memiliki mekanisme antagonis yang disebabkan oleh aktivitasnya yang besar dalam menekan pertumbuhan dan perkembangan mikroba-mikroba patogen. Penggunaan sumber-sumber biologis untuk mengendalikan penyakit tanaman merupakan alternatif penting dalam mengurangi penggunaan pestisida sehingga aman terhadap lingkungan, serta dapat
mempertahankan nilai estetika tanaman dan tidak merusak media tanam (Slusarenko et al., 2000).
Pengendalian penyakit tanaman dengan menggunakan kapang antagonis bertujuan untuk mengurangi laju perkembangan penyakit melalui penurunan daya hidup patogen pada tanaman, menurunkan jumlah propagul yang diproduksi, mengurangi infeksi patogen pada tanaman, membasmi mikroba patogen pada inang yang terinfeksi dan mencegah pembusukan serta perusakan bahan oleh mikroba patogen (Sastrahidayat, 2011).
2.4. Seleksi In Vitro Kapang Antagonis pada Media PDA
Metode seleksi untuk menemukan kapang antagonis penghambat patogen penyebab penyakit tanaman dilakukan dengan teknik in vitro. Teknik in vitro merupakan metode yang efektif dan efisien untuk perbanyakan mikroorganisme dalam kondisi lingkungan aseptik dan dapat dikendalikan. Media kultur in vitro digunakan untuk menumbuhkan isolat kapang yang diperoleh dari inang alaminya (Ubudiyah & Nurhidayati, 2013).
Metode secara in vitro digunakan untuk mendapatkan isolat kapang yang berpotensi menghambat patogen penyebab penyakit di karenakan pada metode in
vitro, media dapat dikondisikan tertentu, sesuai dengan tujuan penelitian yang
ingin dicapai. Inokulasi kapang pada media Potato Dextrose Agar (PDA) merupakan langkah awal untuk proses pembiakan kapang. Media PDA dibuat untuk keperluan pemurnian dan penyimpanan biakan murni isolat kapang. Pertumbuhan kapang pada media PDA dikarenakan kandungan pada media PDA yang menjadi sumber nutrisi bagi kapang. Media PDA mengandung sumber karbohidrat dalam jumlah cukup yaitu terdiri dari 20% ekstrak kentang dan 2% glukosa sehingga baik untuk pertumbuhan kapang (Lay & Hastowo, 1994).
Media PDA dibuat dari campuran ekstrak kentang (kaldu), glukosa, agar
powder, dan chloramphenicol. Kaldu kentang dan glukosa berfungsi sebagai
sumber karbohidrat serta chloramphenicol bertujuan agar media tidak terkontaminasi dengan bakteri. Komposisi media berpengaruh pada pertumbuhan hifa, produksi konidia serta patogenitasnya. Penggunaan media PDA bertindak sebagai lingkungan bagi pertumbuhan organisme. Kapang dapat tumbuh baik apabila kondisi lingkungan sesuai dan nutrisi dapat terpenuhi (Khairani, 2007).
17 BAB III
METODOLOGI PENELITIAN
3.1. Waktu dan Tempat
Penelitian ini dilakukan pada bulan Oktober 2019 hingga April 2020 di Laboratorium Konservasi Mikroorganisme, Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumber Daya Genetik (BB Biogen), Bogor, Jawa Barat.
3.2. Alat dan Bahan
Alat yang digunakan dalam penelitian ini adalah cawan petri, oven, pH meter, inkubator, labu ukur, spektrofotometer UV-Vis, gel elektroforesis horizontal, timbangan analitik scaltec, mikropipet thermo scientific, autoklaf daihan scientific, mikroskop cahaya olympus BX53, microwave wavedom, hot
plate heidolph MR 30001k, vortex seoulin, scalpel, orbital shaker MESH 30, centrifuge legend micro 21F, ESCO-PCR thermal cycler, kamera handphone, freezer, tabung centrifuge steril, eppendorf tube, magnetic stirrer, laminar air flow (LAF), waterbath shaker, tilt shaker, UV-transilluminator, heater, pestle, gel documentation, casting tray, dan well comb.
Bahan yang digunakan dalam penelitian ini antara lain daun, umbi, akar, dan tanah dari tanaman bawang merah (Allium cepa L.) varietas Bima Curut asal Kabupaten Brebes yang telah ditumbuhkan di Rumah Kaca (RK) BB Biogen, kapang Fusarium sp. dari kultur koleksi BB Biogen, kentang, glukosa, akuades steril, kertas saring steril, etanol 70% dingin, alkohol 70%, alkohol 96%, koloid kitin 0,3%, kitin komersial, bor sedotan, kain kasa, agar powder, chlorampenicol,
dextrose, kapas, yellow tip, blue tip, aluminium foil, parafilm, tootpick.
Asam klorida (HCL) pekat, natrium hidroksida (NaOH), magnesium sulfat heptahidrat (MgSO4.7H20), dikalium hidrogen fosfat (K2HPO4), natrium klorida
(NaCl), ammonium sulfat ((NH4)2SO4), yeast extract, triptone, kalsium klorida
(CaCl2), natrium karbonat (Na2CO3), L-cystine HCL, potasium dihidrogen fosfat
(KH2PO4), pepton, natrium hipoklorit (NaOCl) 3%, congo red 0,3%, reagen
K3[Fe(CN)6], natrium dihidrogen fosfat (NaH2PO4), Phosphate Buffer Saline
(PBS) pH 7, ekstrak enzim kasar, reagen 1, reagen 2, kloroform dingin, nucleon
phytopure DNA extraction resin suspension, isopropanol, Tris-EDTA (TE) buffer, nuclease free water, primer ITS-5 (5’-GGAAGTAAAAGTCGTAACAAGG-3’),
primer ITS-4 (5’-TCCTCCGCTTATTGATATGC-3’) produksi PT. Sentra Biosains Dinamika, Jakarta, isolat DNA kapang, ultrapure agarose, Tris Acetate
EDTA (TAE) buffer, gel red nucleic acid gel stain 10.000x, 100 bp plus DNA ladder, blue juice loading dye, N-asetil-D-glukosamin, dan promega go taq green master mix.
3.3. Rancangan Penelitian
Penelitian ini menggunakan Rancangan Acak Lengkap (RAL) dengan perlakuan yaitu isolat kapang diisolasi dari bagian daun, umbi, akar, dan tanah tanaman bawang merah (Allium cepa L.) varietas Bima Curut asal Kabupaten Brebes. Tahapan dalam penelitian ini meliputi tahap isolasi kapang dari A. cepa, pemurnian isolat kapang, uji antagonis secara in vitro dengan 3 kali pengulangan untuk mengetahui isolat kapang yang berpotensi dalam menghambat pertumbuhan
Fusarium sp, uji kitinase secara kualitatif dan kuantitaf, karakterisasi isolat
kapang antagonis secara makroskopis dan mikroskopis. Identifikasi molekuler meliputi isolasi DNA, amplifikasi dengan metode PCR, elektroforesis DNA serta sekuensing DNA terhadap tiga isolat kapang antagonis dengan persentase daya hambat (%) terbesar.
3.4. Cara Kerja 3.4.1. Pembuatan Media
3.4.1.1. Pembuatan Media Potato Dextrose Agar (PDA) dan Pembuatan Media Potato Dextrose Broth (PDB)
Kentang yang telah dicuci bersih ditimbang sebanyak 200 g lalu dikupas dan diiris tipis, kemudian dimasukkan ke dalam erlenmeyer 1000 mL lalu direbus menggunakan microwave sampai setengah matang (20 menit). Air hasil rebusan disaring untuk mendapatkan ekstrak kentang (kaldu). Tahap selanjutnya, sebanyak 20 g glukosa dilarutkan di dalam erlenmeyer, lalu ditambahkan 20 g agar powder
19
untuk membuat media PDA sedangkan untuk media PDB tidak diperlu ditambahkan agar powder.
Hasil campuran bahan pembuatan media di dalam erlenmeyer, ditambahkan 400 mL kaldu dan 100 mg chloramphenicol yang berfungsi untuk menghindari kontaminasi bakteri. Semua bahan diaduk menggunakan magnetic
stirrer di atas hot plate stirrer hingga homogen. Selanjutnya, campuran tersebut
ditambahkan akuades hingga volume mencapai 1000 mL. Media disterilisasi menggunakan autoklaf pada suhu 121 oC selama 60 menit pada tekanan 17.5 Psi, setelah itu media didinginkan hingga suhu 40-45 oC.
3.4.1.3. Pembuatan Media Kitin Padat dan Cair
Pembuatan media kitin padat dan cair diawali dengan pembuatan koloid kitin yaitu 5 g kitin komersial dilarutkan dalam 100 mL HCL 10 N pekat kemudian diaduk menggunakan magnetic stirrer selama 15-30 menit. Kitin yang dipreparasi dengan hidrolisis parsial menggunakan HCL 10 N akan menghasilkan koloidal kitin yang mampu menginduksi kitinase kompleks seperti N-asetilglukosaminidase (Sharma et al., 2014). Selanjutnya, larutan dimasukan ke dalam erlenmeyer yang berisi 1000 mL akuades dingin. Larutan diaduk kembali menggunakan magnetic stirrer lalu disaring menggunakan kain kasa dan ampasnya dibuang. Larutan disimpan selama 24 jam pada suhu 4o C dan setelah 24 jam, air yang berada di bagian atas larutan dibuang dan ditambahkan akuades dingin hingga mencapai volume 1000 mL. Proses pembuangan air pada bagian atas larutan tersebut dilakukan sebanyak lima kali dengan selang waktu dua jam. Setelah selesai, pH larutan diukur dengan menambahkan NaOH hingga pH sesuai mencapai pH 6,8. Koloid kitin yang dihasilkan disimpan pada suhu 4o C (Suryadi et al., 2013).
Pembuatan media kitin padat. Media kitin padat dibuat dengan cara sebanyak 0,1 g MgSO4.7H2O, 1 g K2HPO4, 1 g NaCl, 7 g (NH4)2SO4, 2 g yeast
extract, 1 g tripton, dan 15 ml koloid kitin dilarutkan dalam 1 L akuades dalam erlenmeyer 1000 mL lalu ditambahkan 20 g agar, kemudian dihomogenkan
dengan menggunakan magnetic stirrer di atas hot plate stirrer. Media disterilisasi menggunakan autoklaf pada suhu 121° C selama 60 menit pada tekanan 17.5 Psi. (Suryadi et al., 2013).
Pembuatan media kitin cair. Media kitin cair dibuat dengan cara sebanyak 10 mL koloid kitin, 2 g CaCl2, 0.1 g MgSO4.7H2O, 2,5 g Na2CO3, 2.6 g
(NH4)2SO4, 1 g L-cystein HCL, 5,8 g K2HPO4, 3 g KH2PO4, 1 g pepton, dan 4.5 g
yeast ekstrak dilarutkan dalam 1 L akuades dalam erlenmeyer 1000 mL. Kemudian, dihomogenkan dengan magnetic stirrer. Media cair kitin dipindahkan 20 mL ke dalam tabung ulir dan disterilisasi pada suhu 121° C selama 60 menit pada tekanan 17.5 Psi.
3.4.2. Isolasi Kapang dari Allium cepa L.
Isolasi kapang dilakukan dengan metode inokulasi langsung (direct
inoculation) yaitu kapang diisolasi dari inang alaminya A. cepa varietas Bima
Curut asal Kabupaten Brebes. Prosedur isolasi kapang diawali dengan mengambil masing-masing 3 sampel organ yaitu daun, umbi, dan akar serta untuk isolasi kapang dari media tanam yaitu diambil sampel tanah dari 3 pot A. cepa yang terdapat di rumah kaca, BB Biogen.
Metode isolasi kapang menggunakan metode Isnaeni et al. (2009) yang telah dimodifikasi. Sampel daun, umbi, dan akar A. cepa dibersihkan menggunakan air mengalir untuk membersihkan dari debu dan kotoran-kotoran lain yang menempel. Selanjutnya dilakukan sterilisasi permukaan (surface
sterilization) yaitu daun, umbi, dan akar A. cepa yang sudah bersih dimasukkan ke
dalam beaker glass berisi etanol 70% selama 20 detik. Sampel organ tanaman kemudian direndam dalam larutan natrium hipoklorit (NaOCl) 3% selama 2 menit, lalu dibilas dengan akuades steril sebanyak 3 kali, dan air bilasan terakhir disebar ke media PDA untuk membuktikan keberhasilan sterilisasi permukaan.
Tahap selanjutnya, sampel dikeringkan dengan diletakkan di atas kertas saring steril selama 1 jam. Setelah proses pengeringan selesai, setiap sampel dipotong dengan scalpel steril. Sampel daun dan umbi dipotong menjadi 4 bagian berukuran 1x1 cm, sementara akar diambil rambut akarnya yang halus dan dipotong menjadi 2 bagian sepanjang 1 cm. Setiap potongan sampel diletakkan di atas permukaan media PDA (4 segmen per cawan petri) menggunakan pinset seperti pada Gambar 5. semua perlakuan dilakukan sebanyak 3 kali pengulangan (triplo) untuk setiap sampel, sehingga total sampel organ yang diamati berjumlah
21
108 segmen. Cawan petri yang telah berisi sampel ditutup rapat menggunakan
parafilm dan diinkubasi selama 7 hari dengan suhu ruang (27o C).
Gambar 5. Peletakkan sampel organ tanaman di media PDA
Isolasi kapang yang diperoleh dari sampel tanah dengan metode pengenceran dan sebar seperti yang diterapkan oleh Ramona (2003) yaitu sampel tanah diambil sebanyak 10 g dengan menggunakan sekop kecil dengan kedalaman 10 – 15 cm dari pangkal batang, kemudian sampel tanah dimasukan ke dalam
beaker glass dan diberikan akuades steril lalu sampel tanah dihomogenkan
menggunakan vortex selama 15 menit untuk memperoleh ekstrak tanah. Hasil ekstrak tanah yang sudah homogen, selanjutnya dilakukan pengenceran 10-2 hingga 10-6 seperti pada Gambar 6. ekstrak tanah dari masing-masing sampel tanah pada pengenceran ke-10-4, 10-5, 10-6 diambil sebanyak 1000 µL menggunakan mikropipet dan diteteskan ke dalam cawan petri yang sudah berisi media PDA lalu diratakan menggunakan batang pengaduk segitiga hingga kering, Media PDA diinkubasi dengan posisi cawan petri terbalik selama 7 hari di dalam inkubator pada suhu 30o C.
Pengamatan dilakukan setiap hari dan dilakukan pemurnian apabila ada isolat kapang yang tumbuh. Kapang yang tumbuh pada rentang waktu 1-7 hari digolongkan ke dalam fast growing kapang, dan lebih dari 14 hari digolongkan ke dalam slow growing kapang (Laraswati, 2018).
3.4.3. Pemurnian Isolat Kapang Hasil Isolasi dari Allium cepa L.
Pemurnian isolat kapang yang tumbuh dilakukan dengan metode hypal tip
isolation. Isolat kapang yang telah tumbuh di tepi organ tanaman dan isolat
kapang asal sampel tanah dengan morfologi yang berbeda akan dipindahkan masing-masing ke dalam cawan petri baru berisi media PDA.
Isolat kapang yang telah tumbuh pada media PDA diletakkan pada posisi bagian tengah media PDA baru yang sebelumnya telah dilubangi dengan menggunakan bor sedotan steril dan toothpick, Kemudian, cawan petri ditutup rapat menggunakan parafilm dan diinkubasi selama 7 hari pada suhu ruang (27
o
C).
3.4.4. Uji Antagonis Isolat Kapang dengan Fusarium sp. secara In Vitro
Uji antagonis isolat kapang hasil pemurnian dengan Fusarium sp. dilakukan secara in vitro pada media PDA untuk mengetahui efektivitas kapang antagonis terhadap pertumbuhan Fusarium sp. uji antagonis dilakukan dengan
dual culture assay seperti yang dilakukan oleh (Ramona, 2003).Tahap awal yang
dilakukan yaitu isolat kapang murni yang tumbuh pada media PDA pada tahap pemurnian diambil menggunakan cork borer dan toothpick lalu diletakan pada media cawan petri baru berisi PDA seperti pada Gambar 7., kemudian Fusarium sp. diambil dari kultur berumur 8-10 hari. Isolat kapang dan Fusarium sp. diletakan bersamaan secara tegak lurus dengan jarak 4 cm di dalam cawan petri baru berisi media PDA. Cawan petri ditutup menggunakan parafilm dan diinkubasi di dalam inkubator pada suhu 30o C selama 7 hari setiap perlakuan dilakukan tiga kali pengulangan. Pengamatan dimulai dari hari ke-2 sampai hari ke-7.
23
Gambar 7. Uji antagonis pada media PDA. A. Isolat kapang antagonis; B. Isolat
Fusarium sp. diletakkan tegak lurus
3.4.5. Uji Aktivitas Kitinase
Aktivitas enzim kitinase pada isolat kapang merupakan parameter yang digunakan dalam seleksi mikroorganisme. Enzim kitinase dimanfaatkan dalam pengendalian hayati terhadap patogen penyebab penyakit pada tanaman. Pengendalian hayati terhadap patogen dengan menggunakan mikroorganisme didasarkan pada kemampuan mikroorganisme menghasilkan enzim kitinase yang dapat melisiskan sel patogen (El-Katatny et al., 2000).
Aktivitas enzim yang dihasilkan oleh mikroorganisme dapat diketahui dengan seleksi pada medium selektif. Medium selektif merupakan medium dengan komposisi tertentu, sehingga hanya jenis-jenis mikroorganisme tertentu saja yang dapat hidup. Enzim kitinase yang diproduksi dapat diketahui dengan meilihat aktivitas enzim kitinase. Aktivitas enzim kitinase merupakan ukuran perubahan molekul substrat menjadi produk dalam satuan waktu pada kondisi tertentu. Aktivitas enzim kitinase yang ditunjukkan oleh kapang dapat ditentukan secara kualititif dan kuantitatif (Green et al., 2005).
3.4.5.1. Uji Kualitatif Kitinase
Pengujian aktivitas kitinase secara kualitatif dilakukan dengan cara 2 ose kultur dimasukkan ke dalam tabung eppendorf yang berisi 100 µL akuades steril. Sebanyak 5 µL suspensi dipipet, kemudian diteteskan ke dalam media kitin padat yang telah dibagi menjadi dua kuadran. Setiap kuadran ditetesi 5 µL suspensi dan dibiarkan mengering selama satu hari dalam laminar. Media diinkubasi pada suhu ruang selama 7 hari (Suryadi et al., 2013).
Zona bening yang terbentuk divisualisasikan dengan penambahan pewarna congo red 0,3% hingga menutupi seluruh permukaan media kitin padat
dan dibiarkan selama 5-15 menit, lalu dibuang. Larutan NaCl 0,1% diteteskan hingga menutupi seluruh permukaan media kitin padat, lalu dibuang. Media kemudian didiamkan selama 10 menit dan diamati zona bening yang terbentuk. Diameter zona bening diukur menggunakan rumus perhitungan indeks kitinolitik sebagai berikut:
Keterangan:
I = Indeks kitinolitik d1 = Diameter zona bening d2 = Diameter koloni
3.4.5.2. Uji Kuantitatif Kitinase
Pembuatan reagen Schales dan phosphate buffer saline (PBS) pH 7.
Reagen schales dibuat dengan menyiapkan larutan Na2CO3 0.5M yaitu 5,3 g
kristal Na2CO3 ditimbang lalu dilarutkan dengan 100 mL dH2O. Kemudian,
larutan ditambahkan 0.05 g K3Fe (CN)6 dalam labu ukur yang berisi 100 mL
Na2CO3 0.5M.
Phosphate buffer saline (PBS) pH 7 dibuat dengan mencampurkan
NaOH 0.02M dan NaH2PO4 0,02M. NaOH 0.02M didapatkan dari 0,2759 g
kristal NaOH ditimbang kemudian ditambahkan akuades 100 mL dan NaH2PO4
0,02M didapatkan dari 0,08 g NaH2PO4 ditimbang dan ditambahkan 100 mL
akuades. pH 7 buffer fosfat dihasilkan dengan pencampuran 30 mL NaOH 0.02M dan 50 mL NaH2PO4 0,02M. Larutan buffer fosfat pH 7 ditera dengan akuades
hingga volume 100 mL.
Uji aktivitas enzim kitinase secara kuantitatif dilakukan dengan cara 2 potong kultur kapang dipindahkan dari media PDA ke dalam media kitin cair sebanyak 10 mL dalam tabung ulir. Kultur diinkubasi pada orbital shaker dengan kecepatan 120 rpm selama 48 jam pada suhu ruang hingga keruh. Kultur disentrifugasi dengan kecepatan 10.000 rpm selama 10 menit pada suhu 4° C. Supernatan diambil sebagai ekstrak kasar. Sebanyak 150 µL ekstrak kasar, 150 µl PBS pH 7, dan 300 µL koloid kitin (0,3%) dihomogenkan dengan vortex dan diinkubasi pada waterbath dengan suhu 37° C selama 30 menit (Suryadi et al., 2013).
25
Tahap selanjutnya, campuran enzim disentrifugasi kembali dengan kecepatan 5.000 rpm selama 5 menit. Supernatan dipipet 500 µL dan dimasukkan ke dalam tabung reaksi lalu ditambahkan 500 µL akuades dan 1.000 µL reagen
schales. Hasil campuran tersebut dan larutan standar pada Tabel 2. dididihkan
pada suhu 100° C selama 10 menit. Larutan didinginkan untuk selanjutnya di ukur nilai absorbansinya dengan spektrofotometer UV-Vis pada panjang gelombang 420 nm.
Tabel 2. Konsentrasi larutan standar
Konsentrasi (ppm) N-asetil-D-glukosamin (µL) Akuades (µL)
0 - 5.000 10 500 4.500 20 1.000 4.000 30 1.500 3.500 40 2.000 3.000 50 2.500 2.500
Langkah pertama untuk mengukur nilai absorbansi yaitu akuades diukur absorbansinya lalu dilakukan auto zero. Kemudian, 1.000 µL akuades dan 1.000 µL reagen Schales diukur absorbansinya sebagai blanko pada panjang gelombang 420 nm. Selanjutnya, larutan standar dan seluruh sampel diukur absorbansinya satu per satu pada panjang gelombang yang sama. Setiap pergantian sampel, kuvet dicuci dengan akuades sebanyak 3 kali.
3.4.6. Karakterisasi Kapang Antagonis
Identifikasi kapang dilakukan dengan mengamati beberapa karakteristik morfologi baik secara makroskopis maupun mikroskopis. Karakteristik makroskopis meliputi pengamatan diamter koloni kapang, bentuk koloni yang tumbuh pada cawan petri berisi media PDA, bentuk tepi koloni, tekstur koloni, warna koloni bagian atas (top side) dan bawah cawan petri (reverse side).
Pengamatan mikroskopis dilakukan dengan membuat preparat. Biakan murni sel kapang dipulaskan secara aseptis menggunakan jarum ose steril ke atas permukaan kaca objek yang telah ditetesi larutan shear. Setelah itu, preparat ditutup dengan kaca penutup dan diamati dengan perbesaran 400-1000x menggunakan mikroskop cahaya. Karakteristik secara mikroskopis meliputi pengamatan bentuk spora, ukuran spora, struktur hifa (Tabel 3.).
Hasil pengamatan didokumentasikan menggunakan kamera. Karakterisasi yang diamati dapat digunakan untuk mengidentifikasi kapang melalui kunci analisis kapang yang telah dipublikasikan untuk menentukan marga kapang.
Tabel 3. Karakter yang diamati untuk identifikasikapang (Gandjar et al., 2006)
No Karakter yang diamati Keterangan
Makroskopis
1 Warna koloni Putih, hijau, hitam, coklat, merah
2 Bentuk koloni Bulat, bulat telur, tidak beraturan dan
berserabut seperti benang
3 Tekstur koloni Pasir, kapas, licin, padat, dan kasar
4 Bentuk tepi koloni Rata, berlobus, berlekuk, tidak
beraturan, dan meruncing Mikroskopis
5 Struktur hifa Berseptat atau tidak berseptat
6 Bentuk spora Bulat, elips, semibulat
7 Warna konidia Coklat, hijau, hialin
8 Konidiofor Bercabang atau tidak
9 Warna Konidiofor Hialin, coklat
3.4.7. Isolasi DNA Kapang
Isolasi DNA kapang dilakukan dengan menggunakan metode Rahayu et al. (2015) yang dimodifikasi, yaitu isolasi DNA kapang dilakukan pada miselium berumur 4 hari. Sebanyak tiga isolat kapang hasil uji antagonis dengan nilai persentase daya hambat tertinggi dipindahkan dari media PDA ke dalam 10 mL media PDB di dalam tabung ulir dan diinkubasi bergoyang selama 5 hari. Selanjutnya, isolat dimasukkan ke dalam plastik steril menggunakan tootpick dan digerus sampai halus menggunakan pestle. Isolat dipindahkan ke dalam tabung
sentrifuge steril lalu ditambahkan 600 µL reagen 1 dan 200 µL reagen 2. Inversi
beberapa kali hingga homogen lalu inkubasi pada waterbath shaker dengan suhu 65o C selama 10 menit.
Tahap selanjutnya, inkubasi pada freezer selama 20 menit lalu setelah selesai dikeluarkan dari freezer dan ditambahkan 500µL kloroform dingin dengan suhu -20o C. Setelah proses inkubasi, isolat DNA ditambahkan dengan 100 µL
nucleon phytopure DNA extraction resin suspension kemudian dihomogenkan
menggunakan tilt shaker pada suhu ruang selama 10 menit.
Setelah homogen, tube disentrifuge dengan kecepatan 1.300xg selama 10 menit. Lalu, pindahkan fasa DNA (di atas brown resin layer) menggunakan pipet
27
dan hasil sentrifuge dipindahkan ke dalam tabung eppendorf steril yang baru. Kemudian, ditambahkan 600 µL isopropanol lalu inversi tabung eppendorf sampai DNA presipitasi dan dilakukan sentrifuge dengan kecepatan 4.000xg selama 5 menit. Pelet DNA yang dihasilkan dicuci dengan etanol 70% dingin lalu disentrifugasi kembali dengan kecepatan dan waktu yang sama.
Supernatan yang dihasilkan dari proses sentrifuge dibuang dan tube yang berisi pelet DNA dikeringkan dengan membiarkan tabung terbuka selama 10-15 menit untuk menghilangkan sisa etanol dari tabung. Setelah proses pengeringan, resuspensi DNA dalam 50 µL Tris EDTA (TE) buffer atau nuclease free water. Isolat DNA diinkubasi pada suhu 37o C selama 15 menit, selanjutnya didiamkan pada suhu kamar selama 24 jam. Isolat DNA disimpan di lemari es pada suhu 2-8
o
C.
3.4.8. Amplifikasi DNA dengan metode Polymerase Chain Reaction (PCR)
Amplifikasi PCR dilakukan dengan menggunakan pasangan primer ITS-5 (5’-GGAAGTAAAAGTCGTAACAAGG-3’) sebagai primer forward dan primer
ITS-4 (5’-TCCTCCGCTTATTGATATGC-3’) sebagai primer reverse.
Pembuatan larutan PCR mix solution untuk tiga sampel, dilakukan dengan diambil masing-masing 3µL primer ITS-5 dan primer ITS-4. Kemudian sebanyak 37,5 µL
promega go taq green master mix dimasukkan ke dalam tabung eppendorf steril
dan dicampurkan dengan primer serta ditambahkan nuclease free water sebanyak 25,5 µL. Selanjutnya sebanyak 23 µL hasil campuran primer, promega go taq
green master mix dan nuclease free water dimasukkan ke dalam tabung PCR lalu
ditambahkan isolat DNA kapang sebanyak 2 µL pada masing-masing tube.
Tabung PCR yang berisi PCR mix dan DNA dimasukkan ke dalam mesin
thermal cycler. Selanjutnya, mesin thermal cycler dijalankan dengan kondisi
PCR. Reaksi amplifikasi berlangsung dalam 3 tahap untuk setiap siklus. Reaksi diawali dengan hot start pada suhu 95o C selama 5 menit. Tahap pertama predenaturasi 94o C selama 2 menit dan denaturasi 94o C selama 1 menit. Tahap kedua annealing pada suhu 36o C selama 1 menit. Tahap ketiga adalah pemanjangan rantai DNA (extension) pada suhu 72o C selama 1 menit dan post
extensi pada suhu 72o C selama 10 menit. Selanjutnya penurunan suhu 4o C selama