RENCANA PELAKSANAAN PEMBELAJARAN (RPP) Sekolah : SMA Az-Zahra Palembang
Mata Pelajaran : Kimia Kelas/Semester : X/Ganjil Materi Pokok : Ikatan Kimia Alokasi Waktu: 1 x 45 menit
A. Kompetensi Inti (KI)
Kompetensi Sikap : menghayati dan mengamalkan ajaran agama yang dianutnya serta menunjukkan perilaku jujur, disiplin, tanggung jawab, peduli (gotong royong, kerjasama, toleran, damai), santun, responsif, dan pro-aktif sebagai bagian dari solusi atas berbagai permasalahan dalam berinteraksi secara efektif dengan lingkungan sosial dan alam serta menempatkan diri sebagai cerminan bangsa dalam pergaulan dunia.
KI-3 : Memahami, menerapkan, menganalisis pengetahuan faktual, konseptual, prosedural berdasarkan rasa ingin tahunya tentang ilmu pengetahuan, teknologi, seni, budaya, dan humaniora dengan wawasan kemanusiaan, kebangsaan, kenegaraan, dan peradaban terkait penyebab fenomena dan kejadian, serta menerap-kan pengetahuan prosedural pada bidang kajian yang spesifik sesuai dengan bakat dan minatnya untuk memecahkan masalah.
KI-4 :Mengolah, menalar, dan menyaji dalam ranah konkrit dan ranah abstrak terkait dengan pengembangan dari yang dipelajarinya di sekolah secara mandiri, dan mampu menggunakan metode sesuai kaidah keilmuan.
Kompetensi Dasar Dari KI 3 Kompetensi Dasar Dari KI 4 3.2 Membandingkan proses pembentukan
ikatan ion, ikatan kovalen, ikatan koordinasi, dan ikatan logam serta hubungannya dengan sifat fisika senyawa yang terbentuk.
4.2 Menyajikan hasil diskusi kelompok tentang kestabilan unsur, struktur lewis, ikatan ion, dan ikatan kovalen, kovalen koordinasi, senyawa
kovalen polar dan non polar ikatan logam dan sifat-sifatnya.
Indikator Pencapaian Kompetensi
(IPK) Indikator Pencapaian Kompetensi(IPK) 3.2.1 Menjelaskan kecenderungan suatu
unsur untuk mencapai kestabilannya. 3.2.2 Menggambarkan susunan elektron
valensi atom gas mulia (duplet dan okted) dan elektron valensi bukan gas mulia (struktur Lewis).
3.2.3 Mengidentifikasi proses terbentuknya ikatan ion.
3.2.4 Mengidentifikasi proses terbentuknya ikatan kovalen tunggal, rangkap dua, dan rangkap tiga.
4.2.1 Mempresentasikan proses pembentukan ikatan ion.
4.2.2 Menyajikan proses terbentuknya ikatan kovalen tunggal, rangkap dua, dan rangkap tiga.
C. Tujuan Pembelajaran
Melalui model pembelajaran Discovery Learning dengan pemberian rangsangan dan identifikasi masalah, menggali informasi untuk pengumpulan data, melakukan pengolahan data serta verifikasi dan menarik kesimpulan, diharapkan siswa terlibat aktif selama proses belajar mengajar berlangsung, memiliki sikap ingin tahu, komunikasi dalam melakukan pengamatan dan bertanggung jawab dalam menyampaikan pendapat, menjawab pertanyaan, memberi saran dan kritik, serta mampu menjelaskan kecenderungan suatu unsur untuk mencapai kestabilannya, menggambarkan susunan elektron valensi atom gas mulia (duplet dan okted) dan elektron valensi bukan gas mulia (struktur Lewis), menyajikan proses terbentuknya ikatan ion, ikatan kovalen tunggal, rangkap dua, dan rangkap tiga.
D. Materi Pembelajaran
2. Struktur Lewis
3. Ikatan Ion dan Ikatan Kovalen
E. Pendekatan, Metode dan Model Pembelajaran Pendekatan : saintifik
Metode : ceramah, diskusi kelompok, tanya jawab, dan penugasan Model : Eksplicit Intruction
F. Media Pembelajaran
Media/Alat : Power Point, Lembar Kerja, Papan Tulis/White Board G. Sumber Belajar
1. Buku Kimia Kelas X, Kementerian dan Kebudayaan Tahun 2013. 2. Internet.
3. Buku/ sumber lain yang relevan.
H. Kegiatan Pembelajaran Pertemuan 3
Indikator Pencapaian Kompetensi (IPK) dari KD 3.4
Indikator Pencapaian Kompetensi (IPK) dari KD 4.4
3.2.1 Menjelaskan kecenderungan suatu unsur untuk mencapai kestabilannya. 3.2.2 Menggambarkan susunan elektron
valensi atom gas mulia (duplet dan okted) dan elektron valensi bukan gas mulia (struktur Lewis).
3.2.3 Mengidentifikasi proses terbentuknya ikatan ion.
3.2.4 Mengidentifikasi proses terbentuknya ikatan kovalen tunggal, rangkap dua, dan rangkap tiga.
4.2.1 Mempresentasikan proses pembentukan ikatan ion.
4.2.2 Menyajikan proses terbentuknya ikatan kovalen tunggal, rangkap dua, dan rangkap tiga.
Pendahuluan (5 menit)
1. Memberi salam dan berdoa sebelum pembelajaran dimulai; 2. Mengkondisikan suasana belajar yang menyenangkan;
3. Mengaitkan materi/tema/kegiatan pembelajaran yang akan dilakukan dengan pengalaman peserta didik dengan materi/tema/kegiatan sebelumnya, yaitu : apa saja sifat-sifat dari periodik unsur
4. Menjelaskan mekanisme pelaksanaan pengalaman belajar sesuai dengan langkah-langkah pembelajaran.
Kegiatan Inti (35 menit)
1. Guru mendemonstrasikan pengetahuan dan keterampilan kepada peserta didik, dan memberikan kesempatan kepada setiap peserta didik untuk memperhatikan dan bertanya tentang ikatan kimia
2. Peserta didik dibimbing oleh guru untuk latihan, yaitu memberikan contoh soal dipapan tulis dan mendiskusikan soal dengan teman sebangkunya.
3. Peserta didik melakukan diskusi kepada teman sebangkunya untuk menyelesaikan soal yang diberikan guru .
4. Peserta didik diminta maju kedepan untuk mengerjakan soal yang diberikan dan guru mengecek pemahaman siswa tentang materi ikatan kimia
5. Pendidik memberikan umpan balik terhadap jawaban yang telah dikerjakan oleh siswa
6. Peserta didik diberikan soal latihan lanjutan berupa pekerjaan rumah
7. Peserta didik dibimbing oleh guru untuk menyussun kesimpulan atas materi yang telah didapatkan hari ini
Penutup (5 menit)
1. Guru melakukan penilaian terhadap hasil pencapaian kompetensi pada materi ikatan kimia
2. Guru memberikan penugasan kepada peserta didik untuk melakukan studi literatur tentang materi yang akan dibahas pada pertemuan berikutnya yaitu tentang ikatan kovalen
3. Guru memberi salam.
I. Penilaian
1. Teknik Penilaian:
a. Penilaian Sikap : Observasi/pengamatan/Jurnal b. Penilaian Pengetahuan : Tes Tertulis
c. Penilaian Keterampilan : Unjuk Kerja/ Praktik, Portofolio
2. Bentuk Penilaian :
a. Observasi : lembar pengamatan aktivitas peserta didik b. Tes tertulis : uraian dan lembar kerja
3. Instrumen Penilaian (terlampir)
Komunikasi
Kreatif
Critical Thinking
Colaboration
Creativity Aktif
Mengkonfirmasi
4. Remedial
a. Pembelajaran remedial dilakukan bagi peserta didik yang capaian KD nya belum tuntas
b. Tahapan pembelajaran remedial dilaksanakan melalui remidial teaching (klasikal), atau tutor sebaya, atau tugas dan diakhiri dengan tes.
c. Tes remedial, dilakukan sebanyak 2 kali dan apabila setelah 2 kali tes remedial belum mencapai ketuntasan, maka remedial dilakukan dalam bentuk tugas tanpa tes tertulis kembali.
5. Pengayaan
a. Bagi peserta didik yang sudah mencapai nilai ketuntasan diberikan pembelajaran pengayaan sebagai berikut:
- Siwa yang mencapai nilai n(ketuntasan)<n<n(maksimum) diberikan materi masih dalam cakupan KD dengan pendalaman sebagai pengetahuan tambahan
- Siwa yang mencapai nilai n>n(maksimum) diberikan materi melebihi cakupan KD dengan pendalaman sebagai pengetahuan tambahan.
Palembang, 21 Oktober 2017
Mengetahui
Guru pamong SMA Az-Zahra Mahasiswa PPL
IKATAN KIMIA
Ikatan kimia adalah ikatan yang terjadi antara atom-atom yang membentuk molekul-molekul.
Ikatan yang terjadi antar atom atau antar molekul dengan cara sebagai berikut : a). atom yang 1 melepaskan elektron, sedangkan atom yang lain menerima elektron. b). penggunaan bersama pasangan elektron yang berasal dari salah 1 atom.
a. Kestabilan Unsur
Tujuan pembentukan ikatan kimia adalah agar terjadi pencapaian kestabilan suatu unsur.
Salah 1 petunjuk dalam pembentukan ikatan kimia adalah adanya 1 golongan unsur yang stabil yaitu golongan VIIIA atau golongan 18 (gas mulia).
Maka dari itu, dalam pembentukan ikatan kimia; atom-atom akan membentuk konfigurasi elektron seperti pada unsur gas mulia.
Unsur gas mulia mempunyai elektron valensi sebanyak 8 (oktet) atau 2 (duplet, yaitu atom Helium).
Periode Unsur Nomor Atom K L M N O P
1 He 2 2
2 Ne 10 2 8
3 Ar 18 2 8 8
4 Kr 36 2 8 18 8
5 Xe 54 2 8 18 18 8
6 Rn 86 2 8 18 32 18 8
Kossel dan lewis memperkenalkan cara unsur-unsur mencapai kestabilan seperti gas mulia dengan mengikuti aturan duplet dan oktet.
1. Aturan duplet
Adalah keadaan dimana unsur-unsur lain membentuk kestabilan seperti 2He =2
(duplet) diantaranya H, Li dan Be. Kecenderunga ini bisa didapat dengan melepaskan elektron atau dengan mengikat elektron.
Unsur Konfigurasi elektron
Elektron Valensi
Melepas Menerima
2He 2 2 -
-3Li 2 1 1 1
-4Be 2 2 2 2
-Jadi, Li dan Be masing-masing melepaskan elektron dikulit terluarnya agar mempunyai konfigurasi elektron seperti 2He.
2. Aturan oktet
Merupakan kecenderungan unsur-unsur menjadikan konfigurasi elektronnya
mengikuti gas mulia dengan cara melepas elektron valensinya atu menyerap elektron tambahan.
Untuk atom yang mempunyai elektron valensi kecil (1,2,3) cenderung melepaskan elektron untuk membentuk konfigurasi elektron gas mulia.
11Na = 2 8 1 melepas 1 elektron menyerupai Neon (Ne = 2 8) 10Ne = 2 8
17Cl = 2 8 7 menyerap 1 elektron menyerupai Argon 18Ar = 2 8 8
b. Striktur Lewis
Adalah struktur atom yang dilengkapi dengan elektron valensinya. Elektron valensi digambarkan dengan titik-titik atau lingkran-lingkaran kecil.
Berdasarkan jenis unsur pembentukan dan cara berikatan, ikatan kimia dibedakanmenjadi 3 yaitu:
1. Ikatan ion 2. Ikatan kovalen 3. Ikatan logam
1). Ikatan Ion (elektrovalen)
ikatan ian terjadi apabila
Ion positif den ion negative saling tarik menarik dengan gaya elektrostatis
Di bentuk oleh atom-atom logam (melepas electron) dan non logam (menerima electron )
Contoh 1 :
Ikatan antara 11
Na
dengan 17Cl
Konfigurasi elektronnya :
11
Na
= 2, 8, 117
Cl
= 2, 8, 7 Atom Cl menerima 1 elektron pada kulit terluarnya sehingga konfigurasi elektronnya sama dengan gas mulia.
Na
→
Na
++
e
(2,8,1) (2,8)
Cl
+
e
→
Cl
−(2,8,7) (2,8,8)
¿ ∗¿
¿ ∗¿¿
¿
¿ Cl ¿ ¿
¿
−
¿
( Na+ ) ⋯
¿ ¿
Antara ion Na+ dengan Cl− terjadi gaya tarik-menarik elektrostatis sehingga terbentuk
senyawa ion NaCl.
Senyawa yang mempunyai ikatan ion antara lain :
a) Golongan alkali (IA) [kecuali atom H] dengan golongan halogen (VIIA) Contoh : NaF, KI, CsF
b) Golongan alkali (IA) [kecuali atom H] dengan golongan oksigen (VIA) Contoh : Na2S, Rb2S,Na2O
c) Golongan alkali tanah (IIA) dengan golongan oksigen (VIA) Contoh : CaO, BaO, MgS
Sifat umum senyawa ionik :
1) Titik didih dan titik lelehnya tinggi. 2) Keras, tetapi mudah patah.
3) Penghantar panas yang baik.
4) Lelehan maupun larutannya dapat menghantarkan listrik (elektrolit). 5) Larut dalam air.
6) Tidak larut dalam pelarut/senyawa organik (misal : alkohol, eter, benzena).
o Adalah ikatan yang terjadi karena pemakaian pasangan elektron secara bersama oleh 2 atom yang berikatan.
o Ikatan kovalen terjadi akibat ketidakmampuan salah 1 atom yang akan berikatan untuk melepaskan elektron (terjadi pada atom-atom non logam).
o Ikatan kovalen terbentuk dari atom-atom unsur yang memiliki afinitas elektron tinggi serta beda keelektronegatifannya lebih kecil dibandingkan ikatan ion.
o Atom non logam cenderung untuk menerima elektron sehingga jika tiap-tiap atom non logam berikatan maka ikatan yang terbentuk dapat dilakukan dengan cara mempersekutukan elektronnya dan akhirnya terbentuk pasangan elektron yang dipakai secara bersama.
o Pembentukan ikatan kovalen dengan cara pemakaian bersama pasangan elektron tersebut harus sesuai dengan konfigurasi elektron pada unsur gas mulia yaitu 8 elektron (kecuali He berjumlah 2 elektron).
Ada 3 jenis ikatan kovalen :
a). Ikatan Kovalen Tunggal. Contoh 1 :
Ikatan yang terjadi antara atom H dengan atom H membentuk molekul H2
Konfigurasi elektronnya :
1H = 1
Ke-2 atom H yang berikatan memerlukan 1 elektron tambahan agar diperoleh konfigurasi elektron yang stabil (sesuai dengan konfigurasi elektron He).
Untuk itu, ke-2 atom H saling meminjamkan 1 elektronnya sehingga terdapat sepasang elektron yang dipakai bersama.
H
∗ +⋅
H
→
H
¿¿H
Rumus struktur = H-H Rumus kimia = H2Contoh 2 :
Ikatan yang terjadi antara atom H dengan atom F membentuk molekul HF
Konfigurasi elektronnya :
1H = 1
Atom H memiliki 1 elektron valensi sedangkan atom F memiliki 7 elektron valensi.
Agar atom H dan F memiliki konfigurasi elektron yang stabil, maka atom H dan atom F masing-masing memerlukan 1 elektron tambahan (sesuai dengan konfigurasi elektron He dan Ne).
Jadi, atom H dan F masing-masing meminjamkan 1 elektronnya untuk dipakai
Rumus struktur = H-F Rumus kimia = HF
b). Ikatan Kovalen Rangkap Dua. Contoh :
Ikatan yang terjadi antara atom O dengan O membentuk molekul O2
Konfigurasi elektronnya :
8
O
= 2, 6 Atom O memiliki 6 elektron valensi, maka agar diperoleh konfigurasi elektron yang stabil tiap-tiap atom O memerlukan tambahan elektron sebanyak 2.
Ke-2 atom O saling meminjamkan 2 elektronnya, sehingga ke-2 atom O tersebut akan menggunakan 2 pasang elektron secara bersama.
¿⋅¿ + ¿
Rumus struktur : O=O Rumus kimia : O2
c). Ikatan Kovalen Rangkap Tiga. Contoh 1:
o Ikatan yang terjadi antara atom N dengan N membentuk molekul N2
o Konfigurasi elektronnya :
o Atom N memiliki 5 elektron valensi, maka agar diperoleh konfigurasi elektron yang stabil tiap-tiap atom N memerlukan tambahan elektron sebanyak 3.
o Ke-2 atom N saling meminjamkan 3 elektronnya, sehingga ke-2 atom N tersebut akan menggunakan 3 pasang elektron secara bersama.
N
N
Rumus struktur : N≡N Rumus kimia : N2
Perbedaan antara Senyawa Ion dengan Senyawa Kovalen
No Sifat Senyawa Ion Senyawa Kovalen
1 Titik didih Tinggi Rendah
2 Titik leleh Tinggi Rendah
3 Wujud Padat pada suhu kamar Padat,cair,gas pada suhu kamar 4 Daya hantar listrik Padat = isolator
Lelehan = konduktor Larutan = konduktor
Padat = isolator Lelehan = isolator
Larutan = ada yang konduktor 5 Kelarutan dalam air Umumnya larut Umumnya tidak larut
6 Kelarutan dalam trikloroetana (CHCl3)
Tidak larut Larut
1. Penilaian
INTRUMEN PENILAIAN SIKAP Nama Satuan pendidikan : SMA Az-Zahra
Tahun pelajaran : 2017/2018 Kelas/Semester : X / Semester I Mata Pelajaran : Kimia
N
N
O WAKTU NAMA KEJADIAN/PERILAKU BUTIR SIKAP POS/NEG TINDAK LANJUT 7
8 9 10 11 12 13 14 15 16
Palembang, 21 Oktober 2017 Mengetahui
Guru pamong SMA Az-Zahra Mahasiswa PPL
Penilaian Pengetahuan
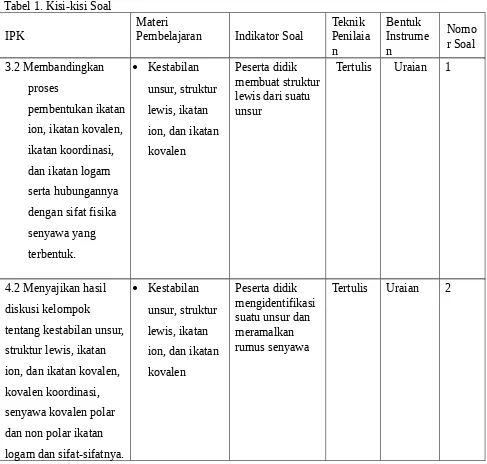
Tabel 1. Kisi-kisi Soal
IPK
Materi
Pembelajaran Indikator Soal
Teknik 3.2 Membandingkan
proses
pembentukan ikatan ion, ikatan kovalen, ikatan koordinasi, dan ikatan logam serta hubungannya dengan sifat fisika senyawa yang terbentuk.
Kestabilan unsur, struktur lewis, ikatan ion, dan ikatan kovalen
Peserta didik membuat struktur lewis dari suatu unsur
Tertulis Uraian 1
4.2 Menyajikan hasil diskusi kelompok tentang kestabilan unsur, struktur lewis, ikatan ion, dan ikatan kovalen, kovalen koordinasi, senyawa kovalen polar dan non polar ikatan logam dan sifat-sifatnya.
Kestabilan unsur, struktur lewis, ikatan ion, dan ikatan kovalen
Peserta didik mengidentifikasi suatu unsur dan meramalkan rumus senyawa
INSTRUMEN TES TERTULIS Satuan Pendidikan : SMA Az-Zahra
Mata Pelajaran : Kimia
Kelas : X
Kompetensi dasar : Sifat Periodik Unsur
Soal :
1. Tuliskan struktur lewis untuk unsur-unsur dibawah ini: a. 19K
b. 20Ca
c. 13Al
2. Ramalkanlah rumus senyawa ion dari pasangan berikut! a. Mg dengan Cl
Tabel 3. Pedoman Penskoran
No .
Jawaban Skor
1. a. K b. Ca c. Al
1 1 1
2 a. MgBr2
b. Na2O
c. Ba d. O
1 1 1
Skor Akhir Predikat
3,01-4,0 A = Sangat Baik 2,01-3,0 B = Baik
1,01-2,0 C = Cukup 0-1,0 D = Kurang Nilai Akhir = (Jumlah skor) x 4