REAKSI SUBSTITUSI REAKSI SUBSTITUSI
Reaksi
Reaksi Substitusi Substitusi Nukleofilik Nukleofilik
Reaksi substitusi nukleofilik terdiri dari tiga jenis reaksi yaitu reaksi substitusi Reaksi substitusi nukleofilik terdiri dari tiga jenis reaksi yaitu reaksi substitusi nukleoflik unimolekuler (S
nukleoflik unimolekuler (S N N1), reaksi substitusi nukleofilik bimolekuler (S1), reaksi substitusi nukleofilik bimolekuler (S N N2), serta reaksi2), serta reaksi substitusi nukleofilik internal (S
substitusi nukleofilik internal (S N Ni). Dalam praktikum ini, reaksi substitusi nukleofilik yangi). Dalam praktikum ini, reaksi substitusi nukleofilik yang dilakukan adalah reaksi substitusi nukleofilik unimolekuler (S
dilakukan adalah reaksi substitusi nukleofilik unimolekuler (S N N1). Reaksi S1). Reaksi S N N1 teramati dari1 teramati dari pelarut yang digunakan yaitu pelarut polar (
pelarut yang digunakan yaitu pelarut polar (HCl). Selain digunakan sebagai pelarut, HCl jugaHCl). Selain digunakan sebagai pelarut, HCl juga digunakan sebagai nukleofil (Nu
digunakan sebagai nukleofil (Nu--) atau reagen dalam reaksi substitusi nukleofilik ini.) atau reagen dalam reaksi substitusi nukleofilik ini.
Tahap pertama yang dilakukan dalam praktikum reaksi substitusi nukleofilik ini Tahap pertama yang dilakukan dalam praktikum reaksi substitusi nukleofilik ini adalah pendinginan larutan HCl pekat yang bertujuan untuk mempertahankan larutan HCl adalah pendinginan larutan HCl pekat yang bertujuan untuk mempertahankan larutan HCl pekat
pekat tetap tetap berada berada pada pada fase fase cair. cair. Pentingnya Pentingnya larutan larutan HCl HCl pekat pekat dalam dalam fase fase cair cair karenakarena apabila tidak didinginkan, maka larutan HCl akan berubah fase menjadi gas (menguap). apabila tidak didinginkan, maka larutan HCl akan berubah fase menjadi gas (menguap). Menguapnya HCl dapat mengakibatkan berkurangnya jumlah HCl yang nantinya akan Menguapnya HCl dapat mengakibatkan berkurangnya jumlah HCl yang nantinya akan digunakan sebagai pelarut dan reaktan (Nukleofil), sehingga berdampak pada sedikitnya hasil digunakan sebagai pelarut dan reaktan (Nukleofil), sehingga berdampak pada sedikitnya hasil reaksi yang akan terbentuk.
reaksi yang akan terbentuk.
Hal lainnya yang menandakan bahwa reaksi substitusi nukleofilik yang terjadi adalah Hal lainnya yang menandakan bahwa reaksi substitusi nukleofilik yang terjadi adalah reaksi S
reaksi S N N1 adalah adalah substrat yang digunakan (t-butil alkohol) memiliki rintangan sterik 1 adalah adalah substrat yang digunakan (t-butil alkohol) memiliki rintangan sterik yang besar (atom C yang mengikat
yang besar (atom C yang mengikat – – OH OH merupakan merupakan atom atom C C tersier). tersier). Dengan Dengan besarnyabesarnya rintangan sterik, maka reaksi S
rintangan sterik, maka reaksi S N N1 ini memerlukan waktu yang lama, sehingga diperlukan cara1 ini memerlukan waktu yang lama, sehingga diperlukan cara untuk dapat mempercepat reaksi S
untuk dapat mempercepat reaksi S N N1 ini. Cara untuk mempercepat reaksi S1 ini. Cara untuk mempercepat reaksi S N N1 dalam1 dalam praktikum
praktikum ini ini adalah adalah menambahkan menambahkan substrat substrat (t-butil (t-butil alkohol) alkohol) secara secara perlahan-lahan perlahan-lahan (tetes(tetes demi tetes) ke dalam larutan HCl pekat, sambil dibantu dengan pengocokan secara rutin. demi tetes) ke dalam larutan HCl pekat, sambil dibantu dengan pengocokan secara rutin. Pada saat pengocokan dengan menggunakan corong pisah ini, sesekali keran corong dibuka Pada saat pengocokan dengan menggunakan corong pisah ini, sesekali keran corong dibuka untuk menghindari tekanan yang terlau tinggi di dalam corong karena terbentuknya gas HCl untuk menghindari tekanan yang terlau tinggi di dalam corong karena terbentuknya gas HCl berlebih.
berlebih.
Setelah semua t-butil alkohol ditambahkan, kemudian campuran didiamkan beberapa Setelah semua t-butil alkohol ditambahkan, kemudian campuran didiamkan beberapa saat (dalam praktikum ini selama 7 hari), sehingga terbentuk 2 lapisan pada corong pisah. saat (dalam praktikum ini selama 7 hari), sehingga terbentuk 2 lapisan pada corong pisah. Lapisan yang terbentuk ini pada bagian atas adalah lapisan t-butil klorida (berat jenis 0,78 g Lapisan yang terbentuk ini pada bagian atas adalah lapisan t-butil klorida (berat jenis 0,78 g cm
cm-3-3) , sedangkan pada bagian bawah adalah HCl (berat jenis 1,19 g cm) , sedangkan pada bagian bawah adalah HCl (berat jenis 1,19 g cm-3-3). Mekanisme reaksi). Mekanisme reaksi S
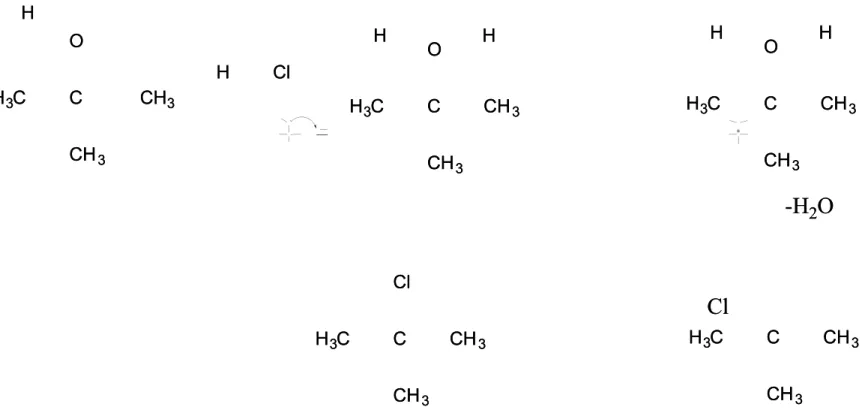
C C O O H H33C C CHCH33 CH CH33 H H C C O O H H33CC CH CH33 CH CH33 H H H H Cl Cl C C O O H H33CC CH CH33 CH CH33 H H H H -H -H22OO C C H H33CC CH CH33 CH CH33 Cl Cl C C H H33CC CH CH33 CH CH33 Cl Cl H H
Gambar 5.1 Mekanisme Reaksi S
Gambar 5.1 Mekanisme Reaksi S N N1 dari t-butil alkohol menjadi t-butil klorida1 dari t-butil alkohol menjadi t-butil klorida
Dari kedua lapisan yang terpisah tadi, lapisan yang digunakan adalah lapisan t-butil Dari kedua lapisan yang terpisah tadi, lapisan yang digunakan adalah lapisan t-butil klorida (lapisan atas), sehingga lapisan bawah (HCl) dipisahkan. Larutan t-butil klorida klorida (lapisan atas), sehingga lapisan bawah (HCl) dipisahkan. Larutan t-butil klorida kemudian dicuci dengan menggunakan air yang bertujuan menghilangkan sisa-sisa HCl yang kemudian dicuci dengan menggunakan air yang bertujuan menghilangkan sisa-sisa HCl yang kemungkinan masih ada pada lapisan t-butil klorida tadi. Setelah dicuci, larutan kembali kemungkinan masih ada pada lapisan t-butil klorida tadi. Setelah dicuci, larutan kembali dibiarkan terpisah menjadi dua lapisan, dimana lapisan bawah adalah lapisan air dengan dibiarkan terpisah menjadi dua lapisan, dimana lapisan bawah adalah lapisan air dengan kontaminan HCl, dan lapisan atas adalah lapisan t-butil klorida. Lapisan yang digunakan kontaminan HCl, dan lapisan atas adalah lapisan t-butil klorida. Lapisan yang digunakan adalah lapisan atas, namun perlu dibersihkan kembali karena kemungkinan masih ada HCl adalah lapisan atas, namun perlu dibersihkan kembali karena kemungkinan masih ada HCl yang tersisa d
yang tersisa dengan menggengan menggunakan larutan unakan larutan natrium natrium bikarbonat. Reakbikarbonat. Reaksi yang si yang terjadi adalahterjadi adalah sebagai berikut.
sebagai berikut.
NaHCO
NaHCO3(aq)3(aq)+ HCl(aq)+ HCl(aq)→ NaCl→ NaCl(aq)(aq)+ H+ H22OO(aq)(aq)+ CO+ CO2(g)2(g) Terbentuknya gas CO
Terbentuknya gas CO22 ditandai dengan adanya gelembung-gelembung pada larutan yangditandai dengan adanya gelembung-gelembung pada larutan yang dicampur dengan Natrium Bikarbonat tadi.
dicampur dengan Natrium Bikarbonat tadi.
Untuk memperoleh t-butil klorida yang murni (bebas dari kontaminan), maka langkah Untuk memperoleh t-butil klorida yang murni (bebas dari kontaminan), maka langkah berikutnya
berikutnya yang yang dilakaukan dilakaukan adalah adalah dengan dengan menambahkan menambahkan zat zat anhidrat anhidrat ke ke dalam dalam lapisan lapisan t- t- butil
butil klorida. klorida. Penambahan Penambahan zat zat anhidrat anhidrat bertujuan bertujuan untuk untuk menghilangkan/mengmenghilangkan/mengikat ikat air air yangyang masih ada di dalam
masih ada di dalam lapisan t-butil klorida. Zat anhidrat lapisan t-butil klorida. Zat anhidrat yang digunakan adalah tembaga sulfatyang digunakan adalah tembaga sulfat (CuSO
(CuSO44), karena CuSO), karena CuSO44 dapat dengan jelas dilihat apabila sudah mengikat air yang ada padadapat dengan jelas dilihat apabila sudah mengikat air yang ada pada t-butil klorida. Perubahan yang terjadi ketika semua air telah diikat oleh CuSO
t-butil klorida. Perubahan yang terjadi ketika semua air telah diikat oleh CuSO44 adalah ketikaadalah ketika CuSO
CuSO44tidak berubah warna menjadi biru lagi ketika dimasukkan ke dalam t-butil klorida.tidak berubah warna menjadi biru lagi ketika dimasukkan ke dalam t-butil klorida. Untuk menguji kemurnian dari t-butil klorida yang terbentuk, maka t-butil klorida Untuk menguji kemurnian dari t-butil klorida yang terbentuk, maka t-butil klorida harus didistilasi pada suhu antara 49
ini adalah 500C, dimana pada suhu tersebut, t-butil klorida yang dihasilkan sudah benar-benar murni dan larutan yang ada pada labu dasar bulat sudah tidak menguap lagi. Warna larutan t- butil klorida murni yang terbentuk adalah tidak berwarna (bening).
Volume t-butil klorida yang terbentuk pada praktikum ini adalah sebanyak 2,3 mL. Secara teoritis, volume t-butil klorida yang harusnya terbentuk adalah sebanyak 5 mL. tidak terbentuknya t-butil klorida sebanyak 5 mL kemungkinan disebabkan oleh beberapa hal yaitu sebagai berikut.
1. Pendinginan HCl yang kurang sempurna pada awal praktikum, sehingga HCl yang bereaksi dengan t-butil alkohol berjumlah sedikit. Hal ini berdampak pada jumlah produk yang sidikit pula.
2. Pengocokan yang tidak optimal mengakibatkan reaksi yang terjadi tidak berjalan dengan optimal.
3. Pemisahan yang kurang akurat karena kelalaian dari praktikan, sehingga kemungkinan beberapa t-butil klorida ikut dengan lapisan HCl yang dipisahkan.
4. t-butil klorida yang terbentuk sebagian telah menguap ke lingkungan, karena titik didih t-butil klorida yang rendah (510C).
Dari banyaknya t-butil klorida yang terbentuk, maka rendemennya adalah sebagai berikut.
Rendemen = 100% teoritis klorida butil -t volume diperoleh yang klorida butil -t volume x = 100% 0 , 5 3 , 2 x mL mL Rendemen = 46 %
Cara berikutnya untuk menguji kemurnian dari t-butil klorida yang terbentuk, adalah dengan menguji indeks biasnya menggunakan refraktometer. Indeks bias dari t-butil klorida yang terbentuk adalah sebesar 1,3828. Secara teoritis, indeks bias dari t-butil klorida adalah sebesar 1,3860. Jika dibandingkan dengan nilai indeks bias t-butil klorida yang dihasilkan pada praktikum ini, maka t-butil klorida yang dihasilkan adalah t-butil klorida yang sudah
V.2 Reaksi Substitusi Elektrofilik
Pada praktikum ini, reaksi substitusi elektrofilik yang dilakukan adalah nitrasi pada senyawa aromatik. Gugus elektrofil NO2+ pada reaksi ini dibuat dengan mencampurkan asam nitrat pekat dengan asam sulfat pekat. Campuran ini harus t etap dijaga berada dalam fase cair, dengan cara pendinginan dengan air es. Berubahnya fase campuran dari cair menadi gas dapat menyebabkan gugus elektrofil NO2+ berkurang, sehingga pada akhirnya dapat mengurangi jumlah produk yang dihasilkan.
Nitrasi senyawa aromatik yang dilakukan pada praktikum ini adalah menggunakan senyawa aromatik berupa bromobenzena. Bromobenzena yang yang ditambahkan ke dalam gugus elektrofil adalah 0,025 mol. Pembuatan 0,025 mol bromobenzena adalah sebagai berikut.
Massa bromobenzena yang digunakan = 0,025molx157g/mol3,925g Volume bromobenzena yang digunakan = 2,63 mL
g/mL 1,49
g 3,925
dengan demikian, bromobenzena yang digunakan adalah sebanyak 2,63 mL.
Penambahan bromobenzena ke dalam gugus elektrofil dilakukan sedikit demi sedikit agar bromobenzena benar-benar tercampur dengan gugus elektrofil. Agar campuran homogen juga dilakukan dengan bantuan pengocokan. Selama penambahan bromobenzena ini, suhu campuran dijaga pada 50 – 550C dengan tujuan agar reaksi dapat berlangsung sempurna. Mekanisme reaksi yang terjadi pada pembentukan nitro bromobenzena dari bromobenzena adalah sebagai berikut.
1. Pembentukan elektrofil (E+) H2SO4 + H N O O O H O O O N H + HSO4 -H O O O N H NO2+ + H2O
2. Serangan Elektrofil (E+) + NO2+ Br NO2 H Or Br H NO2 Br 3. Pelepasan H+ + HSO4 -Br NO2 H Br NO2 Br H NO2 + HSO4 -Br NO2 dan
Setelah adisi berlangsung sempurna, kemudian campuran dibiarkan pada suhu dibawah 500C selama ± 30 menit. Kemudian, campuran didinginkan kembali dalam suhu kamar, lalu dicuci dengan air dingin, disaring, dan dikeringkan. Tujuan dari pendinginan ini adalah agar Kristal yang terbentuk lebih cepat dan lebih baik, sehingga terbentuk kristal nitrobromobenzena. Kristal nitrobromobenzena yang terbentuk pada praktikum ini adalah sebanyak 4,732 gram.
Kristal nitrobromobenzena yang terbentuk ini kemudian kembali dilarutkan menggunakan etanol 95% panas sampai semua kristal larut. Setelah larutan dibiarkan dingin, terbentuklah kristal 4-bromonitrobenzena. Kristal 4-bromonitrobenzena ini kemudian disaring, dan filtratnya ditampung sebagai induk cairan 1. Kristal 4-bromonitrobenzena yang disaring ini kemudian dicuci ,menggunakan alkohol dingin, dengan tujuan menghilangkan kandungan air yang masih berada pada kristal. Filtrat dalam campuran ini kembali ditampung sebagai induk cairan 2.
Induk cairan 1 dan 2 kemudian dicampur lalu diuapkan dalam penangas air sampai volumenya menjadi 1/3 nya. Sisa dari penguapan ini kemudian didinginkan sehingga kembali tebentuk Kristal 4-bromonitrobenzena. Kristal 4-bromonitrobenzena ini kemudian dicuci dengan alkohol dingin agar kandungan airnya hilang. Kristal 4-bromonitrobenzena ini dicampur dengan Kristal 4-bromonitrobenzena sebelumnya dan diperoleh beratntnya adalah sebanyak 4,2322 gram. Secara teoritis, berat kristal yang terbentuk adalah seberat 5,075 gram, dengan perhitungan sebagai berikut:
Mol nitrobromobenzena = mol bromobenzena = 0,025 mol
Massa nitrobromobenzena yang terbentuk = 0,025 mol x 203 g/mol = 5,075 gram Rendemen dari Kristal 4-bromonitrobenzena pada praktikum ini adalah:
Rendemen = 100% ritis benzen teo nitrobromo -4 kristal berat diperoleh yang benzen nitrobromo -4 kristal berat x = 100% 87,33% g 075 , 5 g 4322 , 4 x
Untuk menguji kemurnian dari kristal 4-bromonitrobenzena pada praktikum ini, dilakukan pengujian terhadap titik leleh kristal 4-bromonitrobenzena. Titik leleh dari Kristal 4-bromonitrobenzena adalah sebesar 125oC. Titik leleh dari Kristal 4-bromonitrobenzena ini tidak terlalu berbeda jauh dengan titik leleh p-nitrobromobenzena secara teoritis yaitu sebesar 127oC. Hal ini menunjukkan bahwa kristal yang didapat adalah kristal 4-nitrobromobenzena yang cukup murni.
REAKSI OKSIDASI-REDUKSI
Reaksi oksidasi adalah reaksi yang digunakan untuk membedakan antara alkohol primer, sekunder, dan tersier. Suatu alkohol primer dapat dioksidasi menjadi aldehid atau asam karboksilat. Alkohol sekunder dapat dioksidasi menjadi keton saja. Sedangkan pada alkohol tersier menolak terjadinya reaksi oksidasi (Fessenden, 1997). Oksidasi terhadap alkohol menggunakan bahan pengoskidasi (oksidator) kuat, yang dalam praktikum ini digunakan kalium dikromat (K 2Cr 2O7) dengan bilangan oksidasi Cr adalah +6, dengan warna
larutan orange. Untuk menstabilkan kalium dikromat yang digunakan sebagai oksidator dalam praktikum ini, maka terlebih dahulu larutan kalium dikromat diasamkan dengan menggunakan asam sulfat (H2SO4) pekat. Hal ini dilakukan karena kalium dikromat
natrium atau kalium dikromat dalam suasana asam merupakan oksidator yang kuat. Reaksi yang terjadi antara kalium dikromat (K 2Cr 2O7) dan H2SO4adalah sebagai berikut.
K 2Cr 2O7+ H2SO4→ K 2SO4+ H2Cr 2O7
Pada praktikum ini, alkohol yang akan dioksidasi adalah sikloheksanol (C6H11OH).
Sikloheksanol merupakan alkohol sekunder (20) yang dapat dioksidasi menjadi keton (sikloheksanon). Pada praktium ini, sikloheksanol dioksidasi oleh kalium dikromat menjadi sikloheksanon. Reaksi oksidasi sikloheksanol menjadi sikloheksanon adalah sebagai berikut.
OH
Na2Cr 2O7 + H2SO4
O
+ H2O
Mekanisme reaksi oksidasi sikloheksanol menjadi sikloheksanon adalah sebagai berikut.
O H H :O O + H2O
Untuk mengoptimalkan hasil reaksi, maka suhu dijaga tetap pada suhu 550C. Pada pencampuran sikloheksanol dengan larutan kalium dikromat dalam suasana asam, larutan berubah warna dari berwarna orange menjadi berwarna hijau. Warna hijau yang terbentuk ini disebabkan oleh ion Cr 6+ pada K 2Cr 2O7 yang mengalami reduksi menjadi Cr 3+ yang berwarna
hijau. Reaksi reduksi ion Cr 6+ pada K 2Cr 2O7 menadi ion Cr 3+ adalah sebagai berikut.
Cr 2O72-(aq)+ 14H++ 6e → 2Cr 3+(aq)+ 7H2O(l)
(orange) (hijau)
Untuk mereduksi kelebihan dikromat pada reaksi, ditambahkan larutan oksalat ke dalam campuran. Kemudian, campuran dicuci dengan menggunakan air sehingga terbentuk dua lapisan dimana lapisan atas adalah sikloheksanon yang belum murni dengan berat jenis 0,95 dan lapisan bawah adalah air dengan berat jenis 1,0. Setelah dicuci dengan menggunakan air, kemudian lapisan atas yang berisi sikloheksanon ditampung dan diekstraksi sebanyak 3 kali dengan menggunakan eter.
Ekstraksi bertingkat (berkali-kali) bertujuan untuk memperoleh ekstrak sikloheksanon yang lebih banyak. Sedangkan, tujuan penggunaan eter sebagai bahan pengekstrak
sikloheksanon adalah karena eter merupakan pelarut organic yang dapat melarutkan bahan organic seperti sikloheksanon, sehingga terbentuk dua lapisan dimana lapisan atas adalah sikloheksanon yang terlarut dalam eter (bening dengan sedikit pengotor) dengan berat jenis 0,71 dan lapisan bawah adalah air dengan berat jenis 1,0.
Untuk menghilangkan pengotor yang ada pada sikloheksanon yang terlarut dalam eter, larutan dicuci dengan larutan natrium bikarbonat. Pada penambahan larutan natrium bikarbonat, kembali terbentuk dua lapisan, dimana lapisan atas adalah sikloheksanon yang larut dalam eter, dan lapisan bawah adalah larutan natrium bikarbonat. Lapisan yang digunakan untuk langkah selanjutnya adalah lapisan atas, dimana lapisan atas adalah larutan bening yang sudah bersih tanpa pengotor.
Untuk menghilangkan kadar air yang masih terkandung di dalam sikloheksanon, maka air diserap menggunakan zat anhidrat yaitu CuSO4. Penggunaan CuSO4 sebagai
penyerap air dikarenakan CuSO4 yang berwarna putih bila menyerap air akan berubah warna
menjadi biru. Setelah air dalam larutan habis, maka CuSO4 tidak mengalami perubahan
warna menjadi biru lagi (tetap putih). Dengan kata lain, penggunaan CuSO4sebagai penyerap
air dikarenakan kemudahan dalam mengamati telah habisnya air, yang ditandai dengan tidak berubahnya warna CuSO4 saat dimasukkan ke dalam larutan sikloheksanon dalam eter.
Setelah kandungan air sudah habis, untuk menghilangkan pelarut (eter) yang digunakan dilakukan proses destilasi. Destilasi adalah teknik pemisahan campuran yang didasarkan atas perbedaan titik didih antara dua buah zat yang bercampur tersebut. Titik didih eter adalah berkisar antara 34-350C, sehingga eter dapat dipisahkan pada suhu tersebut. Sedangkan, titik didih sikloheksanon adalah berkisar antara 152-1550C, sehingga sikloheksanon murni akan diperoleh pada suhu tersebut. Dalam destilasi, destilat pertama kali menetes pada suhu 340C, yang menandakan bahwa destilat tersebut adalah eter, karena titik didih eter adalah 340C. kemudian, destilat pada suhu 340 ini ditampung, sampai sisa larutan pada labu dasar bulat tinggal tersisa beberapa mL lagi. Suhu kemudian naik secara perlahan, sampai pada suhu 1610C, terdapat tetesan destilat pada penampung, yang menandakan bahwa destilat tersebut adalah sikloheksanon. Destilat yang dihasilkan ini ditampung dan diukur volumenya. Volume sikloheksason yang diperoleh adalah 4,6 mL. Berdasarkan data ini, maka rendemen dapat dihitung dengan :
Sikloheksanol (ῥ = 0,94 g/mL) :
- Massa sikloheksanol = vol. Sikloheksanol x
= 6,926 mL x 0,94 g/mL = 6,5104 g - Mol sikloseksanol = Mr nol sikloheksa massa = g/mol 100,16 g 5104 , 6 = 0,065 mol
Reaksi yang terjadi:
C6H11OH + Cr 2O72-→ C6H11O + Cr 3+ + H2O
Berdasarkan reaksi di atas, mol sikloheksanon = mol sikloheksanol = 0,065 mol Sikloheksanon :
- Massa sikloheksanon secara teoriris = mol sikloheksanon x Mr = 0,065 mol x 99 g/mol = 6,435 g
- Volume sikloheksanol (0,95 g/mL) yang dihasilkan adalah 4,6 mL - Massa sikloheksanon = volume sikloheksanon x
= mL x 0,95 g/mL = 4,37 g
- Rendemen hasil praktikum = 100%
teoritis secara non sikloheksa massa diperoleh yang non sikloheksa massa = 100% g 6,435 g 370 , 4 = 67,91%
Untuk memastikan kemurnian sikloheksanon yang dihasilkan pada praktikum ini, maka dilakukan uji indeks bias. Indeks bias sikloheksanon pada praktikum ini adalah 1,4500, sedangkan indeks bias sikloheksanon teoritis adalah 1,4507. Tingginya indeks bias
sikloheksanon yang terukur disebabkan karena suhu kamar saat praktikum lebih dari 250C. Suhu mempengaruhi indeks bias dari suati zat semakin tinggi suhu maka indeks biasnya semakin besar pula. Hal ini disebabkan pada suhu yang besar jarak antara molekul semakin meregang. Tekanan juga mempengaruhi indeks bias semakin rendah tekanan maka indeks bias semakin meningkat. Dari data tersebut di atas, maka dapat disimpulkan bahwa
sikloheksanon yang dihasilkan pada praktikum ini adalah murni.
REAKSI ELIMINASI
Alkohol sekunder (20) dapat dieliminasi menghasilkan senyawa alkena dengan cara melepaskan molekul air yang ada pada alkohol sekunder tersebut. Reaksi eliminasi dengan melepaskan molekul air ini juga sering disebut reaksi dehidrasi. Reaksi eliminasi merupakan kebalikan dari reaksi adisi. Pada reaksi eliminasi ini, molekul senyawa yang berikatan tunggal (ikatan jenuh) berubah menjadi senyawa berikatan rangkap (ikatan tak jenuh) dengan melepaskan molekul yang kecil. Eliminasi alkohol sekunder akan
menghasilkan senyawa alkena dengan melepaskan molekul air.
Pada praktikum ini, substrat yang digunakan adalah sikloheksanol (C6H11OH). Sikloheksanol merupakan alkohol sekunder, yaitu alkohol dimana gugus – OH terikat pada atom C sekunder (atom C yang mengikat dua gugus alkil). Sikloheksanol yang digunakan pada praktikum ini yaitu sebanyak 10 gram atau 10,6 mL, karena masa jenis () dari
sikloheksanol adalah 0,94 g/mL. Sedangkan, zat yang digunakan untuk mengeliminasi sikloheksanol adalah asam fosfat. Asam fosfat terdiri dari ion H+ dan ion fosfat. Ion fosfat merupakan basa lewis yang kuat.
Dalam reaksi eliminasi ini, asam fosfat berperan sebagai katalis (pemercepat reaksi), dan juga bertujuan agar reaksi yang berlangsung adalah dominan reaksi eliminasi. Hal ini dikarenakan untuk alkohol sekunder, reaksi eliminasi bersaing dengan reaksi substitusi (S N2) sehingga akan dihasilkan produk yang berbeda. Reaksi eliminasi akan berlangsung dominan dibandingkan dengan substitusi jika basa lewis yang digunakan adalah basa lewis yang kuat dan suhu reaksi berlangsung tinggi. Oleh karena itu, pada reaksi eliminasi ini digunakan asam fosfat sebagai zat pengeliminir dan campuran dipanaskan pada labu didih. Selain bertujuan agar reaksi yang terjadi adalah reaksi eliminasi, pemanasan campuran sikloheksanol dengan asam fosfat juga bertujuan mempercepat dan menyempurnakan reaksi.
Reaksi eliminasi sikloheksena merupakan reaksi eliminasi bimolekuler (E2). Reaksi
dan pengusiran gugus pergi yaitu ion OH- dari karbon α serta pembentukan ikatan rangkap secara stimultan. Laju reaksi ini dipengaruhi oleh jenis substrat dan kekuatan basa yang digunakan. Sikloheksanol memiliki dua buah karbon pada posisi β. Penyerangan ion fosfat dapat terjadi pada kedua karbon tersebut, sehingga terjadi dua kemungkinan mekanisme reaksi yang terjadi. Mekanisme reaksi tersebut dapat digambarkan sebagai berikut.
Mekanisme I : sikloheksanol sikloheksena H H Mekanisme II : H OH B -H H sikloheksanol sikloheksena H + H2O + HB H
dimana HB adalah katalis yang lepas kembali berupa asam fosf at.
Kedua mekanisme di atas menggambarkan bahwa ion basa lewis menyerang atom H yang terletak pada karbon-β dan pada posisi berlawanan dengan gugus yang akan menjadi gugus pergi (-OH). Hal ini terjadi sesuai dengan prinsip reaksi eliminasi yaitu prinsip anti-koplanar. Prinsip anti-koplanar menyatakan bahwa atom H yang diserang adalah atom H yang terletak pada satu bidang dengan x (-OH) dan jarak yang terjauh. Tujuannya yaitu untuk menghasilkan sikloheksena dalam posisi trans. Posisi trans lebih stabil dibandingkan dengan posisi cis.
Dalam praktikum ini, campuran dalam labu yang dipanaskan langsung dihubungkan dengan kolom fraksinasi dan pendingin Leibeg, yang bertujuan agar sikloheksena yang terbentuk dapat langsung terpisah dengan campuran. Prinsip pemisahan ini adalah destilasi bertingkat. Destilasi bertingkat dipilih karena perbedaan titik didih yang dekat antara dua
larutan yang ingin dipisahkan (air dengan titik didih 1000C, serta sikloheksena dengan titik didih 830C). Oleh karena itu, dalam proses destilasi yang terlebih dahulu keluar sebagai hasil destilasi (destilat) adalah sikliheksena. Sedangkan zat-zat lainnya seperti air, sikloheksanol, dan asam fosfat yang titik didihnya lebih besar akan menguap kemudian, namun setelah uapnya mencapai kolom fraksinasi uap tersebut mengalami kondensasi dan turun kembali ke campuran.
Suhu yang terukur saat destilat menetes adalah 670C, yang terus konstan sampai campuran yang terdapat dalam labu ± 3,5 mL. Pemanasan kemudian dihentikan, destilat didinginkan untuk menghindari penguapan destilat yang diperoleh. Setelah proses didinginkan, destilat kemudian ditambahkan 10 mL ksilena yang bertujuan untuk mengekstrak sikloheksena yang ada pada campuran. Ksilena digunakan sebagai zat pengekstrak sikloheksena karena ksilena dan sikloheksena sama-sama bersifat non polar. Proses penarikan zat-zat sejenis ini disebut dengan kohesi. Penambahan ksilena menghasilkan campuran yang saling tidak saling melarut, karena ada dua lisan yaitu lapisan polar dan non polar. Lapisan non polar (sikloheksena dalam ksilena) ada di bagian atas, sedangkan lapisan polar (air dan asam fosfat) berada pada bagian bawah. Campuran kemudian didestilasi kembali, dengan tujuan untuk pemurnian sikloheksena yang diperoleh. Destilasi dilangsungkan sampai volume larutan sikloheksena dalam ksilena tersisa setengahnya.
Destilat yang diperoleh kemudian dicuci dengan 10 mL air, yang bertujuan untuk melarutkan ion fosfat yang masih terkandung dalam hasil reaksi dan memisahkan ion fosfat dengan sikloheksena. Sikloheksena tidak melarut dengan air karena bersifat non polar sehingga akan terbentuk dua lapisan. Lapisan bawah adalah air yang melarutkana ion fosfat, sedangkan lapisan atas adalah sikloheksena. Kedua lapisan ini dipisahkan dengan menggunakan corong pisah.
Untuk memastikan bahwa tidak ada air lagi dalam lapisa sikloheksena tadi, digunakan zat yang dapat mengikat air yaitu CuSO4 anhidrat. Penggunaan CuSO4 sebagai penyerap air
dikarenakan CuSO4yang berwarna putih bila menyerap air akan berubah warna menjadi biru.
Setelah air dalam larutan habis, maka CuSO4 tidak mengalami perubahan warna menjadi biru
lagi (tetap putih). Dengan kata lain, penggunaan CuSO4 sebagai penyerap air dikarenakan
kemudahan dalam mengamati telah habisnya air, yang ditandai dengan tidak berubahnya warna CuSO4 saat dimasukkan ke dalam larutan sikloheksena. Kemudian, larutan didekantasi
untuk memisahkan CuSO4 yang sudah mengikat air tadi dengan sikloheksena.
Untuk menguji kemurnian sikloheksena, dilakukan uji titik didh dan uji indeks bias. Titik didih sikloheksena berdasarkan literatur (pada tekanan 1 atm) adalah 830C. Namun pada
praktikum diperoleh suhu dimana mulai diperoleh destilat adalah pada 820C. perbedaan titik didih ini kemungkinan disebabkan tekanan udara yang lebih rendah dari 1 atm. Sedangkan, indeks bias yang terukur adalah 1,450 (literature 1,445). Tingginya indeks bias sikloheksanon yang terukur disebabkan karena suhu kamar saat praktikum lebih dari 250C. Suhu mempengaruhi indeks bias dari suati zat semakin tinggi suhu maka indeks biasnya semakin besar pula. Hal ini disebabkan pada suhu yang besar jarak antara molekul semakin meregang.
Tekanan juga mempengaruhi indeks bias semakin rendah tekanan maka indeks bias semakin meningkat. Selain itu juga, perbedaan indeks bias ini menunjukkan bahwa sikloheksena yang diperoleh kemurniannya masih dibawah 100%. Sikloheksena yang diperoleh kemudian ditimbang. Massa sikloheksena yang diperoleh adalah 4,9561 g. Berdasarkan data hasil percobaan ini, kemudian dapat dihitung rendemen dari produk seperti berikut ini.
Perhitungan secara teoritis : Reaksi : C6H11OH → C6H10 + H2O
Vol sikloheksanol : 10,6 mL (g/mL) Massa sikloheksanol = V.sikloheksanol
= 10,6 mL x 0,94 h/mL = 9,964 g Mol sikloheksanol = nol sikloheksa Mr nol sikloheksa massa = g/mol 100 g 964 , 9 = 0,09964 mol
Jadi, secara teoritis mol sikloheksanol = mol sikloheksena, maka secara teoritis mol sikloheksena adalah 0,09964 mol.
Massa sikloheksena secara teoritis = mol sikloheksena x Mr sikloheksena = 0,09964 mol x 80 g/mol
= 7,9712 g
Massa sikloheksena yang diperoleh yaitu 4,9561 g
- Rendemen hasil praktikum = x100%
teoritis secara na siklohekse massa praktikum hasil na siklohekse massa = 100% g 7,9712 g 9561 , 4 = 62,18 %
ISOMERISASI GEOMETRI
Pada percobaan ini, asam maleat yang digunakan adalan asam maleat anhidrat, dimana asam maleat anhidrat yang digunakan sebanyak 7,5222 gram. Pertama yang dilakukan adalah asam maleat anhidrat dilarutkan dalam 10 mL air mendidih sambil diaduk, sehingga seluruh padatan asam maleat anhidrat larut dan larutan yang dihasilkan bening. Larutan ini kemudian
didinginkan dalam penangas es dengan suhu ± 20oC dan terbentuk endapan berwarna putih dan masih terdapat larutan tidak berwarna (bening) tadi. Reaksi pelarutan asam maleat anhidrat dengan air mendidih sampai terbentuknya padatan asam maleat adalah sebagai berikut. C C H C H C O O O H2O 100oC C C H C C H O OH O OH Asam Maleat dalam larutan C C H C C H O OH O OH
padatan Asam Maleat 20oC
Asam Maleat Anhidrat
Penggunaan penangas es dengan suhu ± 20oC pada saat pembentukan padatan asam maleat dikarenakan asam maleat bersifat sangat mudah mengendap dalam air dingin (≤ 20oC), sehingga suhu diatur sedemikian rupa agar tidak kurang dari 200C. Mudahnya asam maleat mengendap dalam air dingin dikarenakan asam maleat bersifat tidak stabil pada suhu tersebut, sehingga pada suhu 0oC seluruh asam maleat akan mengendap. Hal ini mengakibatkan diperlukannya pengaturan suhu sedemikian rupa agar tidak seluruh asam maleat mengendap. Suhu yang dikondisikan pada praktikum ini adalah 200C, yang bertujuan agar tidak seluruhnya kristal asam maleat akan mengendap, karena filtratnya akan digunakan untuk dibuat menjadi isomer geometri dari asam maleat yaitu asam fumarat.
Langkah berikutnya yaitu kristal yang terbentuk disaring menggunakan corong Buchner. Penggunaan corong Buchner bertujuan untuk mempercepat proses penyaringan. Penyaringan menghasilkan jumlah filtrat (bening) yang dihasilkan lebih banyak dibandingkan dengan kristal asam maleat (kristal putih) yang terbentuk. Kristal asam maleat atau endapan yang disaring sebelumnya kemudian dikeringkan dengan menggunakan oven sebelum ditentukan titik lelehnya. Tujuan pengeringan adalah untuk menghilangkan kandungan air yang mungkin masih tersisa pada endapan, agar saat ditentukan titik lelehnya, titik leleh dari kristal asam maleat tidak dipengaruhi oleh kandungan air yang ada.
Setelah dikeringkan, kemudian kristal asam maleat ditentukan titik lelehnya. Titik leleh asam maleat ditentukan dengan menggunakan melting block (balok logam). Titik leleh asam maleat yang diperoleh yaitu 130,50C, dengan rentang mulai meleleh ampai habis meleleh adalah 0,50C. Hal ini menandakan bahwa asam maleat yang ditentukan titik lelehnya tersebut merupakan asam maleat murni tanpa adanya kantaminan dan air yang mempengaruhi titikleleh asam maleat. Selain itu berdasarkan teori, titik leleh asam maleat adalah 130,50C, sesuai dengan hasil pengamatan.
Setelah endapan hasil penyaringan tadi diukur titik lelehnya, kemudian langkah berikutnya yang dilakukan yaitu merefluks filtrat hasil penyaringan tadi. Refluks dilakukan dengan cara filtrat yang masih mengandung asam maleat dimasukkan ke dalam labu alas bulat 50 mL, kemudian ditambahkan 7,5 mL asam klorida pekat. Mekanisme reaksi yang
terjadi ketika asam maleat ditambahkan larutan HCl pekat dan dipanaskan dengan merefluks adalah sebagai berikut.
C C C H H C O OH O OH + HCl C C H C H C O OH O HO C C C H H C HO OH O OH C C C H H C HO OH O OH C C H C H C O OH O O H H C C H C H C O OH O O H H C C H C H C O OH O HO + H+
Asam Maleat Asam Fumarat
Asam Fumarat
Campuran tersebut kemudian direfluks selama 10 menit, sehingga terbentuk endapan berwarna putih. Endapan tersebut adalah kristal asam fumarat, dimana asam maleat
membentuk kesetimbangan dengan asam fumarat ketika asam maleat dipanaskan dengan asam klorida.
C C H C C H O OH O OH Asam Maleat dalam larutan C C H H C C O OH Asam Fumarat O HO H+ refluks
Larutan yang sudah direfluks kemudian didinginkan dalam suhu ruangan dan disaring menggunakan corong Buchner. Hasil dari penyaringan kemudian direkristalisasi dengan menggunakan air panas. Air panas yang digunakan adalah sebanyak 60 mL, karena endapan yang dhasilkan adalah sebanyak ± 5 gram (1 gram endapan direkristalisasi dengan 12 mL air panas). Tujuan penggunaan air panas adalah untuk memisahkan asam fumarat murni dari pengotornya. Filtrat murni yang diperoleh kemudian dikisatkan sehingga diperoleh endapan
atau Kristal asam fumarat.
Pada saat mengkisatkan, dilakukan pemanasan namun dalam pemanasan filtrat tidak boleh sampai mendidih, karena akan merusak bentuk kristal asam fumarat. Setelah
dipanaskan, filtrat dalam cawan penguap dikejutkan dengan cara menempelkan dasar cawan penguap pada es batu sehingga endapan yang diperoleh lebih banyak.
Sebelum asam fumarat disaring, kertas saring yang digunakan menyaring ditimbang terlebih dahulu agar berat kertas saring tidak ikut terukur. Berat kertas saring adalah 0,9012 gram. Endapan yang terbentuk disaring menggunakan corong Buchner serta kertas saring yang telah ditimbang dan dikeringkan. Tujuan pengeringan adalah untuk menghilangkan kandungan airnya agar tidak mempengaruhi berat asam fumarat yang dihasilkan dan tidak mempengaruhi penentuan titik leleh asam fumarat.
Asam fumarat yang dihasilkan setelah pengeringan dengan oven tampak seperti kristal putih. Kemudian kristal tersebut ditimbang dan menghasilkan berat 5,8221 gram. Dengan demikian, berat asam fumarat yang dihasilkan adalah berat kristal dan kertas saring dikurangi dengan berat kertas saring. Dari perhitungan diperoleh berat asam fumarat 4,9209 gram.
Titik leleh asam fumarat ditentukan dengan menggunakan melting block (balok logam). Data hasil percobaan diperoleh titik leleh asam fumarat yaitu diatas 2370C. Berdasarkan teori, titik leleh asam fumarat adalah 3020C. Karena keterbatasan alat
(thermometer) dan waktu maka pengukuran titik leleh asam fumarat dihentikan sampai 2370C.
Langkah terakhir yang dilakukan adalah menghitung berat asam fumarat untuk mencari persentase rendemennya. Massa asam maleat anhidrat = 7,5222 gram dan Mr asam maleat anhidrat = 98,03 gram/mol. Dengan demikian, maka mol asam maleat a nhidrat adalah:
Mol asam maleat anhidrat = 0,07673
03 , 98 5222 , 7 mol g g Mr gram mol
Mr asam maleat hidrat adalah 116,03 gram/mol. Massa asam maleat pada larutan adalah 0,07673 mol x 116,03 gram/mol = 8,903 gram. Berdasarkan teori, kelarutan asam maleat dalam air adalah 7,9 gram/10 mL pada suhu 20oC. Jadi, endapan asam maleat yang diperoleh adalah 8,903 gram – 7,9 gram = 1,003 gram. Dengan demikian, mol asam maleat hidrat adalah:
Mol asam maleat hidrat = 0,0086
03 , 116 003 , 1 mol g g Mr gram mol
Mol asam maleat yang akan digunakan pada persamaan asam fumarat adalah mol asam maleta anhidrat dikurangi mol asam maleat hidrat (0,07673 mol – 0,0086 mol = 0,06813 mol). Dalam teori, mol asam maleat ≈ mol asam fumarat sehingga:
9051 , 7 03 , 116 06813 , 0 mol g gram fumarat asam Mr fumarat asam massa mol gram
Massa asam fumarat berdasarkan teori adalah 7,9051 gram sedangkan massa asam fumarat berdasarkan hasil percobaan adalah 4,9209 gram.
Mol asam fumarat = 0,0424
03 , 116 9209 , 4 mol g g Mr gram mol % rendemen = 100% 62,25 9051 , 7 9209 , 4 % 100 x g g x teori massa eksperimen massa %
Berkurangnya jumlah asam fumarat dari hasil teori dapat disebabkan oleh beberapa hal, diantaranya :
a. belum semua asam klorida bereaksi dengan asam maleat membentuk asam fumarat b. Pada saat mendinginkan kemungkinan larutan asam maleat suhunya lebih kecil dari
KAFEIN
Kafein adalah suatu senyawa organik yang mempunyai nama lain 1,3,7- trimetixantin. Kristal kafein dalam air berupa jarum-jarum bercahaya sutra. Bila tidak mengandung air, kafein meleleh pada 2340C sampai 2390C dan menyublim pada suhu yang lebih rendah (Frieda, dkk., 2004). Secara alamiah, kafein terdapat pada biji kopi, daun teh, daun mente, biji kola, dan coklat.
C N C O CH3 O CH3 N N CH3 H Struktur Kafein
Pada praktikum ini, kafein diisolasi dari serbuk kopi Banyuatis yang diperoleh di Pasar Anyar Singaraja. Serbuk kopi Banyuatis merupakan kopi yang termasuk ke dalam kelas kopi Robusta karena memiliki bau yang keras dan khas.
Isolasi kafein dari serbuk kopi pertama-tama dilakukan dengan cara sebanyak 20 gram kopi halus dicampurkan dalam 350 mL aquades kemudian dipanaskan selama 45 menit. Tujuan pemanasan adalah untuk melarutkan kafein, karena kafein mudah larut dalam air panas serta didasarkan oleh kelarutan kafein yang semakin meningkat seiring bertambahnya suhu air, yaitu 22mg/mL pada 250C, 180 mg/mL pada 800C, dan 670 mg/mL pada 1000C. Pemanasan yang dilakukan pada serbuk kopi halus dilakukan dengan cara refluks. Refluks yaitu pemanasan larutan dengan menggunakan pendinginan. Keuntungan pemanasan dengan menggunakan refluks adalah cocok digunakan untuk bahan-bahan yang mempunyai tekstur kasar dan tahan terhadap pemanasan langsung seperti serbuk kopi. Selain itu, penggunaan metode refluks dalam isolasi kafein dari serbuk kopi karena refluks cocok untuk reaksi-reaksi yang berlangsung pada suhu tinggi (kafein memiliki titik didih 1780C dan titik lelehnya 234-2390C). Salah satu bagian dalam set alat refluks yaitu pendingin Liebing. Prinsip kerjanya yaitu air masuk dari selang bawah dan keluar dari selang atas. Hal ini bertujuan untuk memaksimalkan proses refluks, sebab tekanan air dari bawah ke atas akan lebih menyempurnakan proses refluks dibandingkan tekanan air dari atas ke bawah (Anonim, 2010).
Langkah berikutnya yang dilakukan setelah campuran bubuk kopi dan aquades dipanaskan dalam refluks adalah campuran tersebut disaring menggunakan corong Buchner
dalam keadaan panas. Penyaringan dilakukan dalam keadaan panas karena kafein sedikit larut dalam air dingin, sehingga apabila penyaringan dilakukan dalam keadaan dingin, maka kafein akan kembali mengendap yang pada akhirnya menyebabkan kafein akan tersaring oleh corong Buchner (ada sebagai residu). Dalam penyaringan digunakan corong Buchner yang bertujuan untuk mempercepat proses penyaringan. Proses penyaringan harus dilakukan lebih
cepat karena untuk menghindari larutan menjadi dingin karena dengan dinginnya larutan maka kafein akan kembali mengendap. Selain itu, penyaring Buchner digunakan untuk proses penyaringan yang tidak dapat dilakukan dengan penyaring biasa. Penyaringan biasa dilakukan dengan memanfaatkan gaya grafitasi, sedangkan pada penyaring Buchner, filtrat dipisahkan dari sistem campuran dengan cara disedot atau divakum.
Untuk memisahkan bahan lain yang ada di dalam serbuk kopi seperti tanin, glukosa, lemak, protein, dan selulosa, maka berikutnya filtrat ditambahkan larutan timbal asetat (3 gram timbale asetat dalam 27 mL aquades) tetes demi tetes. Jika tanin terisolasi ke dalam air panas, maka akan terhidrolisis menghasilkan asam klorogenat. Asam klorogenat ini akan
akan menghasilkan endapan bila direaksikan dengan timbal asetat (Frieda dkk., 2004).
O OH OH CO2H HO OH HO O Asam Klorogenat
Campuran yang terdapat endapan tersebut kemudian didinginkan dan disaring kembali dengan menggunakan corong Buchner. Corong Buchner digunakan untuk membantu mempercepat proses penyaringan karena campuran telah mengental karena proses pendinginan sebelumnya.
Filtrat yang didapat dari hasil penyaringan menggunakan corong Buchner kemudian diekstraksi dengan menggunakan kloroform 3 x 25 mL. Ekstraksi dengan menggunakan kloroform ini adalah salah satu aplikasi dari ekstraksi cair-cair yaitu pemisahan solut dari cairan pembawa dengan menggunakan solven/pelarut cair. Penggunaan kloroform sebagai bahan untuk mengekstraksi kafein adalah karena kafein merupakan senyawa organik yang
larut dalam pelarut organik seperti kloroform. Selain itu, penggunaan kloroform karena kafein mudah larut dalam kloroform. Ekstraksi dilakukan sebanyak 3 kali bertujuan untuk
memperoleh kafein dalam jumlah maksimal, karena semakin sering ekstraksi dilakukan maka efektifitas dari proses ekstraksi tersebut akan semakin meningkat.
Pada proses ekstraksi ini, terbentuk 2 lapisan dimana lapisan atas yang berwarna kecoklatan adalah lapisan dengan senyawa-senyawa yang larut dalam air (massa jenis air = 1 gram/cm3), sedangkan lapisan bawah yang bening adalah lapisan dengan senyawa yang larut dalam kloroform (massa jenis kloroform = 1,5 gram/cm3). Senyawa yang kemungkinan berada pada lapisan atas adalah tanin dan timbale asetat yang masih tersisa, karena tanin dan timbale asetat larut dalam air. Lapisan bawah kemungkinan adalah kafein, karena kafein merupakan senyawa organik yang larut dalam pelarut organik seperti kloroform.
Lapisan bawah yang merupakan lapisan senyawa yang larut dalam kloroform kemudian dikumpulkan lalu kloroformnya yang memiliki titik didih 620C dipisahkan dengan cara diuapkan dengan cawan penguap. Penguapan dengan cawan penguap ini dilakukan agar kloroform menguap dan yang tertinggal hanyalah kafein kasarnya saja.
Langkah terakhir yang dilakukan yaitu melakukan sublimasi dari cawan penguapan yang berisi kafein kasar tersebut agar diperoleh kafein murni dengan cara menutupi bagian atas cawan penguap dengan kaca arloji yang telah ditimbang terlebih dahulu, kemudian cawan penguapan yang berisi kafein kasar tersebut diletakkan di atas nyala api kecil selama beberapa saat hingga terbentuk kristal jarum yang merupakan kafein murni. Dalam praktikum ini proses sublimasi tidak berhasil dilakukan karena air yang ditempatkan di atas kaca arloji menetes ke dalam cawan penguap karena pemanasan yang terlalu tinggi. Menetesnya air dari kaca arloji mengakibatkan tidak berhasilnya proses sublimasi karena tidak ada cairan pendingin di atas kaca arloji. Mengantisipasi kegagalan praktikum karena tidak berhasilnya sublimasi ini, maka kaca arloji dipindahkan dan cawan penguap dibiarkan terbuka. Setelah diuapkan selama ± 1,5 jam, diperoleh kristal putih berbentuk jarum di dasar cawan penguap yang diduga merupakan Kristal kafein.
Untuk menguji kemurnian kristal yang diduga kafein ini, maka langkah berikutnya yang dilakukan adalah uji sifat fisikanya yaitu dengan uji titik leleh. Titik leleh kristal kafein yang dihasilkan pada praktikum ini adalah sebesar 2350C, maka dapat disimpulkan Kristal yang diduga kafein tersebut adalah kafein murni karena titik leleh kafein adalah 234-2390C. Dari hasil percobaan yang dilakukan, kafein yang diperoleh dalam 20 gram kopi Banyautis adalah sebesar 0,2069 gram, sehingga perhitungan kadar kafein dalam serbuk kopi Banyuatis adalah sebagai berikut.
% kadar =
=
= 1,034 %
Jadi, berdasarkan perhitungan di atas, kadar kafein dalam kopi Banyuatis adalah 1,034%. Menurut Chem-is-try.org (2010), kandungan kafein dalam kopi robusta adalah 1,48%. Tidak sesuainya kadar kafein hasil praktikum dengan kadar kafein teoritis kemungkinan disebabkan oleh tidak dilakukannya proses rekristalisasi untuk memperoleh kristal kafein. Rendemen kristal kafein yang terkandung dalam kopi Bnyuatis dapat dihitung sebagai berikut.
% rendemen =
=
= 69,898 %