Modifikasi Silika dengan ligan 2-mercaptoimidazole untuk
Adsorpsi Logam Berat Krom VI
Harry Budiman1*, Fransiska Sri H.K1, Achmad Hanafi. S1 1
Pusat Penelitian Kimia, Lembaga Ilmu Pengetahuan Indonesia Kawasan PUSPIPTEK, Serpong, Banten 15314;
*email address: [email protected]
ABSTRAK
Pencemaran logam berat pada lingkungan menjadi masalah yang sangat diperhatikan. Hal ini disebabkan keberadaan logam berat dilingkungan pada tingkat konsentrasi tertentu dapat mempengaruhi kesehatan manusia dan mahluk hidup sekitar. Sebagai contoh logam berat krom, masuknya logam krom VI dalam konsentrasi yang besar dan berlebihan melalui pernapasan, minuman atau makanan pada tubuh manusia dapat menyebabkan beberapa pengaruh negatif diantaranya kerusakan pada hati, ginjal, sistem pernafasan, jaringan saraf dan organ-organ pembentuk darah. Oleh karena itu, teknologi pemisahan untuk menangani pencemaran logam berat terus berkembang sampai saat ini. Dalam penelitian ini telah dilakukan modifikasi silika dengan ligan 2-mercaptoimidazole untuk pemisahan logam berat krom. Modifikasi silika dilakukan dengan terlebih dahulu mengontakkan silika aktif dengan reagen perantara 3-chloropropyltrimethoxysilane, kemudian diimobilisasi dengan ligan 2-mercaptoimidazole. Hasil karakterisasi silika modifikasi dengan spektrum infra merah menunjukkan ligan 2-mercaptoimidazole terikat pada silika yaitu dengan adanya regang S-H: 2630 cm-1, lentur N-H: 1585 cm-1, regang C-S: 673,16, regang C-S: 673,16 cm-1, dan regang C=C: 3128,54 cm-1. Adsorpsi krom VI pada silika termodifikasi 2-mercaptoimidazole (Si-CTS-MCP) mencapai optimum dalam kondisi pH 3, waktu pengocokan selama 80 menit dan Si-CTS-MCP dapat dikontakkan hingga konsentrasi krom VI 150 ppm. Perolehan kembali krom VI dalam sampel air setelah diadsorpsi oleh Si-CTS-MCP yaitu mencapai 31,088 %.
Kata kunci: logam berat, krom VI, adsorpsi, silika, 2-mercaptomidazole.
Seminar Nasional XVI Kimia dalam Industri dan Lingkungan, Jaringan Kerjasama Kimia Indonesia (JASAKIAI), Yogyakarta, 6 Desember 2007
ABSTRACT
The heavy metal pollution has become great concern in environmental system at the moment since the heavy metal in particular concentration can affect to the human and organism body. For instance chromium, excessive exposure and inhalation of chromium VI can cause various diseases and damage the liver, kidney, circulatory system, nerve tissue, blood forming organs. Therefore, analytical method and separation technology has been developed to solve the heavy metal pollution in recent days. The research is focused on modified silica with 2-mercaptoimidazole for chromium separation. Activated silica gel was modified first with 3-chloropropyltrimethoxysilane to load the chlor group that will bond with the organic functional group contained in 2-mercaptoimidazole, then it was immobilized with 2-mercaptoimidazole. The modified silica gel was characterized
by Infrared Spectrometry. The S-H stretch: 2630 cm-1; N-H bend: 1585 cm-1; C-S stretch:
673,16 cm-1; C=C stretch: 3128,54 cm-1 were shown corresponding to organic functional
group of mercaptoimidazole. Adsorption of Chrom VI on modified silica with 2-mercaptoimidazole (Si-CTS-MCP) gained optimum condition at pH 3, shaking time 30 min and Si-CTS-MCP could be interacted with Chrom VI till 150 ppm. The % recovery of Chrom VI in water sample after adsorption on Si-CTS-MCP is 31,088%.
Keywords: heavy metal, Chrom VI, adsorption, silica, 2-mercaptomidazole
PENDAHULUAN
Pencemaran logam berat pada lingkungan menjadi masalah yang sangat diperhatikan. Hal ini disebabkan logam berat pada tingkatan konsentrasi tertentu dapat berpengaruh pada kesehatan manusia dan mahluk hidup. Dalam konsentrasi yang sangat kecil (trace) logam berat sangat dibutuhkan dalam metabolisme tubuh misalnya kebutuhan manusia terhadap kandungan mineral dalam makanan, buah-buahan, vitamin, namun dalam konsentrasi yang besar, logam berat dapat menyebabkan gangguan kesehatan dan keracunan seperti gangguan fungsi syaraf, perubahan komposisi darah, kelainan pada jantung, paru-paru dan sebagainya1.Oleh karena itu, teknologi pemisahan untuk menangani pencemaran logam berat terus berkembang sampai saat ini.
Tehnik pemisahan dan prekonsentrasi logam runut dapat dilakukan dengan berbagai cara yaitu ekstraksi cair-cair, ekstraksi fasa padat, kopresipitasi, pertukaran ion,
floatasi, dan deposisi secara elektrokimia2,3.Namun Proses Pemisahan dan prekonsentrasi logam berat dalam suatu sampel sering dilakukan dengan prinsip ekstraksi fasa padat
(solid phase extraction) karena tidak membutuhkan pelarut yang berbahaya. Sorben yang
paling sering digunakan dalam prekonsentrasi logam-logam dalam sampel lingkungan adalah resin polimer, silika gelas berpori, silika yang dimodifikasi dengan proses grafting, atau metode sol gel4. Namun silika yang dimodifikasi oleh gugus fungsi organik pada umumnya digunakan sebagai sorben dalam metode analisa karena bahan silika mempunyai beberapa keuntungan yaitu
Bersifat inert,
Mempunyai sifat adsorpsi dan kapasitas pertukaran kation yang baik,
Mudah di preparasi dengan senyawa kimia atau dengan media impregnansi tertentu sehingga menghasilkan bermacam-macam modifikasi permukaan silika5
Mempunyai kestabilan mekanik dan termal yang tinggi6,
Bisa digunakan untuk prekonsentrasi atau pemisahan suatu analit karena proses penahanan atau pengikatan analit (adsorpsi, pembentukan kompleks khelat, pertukaran ion) dalam permukaaan silika termodifikasi bersifat bolak-balik
(reversible)5.
Modifikasi silika gel dilakukan untuk meningkatkan kemampuan sifat adsorpsi dan pertukaran kation dari silika gel sehingga silika gel memiliki sifat selektifitas terhadap ion-ion logam yang teradsorpsi didalamnya. Senyawa-senyawa kimia yang biasa digunakan dalam memodifikasi permukaan silika adalah senyawa yang mempunyai atom donor seperti S, N, O, P yang sering disebut sebagai ligan. Proses pengikatan ligan imobilisasi dengan permukaan silika gel dapat terjadi melalui 2 proses yaitu
1. Adsorpsi kimia: pembentukan ikatan kimia antara atom donor dari ligan dengan silika yang telah mengandung gugus amin atau klor (Cl-).
2. Adsorpsi fisik: proses adsorpsi secara fisik dari ligan ke permukaaan silika gel5.
Silika gel termodifikasi selain digunakan untuk prekonsentrasi dan pemisahan logam-logam runut sebelum dianalisis secara on line prekonsentrasi dengan flow injection
metode elektrokimia, Inductively Coupled Plasma Atomic Emission Spectrometry (ICP- AES)2,9, juga berguna dalam aplikasi katalisis karena silka gel termodifikasi memiliki luas permukaan yang tinggi dan meningkatkan kestabilan mekanik. Modifikasi silika gel dengan gugus fungsi organik seperti –NH2, -SH,dan –CH menjadi objek penelitian yang
menarik5. Beberapa senyawa organik yang digunakan untuk memodifikasi silika gel dalam pemisahan logam misalnya 5-formyl(1-carboxyphenylazo)salcylic acid, 8-hidroxyquinoline, senyawa turunan thiourea, tetra(2-aminoethyl)-ethylenediamine, 3-methyl-1-phenyl-5-pyrazoone, 1,8-dihydroxyanthraquinone, dihydrokxy benzen, 1, 10 phenanthroline, 1-(2-thiazolyazo)2-naphthol, 1,5-bis(di-2pyridyl)methylene thiocarbohydrazide, 2-[2-(6-methyl-benzothiazolyazo0]-4-bromophenol10,11.
Artikel ini memaparkan modifikasi silika dengan 2-mercaptoimidazole. Modifikasi silika dilakukan dengan terlebih dahulu meninteraksikan silika aktif dengan reagen perantara 3-chloropropyltrimethoxysilane, kemudian diimobilisasi dengan ligan 2-mercaptoimidazole. Sifat adsorpsi silika termodifikasi terhadap krom VI telah diamati melalui beberapa parameter seperti pengaruh pH, pengaruh konsentrasi krom VI dan pengaruh waktu pengocokan. Silika hasil modifikasi diaplikasikan untuk memisahkan logam berat krom VI dalam sampel air.
PERCOBAAN Bahan Kimia
Bahan kimia yang digunakan merupakan bahan kimia dengan grade pro analysis
(p.a) yang terdiri dari silika gel, 3-chloropropyltrimethoxysilane, 2-mercaptoimidazole, kalium dikromat, natrium hidrogenposfat, asam sitrat, etanol, toluen, natrium sulfat anhydrous, air demineralisasi, gas nitrogen, asam klorida.
Larutan stok Krom VI 1000 ppm: 0,283 g kalium dikromat dilarutkan dalam 100 mL air demineralisasi.
Instrumen
Peralatan refluks untuk pembuatan silika termodifikasi. Shaker Micromat. Vacuum Oven. Silika modifikasi dikarakterisasi oleh Fourier Transform Infra Red
dengan Atomic Absorption Spectrometer GBC 904AA, Graphite Furnace Atomic
Absorption Spectrometer SpectrAA-880 Zeeman Varian.
Metoda
Preparasi silika termodifikasi oleh 2-mercaptoimidazole
Aktivasi silika. Sebanyak 10 g silika gel direndam dengan 50 mL asam klorida 4 M dan direfluks disertai pengadukan selama 4 jam. Kemudian, campuran disaring dan silika gel dicuci dengan air demineralisasi sampai bebas asam. Selanjutnya silika dikeringkan di furnace pada suhu 150 oC selama 5 jam.
Silika dimodifikasi dengan 3-chloropropyltrimethoxysilane (Si-CTS). Sebanyak 1 g silika aktif dicampur dengan 20 mL toluen kering dan 2,5 mL 3-chloropropyltrimethoxysilane. Campuran diaduk dan direfluks pada suhu 70-80 oC selama 8 jam. Kemudian, campuran disaring dan silika dicuci dengan toluen dan aseton kering. Si-CTS dikeringkan dalam vacum oven pada suhu 70 oC selama 3 jam.
Si-CTS dimodifikasi dengan 2-mercaptoimidazole (Si-CTS-MCP). Sebanyak 40 ml toluen kering dan 5 mL 4% (b/v) 2-mercaptoimidazole dalam metanol ditambahkan ke dalam 1 g Si-CTS. Kemudian campuran tersebut direfluks sambil diaduk pada suhu 70-80 oC dalam lingkungan gas nitrogen selama 8 jam. Silika termodifikasi disaring dan dicuci dengan toluen untuk menghilangkan 2-mercaptoimidazole yang tidak berikatan dengan silika. Selanjutnya, silika termodifikasi dikeringkan dalam oven vakum pada suhu 50 oC selama 3 jam. Si-CTS-MCP dikarakterisasi dengan Fourier Tranform Infrared
Spectrometry.
Adsorpsi Krom VI pada silika termodifikasi
Sebanyak 50 mg adsorben Si-CTS-MCP dikontakkan dengan 10 mL larutan Krom VI 5 ppm disertai dengan pengocokan selama 1 jam pada pH larutan 2-10 kemudian disaring dan silika dicuci dengan air demineralisasi, selanjutnya konsentrasi Krom VI yang terkandung dalam air cucian dan larutan supernatan diukur. Setelah kondisi pH optimum penyerapan krom VI pada silika termodifikasi ditemukan, sebanyak 50 mg Si-CTS-MCP dikontakkan dan dikocok selama 1 jam dalam 10 mL larutan krom VI berbagai konsentrasi (0,5-200 ppm). Selanjutnya pengaruh waktu pengocokan terhadap adsorpsi Krom VI diperiksa, sebanyak 50 mg Si-CTS-MCP dikontakkan dengan
larutan krom VI 5 ppm pada pH optimum dan dikocok dengan berbagai variasi waktu (0-120 menit). Konsentrasi Krom VI di larutan supernatan diukur dengan menggunakan Spektroskopi Serapan Atom.
Pemisahan Logam Krom VI pada sampel air dengan Si-CTS-MCP
Sebanyak 10 mL sampel air ditambahkan dengan larutan krom VI 5 ppm pada kondisi pH larutan optimum kemudian dikontakkan dengan 50 mg Si-CTS-MCP dan dikocok pada waktu pengocokan optimum
HASIL DAN DISKUSI Karakterisasi Si-CTS-MCP
Pembuatan silika termodifikasi 2-mercaptoimidazole dilakukan melalui tiga tahap yaitu pembuatan silika aktif, modifikasi silika aktif oleh reagen perantara 3-chloropropyltrimethoxysilane (Si-CTS), dan pengontakkan Si-CTS oleh ligan 2-mercaptoimidazole (Si-CTS-MCP), Gambar 1.
SiO2 O Si O CH3 O C H2 H2 C H2 C Cl SiO2 O Si O CH3 O C H2 H2 C H2 C N N H S
Gambar 1. (a) Silika gel aktif, (b) Silika termodifikasi oleh 3-chloropropyltrimethoxysilane (Si-CTS), (c) Si-CTS termodifikasi oleh 2-mercaptoimidazole (Si-CTS-MCP) 5. SiO2 OH OH (a) (b) (c)
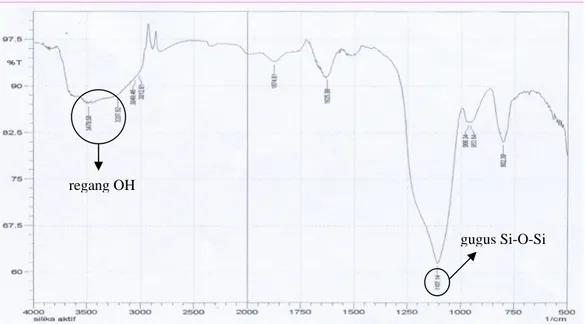
Silika gel sebelum dimodifikasi oleh gugus organik perlu diaktivasi terlebih dahulu. Aktivasi dilakukan dengan merendam silika dengan asam klorida terlebih dahulu untuk menghilangkan logam-logam yang mungkin ada12 dan tahap aktivasi dilanjutkan dengan pemanasan hingga suhu 150 0C yang bertujuan untuk menguapkan dan menghilangkan molekul-molekul air yang berikatan dengan gugus silanol (Si-OH) melalui ikatan hidrogen. Dengan aktivasi ini, maka gugus silanol pada silika siap untuk berikatan secara kovalen dengan gugus fungsi organik pada suatu senyawa13. Disamping itu, hilangnya molekul air dari permukaan silika menyebabkan luas permukaan silika dan volume pori menjadi lebih besar sehingga proses adsorpsi fisik, adsorpsi kimia ataupun kondensasi kapiler menjadi lebih efektif dan efisien. Pada spektrum Infra Red (IR) silika setelah aktivasi Gambar 2, gugus silanol ditunjukkan oleh adanya regang OH pada daerah 3207,62 cm-1, 3479,62 cm-1 dan gugus siloksan (Si-O-Si) ditunjukkan pada serapan didaerah 1107,14 cm-1. Kedua gugus inilah yang merupakan gugus aktif dari silika gel yang menyebabkan silika dapat dimodifikasi.
Gambar 2. Spektrum IR Silika Aktif.
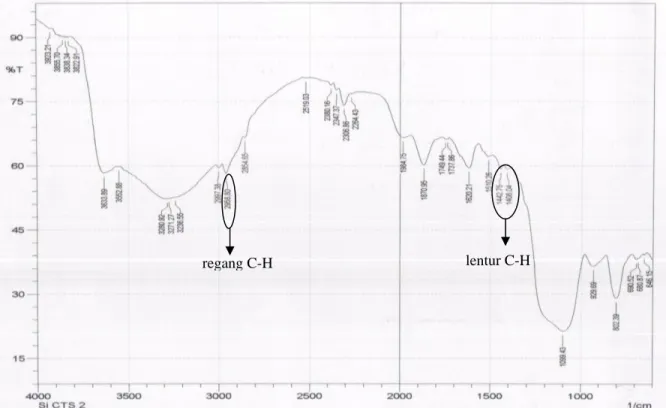
Selanjutnya silika hasil aktivasi dimodifikasi dengan reagen perantara 3-chloropropyltrimethoxysilane untuk memasukkan gugus klor, sebelum diimobilisasi dengan ligan 2-mercaptoimidazole16,17. Ligan 2-mercaptoimidazole digolongkan sebagai
regang OH
senyawa heterosiklik, dimana untuk mengimobilisasinya kepada permukaan silika diperlukan reagen 3-chloropropyltrimethoxysilane sebagai molekul perantara14. Karakterisasi dengan FT-IR pada Si-CTS menunjukkan adanya regangan C-H pada daerah 2958,80 cm-1 dan lentur C-H didaerah 1442,75 cm-1 dan 1408,04 cm-1 yang berasal dari reagen perantara tersebut, Gambar 3.
Gambar 3. Spektrum IR Silika-CTS.
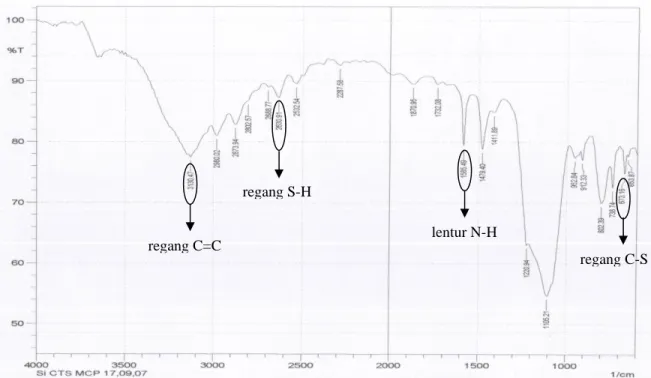
Pada tahap modifikasi Si-CTS dengan ligan organik, ligan 2-mercaptoimidazole dapat terimobilisasi pada silika yaitu dengan teramatinya regang S-H: 2630 cm-1, lentur N-H: 1585 cm-1, regang C-S: 673,16, dan regang C=C: 3130,54 cm-1 pada spektrum IR Si-CTS-MCP15, Gambar 4. Ligan 2-mercatoimidazole terimobilisasi setelah ligan bereaksi dengan gugus klor dari reagen perantara melalui mekanisme reaksi subtitusi nukleofilik (SN2)14.
Gambar 4. Spektrum IR Silika-CTS-MCP.
Adsorpsi krom VI pada silika termodifikasi Pengaruh pH
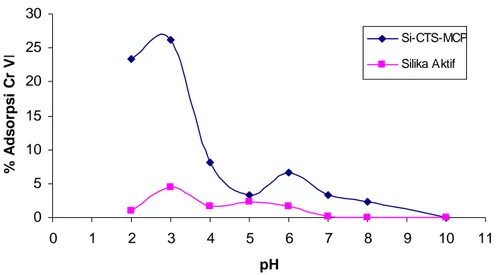
Adsorpsi logam pada silika termodifikasi oleh ligan organik terjadi melalui pembentukkan senyawa kompleks antara ion logam dengan atom donor pada ligan organik. Oleh karena itu derajat keasaman (pH) larutan merupakan salah satu faktor memegang peranan penting dalam besar kecilnya logam teradsorpsi pada silika termodifikasi10. Pada Si-CTS-MCP, ion logam krom VI dapat teradsorpsi optimum hingga 26,22 % pada kondisi pH larutan 3, seperti terlihat pada Gambar 5, sedangkan ion logam krom VI hanya dapat teradsorpsi 4,49 % pada silika tanpa modifikasi. Pada pH 2, jumlah logam yang teradsorpsi cukup tinggi tapi belum optimal sedangkan pada pH setelah 3 jumlah ion logam teradsorpsi mulai menurun. Hal ini kemungkinan disebabkan karena pada suasana asam (pH 2) dimungkinkan terjadi kompetisi antara ion H+ dan ion logam Cr6+ untuk terikat pada permukaan adsorben sehingga jumlah ion logam yang teradsorpsi sedikit karena ada sebagian gugus aktif adsorben yang mengikat ion H+. Sedangkan pada pH di atas 3, konsentrasi ion logam yang teradsorpsi mulai menurun walaupun tidak dapat dilihat dengan jelas pola penurunannya. Penurunan jumlah ion logam yang terserap kemungkinan disebabkan efektifitas atom donor dari MCP untuk
regang C=C
regang S-H
lentur N-H
membentuk ikatan kovalen koordinasi dengan krom VI semakin berkurang seiring dengan semakin besar pH.
0 5 10 15 20 25 30 0 1 2 3 4 5 6 7 8 9 10 11 pH % A d s o rp s i C r V I Si-CTS-MCP Silika Aktif
Gambar 5. Grafik Pengaruh pH larutan terhadap persentase adsorpsi krom VI pada Si-CTS-MCP dan silika aktif.
Ligan 2-mercaptoimidazole mempunyai lebih dari satu atom donor yang memungkinkan untuk membentuk ikatan kovalen koordinasi dengan ion logam yaitu satu atom sulfur dan dua atom heterosiklik nitrogen, Gambar 6. Pada kondisi pH 3 yaitu asam, terjadi protonasi atom heterosiklik nitrogen pada 2-mercaptoimidazole, sehingga hanya atom sulfur yang dapat berfungsi sebagai atom donor dan membentuk ikatan kovalen koordinasi dengan ion logam krom VI17. Secara umum skema adsorpsi krom VI pada silika termodifikasi dapat dilihat pada Gambar 6.
SiO2 O Si O CH3 O C H2 H2 C H2 C N N H S Cr
Pengaruh variasi konsentrasi krom VI
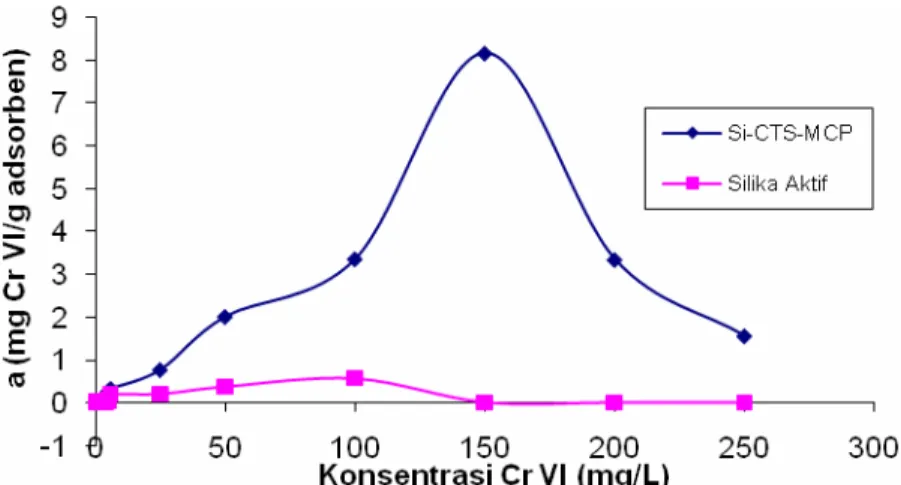
Selanjutnya pengaruh dari berbagai konsentrasi krom VI terhadap Si-CTS-MCP diperiksa untuk mengamati kemampuan Si-CTS-MCP dalam mengadsorpsi Krom VI. Pada tahap ini variasi konsentrasi krom VI yang digunakan yaitu 0.5, 1, 2, 3, 4, 5, 6, 25, 50, 100, 150, 200, dan 250 ppm (mg/L), dan larutan krom VI dikontakkan dengan Si-CTS-MCP melalui pengocokan selama 60 menit pada kondisi pH optimum yaitu pH 3. Hasil yang diperoleh disajikan dalam Gambar 7.
Gambar 7. Grafik pengaruh variasi konsentrasi Krom VI terhadap jumlah adsorpsi krom VI per 1 g adsorben Si-CTS-MCP dan silika aktif.
Berdasarkan grafik pada Gambar 7 terlihat bahwa pada konsentrasi 150 ppm, jumlah ion logam krom VI yang teradsorpsi oleh setiap satu g adsorben Si-CTS-MCP mencapai maksimum, sedangkan pada konsentrasi yang sama, adsorben silika aktif sudah tidak mampu mengadsorpsi ion logam krom VI. Hal ini menunjukkan bahwa jumlah gugus aktif pada MCP lebih banyak sehingga kemampuan adsorpsi oleh Si-CTS-MCP lebih baik karena adsorben modifikasi mampu mengadsorpsi ion logam dalam konsentrasi yang cukup pekat.
Secara teoritis semakin tinggi konsentrasi ion logam semakin banyak jumlah ion logamnya sedangkan jumlah gugus aktifnya tetap. Hal ini menyebabkan kemampuan adsorben untuk mengadsorpsi ion logam akan meningkat seiring dengan meningkatnya konsentrasi ion logam dan mencapai puncaknya pada konsentrasi tertentu lalu menurun.
Berdasarkan data di atas, adsorpsi dengan silika aktif mencapai optimum pada konsentrasi 6 ppm sedangkan pada Si-CTS-MCP mencapai optimum pada konsentrasi 150 ppm. Perbedaan konsentrasi ini menunjukkan bahwa gugus aktif pada silika aktif lebih sedikit dibandingkan dengan gugus aktif pada Si-CTS-MCP sehingga jumlah ion logam yang teradsorpsi pada silika aktif jauh lebih sedikit.
Pada konsentrasi ion logam di atas konsentrasi optimum jumlah ion logam yang teradsorpsi mengalami penurunan. Hal ini kemungkinan disebabkan karena semua gugus aktif pada adsorben telah mengikat ion logam krom VI sehingga tidak ada tempat lagi untuk ion-ion logam yang belum terikat. Bahkan ada kemungkinan terjadinya perebutan gugus aktif pada adsorben menyebabkan adanya ion logam yang telah terikat menjadi terlepas kembali.
Pengaruh waktu pengocokan
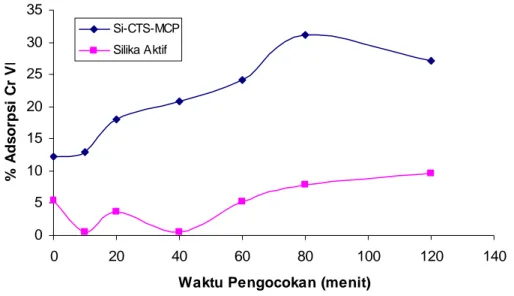
Faktor lain yang mempengaruhi besarnya konsentrasi krom VI yang teradsorpsi pada Si-CTS-MCP adalah waktu pengocokan. Waktu pengocokan dibuat bervariasi yaitu 0, 10, 20, 40, 60, 80, 120 menit, sedangkan adsorpsi tetap dikondisikan pada pH optimum yaitu 3 dan konsentrasi Krom VI yang dikontakkan sebesar 5 ppm, pengaruh dari waktu pengocokan terhadap adsorpsi Krom VI dapat dilihat pada grafik gambar 8.
0 5 10 15 20 25 30 35 0 20 40 60 80 100 120 140
Waktu Pengocokan (menit)
% A d so rp si C r V I Si-CTS-MCP Silika Aktif
Gambar 8. Grafik pengaruh waktu pengocokan terhadap persentase adsorpsi krom VI pada Si-CTS-MCP dan silika aktif.
Persentase adsorpsi krom VI dalam Si-CTS-MCP mengalami peningkatan pada waktu pengocokan 0-80 menit yaitu dari 12,26% sampai 31,09%, Gambar 8. Peningkatan ini disebabkan semakin lama waktu pengocokan maka logam krom VI semakin lama berinteraksi dengan Si-CTS-MCP sehingga semakin besar konsentrasi krom VI yang membuat kesetimbangan dengan Si-CTS-MCP untuk membentuk senyawa kompleks dengan ligan organik MCP. Kesetimbangan yang terjadi dapat dilihat pada skema reaksi pada Gambar 9. Hal ini juga terjadi pada silika aktif, konsentrasi krom VI yang teradsorpsi semakin besar sejalan dengan makin lamanya waktu pengocokan, seperti yang dapat diamati grafik Gambar 8 pada waktu pengocokan antara 40-120 menit.
Si-CTS-MCP + Cr6+ [Si-CTS-MCP-Cr]
Gambar 9. Skema reaksi kesetimbangan pada pembentukan senyawa kompleks krom VI dengan Si-CTS-MCP.
Sedangkan pada waktu pengocokan 120 menit, konsentrasi krom VI yang teradsorpsi mengalami penurunan menjadi 27,09%. Proses pengocokan yang terlalu lama menyebabkan logam krom VI yang telah terikat pada Si-CTS-MCP kemungkinan terlepas kembali atau kesetimbangan reaksi bergeser ke kiri akibat efek mekanik dari pengocokan namun penurunan konsentrasi krom VI yang terjadi kecil.
Pemisahan Logam krom VI pada sampel air dengan SI-CTS-MCP
Krom VI dalam sampel air dapat dipisahkan dengan Si-CTS-MCP hingga 31,088% pada kondisi optimum yaitu pH larutan 3 dan waktu pengocokan selama 80 menit, seperti yang terlihat pada Tabel 1.
Tabel 1. Persentase logam Krom dalam sampel air yang diserap oleh Si-CTS-MCP pada kondisi optimum. [Krom VI] (ppm) Replikasi awal adsorpsi % Adsorpsi Krom VI Rata-rata % Adsorpsi Krom VI Stdev 1 4.755 1.605 33.754 2 4.750 1.350 28.421 31.088 3.622
KESIMPULAN
Ligan organik 2-mercaptoimidazole dapat terimobilisasi pada silika melalui media perantara 3-chloropropyltrimethoxysilane. Silika yang terimobilisasi 2-mercaptoimidazole ini (Si-CTS-MCP) dapat mengadsorpsi optimum krom VI pada kondisi pH 3 dan waktu pengocokan selama 80 menit, juga dapat dikontakkan sampai konsentrasi krom VI 150 ppm. Perolehan kembali yang didapat setelah krom VI dalam matriks air dikontakkan dengan Si-CTS-MCP pada kondisi optimum yaitu sebesar 31,088%.
UCAPAN TERIMA KASIH
Penulis mengucapkan terima kasih pada Proyek DIPA 2007 Pusat Penelitian Kimia-LIPI yang telah membiayai penelitian ini.
DAFTAR PUSTAKA
1. Anonim, Heavy Metal Toxicity, 2003, www.lef.org 2. Liang, P. and Chen, X., 2005, Anal.Sci., 21, 1185-1188
3. Shemirani, F., Abkenar, S.D., Mirroshandel, A.A., Niasari, M.S., Kozania, R.R., 2003, Anal. Sci., 19, 1453-1456
4. De Moraes, S.V.M, Tisott, M.M., Milcharek, C.D., Brasil, J.L., Costa, T.M.H., Gallas, M.R., Benvenutti, E.V., Lima, E.C., 2005, Anal. Sci., 21, 573-577.
5. Osman, M.M, Kholeif, S.A., Abou-Almaaty, N.A., Mahmoud, M.E., 2004, Anal. Sci., 20, 847-852.
6. Pyrzynska, K. and Wierzbicki, T., 2005, Anal. Sci., 21, 951-954
7. Lapanantnoppakhun, Somchai, Kasuwas, S., Ganranoo, L., Jakmunee, J., Grudpan, K., 2006, Anal. Sci., 22, 153-155
8. Matsuoka, S., Shiota, N., Yoshimura, K., 2006, Anal. Sci., 22, 177-181
9. Sumida, T., Sabarudin, A., Oshima, M., Motomizu, S., , 2006, Anal. Sci., 22, 161-164
11.Yebra-Biurrun, M.C.& Crespon-Romero, R.M., 2006, Anal. Sci., 22, 51-55 12.Peng Liu ,2002, , J. Anal At. Spectrom,17, 125-130
13.Misra, B.K., Jal. P.K., Patel, S., 2004, Talanta, 62, 1005-1028.
14.Foschiera, J.L., Pizzolato, T.M., Benvennuti, E.V., 2001, J.Braz.Chem.Soc., 12 no. 2, 159-164.
15.Coates, J., 2000, Interpretation of Infra Red Spectra, A Practical Approach, editor: R.A. Meyers, Encyclopedia of Analytical Chemistry, John willey&Sons, Cinchester. 16.Fujiwara, S.T., and Gushikem, Y., 1999, J. Braz. Chem. Soc, 10 no 5, 389-393. 17.Dias Filho, N.L, do Carmo, D.R.,Caetano, L., Rosa, A.H., 2005, Anal. Sci., 21,