BAB 1
KESELAMATAN KERJA DI LABORATORIUM KIMIA
1.1. Pendahuluan
Setiap pekerja di laboratorium sebaiknya menyadari bahwa bekerja di laboratorium mengandung resiko yang membahayakan keselamatan kerja. Bahaya di laboratium bisa terjadi sebagai akibat kelalaian para pekerja laboratorium. Akan tetapi sekali kita menyadari akan bahaya tertentu, kita akan mencari jalan untuk menghindari terjadinya kecelakaan yang membahayakan keselamatan kerja. Maka para pekerja laboratorium perlu mengetahui sumber-sumber bahaya di laboratorium, simbol-simbol bahan kimia berbahaya dan teknis penggunaan peralatan keselamatan kerja.
1.2. Pengenalan Jenis Bahaya di Laboratorium
Jenis bahaya yang menimbulkan kecelakaan di laboratorium IPA meliputi keracunan, iritasi, luka kulit, luka bakar dan kebakaran.
Keracunan diakibatkan karena penyerapan zat kimia beracun (toxic) baik melalui oral maupun kulit. Keracunan dapat bersifat kronis maupun akut. Misalnya keracunan fenol dapat menyebabkan diare dan keracunan CO dapat menyebabkan pingsan atau kematian dalam waktu singkat. Sedangkan penyerapan bahan kimia yang terakumulasi terus menerus pengaruhnya kronis, contohnya menghirup udara benzena, CHCl3, CCl4 terus menerus
dapat menyebabkan sakit lever. Uap timbal dapat menyebabkan kerusakan dalam darah.
Iritasi dapat berupa luka atau peradangan pada kulit, saluran pernafasan dan mata akibat kontak dengan bahan kimia korosif. Bahan kimia yang dapat menyebabkan iritasi misalnya H2SO4, HCl, NaOH, Cl2, NH3 dan SO2.
Luka kulit dapat terjadi sebagai akibat bekerja dengan gelas. Kecelakaan ini sering terjadi pada tangan atau mata karena pecahan gelas.
Luka bakar dan kebakaran disebabkan kurang hati-hati dalam menangani pelarut-pelarut organik yang mudah terbakar seperti eter, aseton dan alkohol. Hal yang sama dapat diakibatkan oleh peledakan bahan reaktif seperti peroksida dan perklorat.
1.3.Sumber-sumber Bahaya dan Penanganannya
Sumber bahaya di laboratorum dapat dikelompokkan ke dalam tiga kelompok, yaitu:bahan - bahan kimia berbahaya, teknik percobaan dan sarana laboratorium
1.3.1. Bahan-bahan kimia Berbahaya
Bahan-bahan kimia Berbahaya dapat dikategorikan sebagai berikut: bahan kimia beracun(toxic), korosif (corrosive), mudah terbakar (flammable), mudah meledak (explosive), oksidator (oxidizing), reaktif terhadap air (water reactive), reaktif terhadap asam (acid reactive), gas bertekanan tinggi (compressed gases) dan bahan kimia radio aktif (radioactive substance).
1.3.2. Simbol Bahaya
Untuk mempermudah mengenali bahan kimia berbahaya, berikut disertakan lambang-lambang bahaya disamping pembahasannya. Simbol-simbol bahaya dapat dilihat pada label botol bahan kimia. Suatu bahan kimia dapat mempunyai lebih dari satu simbol.
1.3.3. Bahan kimia beracun
Semua bahan kimia pada dasarnya beracun, akan tetapi bahaya kesehatan bergantung pada jumlah zat tersebut masuk ke dalam tubuh. Bahan kimia masuk ke dalam tubuh masuk ke dalam tubuh melalui tiga saluran, yaitu:
-. Melalui mulut atau tertelan, hal ini jarang terjadi, kecuali karena kesalahan memipet dengan mulut atau makan dan minum di laboratorium.
-. Melalui kulit, misalnay anilin, nitrobenzena, fenol dan asam sianida.
-. Melalui pernafasan, gas, debu dan uap seperti SO2, Cl2 , gas HCN, H2S, uap Pb
dan Zn akan masuk ke dalam darah kemudian terdistribusi ke seluruh organ tubuh. Untuk menghindari keracunan zat-zat di atas sebaiknya: percobaan dilakukan dalam lemari asam, diperhatikan sirkulasi udara di ruangan kerja, memakai alat pelindung pernafasan (masker), memakai sarung tangan (gloves) dan kaca mata pelindung(goggles).
1.3.4.Bahan kimia korosif
Bahan kimia ini dapat merusak peralatan logam, bila kena kulit dapat terjadi iritasi dan peradangan kulit. Asam sulfat pekat dapat menimbulkan luka yang sukar dipulihkan.
Contoh bahan korosif cair: HNO2, H2SO4, HCl, HF, H3PO4, HCOOH, CH3COOH,
CH2ClCOOH, CS2, hidrokarbon terklorinasi.
Contoh bahan korosif padat: NaOH, KOH, CaO, Ca(OH)2, Na2O.x SiO2, CaC2,
C6H5OH, Na, K, P, AgNO3.
Contoh bahan korosif gas: HCl, HF, NH3 Br2, PCl5, CH3COOH dan SO2
Bahaya zat korosif dapat dihindari dengan menghindarkan kontak dengan tubuh, alat proteksi perlu digunakan adalah sarung tangan, kacamata pelindung, pelindung muka. Pertolongan pertama selalu dilakukan dengan mencuci bagian yang terkena dengan air yang cukup banyak sebelum dibawa ke dokter.
1.3.5.Bahan kimia mudah terbakar
Berdasarkan teori segitiga api, kebakaran dapat terjadi apabila tiga gaktor yaitu A (bahan mudah terbakar), P (panas atau energi cukup) dan I (oksigen yang cukup) berada bersamaan. Dalam atorium labor, oksigen tidak dapat ditiadakan. Untuk menghindarkan kebakaran adalah mencegah adanya pertemuan antara panas atau sumber penyalaan dan bahan mudah terbakar. Sumber penyalaan dapat berasal dari api terbuka, logam bersuhu tinggi(permukaan pemanas), reaksi eksotermis dan
loncatan listrik. Bahan kimia mudah terbakar di laboratorium seperti: padat : S8, P4,
hidrida logam, Na, K; cair: eter, alkohol, metanol, n-heksana, benzena, aseton,pentana; gas: H2 , asetilen.
Urutan tindakan – tindakan yang harus di lakukan bila terjadi kebakaran di laboratorium :
(a). Menolong korban
-.Luka bakarnya kecil, dibasahi air mengalir
-.Rambut atau pakaian korban terbakar, jangan berlarian tetapi bergulir di lantai atau ditutup handuk basah akan lebih baik lagi memakai selimut kebakaran.
-.Luka bakar sebaiknya minta diobati oleh tenaga medis. (b). Melaporkan terjadinya kebakaran
-.Mahasiswa lapor kepada pemimpin praktikum
-.Kebakaran besar panggil barisan pemadam kebakaran (c). Batasi Lingkup kebakaran
-.Tutup keran gas
-.Matikan saklar listrik utama
-.Singkirkan bahan-bahan mudah terbakar
-.Kebakaran di ruang asam, matikan motor ruang asam
(d).Memadamkan kebakaran dengan pemadam kebakaran (kebakaran skala kecil)
Tabel 1.1. Penggunaan P emadam Kebakaran dan Jenis Api
Kelas Api
Bahan Terbakar Pemadam Kebakaran
Air Busa Bubuk
Kering
CO2
A Kertas, kayu,karet Ya Ya Ya Ya
C Listrik dan motor Tidak Tidak Ya Ya
D Logam alkali Tidak Tidak Ya Ya
1.3.6. Bahan kimia mudah meledak
Ada dua jenis ledakan yaitu ledakan fisika dan ledakan kimia. Ledakan fisika misalnya meledaknya bejana tertutup berisi gas bertekanan tinggi. Ledakan kimia diakibatkan oleh reaksi eksotermis yang amat cepat menghasilkan panas dan gas dalam jumlah besar.
Beberapa contoh zat dan reaksi yang mudah meledak adalah: -.Senyawa peroksida
-.Nitroamida
-.Senyawa nitrat organik -.Nitrasi zat organik
-.Reaksi ozonisasi senyawa tak jenuh -.Reaksi dengan klor
-.Reaksi polimerisasi
Tindakan-tindakan yang perlu dilakukan sebagai pencegahan terjadinya ledakan :
-.Pengendalian suhu (pendinginan) -.Menambahkan jumlah zat dengan benar
-.Mencegah zat-zat yang mempercepat berlangsungnya reaksi secara katalis -.Menggunakan sarana pelindung wajah
1.3.7. Bahan kimia oksidator
Bahan kimia oksidator adalah bahan kimia yang dapat menghasilkan oksigen dalam penguraian atau reaksinya dengan senyawa lain. Bahan tersebut bersifat reaktif dan eksplosif serta sering menimbulkan kebakaran.
Beberapa contoh bahan oksidator adalah: -. permanganat
-. perklorat -. dikromat
-. hidrogen peroksida -. periodat -. persulfat -. benzil peroksida -. asetil peroksida -. eter oksida.
Penanganan peledakan peroksida tersembunyi perlu dilakukan sbb: -.Uji KI keberadaan peroksida dalam pelarut
-.Menyimpan pelarut dalam botol coklat -.Tidak menyimpan sisa-sisa pelarut -.Memakai pelindung muka.
1.3.7.Bahan kimia reaktif terhadap air
Bahan kimia ini adalah bahan kimia yang mudah bereaksi dengan air menghasilkan panas yang besar dan atau gas mudah terbakar. Contoh: Na, K, Ca, logam halida anhidrat, oksida non logam halida dan asam sulfat. Karena itu bahan-bahan kimia tersebut harus dijauhkan dari air dan disimpan diruangan kering.
1.3.8.Bahan kimia reaktif terhadap asam
Bahan kimia ini adalah bahan kimia yang mudah bereaksi dengan asam menghasilkan panas, gas mudah terbakar dan beracun. Beberpa Contoh zat ini adalah: Na, K, Ca, KClO3, KMnO4, H2CrO4 amat reaktif terhadap asam sulfat dan asam
asetat. Zat yang menghasilkan gas beracun adalah NaCN atau KCN. Demikian pula Cu, Zn dan Al reaktif terhadap asam nitrat menghasilkan gas beracun NO2.
1.3.9. Gas bertekanan tinggi
Gas bertekanan tinggi banyak dipakai sebagai reagen, bahan bakar dan gas pembawa. Gas-gas tersebut disimpan dalam silinder dalam bentuk:
-.Gas tekan seperti udara, hidrogen dan klor -.Gas cair: nitrogen dan amonia
Bahaya gas-gas bertekanan tersebut selain beracun, korosif dan mudah terbakar juga bahaya mekanik. Karena itu selinder gas tersebut harus disimpan di tempat yang tidak kena panas, terikat dan bebas dari kebocoran kran.
1.3.10. Bahan kimia radioaktif
Bahan kimia ini adalah bahan yang mampu memancarkan sinar alfa, beta dan gama. Banyak dipakai untuk bahan sintetis atau analisis. Penanganan bahaya dari zat ini ialah dengan cara melindungi diri dengan panahan timbal, menjauhkan diri dari sumber radiasi.
1.4.Sarana Laboratorium
Tiga jenis sarana laboratorium yang sangat penting untuk memperlancar kegiatan laboratorium yaitu gas, air dan listrik. Ketiga sarana tersebut dapat menimbulkan kerusakan dan kecelakaan apabila tidak dijaga penggunaannya dengan baik.
Gas dapat menimbulkan kecelakaan akibat kebocoran dari sambungan selang atau dari pembakar. Periksa setiap kali akan praktikum. Hindari kran terbuka setelah bekerja. Pipa utama menuju lab harus dilengkapi kran diluar lab dan diketahui oleh staf dan pembimbing praktikum. Sebelum kran utama dibuka, semua kran pada meja praktikum atau bunsen harus ditutup.
Air sangat penting untuk mencuci peralatan gelas, pendingin, pemanas dan untuk pemadam api. Kecelakaan terputusnya air dapat menimbulkan kebakaran khususnya jika di lab ada orang yang sedang melakukan destilasi. Sebagaimana penanganan gas, hindarilah kran air dalam keadaan terbuka setelah bekerja. Kelalaian ini dapat menyebabkan banjir.
Listrik di lab digunakan untuk penerangan, pemanasan dan sumber tenaga peralatan. Bahaya utama adalah sengatan listrik, hubungan pendek dan loncatan api. Karena itu lab kimia harus selalu diperiksa oleh ahli listrk secara khusus. Staf pengelola lab harus mengetahui jaringan listrik yang ada di labnya. Tuliskan berapa tegangan masing-masing stop kontak (110 V atau 120 V) untuk menghindari rusaknya peralatan yang menggunakan sumber listrik. Padamkan aliran arus listrik
setelah selesai bekerja. Kebakaran karena listrik tidak diperbolehkan menggunakan pemadam kebakaran air atau busa karena akan menimbulkan hubungan pendek.
1.5.Perlengkapan Keselamatan Kerja
Untuk menciptakan keselamatan kerja faktor penunjang lain yang dipandang penting adalah dipenuhinya bangunan lab yang memenuhi persyaratan juga dilengkapi peralatan keselamatan kerja.
Karena laboratorium dipenuhi oleh peralatan dan bahan kimia yang peka terhadap cahaya, maka dipersyaratkan bahwa bangunan lab harus melintang dari timur ke barat. Jenis ruangan yang harus ada adalah ruang praktikum tempat melakukan percobaan, ruang alat, ruang zat, ruang persiapan, ruang timbang, ruang pembimbing praktikum dan ruang asam.
Sirkulasi udara harus cukup, karena itu bangunan lab memerlukan banyak jendela atau blower. Pintu minimal 2 buah dan terbuka keluar dan bagian atas pintu harus memakai kaca terang. Ada pintu darurat atau tangga darurat bila terjadi kebakaran. Kapasitas ruang untuk tiap orang adalah kurang lebih 4 m2, jarak antar meja 1,6 m. Panjang, lebar dan tinggi meja mahasiswa beukuran 1,2 m x 0,8 m x 0,8 m. Lemari asam harus menggunakan kaca terang, pintu dapat digeser, terpasang blower berdaya isap tinggi. Pada ruang timbang harus dipasang meja beton. Meubel untuk alat, zat, meja tulis dan kursi sesuai dengan kapasitas lab. Juga tersedia lemari arsip data.
Peralatan keselamatan kerja yang tersedia di lab adalah : jas lab( individual), pemadam kebakaran (extinguisher), eyewash station, shower, goggles, face shields, gloves, sound level, stepladers, emergency lights, toxic gas monitor, radiation detectors, reference materials, partikel mask dan fire blanket.
LATIHAN
1. Jelaskan tujuan peraturan - peraturan laboratorium kimia 2. Jelaskan jenis gelas tahan panas
4. Jelaskan kegiatan yang harus dilakukan setelah kegiatan praktikum selesai 5. Sebutkan peralatan keselamatan kerja di laboratorium kimia
6. Jelaskan sumber kebakaran yang dapat terjadi di laboratorium kimia 7. Jelaskan cara menghindari keracunan oleh bahan kimia beracun 8. Jelaskan jenis sampah di laboratorium kimia
9. Jelaskan bahan kimia yang bersifat oksidator
10.Jelaskan pertolongan pertama pada korban terkena aliran listrik
UJI KOMPETENSI
1. Jelaskan tanda bahaya pada bahan
2. Klassifikasikan bahan kimia berdasarkan bahayanya 3. Berikan contoh bahan kimia yang mudah meledak
4. Jelaskan contoh bahan kimia yang mudah terbakar bila kena air 5. Jelaskan cara mengatasi keracunan
6. Sebutkan tiga jenis asam kuat
7. Jelaskan jenis bahan kimia yang korosif (iritan)
8. Jelaskan bahan kimia yang reaktif terhadap asam nitrat 9. Jelaskan aturan pembuangan sampah kimia
BAB II
TEKNIK DASAR DALAM ANALISIS KUALITATIF
2.1.Pendahuluan
Dalam analisis kualitatif seorang analis perlu trampil dan profesional dalam lingkup keahlian kimia, khususnya analisis kimia. Berbagai teknik yang harus dikuasai diantaranya melarutkan, menguapkan, kristalisasi, destilasi, presipitasi, filtrasi, dekantasi, mengadministrasikan dan memelihara alat-alat dan sarana laboratorium kimia, menggunakan alat-alat kesehatan dan keselamatan kerja, melakukan pengolahan limbah laboratorium kimia, menganalisis bahan makanan, bahan farmasi dan bahan alam.
Skala percobaan dalam analisis kualitatif dapat dilakukan dalam analisis makro , bahan yang digunakan berkisar 0,5 – 1,0 g dan volume larutan 20 mL. Dalam Analisis mikro , bahan yang digunakan berkisar 0.01 mg dan volume larutan μL. Untuk analisis semimikro, senyawa yang digunakan berkisar 0.05 – 0.1 mg dan volume larutan sekitar 1 mL.Dalam analisi kualitatif dianjurkan untuk menggunakan mikroanalisis dan semimikroanalisis, hal ini disebabkan efisiensi pemisahan, waktu dan biaya serta limbah yang dibuang dapat lebih mudah dikontrol dan ditangani. 2.2. Teori dasar kimia dalam pembuatan larutan
Agar mampu membuat larutan, ada tiga hal pokok yang mesti diperhatikan, yaitu: memahami teori dasar kimia yang meliputi: klasifikasi zat; konsep mol; massa atom dan molekul; massa molar; pengertian larutan; jenis larutan; sifat larutan; indicator; konsentrasi larutan; pengenceran; pembuatan larutan dan penetapan konsentrasi larutan. Kemudian perlu memahami teknik-teknik dasar pembuatan larutan seperti mencuci alat gelas; mengeringkan alat gelas; membilas alat gelas; mengambil dan menuangkan zat; mengetahui bau zat; melarutkan/mengocok; menyaring; memanaskan zat cair; menguapkan dengan penangas; menimbang; mengukur volum, mengencerkan; memeriksa pH dsb.
Dilihat dari ujudnya, zat-zat kimia itu ada yang berujud padat, cair dan gas. Zat kimia padatan yang disediakan di laboratorium ada yang berupa lempengan seperti aluminium, butiran seperti timah dan serbuk seperti aluminium, kanji. Ingat ada beberapa zat kimia padatan yang mudah menguap. Zat kimia cairan ada yang larut dalam air seperti asam klorida dan ada yang tidak seperti aseton. Hati-hati beberapa zat kimia cairan mudah menguap. Zat kimia berupa gas misalnya gas nitrogen, gas butane (LPG). Persediaan zat kimia di laboratorium lebih banyak berujud padat dan cair.
2.3. Reaksi pengujian dalam Analisis Kualitatif
Pengujian dalam analisis kualitatif dapat dilakukan dengan analisis kering dan analisis basah. Dalam analisis kering dapat dilakukan dengan test pemanasan, test pembakaran melalui pipa tiup, test nyala, test boraks dan test fosfat.Test pemanasan
dilakukan dengan menempatkan sampel pada wadah pembakaran yang terbuat dari tabung gelas, kemudian dipanaskan dengan pemanas bunsen dengan menggunakan nyala rendah sampai nyala tinggi sehingga senyawa yang dianalisis akan mengalami pelelehan atau terurai yang disertai adanya perubahan warna sampel atau mengeluarkan gas sebagai hasil reaksi. Pengamatan perubahan ini dilakukan dengan melihat sifat-sifat fisis atau sifat kimia senyawa yang dianalisis.
2.4. Uji Nyala
Test nyala merupakan pemeriksaan pendahuluan untuk kation dalam keadaan kering didasarkan pada pembentukan warna senyawa saat dibakar pada nyala bunsen. Nyala bunsen mempunyai konstruksi seperti pada gambar di bawah ini. Alat ini dibuat dari logam. Biasanya dibuat dari besi.
A. Lubang dimana gas lampu masuk kedalam lampu bunsen. Masuknya gas dapat diatur dengan suatu klep yang tidak tertera disitu.
B. Merupakan pipa yang berlubang pada B yang berguna untuk memasukkan udara.
C. Merupakan cincin yang dapat bergerak mengelilingi piapa B.
Pada cincin ini terdapat lubang B. Cincin ini gunanya untuk membuka dan menutup lubang B, guna mengatur udara yang masuk. Lubang biasanya hanya terbuka sedikit untuk mendapatkan nyala api yang tidak berwarna.
Cara menyalakan lampu Bunsen
1. Lubang B ditutup dapat dengan cincin C 2. Kran gas dibuka dan gas ini masuk melalui A
3. Gas dinyalakan dengan korek api pada ujung atas dari pipa
4. Cincin C diputar pelan-pelan, sehingga lubang B terbuka sedikit demi sedikit. Api diatur hingga nyalanya menjadi biru
a. Zone oksidasi atas
Gas terbakar dengan sempurna, tetapi kelebihan udara sehingga temperatur tidak begitu tinggi
b. Temperatur yang tertinggi adalah zone oksidasi bawah. Dalam daerah ini yang terbaik untuk melebur benda-benda c. Zone reduksi atas
Dibagian ini terdapat gas-gas yang terbakar tidak sempurna, karena itu sangat baik untuk mereduksi zat-zat
d. Tetapi pada zone reduksi bawah sudah tercampur dengan udara dan kekuatan untuk mereduksi kurang kuat.
2.4.1. Test boraks
Test boraks didasarkan pada pembentukan warna senyawa yang dibakar di dalam nyala bunsen yang terlebih dahulu dicelupkan ke dalam senyawa boraks Na2B4O7.10 H2O sebagai media. Pada pemanasan akan terbentuk NaBO2 ; B2O3 dan
H2O. B2O3 ini dengan garam-garam akan terjadi metaborat yang warnanya
karakteristik untuk tiap-tiap logam Cara membuat Mutiara boraks:
Batang kawat platina dengan mata mula-mula dipanasi, kemudian lubang dari kawat platina itu diberi boraks, dipanasi perlahan-lahan hingga terjadi mutiara yang jernih. Setelah itu mutiara panas dimasukkan dalam garam yang dibuat halus, kemudian dipanasi.
I. Dalam api oksidasi, lihat warna mutiara dalam keadaan panas dan dalam keadaan dingin.
II. Dalam api reduksi, lihat warna dari mutiara dalam keadaan panas dan keadaan dingin.
Dari warna-warna yang didapat dengan membandingkan dengan tabel dapat ditentukan logam apa yang terdapat disitu.
Tabel 2.1.Warna mutiara dingin dalam api oksidasi dan api reduksi Warna mutiara dingin
dalam api oksidasi
Warna mutiara dingin dalam api reduksi
UNSUR 1.Tidak berwarna 2.Biru 3.Kuning 4.Coklat merah 5.Hijau abu-abu merah tak berwarna tak berwarna hijau Bi Cu Ni Mn Cr 2.4.2.Test fosfat
Test fosfat didasarkan pada pembentukan warna senyawa yang dibakar di dalam nyala bunsen yang terlebih dahulu dicelupkan ke dalam senyawa Na(NH4)HPO4. 4 H2O sebagai media.Karena pemanasan maka akan terurai menjadi
NH3 ; H2O dan NaPO3. Test ini biasanya hanya untuk menyelidiki adanya silikat saja.
Pada waktu memanasi garam Na(NH4)HPO4. 4 H2O ini memercik – mercik. Karena
2.5.Reaksi Analisis Basah
Reaksi analisis basah dilakukan terhadap senyawa di dalam larutan. Perubahan yang dapat diamati berupa terjadinya endapan, gas yang dikeluarkan dan perubahan warna. Reaksi analisis basah dapat dilakukan dengan menggunakan tabung reaksi, beker glass, erlenmeyer dan spot plate.
BAB III
ANALISIS KATION GOLONGAN I Kation Golongan I ( Pb2+, Ag+ dan Hg22+)
3.1.Pendahuluan
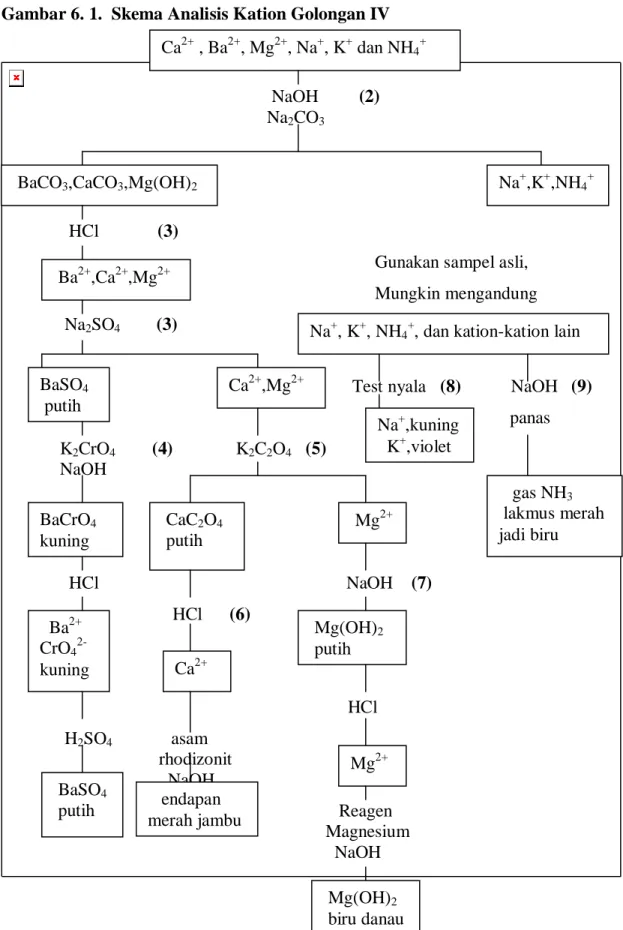
Sesudah cuplikan dilarutkan, mahasiswa dapat mencoba memisahkan kation-kation kedalam golongan-golongan. Ini dapat dilakukan dengan skema yang diuraikan pada Tabel 3.1.
Hal-hal yang perlu diperhatikan agar kesalahan-kesalahan dalam analisis kualitatif dapat dihindari adalah:
1. Analisis harus dilakukan dengan sampel dalam jumlah yang banyak,karena banyak waktu akan dihabiskan dengan menyaring endapan dan kesulitan akan dialami dalam mencuci dan melarutkan endapan ini. Maka dianjurkan untuk menggunakan 0.5 – 1 g sampel untuk dianalisis.
2. Uji-uji harus pertama-tama sekali dilakukan menurut urut-urutan yang diberikan. Suatu reagensia golongan akan memisahkan golongannya yang khusus hanya dari golongan-golongan yang berikutnya, dan tidak dari golongan-golongan yang mendahuluinya. Jadi gas H2S dengan adanya HCl
0.4 M akan memisahkan golongan II dari III, IV dan V, tetapi tidak memisahkan golongan II dari golongan I. Maka penting sekali agar satu golongan harus telah sempurna diendapkan sebelum pengendapan golongan selanjutnya dilakukan, kalau tidak endapan-endapan golongan itu akan mencemari ion-ion logam yang berikutnya dan akan diperoleh hasil yang menyesatkan.
3. Kondisi untuk pengendapan dan pelarutan harus diikuti dengan ketat.
4. Semua endapan harus dicuci untuk menghilangkan larutan yang melekat, agar mencegah kontaminasi oleh logam-logam yang tetap tinggal di dalam filtrat, Air cucian yang pertama harus ditambahkan kepada larutan dari endapan yang disaring, sedangkan air cucian yang belakangan boleh dibuang.
5. Jika volume larutan pada salah satu tahap analisis menjadi terlalu besar, volume harus dikurangi dengan penguapan.
6. Semua alat yang digunakan dalam analisis harus bersih benar. Pemakaian alat yang kotor akan mencemari zat-zat yang sedang diselidiki.
Tabel 3.1 berikut ini menyajikan pemisahan kation-kation dalam golongan-golongan.Jika ada serta anion-anion asam-asam organik, borat, fluorida, silikat dan fosfat. Tambahkan beberapa tetes HCl encer dalam larutan dingin. Jika terbentuk endapan, maka tambahkan HCl encer sampai tidak terjadi pengendapan lebih lanjut. Saring endapan tersebut (1).
Tabel 3.1. Skema pemisahan kation-kation dalam golongan-golongan Residu Filtrat
Residu berwarna putih (golongan I ada) Pada filtrat tambahkan 1 mL H2O2 3% (2)
Selidiki dengan menggunakan prosedur Sesuaikan konsentrasi HCl 0,3 M (3). Pada Tabel 2. Panaskan larutan sampai hampir Mendidih, dan jenuhi dengan H2S
Dengan tekanan (4) Saring jika terbentuk Endapan
____________________________________ Residu
Residu berwarna maka golongan II ada. Selidiki dengan prosedur pada Tabel 3. Pemisahan golongan pada bagian Filtrat
Untuk penyelidikan kation golongan III Beberapa catatan dan keterangan untuk Tabel 3.1 adalah sebagai berikut:
1. Jika zat asli larut sempurna dalam HCl encer, maka jelaslah bahwa tidak ada garam perak merkurium(I). Bila timbal ada, larutan mungkin jernih setiap waktu panas, tetapi PbCl2 akan mengendap setelah larutan didinginkan. Setiap
ion Pb2+ yang lolos dari golongan ini, akan diendapkan oleh H2S dalam
golongan II. Endapan mungkin terbentuk setelah penambahan HCl kepada larutan-larutan tertentu yang netral atau sedikit asam, bahkan bila tidak ada golongan I. Hal ini dapat terjadi pada keadaan-keadaan berikut ini:
Larutan-larutan Sb, Bi, Sn dalam air yang tidak mengandung HCl bebas, mengendapkan oksiklorida setelah penambahan asam dengan berlebihan.
Larutan pekat klorida-klorida tertentu, misalnya NaCl dan BaCl2
mungkin membentuk endapan-endapan setelah penambahan HCl dan ini akan melarut setelah diencerkan dengan air.
Borat mungkin menghasilkan endapan kristalin putih asam borat, terutama jika asam pekat, disini mungkin hanya terjadi pengendapan parsial.
Silikat-silikat mungkin menghasilkan endapan asam silikat yang berarti seperti gelatin. Disini mungkin hanya terjadi penegendapan parsial.
Garam tio dan arsenik, stibium dan timah akan memberikan sulfifa-sulfida yang bersangkutan.
2. Larutan H2O2 ditambahkan untuk mengoksidasikan Sn2+ menjadi Sn4+, jadi
seperti gelatin. Kelebihan H2O2 sebaiknya diuraikan dengan mendidihkan,
sebelum mengalirkan H2S, kalau tidak maka sedikit S mungkin mengendap.
Maka pemisahan berikutnya dari golongan IIA dan IIB dengan memakai larutan KOH dalam air menjadi lebih sempurna, karena SnS2 melarut
seluruhnya sedangkan SnS hanya melarut sebahagian dan KOH 2M. Jika diinginkan untuk memakai ammonium polisulfida dalam pemisahan golongan IIA dan IIB, penambahan H2O2 tidak begitu penting, karena ammonium
polisulfida akan mengoksidasi SnS menjadi SnS2 dan senyawa ini akan
melarut sebagai tiostanat, SnS32-.
3. Konsentrasi HCl yang digunakan harus tepat yaitu kira-kira 0,3 M, sebelum mengaliri H2S dengan konsentrasi asam yang lebih tinggi, timbal kadmium,
dan timah(II) akan tidak sempurna diendapkan, dan jika keasaman terlalu rendah, sulfida-sulfida dari golongan IIIB (NiS, CoS dan ZnS) mungkin akan mengendap. Salah satu dari dua metode berikut ini dapat dipakai untuk menyesuaikan konsentrasi asam tersebut.
Pekatkan larutan sampai volumenya menjadi 10-15 mL dan kemudian dinginkan dan tambahkan larutan NH3 pekat setetes demi setetes
dengan pipet tetes, sambil terus diaduk, sampai campuran menjadi bersifat basa (abaikan setiap endapan yang mungkin terbentuk). Masukan HCl encer setetes demi setetes sampai campuran tepat asam (pakai lakmus), kemudian tambahkan 3,0 mL HCl 2M (diukur dengan pipet ukur atau penetes yang telah dikalibrasi) dan encerkan larutan sampai volumenya menjadi 20 mL dengan air suling.
Tambahkan 1 tetes larutan indukator lembayung metil dan masukkan HCl encer atau larutan air NH3 encer setetes demi setetes dan dengan
terus diaduk sampai warna larutan menjadi hijau kuning. Dianjurkan untuk memakai larutan pembanding yang baru saja dibuat dengan mencampurkan 5 mL natrium asetat 2M dan 10 mL HCl 2M, larutan ini mempunyai pH 0,5M.
4. Untuk mengalirkan H2S ke dalam larutan, maka larutan ditaruh dalam
erlenmeyer kecil dengan kapasitas 50 mL. Panaskan larutan sampai hampir mendidih dan alirkan H2S sambil labu dikocok perlahan-lahan dengan gerakan
memutar, sampai pengendapan telah sempurna. Kejenuhan biasanya tercapai setelah 2-5 menit. Metode yang terbaik untuk menentukan apakah pengendapan telah sempurna adalah dengan menyaring sebagian kecil larutan dan menguji filtratmya dengan H2S. Jika hanya diperoleh endapan atau
suspensi yang putih, ini menunjukkan adanya suatu zat pengoksidasi.
Jika suatu zat pengoksidasi ada, misalnya garam permanganat, dikromat atau besi(III), biasanya dengan mengalirkan gas SO2 ke dalam larutan yang panas
sampai reduksi telah sempurna, lalu didihkan untuk mengusir SO2 yang berlebih
dan kemudian alirkan gas H2S. Keberatan terhadap pemakaian SO2 disebabkan
ini mungkin akan mengendapkan sebagian Pb, Sr dan Ba sebagai garam sulfat. Maka terhadap setiap pengendapan yang terbentuk harus diuji terhadap kation-kation tersebut. Sulfida-sulfida yang diendapkan dapat dicuci dengan cairan pencuci yang dibuat dengan melarutkan 0,25 g NH4NO3 dalam 5 mL air dan
mengolah larutan ini dengan H2S. H2S harus ada dalam cairan pencuci untuk
mencegah sebagian sulfida yang basah itu menjadi sulfat.
5. Asam nitrat ditambahkan untuk mengoksidasi besi(II) menjadi besi (III); jika besi (III) dalam zat aslinya sudah ada, besi mungkin telah direduksi oleh H2S.
Cara lain adalah air brom boleh dipakai untuk oksidasi, dan brom yang kelebihan harus dihilangkan dengan pendidihan.
Asam-asam organik (dan anion-anionnya) mengganggu jalannya analisis yang normal. Maka dengan adanya asam oksalat, tartarat atau sitrat, penambahan reagensia golongan NH4Cl dan NH3 mungkin akan gagal mengendapkan
hidroksida dari Fe, Al dan Cr, selanjutnya dengan adanya asam oksalat dari beberapa logam golongan IIIB,IV dan dari Mg yang tidak larut dalam larutan amoniakal, mungkin akan mengendap pada tahap ini. Maka penting sekali untuk menghancurkan asam-asam organik ini, yang keberadaannya telah ditunjukkan dalam uji pendahuluan, sebelum mengendapkan golongan IIIA. Ini paling baik dilakukan dengan menguapkan menggunakan asam nitrat pekat, sampai residu yang hitam itu teroksidasi sempurna. Residu tidak boleh dipanaskan terlalu keras, karena dapat mengubah setiap Fe, Al atau Cr yang ada dalam bentuk oksida yang sangat sedikit larut dalam HCl pekat. Jika ada asam benzoat atau salisilat, asam bebasnya akan memisah pada penambahan HCl dan karenanya zat-zat ini harus dicari dalam endapan golongan I. Jika sekiranya ada asam salisilat yang lolos ke dalam golongan III, harus berhati-hati ketika menguapkan sampai kering dengan HNO3 pekat, karena asam nitrosalisilat akan meledak pada pemanasan yang
keras.
6. Borat dan fluorida dari logam golongan IIIB, IV dan dari Mg tidak larut dalam larutan amoniakal, maka dapat mengendap dalam tahap ini. Anion- anion ini dapat dihilangkan dengan menguapkan berulang-ulang dengan HCl pekat. Asam borat akan perlahan-lahan menguap dalam uap air dan hidrogen fluorida menguap bersama HCl yang berlebihan.
7. Asam borat bila sendiri dapat lebih cepat dihilangkan sebagai metil borat, B(OCH3)3 yang mudah menguap. Jika asam borat terdapat banyak maka
mungkin diperlukan dua kali pengolahan dengan CH3OH dan HCl.
8. Bila silikat dihilangkan disini, akan dikira sebagai Al(OH)3 pada pemisahan
golongan. Penguapan yang berulang-ulang dengan HCl pekat akan mengubah silikat menjadi silika berhidrat dalam bentuk butiran yang mudah disaring. Endapan ini harus diuji dengan silikon tetrafluorida.
Larutan silikat diuraikan oleh HCl encer menjadi asam silikat, yang mungkin memisah sebagian dalam golongan I dalam bentuk seperti gelatin. Yang belum diendapkan dalam golongan I akan diendapkan oleh larutan NH4Cl dalam
golongan IIIA.
9. Fosfat dari logam-logam golongan IIIA, IIIB,IV dan dari Mg yang tidak larut dalam air dan dalam larutan amoniakal, dan mungkin mengendap pada tahap
ini.
10.Dianjurkan agar suatu bagian kecil filtrat dari golongan III A diuji dahulu dengan sedikit larutan NH3 dan H2S. Jika diperoleh endapan, berarti logam-
logam golongan IIIB tidak ada, maka filtrat utama dari golongan IIIA dapat dipakai untuk menguji ke golongan IV.Harus diingat bahwa kondisi-kondisi untuk pengendapan golongan IIIB berbeda dengan kondisi-kondisi untuk golongan II. Pada golongan II, H2S dialirkan ke dalam larutan yang asam dan
gas ini hanya larut sedikit sehingga banyak daripadanya lolos keluar dan tidak terserap,kecuali jika dipakai, NiS mungkin mengendap sebagian dan membentuk larutan koloid. Ini sebagian besar tercegah dengan mengalirkan H2S selama 30 – 60 detik, serta menguji kesempurnaan dari pengendapan.
11.Cairan pencuci untuk endapan golongan IIIB boleh terdiri dari 1% NH4Cl
yang ditambahkan larutan ammonium sulfida sebanyak 1% volume. Dengan demikian, oksida dari sulfida-sulfida yang basa menjadi sulfat yang larut sangat dikurangi.
12.Jika larutan atau filtrat dari golongan IIIB berwarna coklat atau gelap, mungkin ada Ni. Larutan yang berwarna gelap itu mengandung NiS koloidal, yang dapat menembus kertas saring. Larutan ini dapat diasamkan dengan asam asetat, lalu dididihkan sampai NiS telah berkonjugasi.
13.Filtrat harus segera diasamkan atau dipekatkan untuk menghilangkan H2S.
Larutan ammonium sulfida bila terkena udara, perlahan-lahan teroksidasi menjadi ammonium sulfat lalu mengendapkan semua Ba dan Sr sebagai BaSO4 dan SrSO4. Alasan lain untuk mengasamkan segera filtrat dari
golongan IIIB adalah untuk mencegah penyerapan CO2dari udara yang dapat
mengakibatkan terbentuknya ion karbonat yang dapat mengendapkan logam-logam golongan IV.
14.Filtrat dari golongan IIIB akan mengandung garam-garam ammonium dengan konsentrasi yang sangat tinggi. Konsentrasi ion-ion amonium ini jauh lebih besar dari pada yang perlu untuk mencegah pengendapan Mg(OH)2, dan juga
mungkin mengakibatkan pengendapan yang tidak sempurna dari karbonat-karbonat golongan IV. Efek yang terakhir ini disebabkan oleh kesetimbangan reaksi sebagai berikut ini:
-Hal ini dapat mengurangi konsentrasi ion CO32- bebas dalam larutan yang
mengandung ion-ion ammonium. Oleh sebab itu sebagian besar garam-garam ammonium harus dihilangkan terlebih dahulu. Ini dapat dilakukan dengan penguapan sederhana, atau dengan penambahan HNO3 pekat seperti yang
dianjurkan. Garam ammonium akan terurai pada suhu yang lebih rendah dari pada yang diperlukan untuk penguapan.
NH4+ + HNO3 ↔ NO2 + H+ + 2 H2O
15.Larutan ammonium karbonat ini mengandung banyak ammonium hidrogen karbonat, NH4HCO3 dan oleh karena itu akan membentuk hidrogen karbonat
yang larut dengan logam alkali tanah , kecuali bila ada larutan ammonia berlebihan. Ketika mengendapkan kation golongan IV, larutan harus panas untuk menguraikan setiap hidrogen karbonat yang terbentuk, namun larutan tidak boleh dididihkan, karena dapat terjadi reaksi berikut ini:
MCO3 + 2 NH4+ ↔ M2+ + 2 NH3 + CO2 + H2O
Reaksi akan bergeser ke kanan sewaktu NH3 dan CO2 menghilang.
Ammonium karbonat yang berlebihan juga akan terurai pada temperatur diatas 600C.
2 NH4+ + CO32- ↔ 2 NH3 + CO2 + H2O
16.Kelarutan dari senyawa CaCO3 , SrCO3 dan BaCO3 dalam larutan garam-
garam ammonium, filtrat dari golongan IV akan mengandung sejumlah yang sangat kecil ion-ion logam alkali tanah, nila logam-logam ini ada. Oleh karena logam golongan IV dapat mengganggu sampai batas tertentu pada uji nyala terhadap Na, dan K dan terhadap uji Na2HPO4 terhadap Mg maka dianjurkan
agar filtrat dari golongan IV dipanaskan dengan 1 mL larutan (NH4)2SO4 dan
larutan (COONH4)2 dan disaring dari setiap endapan yang terbentuk.
3.2.Pemisahan dan Identifikasi Kation-kation Golongan I
Residu sesudah penyaringan endapan yang terdiri dari asam klorida encer mungkin mengandung ion-ion Pb2+ ; Ag+ ; Hg22+ . Pemisahan dan identifikasinya
dapat dilakukan menurut skema yang diperlihatkan pada Tabel 2.
Endapan mungkin mengandung PbCl2 ; AgCl ; dan Hg2Cl2 . Cucilah endapan
di atas saringan, mula-mula dengan 2 mL HCl 2 M, lalu 2 – 3 kali dengan air dingin 1 mL setiap kalinya, dan buang air cucian. Pindahkan endapan ke sebuah gelas piala atau ke tabung pendidihan dan didihkan dengan 5 – 10 mL air. Saring dalam keadaan panas (1).
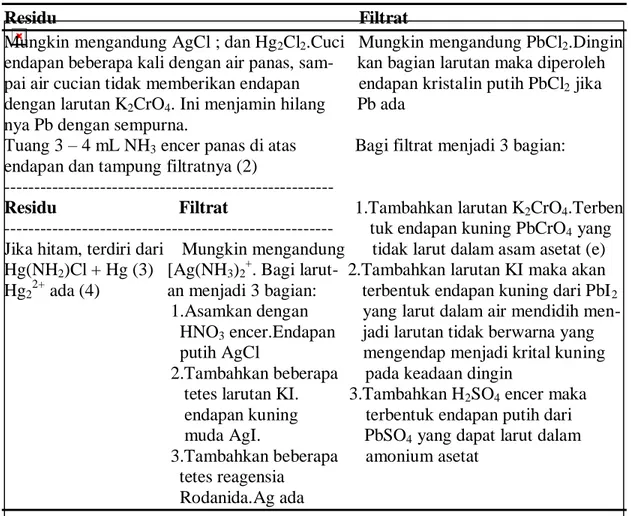
Tabel 3.2. Pemisahan dan identifikasi kation-kation golongan I Residu Filtrat
Mungkin mengandung AgCl ; dan Hg2Cl2.Cuci Mungkin mengandung PbCl2.Dingin
endapan beberapa kali dengan air panas, sam- kan bagian larutan maka diperoleh pai air cucian tidak memberikan endapan endapan kristalin putih PbCl2 jika
dengan larutan K2CrO4. Ini menjamin hilang Pb ada
nya Pb dengan sempurna.
Tuang 3 – 4 mL NH3 encer panas di atas Bagi filtrat menjadi 3 bagian:
endapan dan tampung filtratnya (2)
---
Residu Filtrat 1.Tambahkan larutan K2CrO4.Terben
--- tuk endapan kuning PbCrO4 yang
Jika hitam, terdiri dari Mungkin mengandung tidak larut dalam asam asetat (e) Hg(NH2)Cl + Hg (3) [Ag(NH3)2+. Bagi larut- 2.Tambahkan larutan KI maka akan
Hg22+ ada (4) an menjadi 3 bagian: terbentuk endapan kuning dari PbI2
1.Asamkan dengan yang larut dalam air mendidih men- HNO3 encer.Endapan jadi larutan tidak berwarna yang
putih AgCl mengendap menjadi krital kuning 2.Tambahkan beberapa pada keadaan dingin
tetes larutan KI. 3.Tambahkan H2SO4 encer maka
endapan kuning terbentuk endapan putih dari muda AgI. PbSO4 yang dapat larut dalam
3.Tambahkan beberapa amonium asetat tetes reagensia
Rodanida.Ag ada
Catatan dan penjelasan dari pemisahan dan identifikasi kation-kation golongan I: 1.Ion-ion timbal, perak dan merkurium(I) masing-masing diendapkan oleh HCl encer sebagai klorida yang tidak larut, yaitu sebagai PbCl2; AgCl ; dan Hg2Cl2.
Klorida dari logam-logam umum lainnya semua larut. Diantara endapan- endapan ini, PbCl2 larut dalam air mendidih, sedangkan AgCl ; dan Hg2Cl2 tidak larut. Maka ekstraksi endapan dengan air panas dapat memisahkan PbCl2.
Uji-uji identifikasi untuk ion timbal adalah sebagai berikut: Pb2+ + CrO42- → PbCrO4 (s)
2.AgCl dapat larut dalam larutan NH3 encer, menghasilkan ion kompleks yang
larut [Ag(NH3)2]+. Kompleks ini diuraikan baik oleh larutan HNO3 encer
maupun oleh larutan KI dengan masing-masing mengendapkan garam AgCl dan AgI yang tidak larut.
AgCl + 2 NH3 → [Ag(NH3)2]+ + Cl
[Ag(NH3)2]+ + Cl- + 2 H+ → AgCl ↓ + 2 NH4+
[Ag(NH3)2]+ + I- → AgI ↓ + 2 NH3
Reagensia rodanida memberikan endapan dengan larutan [Ag(NH3)2]+. Dengan
demikian setiap gangguan dari merkurium dan tembaga(I) telah dihapuskan. 3.Pengubahan Hg2Cl2 oleh larutan NH4OH encer menjadi campuran hitam yang
tidak larut yaitu senyawa merkurium amido klorida, Hg(NH2)Cl, dan
merkurium yang berbutir halus.
Hg2Cl2 ↓ + 2 NH3 → Hg(NH2)Cl + Hg ↓ + NH4+ + Cl-
Air raja mengubah campuran hitam ini menjadi HgCl2, dan merkurium (II)
dideteksi dengan larutan SnCl2.
HgCl2↓ + Sn2+ → Hg2Cl2 ↓ + Sn4+ + 2Cl-
Hg2Cl2 ↓ + Sn2+ → 2Hg ↓ + Sn4+ + 2Cl-
4.Ini adalah suatu uji yang memastikan terhadap merkurium(I). Bisa dipastikan lebih lanjut dengan melarutkan endapan dalam 3 – 4 mL air raja yang mendidih, mengencerkannya, menyaringnya jika perlu dan menambahkan larutan SnCl2.
5.Jika Hg ada dalam jumlah cukup banyak dan Ag belum dideteksi, mahasiswa dapat melakukan uji pemastian terhadap Hg dengan larutan NH3 encer. Saring,
jika perlu tambahkan HNO3 encer kepada larutan. Endapan putih AgCl akan
terbentuk jika ada Ag dalam junlah sedikit. LATIHAN
1. Sebutkan nama-nama kation golongan I, dan jelaskan sifat-sifat yang mendasari sehingga kation-kation tersebut dikelompokkan menjadi golongan I.
2. Tuliskan skema pemisahan kation-kation golongan I, gunakan flow chart untuk menjelaskan pemisahan satu kation dengan kation yang lain sampai semua kation dapat dipisahkan.
3. Jelaskan kesalahan-kesalahan yang harus dihindari dalam pemisahan ion-ion logam kedalam golongan-golongan.
5. Tuliskan reaksi identifikasi kation golongan I, untuk ion Ag+ 6. Tuliskan reaksi identifikasi kation golongan I, untuk ion Hg22+
7. Jelaskan bagaimana cara memisahkan endapan PbCl2 dengan endapan AgCl
dan Hg2Cl2
8. Jelaskan bagaimana cara memisahkan endapan AgCl dengan Hg2Cl2
9. Pengubahan Hg2Cl2 oleh larutan NH4OH encer akan menjadi campuran yang
berwarna hitam yang tidak larut. Tuliskan reaksi yang terjadi.
10.Tuliskan reaksi identifikasi adanya ion Hg22+ dalam bentuk endapan Hg2Cl2
Dengan larutan SnCl2.
UJI KOMPETENSI
1.Dalam pemisahan kation-kation dalam golongan-golongan maka sering terjadi kesalahan-kesalahan. Jelaskan beberapa kesalahan yang sering terjadi terutama dalam pemisahan katio-kation dalam golongan II.
2.Tuliskan skema pemisahan kation dalam golongan –golongan sampai pada golongan II saja.
3.Tuliskan skema pemisahan kation gologan I secara lengkap.
4.Bagaimana cara memisahkan endapan PbCl2 dengan endapan AgCl dan Hg2Cl2
Tuliskan reaksi yang terjadi
5.Jelaskan bagaimana cara memisahkan endapan AgCl dengan Hg2Cl2. Tuliskan
reaksi yang terjadi.
6.Tuliskan reaksi identifikasi untuk kation-kation berikut ini: a. Pb2+
b. Ag+ c. Hg22+
BAB IV
ANALISIS KATION GOLONGAN II
Hg2+, Bi3+, Pb2+, Cu2+ dan Cd2+, Sb3+, Sb5+, Sn2+ dan Sn4+
4.1.Pendahuluan
Kation golongan II terdidi dari: Hg2+, Bi3+, Pb2+, Cu2+ dan Cd2+, Sb3+, Sb5+, Sn2+ dan Sn4+. Kation-kation golongan II diendapkan sebagai endapan sulfida dalam suasana asam kuat. Dalam pengendapannya sulfida dengan mudah dipisahkan menjadi dua golongan pada dasarnya CuS, Bi2S3, CdS, HgS dan PbS tidak larut
dalam larutan basa, akan tetapi SnS2 dan Sb2S3 memiliki kecendrungan membentuk
ion kompleks hidrokso yang larut, Sn(OH)62- dan Sb(OH)4-.
Sulfida dari tembaga, bismut, kadmium dan timbal larut dengan asam nitrat, sedangkan HgS tidak. Selanjutnya larutan ini dibasakan dengan amonia dan membentuk kompleks Cu(NH3)42+ dan Cd(NH3)42+, sedangkan Bi3+, Pb2+ mengendap
sebagai hidroksida dan garam basa. Dengan hadirnya Cu larutan berwarna biru dari kompleks Cu(NH3)42+dan ion logam direduksi oleh hidrosulfit menjadi logam Cu,
sedangkan kadmium diendapkan menjadi CdS yang berwarna kuning.
Endapan dari HgS larut dengan air raja. Kehadiran dari merkuri dapat diidentifikasi dengan mereaksikannya dengan logam tembaga dan larutan kalium jodida. Larutan yang mengandung Sn(OH)62- dan Sb(OH)4- dalam suasana asam, akan
mengendapkannya sebagai sulfida dari SnS2 dan Sb2S3. Setelah dilarutkan dengan
asam, sebahagian dari larutan direduksi dengan logam Al menjadi Sn2+ dan selanjutnya dengan HgCl2 akan membentuk Hg dan Hg2Cl2.
4.2. Reaksi – reaksi spesifik dari ion tembaga
Asam sulfida.: ion tembaga dengan hidrogen sulfida membentuk endapan CuS yang berwarna hitam, reaksi yang terjadi sbb:
Cu2+ + H2S → CuS ↓ + 2 H+
CuS tidak larut dalam asam,basa dan tidak seperti sulfida lainnya, tetapi larut dengan HNO3 6 M panas dengan reaksi sbb:
3 CuS ↓ + 2 NO3- + 8 H+ → 3 Cu2+ + 2 NO + 3 S↓ + 4 H2O
Natrium hidroksida : dengan reagent ini dihasilkan endapan biru terang dari Cu(OH)2 dan bila dilarutkan dengan NaOH yang pekat dapat membentuk
larutan kompleks dari Cu(OH)42-.
Ammonia: penambahan amonia pada endapan Cu(OH)2 akan menghasilkan
larutan biru gelap dari ion kompleks tembaga(II): Cu(OH)2 ↓ + 4 NH3 ↔ Cu(NH3)42+ + 2 OH
-Kalium ferosianida: dengan hadirnya reagensia ini, menghasilkan endapan merah coklat dari Cu2[Fe(CN)6]
2 Cu2+ + [Fe(CN)6]4- → Cu2[Fe(CN)6] ↓
Kalium Jodida:bila larutan ini ditambahkan ke dalam larutan yang mengandung ion tembaga, maka reaksi redoks akan terjadi, membentuk warna coklat dari I2 dan endapan putih dari tembaga jodida
2 Cu2+ + 4 I- → 2 CuI↓ + I2
Pengoksidasi dan pereduksi: ion kupri sangat mudah direduksi menjadi ion logam, seperti halnya ion besi dan seng. Juga dapat direduksi dengan hidrosulfit atau ion dithionit, S2O42-, lebih dahulu menjadi kupro selanjutnya
menjadi logam tembaga
Cu2+ + S2O42- + 4 H2O → Cu + 2 SO32- + 2 NO↑ + 4 H+
4.3. Reaksi – reaksi spesifik dari ion Bismut
Hidrogen sulfida: bismut dengan H2S membentuk endapan berwarna coklat
gelap dan tidak larut dalam asam dan basa dalam suasana dingin, tetapi dalam HNO3 6M panas dan 12 M HCl dapat larut. Juga tidak larut di dalam larutan
NaOH.
Air: jika larutan garam bismut ditambahkan air dalam jumlah yang besar maka akan terjadi endapan putih dari garam bismut.
Bi3+ + Cl- ↔ BiOCl ↓ + 2 H+
Natrium hidroksida dan amonia: dengan larutan basa dihasilkan endapan bismut hidroksida, yang mana endapan ini tidak larut dengan kelebihan reagen.Hidroksida ini larut dengan asam kuat yang pekat.
Pengoksidasi dan pereduksi: ion bismut dapat direduksi menjadi logam dengan larutan Sn2+. Reaksi yang terjadi adalah sbb:
2 Bi3+ + 3 Sn2+ → 2 Bi↓ + 3 Sn4+
Akan tetapi dalam larutan basa, Bi(III) dengan kelebihan hidroksida dan adanya Sn2+ dan Sn4+ akan membentuk kompleks Sn(OH)42- dan Sn(OH)62- :
2 Bi(OH)3 ↓ + 3 Sn(OH)42- → 2 Bi↓ + 3 Sn(OH)62-
untuk menentukan adanya bismut. Bismut larut di dalam HNO3 6 M panas
dan 18 M H2SO4 panas.
4.4. Reaksi – reaksi spesifik dari ion Merkuri
Asam sulfida: dengan adanya H2S, Hg2+ akan membentuk endapan hitam dari
HgS . Dengan 6 M HNO3 panas atau 6 M HCl panas, HgS tidak dipengaruhi,
akan tetapi akan membentuk kompleks HgS22- di dalam NaOH 6 M panas.
Merkuri sulfida juga larut di dalam air raja.
HgS↓ + 12 Cl- + 2 NO3- + 8 H+↔ 3 HgCl42- + 2 NO↑ + 3 S↓ + 4 H2O
Natium hidroksida: dengan reagensia ini diperoleh endapan kuning dari HgO, yang tidak larut dengan kelebihan basa, tetapi dengan kelebihan asam larut.
Kalium Jodida: ion Hg2+ bereaksi dengan ion jodida menghasilkan endapan merah dari HgI2, yang larut dengan mudah dengan kelebihan reagen
membentuk ion kompleks HgI42- yang tidak berwarna.
Amonia: terbentuk endapan putih yang sangat cepat larut dengan garam basa amido seperti HgNH2Cl, akan tetapi tidak larut dengan kelebihan reagensia.
Garam ini larut dalam asam
HgNH2Cl ↓ + 2 H+ + Cl- ↔ HgCl2 + NH4+
4.5. Reaksi – reaksi spesifik dari ion Kadmium
Asam sulfida: dengan H2S membentuk endapan kuning dari CdS. Sulfida ini
sangat cepat larut dengan larutan klorida, bromida dan jodida membentuk kompleks. Sulfida ini juga larut di dalam HNO3 6 M panas dan 6M H2SO4
panas
CdS+ 2 H+ ↔Cd2+ + H2S
CdS tidak larut di dalam larutan NaOH
Natrium hidroksida: endapan putih dari Cd(OH)2 akan dihasilkan yang tidak
larut dengan kelebihan reagensia.
Amonia: mula-mula dihasilkan endapan Cd(OH)2 , yang akan larut dengan
kelebihan amonia membentuk ion kompleks Cd(NH3)42+ yang tidak berwarna.
Pengoksidasi dan pereduksi: logam kadmium adalah pereduksi yang baik.Dengan menggunakan 6 M HNO3 panas, kadmium juga larut dengan
4.6. Reaksi – reaksi spesifik dari ion Sn(II) dan Sn(IV)
Asam sulfida:dengan H2S membentuk endapan coklat dari SnS dan endapan
kuning dari SnS2. Dengan NaOH yang mengandung ion S2-, endapan ini larut,
dengan larutan HCl akan membentuk ion kompleks kloro dan hidrokso. Sn(IV) membentuk kompleks oksalato yang stabil SnS2 tidak larut di dalam
NaOH, tetapi larut di dalam 6 M HCl, membentuk ion kompleks SnCl42-.
Natrium hidroksida: dengan reagensia ini dihasilkan endapan putih Sn(OH)2 atau Sn(OH)4 dari larutan Sn(II) dan Sn(IV). Kedua senyawa ini
dengan cepat larut membentuk kompleks Sn(OH)42- dan Sn(OH)62- dengan
kelebihan reagen.
Amonia: dalam NH3 dibentuk hidroksida yang putih yang tidak larut dengan
kelebihan reagen.
Pereduksi: di dalam larutan HCl logam besi atau aluminium akan mereduksi Sn(IV) menjadi Sn(II)
2 Al↓ + 3 SnCl62- → 2 Al3+ + 3 SnCl42- + 6 Cl
-4.7. Reaksi – reaksi spesifik dari ion Sb(III) dan Sb(V)
Asam sulfida: Dibawah kondisi asam sedang, H2S aion Sb(III) dan Sb(V)
akan membentuk endapan merah oranye dari Sb2S3 dan Sb2S5. Sulfida ini
larut di dalam NaOH panas dan HCl 6 M panas, karena membentuk kompleks hidokso dan kloro yang stabil.
Air: larutan Sb(III)klorida di dalam HCl membentuk garam SnOCl putih yang tidak larut, bila ditambahkan air berlebih.Reaksi ini mirip dengan apa yang diperlihatkan oleh larutan garam bismut. Untuk membedakan keduanya adalah dengan menggunakan asam tartarat, garam bismut tidak larut sedangkan antimon larut
2 SbOCl↓ + 3 C4H4O62- + 4 H+ ↔ Sb2(C4H4O6)3 + 2 H2O + 2 Cl-
Natrium hidroksida: endapan putih dari hidroksida yang bersifat amfoter dan dengan mudah larut dengan kelebihan hidroksida atau asam kuat.
Amonia: dihasilkan endapan garam basa dengan larutan antimon, garam ini tidak larut dengan kelebihan NH3, akan tetapi larut di dalam asam atau basa
4.8. Prosedur Analisis kation Golongan II H2O2 HCl, tioacetamida NaOH HNO3 HNO3, HCl NH3 KI Cu HCl Na2S2O4 NaC2H3O2 H2O HCl H2SO4 NaOH,SnCl2 tioacetamida HCl
NaOH, asam oksalat Al tioasetamida HgCl2 Cu2+, Bi3+, Cd2+, Hg2+, Sn2+, Sn4+, Sb3+, Sb5+, (Pb2+) Cu2+, Bi3+, Cd2+, Hg2+, Sn4+, Sb3+, Sb5+, (Pb2+) CuS, Bi2S3, CdS, PbS, HgS, SnS2, Sb2S3, Sb2S5 CuS, Bi2S3, CdS, PbS, HgS HgS Cu2+, Bi3+, Cd2+,Pb2+ HgCl4
2-Bi(OH)3, garam Pb Cu(NH3)42+,Cd(NH3)42+,biru
HgI2 oranye Hg mengkilap PbCl 2 Bi3+ Pb(C2H3O2)2 BiOCl putih
PbSO4,putih Bi, hitam
Cu coklat Cd(NH3)42+ CdS,kuning Sn(OH)62-,Sb(OH)4- SnS2, Sb2S3 SnCl62-, SbCl63- Sn2+ Hg2Cl2,putih, Hg hitam Sb2S3 merah-oranye
LATIHAN
1.Sebutkan nama-nama kation golongan II
2.Jelaskan langkah-langkah pemisahan kation golongan II dengan skema 3.Tuliskan reaksi identifikasi dari ion Pb2+
4.Tuliskan reaksi identifikasi dari ion Hg2+ 5.Tuliskan reaksi identifikasi dari ion Cd2+ 6.Tuliskan reaksi identifikasi dari ion Cu2+ 7.Tuliskan reaksi identifikasi dari ion Bi3+ 8.Tuliskan reaksi identifikasi dari ion Sn2+ 9.Tuliskan reaksi identifikasi dari ion Sn4+ 10.Tuliskan reaksi identifikasi dari ion Sb3+ 11.Tuliskan reaksi identifikasi dari ion Sb5+
UJI KOMPETENSI
1.Dengan melarutkan endapan golongan II dengan larutan NaOH, maka sulfida- sulfida dari Sb dan Sn melarut, sedangkan sulfida-sulfida dari Hg, Pb, Bi, Cu dan Cd tidak larut. Tuliskan reaksinya secara lengkap.
2.Jelaskan reagen apa yang digunakan untuk memisahkan endapan HgS terhadap endapan PbS, Bi2S3, CuS dan CdS. Tuliskan reaksinya secara lengkap.
3.Tuliskan reaksi identifikasi dari kation-kation berikut: a. Sb3+
b. Cu2+ c. Pb2+ d. Bi3+ e. Cd2+
4.Jelaskan disertai dengan reaksi bagaimana dapat membedakan Bi3+ dengan Sb3+ 5.Jelaskan disertai reaksi, yang mana dari hidroksida Cu(OH)2, Cd(OH)2, Bi(OH)3
dan Pb(OH)2 yang larut dengan kelebihan :
a. NH3
6.Jelaskan mengapa:
a. Dengan penembahan H2S dalam larutan asam dapat memisahkan kation golongan
II dengan kation golongan III
BAB V
ANALISIS KATION GOLONGAN III
5.1.Pendahuluan
Kation golongan III semuanya membentuk endapan dalam larutan buffer amonia/amonium klorida yang mengandung H2S dalam bentuk tioasetamida.
Golongan ini disebut sebagai kelompok hidrogen sulfida basa, atau golongan besi-aluminium. Semua kation yang tidak mengendap dalam analisis kation golongan I dan golongan II melalui penambahan HCl dan H2S dalam suasana dingin akan
mengendap dalam golongan ini. Senyawa sulfida golongan III memiliki hasil kali kelarutan (Ksp) lebih besar di banding senyawa sulfida golongan II, sehingga untuk membentuk endapan dibutuhkan kosentrasi S2- yang lebih tinggi dalam suasana basa (pH sekitar 9,0).
Dua kation dalam golongan III, yaitu Aluminium dan Kromium membentuk endapan hidroksida yang sedikit larut dalam air. Kehadiran ion hidroksida di dalam larutan amonia telah mencukupi untuk dapat mengendapkan hidroksida sehingga kation akan mengendap sempurna dalam bentuk hidroksida. Yang menjadi pertanyaan adalah mengapa yang mengendap itu adalah hidroksida dan bukan sulfida ?.Hal ini disebabkan kesetimbangan ion terkecil yang terdapat di dalam larutan itu sendiri. Dalam tahapan pemisahan melalui pembentukan endapan, hanya ion Magnesium yang membentuk hidroksida, akan tetapi hidroksidanya lebih mudah larut bila dibandingkan dengan aluminium dan krom, sehingga dalam pembentukan endapannya sangat diperlukan konsentrasi OH- lebih tinggi dengan kehadiran ion NH4+.
Senyawa kompleks dari kation golongan III umumnya membentuk warna yang bervariasi disebabkan oleh bilangan oksidasi yang berbeda-beda, terutama oleh orbital d yang belum terisi penuh. Senyawa kompleks yang bervariasi warna ini dapat digunakan untuk mengidentifikasi adanya kation golongan III. Akan tetapi harus diingat bahwa identifikasi berdasarkan warna saja tidak cukup, karena dapat memberikan hasil identifikasi yang salah.
5.2.Skema Analisis Kation Golongan III
NH4Cl; NH3; tioasetamida (1)
HCl (2)
HCl, HNO3 (3) NaClO; NaOH; NH3 (6)
NH4SCN (4) dimetilglyoksim (5) H2SO4(7) HC2H3O2 NH3 (13) H2SO4 (8) (10) KSCN H2O2 NH3(10) HC2H3O2 BaCl2 (15) Catecol (14) violet HNO3 NaBiO3 (9) HNO3 (16) H2O2 tioasetamida (12) dimetilglyoksim (11) K4Fe(CN)6 (17) NaOH, HCl Fe2+,Fe3+, Al3+, Zn2+, Mn2+, Cr3+, Co2+, Ni2+, (Cd2+)
FeS, Al(OH)3, ZnS, MnS, Cr(OH)3, CoS, NiS, CdS
CoS, NiS Fe3+, Al3+, Zn2+, Mn2+, Cr3+, Ni2+, ,Cd2+ Ni2+, Co2+, Ni2+ Co(SCN)4 2-biru NiC8H14N4O4 merah-ros
Fe(OH)3, MnO2, Ni(OH)2, Cd(OH)2 CrO42-, Al(OH)4-, Zn(OH)4
2-MnO2 Fe 3+ , Ni2+, Cd2+ Mn2+ FeSCN 2+ , merah MnO4 -ungu Al(OH)3 CrO4 2-,Zn(NH3)42+ Al3+ kompleks biru BaCrO4 Cr2O72- CrO5 biru Fe(OH)3 coklat Ni(NH3)62+ NiC8H14N4O4 merah-ros Cd(NH3)42+ CdS kuning Zn(NH3)42+ K2Zn3[Fe(CN)6]2, hijau K2Zn3[Fe(CN)6]2 , hijau
5.3.Prosedur Analisis Kation Golongan III Tahap 1.
Larutan hasil pemisahan kation golongan II dimasukkan kedalam gelas kimia 50 mL, kemudian dipanaskan sampai mendidih untuk menghilangkan ion sulfida dalam bentuk asam sulfida , lalu ditambahkan 1 mL NH4Cl dan aduk. Tambahkan
tetes demi tetes 6 M NH3 sampai larutan bersifat basa (pakai lakmus) selanjutnya
lebihkan 0,5 mL 6 M NH3. Kemudian tambahkan 1 mL 1 M tioasetamida, aduk
dengan baik , tempatkan dalam penangas air selama 5 menit, setelah 2 menit warna endapan berhenti berubah. Sentrifus larutan, lalu dekantasi, tambahkan beberapa tetes 1 M asetamida ke dalam cairan, panaskan beberapa menit dalam penangas air. Periksa endapan sebagai golongan III dan filtrat simpan untuk golongan IV.Cuci endapan dengan 1 mL NH4Cl 1 M, 2 mL air dan beberapa tetes 6 M NH3, aduk
dengan baik dan sentrifus. Buang air cucian. Tahap 2.
Endapan dari tahap 1 yang mengandung sulfida atau hidroksida kation golongan III, tambah 1 mL 6 M HCl dan 1 mL air. Campur, didihkan beberapa menit, residu hitam sebagian besar menunjukkan adanya CoS dan NiS. Tambahkan 1 mL air, aduk dan masukkan ke dalam tabung. Sentrifus dan dekantasi ,cairan mungkin mengandung Al3+, Fe2+, Zn2+, Cr3+ dan Mn2+, sama baiknya dengan Ni2+dan Cd2+, masukkan ke dalam tabung (label 2). Cuci padatan dengan 1 mL 6 M HCl dan 2 mL air. Sentrifus dan buang air cucian.
Tahap 3.
Endapan dari tahap ke 2, tambahkan 0,5 mL 6 M HCl dan 0,5 mL 6 M HNO3.Putar dan tempatkan dalam tabung reaksi di dalam penangas air beberapa
menit.Endapan akan larut, tambahkan 2 mL air dan campur dengan baik. Tahap 4.Konfirmasi adanya ion kobal
Sedikit larutan dari tahap 3 masukkan ke dalam tabung reaksi, tambahkan 1 mL larutan NH4SCN jenuh di dalam etanol. Jika kobal ada akan terbentuk larutan
biru dari Co(SCN)42 -. Sebagian dari larutan ini tambah NaOH 6 M tetes demi tetes,
melarutkan endapan. Ke dalam larutan ini tambahkan 0,4 g KNO2 padat dan aduk.
Endapan kuning dari K3Co(NO2)6 dalam beberapa menit menunjukkan adanya kobal.
Tahap 5.Konfirmasi adanya ion nikel.
Sebagian larutan dari tahap 4 tambah 0,5 mL reagen dimetilglyoksim. Endapan merah-ros menunjukkan hadirnya Ni.
Tahap 6.
Larutan dari tahap 2 tambah 6 M NaOH tetes demi tetes sampai larutan basa dan lebihkan 0,5 mL. Masukkan kedalam gelas kimia 50 mL, didihkan 2 menit, aduk dan tambah 1 mL 1 M NaClO, aduk selama 30 detik. Pindahkan ke dalam tabung dan sentrifus. Dekantasi, cairan mungkin mengandung Al(OH)4-, Zn(OH)42- dan CrO4
2-(buat label 6). Cairan yang berwarna kuning, menunjukkan hadirnya kromium. Cuci padatan dua kali dengan 2 mL air dan 0,5 mL 6 M NaOH, sertifus dan buang air cucian.
Tahap 7.
Endapan dari tahap ke 6, mungkin mengandung Fe(OH)3, MnO2, Ni(OH)2 dan
Cd(OH)2 , tambahkan 1 mL air dan 1 mL 3 M H2SO4. Putar dan panaskan beberapa
menit dalam penangas air, sentrifus padatan yang tidak larut mungkin mengandung MnO2. Dekantasi cairan, mungkin mengandung Fe3+, Ni2+, Cd2+, masukkan ke dalam
tabung (label 7). Cuci endapan dengan 2 mL air dan 1 mL 6 M H2SO4 sentrifus dan
buang air cucian. Tahap 8.
Endapan dari tahap 7, tambahkan 1 mL air dan 1 mL 3 M H2SO4, putar dan
kemudian tambahkan 1 mL 3% H2O2. Letakkan tabung di dalam penangas air
beberapa menit.Endapan akan larut dengan cepat setelah diaduk dengan kemungkinan sejumlah kecil ada residu.
Tahap 9. Konfirmasi adanya ion mangan.
1 mL cairan dari tahap 8 masukkan kedalam tabung dan tambahkan 1 mL 6 M HNO3. Tambahkan 0,4 g NaBiO3 padat dengan spatula, aduk dengan baik, lebihkan
sedikit bismutat. Campur dan sentrifus. Jika ada warna ungu, ini berarti terbentuk MnO4-, yang berarti Mangan positif.
Tahap 10. Konfirmasi hadirnya ion besi
Sedikit cairan dari tahap 7, tambahkan 2 mL air dan 2 atau 3 tetes 0,5 M KSCN. Pembentukan warna merah dari larutan FeSCN2+ menunjukkan hadirnya Fe. Tahap 11.Alternatif konfirmasi adanya ion nikel
Larutan dari tahap 10 mungkin mengandung Ni(NH3)62+ dan Cd(NH3)42+.
Setengah dari larutan ini tambah 0,5 mL dimetilglyoksim. Pembentukan warna merah – ros menunjukkan adanya nikel.
Tahap 12.Alternatif konfirmasi hadirnya ion kadmium
Jika kadmium tidak ditemukan pada golongan II, sebagian larutan dari tahap 10, tambahkan 6 M asam asetat hingga larutan bersifat asam (pakai lakmus). Kemudian tambahkan 1 mL tioasetamida dan letakkan tabung dalam penangas air. Jika kadmium hadir, endapan kuning dari CdS akan terbentuk dalam beberapa menit. Tahap 13.
Kembali ke larutan dari tahap 6, tambahkan 6 M asam asetat aduk hingga larutan bersifat asam. Jika mungkin didihkan larutan hingga 3 mL. Ke dalam tabung reaksi ini tambahkan 6 M NH3 tetes demi tetes, tambahkan berlebih 0,5 mL. Aduk
sampai tercapai kesetimbangan. Jika aluminium hadir, akan terbentuk endapan gelatin dari Al(OH)3 yang berwarna kuning. Sentrifus, padatan keluarkan, larutan dekantasi,
mungkin mengandung CrO42- dan Zn(NH3)42+.
Tahap 14.Konfirmasi hadirnya ion aluminium.
Cuci endapan pada tahap 13 dengn 3 mL air sekali atau dua kali, selagi tabung dipanaskan dalam penangas air, aduk dengan baik. Sentrifus dan buang air cucian. Larutkan endapan dengan 2 tetes 6 M asam asetat. Tambahkan 3 mL 2 tetes reagen katekol violet dan aduk. Jika aluminium hadir larutan akan segera berwarna biru. Tahap 15.
Jika larutan pada tahap 13 kuning, kemungkinan krom ada, jika tidak berwarna berarti krom tidak ada.. Untuk meyakinkan bahwa ada krom, tambahkan 0,5 mL 1 M BaCl2. Jika terbentuk endapan kuning dari BaCrO4 berarti krom ada, bisa
penangas air beberapa menit, sentrifus , dekantasi cairan ke dalma tabung. Cuci endapan dengan 2 mL air, sentrifus dan buang air cucian.
Step 16. Konfirmasi hadirnya ion krom
Endapan pada tahap 15, tambahkan 0,5 mL 6 M HNO3 dan putar untuk
melarutkan BaCrO4. Tambahkan 1 mL air, aduk, larutan oranye dan tambahkan 2
tetes 3% H2O2. Larutan biru yang terbentuk menunjukkan hadirnya ion krom.
Step 17. Konfirmasi hadirnya ion seng.
Jika anda rasa krom hadir, gunakan larutan pada tahap 15. Jika anda yakin krom tidak ada, gunakan larutan dari tahap 13. Buat larutan menjadi bersifat asam dengan menambahkan tetes demi tetes 6 M HCl. Tambahkan 3 tetes berlebih, kemudian 3 tetes 0,2 M K4Fe(CN)6, dan aduk. Jika seng hadir akan terbentuk
endapan warna hijau dari K2Zn3[Fe(CN)6]2. Sentrifus endapan, dekantasi cairan, dan
buang air cucian. Tambahkan 5 tetes 6 M NaOH ke dalam endapan dengan cepat endapan akan larut, aduk, jika mungkin panaskan dalam penangas air. Jika residu tidak larut, sentrifus dan dekantasi cairan ke dalam tabung. Ke dalam cairan ini tambahkan 0,5 mL air dan 6 M HCL tetes demi tetes sampai asam. Adanya endapan hijau, konfirmasi bahwa seng hadir.
5.4.Reaksi-reaksi identifikasi a.Besi(II) dan Besi(III)
Kalium ferro sianida. Dengan Fe3+akan menghasilkan endapan biru, tetapi dengan Fe2+ menghasilkan endapan putih.
K+ + Fe3+ + Fe(CN)64- → Kfe[Fe(CN)6] ↓
Kalium tiosianat. Reagen ini sensitif dengan Fe3+ membentuk kompleks Fe(III) tiosianat dan kation Fe2+ tidak mengganggu
Fe3+ + SCN - ↔ FeSCN2+
Pengoksidasi dan pereduksi. Ion Fe2+, mudah di oksidasi menjadi Fe3+ oleh udara, juga di dalam H2O2 , dalam asam atau asam nitrit pekat yang dapat
digunakan untuk pengoksidasi yang cepat bila dibutuhkan. Pereaksi H2S,
SnCl2 dan KI semuanya dapat mereduksi Fe3+ menjadi Fe2+ dibawah kondisi
2 Fe2+ + H2O2 + 2 H+ → 2 Fe3+ + 2 H2O
2 Fe3+ + 2 I- 2 Fe2+ + I2
Logam besi adalah pereduksi yang baik. Sangat mudah larut di dalam HCl encer dan H2SO4 dan menghasilkan hidrogen dan membentuk ion Fe2+. Juga larut di
dalam asam pengoksidasi seperti HNO3 encer, dalam hal ini besi dioksidasi
menjadi Fe3+, dan ion NO3- lebih disukai dari padareduksi dengan ion H+
b.Aluminium
Natrium hidroksida. Di dalam larutan basa ion sulfida tidak mengendap dengan Al(III) sebagai garam sulfida. Malahan, diperoleh gelatin putih yang tidak larut Al(OH)3. Tidak terjadi reaksi dengan H2S dalam larutan asam.
Kecendrungan ini konsisten dengan fakta bahwa Al2S3 disiapkan secara
langsung dengan mereaksikan aluminium dan belerang dengan air untuk menghasilkan Al(OH)3 dan H2S:
Al2S3 ↓ + 6 H2O → Al(OH)3↓ + 3 H2S
Natrium hidroksida. Dengan larutan basa kuat, diperoleh endapan gelatin putih Al(OH)3, yang sangat mudah larut dengan kelebihan reagen
Al(OH)3↓ + OH- ↔ Al(OH)4-
c.Seng
Amonia. Larutan amonia akan menghasilkan endapan putih dari Zn(OH)2,
yang mana endapan ini dapat larut dan membentuk ion kompleks dengan kelebihan reagen.
Zn(OH)2↓ + 4 NH3 ↔ Zn(NH3)42+ + 2 OH
-Kalium Ferrosianida. Larutan K4[Fe(CN)6] menghasilkan endapan putih dari
K2Zn3[Fe(CN)6]2, yang kemudian berwarna biru-hijau dengan hadirnya
sedikit besi.
Natrium Hidroksida. Larutan basa kuat menghasilkan endapan gelatin Zn(II) putih, Zn(OH)2 yang mudah larut dengan kelebihan reagen menghasilkan
d. Mangan
Pengoksidasi dan Pereduksi
Hidrogen Peroksida. Di dalam larutan basa senyawa Mn(II) di oksidasi dan dihasilkan endapan warna coklat dari MnO2:
Mn(OH)2↓ + H2O2 → MnO2↓ + 2 H2O
Di dalam larutan asam, H2O2 mereduksi MnO2:
MnO2↓ + H2O2 + 2 H+→Mn2+ + O2↑ + 2 H2O
Tanpa reduksi atau oksidasi MnO2 lambat terbawa ke dalam larutan.
Ion Hipoklorit. Di dalam larutan basa ion ClO- akan mengoksidasi Mn(VII) menjadi ion MnO4-. Ion yang berwarna ungu ini akan direduksi amonia
menghasilkan MnO42 - yang berwarna hijau, yang mana dengan kelebihan amonia
akan direduksi menjadi MnO2 :
2 Mn(OH)2↓ + 5 ClO- + 2 OH-→ 2 MnO4-+ 5 Cl- + 3 H2O
Natrium Bismutat. Di dalam HNO3 encer, BiO3- akan mengoksidasi
Mn2+menjadi MnO4- yang berwaarna ungu tanpa pemanasan. Hal ini sangat
penting di laboratorium yang banyak menggunakan NaBiO3, senyawa Bi(V) yang
paling mudah untuk mengidentifikasi mangan di dalam campurannya dengan senyawa kation lainnya:
2 Mn2++ 5 BiO3- + 14 H+→ 2 MnO4-+ 5 Bi3++ 7 H2O
Natrium Hidroksida dan Amonia. Larutan ini memberikan endapan putih Mn(OH)2, yang punya kecendrungan keruh bila terkena udara karena senyawa
Mn(III) di oksidasi menjadi Mn(IV). e.Krom
Pengoksidasi dan Pereduksi. Ion krom dapat diokasidasi menjadi Cr(VI) di dalam asam atau basa. Reaksi di dalam asam di bawah kondisi yang ekstrim dengan HNO3 pekat dengan kalium klorat akan bertindak sebagai
pengoksidasi yang kuat.
2 Cr3+ + 6 ClO3- + H2O → Cr2O72- + 6 ClO2-↑ + 2 H+
Di dalam larutan basa reaksi lebih mudah terjadi dengan ion ClO- , yang sering digunakan untuk oksidasi:
2 Cr(OH)4 + 3 ClO- + 2 OH- → 2 CrO42- + 3 Cl- + 5 H2O
Di bawak kondisi asam ion Cr2O72- adalah pengoksidasi yang kuat, dengan cepat
mengoksidasi H2S, SO32-, HI dan NO2-:
Cr2O72- + 8 H+ + 3 H2S → 2 Cr3+ + 3 S↓ + 7 H2O
Untuk test secara kualitatif biasa digunakan untuk menentukan hadirnya ion krom sebagai endapan PbCrO4 atau BaCrO4, yang keduanya berwarna kuning. PbCrO4
larut di dalam NaOH dan asam kuat, tetapi tidak di dalam asam asetat atau amonia. BaCrO4 larut di dalam asam kuat:
BaCrO4+ 2 H+ ↔ 2 Ba2+ + Cr2O72- + H2O
Di dalam larutan asam nitrat, Cr2O72- bereaksi dengan H2O2 memberikan larutan
biru yang merupakan reaksi spesifik yang mungkin memiliki rumus CrO5-:
Cr2O72- + H2O2 + 2 H+ → 2 CrO5- + 5 H2O
Kromium peroksida tidak stabil, dengan cepat warna berubah. Logam krom adalah keras dan kristalin. Larut di dalam HCl dan H2SO4, tetapi tidak di dalam
HNO3.
Natrium hidroksida dan Amonia.Reagen ini membentuk endapan Cr(OH)3,
yang larut dengan kelebihan ion hidroksida, membentuk larutan yang berwarna hijau dari Cr(OH)4-. Di dalam NH3 yang berlebih, larut dan
menghasilkan warna merah jambu atau ion kompleks violet. Pada pendidihan larutan , dihasilkan endapan kembali dari Cr(OH)3.
f.Kobalt
Sulfida. Di dalam larutan basa yang mengandung Co(II), akan menghasilkan endapan hitam dari CoS. CoS tidak larut kembali dengan cepat di dalam HCl pada pemanasan. Tetapi dalam larutan asam nitrat panas atau air raja larut. CoS↓ + 12 Cl- + 2 NO3- + 8 H+ → 3 CoCl42- + 3 S↓ + 2 NO↑ + 4 H2O
Di dalam larutan asam, H2S tidak dapat mengendapkan CoS.
Amonium Tiosianat. Reagen ini menghasilkan ion kompleks berwarna biru dari Co(II) di dalam etanol, C2H5OH, yang lebih stabil di dalam air:
Kalium Nitrit. Jika larutan ini ditambahkan kedalam larutan kobalt dengan konsentrasi sedang, dihasilkan endapan kuning dari senyawa Co(III):
Co2+ + 7 NO2- + 3 K+ + 2 H+ → K3Co(NO2)6↓ + NO↑ + H2O
g.Nikel
Dimetilglyoksim. Reagen ini menghasilkan endapan merah-ros bila ditambahkan ke dalam larutan Ni2+:
H O O .. Ni2+ + 2 CH3-C=N-O-H CH3 – C = N N = C - CH3 .. Ni CH3-C=N-O-H CH3 – C = N N = C - CH3 O O . H Natrium Hidroksida.Dalam larutan basa menghasilkan warna hijau berupa
endapan gelatin dari Ni(OH)2, yang tidak larut dengan kelebihan reagensia. Di
bawah kondisi basa, Ni(OH)2 dapat dioksidasi menjadi Ni(OH)3 berwarna
biru oleh pengoksidasi kuat seperti: Cl2 atau Br2.
Pengoksidasi dan pereduksi. Logam Nikel adalah pereduksi sedang yang baik. Logam Nikel adalah relatif keras dan stabil di udara. Logam ini mudah larut dalam HNO3 encer. Seperti halnya besi, tetapi tidak reaktif bila
diperlakukan dengan asam nitrat pekat.
Amonia. Endapan Ni(OH)2 dibentuk mula-mula pada penambahan NH3 pada
larutan Ni(II), mudah larut dengan kelebihan reagensia, menghasilkan warna biru dari Ni(NH3)62+.
LATIHAN
1.Sempurnakanlah reaksi redoks dibawah ini: a. Fe(OH)2↓ + O2↑ → Fe(OH)3↓
b. Fe3+ + I- → c. Zn↓ + H+→