Standar Kompetensi : Menerapkan dasar-dasar kimia adan prinsip laboratorium
Kompetensi Dasar :
11.1 Menjelaskan senyawa anorganik 11.2 Menjelaskan senyawa organik
11.3 Menerapkan uji kualitatif senyawa anorganik dan senyawa organik
11.4 Menerapkan uji kuantitatif/penetapan kadar senyawa anorganik dan senyawa organik 11.5 Menjelaskan Good Laboratory Practice (GLP)
DAFTAR ISI BAB XI KIMIA FARMASI
11.1 Pendahuluan ... 343
11.1.1 Reaksi Kering ... 343
11.1.2 Reaksi Basah ... 345
11.2 Senyawa An Organik... 345
11.2.1 Identifikasi Kation... 345
11.2.2 Identifikasi Anion ... 359
11.2.3 Pemisahan Campuran Senyawa An Organik ... 367
11.3 Senyawa Organik ... 370 11.3.1 Identifikasi Senyawa Obat ... 370 11.4 Penetapan Kadar Senyawa Obat... 376 11.5 Prosedur Laboratorium sesuai Good Laboratory
11.1 Pendahuluan
Analisa kualitatif dapat menggunakan dua macam uji, reaksi kering dan basah. Reaksi kering dapat diterapkan untuk zat-zat padat dan reaksi basah untuk zat dalam larutan.
11.1.1 Reaksi Kering
Sejumlah uji yang dapat dilakukan dalam keadaan kering yakni tanpa melarutkan contoh. Reaksi ini dapat dilakukan dengan
1. Pemanasan
Zat dimasukkan dalam sebuah tabung pengapian (tabung bola)yang terbuat dari pipa kaca lunak, dan dipanasi dalam sebuah nyala bunsen. Mula-mula dengan nyala kecil kecil kemudian dengan nyala yang lebih kuat. Tabung reaksi kecil, 60-70 mm x 7-8mm, yang mudah diperoleh dan murah dapat juga dipakai. Dapat terjadi sublimasi, pelelehan, atau penguraian yang disertai perubahan warna, atau dapat dibe-baskan suatu gas yang dapat dikenali dari sifat-sifat khas tertentu.
2. Uji Nyala
Halaman ini menguraikan bagaimana melakukan sebuah uji nyala untuk berbagai ion logam,
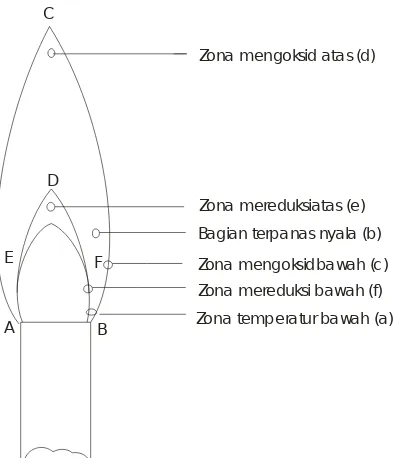
Gambar 145. Struktur Nyala Bunsen
Temperatur yang terendah adalah pada dasar nyala (a), ini dimanfaatkan untuk menguji nyala dari zat-zat atsiri. Bagian terpanas nyala adalah zona pelelehan pada (b), daerah ini dimanfaatkan untuk menguji kedapat-lelehan zat dan juga melengkapi (a) dalam menguji keatsirian relatif dari campuran zat-zat. Zat mengoksid bawah terletak ada batas luar (b) dan dapat digunakan untuk mengoksid zat-zat yang terlarut dalam manik borak, natrium karbonat atau garam mikroskopik. Zat mengoksid atas (d), daerah ini
digunakan untuk semua proses oksidasi yang tidak diperlukan temperatur tinggi. Zona reduksi atas (e) adalah ujung kerucut biru dalam. Daerah ini berguna untuk mereduksi oksida kerak menjadi logam. Zona mereduksi ba-wah (f) berguna untuk mereduksi boraks lelehan.
Bersihkan sebuah kawat platinum atau nikrome-(sebuah alloy nikel-kromium) dengan mencelupkannya ke dalam asam hidroklorat pekat dan kemudian panaskan pada Bunsen. Ulangi prosedur ini sampai kawat tidak
A B
E D
F C
Zona mengoksid atas (d)
menimbulkan warna pada zona pelehan b nyala api Bunsen. Jika kawat telah bersih, basahi kembali dengan asam dan kemudian celupkan ke dalam sedikit bubuk padatan yang akan diuji sehingga ada beberapa bubuk padatan yang menempel pada kawat tersebut. Agar dapat memahami uji ini maka perlu mengetahui struktur nyala Bunsen. Kemudian
zat dimasukkan ke dalam zona mengoksid bawah (c) dan diamati warna yang terjadi. Zat-zat yang kurang mengatsri dipanaskan zona pemanasan b, dengan cara ini dimungkinkan untuk memanfaatkan perbedaan keatsirian untuk memisahkan komponen- komponen dalam campuran.
Tabel 21. Warna Nyala dengan Api Bunsen
Zat mengandung Warna Nyala
Na Kuning
K Violet
Ca Merah bata
Sr Merah
Ba Hijau kuning
Cu Hijau kebiruan
3. Uji manik boraks
Sehelai kawat platinum digunakan untuk uji manik boraks.Ujung bebas kawat platinum dibengkokan menjadi suatu lingkaran kecil. Lingkaran ini dipanasi dalam dalam nyala bunsen sampai membara dan kemudian dengan cepat dibenamkan dalam bubuk boraks Na2B4O7.10 H2O. Zat padat
yang menempel ditaruh pada bagian nyala terpanas, garam
tersebut mengembang ketika melepaskan air kristalnya dan menyusut sebesar lingkaran tersebut dengan membentuk manik mirip kaca, tembus cahaya dan tak berwarna yang terdiri dari suatu campuran natrium metaborat dan anhidrida borat.
dipanasi dalam nyala reduksi bawah , dibiarkan dingin dan warnanya diamati. Kemudian manik tersebut dipanasi dalam nyala mengoksid bawah, dibiarkan mendingin dan diamati warnanya lagi.
Manikyang secara kharakteristik berwarna dihasilkan dengan garam tembaga, besi, kromium, mangan , kobalt dan nikel.
11.1.2 Reaksi Basah
Uji ini dilakukan dengan cara zat yang akan dianalisis dilarutkan lebih dahulu dalam suatu zat pelarut yang tepat.
Sebagai zat pelarut berturut-turut dapat dicoba :
1. Aquadest dingin/panas 2. Asam klorida encer dingin/
panas
3. Asam florida pekat dingin/ panas
4. Asam nitrat encer dingin/panas 5. Asam nitrat pekat dingin/panas
6. Aqua regia (campuran 3 bagian HCl pekat dan 1 bagian HNO3 pekat)
Reaksi dikatakan terjadi bila : a. terbentuk endapan b. terjadi pembebasan gas c. terjadi perubahan warna.
Mayoritas reaksi analisis kualitatif dilakukan dengan cara basah.
11.2 Senyawa An.Organik
11.2.1
Identifikasi Kation
11.2.1.1 Klasifikasi Kation.
Reagensia yang digunakan untuk klasifikasi kation yang paling umum adalah asam klorida, hidrogen sulfida, amonium sulfida dan amonium karbonat. Klasifikasi ini didasarkan apakah suatu kation bereaksi dengan reagensia-reagensia ini dengan membentuk endapan.
Kelima golonan kation dan ciri-ciri khas golongan– golongan ini adalah sebagai berikut:
a. Golongan I
Golongan ini membentuk endapan dengan asam klorida encer. Ion-ion golongan ini adalah timbal (Pb), merkurium (I) raksa, dan perak(Ag).
b. Golongan II
Kation golongan ini tidak bereaksi dengan asam klorida tetapi membentuk endapan dengan hidrogen sulfida dalam suasana asam mineral encer. Ion-ion golongan ini adalah golongan IIA yaitu merkurium(II), tembaga , bismuth, kadmium, dan golongan IIB yaitu arsenik (III), ar
senik (V), stibium(III), stibium (V), timah (II) danTimah (III) (IV). Sulfida dari kation golongan IIA tidak dapat larut dalam amoniumpolisulfida sedang-kan sulfida dari golongan IIB justru dapat larut.
c. Golongan III
Kation golongan ini tidak bereaksi dengan asam klorida encer ataupun dengan hidrogen sulfida dalam suasana asam mineral encer. Namun kation ini membentuk endapan dengan amonium sulfida dalam suasana netral atau amoniakal. Kation-kation golong-an ini adalah kobalt (II), nikel (II), besi (II), besi (III), kromium(III) aluminium, zink dan mangan (II).
d. Golongan IV
Kation golongan ini tidak bereaksi dengan reagensia golongan I, II, dan III. Kation-kation ini membentuk endapan dengan amonium karbonat dengan adanya amonium klorida dalam suasana netral atau sedikit asam. Kation-kation golongan ini adalah kalsium, stronsium dan barium.
e. Golongan V
Kation-kation yang umum, yang tidak bereaksi dengan reagensia golongan sebelumnya, merupakan golongan kation terakhir (sisa) yang meliputi ion magnesium, natrium, kalium, dan amonium.
Larutan timbal nitrat (0,25 M atau timbal Asetat (0,25 M) dapat dipakai untuk mempelajari reaksi-reaksi ini.
a. Dengan asam klorida encer terbentuk endapan putih, endapan larut dalam NH4OH encer.
Pb2+ + 2Cl- ↔ PbCl 2
Apabila ke dalam larutan yang terjadi ditambah HNO3
encer terbentuk endapan putih.
b. Dengan Hidrogen sulfida dalam suasana netral atau asam encer terbentuk endapan hitam timbal sulfida. Pb2+ + H
2S ↔ PbS↓ + 2H+
c. Dengan larutan amonia terbentuk endapan putih timbal hidroksida.
Pb2+ + 2NH
3 + 2H2O → Pb(OH)2↓ + 2NH4+
d. Dengan larutan NaOH terbentuk endapan putih timbal hidroksida, endapan larut dalam reagensia berlebih, yaitu terbentuk ion tetrahidroksiplumbat (II). Pb2+ + 2OH-→ Pb(OH)
2↓
Pb(OH)2↓ + 2OH- → Pb(OH)4
2-e. Dengan asam sulfat encer terbentuk endapan putih timbal sulfat.
Pb2+ + SO
42- → Pb SO4↓
Pb SO4↓ + H2SO4 →Pb2+ +HSO4-↓
f. Dengan Kalium Iodida terbentuk endapan kuning timbal iodida
Pb2+ + 2I -→PbI 2 ↓
Endapan larut dalam air mendidih menghasilkan larutan tak berwarna, setelah dingin akan memisah membentuk keping-keping berwarna kuning keemasan.
2. Identifikasi Merkurium (I) ( Hg22+)
a. Dengan asam klorida encer atau klorida–klorida yang larut terbentuk endapan putih kalomel.
Hg22+ + 2Cl- → Hg2Cl2↓
b. Dengan hidrogen sulfida dalam suasana netral atau asam encer terbentuk endapan hitam.
d. Dengan larutan amonia terbentuk endapan hitam yang merupakan campuran merkurium (I) dan merkurium (II) amidonitrat basa.
.
Hg22++ NO3-+4NH3+H2O → HgOHg– NH2↓ + 2Hg↓ +
3NH4+NO3
e. Dengan larutan NaOH terbentuk endapan hitam Mer-kurium (I) oksida
Hg22+ + 2OH- → Hg2O↓ + H2O
e. Dengan Kalium Iodida terbentuk endapan hijau merkurium(I) iodida, jika ditambah reagensia berlebihan terbentuk ion tetraiodomerkurat (II) yang larut dan merkurium hitam yang berbutir halus.
Hg22+ + 2I -→Hg2I2 ↓
Hg2I2 ↓ + 2I- -→HgI42- ↓ + Hg↓
3. Identifikasi Perak (Ag+)
a. Dengan asam klorida encer atau klorida–klorida yang larut terbentuk endapan perak klorida. Endapan larut dalam amonia encer dan dengan asam nitrat encer akan menetralkan kelebihan amonia sehingga akan terbentuk endapan lagi.
Ag+ + 2Cl- → AgCl↓
Ag+ + 2NH
3- → [Ag (NH3)2]+ + Cl
-b. Dengan hidrogen sulfida dalam suasana netral atau asam encer terbentuk endapan hitam perak sulfida .
2Ag+ + H
2S ↔ Ag2S↓ + 2H+
c. Dengan larutan amonia terbentuk endapan coklat perak oksida.
2Ag+ + 2NH
3 + H2O → Ag2O↓ + 2NH4+
d. Dengan larutan NaOH terbentuk endapan coklat perak oksida
2Ag+ + 2OH- → Ag
e. Dengan Kalium Iodida terbentuk endapan kuning perak iodida, jika ditambah reagensia amonia encer/ pekat endapan tidak larut. Endapan mudah larut dalam kalium sianida dan natrium tiosulfat.
Ag+ + I - →AgI ↓
AgI ↓+ 2CN -→ [Ag(CN) 2]- + I
-AgI ↓+ 2S2O32-→Ag(S2O3)23- + I –
B. Identifikasi Kation Golongan II 1. Identifikasi Merkurium (II)
a. Dengan Hidrogen sulfida (gas/larutan jenuh): dengan adanya asam klorida encer, mula-mula akan terbentuk endapan putih merkurium (II) klorosulfida yang terurai bila ditambahkan hidrogen sulfida lebih lanjut dan akhirnya terbentuk endapan hitam merkuri (II) sulfida.
3Hg2+ + 2Cl- + 2H
2S ↔ Hg3S2Cl2↓ + 4H+ + 2Cl
-b. Dengan larutan amonia terbentuk endapan putih yang merupakan campuran merkurium (II) oksida dan merkurium (II) amidonitrat.
2Hg2+ + NO
3- + 4NH3 +H2O → HgO↓ + Hg ( NH2)NO3↓
+ 2Hg + 3NH4+
c. Dengan larutan NaOH dalam jumlah sedikit terbentuk endapan merah kecoklatan, bila ditambahkan dalam jumlah yang stoikiometris endapan berubah menjadi kuning terbentuk Merkurium (II) oksida
Hg2+ + 2OH- → HgO↓ + H 2O
d. Dengan Kalium Iodida bila ditambahkan perlahan-lahan pada larutan terbentuk endapan merah merkurium(II) iodida, jika ditambah reagensia berlebihan terbentuk ion tetraiodomerkurat (II) yang larut
Hg2+ + 2I -→HgI 2 ↓
HgI2 ↓ + 2I- -→[HgI4]2- (Aq)
e. Dengan kalium sianida tidak terjadi perubahan apa-apa.
2. Identifikasi Bismut (Bi3+ )
larut dalam asam klorida pekat yang mendidih, yaitu pada saat gas hidrogen sulfida dibebaskan.
2Bi3+ + 3H
2S ↔ Bi2S3↓ + 6H+
Bi2S3↓ + 6HCl → 2Bi3+ + 6Cl- + 3H2S↑
b. Dengan larutan amonia terbentuk endapan putih
Bi3++ NO
3- + 2NH3 +2H2O → Bi ( OH)2NO3↓ + 2Hg↓ +
2NH4+
c. Dengan larutan NaOH terbentuk endapan putih bismut hidroksida.
Bi3++ 3OH- → Bi (OH) 3↓
d. Dengan Kalium Iodida bila ditambahkan perlahan-lahan pada larutan terbentuk endapan hitam bismut (II) iodida, jika ditambah reagensia berlebihan terbentuk ion tetraiodobismutat (II) yang berwarna jingga.
Bi3+ + I- → BiI 3↓
BiI3↓ + I- ↔ BiI 4
-e. Dengan kalium sianida terbentuk endapan putih bismut hidroksida
Bi3++ 3H
2O + 3CN -→Bi(OH)3↓ + 3HCN↑
3. Identifikasi Tembaga (Cu2+)
a. Dengan Hidrogen sulfida (gas/ larutan jenuh): terbentuk endapan hitam tembaga(II) sulfida.
Cu2+ + H
2S ↔ CuS↓ + 2H+
b. Dengan larutan amonia dalam jumlah yang sangat sedikit terbentuk endapan biru.
2Cu2++ SO
4- + 2NH3 +2H2O →
Cu (OH)2CuSO4↓ + 2NH4+
c. Dengan larutan NaOH dalam larutan dingin terbentuk endapan biru tembaga (II) hidroksida.
d. Dengan Kalium Iodida terbentuk endapan putih tem-baga (II) iodida, tetapi larutannya berwarna coklat tua karena terbentuk ion-ion tri-iodida (iod)
2Cu2+ + 5I- → 2CuI↓ + I 3
-e. Dengan kalium sianida terbentuk endapan kuning tembaga(II) sianida
Cu2+ CN -→Cu(CN) 2↓
4. Identifikasi Kadmium ( Cd2+)
a. Dengan Hidrogen sulfida (gas/larutan jenuh) terbentuk endapan kuning kadmium sulfida.
Cd2+ + H
2S ↔ CdS↓ + 2H+
b. Dengan larutan amonia bila ditambahkan tetes demi tetes terbentuk endapan putih
Cd2++ 2NH
3 +2H2O ↔
Cd( OH)2↓ + 2NH4+
c. Dengan larutan NaOH dalam larutan dingin terbentuk endapan putih kadmium (II) hidroksida.
Cd2++ 2OH- ↔ Cd (OH) 2↓
d. Dengan Kalium Iodida tidak terbentuk endapan
e. Dengan kalium sianida terbentuk endapan putih kad-mium(II) sianida
Cd2++ 2 CN -→Cd(CN) 2↓
5. Identifikasi Arsenik ( As3+)
a. Dengan Hidrogen sulfida (gas/larutan jenuh) terbentuk endapan kuning arsenik (III) sulfida.
2As3+ + 3H
2S → As2O3↓ + 6H+
b. Dengan larutan perak nitrat dalam larutan netral terbentuk endapan kuning
AsO33- + 3Ag+→ AsO33- + Ag2AsO3↓
c. Dengan campuran magnesia (larutan yang mengandung MgCl2, NH4Cl dan sedikit NH3 tidak
d. Dengan larutan tembaga sulfat terbentuk endapan hijau tembaga arsenit
e. Dengan kalium tri-iodida larutan iod dalam kalium iodida mengoksidasikan ion arsenit sehingga warna luntur.
AsO33- + I3- + H2O → AsO43- +3I- +2H+
6. Identifikasi Arsenik ( As5+)
a. Dengan Hidrogen sulfida (gas/larutan jenuh): tidak terbentuk. Jika aliran udara diteruskan,campuran Arsenik (III) sulfida, As2S3 dan belerang mengendap
dengan lambat. Pengendapan akan lebih cepat dalam larutan panas.
AsO43-+ H2S → AsO33- + S↓+ H2O
2AsO33- + 3H2S + 6H+ → As2S3↓ + 6H2O
b. Dengan larutan perak nitrat dalam larutan netral terbentuk endapan merah kecoklatan.
AsO43-+ 3Ag2+ → Ag3AsO4↓
c. Dengan campuran magnesia (larutan yang mengandung MgCl2, NH4Cl dan sedikit NH3) endapan
kristalin putih.
AsO43-+ 3Mg2+ + NH4 +→ MgNH4AsO4↓
d. Dengan larutan amonium molybdat dan asam nitrat berlebihan terbentuk endapan kristalin berwarna kuning.
AsO43-+ 12MoO42- + 3NH4+ +2H+ → (NH4)As Mo12O40↓
+ 12H2O
e. Dengan larutan kalium iodida dan asam klorida pekat maka ion iod akan diendapkan..
AsO43- +2H+ + 2I- ↔ + H2O → AsO33- + I2↓+ H2O
7. Identifikasi Stibium (Sb3+)
a. Dengan Hidrogen sulfida (gas/larutan jenuh) terbentuk endapan merah stibium trisulfida.
2Sb3+ + 3H
2S → Sb2S3 + 6H+
d. Dengan natrium hdroksida atau amonia terbentuk endapan putih stibium (III)oksida yang larut dalam larutan basa yang pekat membentuk antimonit. 2Sb3++6OH- → Sb
2O3↓ + 3H2O
Sb2O3↓ + 2OH-→ 2SbO2-↓ + H2O
e. Dengan Zink membentuk endapan hitam yaitu stibium.
2Sb3+ + 3Zn ↓→ 2Sb↓ + 3Zn2+
f. Dengan kawat besi terbentuk endapan hitam stibium. 2Sb3+ + 3Fe→ 2Sb↓ + 3Fe2+
8. Identifikasi Stibium (Sb5+)
a. Dengan Hidrogen sulfida (gas/larutan jenuh) terbentuk endapan merah jingga stibium pentasulfida.
2Sb5+ + 5H
2S → Sb2S5↓ + 10H+
b. Dengan air (aquades) terbentuk endapan putih dengan komposisi macam-macam akhirnya akan terbentuk asam antimonat.
2Sb5+ + 4H
2O → H3SbO4↓ + 5H+
c. Dengan kalium iodide dalam larutan yang bersifat asam,iod memisah.
Sb5+ + 2I- → Sb3+ + I 2(g)
d. Dengan Zink atau timah membentuk endapan hitam yaitu stibium dengan adanya asam klorida..
2Sb5+ + 5Zn ↓→ 2Sb↓ + 5Zn2+
2Sb5+ + 5Sn ↓→ 2Sb↓ + 5Sn2+
9. Identifikasi Timah (II)/ (Sn2+)
a. Dengan Hidrogen sulfida (gas/ larutan jenuh) terbentuk endapan coklat timah (II) sulfida.
Sn2+ + H
2S → SnS↓ + 2H+
b. Dengan natrium hidroksida terbentuk endapan putih timah (II) hidroksida yang larut dalam alkali berlebihan.
Sn2++2OH- → Sn(OH) 2↓
Sn(OH)2↓ +2OH- → Sn(OH)42-↓
d. Dengan larutan bismut nitrat dan natrium hidroksida terbentuk endapan hitam logam bismut.
Bi3++ 3OH-→ Bi (OH)3↓
Bi (OH)3↓ + Sn(OH)42- → 2Bi↓ + 3Sn(OH)6
2-10. Identifikasi Timah (IV) (Sn2+)
a. Dengan Hidrogen sulfida (gas/larutan jenuh) terbentuk endapan kuning timah (IV) sulfida. Endapan larut dalam asam klorida pekat.
Sn4+ + 2H
2S → SnS2↓ + 4H+
b. Dengan natrium hidroksida terbentuk endapan putih seperti gelatin yaitu timah (IV) hidroksida.
Sn4++2OH- → Sn(OH) 4↓
Sn(OH)42-↓+2OH-→Sn(OH)62↓
c. Dengan larutan merkurium (II) klorida tidak terbentuk endapan.
d. Dengan logam besi terjadi reduksi ion timah (IV) menjadi timah(II).
Sn4++ Fe → Fe2+ + Sn2+
C. Identifikasi Kation Golongan III 1. Identifikasi Besi (II)
a. Dengan larutan natrium hidroksida terbentuk endapan putih bila tidak terdapat udara sama sekali. Bila terkena udar akan teroksidasi menjadi besi (III) hidroksida yang berupa endapan coklat kemerahan. Fe2+ + 2OH- → Fe(OH)
2↓
4Fe(OH)2↓ + 2H2O + O2→ 4Fe(OH)3↓
4Fe(OH)3↓ + H2O2 → 2Fe(OH)3↓
b. Dengan larutan amonia terjadi pengendapan besi (II) hidroksida.
Fe2+ + 2OH- → Fe(OH) 2↓
c. Dengan hidrogen sulfida tidak terjadi pengendapan dalam larutan asam.
d. Dengan larutan amonium sulfida terbentuk endapan hitam besi (II) sulfida yang larut dengan mudah dalam larutan asam.
Fe2++ S2- → FeS↓
FeS↓+ 2H+ → Fe2+ +H 2S ↑
e. Dengan larutan kalium sianida terbentuk endapan
a. Dengan larutan amonia terjadi endapan coklat merah seperti gelatin dari besi (III) hidroksida yang tidak larut dalam reagensia berlebihan tetapi larut dalam asam.
Fe3+ + 3NH
3 + 3H2O → Fe(OH)3↓ + 3NH4+
b. Dengan larutan natrium hidroksida terbentuk endapan coklat kemerahan besi (III) hidroksida Fe3+ + 3OH- → Fe(OH)
3↓
c. Dengan hidrogen sulfida dalam larutan asam mereduksi ion-ion besi (III) menjadi besi (II) dan terbentuk belerang sebagai endapan putih susu. 2Fe3++ +H
2S → FeS↓
FeS↓+ 2H+ → 2Fe2++2H+ + S↓
d. Dengan larutan amonium sulfida terbentuk endapan hitam yang terdiri dari besi (II) sulfida dan belerang.. 2Fe3++ 3S2- → 2FeS↓+ S↓
e. Dengan larutan kalium sianida bila ditambahkan perlahan-lahan menghasilkan endapan coklat kemerahan besi (III) sianida.
Fe3++ 3CN- → Fe(CN) 3↓
3. Identifikasi Aluminium (Al3+)
a. Dengan larutan amonia terjadi endapan putih seperti gelatin dari aluminium hidroksida yang larut sedikit dalam reagensia berlebihan.
Al3+ + 3NH
3 + 3H2O → Al(OH)3↓ + 3NH4+
b. Dengan larutan natrium hidroksida terbentuk endapan putih dari aluminium hidroksida
Al3+ + 3OH- → Al(OH) 3↓
c. Dengan larutan amonium sulfida terbentuk endapan putih yang terdiri dari aluminium hidroksida
Al3+ + 2S2- + 6H
2O → 2Al(OH)3↓+3H2S↑
mendidihkan dengan reagensia berlebihan terbentuk endapan.
Al3+ + 3CH
3COO- + 2H2O →
Al(OH)2CH3COO↓+CH3COOH
4. Identifikasi Kromium (Cr3+)
a. Dengan larutan amonia terjadi endapan abu-abu endapan abu-abu hijau dari kromium hidroksida Cr3+ + 3OH- → Cr(OH)
3↓
c. Dengan larutan natrium karbonat terbentuk endapan abu-abu hijau dari kromium hidroksida
2Cr3+ + 3CO
32-+ 3H2O → 2Cr(OH)3↓ +3CO2↑
d. Dengan larutan amonium sulfida terbentuk endapan abu-abu hijau dari kromium hidroksida
2Cr3+ + 3S2- + 6H
2O → 2Cr(OH)3↓+3H2S↑
e. Dengan larutan natrium asetat tidak terbentuk en-dapan dalam larutan netral dingin walaupun dengan mendidihkan.
5. Identifikasi Kobalt (Co2+)
a. Dengan larutan natrium hidroksida terbentuk endapan biru
Co2+ + OH- + NO
3- → Co(OH) NO3 ↓
b. Dengan larutan amonia terjadi endapan biru. Co2+ + NH
3 + H2O + NO3- → Co(OH) NO3 ↓+ NH4+
c. Dengan larutan amonium sulfida terbentuk endapan hitam kobalt sulfida
Co2+ + S2- → CoS↓
d. Dengan larutan kalium sianida bila ditambahkan per-lahan-lahan menghasilkan endapan coklat kemerahan besi (III) sianida.
Co2++ 2CN- → Co(CN) 2↓
a. Dengan larutan natrium hidroksida terbentuk endapan hijau
Ni2+ + 2OH- → Ni(OH) 2↓
b. Dengan larutan amonia terjadi endapan hijau Ni2+ + 2NH
3 + 2H2O → Ni(OH)2↓ + 2NH4+
c. Dengan larutan amonium sulfida terbentuk endapan hitam nikel sulfida.
7. Identifikasi Mangan (Mn2+)
a. Dengan larutan natrium hidroksida terbentuk Endapan dengan cepat teroksidasi bila terkena udara menjadi coklat
Mn2+ + 2NH
3 + 2H2O →Mn(OH)2↓ + 2NH4+
c. Dengan larutan amonium sulfida terbentuk endapan merah jambu dari mangan sulfida.
Mn2+ + S2- → MnS↓
8. Dengan larutan natrium fosfat terbentuk endapan merah jambu dari mangan amonium fosfat.
Mn2+ + 2NH
3 + HPO42- →Mn(NH4) PO4 ↓
8.Identifikasi Zink (Zn2+)
a. Dengan larutan natrium hidroksida terbentuk endapan seperti gelatin yang putih. Endapan larut dalam asam.
Zn2+ + 2OH- → Zn(OH) 2↓
Zn(OH)2↓ + 2H+ → Zn2++ 2H2O
b. Dengan larutan amonia terbentuk endapan putih.
Zn2+ + 2NH
3 + 2H2O →Zn(OH)2↓ + 2NH4+
c. Dengan larutan amonium sulfida terbentuk endapan putih
d. Dengan larutan dinatrium hidrogen fosfat terbentuk endapan putih
Zn2+ + HPO
42- → Zn(PO4)2 ↓ + 2H+
D. Identifikasi Kation Golongan IV 1. Identifikasi Barium (Ba2+ )
a. Dengan larutan amonia tidak terbentuk endapan.
b. Dengan larutan amonium karbonat terbentuk endapan putih
Ba2+ + CO
32- → Ba CO3 ↓
c. Dengan larutan amonium oksalat terbentuk endapan putih
Ba2+ + (COO)
22-→ Ba(COO)2↓
d. Dengan asam sulfat terbentuk endapan putih
Ba2+ + SO
42-→ BaSO4↓
e. Dengan kaliumkromat terbentuk endapan kuning
Ba2+ + CrO
42-→ Ba CrO4↓
2. Identifikasi Calsium (Ca2+ )
a. Dengan larutan amonia tidak terbentuk endapan.
b. Dengan larutan amonium karbonat terbentuk endapan putih
Ca2+ + CO
32- → CaCO3 ↓
c. Dengan larutan amonium oksalat terbentuk endapan putih
Ca2+ + (COO)
22-→ Ca (COO)2 ↓
d. Dengan asam sulfat terbentuk endapan putih
Ca2+ + SO
42-→ CaSO4↓
e. Dengan kalium kromat tidak terbentuk endapan.
Ca2+ + CrO
42-→ CaCrO4↓
3. Identifikasi Stronsium (Sr2+)
b. Dengan larutan amonium karbonat terbentuk endapan putih
Sr2+ + CO
32- → SrCO3 ↓
c. Dengan larutan amonium oksalat terbentuk endapan putih
Sr2++ (COO)
22-→ Sr (COO)2 ↓
d. Dengan asam sulfat terbentuk endapan putih
Sr2++ SO
42-→ SrSO4↓
e. Dengan kalium kromat terbentuk endapan kuning
Sr2+ + CrO
42-→ SrCrO4↓
f. Dengan uji nyala terjadi warna nyala merah karmin
E. Identifikasi Kation Golongan V 1. Identifikasi Magnesium (Mg2+ )
a. Dengan larutan amonia terbentuk endapan putih seperti gelatin.
Mg2++ 2NH
3 + 2H2O →
Mg(OH)2↓ + 2NH4+
b. Dengan larutan natrium hidroksida membentuk endapan putih
Mg2+ + 2OH- → Mg(OH)
2↓
c. Dengan larutan amonium karbonat terbentuk endapan putih
5Mg2+ + 6CO
32- + 7H2O → 4MgCO3 Mg(OH)2. 5H2O +
2HCO3-
d. Dengan larutan natrium karbonat terbentuk endapan putih
Mg2+ + HPO
42- → Mg(PO4)2 ↓ + 2H+
e. Dengan larutan natrium hidroksida dan reagensia difenilkarbazida terbentuk endapan lembayung merah.
2. Identifikasi Kalium (K+ )
a. Dengan larutan Natrium heksanitritokobaltat terbentuk endapan kuning.
3K+ + Co(NO
b. Dengan larutan asam tartrat membentuk endapan kristalin putih
K+ + H
2C4H4O6 → KH2C4H4O6 ↓ + H+
c. Dengan larutan asam perklorat terbentuk endapan putih
K+ + ClO
4- → KClO4↓
d. Dengan larutan asam heksakloroplatinat terbentuk endapan kuning
K+ + PtCl
62- → KPtCl62-↓
e. Dengan uji nyala terjadi warna nyala ungu
3. Identifikasi Natrium (Na+ )
a. Dengan larutan uranil magnesium asetat terbentuk endapan kristalin kuning.
Na++Mg2++3UO
22++9CH3COO-→NaMg(3UO2)3
(CH3COO)9
b. Dengan larutan asam kloroplatinat tidak membentuk endapan
c. Dengan larutan asam tartrat tidak membentuk endapan
d. Dengan larutan asam p-heksanitritokobaltat tidak membentuk endapan
e. Dengan uji nyala terjadi warna nyala kuning
4. Identifikasi Amonium (NH4+ )
a. Dengan larutan natrium hidroksida dan dipanaskan keluar gas amonia.
NH4+ + OH-→ NH3+↑ + H2O
b. Dengan reagen Nessler membentuk endapan coklat
NH4+ + 2(HgI4)2- + 4OH- → HgO.Hg(NH2)I↓ + 7I- +
3H2O
c. Dengan larutan Natrium heksanitritokobaltat terbentuk endapan kuning.
3NH4+ + Co(NO2)63- → (NH4+)3Co(NO2)6↓
d. Dengan larutan asam heksakloroplatinat terbentuk endapan kuning
(PtCl6)2↓
e. Dengan larutan natrium hidrogen tartrat membentuk endapan putih
NH4+ + HC4H4O6- → NH4HC4H4O6 ↓
f. Dengan larutan asam perklorat tidak terbentuk en-dapan.
11.2.2 Identifikasi Anion
Secara umum anion dibagi dalam 2 golongan besar yaitu:
1. Kelas A
a. Anion yang menghasilkan gas bila direaksikan dengan HCl encer/asam sulfat encer: karbonat, bikarbonat, sulfat, tiosulfat, sulfida, nitrit, poklorit, sianida dan sianat.
b. Anion yang menghasilkan gas atau uap asam, bila direaksikan dengan larutan asam sulfat pekat: korida, bromida, iodida, nitrat, klorat, perklorat,
permanganat, bromat, borat, heksasianoferrat (II), heksasianoferrat (III), tiosianat, format, asetat, oksalat, tartrat dan sitrat.
2. Kelas B
a. Reaksi pengendapan: Sulfat, fosfat, fosfit, hipofosfit, arsenat, arsenit, kromat, dikromat, silikat, heksafluorosilikat.
b.Oksidasi dan reduksi dalam larutan: Manganat, permanganat, kromat dan dikromat.
Berikut ini djelaskan satu-persatu identifikasi dari masing-masing anion:
1. Identifikasi Karbonat (CO3 2-)
a. Dengan asam klorida encer terjadi penguraian yang ditandai dengan terjadinya gelembung gas. Gas ini dapat diidentifikasi dari sifatnya yang mengkeruhkan air kapur.
CO3 2- + 2H+ → CO2 ↑ + H2O
CO2 ↑ + Ba2++ 2OH- → BaCO3 ↓+ H2O
b. Dengan larutan barium/kalsium klorida terbentuk en-dapan putih
CO3 2- + Ca2+ → CaCO3 ↓
CO3 2- + Ba2+ → BaCO3 ↓
c. Dengan larutan perak nitrat terbentuk endapan putih perak karbonat.
CO3 2- + 2Ag+ → Ag2CO3 ↓
d. Uji karbonat- fenolphtalein terbentuk warna merah jambu pada fenolphtalein.
2. Identifikasi Hidrogen karbonat (HCO3-)
a. Dengan asam klorida encer terjadi penguraian yang ditandai dengan terjadinya gelembung gas. Gas ini dapat diidentifikasi dari sifatnya yang mengkeruhkan air kapur.
HCO3- + H+ → CO2 ↑ + H2O
CO2 ↑ + Ca2++ 2OH- → CaCO3 ↓+ H2O
CO2 ↑ + Ba2++ 2OH- → BaCO3 ↓+ H2O
b. Bila dididihkan, hidrogen karbonat terurai. Karbon dioksida yang terbentuk dapat diidentifikasi dari sifatnya yang mengkeruhkan air kapur.
2HCO3- → CO3 2- + H2O + CO2 ↑
CO2 ↑ + Ca2++ 2OH- → CaCO3 ↓+ H2O
CO2 ↑ + Ba2++ 2OH- → BaCO3 ↓+ H2O
c. Dengan larutan magnesium sulfat tidak terbentuk endapan, bila dipanaskan baru terbentuk endapan putih.
Mg2+ + 2HCO
3-→ MgCO3 ↓+ H2O + CO2 ↑
d. Dengan larutan Merkurium (II) klorida tidak terbentuk endapan .
3. Identifikasi Sulfit ( SO3 2-)
(ii) Bila sehelai kertas saring yang dibasahi dengan larutan kalium dikromat yang telah diasamkan diletakkan di atas mulut tabung uji maka kertas saring akan berwarna hijau.
SO3 2- + H+ → SO2 ↑ + H2O
3SO2 ↑ + Cr2O42- + H+ → 2Cr3+ + 3SO42- ↑ + H2O
b. Dengan larutan barium/ stronsium klorida terbentuk endapan putih
SO3 2- + Ba2+ → BaCO3 ↓
b. Dengan larutan perak nitrat mula-mula tidak terbentuk endapan, setelah ditambah reagensia berlebih terbentuk endapan putih
SO3 2- + 2Ag+ → (AgSO3 )
-(AgSO3 )- + Ag+ → Ag2SO3↓
d. Dengan larutan kalium permanganat yang telah diasamkan dengan asam sulfat encer maka warna ungu dari kalium permanganat luntur.
5SO3 2- + 2MnO4-+ 6H+ → 2 Mn2++ 3SO42-+ 3H2O
c. Dengan larutan kalium dikromat yang telah diasamkan dengan asam sulfat encer maka terjadi warna hijau karena terbentuknya ion-ion kromium (III).
3SO3 2- + Cr2O42- + 8H+ → 2 Cr3++ 3SO42-+ 4H2O
4. Identifikasi Tiosulfat (S2O3 2- )
a. Dengan asam klorida encer tidak terjadi perubahan dengan segera, setelah diasamkan baru terjadi kekeruhan karena terjadi pemisahan belerang.
S2O3 2- +2H+ → S↓ + SO2 ↑ + H2O
c. Dengan larutan iod maka warna iod luntur karena terbentuk ion tetrationat yang tak berwarna.
I2 + S2O3 2-→ 2I- + S4O6
2-c. Dengan larutan barium klorida terbentuk endapan putih barium tiosulfat.
d. Dengan larutan perak nitrat mula-mula tidak terbentuk endapan, setelah ditambah reagensia berlebih terbentuk endapan putih
SO3 2- + 2Ag+ → (AgSO3 )- (AgSO3 )- + Ag+ →
Ag2SO3↓
5. IdentifikasiSulfida (S2-)
a. Dengan asam klorida/asam sulfat encer terjadi pelepasan gas hidrogen sulfida yang dapat diidentifikasi dar baunya yang khas dan menghi-tamnya kertas saring yang dibasahi timbal asetat.
S2- + 2H+ → H 2S ↑
H2S ↑ + Pb2+ → PbS ↓
.b. Dengan larutan perak nitrat terbentu endapan hitam perak sulfida.
S2- + 2Ag+ → Ag 2S↓
d. Dengan larutan barium klorida tidak terbentuk endapan.
6. Identifikasi Nitrit (NO2- )
a. Dengan asam klorida encer dengan hati-hati dihasilkan cairan biru pucat yang tidak stabil dan dilepaskan uap nitrogen dioksida yang berwarna coklat.
NO2-+ H+ → HNO
2 3HNO2 → HNO3 +
2NO↑ + H2O
2NO↑ + O2 ↑ → 2NO2 ↑
b. Dengan larutan besi (II) sulfat yang ditambahkan pelan-pelan melalui dinding tabung yang telah ditambah asam sulfat/asetat encer terbentuk cincin coklat pada perbatasan kedua larutan.
NO2- + CH
3COOH → HNO2 + CH3COO
-3HNO2 → HNO3 + 2NO↑ + H2O
Fe2+ + SO
42- + 2NO↑ → (Fe2NO)SO4
c. Dengan larutan barium klorida tidak terbentuk endapan
d. Dengan larutan perak nitrat terbentu endapan putih perak nitrit.
e. Dengan larutan kalium permanganat yang telah diasamkan dengan asam sulfat encer maka warna ungu dari kalium permanganat luntur, tapi tak ada gas yang dilepaskan.
5NO2- + 2MnO
4- + 6H+ → 2 Mn2++ 5NO3-+ 3H2O
7. Identifikasi Sianida (CN- )
a. Dengan asam klorida encer terbentuk asam sianida.
CN- + H+ → HCN↑
b. Dengan larutan perak nitrat terbentuk endapan putih perak sianida yang mudah larut dalam larutan sianida berlebih.
CN- + Ag+ → AgCN↓
AgCN↓ + CN- → Ag(CN) 2-↓
c. Dengan asam sulfat pekat dipanaskan akan dilepaskan karbon monoksida
2KCN + 2H2SO4 + 2H2O → 2CO↑ + K2SO4 (NH4)2SO4
8. Identifikasi Tiosianat (SCN-)
a. Dengan asam sulfat pekat dihasilkan pewarnaan kuning, bila dipanaskan timbul reaksi yaitu terbakar dengan nyala biru.
SCN- + H
2SO4 + 2H2O → COS↑ + NH4+ + SO4
2-b. Dengan larutan perak nitrat terbentuk endapan putih perak tiosianat yang larut dalam amonia.
SCN- + Ag+ → Ag SCN↓
Ag SCN↓ + 2NH3 → Ag(NH3)2+ + SCN+
c. Dengan larutan tembaga sulfat terbentuk warna hijau yang berubah menjadi endapan hitam
SCN- + Cu2+ → Cu
( SCN)2↓
e. Dengan larutan besi (III) klorida terbentuk larutan merah darah karena terbentuknya suatu kompleks.
SCN- + Fe3+ → Fe( SCN) 3↓
a. Dengan larutan Argentum nitrat terbentuk endapan putih, endapan tidak larut dalam amonia tapilarut dalam kalium sianida dan natrium tiosulfat.
[Fe(CN)6]4+ 4Ag+ → Ag4 [Fe(CN)6]↓
Ag4 [Fe(CN)6]↓ + 8CN-→
4 [Ag(CN)2]- + [Fe(CN)6]4
Ag4 [Fe(CN)6]↓ + 8S2O32-→ 4 [Ag(S2O3)2]3- +
[Fe(CN)6]4
b. Dengan larutan Ferri klorida terbentuk endapan biru prussian
3[Fe(CN)6]4+ Fe3+ → Fe4[Fe(CN)6]3↓
c. Dengan larutan Ferro sulfat terbentuk endapan putih yang dengan cepat menjadi biru karena oksidasi.
[Fe(CN)6]4+ Fe2+ + 2K+→ K2Fe[Fe(CN)6]↓
2. Dengan larutan Cupri sulfat terbentuk endapan coklat
[Fe(CN)6]4+ 2Cu2+→ Cu2[Fe(CN)6]↓
10. Identifikasi ion Ferrisianida = [Fe(CN)6]3
a. Dengan larutan Argentum nitrat terbentuk endapan merah jingga
[Fe(CN)6]3+ 3Ag+ → Ag3 [Fe(CN)6]↓
b. Dengan larutan Ferro sulfat terbentuk endapan biru Turnbull
[Fe(CN)6]3 + Fe2+ → Fe3[Fe(CN)6]2
c. Dengan larutan Ferri klorida terbentuk larutan coklat [Fe(CN)6]3+ Fe3+ → Fe[Fe(CN)6]
d. Dengan larutan Cupri sulfat terbentuk endapan hijau
[Fe(CN)6]3+ 3Cu2+→ Cu3[Fe(CN)6]2 ↓
11. Identifikasi ion Klorida (Cl)
a. Dengan larutan Argentum nitrat terbentuk endapan putih yang larut dalam larutan amonia encer dan dengan larutan asam nitrat encer akan terbentuk endapan putih lagi.
Endapan dikenakan sinar matahari menjadi endapan ungu
Cl+ Ag+ → AgCl↓
-[Ag (NH3)2]+ + Cl- + 2H+ → AgCl↓ + 2NH4+
b. Dengan larutan Asam sulfat pekat, dipanaskan timbul gas. Gas ini dapat dibuktikan dengan:
Bau yang merangsang
Membentuk kabut putih, jika batang pengaduk yang dibasahi dengan ammonium hidroksida pekat didekatkan ke mulut tabung reaksi
Kertas lakmus biru merah
Cl+ H2SO4 → HCl↑ + HSO4
-c. Dengan larutan Plumbum nitrat terbentuk endapan putih, bila dipanaskan endapan larut dan bila didinginkan terbentuk endapan jarum
2Cl+ Pb2+ → PbCl2↓
12. Identifikasi ion Bromida ( Br )
a. Dengan larutan Argentum nitrat terbentuk endapan kuning muda.
Br+ Ag+ → AgBr↓
AgBr↓ + 2NH3→ [Ag (NH3)2]+ + Br
AgBr↓ + 2CN-→ [Ag(CN)
2]- + Br
AgBr↓+2S2O32-→ [Ag(S2O3)2]3- + Br
b. Dengan larutan Asam nitrat pekat, dipanaskan terbentuk larutan coklat merah, timbul uap coklat merah, dibuktikan dengan:
Larutan + kloroform lapisan
kloroform berwarna coklat merah
Kertas saring yang dibasahi dengan fluorescein, akan berwarna merah jingga jika di-letakkan di mulut tabung reaksi
6Br+ 8HNO3 → 3Br2↑ + 2NO↑ + 6NO3- + 4H2O
c. Dengan larutan Plumbum nitrat terbentuk endapan putih, yang larut di air mendidih
2Br+ Pb2+→ PbBr2
13.Identifikasi ion Iodida ( I)
a. Dengan larutan Argentum nitrat terbentuk endapan kuning yang mudah larut dalam larutan kalium sianida dan larutan natrium tiosulfat.
I+ Ag+ → AgI↓
AgI↓ + 2CN- → [Ag (CN) 2]- + I
AgI↓ + 2S2O32-→ [Ag(S2O3)2]3- + I
Larutan + kloroform terbentuk lapisan kloroform berwarna ungu
Kertas saring yang dibasahi amylum, akan berwarna biru jika diletakkan di atas tabung reaksi
2I- + 2H
2SO4 → I2↑+ SO42- + 2H2O
I- + H
2SO4 → HI↑+ HSO4-
6I- + 4H
2SO4 →3I2↑+ S↓ + 3SO42- + 4H2O
8I- + 5H
2SO4 → 4I2↑+ H2S + 4SO42- + 4H2O
c. Dengan larutan Plumbum nitrat terbentuk endapan kuning yang bila diencerkan dengan aquadest terbentuk endapan larut dan bila didinginkan terbentuk endapan berbentuk keping-keping kuning emas seperti sisik ikan.
2I+ Pb2+ → PbI2↓
d. Dengan larutan sampel ditambah Merkuri klorida ter-bentuk endapan merah jingga, jika sampel berlebih terbentuk endapan larut
2I+ HgCl2 → HgI2↓ +2Cl
-14. Identifikasi ion Borat ( BO33- , B4O72-, BO2-)
a. Dengan larutan Argentum nitrat terbentuk endapan putih, bila terhidrolisis menjadi endapan menjadi coklat.
B4O72-+ 4Ag+ + H20→ 4AgBO2↓ + 2H+
2AgBO2↓+3 H20→ Ag2O↓ + 3H3BO3
b. Dengan larutan diuapkan di atas cawan porselin, setelah kering ditambah metanol, kemudian dibakar terbentuk nyala api hijau
c. Dengan larutan Barium klorida terbentuk endapan putih, bila ditambah larutan Barium klorida berlebih terbentuk endapan larut
B4O72-+ 2Ba2+ + H2O → 2Ba(BO2)2↓ + 2H+
15. Identifikasi ion Kromat atau Dikromat = CrO42 atau Cr2O7
2-a. Dengan larutan Argentum nitrat terbentuk endapan merah coklat, endapan larut dalam asam nitrat encer dan dalam larutan amonia. Asam klorida mengubah endapan menjadi perak klorida (putih).
2Ag2 CrO4↓ + 2H+→ 4Ag+ + Cr2O72- + H20
Ag2 CrO4↓ + 4NH3→ 2[Ag (NH3)2]+ + CrO42
Ag2 CrO4↓+2Cl-→ 2AgCl↓ + CrO42
b. Dengan larutan Asam sulfat encer ditambah hidrogen peroksida terbentuk larutan biru tua, kemudian timbul gas dan larutan menjadi hijau
c. Dengan larutan Barium klorida terbentuk endapan kuning
Cr2O4-2 + Ba+→ Ba CrO4↓
d. Dengan larutan Plumbum nitrat terbentuk endapan kuning yang larut dalam asam nitrat encer.
Cr2O4-2+ Pb2+→ PbCrO4↓
2PbCrO4↓+ 2H+→ 2Pb2+ + Cr2O72- + H20
16. Identifikasi ion Permanganat (MnO4=)
a. Dengan larutan Argentum nitrat tidak terjadi perubahan
b. Dengan larutan Kalium hidroksida pekat terbentuk la-rutan hijau ditambah air dan asam sulfat encer terbentuk larutan ungu
4 MnO4- + 4OH- → 4 MnO42- + O2↑ + 2H2O
3MnO42- + 2H2O→ 2 MnO4- + MnO2↓ + 4OH
-b. Dengan larutan asam sulfat encer ditambah hidrogen peroksida terbentuk timbul gas, dan warna ungu dilunturkan
2 MnO4- + 5 H2O2 + 6H+ → SO2↑ + 2Mn2+ + 8H2O
c. Dengan larutan asam sulfat encer ditambah natrium nitrit warna ungu dilunturkan
2 MnO4- + 5NO2- + 6H+ → 2Mn2+ + 5NO3- + 3H2O
d. Dengan larutan asam sulfat encer ditambah Ferro sulfat warna ungu dilunturkan
2MnO4- + 5Fe2+ + 8H+ → 5Fe3+ + Mn2+ + 4H2O
e. Dengan larutan asam sulfat encer ditambah asam oksalat warna ungu dilunturkan
2MnO4- + 5 (COO)22- + 16H+ →10CO2↑ + 2Mn2+ +
8H2O
17. Identifikasi ion Asetat ( CH3COO)
CH3COO+ Ag+ ↔ CH3COOAg
d. Dengan larutan Alkohol dan asam sulfat pekat terbentuk bau harum
CH3COO+C2H5OH → CH3COOC2H5 + OH
-e. Dengan larutan Ferri klorida terbentuk larutan coklat merah
6CH3COO+ 3Fe 3+ + 2H2O→
[Fe3(OH)2( CH3COO)6]+ +2H+
[Fe3(OH)2( CH3COO)6]+ + 4H2O→ 3Fe(OH)2
CH3COO↓ + CH3COOH + H+
11.2.3
Pemisahan Campuran Senyawa AnOrgank
Setelah melakukan reaksi/analisis pendahuluan kita telah dapat memperkirakan zat/unsur anorganik apa yang mungkin terdapat dalam bahan (sampel) yang dianalisis. Untuk itu perlu dianalisis kation dan anion yang ada dalam campuran senyawa anorganik.
Untuk memastikan kation apa yang terdapat dalam bahan maka harus dilakukan reaksi selektif untuk memisahkan/menggolongkan unsur-unsur yang ada terutama bila zat dalam bentuk campuran.
Ada beberapa cara analisis sistematika kation, antara lain:
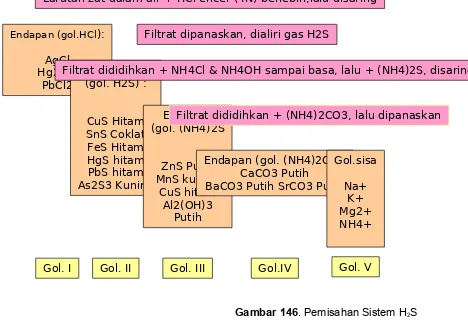
1. Metode H2S
Larutan zat dalam air + HCl encer (4N) berlebih,lalu disaring
Endapan (gol.HCl):
AgCl Hg2Cl2
PbCl2
Gol. I
Filtrat dipanaskan, dialiri gas H2S
Endapan (gol. H2S) :
CuS Hitam SnS Coklat FeS Hitam HgS hitam PbS hitam As2S3 Kuning
Filtrat dididihkan + NH4Cl & NH4OH sampai basa, lalu + (NH4)2S, disaring
Endapan (gol. (NH4)2S
ZnS Putih MnS kuning
CuS hitam Al2(OH)3
Putih
Filtrat dididihkan + (NH4)2CO3, lalu dipanaskan
Endapan (gol. (NH4)2CO3 CaCO3 Putih
BaCO3 Putih SrCO3 Putih Gol.sisa
Na+ K+ Mg2+ NH4+
Gol. II Gol. III Gol.IV Gol. V
Gambar 146. Pemisahan Sistem H2S
Selanjutnya dari endapan-endapan atau larutan golongan sisa di atas dilakukan identifikasi
Filtrat :
K+ Na+
Li+
Residu + HNO3 encer, panaskan, kocok,
kemudian disaring
Filtrat :
Ca2+ Ba2+ Sr2+ Mg2+
Zn2+ Cu2+
Residu + HCl encer, panaskan,
kocok, saring
Filtrat : Ag+Al+ Bi2+ Sn4+ As3+ Pb2+ Hg2+ Fe3+ Mn3+Cd2+ Cr3+ No3+
Co2+
Residu : SiO2 Filtrat :
Sb3+
Zat dipijar dalam cawan pijar, setelah dingin larutan dingin disaring Maksud dilakukannya pemisahan adalah agar reaksi
spesifik suatu ion tidak terganggu karena adanya kation yang lain.
2. Metode non H2S
Cara ini terutama didasarkan pada kelarutan oksida logam dalam pelarut asam yang digunakan.
Zat yang akan diperiksa dipijarkan di dalam krus porselain diatas nyala bunsen, kecuali untuk memeriksa kation-kation yang mudah menguap, menyublim atau mudah terurai seperti kation NH4+,
As3+, Bi3+, Hg2+ yang harus diperiksa langsung dari zat
asalnya sebelum dipijarkan.
Gambar 147. Pemisahan Sistem Non H2S
Cara non H2S ini tidak berarti tiap filtrat atau residu
hanya terdiri dari ion-ion seperti tersebut di atas, tapi kemungkinan juga ada ion-ion yang termasuk golongan filtrat lain dalam jumah sedikit yang ikut di dalamnya.
Untuk mengidentifikasi anion-anion yang ada dalam campuran senyawa anorganik perlu dipisahkan antara kation dan anionnya dengan membuat ekstrak soda.
Cara membuat ekstrak soda:
Kurang lebih 1 gram zat dimasukkan dalam beaker
glass 100 mL.
Ditambahkan 20 mL larutan Na2CO3 jenuh dan dididihkan
selama 15 menit, didinginkan dan disaring.
Filtratnya ini disebut ekstrak soda dan digunakan untuk identifikasi anion selain ion karbonat. Endapan pada kertas saring merupakan garam karbonat dari kation logam yang dapat dipakai untuk analisis kation.
11.3 Senyawa Organik
11.3.1
Identifikasi Senyawa Obat
Tahapan dalam identifikasi senyawa organik/ senyawa obat:
I. Organoleptis
Bentuk: Kristal atau serbuk
Warna: Putih, Kuning, Coklat atau Jingga
Bau: Terutama penting pada zat-zat yang mempunyai bau spesifik
Rasa: Manis, Asin, Pahit, Masam, Anaesthetis ( rasa tebal di lidah ), Dingin, Panas atau tidak berasa
II. Pemanasan pada cawan porselin :
membirukan kertas lakmus merah, hendaknya diselidiki terhadap NH3.
Uap tersebut juga dapat berbau: Phenol, Rambut terbakar, karamel, dsb.
Kalau pada pemanasan setelah penambahan HNO3 pekat
meninggalkan sisa di atas cawan porselin, maka menunjukkan adanya oksida logam (mungkin zat yang diselidiki merupakan suatu garam).
Perlu diingat bahwa untuk senyawa-senyawa NH4 , Hg dan
As akan menguap seluruhnya pada pemanasan. Jadi harus diadakan pemeriksaan pendahuluan terhadap unsur-unsur tersebut.
Kalau pada sisa pemanasan itu dalam keadaan:
- panas dan dingin putih: K, Na, Ca, Ba, Mg, Al, Sr - panas dan dingin coklat hitam: Ag, Sb, As, Cu, Fe, Mn - panas kuning, dingin putih: Zn
- panas dan dingin kuning: Pb
- panas kuning coklat, dingin kuning: Bi, Sn
III. Kelarutan :
Lihat kelarutannya dalam keadaan dingin dan panas, dalam Air, Asam, Basa dan Alkohol.
IV. Penyelidikan Constanta Physis (yang mungkin dilakukan )
Terutama untuk zat tunggal, biasanya hasil tidak dapat tepat tetapi lebih rendah dari pada ketentuan-ketentuan yang ada.
- Titik lebur (Melting Point)
Untuk zat yang mudah terurai pada pemanasan, tidak dapat ditentukan dengan cara ini.
Alat: MELTING BLOCK dari THIEF
- Bobot Jenis
Perbandingan bobot zat terhadap air pada volume yang sama dan suhu yang sama yang ditimbang di udara.
Alat: PIGNOMETER
- Index Bias
Perbandingan kecepatan cahaya dalam hampa udara dengan kecepatan cahaya dalam zat terse-but.
Alat : REFRAKTOMETER
- Rotasi Optik
Besar sudut pemutaran bidang polarisasi yang terjadi, jika sinar terpolarisasi dilewatkan melalui cairan.
Kecuali dinyatakan lain, pengukuran dilakukan dengan menggunakan sinar pada lapisan cairan setebal 1 dm pada suhu 20 0 C.
Alat : POLARIMETER
V. Fluorescensi : dengan sinar Ultra Violet
- Zat padat
- Dengan H2SO4 encer
- Dengan NaOH encer
VI. Penyelidikan terhadap unsur :
Pada umumnya zat organik mengandung unsur-unsur: C, H, O, N, S, P, Halogen, Logam. Untuk dapat menganalisis unsur-unsur tersebut maka zat organik harus dirusak dulu dengan cara:
1. Pemijaran / Pengarangan
Zat di dalam cawan porselen dipanaskan, hasil pemijaran menunjukkan adanya: uap/gas, bau, warna dsb bila hasil pemijaran hitam maka C positif.
2. Penfield
Zat + Pb2CrO4 dipanaskan akan keluar gas CO2,
bila dialirkan dalam air barit/air kapur akan menjadi keruh.
3. Castellana
Zat yang akan diselidiki dicampur dengan serbuk Castellana (terdiri dari campuran Na2CO3 dan
Magnesium 2: 1 ) dengan perbandingan 1: 5. Masukkan dalam pipa kapiler hampir penuh, panas-kan di api bebas sampai berpijar. Masukpanas-kan ke dalam aquadest (untuk melarutkan zat-zat organik yang telah dirusak) diaduk lalu didiamkan sampai terbentuk endapan. Kemudian disaring, filtrat digunakan untuk menyelidiki unsur-unsur seperti : N, S, P, As dan Halogen.
Unsur N: N diubah menjadi CN
- Filtrat + HCl + FeSO4 jenuh Fe4(Fe(CN)6)3
biru berlin
- Filtrat + Pb Ac PbS hitam coklat
- Filtrat + Na Nitropruside kristal violet
Unsur P:
- Filtrat + Mg Mixture MgNH4PO4 putihat
+ HNO3 pk + NH4 Molybdat (NH4)3PO412MoO3
Ammonium fosfomolybdat kuning
Unsur As:
- Filtrat + HNO3 p + NH4 Molybdat
(NH4)3AsO412MoO3 Ammonium arsenomolybdat
kuning
- Test Gutzeit:
Zat direduksi dengan serbuk Zn + H2SO4 terbentuk
AsH3 yang dapat ditunjukkan dengan:
+ kristal AgNO3 kuning + larutan AgNO3
hitam
AsH3 + 6 AgNO3 Ag3As.3AgNO3 + 3 HNO3
Ag3As.3AgNO3 + H2O H3AsO3 + 6 Ag + 6 HNO3
Unsur Cl:
- Filtrat + HNO3 + AgNO3 AgCl putih yang larut
dalam NH4OH dan mengendap kembali dengan
penambahan HNO3
- Filtrat + H2SO4 + K2Cr2O7 kertas o. Toluidin biru
Unsur Br:
- Filtrat + HNO3 + AgNO3 AgBr putih
kekuningan sedikit larut dalam NH4OH berlebihan
- Filtrat + HCl + NaNO2 + CHCl3 CHCl3
coklat
- Filtrat + H2SO4 + K2Cr2O7 kertas
Fluorescein merah
Unsur I:
- Filtrat + HNO3 + AgNO3 AgI kuning tidak larut
dalam NH4OH berlebihan
- Filtrat + HCl + NaNO2 + CHCl3 CHCl3 violet
- Filtrat + HNO3 + Pb Ac PbI2 kuning
- Filtrat + H2SO4 pk + K2Cr2O7 kertas Amylum biru
VII. Penyelidikan terhadap gugus :
- C H
- Reaksi Pendamaran
Zat + larutan NaOH / KOH larutan kuning yang
kemudian mengendap merah kekuningan
- Mereduksi larutan Ag-Amoniakal
Zat + AgNO3 + NH4OH berlebihan Ag yang
mem-bentuk cermin perak pada dinding tabung
- Zat + Schiff merah jambon
- Zat + Barfoed merah coklat
- Zat + Fehling A & B Cu2O merah bata
- Zat + Nessler abu-abu
- Zat + Tollens lemah terjadi lapisan perak abu-abu
2. Keton :
- Zat + Na Nitropruside + NH4Cl + NH4OH violet
(pereaksi Legal Rothera)
3. Karboksilat :
- Gugus karboksilat bersifat asam yang dapat ditunjukkan dengan indikator/lakmus
- Esterifikasi:
Zat + Alkohol + H2SO4 p bau harum
4. Sulfon : - SO3H
- S dari filtrat Castellana + Pb Ac PbS hitam coklat
- Bila dioksidasi keluar ion Sulfat
Zat + H2O2 3 % + 1 tetes FeCl3 0,5 N; setelah reaksi
selesai + HNO3 + lar. BaCl2 0,5 N putih dari
BaSO4
5. Amina : Ada 3 macam
a. Amina primer: R – C – NH2
b. Amina sekunder:
NH
R
c. Amina tersier: R
N - R
R
Reaksi umum:
- Zat + NaOH gas NH3 yang dapat
ditunjukkan dengan kertas lakmus merah basah atau dengan Nessler coklat
- Zat + As. Pikrat endapan
a. Amina primer
1. Reaksi Isonitril:
R-NH2 + CHCl3 + NaOH R-N=C + NaCl + H2O
Isonitril ( dikenal baunya )
Reaksi ini kepekaannya berkurang dengan adanya gugus karboksil sulfon atau OH fenolis
2. Reaksi Parri ( baik untuk amin alifatis ) R-NH2 + HNO3 ROH + H2O + N2
3. Remini test:
Zat + aceton + Na-Nitroprusid r.p merah ungu
4. Reaksi Erlich ( DAB.HCl) = Dimetil Amino Benzaldehide dalam HCl.
Amine primer aromatis + DAB.HCl jingga/kuning
b. Amina sekunder
R2NH + HNO2 R2NNO + H2O
Nitrosamine
Nitrosamine dapat ditunjukkan dengan:
Zat + HCl encer/etanol sampai larut + HCl p sampai asam, didinginkan + NaNO2 dan kocok pelan-pelan
lalu didiamkan 5 menit maka terbentuk larutan kuning yang memisah, kemudian dipisahkan, + Phenol dan dipanaskan pelan-pelan, didinginkan, + H2SO4 pk
hijau biru, akan berubah biru/hijau tua, jika + NaOH berlebihan.
c. Amina tersier
Reaksi ini positif untuk Amina tersier dan garam-garamnya, seperti Trimetil Amina, Trietanol Amina, Tribenzilamine, Prokain, Metil Ephedrin
6. Zuur amide :
O - C
NH2
- Reaksi Biuret
Zat + NaOH + CuSO4 Biru/biru violet
7. Nitro ( NO2 pada atom C ):
-NO2
- Zat + H2SO4 pk + Diphenilamin biru
- Zat direduksi dengan Zn + HCl amina primer
DAB.HCl jingga
8. Alkohol : - OH
- Reaksi Diazo ( Diazo A : B = 4:1 )
Zat + Diazo A (as. Sulfanilat) + HCl + Diazo B ( NaNO2 ) +
NaOH sampai basa merah frambors + eter /
amilalkohol warna tak masuk (Beda dengan Fenol
warna merah dapat ditarik dengan eter / amilalkohol)
Reaksi Diazo juga positif terhadap: alkohol primer, sekunder yang larut dalam air, Aceton, Fenol, beberapa asam oxy ( as. Sitrat, as. Malat )
H
Alkohol primer: R – C – OH
H
- Zat + KMnO4 + H2SO4 warna hilang +
Schiff merah violet
R1
Alkohol sekunder: R2 – C – OH
H
- Zat dioksidasi dengan aq. Bromata
kemudian + pereaksi Legal Rothera merah coklat /
violet
R1
Alkohol tersier: R2 – C – OH
R
3Alkohol Polyvalen
- Zat + NaOH + 1 tetes CuSO4 larutan biru
9. Pheno l
- Zat + FeCl3 larutan ungu + Alkohol
kuning
10. Inti Aromatik
Reaksi GUERBERT: Zat + HNO3 p dengan katalisator
H2SO4 p dipanaskan hati-hati sisanya dilarutkan dalam
alkohol + HCl + Zn (untuk mereduksi) dipanaskan sedikit, maka Nitro yang terjadi direduksi jadi Amine, pindahkan ke dalam tabung lain + HCl + lar. NaNO2 1
% + 1 % Beta Naftol dalam amoniak sampai alkalis
cincin merah / jingga
Yang dapat bereaksi adalah inti: benzene, naftalene, fenantren.
11.4 Penetapan Kadar Senyawa Obat
Senyawa-senyawa obat dapat ditetapkan dengan berbagai metode, mulai dari metode yang klasik misalnya meode Volumetri dan Gravimetri atau dapat juga dengan metode yang modern misalnya Spektrofometri (Uv-Vis, IR, AAS, NMR ), Kromatografi , Spektrodensitometri , Potensiometri dan lain-lain. Berikut ini akan diuraikan beberapa metode yang dapat digunakan untuk menetapkan kadar beberapa senyawa obat .
11.4.1 Volumetri
11.4.1.1 Teori Dasar Analisa Volumetri
Volumetri/titrimetri ialah penyelidikan untuk mengetahui kadar suatu zat dengan cara mengukur volume larutan yang sudah diketahui konsentrasinya, secara tepat sehingga keduanya bereaksi equivalen.
Titik equivalen adalah suatu keadaan tentang kadar dalam gram equivalen dari zat yang diselidiki sama dengan konsentrasi dalam gram equivalen dari larutan standar.
Reaksi yang terjadi dalam analisa volumetri bermacam-macam, sehingga analisis volumetri dapat dibagi menjadi 3 bagian yang berdasarkan prinsip dari reaksi-reaksi yang terjadi yaitu:
1. Acidialkalimetri
Prinsip: netralisasi asam basa.
Reaksi-reaksi yang terjadi merupakan kombinasi dari ion hidrogen dan ion hidroksil yang membentuk air.
H+ + OH
H2O
Acidialkalimetri dibagi menjadi 2 bagian yaitu:
► Acidimetri
Penyelidikan untuk menentukan kadar suatu basa dengan memakai larutan asam yang sudah diketahui konsentrasinya (dengan memakai larutan asam sebagai larutan standar).
► Alkalimetri
Penyelidikan untuk menentukan kadar asam dengan memakai larutan basa yang sudah diketahui konsen-trasinya (dengan memakai larutan basa sebagai larutan standar)
2. Oxidimetri
Prinsip: reaksi reduksi - oksidasi.
Reaksi-reaksi yang terjadi meliputi perubahan bilangan oxidasi atau perpindahan elektron-elektron dari zat-zat yang bereaksi.
Larutan standar merupakan zat-zat oxidator atau reduktor.
Zat-zat oxidator antara lain: KMnO4; K2Cr2O7; Ce(SO4)2; I2;
KIO3; KBrO3; Chloramin – T.
Zat-zat reduktor antara lain: persenyawaan ferro atau stanno; Na2S2O3; As2O3; TiCl3; Ti2(SO4)3.
Oxidimetri terdiri atas beberapa cara antara lain: Permanganometri, Iodometri dan Iodimetri, Bromometri, Serimetri.
3. Nitrimetri
NaNO2 + HCl → HNO2 + NaCl
R NH2+ HNO2 + HCl →
R N+─Cl-+ H
2O
║│
N
Reaksi diazotasi dapat berlangsung dengan syarat sebagai berikut:
1. temperatur yang digunakan harus rendah yaitu di bawah 150 C, sebab pada temperatur yang lebih
tinggi garam diazonium yang terbentuk tidak stabil dan akan terhidrolisis menjadi fenol dan gas hi-drogen, dan dikhawatirkan pada temperatur yang lebih tinggi asam nitrit lebih cepat terurai sehingga reaksinya tidak stoikiometri. Titrasi pada suhu kamar tidak berbeda hasilnya apabila dilakukan perlahan-lahan.
2. Ditambah KBr sebagai katalis 3. Dalam suasana asam (HCl)
4. Argentometri
5. Argentometri adalah suatu cara penetapan kadar titrasi, berdasarkan reaksi pengendapan dan meng-gunakan larutan baku AgNO3.
Larutan standar primer: NaCl
Larutan standar sekunder: AgNO3, KCNS, NH4CNS
Macam-macam Argentometri:
A. Argentometri Mohr B. Argentometri Volhard C. Argentometri Fajans D. Argentometri Liebig
A. Argentometri Mohr
Prinsip :Pengendapan bertingkat/pembentukan suatu endapan berwarna.
Larutan standar sekunder :AgNO3
Indikator: K2CrO4 5 %
Syarat: suasana netral
Pada analisis Cl mula-mula terjadi reaksi:
Ag+ + Cl
Sebelum titik ekuivalensi Clnya masih ada, tetapi saat titik
ekuivalensi Cl nya habis, maka dengan penambahan
AgNO3 akan bereaksi dengan K2CrO4 sehingga terbentuk
endapan merah coklat sebagai titik akhir titrasi.
2 Ag+ + CrO
42 - Ag2CrO4 merah coklat
Konsentrasi CrO42 yang ditambahkan sebagai indikator
tidak boleh sembarang, tetapi harus dihitung berdasar Ksp AgCl dan Ksp Ag2CrO4. Konsentrasi CrO42 tidak boleh tinggi
karena warna CrO42 adalah kuning, sehingga
mengakibatkan perubahan warna pada titik akhir titrasi sulit dilihat (konsentrasi CrO42= 2,5 x 103 M).
Pengaturan pH juga perlu dilakukan agar tidak terlalu rendah ataupun terlalu tinggi. Sebaiknya dilakukan dalam suasana netral atau sangat sedikit sekali basa yakni dalam jangkauan pH 6,59 (pH 7).Bila terlalu tinggi (basa) dapat terbentuk endapan Ag(OH) yang selanjutnya terurai menjadi Ag2O
sehingga titran terlalu banyak dipakai.
2Ag+ + 2OH 2Ag(OH) putih Ag2O Hitam + H2O
Bila pH terlalu rendah (asam), ion CrO42 sebagian berubah
menjadi Cr2O72 yang mengurangi konsentrasi indikator dan
menyebabkan tidak timbul endapan atau sangat terlambat.
2H+ + 2CrO
42 Cr2O72 + H2O
Selama titrasi Mohr, larutan harus dikocok dengan baik. Bila tidak maka secara lokal terjadi kelebihan titran yang menyebabkan indikator mengendap sebelum titik ekuivalen tercapai dan dioklusi oleh endapan AgCl yang terbentuk kemudian. Akibatnya titik akhir titrasi menjadi kurang tepat.
Metoda sederhana untuk membuat larutan menjadi netral:
1. Jika larutan asam dengan penambahan Kalsium karbonat/ Natrium hidrogen karbonat murni dengan berlebih.
2. Jika larutan basa: diasamkan ngan Asam Asetat lalu ditambahkan Kalsium karbonat yang sedikit berlebih.
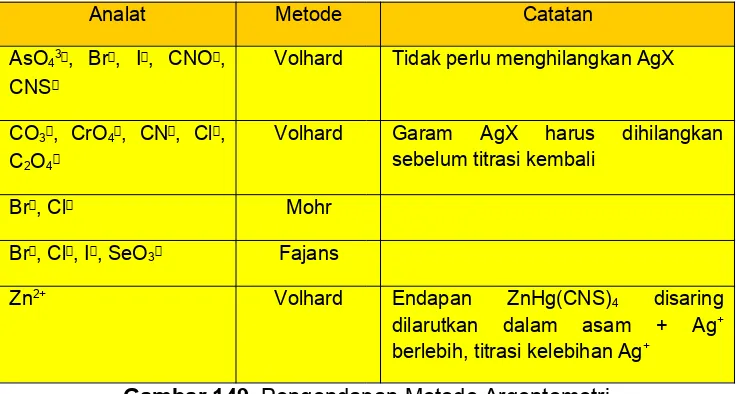
B. Argentometri Volhard
Titrasi dengan menggunakan metode Argentometri Volhard dapat diterapkan pada penentuan Ag+ atau CNS secara
Titrasi langsung. Sampai dengan titik ekuivalen harus terjadi reaksi antara titran dengan Ag+ membentuk endapan putih.
Gambar 148. Perbedaan Kelarutan Endapan pada
Metode Argentometri
Hendaklah diingat bahwa
Ksp lebih kecil
menunjukkan kelarutan lebih kecil pula asal jenis
senyawanya sama
misalnya biner dengan
biner, terner dengan terner. Tidak demikian halnya bila biner dengan terner misal: AgCNS dengan Ag3PO4. Ksp Ag3PO4
lebih kecil namun kelarutannya lebih besar.
1. Untuk X yang kelarutan AgX-nya lebih besar dapat
ditempuh beberapa cara isolasi AgX untuk menghindarkan reaksi antara AgX dengan CNS yaitu:
2. Endapan AgX disaring, dicuci, filtrat yang sudah tidak mengandung AgX dititrasi. Cara ini efektif tetapi tidak efisien.
a. Setelah terjadi endapan AgX, campuran ditam-bah Nitrobenzen yaitu suatu cairan
organik yang
membentuk lapisan yang membungkus gumpalan AgX bila dikocok. Karena terbungkus, maka AgX tidak dapat berhubungan dengan CNS
b. Bila endapan AgX dapat larut dalam asam kuat encer maka endapan disaring dan dicuci kemudian dilarutkan dalam asam kuat encer dan larutan ini yang dititrasi. Jadi disini bukan kelebihan Ag+ yang
dicari melainkan banyaknya Ag+ yang bereaksi
de-ngan X. AgCNS larut dalam asam kuat encer.
Yang tidak larut adalah: Ag2(COO)2, Ag2CO3, Ag
3-PO4, Ag2CrO4 dan Ag3AsO4.
lebih sukar larut lebih mudah larut dari AgCNS
AgCN 15,92 AgIO3 7,51 Ag2CO3 11,25
AgBr 12,31 AgCl 9,75 Ag2CrO4 11,89
AgI 16,01 Ag2(COO)2 11,05 Ag3PO4 19,9
c. Mempergunakan Fe3+ yang lebih besar sehingga
CNS pada titik ekivalen menjadi terlalu rendah
untuk bereaksi dengan AgX karena terkompleks oleh indikator.
Konsentrasi indikator dalam titrasi Volhard juga tidak boleh sembarang karena titrant bereaksi dengan titrat maupun dengan indikator sehingga kedua reaksi ini sering saling mempengaruhi, tetapi tidak kritis. Konsentrasi lebih kecil dapat dipakai, tetapi untuk konsentrasi lebih besar maka warna asli kuningnya cukup jelas sehingga menyulitkan pengamatan warna kompleks Fe(CNS)3
(kon-sentrasi = 0,2 M).
Penerapan terpenting cara Volhard ialah penentuan secara tidak langsung ion-ion halogenida. Keadaan larutan yang harus asam sebagai syarat titrasi Volhard merupakan keuntungan dibanding penentuan ion halogenida, karena ion karbonat, oksalat dan arsenat tidak mengganggu sebab garamnya larut dalam keadaan asam.
Dalam titrasi ini suasana yang dibutuhkan harus asam yaitu dengan HNO3, sedangkan suasana basa/netral
tidak diperbolehkan.
► Jika digunakan HCl maka akan bereaksi dengan AgNO3
membentuk endapan AgCl putih.
HCl + AgNO3 AgCl putih + HNO3
► Jika suasana netral maka Fe(NH4)(SO4)2 akan
terhidro-lisis menjadi Fe(OH)3 yang berwarna coklat.
Fe3+ + 3H
2O Fe(OH)3 coklat + 3H+
► Jika suasana basa akan terbentuk AgOH yang kemudian terurai menjadi Ag2O hitam. AgNO3 dan sebagai indikator: indikator adsorpsi.
Dalam titrasi Fajans digunakan indikator adsorpsi yaitu zat yang dapat diserap pada permukaan endapan (diadsorpsi) dan menyebabkan timbulnya warna. Penyerapan ini dapat diatur agar terjadi pada titik ekivalen, antara lain dengan memilih macam indikator yang dipakai dan pH.
Cara kerja indikator adsorpsi ialah sebagai berikut:
larutan fluorescein akan mengion (untuk mudahnya ditulis HFl saja).
HFl H+ + Fl
Ion Fl inilah yang diserap oleh endapan AgX dan
menyebabkan endapan berwarna merah muda, karena penyerapan terjadi pada permukaan. Dalam titrasi ini di-usahakan agar permukaan endapan itu seluas mungkin supaya perubahan warna juga tampak sejelas mungkin maka endapan harus berukuran koloid. Penyerapan terjadi apabila endapan yang koloid itu permukaan positif, dengan perkataan lain setelah sedikit kelebihan titran (ion Ag+).
Pada tahap-tahap pertama dalam titrasi, endapan terdapat koloid menjadi bermuatan negatif.
Karena Fl juga negatif maka Fl tidak dapat diserap oleh
butiran koloid tersebut.
Makin lanjut titrasi dilakukan makin berkurang kelebihan ion. Menjelang titik ekivalen ion X yang diserap
endapan akan lepas kembali, bereaksi dengan titran sehingga muatan koloid makin berkurang negatifnya. Pada titik ekivalen tidak ada kelebihan X maupun Ag+. Jadi koloid
menjadi netral. Setetes titran kemudian menyebabkan kelebihan ion Ag+. Ion-ion Ag+ ini diserap oleh koloid yang
menjadi positif dan selanjutnya dapat menarik Fl dan
nyebabkan warna endapan berubah mendadak menjadi me-rah muda.
Pada waktu bersamaan sering juga terjadi penggumpalan koloid maka larutan yang tadinya keruh menjadi jernih atau lebih jernih.
Dari kesetimbangan pengionan HFl di atas terlihat bahwa konsentrasi Fl akan sangat dipengaruhi oleh pH.
Makin rendah pH, makin mengarah kekiri kesetimbangan tersebut dan makin kecil konsentrasi Fl. Bila jumlah Fl
terlalu kecil maka perubahan warna akan kurang jelas dan titik akhir titrasi terlambat.
Kebanyakan indikator adsorpsi bersifat asam lemah, maka umumnya tidak dapat dipakai dalam larutan yang terlalu asam.
Ada juga beberapa indikator adsorpsi "kationik" yaitu bersifat basa lemah. Indikator demikian baik untuk titrasi dalam keadaan sangat asam.