SINTESIS NANOKRISTAL MAGNETIT MENGGUNAKAN
UREA SEBAGAI PENJERAP Cr(VI)
SETYONINGSIH
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2010
ABSTRAK
SETYONINGSIH.
Sintesis Nanokristal Magnetit Menggunakan Urea sebagai
Penjerap Cr(VI). Dibimbing oleh DEDEN SAPRUDIN dan AKHIRUDDIN
MADDU.
Penelitian ini bertujuan mensintesis dan mencirikan nanokristal magnetit.
Senyawa magnetit dalam bentuk serbuk telah berhasil disintesis dengan metode
hidrotermal dari FeSO
4sebagai prekursor serta natrium hidroksida dan urea
sebagai sumber basa. Serbuk yang diperoleh dicirikan dengan teknik difraksi
sinar-X, mikroskop elektron payaran, dan penganalisis sinar-X dispersif energi.
Ukuran kristal magnetit melalui difraksi sinar-X diperoleh dari 18,23 sampai
67,34 nm. Hasil mikroskop elektron payaran memperlihatkan partikel magnetit
mengalami aglomerasi. Serbuk magnetit digunakan sebagai penjerap Cr(VI).
Kapasitas adsorpsi magnetit berbasa urea pada pH 1 sampai 5 (2 jam)
berturut-turut 1.92; 1.91; 1.59; 1.20; dan 1.21 mg/g. Kapasitas adsorpsi magnetit berbasa
natrium hidroksida pada pH 1-5 (2 jam) berturut-turut 1.74; 1.83; 0.64; 0.69; dan
0.77 mg/g. Hasil ini menunjukkan bahwa magnetit berbasa urea mampu
meningkatkan kapasitas adsorpsi Cr(VI).
ABSTRACT
SETYONINGSIH. Synthesis of Magnetite Nanocrystal Used Urea as Cr(VI)
Adsorbent. Supervised by DEDEN SAPRUDIN and AKHIRUDDIN MADDU.
The study was to synthesize and characterize magnetite nanocrystal.
Magnetite powder was synthesized using hydrothermal method from FeSO
4as
precursor and sodium hydroxide and urea as the base sources. Characterization of
the obtained powder was carried out using X-ray diffraction, scanning electron
microscope, and energy dispersive X-ray analyzer. The crystallite size of
magnetite by X-ray diffraction was obtained from 18,23 to 67,34 nm. The
scanning electron microscope observations showed that magnetite particles
underwent agglomeration. Magnetite powder was used as Cr(VI) adsorbent. The
results showed that adsorption capacity for urea-based magnetite at pH 1-5 in 2
hours were 1.92; 1.91; 1.59; 1.20; and 1.21 mg/g, respectively. Adsorption
capacity for sodium hydroxide-based magnetite (pH 1-5, 2 hours) were 1.74; 1.83;
0.64; 0.69; and 0.77 mg/g. The results indicated that urea-based magnetite is able
to increase adsorption capacity.
SINTESIS NANOKRISTAL MAGNETIT MENGGUNAKAN
UREA SEBAGAI PENJERAP Cr(VI)
SETYONINGSIH
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2010
Judul : Sintesis Nanokristal Magnetit Menggunakan Urea sebagai Penjerap
Cr(VI)
Nama : Setyoningsih
NIM : G44060659
Menyetujui
Pembimbing I,
Pembimbing II,
Deden Saprudin, S.Si, M.Si Dr. Akhiruddin Maddu
NIP 196805181994121001 NIP 196609071998021006
Mengetahui
Ketua Departemen,
Prof. Dr. Ir. Tun Tedja Irawadi, MS
NIP 195012271976032002
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Allah SWT atas segala kasih
sayang, nikmat, rahmat, dan karunia-Nya sehingga penulis dapat menyelesaikan
skripsi ini. Skripsi yang berjudul ‘Sintesis Nanokristal Magnetit Menggunakan
Urea sebagai Penjerap Cr(VI)’ ini merupakan salah satu syarat untuk memperoleh
gelar sarjana sains pada Departemen Kimia FMIPA IPB.
Penulis mengucapkan terima kasih kepada Deden Saprudin, S.Si, M.Si dan
Dr. Akhiruddin Maddu sebagai pembimbing yang telah memberikan arahan,
saran, dan dorongan selama pelaksanaan penelitian dan penulisan skripsi ini.
Ungkapan terima kasih penulis berikan kepada keluarga tercinta, Bapak,
Mama, Mas Irwan, dan kedua orangtua Irwan Purnomo yang selalu memberikan
semangat, doa, dan kasih sayang dalam berbagai bentuk yang tak pernah putus.
Terima kasih juga kepada Pak Eman, Bu Nunung, Pak Ridwan, Pak Kosasih dan
seluruh staf Laboratorium Kimia Analitik; Mba Siti Rachmawati dan Mas Eko di
Laboratorium Bersama, Departemen Kimia; Mba Hasti, Mba Nurul, Mba Hikmah,
dan Mba Tia di Laboratorium Biofisika, Departemen Fisika, IPB; Pak Didik dan
Pak Dadang di Puslitbang Kehutanan Bogor; serta Pak Sulis di BATAN Serpong
atas fasilitas dan bantuan yang diberikan selama penelitian. Ucapan terima kasih
tak lupa penulis berikan kepada teman seperjuangan Kimia 43 dan
teman-teman Fisika 43 yang turut membantu, memberikan semangat dan dukungannya
dalam penyusunan skripsi, serta semua pihak yang tidak dapat penulis sebutkan
satu-persatu.
Semoga karya tulis ini dapat bermanfaat.
Bogor, Oktober 2010
RIWAYAT HIDUP
Penulis dilahirkan di Bogor pada tanggal 05 Oktober sebagai putri tunggal
dari ayah Jumingin dan Ibu Sri Sutiwi.
Tahun 2006 penulis lulus dari Sekolah Menengah Analis Kimia Bogor dan
pada tahun yang sama lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui
jalur Undangan Seleksi Masuk IPB (USMI). Penulis memilih Program Studi
Kimia, Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.
Selama mengikuti perkuliahan, penulis pernah menjadi asisten praktikum
Kimia Dasar pada tahun ajaran 2007/2008, 2009/2010, dan alih tahun 2008/2009,
Kimia Analitik II untuk program Ekstensi (2008/2009), Kimia Analitik IV untuk
program Ekstensi (2009/2010), Kimia Analitik Layanan (2010/2011), pengajar
Kimia Dasar di Bimbingan Belajar Avogadro IPB (2008/2009), pengajar Kimia
Dasar dan Kimia Analitik Layanan di Bimbingan Belajar Katalis IPB
(2009-sekarang). Bulan Juli-Agustus 2007, penulis melaksanakan praktik lapangan di
Unit Pelaksana Teknis Biomaterial LIPI.
DAFTAR ISI
Halaman
DAFTAR TABEL ... vi
DAFTAR GAMBAR ... vii
DAFTAR LAMPIRAN ... viii
PENDAHULUAN ... 1
TINJAUAN PUSTAKA ... 1
Nanokristal ... 1
Magnetit ... 1
Pemanasan Hidrotermal ... 2
Kromium ... 2
Difraksi Sinar-X ... 3
Mikroskop Elektron Payaran (SEM) ... 3
Adsorpsi ... 3
Mekanisme Adsorpsi ... 4
Spektrofotometer ... 4
BAHAN DAN METODE ... 4
Alat dan Bahan ... 4
Metode ... 4
HASIL DAN PEMBAHASAN ... 6
SIMPULAN DAN SARAN ... 11
DAFTAR PUSTAKA ... 11
DAFTAR TABEL
Halaman
1 Komposisi larutan B dan suhu sintesis ... 5
2 Perhitungan nilai hkl magnetit ... 6
3 Ukuran kristal magnetit ... 7
DAFTAR GAMBAR
Halaman
1 Batu magnetit ... 2
2 Struktur kristal magnetit ... 2
3 Reaktor pemanasan hidrotermal ... 2
4 Skema difraksi sinar-X menurut Hukum Bragg ... 3
5 Sinyal-sinyal yang diemisikan sampel bila bertumbukan dengan berkas
elektron pada SEM ... 3
6 Serbuk hasil sintesis sampel A (magnetit NaOH suhu 29 °C), B (magnetit
NaOH oleat suhu 29 °C), C (magnetit NaOH suhu 180 °C), D (magnetit
NaOH oleat suhu 180 °C), F (magnetit 8 g urea oleat suhu 300 °C), H
(goetit 6 g urea oleat suhu 300 °C), dan J (goetit 2 g urea oleat suhu 300 °C)
... 6
7 Pola difraksi serbuk D (magnetit NaOH oleat suhu 180 °C), F (magnetit 8 g
urea oleat suhu 300 °C), H (goetit 6 g urea oleat suhu 300 °C), dan J (goetit
2 g urea oleat suhu 300 °C). ( ) Fe
3O
4, ( ) Fe
2O
3·H
2O, ( ) FeSO
4... 7
8 Pola difraksi sampel B (magnetit NaOH oleat suhu 29 °C), C (magnetit
NaOH suhu 180 °C), dan D (magnetit NaOH oleat suhu 180 °C). ( ) Fe
3O
4,
( ) Fe
2O
3·H
2O
...8
9 Morfologi SEM sampel A (magnetit NaOH suhu 29 °C), B (magnetit NaOH
oleat suhu 29 °C), C (magnetit NaOH suhu 180 °C), D (magnetit NaOH
oleat suhu 180 °C), dan F (magnetit 8 g urea oleat suhu 300 °C) ... 9
10 Pola difraksi sampel A (magnetit NaOH suhu 29 °C) dan C (magnetit NaOH
suhu 180 °C). ( ) Fe
3O
4, ( ) Fe
2O
3·H
2O, ( ) FeSO
4... 9
11 Koloid sampel E (8 g urea oleat suhu 180 °C), F (8 g urea oleat suhu 300
°C), G (6 g urea oleat suhu 180 °C), H (6 g urea oleat suhu 300 °C), I (2 g
urea oleat suhu 180 °C), dan J (2 g urea oleat suhu 300 °C) ... 10
12 Grafik hubungan antara kapasitas adsorpsi dan pH pada sampel C (magnetit
NaOH suhu 180 °C), D (magnetit NaOH oleat suhu 180 °C), dan F
(magnetit 8 g urea oleat suhu 300 °C). ( ) C, ( ) D, dan (
x
) E ... 10
13 Grafik hubungan antara kapasitas adsorpsi dan waktu kontak pada sampel C
(magnetit NaOH suhu 180 °C), D (magnetit NaOH oleat suhu 180 °C), dan
F (magnetit 8 g urea oleat suhu 300 °C). ( ) C, ( ) D, dan (
x
) E... 11
DAFTAR LAMPIRAN
Halaman
1 Diagram alir penelitian ... 14
2 Spektrum absorpsi hasil reaksi 1,5-difenilkarbazida dengan Cr(VI) ... 15
3 Kurva standar kromium(VI) ... 15
4 Pola difraksi JCPDS ... 16
5 Hasil pengukuran difraksi sinar-X magnetit NaOH suhu 29 °C ... 17
6 Penentuan pH optimum oleh magnetit NaOH suhu 180 °C ... 17
7 Penentuan pH optimum oleh magnetit NaOH dan oleat suhu 180 °C ... 18
8 Penentuan pH optimum oleh magnetit urea dan oleat suhu 300 °C ... 18
1
PENDAHULUAN
Kromium merupakan kontaminan dalam air tanah dan tanah yang berasal terutama dari proses industri. Kromium memiliki sifat toksisitas yang tinggi dan karsinogenik walaupun pada konsentrasi rendah. Bentuk Cr(VI) seperti kromat (CrO4
2-) dan dikromat (Cr2O72-) memiliki sifat lebih berbahaya
terhadap lingkungan karena kromium bentuk ini sangat mudah larut dalam air sehingga mampu menyebabkan gangguan ginjal, pernafasan, dan kanker paru-paru. Bentuk Cr(III) merupakan bentuk yang tidak berbahaya (Suardana 2008).
Kristal magnetit merupakan material ferimagnetik yang digunakan dalam banyak aplikasi seperti perekam magnet, pengantar obat, katalis, ferofluida, dan bioteknologi. Selain itu, menurut Kendelewicz et al. (1999), magnetit mampu mereduksi Cr(VI) menjadi Cr(III) karena magnetit mengandung Fe(II) sehingga jumlah Cr(VI) dapat berkurang. Magnetit berorde nanometer mulai banyak dikembangkan karena memiliki keunggulan sifat, seperti luas permukaannya yang makin besar.
Metode yang sudah dikembangkan dalam sintesis magnetit berukuran nanometer di antaranya reaksi oksidasi-reduksi besi hidroksida, penyinaran mikrogelombang besi hidroksida, teknik mikro emulsi, dan teknik pemanasan hidrotermal. Menurut Byrappa & Adschiri (2007), pemanasan hidrotermal banyak digunakan karena mampu menghasilkan partikel murni dan homogen yang sangat tinggi.
Liang et al. (2006) telah mensintesis magnetit dan goetit dari prekursor FeSO4
secara hidrotermal dengan menambahkan sejumlah NaOH. Pada penambahan 1 g NaOH terbentuk magnetit, sedangkan dengan penambahan 0,5 g NaOH terbentuk goetit. Pada metode ini ditambahkan asam oleat yang berfungsi melapisi partikel magnetit dan goetit. Selain itu, Zhao & Asuha (2010) telah mensintesis magnetit dengan penambahan urea sebagai basa berdasarkan metode solvotermal dengan nisbah molar Fe(NO3)3·9H2O dan urea 1:6 dalam pelarut
etanol pada suhu 200 °C.
Penelitian ini mensintesis magnetit dan goetit secara hidrotermal dengan FeSO4
sebagai prekursor, NaOH dan urea sebagai sumber basa, serta asam oleat sebagai surfaktan. Serbuk kristal yang terbentuk dicirikan dengan alat difraksi sinar-X (XRD) untuk penentuan ukuran kristal dan fasa
kristal yang terbentuk, mikroskop elektron payaran (SEM) untuk pengamatan morfologi partikel, dan penganalisis sinar-X dispersif energi (EDXA) untuk penentuan komposisi kristal berbasa urea. Serbuk magnetit yang diperoleh diuji kemampuan adsorpsinya terhadap Cr(VI). Dari penelitian ini diharapkan terungkap pengaruh penambahan urea dan asam oleat pada karakteristik nanokristal yang terbentuk dan kemampuan adsorpsinya terhadap Cr(VI).
TINJAUAN PUSTAKA
Nanokristal
Material padatan dapat berwujud kristal dan amorf. Apabila atom atau molekul penyusun tersusun dalam pengulangan yang beraturan maka disebut kristal, sedangkan atom atau molekul penyusun amorf tidak memiliki pengulangan yang teratur. Kristal terbagi menjadi 4 jenis, yaitu kristal tunggal, polikristal, mikrokristal, dan nanokristal. Nanokristal memiliki skala ukuran 1–100 nm (Cullity & Stock 2001). Nanokristal merupakan jenis nanomaterial. Jenis nanomaterial lainnya ialah nanopartikel (nol dimensi), nanorods (satu dimensi), nanofilm (dua dimensi), dan bulk (tiga dimensi). Nanopartikel memiliki skala ukuran 1–100 nm.
Proses sintesis nanomaterial dapat berlangsung secara fisika atau kimia. Proses sintesis secara fisika tidak melibatkan reaksi kimia, yang terjadi hanya pemecahan material berukuran besar menjadi material berukuran nanometer tanpa mengubah sifat bahan. Proses sintesis secara kimia melibatkan reaksi kimia dari sejumlah material awal (prekursor) sehingga dihasilkan material lain yang berukuran nanometer (Abdullah 2009).
Magnetit
Magnetit (Fe3O4) merupakan oksida besi
magnet alam yang berupa padatan berwarna hitam dengan bobot jenis 5,1 g/cm3 (Gambar 1). Senyawa magnetit tersusun dari campuran Fe(II) berupa FeO dan Fe(III) berupa Fe2O3.
Senyawa magnetit memiliki sifat ferimagnetik dan stabil terhadap suhu tinggi (Cotton et al. 1999).
2
Gambar 1 Batu magnetit.
Magnetit memiliki struktur kristal spinel kubik FCC (face centered cubic) dengan panjang atau parameter kisi a = b = c dan sudut yang dibentuk sama yaitu sebesar 90°. Struktur spinel dapat dilihat pada Gambar 2. Spinel merupakan jenis struktur kristal yang memiliki dua substruktur, yaitu struktur tetrahedral dan struktur oktahedral. Pada bagian tetrahedral, ion-ion logam berlokasi di pusat tetrahedron dengan sudut-sudutnya ditempati oleh ion-ion oksigen, sedangkan pada bagian oktahedral, ion-ion logam berlokasi di pusat oktahedron dengan sudut-sudutnya ditempati oleh ion-ion oksigen (Duan et al. 2009).
Gambar 2 Struktur kristal magnetit (Duan et al. 2009).
Pemanasan Hidrotermal
Menurut Byrappa & Adschiri (2007), teknik pemanasan hidrotermal merupakan suatu teknik sintesis berdasarkan reaksi kimia di atas suhu kamar dan tekanan lebih besar dari 1 atm dalam sistem tertutup (Gambar 3). Metode ini dapat memaksimumkan proses reaksi kimia. Tekanan tinggi ini akan mencegah pertumbuhan kristal (Rizal & Ismunandar 2007). Metode pemanasan tanpa disertai pertumbuhan ukuran partikel akan meningkatkan kristalinitas. Setelah proses pemanasan, partikel-partikel senyawa tetap terpisah, tetapi telah mengalami peningkatan kristalinitas (Abdullah et al. 2008). Keuntungan menggunakan metode hidrotermal adalah dapat menghasilkan produk yang lebih murni, komposisi partikel lebih homogen, distribusi ukuran lebih baik,
dan ukuran partikel yang lebih kecil (Byrappa & Adschiri 2007).
Gambar 3 Reaktor pemanasan hidrotermal.
Kromium
Kromium termasuk unsur transisi golongan VI-B periode ke-4 yang mempunyai massa jenis 7,9 g/cm3 dan titik didih 2658 °C. Kromium banyak terdapat dalam bilangan oksidasi +3 dan +6. Kromium valensi enam merupakan komponen utama yang terikat dengan oksigen seperti kromat (CrO4
2-) atau dikromat (Cr2O7
2-) yang merupakan pengoksidasi kuat dan sangat mudah tereduksi menjadi Cr3+ dalam lingkungan asam.
Kromium valensi tiga terdapat dalam bentuk Cr3+, [Cr(OH)]2+, [Cr(OH)2]
+
, dan [Cr(OH)4]
-(Clesceri et al. 2005).
Kromium(VI) banyak digunakan dalam bidang industri seperti dalam industri elektroplating, produksi zat kimia kromium, cat, dan tekstil. Selain bermanfaat dalam industri, Cr(VI) bersifat toksik dan dapat menyebabkan gangguan metabolisme organ tubuh, seperti kerusakan hati dan ginjal, pendarahan di dalam tubuh, kerusakan saluran pernafasan, dan kanker paru-paru (Kusnoputranto 1996). Menurut Peraturan Pemerintah RI Nomor 82 Tahun 2001, nilai ambang batas Cr(VI) pada air minum maupun kebutuhan sehari-hari adalah 0,05 ppm.
Metode yang digunakan untuk pengukuran Cr(VI) pada berbagai material seperti tanah dan air adalah spektrofotometri ultraviolet sinar tampak (UV-Vis). Kromium(VI) bila ditambahkan larutan 1,5-difenilkarbazida (DPC) dalam larutan asam membentuk kompleks berwarna lembayung yang intensitasnya sebanding dengan banyaknya Cr(VI) dalam contoh. Pewarnaan dengan DPC cukup sensitif dengan nilai absorptivitas molar berkisar 40.000 L/mol cm pada panjang gelombang 540 nm (Clesceri et al. 2005).
3
Gambar 5 Sinyal-sinyal yang diemisikan sampel bila bertumbukan dengan berkas elektron pada SEM.
Difraksi Sinar-X
Difraksi sinar-X digunakan untuk mengetahui nilai parameter kisi, fasa kristal, ukuran kristal, dan derajat kekristalan. Metode XRD berdasarkan sifat difraksi sinar-X, yakni hamburan cahaya dengan panjang gelombang λ saat melewati kisi kristal dengan sudut datang θ dan jarak antarbidang kristal sebesar
d (Gambar 4).
Menurut Cullity & Stock (2001), ketika sinar-X ditembakkan pada bahan terjadi interaksi dengan elektron dalam atom. Saat foton sinar-X bertumbukan dengan elektron, beberapa foton hasil tumbukan akan mengalami pembelokan dari arah awal datang. Jika panjang gelombang hamburan sinar-X tidak berubah, maka dinamakan hamburan elastik. Sinar-X ini yang membawa informasi distribusi atom dalam suatu bahan. Syarat terjadinya difraksi ialah harus memenuhi hukum Bragg, yaitu 2 d sin θ = n λ
Gambar 4 Skema difraksi sinar-X menurut Hukum Bragg (Cullity & Stock 2001).
Ukuran kristal dapat ditentukan dengan pola XRD berdasarkan metode Scherrer. Ukuran kristal ditentukan berdasarkan pelebaran puncak XRD yang muncul. Metode ini sebenarnya memprediksi ukuran kristal dalam material, bukan ukuran partikel. Berdasarkan metode ini, makin lebar puncak difraksi yang dihasilkan, makin kecil ukuran kristal. Kristal yang berukuran besar dengan satu orientasi menghasilkan puncak difraksi yang mendekati sebuah garis vertikal. Kristal yang sangat kecil menghasilkan puncak difraksi yang sangat lebar (Abdullah 2009). Persamaan Scherrer sebagai berikut:
dengan D adalah ukuran (diameter) kristal, λ adalah panjang gelombang sinar-X yang digunakan (nm), θB adalah sudut Bragg, B
adalah full width at half maximum (FWHM)
suatu puncak yang dipilih, dan 0,9 adalah konstanta material.
Mikroskop Elektron Payaran(SEM)
SEM digunakan untuk mengamati morfologi pada suatu bahan. Prinsip SEM didasarkan pada sifat gelombang dari elektron, yaitu difraksi pada sudut yang sangat kecil. Elektron dihamburkan oleh sampel yang bermuatan. Jika sampel yang digunakan tidak bersifat konduktif, maka sampel terlebih dahulu harus dilapisi dengan emas (Prabakaran et al. 2005). Pembentukan citra pada SEM berasal dari berkas elektron yang dipantulkan oleh permukaan sampel (Gambar 5).
Suatu penganalisis sinar-X dispersif energi (EDXA) merupakan pelengkap dari SEM yang digunakan untuk analisis unsur-unsur dalam bahan. Analisis komposisi bahan dapat diperoleh dengan memantau sinar-X yang dihasilkan dari interaksi elektron dengan spesimen. Ketika berkas elektron mengenai spesimen, elektron akan menembus sampai ke suatu kedalaman yang bergantung secara langsung pada energi elektron dan nomor-nomor atom dari atom-atom yang ada di dalam spesimen (Abdullah 2009).
Adsorpsi
Adsorpsi merupakan terjerapnya suatu zat (molekul atau ion) pada permukaan adsorben. Adsorpsi yang terjadi pada permukaan padatan atau cairan dapat melibatkan satu atau banyak lapisan molekul. Selain itu, adsorpsi bergantung pada luas permukaan. Semakin besar luas permukaan, adsorpsi juga semakin besar. Adsorben yang baik adalah padatan yang sangat berongga dan butiran yang sangat halus (Rohaeni 2005).
Terdapat dua metode adsorpsi, yaitu tumpak (batch) dan lapik tetap (fixed bed). Pada metode tumpak, larutan sampel
B
cos
B
0,9
D
θ
λ
=
4
dicampur dan dikocok bersama-sama dengan adsorben sampai tercapainya kesetimbangan. Adsorpsi pada fase padat-cair ini mencapai kesetimbangan saat adsorben telah jenuh oleh adsorbat. Zat yang tidak teradsorpsi dipisahkan dari adsorben dengan cara penyaringan kemudian konsentrasi sisa larutan diukur.
Metode lapik tetap menggunakan kolom sebagai lapik, dan zat yang akan diadsorpsi dialirkan ke dalam kolom tersebut sebagai influen. Larutan yang keluar dari kolom merupakan sisa zat yang tidak teradsorpsi yang disebut efluen (McCabe et al. 2001).
Mekanisme Adsorpsi
Mekanisme adsorpsi dapat dibedakan menjadi dua, yaitu adsorpsi secara fisika (fisisorpsi) dan adsorpsi secara kimia (kemisorpsi). Pada proses fisisorpsi, gaya yang mengikat adsorbat oleh adsorben adalah gaya-gaya van der Waals. Molekul terikat sangat lemah dan energi yang dilepaskan pada adsorpsi fisika relatif rendah, yakni sekitar 20 kJ/mol. Sementara pada proses adsorpsi kimia, interaksi adsorbat dengan adsorben melalui pembentukan ikatan kimia. Kemisorpsi terjadi diawali dengan adsorpsi fisik, yaitu partikel-partikel adsorbat mendekat ke permukaan adsorben. Selanjutnya, proses diikuti oleh adsorpsi kimia. Reaksi yang terjadi dapat berupa reaksi reduksi-oksidasi (Atkins 1999).
Menurut Yuan et al. (2009), anion Cr(VI) dalam larutan dijerap pada permukaan adsorben magnetit kemudian direduksi menjadi Cr(III). Kromium (III) yang terbentuk berupa senyawa CrOOH (Peterson et al. 1997).
Spektrofotometer
Spektrofotometer merupakan alat yang digunakan untuk mengukur jumlah analat suatu sampel dengan menggunakan metode analisis spektrofotometri. Sumber radiasi yang digunakan adalah lampu deuterium untuk mendapatkan radiasi di daerah ultraviolet, yaitu daerah dengan panjang gelombang 180– 350 nm dan lampu wolfram untuk mendapatkan radiasi di daerah sinar tampak sampai inframerah dekat, yaitu daerah dengan panjang gelombang 350–2500 nm (Rouessac & Rouessac 2007).
Sinar radiasi yang dipancarkan kemudian dilewatkan pada lensa yang berfungsi untuk membuat berkas sinar menjadi sejajar. Berkas
sinar tersebut dilewatkan ke sebuah celah yang berfungsi untuk mempersempit berkas sinar. Sinar tersebut diteruskan ke monokromator yang berfungsi menghasilkan sinar yang monokromatis yang kemudian diserap oleh zat yang akan diukur yang ditempatkan pada sel. Sinar yang diteruskan mencapai fotosel yang berfungsi untuk mengubah energi cahaya menjadi energi listrik. Energi listrik yang dihasilkan dalam fotosel memberikan sinyal pada detektor, kemudian dari sinar tersebut dapat dibaca nilai serapan ataupun transmisi radiasi dari zat tersebut. Rumusan yang berlaku dalam metode spektrofotometri adalah hukum Lambert Beer, yaitu
-log (I/Io) = a . b . C
A = a . b . C
Keterangan :
A : absorbans atau serapan
C : konsentrasi zat
a : koefisien serapan spesifik
b : tebal zat
Io : intensitas mula-mula
I : intensitas akhir
BAHAN DAN METODE
Alat dan Bahan
Alat yang digunakan adalah reaktor bertekanan, XRD Shimadzu Philips, SEM-EDXA Bruker, dan spektrofotometer UV-Vis 1700 PharmaSpec.
Bahan yang digunakan adalah garam FeSO4·7H2O, NaOH, urea, asam oleat, etanol,
larutan kromium(VI) dari K2Cr2O7, dan
larutan difenilkarbazida.
Metode
Metode percobaan ini terdiri atas tiga tahap. Tahap pertama adalah sintesis nanokristal magnetit. Tahap kedua ialah karakterisasi nanokristal magnetit yang diperoleh. Selanjutnya, pada tahap ketiga kemampuan penjerapan nanokristal magnetit terhadap kromium(VI) diuji (Lampiran 1).
Sintesis Nanokristal Fe3O4 (Magnetit) (Liang et al. 2006)
Sintesis magnetit dibuat dengan 7 variasi. Sebanyak 0,556 g garam FeSO4·7H2O
dilarutkan dalam air sampai volumenya 50 ml (larutan A) dan disiapkan larutan B dengan komposisi seperti pada Tabel 1. Selanjutnya,
5
masing-masing larutan B dimasukkan ke dalam larutan A, kemudian direaksikan pada suhu sintesis masing-masing dengan pengadukan 500 rpm selama 10 jam. Produk yang dihasilkan didinginkan pada suhu kamar. Hasil yang berupa endapan langsung disaring, sedangkan hasil yang berupa koloid ditambahkan 50 mL etanol sampai didapatkan endapan halus, kemudian dipisahkan endapannya dengan penyaringan menggunakan kertas saring. Endapan yang diperoleh dicuci dan dikeringkan.
Tabel 1 Komposisi larutan B dan suhu sintesis Komposisi Larutan B Suhu Sintesis (°C) Kode Sampel NaOH 1 g + etanol 10 ml + air sampai 50 ml 29 A NaOH 1 g + asam oleat 2,5 ml + etanol 10 ml + air sampai 50 ml 29 B NaOH 1 g + etanol 10 ml + air sampai 50 ml 180 C NaOH 1 g + asam oleat 2,5 ml + etanol 10 ml + air sampai 50 ml 180 D Urea 8 g + asam oleat 2,5 ml + etanol 10 ml + air sampai 50 ml 180 E Urea 8 g + asam oleat 2,5 ml + etanol 10 ml + air sampai 50 ml 300 F Urea 6 g + asam oleat 2,5 ml + etanol 10 ml + air sampai 50 ml 180 G Urea 6 g + asam oleat 2,5 ml + etanol 10 ml + air sampai 50 ml 300 H Urea 2 g + asam oleat 2,5 ml + etanol 10 ml + air sampai 50 ml 180 I Urea 2 g + asam oleat 2,5 ml + etanol 10 ml + air sampai 50 ml 300 J Pencirian XRD
Pencirian XRD dilakukan untuk mengetahui fasa yang terdapat dalam sampel dan untuk menentukan ukuran kristal. Sekitar 200 mg sampel dicetak langsung pada aluminium ukuran 2×2,5 cm. Sampel dikarakterisasi menggunakan alat XRD dengan lampu radiasi Cu.
Pencirian SEM-EDXA
Pencirian dengan SEM dilakukan untuk mengetahui morfologi sampel, sedangkan EDXA untuk mengetahui komposisi sampel yang menggunakan basa urea. Sampel diletakkan pada plat aluminium yang memiliki dua sisi kemudian dilapisi dengan lapisan emas setebal 48 nm. Sampel yang telah dilapisi diamati menggunakan SEM dengan tegangan 22 kV dan perbesaran tertentu.
Adsorpsi
Sebanyak 25 mg nanokristal magnetit ditambahkan ke dalam 10 ml larutan kromium(VI) berkonsentrasi 5 ppm. Larutan ditambahkan HNO3 0,1 M untuk menurunkan
pH. Larutan tersebut kemudian digoyang dengan putaran 160 rpm selama 1, 2, 3, dan 4 jam pada pH 1, 2, 3, 4, dan 5 (Ajouyed et al. 2010). Proses adsorpsi dilakukan pada suhu kamar. Larutan yang tersisa disaring dan diukur kandungan kromiumnya dengan spektrofotometer UV-Vis. Kapasitas adsorpsi kromium(VI) dapat dicari dengan rumus
q = [v(Co – Ct)]/m, dengan q adalah kapasitas adsorpsi kromium(VI) (mg/g), v adalah volume larutan kromium(VI) (liter), Co adalah konsentrasi larutan kromium(VI) sebelum proses adsorpsi (mg/L), Ct adalah konsentrasi kromium(VI) setelah proses adsorpsi (mg/L), dan m adalah jumlah nanokristal magnetit yang digunakan (g) (Yuan et al. 2010).
Analisis Kromium(VI) dan Pembuatan Kurva Standar
Analisis kromium dilakukan dengan cara memasukkan sejumlah larutan Cr(VI) yang akan diukur ke dalam labu takar 50 mL. Selanjutnya, larutan ditambahkan 5 tetes H2SO4 0,2 N, 5 tetes H3PO4 85%, dan
ditambahkan 1,0 mL larutan difenilkarbazida. Larutan tersebut diencerkan dengan air bebas ion sampai tanda tera dan dikocok sampai bercampur merata. Setelah didiamkan selama 5–10 menit, larutan diukur dengan spektrofotometer UV-Vis pada λ 542,2 nm (Lampiran 2) (Clesceri et al. 2005).
Pembuatan kurva standar diawali dengan menyiapkan larutan standar Cr(VI) berbagai
6
konsentrasi, yaitu 0,1; 0,2; 0,4; 0,6; 0,8; dan 1,0 ppm (dari bahan baku Cr(VI) 50 ppm), kemudian masing-masing ditambahkan 1,0 mL difenilkarbazida. Blangko dibuat dengan menggantikan larutan standar oleh air bebas ion dalam jumlah yang sama. Selanjutnya larutan-larutan ini diukur serapannya dan dibuat kurva standar hubungan antara konsentrasi Cr(VI) dan absorbans untuk menentukan konsentrasi Cr(VI) pada sampel (Lampiran 3).
HASIL DAN PEMBAHASAN
Pengaruh Penambahan Basa pada Sintesis Magnetit
Berdasarkan hasil sintesis, dengan penambahan 1 g basa NaOH dihasilkan serbuk berwarna hitam (sampel A, B, C, dan D), sedangkan dengan penambahan 8 g basa urea (suhu 300 °C) diperoleh serbuk berwarna hitam kecokelatan (sampel F). Penambahan urea sebanyak 6 g dan 2 g dengan sintesis pada suhu 300 °C menghasilkan serbuk yang berwarna kuning kecokelatan (sampel H dan J) (Gambar 6). Wiberg (1995) menyebutkan bahwa serbuk magnetit berwarna hitam dan serbuk goetit berwarna kuning kecokelatan. Berdasarkan warna serbuk yang dihasilkan, diduga sampel A, B, C, D, dan F mengandung magnetit, sedangkan sampel H dan J mengandung goetit.
Gambar 6 Serbuk hasil sintesis sampel A (magnetit NaOH suhu 29 °C), B (magnetit NaOH oleat suhu 29 °C), C (magnetit NaOH suhu 180 °C), D (magnetit NaOH oleat suhu 180 °C), F (magnetit 8 g urea oleat suhu 300 °C), H (goetit 6 g urea oleat suhu 300 °C), dan J (goetit 2 g urea oleat suhu 300 °C).
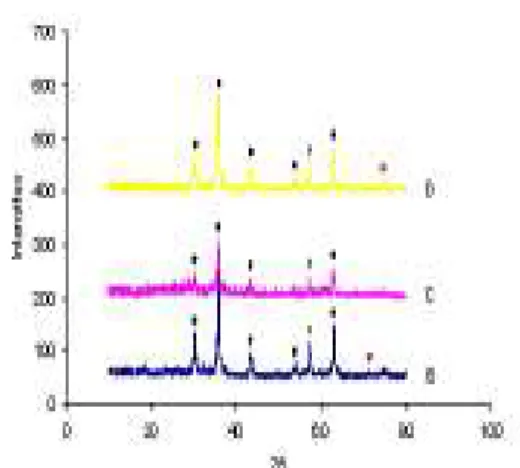
Terbentuknya kristal magnetit dan goetit dibuktikan dari pola XRD (Gambar 7,8,10).
Berdasarkan pola difraksi, Gambar 7 menunjukkan bahwa sampel D dan F mengandung kristal magnetit, sedangkan sampel H dan J mengandung kristal goetit. Puncak-puncak pada sampel D dan F yang terbentuk serupa dengan JCPDS No. 01-1111 (Joint Committee Powder Diffraction Standarduntuk magnetit murni) (Lampiran 4). Pada penelitian ini, magnetit hasil sintesis memiliki struktur kristal FCC (face centered cubic). Hal ini berdasarkan pola nilai h2 + k2 + l2 seperti terlihat pada Tabel 2. Menurut Cullity & Stock (2001), jika nilai h2 + k2 + l2
yang dihasilkan memiliki pola 3, 8, 11, 16, 24, 27, 32... maka kristal memiliki bentuk struktur FCC (face centered cubic).
Gambar 7 Pola difraksi serbuk D (magnetit NaOH oleat suhu 180 °C), F (magnetit 8 g urea oleat suhu 300 °C), H (goetit 6 g urea oleat suhu 300 °C), J (goetit 2 g urea oleat suhu 300 °C). ( ) Fe3O4, ( )
Fe2O3·H2O, ( ) FeSO4.
Tabel 2 Perhitungan nilai hkl magnetit
2θ h k l h2 + k2 + l2 30,24 2 2 0 8 35,56 3 1 1 11 43,16 4 0 0 16 53,48 4 2 2 24 57,18 5 1 1 27 62,88 4 4 0 32
Berdasarkan pola difraksi, sampel D memperlihatkan adanya puncak magnetit (30,24; 35,56; 43,16; 53,48; 57,18; dan 62,88°) dan goetit (74,24°). Munculnya puncak goetit pada sampel D karena basa NaOH yang digunakan tidak hanya bereaksi dengan prekursor FeSO4, tetapi juga dengan
asam oleat untuk membentuk surfaktan sehingga ketersediaan jumlah basa berkurang.
A B C
D F
7
Reaksi pembentukan magnetit ialah sebagai berikut:
3FeSO4 + 6NaOH + 1/2O2 → Fe3O4 +
3Na2SO4 + 3H2O
Penggunaan 8 g urea (suhu 300 °C) sebagai sumber basa memperlihatkan bahwa kristal magnetit yang terbentuk masih bercampur dengan goetit (Gambar 7). Hal ini disebabkan sumber basa OH- yang dihasilkan merupakan basa lemah. Selain itu, dekomposisi urea akan melepaskan OH -secara lambat (Subrt et al. 2006). Bukti lain terbentuknya kristal magnetit pada sampel F ialah serbuk hasil sintesis dapat tertarik juga oleh batang magnet seperti pada sampel A, B, C, dan D. Penambahan 6 g (sampel H) dan 2 g urea (sampel J) menghasilkan kristal goetit murni (Gambar 7). Hal ini ditunjukkan dengan adanya puncak-puncak yang mirip dengan JCPDS No. 02-0272 (Lampiran 4). Pola difraksi goetit ditunjukkan pada sudut 2θ sebesar 17,8; 21,18; 26,42; 33,28; 34,7; 36,66; 40,02; 41,22; 47,28; 50,64; 53,22; 57,56; 59,04; 61,44; dan 71,54°. Pada penambahan 6 dan 2 g urea tidak dihasilkan magnetit karena basa yang digunakan untuk bereaksi dengan prekursor FeSO4 merupakan basa lemah.
Menurut Liang et al. (2006), pembentukan magnetit membutuhkan basa kuat dengan konsentrasi tinggi, sedangkan penambahan basa berkonsentrasi rendah akan menghasilkan goetit. Penambahan 8 g urea dan asam oleat (sampel F) menghasilkan ukuran kristal magnetit lebih kecil dibandingkan dengan penambahan 1 g NaOH dan asam oleat (sampel D) (Tabel 3).
Tabel 3 Ukuran kristal magnetit
Sampel Ukuran (nm) A 67,34 B 43,42 C 59,00 D 36,93 F 18,23
Catatan : A (magnetit NaOH suhu 29 °C), B (magnetit NaOH oleat suhu 29 °C), C (magnetit NaOH suhu 180 °C), D (magnetit NaOH oleat suhu 180 °C), dan F (magnetit 8 g urea oleat suhu 300 °C).
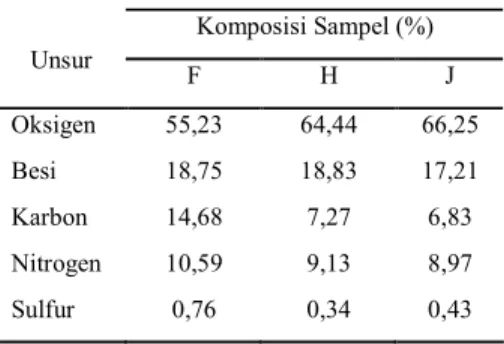
Analisis EDXA dilakukan pada sampel F, H, dan J untuk membuktikan terbentuknya senyawa bernitrogen karena penggunaan basa urea. Berdasarkan analisis unsur oleh EDXA, sampel F, H, dan J tersusun dari unsur
oksigen, besi, karbon, nitrogen, dan sulfur (Tabel 4). Adanya unsur karbon berasal dari urea dan asam oleat yang ditambahkan, adanya nitrogen berasal dari basa urea yang digunakan, dan adanya sulfur berasal dari prekursor garam besi sulfat. Tabel 4 memperlihatkan pengaruh penambahan urea terhadap komposisi nanokristal. Semakin banyak urea, komposisi nitrogen sampel semakin banyak. Komposisi nitrogen dalam sampel menunjukkan tidak hanya terbentuk magnetit atau goetit dari hasil sintesis. Menurut Zhao & Asuha (2010), senyawa kompleks [Fe(CON2H4)6]SO4 akan terbentuk
lebih awal sebelum terbentuk magnetit. Dengan adanya panas (200 °C), urea akan lepas dan terbentuk magnetit atau goetit. Selain itu, menurut Winarso (2004), pemanasan urea tidak hanya menghasilkan CO2 dan NH3, tetapi juga menghasilkan
produk samping senyawa biuret NH2CONHCONH2. Berdasarkan MSDS
(Material Safety Data Sheet), urea mulai mengurai pada suhu 132,7 °C. Reaksi yang terjadi dalam reaktor ialah sebagai berikut: FeSO4 + 6NH2CONH2 →
[Fe(NH2CONH2)6]SO4
[Fe(NH2CONH2)6]SO4 → FeSO4 +
6NH2CONH2
6NH2CONH2 + 6H2O → 12NH3 + 6CO2
12NH3 + 12H2O → 12NH4OH
6FeSO4 + 12NH4OH + O2 → 2Fe3O4 +
6(NH4)2SO4 + 6H2O
Terdapat pula reaksi samping:
2NH2CONH2 → NH2CONHCONH2 + NH3
Tabel 4 Komposisi sampel dengan basa urea
Komposisi Sampel (%) Unsur F H J Oksigen 55,23 64,44 66,25 Besi 18,75 18,83 17,21 Karbon 14,68 7,27 6,83 Nitrogen 10,59 9,13 8,97 Sulfur 0,76 0,34 0,43
Catatan : F (magnetit 8 g urea oleat suhu 300 °C), H (goetit 6 g urea oleat suhu 300 °C), dan J (goetit 2 g urea oleat suhu 300 °C).
8
Pengaruh Penambahan Asam Oleat pada Sintesis Magnetit
Penambahan asam oleat dilakukan pada sintesis sampel B, D, E, F, G, H, I, dan J. Dengan penambahan asam oleat, dihasilkan produk berupa koloid, karena terbentuk surfaktan natrium oleat atau amonium oleat. Molekul surfaktan akan menempel pada permukaan partikel dan melindungi permukaan tersebut dari pertambahan atom prekursor yang belum bereaksi. Produk yang berupa koloid dipisahkan endapannya dengan penambahan etanol. Setelah produk ditambahkan etanol dan didiamkan, endapan akan terpisah. Hal ini dikarenakan interaksi antara surfaktan garam oleat dan partikel magnetit diganggu oleh etanol sehingga magnetit ataupun goetit mengendap. Pada sampel A dan C, magnetit yang terbentuk langsung mengendap, karena tidak ada penambahan asam oleat sehingga tidak terbentuk koloid.
Serbuk magnetit diperoleh dari sampel A, B, C, D, dan F. Berdasarkan sampel C dan D, adanya penambahan asam oleat pada sampel D akan menghasilkan ukuran kristal lebih kecil dibandingkan dengan sampel C. Surfaktan yang dihasilkan dari asam oleat dan basa berperan melindungi permukaan partikel dari prekursor lain sehingga mencegah terjadinya pertumbuhan kristal (Yin et al.
2004). Ukuran kristal magnetit dihitung dari persamaan Debye-Scherrer berdasarkan data FWHM (Lampiran 5). Hasil perhitungan ukuran kristal magnetit diperlihatkan pada Tabel 3. Ukuran kristal magnetit yang diperoleh lebih kecil dari 100 nm maka dapat dikatakan sampel magnetit yang diperoleh adalah nanokristal. Namun, sampel tersebut belum tentu nanopartikel karena kristal yang terbentuk belum diketahui termasuk monokristal atau polikristal. Menurut Cullity & Stock (2001), partikel dapat tersusun dari banyak kristal maupun kristal tunggal.
Berdasarkan pola difraksi Gambar 8, magnetit murni muncul pada sampel C karena NaOH yang ditambahkan hanya bereaksi dengan prekursor FeSO4. Pola difraksi B dan
D memperlihatkan adanya puncak magnetit (30,24; 35,56; 43,16; 53,48; 57,18; dan 62,88°), namun terbentuk pula goetit (74,24°) (Gambar 8). Munculnya puncak goetit pada sampel B dan D dikarenakan basa yang digunakan tidak hanya bereaksi dengan prekursor FeSO4, tetapi juga dengan asam
oleat untuk membentuk surfaktan. Selain itu, basa yang digunakan merupakan basa lemah.
Gambar 8 Pola difraksi sampel B (magnetit NaOH oleat suhu 29 °C), C (magnetit NaOH suhu 180 °C), dan D (magnetit NaOH oleat suhu 180 °C). ( ) Fe3O4, ( ) Fe2O3·H2O.
Fungsi lain penambahan asam oleat adalah sebagai pencegah terjadinya aglomerasi antarpartikel. Morfologi sampel dapat dilihat dari hasil SEM. Analisis SEM hanya dilakukan pada sampel A, B, C, D, dan F yang merupakan magnetit, sedangkan pada sampel H dan J tidak dilakukan karena yang terbentuk bukan magnetit, melainkan goetit murni. Hasil SEM pada Gambar 9 memperlihatkan perbedaan morfologi partikel. Foto SEM sampel dilihat dengan perbesaran 10000 kali. Pada foto sampel B dan D, partikel magnetit yang terbentuk terlihat sedikit lebih terpisah dibandingkan dengan sampel A dan C. Hal ini disebabkan oleh adanya surfaktan garam oleat yang melapisi partikel sampel B dan D. Surfaktan yang melapisi partikel di samping mencegah terjadinya pertumbuhan kristal, juga menghindari penggumpalan partikel membentuk aglomerasi yang lebih besar (Abdullah et al. 2008). Namun, penambahan asam oleat pada sintesis terlampau sedikit, sehingga partikel sampel B dan D masih agak teraglomerasi. Sampel F juga masih memperlihatkan terjadinya aglomerasi butiran partikel. Selain itu, menurut Zhao & Asuha (2010), aglomerasi dapat juga terjadi karena adanya interaksi magnetik antarpartikel magnetit.
9
Gambar 9 Morfologi SEM sampel A (magnetit NaOH suhu 29 °C), B (magnetit NaOH oleat suhu 29 °C), C (magnetit NaOH suhu 180 °C), D (magnetit NaOH oleat suhu 180 °C), dan F (magnetit 8 g urea oleat suhu 300 °C).
Pengaruh Penggunaan Teknik Hidrotermal pada Sintesis Magnetit
Sintesis magnetit dilakukan tanpa teknik hidrotermal (29 °C) dan dengan teknik hidrotermal pada suhu 180 dan 300 °C. Pada sintesis magnetit tanpa teknik hidrotermal
dengan penambahan 1 g NaOH (sampel A) dapat dihasilkan kristal magnetit, tapi tidak optimal karena masih adanya sisa prekursor FeSO4. Pola difraksi kristal magnetit
ditunjukkan pada sudut 2θ sebesar 30,24; 35,56; 43,16; 53,48; 57,18; dan 62,88°, serta prekursor FeSO4 sebesar 36,66; 41,08; 59,18;
dan 62,26°. Selain itu, pada pola difraksi sampel A terbentuk pula kristal goetit (21,2; 33,26; 71,5; dan 74,32°). Pada sampel A munculnya goetit dan prekursor FeSO4 karena
reaksi kimia tidak berlangsung sempurna pada suhu rendah (Gambar 10). Sintesis magnetit menggunakan teknik hidrotermal (suhu 180 °C) dengan penambahan 1 g NaOH menghasilkan kristal magnetit murni (sampel C). Hasil XRD ditunjukkan terbentuknya puncak-puncak magnetit saja pada sampel C (Gambar 10). Hal ini sesuai dengan pernyataan Byrappa & Adschiri (2007) bahwa penggunaan teknik hidrotermal mampu menghasilkan produk yang lebih murni. Selain itu, reaksi pada suhu tinggi akan menghasilkan reaksi yang sempurna.
Gambar 10 Pola difraksi sampel A (magnetit NaOH suhu 29 °C) dan C (magnetit NaOH suhu 180 °C). ( ) Fe3O4, ( ) Fe2O3·H2O, ( )
FeSO4.
Sintesis pada suhu 180 °C dengan penambahan 8, 6, dan 2 g urea tidak dapat menghasilkan magnetit. Penggunaan suhu 180 °C dengan penambahan 6 dan 2 g urea (sampel G dan I) menghasilkan produk yang berwarna kuning kecokelatan dan terbentuk 2 lapisan dari asam oleat dan air. Hal ini dikarenakan basa yang dihasilkan merupakan basa lemah, sehingga basa tidak cukup bereaksi dengan asam oleat dan garam FeSO4.
Pada penambahan 8 g urea dengan suhu 180 °C (sampel E), produk mulai berwarna hitam kecokelatan, namun masih terbentuk 2 lapisan karena basa ammonium dari urea belum
A
B
C
F D
10
0 0,5 1 1,5 2 2,5 0 1 2 3 4 5 pH K a p a s it a s a d s o rp s i (m g /g )bereaksi sempurna dengan asam oleat pada suhu tersebut. Produk mulai terbentuk 1 lapisan koloid pada suhu 300 °C. Dengan penambahan asam oleat dihasilkan produk berupa koloid karena terbentuknya surfaktan ammonium oleat. Penambahan 6 dan 2 g urea pada suhu 300 °C (sampel H dan J) menghasilkan produk koloid kuning kecokelatan, sedangkan penambahan 8 g urea pada suhu 300 °C (sampel F) menghasilkan produk berwarna hitam kecokelatan (Gambar 11). Berdasarkan hasil sintesis dapat dijelaskan bahwa penggunaan suhu semakin tinggi akan menyempurnakan proses reaksi. Subrt et al. (2006) menggunakan suhu 1000 °C selama 2 jam pada sintesis oksida logam dengan penambahan urea. Sedangkan Zhao & Asuha (2010) menggunakan suhu 200 °C selama 50 jam untuk sintesis magnetit dengan urea sebagai basa.
Gambar 11 Koloid sampel E (8 g urea oleat suhu 180 °C), F (8 g urea oleat suhu 300 °C), G (6 g urea oleat suhu 180 °C), H (6 g urea oleat suhu 300 °C), I (2 g urea oleat suhu 180 °C), dan J (2 g urea oleat suhu 300 °C).
Selanjutnya, jika membandingkan sampel A dan C, penggunaan teknik pemanasan hidrotermal akan menghasilkan ukuran kristal magnetit lebih kecil (Tabel 3). Hal ini disebabkan perlakuan hidrotermal pada suhu tinggi dalam sistem tertutup akan menghasilkan tekanan di atas 1 atm. Tekanan tinggi ini akan mencegah pertumbuhan kristal (Rizal & Ismunandar 2007).
Adsorpsi Magnetit Terhadap Cr(VI)
Adsorpsi terhadap Cr(VI) hanya dilakukan pada sampel C, D, dan F. Pada sampel A dan B tidak dilakukan adsorpsi karena masih terdapat prekursor FeSO4 di
serbuk hasil sintesis. Kristal FeSO4 ini juga
memiliki kemampuan mereduksi Cr(VI)
menjadi Cr(III). Pada sampel H dan J tidak dilakukan adsorpsi karena kristal yang terbentuk bukan magnetit melainkan goetit murni.
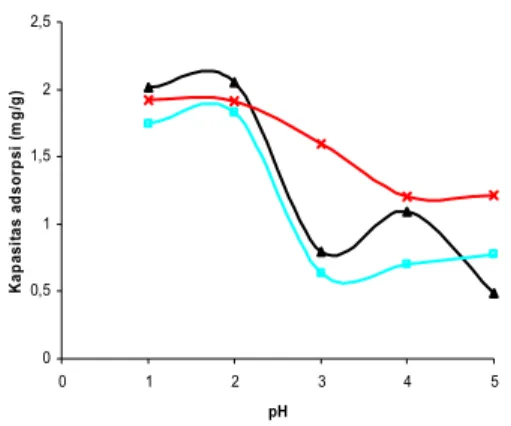
Gambar 12 memperlihatkan sampel C, D, dan F pada pH 1 dan 2 memiliki kapasitas adsorpsi Cr(VI) besar kemudian turun setelah pH di atas 2. Berdasarkan penelitian Peterson
et al. (1996), magnetit dapat mengadsorpsi Cr(VI) dengan optimum pada pH 2. Jenis Cr(VI) yang paling dominan pada larutan pH 1-5 adalah anion HCrO4
dan pada pH di atas 6 lebih dominan CrO4
(Palmer & Puls 1994). Sampel C dan D memiliki kapasitas adsorpsi masing-masing sebesar 2,0486 mg/g dan 1,8304 mg/g pada pH 2, sedangkan sampel F memiliki kapasitas adsorpsi sebesar 1,9243 mg/g. Berdasarkan hasil penelitian, jenis anion Cr(VI) yang paling dominan terdapat di larutan dan diadsorpsi magnetit adalah HCrO4-. Pada pH 2, kapasitas adsorpsi
sampel C cenderung lebih tinggi (Lampiran 6-8). Hal ini disebabkan kristal yang diperoleh murni magnetit. Kromium(VI) akan tereduksi menjadi Cr(III) oleh Fe(II) dari magnetit jika teradsorpsi pada permukaannya (Kendelewicz
et al. 1999). Sebelum Cr(VI) mengalami reaksi reduksi, senyawa Cr(VI) akan menempel lebih dahulu pada permukaan adsorben nanokristal magnetit. Reaksi yang terjadi ialah sebagai berikut:
6Fe3O4 + 2HCrO4 + 2H3O + → 9Fe2O3 + 2CrOOH + 3H2O
Gambar 12 Grafik hubungan antara kapasitas adsorpsi dan pH pada sampel C (magnetit NaOH suhu 180 °C), D (magnetit NaOH oleat suhu 180 °C), dan F (magnetit 8 g urea oleat suhu 300 °C). ( ) C, ( ) D, dan (
x
) F.Kapasitas adsorpsi pada sampel D cenderung lebih rendah walaupun ukuran kristal sedikit lebih kecil dari sampel C. Hal
I J
G
H
11
1 1,2 1,4 1,6 1,8 2 2,2 0 1 2 3 4Waktu kontak (jam)
K a p a s it a s a d s o rp s i (m g /g )
ini disebabkan adanya surfaktan (garam oleat) yang menghalangi sisi aktif magnetit. Kapasitas adsorpsi sampel C dan D mengalami penurunan kapasitas adsorpsi drastis dibandingkan dengan sampel F pada pH 2–5. Hal ini dikarenakan sampel F memiliki kandungan nitrogen dari senyawa biuret NH2CONHCONH2. Gugus -NH2 pada
senyawa tersebut dalam suasana asam akan menjadi -NH3+. Oleh karena itu, pada adsorpsi
sampel F akan terjadi juga interaksi kation -NH3
+
dengan anion HCrO4
-.
Penentuan waktu optimum adsorpsi dilakukan untuk mengetahui waktu minimum yang dibutuhkan oleh adsorben nanokristal magnetit dalam mengadsorpsi ion logam Cr(VI) secara maksimum sampai tercapai keadaan jenuh. Gambar 13 menunjukkan bahwa kapasitas adsorpsi cenderung meningkat dengan bertambahnya waktu kontak. Kapasitas adsorpsi sampel C meningkat pada waktu kontak 1 sampai 4 jam. Kapasitas adsorpsi sampel D mengalami kenaikan pada waktu 1 sampai 2 jam, kemudian mulai mengalami penurunan pada waktu 3 jam. Kapasitas adsorpsi mengalami sedikit peningkatan kembali pada waktu 4 jam. Kapasitas adsorpsi sampel F mengalami kenaikan pada waktu 1 sampai 2 jam dan kemudian mengalami sedikit penurunan pada waktu setelah 2 jam.
Gambar 13 Grafik hubungan antara kapasitas adsorpsi dan waktu kontak pada sampel C (magnetit NaOH suhu 180 °C), D (magnetit NaOH oleat suhu 180 °C), dan F (magnetit 8 g urea oleat suhu 300 °C). ( ) C, ( ) D, dan (
x
) F.Turunnya jumlah ion Cr(VI) yang teradsorpsi dapat disebabkan oleh ketidakstabilan ikatan antara ion Cr(VI) dan
magnetit saat menempel pada permukaan adsorben sehingga kemungkinan ada Cr(VI) yang terlepas kembali sebelum mengalami reduksi. Hasil penelitian menunjukkan bahwa sampel D dan F memiliki waktu kontak optimum 2 jam. Pada sampel C, kapasitas adsorpsi mengalami peningkatan dari waktu 1 sampai 4 jam. Kapasitas adsorpsi sampel C pada waktu maksimum 4 jam diperoleh sebesar 1,9595 mg/g (Lampiran 9).
SIMPULAN DAN SARAN
Simpulan
Urea sebanyak 8 g dapat digunakan untuk mensintesis dan memodifikasi magnetit secara hidrotermal pada suhu minimum 300 °C selama 10 jam. Penggunaan urea sebagai sumber basa mampu menghasilkan ukuran kristal magnetit yang lebih kecil dibandingkan NaOH. Kemampuan adsorpsi magnetit berbasa urea terhadap Cr(VI) memiliki jangkauan pH yang lebih lebar.
Saran
Suhu sintesis sebaiknya ditingkatkan untuk pembentukan kristal magnetit yang lebih baik. Penambahan jumlah surfaktan perlu dilakukan karena masih terjadinya aglomerasi terhadap produk. Perlu juga dilakukan sifat penjerapan goetit terhadap Cr(VI).
DAFTAR PUSTAKA
Abdullah M, Virgus Y, Nirmin, Khairurrijal. 2008. Sintesis nanomaterial. J Nanosains Nanoteknol 1:33-57.
Abdullah M. 2009. Pengantar Nanosains. Bandung: ITB Pr.
Ajouyed O, Hurel C, Ammari M, Allal LB, Marmier N. 2010. Sorption of Cr(VI) onto natural iron and aluminium (oxy)hydroxides: Effects of pH, ionic strength and initial concentration. J Hazardous Mat 174:616-622.
Atkins PW. 1999. Kimia Fisik. Kartohadiprojo II, penerjemah. Jakarta: Erlangga. Terjemahan dari: Physical Chemistry.
Byrappa K, Adschiri T. 2007. Hydrothermal technology for nanotechnology. Prog in
12
Cryst Growth and Characterization Mat
53:117-166.
Clesceri LS, Greenberg AE, Eaton AD. 2005.
Standard Methods for Examination of
Water and Wastewater. Ed. ke-21.
Washington DC: American Public Health Association.
Cotton FA, Wilkinson G, Murillo CA, Bochman M. 1999. Advanced Inorganic Chemistry. Texas: J Wiley.
Cullity BD, Stock SR. 2001. Elements of X-Ray Diffraction. New Jersey: Prentice Hall.
Duan L, Jia S, Wang Y, Chen J, Zhao L.
2009. Synthesis of Fe3O4 polyhedra by
hydrothermal method: using L-arginine as precipitator. J Mat Sci 44:4407-4412. Kendelewicz et al. 1999. X-ray absorption
and photoemission study of the adsorption of aqueous Cr(VI) on single crystal hematite and magnetite surfaces. Surface Sci 424:219-231.
Kusnoputranto H. 1996. Toksikologi
Lingkungan Logam Toksik dan B3.
Jakarta: Fakultas Kesehatan Masyarakat dan Pusat Penelitian Sumber Daya Manusia dan Lingkungan, Universitas Indonesia.
Liang et al. 2006. Synthesis of nearly monodisperse iron oxide and oxyhydroxide nanocrystals. Adv Functional Mat 16:1805-1813.
McCabe WL et al. 2001. Unit Operation of Chemical Engineering. Ed. ke-6. New York: McGraw Hill.
Palmer CD, Puls RW. 1994. Natural attenuation of hexavalent chromium in groundwater and soils. EPA Ground Water Issue 540:1-12.
Peterson ML, White AF, Brown GE, Parks GA. 1997. Surface passivation of magnetite by reaction with aqueous Cr(VI): XAFS and TEM results. Environ Sci & Technol 31:1573-1576.
Prabakaran K, Balamurunga A, Rajeswari S. 2005. Development of calcium phosphate based apatie from Hen’s eggshell. Bull Mat Sci 28:115-119.
Rizal M, Ismunandar. 2007. Sintesis dengan metode hidrotermal dan karakterisasi senyawa berstruktur Aurivillius Bi4Ti3O12. J Mat Sains 12:44-48.
Rohaeni A. 2005. Penetapan kapasitas jerapan zeolit dan zeolit termodifikasi heksadesiltrimetil amonium bromida terhadap K2Cr2O7 [skripsi]. Bogor:
Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Rouessac F, Rouessac A. 2007. Chemical
Analysis: Modern Instrumentation
Methods and Techniques. Chichester: J Wiley.
Suardana. 2008. Optimalisasi Daya Adsorpsi Zeolit Terhadap Ion Kromium(III). J Penelitian dan Pengembangan Sain & Humaniora 2:17-33.
Subrt J, Stengl V, Bakardjieva S, Szatmary L. 2006. Synthesis of spherical metal oxide particles using homogeneous precipitation of aqueous solutions of metal sulfates with urea. Powder Technol 169:33-40.
Wiberg N. 1995. Lehrbuch der Anorganischen Chemie. New York: Walter de Gruyter. Winarso L. 2004. Optimasi alat pengolah
limbah cair 2ndstage hydrolizer dan pemanfaatannya sebagai air umpan boiler [tesis]. Semarang: Program Pascasarjana, Universitas Diponegoro.
Yin M, Willis A, Redl F, Turro NJ, Brien SP. 2004. Influence of capping groups on the synthesis of γ-Fe2O3 nanocrystals. J Mat Res. 19:1208-1215.
Yuan P, Fan M, Yang D, Liu D, Zhu J. 2009. Montmorillonite-supported magnetite nanoparticles for the removal of hexavalent chromium [Cr(VI)] from aqueous solutions. J Hazardous Mat
166:821-829.
Yuan P, Liu D, Fan M, Yang D, Zhu R. 2010. Removal of hexavalent chromium [Cr(VI)] from aqueous solutions by the diatomite-supported/unsupported magnetite nanoparticles. J Hazardous Mat 173:614-621.
Zhao S, Asuha S. 2010. One-pot synthesis of magnetite nanopowder and their magnetic properties. Powder Technol 197:295-297.
13
14
Lampiran 1 Diagram alir penelitian
Garam Besi Basa (NaOH atau urea), asam oleat, etanol, air.
Larutan garam besi Larutan basa
Pencampuran
Larutan
koloid
Endapan
Serbuk
Hasil karakterisasi dan adsorpsi
+ air Penghomogenan
Proses sintesis selama 10 jam (suhu 29, 180, 300 °C)
Penambahan etanol
Pencucian dan pengeringan
1.Karakterisasi SEM-EDXA dan XRD
2.Adsorpsi Cr(VI) berdasarkan pH dan waktu kontak
15
Lampiran 2 Spektrum absorpsi hasil reaksi 1,5-difenilkarbazida dengan Cr(VI)
Lampiran 3 Kurva standar kromium(VI) Larutan Konsentrasi (ppm) Absorbans standar 1 0,1 0,076 standar 2 0,2 0,158 standar 3 0,4 0,309 standar 4 0,6 0,458 standar 5 0,8 0,605 standar 6 1,0 0,748 y = 0,7453x + 0,0073 R2 = 0,9997 0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0 0,2 0,4 0,6 0,8 1 1,2 Konsentrasi (ppm ) A b s o rb a n s λ maks = 542,2 nm
16
Lampiran 4 Pola difraksi JCPDS 01-1111 magnetit (Fe3O4)
02-0272 goetit (Fe2O3·H2O)
17
Lampiran 5 Hasil pengukuran difraksi sinar-X magnetit NaOH suhu 29 °C
2θ (deg)a θ (deg) cos θ FWHMdega FWHM/2
FWHMrad (β) λ (nm)a kristal(nm) 21,20 10,6 0,9829 0,3950 0,1975 0,0034 0,154056 40,94 30,24 15,12 0,9654 0,2850 0,1425 0,0025 57,78 33,26 16,63 0,9582 0,2900 0,1450 0,0025 57,21 35,56 17,78 0,9522 0,3025 0,1513 0,0026 55,19 36,66 18,33 0,9492 0,2700 0,1350 0,0024 62,03 41,08 20,54 0,9364 0,2200 0,1100 0,0019 77,16 43,16 21,58 0,9292 0,2433 0,1217 0,0021 70,31 53,48 26,74 0,8923 0,2400 0,1200 0,0021 74,23 57,18 28,59 0,8781 0,4000 0,2000 0,0035 45,26 59,18 29,59 0,8696 0,3933 0,1967 0,0034 46,48 62,26 31,13 0,8559 0,1400 0,0700 0,0012 132,66 62,88 31,44 0,8532 0,3633 0,1817 0,0032 51,28 71,50 35,75 0,8116 0,2400 0,1200 0,0021 81,61 74,32 37,16 0,7969 0,2200 0,1100 0,0019 90,67 rata-rata 67,34
Catatan : FWHM = full width at half maximum a = hasil pengukuran Contoh perhitungan: Ukuran kristal (nm) = 40,94nm 9829 , 0 0034 , 0 0,154056 x 0,9 x 0,9
cos
θ
= x =β
λLampiran 6 Penentuan pH optimum oleh magnetit NaOH suhu 180 °C Ulangan 1 pH Adsorben (g) Absorbans ppm fp ppm x fp Kapasitas 1 0,0252 0,190 0,2451 1 0,2451 1,9881 2 0,0249 0,168 0,2156 1 0,2156 2,0239 3 0,0248 0,247 0,3216 10 3,2160 0,8222 4 0,0249 0,206 0,2666 10 2,6660 1,0398 5 0,0247 0,307 0,4021 10 4,0210 0,4996 Co Cr(VI) 0,399 0,5255 10 5,2550 Ulangan 2 pH Adsorben (g) Absorbans ppm fp ppm x fp Kapasitas 1 0,0250 0,103 0,1284 1 0,1284 2,0506 2 0,0249 0,076 0,0922 1 0,0922 2,0734 3 0,0248 0,259 0,3377 10 3,3770 0,7573 4 0,0250 0,185 0,2384 10 2,3840 1,1484 5 0,0249 0,311 0,4075 10 4,0750 0,4739 Co Cr(VI) 0,399 0,5255 10 5,2550
18
Lampiran 7 Penentuan pH optimum oleh magnetit NaOH dan oleat suhu 180 °C Ulangan 1 pH Adsorben (g) Absorbans ppm fp ppm x fp Kapasitas 1 0,0250 0,328 0,4303 1 0,4303 1,7269 2 0,0253 0,190 0,2451 1 0,2451 1,7796 3 0,0252 0,223 0,2894 10 2,8940 0,7355 4 0,0258 0,255 0,3323 10 3,3230 0,5521 5 0,0253 0,246 0,3203 10 3,2030 0,6105 Co Cr(VI) 0,715 0,9495 5 4,7475 Ulangan 2 pH Adsorben (g) Absorbans ppm fp ppm x fp Kapasitas 1 0,0253 0,143 0,1821 5 0,9105 1,7543 2 0,0247 0,112 0,1405 5 0,7025 1,8812 3 0,0251 0,305 0,3994 10 3,9940 0,5398 4 0,0252 0,247 0,3216 10 3,2160 0,8464 5 0,0247 0,232 0,3015 10 3,0150 0,9449 Co Cr(VI) 0,406 0,5349 10 5,3490
Catatan : fp = faktor pengenceran , Co = konsentrasi awal
Lampiran 8 Penentuan pH optimum oleh magnetit urea dan oleat suhu 300 °C Ulangan 1 pH Adsorben (g) Absorbans ppm fp ppm x fp Kapasitas 1 0,0198 0,209 0,2706 5 1,353 1,9707 2 0,0196 0,126 0,1592 10 1,592 1,8689 3 0,0196 0,154 0,1968 10 1,968 1,6770 4 0,0197 0,227 0,2947 10 2,947 1,1716 5 0,0196 0,214 0,2773 10 2,773 1,2663 Co Cr(VI) 0,399 0,5255 10 5,255 Ulangan 2 pH Adsorben (g) Absorbans ppm fp ppm x fp Kapasitas 1 0,0201 0,228 0,2961 5 1,4805 1,8779 2 0,0198 0,109 0,1365 10 1,3650 1,9646 3 0,0198 0,176 0,2264 10 2,2640 1,5106 4 0,0196 0,219 0,284 10 2,8400 1,2321 5 0,0199 0,226 0,2934 10 2,9340 1,1663 Co Cr(VI) 0,399 0,5255 10 5,2550
19
Lampiran 9 Penentuan waktu optimum oleh magnetit NaOH suhu 180 °C Ulangan 1 Jam Adsorben (g) Absorbans ppm fp ppm x fp Kapasitas 1 0,0251 0,094 0,1163 5 0,5815 1,8460 2 0,0249 0,2 0,2585 1 0,2585 1,9906 3 0,0248 0,276 0,3605 1 0,3605 1,9575 4 0,0250 0,205 0,2653 1 0,2653 1,9799 Co Cr(VI) 0,396 0,5215 10 5,2150 Ulangan 2 Jam Adsorben (g) Absorbans ppm fp ppm x fp Kapasitas 1 0,0249 0,148 0,1887 5 0,9435 1,7155 2 0,0249 0,094 0,1163 5 0,5815 1,8608 3 0,0250 0,286 0,3739 1 0,3739 1,9364 4 0,0248 0,310 0,4061 1 0,4061 1,9391 Co Cr(VI) 0,396 0,5215 10 5,2150
Catatan : fp = faktor pengenceran , Co = konsentrasi awal
Contoh perhitungan: Kapasitas adsorpsi (Q) = m ) C l V(Cawa − akhir = g 0,0249 ppm) 9435 , 0 ppm (5,215 ml 10 − x ppm ml mg/1000 = 1,7155 mg/g