ANALISIS KEMUNDURAN MUTU
DAGING DAN MATA IKAN BANDENG (Chanos chanos)
MELALUI PENGAMATAN HISTOLOGIS
AINI SYARIAH SAGALA
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
RINGKASAN
AINI SYARIAH SAGALA. C34070015. Analisis Kemunduran Mutu Daging dan Mata Ikan Bandeng (Chanos chanos) melalui Pengamatan Histologis. Di bawah bimbingan TATI NURHAYATI dan AGOES M JACOEB.
Mutu ikan berkaitan dengan tingkat kesegaran ikan. Ikan dikategorikan masih segar jika perubahan-perubahan biokimiawi, mikrobiologi, dan fisikawi yang terjadi belum menyebabkan kerusakan berat pada ikan. Perubahan kesegaran tersebut diamati pada jaringan ikan bandeng. Pengamatan histologis daging ikan bandeng yang ditunjang dengan pengujian tekstur, proksimat dan organoleptik penting untuk dilakukan guna memperoleh data dan pemahaman kondisi jaringan ikan selama fase kemunduran mutu ikan. Hal tersebut penting untuk memperkaya pengetahuan dan pemahaman terhadap ikan bandeng yang merupakan salah satu komoditas ikan lokal Indonesia. Tujuan penelitian ini adalah untuk memperoleh data mengenai komposisi kimia ikan bandeng, mengamati kemunduran mutu ikan secara organoleptik; dan mengamati kemunduran mutu ikan secara fisik dan histologis.
Metode yang digunakan adalah kombinasi pengamatan dan pengujian laboratorium. Pertama, ikan diambil dari tambak dengan ukuran yang seragam 200-250 gram, selanjutnya ikan disimpan sampai ikan busuk. Ikan selalu diamati selama penyimpanan (uji organoleptik, histologis, dan tekstur) dan proksimat.
Ikan bandeng memiliki kandungan air 77,54±0,46%, protein 12,45±1,79%, lemak 1,08±0,12%, abu 1,55±0,03%, dan karbohidrat 7,38±2,10%. Hasil penelitian menunjukkan kondisi daging dan mata ikan fase prerigor masih segar
seperti saat masih hidup, daging lunak dengan nilai uji kekerasan 2,34 mm/10’’/50g. Pada fase rigor, penampakan histologis jaringan daging
menebal dan mulai terjadi perenggangan antar serabut otot, namun belum terlihat jelas. Daging ikan mengalami pengerasan (kaku) yang diakibatkan bersatunya filamen aktin dan miosin. Hal tersebut dibuktikan dengan pengujian texture analysis yang mendapatkan nilai paling rendah diantara fase-fase lainnya, yaitu 1,42 mm/10’’/50g. Pada mata mulai terlihat terjadi pemisahan antar komponen mata. Komponen sudah tidak terlihat kompak. Pada fase post rigor menunjukkan jaringan daging telah mengalami perenggangan yang terlihat jelas. Komponen mata terlihat terburai, batas antar komponen terlihat tidak jelas. Pada fase busuk daging dan mata ikan telah menunjukkan kerusakan yang jelas. Kerusakan terutama terlihat pada mata ikan yang sudah terburai. Komponen yang tadinya jelas terlihat hanya menyisakan bekas-bekasnya saja. Pengujian kekerasan menunjukkan bahwa daging ikan pada kondisi ini adalah yang paling lunak
dengan nilai rata-rata kekerasan dari dua kali pengulangan adalah 33 mm/10’’/50g. Pada fase ini, ikan sudah tidak layak lagi untuk dikonsumsi.
ANALISIS KEMUNDURAN MUTU
DAGING DAN MATA IKAN BANDENG (Chanos chanos)
MELALUI PENGAMATAN HISTOLOGIS
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan
pada Departemen Teknologi Hasil Perairan, Institut Pertanian Bogor
Oleh
AINI SYARIAH SAGALA
C34070015
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi dengan judul “Analisis Kemunduran Mutu Daging dan Mata Ikan Bandeng (Chanos chanos) melalui Pengamatan Histologis” adalah karya saya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang telah diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, November 2011
Aini Syariah Sagala C34070015
Judul Skripsi
: Analisis
Kemunduran Mutu Daging dan Mata Ikan Bandeng (Chanos chanos) melalui Pengamatan HistologisNama : Aini Syariah Sagala
NIM : C34070015
Departemen : Teknologi Hasil Perairan
Menyetujui,
Pembimbing I Pembimbing II
Dr. Tati Nurhayati, S.Pi, MSi Dr. Ir. Agoes .M. Jacoeb, Dipl.- Biol. NIP. 197008071996032002 NIP. 195911271986011005
Mengetahui :
Ketua Departemen Teknologi Hasil Perairan,
Dr. Ir. Ruddy Suwandi, MS, Mphil. NIP. 195805111985031002
KATA PENGANTAR
Puji dan syukur dipanjatkan ke hadapan Allah SWT atas karuniaNya sehingga skripsi ini berhasil diselesaikan. Penelitian dengan judul Analisis Kemunduran Mutu Daging dan Mata Ikan Bandeng (Chanos chanos) melalui Pengamatan Histologis dilaksanakan di Fakultas Perikanan dan Ilmu Kelautan IPB sejak Februari sampai Juni 2011.
Dengan telah selesainya penelitian hingga tersusunnya skripsi ini, penulis ingin menyampaikan penghargaan dan terima kasih yang sebesar-besarnya kepada:
1. Dr. Tati Nurhayati, S.Pi, MSi selaku dosen pembimbing pertama yang telah memberikan bimbingan dan pengarahan kepada penulis sampai dapat menyelesaikan penelitian dan penulisan skripsi ini.
2. Dr. Agoes M Jacoeb, Dipl.-Biol. selaku dosen pembimbing kedua yang telah membantu dan memberikan pengarahan bagi penulis selama melakukan penelitian dan penulisan skripsi.
3. Rahmida (ibu), Amirudin Sagala (ayah), Riski Bayuni Sagala (adik) dan keluarga besar tercinta yang dengan senantiasa selalu mendukung dan memberikan semangat serta doa yang tak henti-hentinya kepada penulis demi kesuksesan masa depan penulis.
4. Bapak Ranta selaku laboran pada Laboratorium Kesehatan Ikan atas bantuannya terhadap kelancaran penelitian ini.
5. Medal Lintas Perceka dan Supartinah, kedua kawan satu tim penulis yang sabar dan murah hati membantu penulis saat pelaksanaan penelitian ini. 6. Teman-teman THP 44 yang telah memberikan dukungan moral serta tenaga
yang begitu besar kepada penulis selama pelaksanaan penelitian ini.
Akhirnya penulis berharap semoga tulisan ini bermanfaat dan memberikan kontribusi yang nyata terhadap perkembangan ilmu pengetahuan di bidang perikanan.
Bogor, November 2011
Aini Syariah Sagala
BIODATA PENULIS
Aini Syariah Sagala. Lahir di Medan, 26 Juli 1990 sebagai putri pertama dari dua bersaudara dari Rahmida dan Amirudin Sagala. Penulis menamatkan Sekolah Menengah Atas pada tahun 2007 di SMA Negeri 58, Jakarta dan pada tahun yang sama diterima di IPB melalui jalur Undangan Seleksi Masuk IPB. Penulis memilih Program Studi Teknologi Hasil Perairan, Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan. Selama mengikuti perkuliahan, penulis tercatat sebagai anggota tidak aktif Himpunan Mahasiswa Hasil Perairan (Himasilkan). Penulis merupakan penerima beasiswa PPA dari Departemen Pendidikan Nasional Republik Indonesia pada tahun 2010-2011. Penulis melaksanakan Praktik Lapangan pada tahun 2010 di PT Indocitra Jaya Samudera, Jembrana, Bali. Penulis menyelesaikan skripsi berjudul “Deskriptif Kemunduran Mutu Daging dan Mata Ikan Bandeng (Chanos chanos) melalui Pengamatan Histologis” untuk mendapatkan gelar Sarjana Perikanan di bawah bimbingan Dr. Tati Nurhayati, SPi, MSi dan Dr. Ir. Agoes M Jacoeb, Dipl.-Biol.
DAFTAR ISI
Halaman
DAFTAR TABEL... ... viii
DAFTAR GAMBAR ... ix DAFTAR LAMPIRAN ... x 1 PENDAHULUAN... 1 1.1 Latar Belakang ... 1 1.2 Tujuan ... 2 2 TINJAUAN PUSTAKA... 3
2.1 Deskripsi, Klasifikasi dan Komposisi Kimia Ikan Bandeng ... 3
2.1.1 Deskripsi dan klasifikasi ikan bandeng ... 3
2.1.2 Komposisi kimia ikan bandeng ... 4
2.2 Kemunduran Mutu Ikan... 8
2.3 Histologi ... 10
2.3.1 Jaringan otot ... 11
2.3.2 Mata ... 12
2.4 Pembuatan Preparat Histologi ... 13
3 METODOLOGI ... 17
3.1 Waktu dan Tempat Penelitian... 17
3.2 Bahan dan Alat Penelitian ... 17
3.3 Metode Penelitian ... 17
3.3.1 Analisis proksimat (AOAC 1995) ... 18
3.3.2 Uji organoleptik (BSN 2006) ... 20
3.3.3 Analisis kekerasan (Precision, Scientific Petroleum Instruments) ... 21
3.3.4 Pembuatan preparat histologis (Angka et al. 1990) ... 21
3.3.5 Analisis data secara deskriptif ... 25
4 HASIL DAN PEMBAHASAN ... 26
4.1 Komposisi Proksimat Ikan Bandeng ... 26
4.2 Organoleptik Daging dan Mata Ikan Bandeng ... 28
4.3 Kekerasan Daging dan Mata Ikan Bandeng ... 29
5 KESIMPULAN DAN SARAN ... 38
5.1 Kesimpulan ... 38
5.2 Saran ... 38
DAFTAR PUSTAKA ... 39
DAFTAR TABEL
Teks Halaman
1 Komposisi kimia ikan bandeng (Chanos chanos) ... 5
2 Perbedaan fiksasi aktif dan pasif ... 14
3 Kelebihan dan kekurangan berbagai larutan pengawet ... 15
4 Masalah-masalah dalam preparasi histologis spesimen ... 16
5 Hasil pengujian proksimat daging ikan bandeng ... 26
6 Hasil pengujian kekerasan daging ikan bandeng ... 30
DAFTAR GAMBAR
Teks Halaman
1 Ikan bandeng (Chanos chanos) (FAO 2011) ... 3
2 Otot merah ikan (Morrison et al. 2007) ... 11
3 Otot putih ikan (Morrison et al. 2007) ... 11
4 Anatomi mata (Care and healed 2010)... 12
5 Retina mata ikan normal (Morrison et al. 2007) ... 13
6 Diagram alir penelitian ... 18
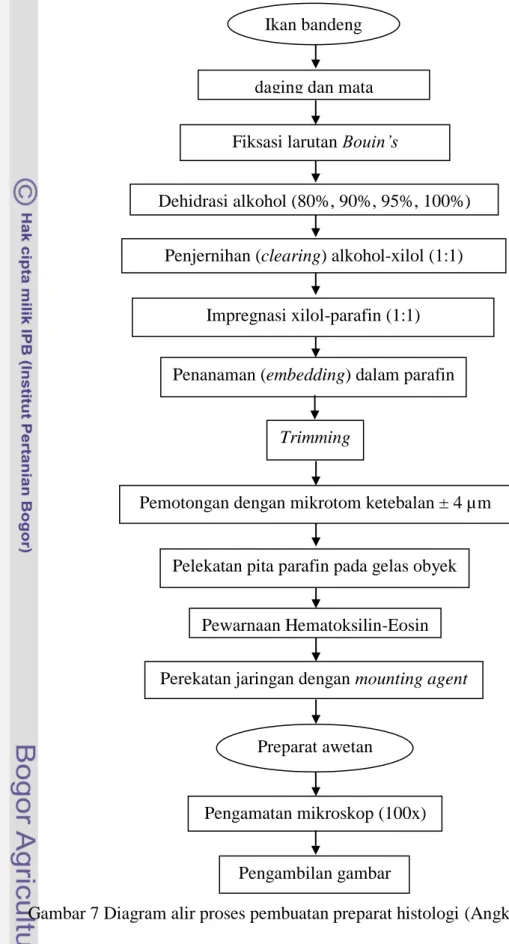
7 Diagram alir proses pembuatan preparat histologi (Angka et al. 1990) ... 24
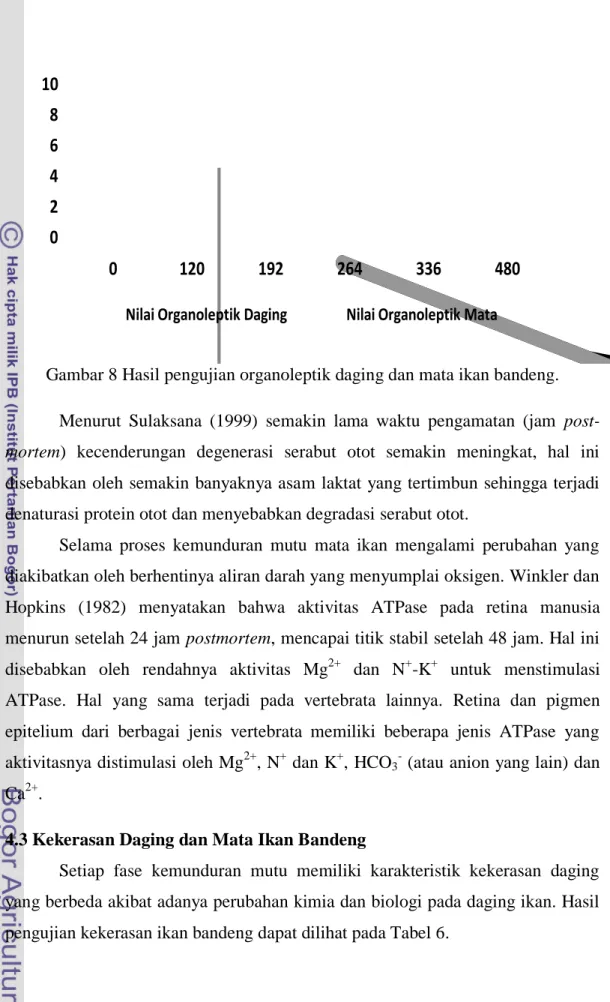
8 Hasil pengujian organoleptik daging dan mata ikan bandeng ... 29
9 Kondisi histologis daging ikan bandeng fase pre rigor (perbesaran 100x) .... 31
10 Kondisi histologis daging ikan bandeng fase rigor (perbesaran 100x)... 32
11 Kondisi histologis daging ikan bandeng fase post rigor (perbesaran 100x) ... 33
12 Kondisi histologis daging ikan bandeng fase busuk (perbesaran 100x) ... 33
13 Kondisi histologis mata ikan bandeng bagian posterior fase pre rigor (perbesaran 100x) ... 34
14 Kondisi histologis mata ikan bandeng bagian posterior fase rigor (perbesaran 100x) ... 35
15 Kondisi histologis mata ikan bandeng bagian posterior fase post rigor (perbesaran 100x) ... 36
16 Kondisi histologis mata ikan bandeng bagian posterior fase busuk (perbesaran 100x) ... 36
DAFTAR LAMPIRAN
Teks Halaman 1 Lembar penilaian organoleptik ... 44
1 PENDAHULUAN
1.1 Latar Belakang
Bandeng merupakan salah satu komoditas penting perikanan Indonesia. Permintaan pasar menunjukkan peningkatan terhadap ikan ini setiap tahunnya. Peningkatan permintaan tersebut diiringi dengan peningkatan produksi ikan bandeng yang pada tahun 2007 hanya 269.530 ton kemudian meningkat pada tahun 2010 menjadi 483.948 ton dan target pemerintah tahun ini untuk produksi bandeng diperkirakan mencapai 500.000 ton. Indonesia juga merupakan pengekspor nener bandeng untuk negara-negara Asia terutama Filipina yang mengimpor 400 juta ton nener (anakan bandeng) per tahun dari Indonesia (Ditjen Perikanan Budidaya 2007; KKP 2010; KKP 2011).
Mutu ikan berkaitan dengan tingkat kesegaran ikan. Ikan dikategorikan masih segar jika perubahan-perubahan biokimiawi, mikrobiologi, dan fisikawi yang terjadi belum menyebabkan kerusakan berat pada ikan. Temperatur yang relatif tinggi di negara-negara tropis dapat mempercepat pembusukan karena peningkatan aktivitas bakteri, enzim dan oksidasi kimia lemak pada ikan segar (Bernard et al. 2010). Berdasarkan kesegarannya, ikan dapat digolongkan menjadi empat kelas mutu, yaitu ikan yang kesegarannya masih baik sekali (prima), ikan yang kesegarannya masih baik (advance), ikan yang kesegarannya sudah mulai mundur (sedang), dan ikan yang sudah tidak segar lagi (mutu rendah/busuk).
Proses kemunduran mutu ikan dapat diamati secara mikroskopis dengan pengamatan histologis. Pengamatan dengan cara ini dilakukan untuk mengamati perubahan kondisi jaringan ikan pada setiap fase kemunduran mutu. Perubahan tersebut dapat diamati sejak dari fase prerigor sampai fase busuk. Pada fase prerigor keadaan ikan masih sangat segar yang ditunjukkan dengan tampilan histologisnya yang kompak dan belum rusak, sedangkan saat ikan telah masuk fase busuk, penampakan jaringan ikan terlihat longgar dan menunjukkan tanda-tanda kebusukan (terurai).
Pengamatan histologis daging dan mata ikan bandeng yang didukung dengan pengujian tekstur, proksimat dan organoleptik penting untuk dilakukan guna memperoleh data dan pemahaman kondisi jaringan ikan selama fase
kemunduran mutu. Ikan memiliki tiga tipe sel otot: (1) lurik, tidak bercabang, bekerja secara sadar; (2) otot jantung yang terdiri dari serabut otot bercabang dan (3) otot halus yang bekerja secara tidak sadar (Morrison et al. 2007). Peranan jaringan otot yang utama sebagai alat gerak, karena sifatnya yang mampu berkontraksi. Kontraksi dapat berlangsung bila ada rangsangan (stimulus) dari syaraf atau pengaruh lain (Hartono 1989). Mata terdiri dari tiga bagian dasar atau lapisan. Bagian paling luar disebut fibrous tunic, yang dibagi menjadi kornea dan sklera. Bagian tengah mata terdiri dari koroid, ciliary body dan iris. Bagian posterior mata adalah retina dan saraf optik yang merupakan bagian paling sentral (Samuelson 2007).
1.2 Tujuan
Tujuan penelitian ini adalah sebagai berikut :
1 memperoleh informasi mengenai komposisi kimia ikan bandeng. 2 mengamati kemunduran mutu ikan secara organoleptik.
2 TINJAUAN PUSTAKA
2.1 Deskripsi, Klasifikasi dan Komposisi Kimia Ikan Bandeng
Deskripsi dan klasifikasi merupakan bagian yang penting dalam mempelajari suatu jenis ikan.
2.1.1 Deskripsi dan klasifikasi ikan bandeng
Bandeng (Gambar 1) mampu mentolelir salinitas perairan yang luas (0-158 ppt) sehingga digolongkan sebagai ikan eurihalin. Ikan muda dan dewasa dapat menyesuaikan diri pada perubahan salinitas. Ikan ini juga dapat bertahan pada perubahan jumlah makanan yang tiba-tiba. Makanan alami mereka adalah bentos dan fitoplankton. Ikan bandeng mampu beradaptasi terhadap perubahan lingkungan yakni suhu, pH, dan kekeruhan air serta tahan terhadap serangan penyakit (Schuster 1959; Ghufron dan Kardi 1997).
Klasifikasi ikan bandeng menurut Saanin (1984) adalah sebagai berikut :
Filum : Chordata Subfilum : Vertebrata Kelas : Pisces Subkelas : Teleostei Ordo : Malacopterygii Famili : Chanidae Genus : Chanos
Spesies : Chanos chanos
Tipe ikan bandeng yang ditemukan di Indonesia memiliki ciri dengan adanya perpanjangan sirip dorsal dan pektoral. Tipe ikan dengan perpanjangan ini hanya ditemukan di Indonesia (Schuster 1959).
Swanson (1998) menyatakan bahwa kadar garam perairan (salinitas) berpengaruh terhadap fisiologi dan tingkah laku ikan. Pertumbuhan ikan yang lebih tinggi pada salinitas 50‰ dibandingkan salinitas 35‰ dan pertumbuhannya sedang pada salinitas 15‰, sedangkan aktivitas paling tinggi ditunjukkan ikan dengan salinitas air 35‰. Pola yang bervariasi tersebut berhubungan dengan laju metabolisme ikan dengan kisaran salinitas yang relatif tinggi, yaitu 15‰ dan 55‰.
Toleransinya yang besar terhadap salinitas tersebut sangat menguntungkan petani ikan. Ikan bandeng juga dapat dibudidaya secara polikultur. Suharyanto (2008) melakukan penelitian tentang kemungkinan polikultur rajungan (Portunus pelagius), udang vanamei (Litopenaeus vannamei), ikan bandeng (Chanos chanos), dan rumput laut (Gracilari sp.) di tambak dan pakan yang diberikan ikan rucah (Clupea sp.) selama 105 hari mendapatkan hasil, produksi rajungan adalah 32,6% (18 kg), udang vanamei 70% (10%), ikan bandeng 100% (30 kg), dan rumput laut 125% (36,25 kg).
Temperatur adalah faktor utama yang bertanggung jawab terhadap pembatasan habitat spesies pada daerah tropis dan subtropis di Samudera Hindia dan Pasifik. Batas maksimal toleransi suhu Chanos chanos di atas spesies laut lainnya, Chanos chanos dapat bertahan pada suhu di atas 40 ºC (Schuster 1959).
Chanos chanos juga ditemukan di pantai-pantai sekitar Laut Merah, pantai timur Afrika termasuk Zanzibar dan Madagaskar, Teluk Aden, pantai barat daya, selatan dan barat India, pantai Ceylon, Malaysia, Thailand, Vietnam dan Taiwan, perairan antara Filipina dan Indonesia, pantai-pantai di Australia, New Zealand, New Guinea, Fiji, Samoa, the Society, Gilbert, Lau dan Pulau Tuamoto, kepulauan Hawai, pantai barat USA (selatan San Francisco), teluk California dan pantai Meksiko. Berdasarkan informasi ini, sebaran geografis spesies ini adalah dari 40º BT-100º BB dan 30º-40º LU sampai 30º-40º LS (Schuster 1959).
2.1.2 Komposisi kimia ikan bandeng
Ikan merupakan pangan yang bergizi. Tabel 1 menunjukkan komposisi kimia ikan bandeng.
Tabel 1 Komposisi kimia ikan bandeng (Chanos chanos)
Zat gizi Jumlah Satuan
Kalori 126 Kalori Protein 17,4 Gram Lemak 5,7 Gram Air 60,2 Gram Kalsium 43,4 Milligram Fosfor 138 Milligram Besi 0,3 Milligram Vitamin A 85 Milligram Vitamin B6 0,4 Milligram Vitamin B12 2,9 Milligram Sumber: www.nutritiondata.com (2007)
Jaringan ikan sebagian besar terdiri dari protein. Kandungan protein dalam daging ikan sehat adalah 16-18%. Protein ditemukan di dalam semua sel dan semua bagian sel (Lehninger 1982; Burgess et al. 1967). Satu molekul protein dapat terdiri dari 12 sampai 18 macam asam amino dan dapat mencapai jumlah ratusan dari setiap macam asam aminonya. Berdasarkan kelarutannya dalam air, protein dapat digolongkan menjadi tiga macam, yaitu protein miofibril, protein sarkoplasma, dan protein stroma (Suhardjo dan Kusharto 1987; Muchtadi et al. 1993).
Protein miofibril merupakan bagian terbesar dalam jaringan daging dan merupakan jenis protein yang larut dalam larutan garam. Protein ini terdiri dari miosin, aktin, dan protein regulasi (tropomiosin, troponin, dan aktin). Penyusun utama protein miofibril adalah aktin (hampir 20% dari total miofibril) dan miosin (sebesar 50-60% dari total protein miofibril). Gabungan aktin dan miosin membentuk aktomiosin. Miosin merupakan protein esensial yang dapat meningkatkan elastisitas gel protein. Protein miofibril berfungsi untuk kontraksi otot (Muchadi et al. 1993; Suzuki 1981). Menurut Nurjanah et al. (2004), protein larut garam pada ikan merupakan protein miofibril. Kadar miofibril dalam daging ikan 65-75% yang terdiri dari miosin, aktin, dan komponen minor lainnya. Sarkoplasma merupakan protein terbesar kedua di dalam protein daging, memiliki
sifat larut dalam air dan secara umum ditemukan dalam plasma sel. Protein sarkoplasma tidak berperan dalam pembentukan gel dan kemungkinan mengganggu pembentukan gel (Hall dan Ahmad 1992). Sarkoplasma memiliki bobot molekul yang relatif rendah, pH isoelektrik tinggi dan struktur berbentuk bulat. Karakteristik fisik ini mungkin yang bertanggung jawab untuk daya larut sarkoplasma yang tinggi dalam air (Muchtadi et al.1993). Protein stroma adalah protein yang membentuk jaringan ikat. Protein stroma tidak dapat diekstrak
dengan larutan asam, alkali atau larutan garam netral pada konsentrasi (0,01-0,10) M. Protein stroma terdapat pada bagian luar sel otot. Selain protein
stroma, protein kontraktil, seperti konektin dan desmin juga tidak dapat terekstrak (Suzuki 1981).
Analisis protein untuk bahan pangan, umumnya lebih ditujukan pada kadar total protein daripada keberadaan protein spesifik dalam bahan pangan tersebut. Jumlah gram protein dalam bahan pangan biasanya dihitung sebagai hasil perkalian jumlah gram nitrogen dengan faktor 6,25 dan kadar protein yang dilaporkan adalah kadar protein kasar (crude protein) (Danitasari 2010).
Kandungan lemak pada suatu makanan dapat rendah maupun tinggi hal tersebut tergantung pada bahannya. Asam lemak dibagi menjadi dua golongan, yaitu asam lemak jenuh dan tak jenuh, asam lemak jenuh bertitik leleh lebih tinggi dibandingkan dengan asam lemak tidak jenuh (deMan 1997). Asam lemak tak jenuh yang mengandung satu ikatan rangkap disebut asam lemak tak jenuh tunggal (Monounsaturated fatty acid/MUFA). Asam lemak yang mengandung dua atau lebih ikatan rangkap disebut asam lemak tak jenuh majemuk (Polyunsaturated fatty acid/PUFA) (Muchtadi et al. 1993).
Asam lemak yang mengandung dua atau lebih ikatan rangkap disebut asam lemak tak jenuh majemuk. Asam lemak tidak jenuh umumnya terdapat dalam bentuk cis, sedangkan bentuk trans banyak terdapat pada asam lemak susu
ruminansia pada hewan teresterial dan lemak yang telah dihidrogenasi (Muchtadi et al. 1993). Lemak daging ikan mengandung asam-asam lemak jenuh
dengan panjang rantai C14-C22 dan asam lemak tidak jenuh dengan jumlah ikatan
tanaman dan hewan darat jarang yang memiliki asam lemak dengan rantai karbon lebih dari 18 (Adawyah 2006; Nurjanah dan Abdullah 2010).
Ikan tidak makan terlalu banyak karbohidrat, tetapi makanan mereka mengandung banyak protein dan lemak. Ketiga jenis makanan, karbohidrat, lemak dan protein dapat digunakan sebagai bahan bakar untuk memenuhi kebutuhan energi. Jika total pemasukan makanan kurang dari total kebutuhan energi yang dibutuhkan, maka jaringan lemak akan digunakan untuk melengkapinya. Lemak tidak dapat menggantikan protein yang dibutuhkan untuk pertumbuhan tetapi dapat menjaga cadangan protein (Burgess et al. 1967).
Karbohidrat dalam daging ikan merupakan polisakarida yaitu glikogen yang terdapat dalam sarkoplasma diantara miofibril-miofibril. Glikogen terdapat dalam jumlah jumlah terbanyak dari karbohidrat yang terdapat pada daging ikan yaitu 0,05 – 0,085 %, selain itu terdapat juga glukosa (0,038 %), asam laktat (0,005 – 0,43 %) dan berbagai senyawa antara dalam metabolisme karbohidrat (Hadiwiyoto 1993).
Mineral dalam makanan ditentukan dengan pengabuan atau insinerasi (pembakaran). Pada proses pembakaran yang terbakar adalah bahan-bahan organik karena itulah disebut abu (deMan 1997; Winarno 1992). Akan tetapi mineral yang didapat dengan pembakaran tidak mengandung nitrogen yang ada dalam protein, sehingga jumlahnya berbeda dengan kandungan mineral bahan yang sebenarnya. Karbonat dalam abu dapat dibentuk karena penguraian bahan organik. Beberapa unsur sesepora (trace elements) dan beberapa garam dapat hilang karena penguapan. Oleh karena itu, jumlah mineral dalam makanan bergantung kepada metode analisisnya (deMan 1997).
Mineral dapat dikelompokkan menjadi dua, yaitu komponen garam utama dan unsur sesepora (trace elements). Komponen garam utama mencakup kalium, natrium, kalsium, magnesium, klorida, sulfat, fosfat, dan bikarbonat. Unsur sesepora dapat dibagi menjadi tiga golongan yang pertama adalah unsur gizi esensia, termasuk Fe, Cu, I, Co, Mn, dan Zn, yang kedua adalah unsur gizi nontoksik, termasuk Al, B, Ni, Sn, dan Cr, dan yang terakhir adalah unsur nongizi dan toksik, termasuk Hg, Pb, As, Cd, dan Sb (deMan 1997).
Vitamin yang terdapat pada daging ikan terbagi menjadi dua golongan, yaitu vitamin yang larut dalam air seperti vitamin B kompleks dan vitamin yang larut dalam lemak seperti vitamin A, D, dan E. Vitamin A dan D banyak ditemukan pada spesies-spesies ikan berlemak, terutama dalam hati, seperti pada ikan cod (Junianto 2003).
2.2 Kemunduran Mutu Ikan
Ikan merupakan bahan pangan yang mudah mengalami kerusakan dan kemunduran mutu (perishable food). Kerusakan ini dapat terjadi secara biokimiawi maupun mikrobiologi. Proses kerusakan ikan ini berlangsung cepat terutama di daerah tropis yang mempunyai kelembaban harian yang tinggi. Proses tersebut dipercepat dengan praktek-praktek penangkapan atau pemanenan yang tidak baik, cara penanganan yang kurang tepat, sanitasi dan higiene yang tidak memadai, terbatasnya sarana distribusi dan sarana pemasaran dan sebagainya (Yuniarti 2010).
Menurut Eskin (1990) ikan yang telah mati akan mengalami perubahan-perubahan yang mengakibatkan penurunan mutu ikan. Perubahan biokimia dan fisikokimia mengakibatkan turunnya kesegaran ikan. Proses perubahan tersebut dibagi menjadi tiga tahap, yaitu pre rigor, rigor mortis dan post rigor. Jika masih ingin dilanjutkan penyimpanan ikan yang telah mencapai fase post rigor selanjutnya ikan akan masuk pada kebusukan. Ikan yang busuk sudah tidak layak konsumsi lagi, biasanya ikan ini hanya digunakan sebagai tepung ikan.
Kondisi daging ikan pada fase pre rigor masih lembut dan lunak, dan secara kimiawi ditandai dengan penurunan jumlah ATP dan kreatin fosfat, seperti halnya pada reaksi aktif glikolisis. Sirkulasi darah berhenti pada awal kematian dan terjadi perubahan susunan yang kompleks pada daging. Sirkulasi darah yang terhenti pada ikan mati akan mengakibatkan habisnya aliran oksigen di dalam jaringan. Tahap berikutnya adalah terjadinya perubahan ATP yang telah terbentuk selama ikan masih hidup sebagai sumber energi, sehingga sumber ATP semakin berkurang. Adenosin trifosfat (ATP) mengalami perubahan akibat aktivitas enzim ATPase, bersamaan dengan itu glikogen akan diurai menjadi asam laktat. Proses ini menyebabkan terjadinya akumulasi asam laktat sehingga pH jaringan otot ikan akan terus menurun, kondisi ini disebut rigor mortis. Rigor mortis ditandai dengan
keadaan otot yang kaku dan keras. Lamanya tahap rigor dipengaruhi oleh kandungan glikogen dalam tubuh ikan dan suhu lingkungan. Kandungan glikogen yang tinggi dapat menunda datangnya proses rigor. Pada fase rigor mortis terjadi penurunan kelenturan otot terus berlangsung seiring dengan semakin sedikitnya jumlah ATP. Kelenturan otot yang hilang ini diakibatkan ion Ca2+ yang berikatan dengan protein troponin sehingga menyebabkan terjadinya ikatan elektrostatik antara filamen aktin dan miosin (aktomiosin) yang ditandai dengan terjadinya pengkerutan atau kontraksi serabut otot yang tidak dapat balik (irreversible). Adenosin trifosfat merupakan sumber energi tertinggi bagi aktivitas ikan. Pada ikan mati, ATP diperoleh dari penguraian kreatin fosfat. Kemudian ATP mulai mengalami penguraian ketika kandungan kreatin fosfat dan ATP mencapai titik yang sama. Hidrolisis ATP menjadi ADP dengan bantuan enzim ATPase akan menghasilkan energi. Penguraian tersebut terjadi berdasarkan reaksi berikut ini (Eskin 1990):
ATP + H2O ATPase ADP + H3PO4
Otot ikan ketika baru mati memiliki pH netral atau sedikit basa. Selama rigor mortis, nilai pH perlahan-lahan turun menjadi 6,2-6,5 karena akumulasi asam laktat. Kandungan glikogen yang lebih banyak pada otot ikan mati akan memperpanjang fase rigor mortis (Govidan 1985). Penguraian ATP berkaitan erat dengan terjadinya rigor mortis. Pada saat ATP mulai mengalami penurunan, rigor mortis pun mulai terjadi dan mencapai kejang penuh (full-rigor) ketika kandungan ATP sekitar 1 µmol/g. Energi pada jaringan otot ikan setelah mati diperoleh secara anaerobik dari pemecahan glikogen melalui proses glikolisis menghasilkan ATP dan asam laktat. Akumulasi asam laktat selain menurunkan pH otot, juga diikuti oleh peristiwa rigor mortis (Eskin 1990).
Fase post rigor terjadi pada saat otot ikan melunak setelah melewati fase rigor mortis terjadi kenaikan pH ikan secara perlahan-lahan dengan meningkatnya laju perubahan autolitik yang ditandai dengan proses pelunakan daging ikan (Govidan 1985). Serabut otot daging ikan hidup mengandung protein dalam gel lunak. Selama rigor, gel ini menjadi kaku dan bila rigor telah berlalu, otot daging menjadi lunak, keadaan ini berlangsung selama 1-7 jam sesaat setelah ikan mati.
Nilai pH daging ikan pada fase ini sekitar 6-7. Kelenturan ikan yang hilang tersebut karena terbentuknya aktomiosin yang berlangsung lambat pada tahap awal dan kemudian menjadi cepat pada tahap selanjutnya. Lama tahap rigor dipengaruhi oleh kandungan glikogen dalam tubuh ikan dan suhu lingkungannya. Kandungan glikogen yang tinggi dapat menunda datangnya proses rigor (Eskin 1990). Penguraian protein daging ikan karena aktivitas enzim proteolitik mengakibatkan daging ikan menjadi lunak, mudah dilepaskan dari tulang, kehilangan elastisitasnya, dan meninggalkan bekas jari pada saat ditekan (Govidan 1985).
Reaksi kimiawi yang terjadi selama proses kemunduran kesegaran ikan adalah penguraian lemak oleh aktivitas enzim jaringan tubuh dan enzim yng dihasilkan oleh bakteri serta berlangsung akibat oksidasi dengan adanya oksigen menjadi asam lemak. Akibat dari reaksi ini adalah terjadinya ketengikan, perubahan warna daging menjadi pucat yang mengarah pada rasa, bau dan perubahan lain yang tidak dikehendaki. Geesink et al. (2006) melakukan penelitian mengenai peran µ-kalpain terhadap proteolisis post mortem pada protein otot menghasilkan kesimpulan bahwa µ-kalpain memiliki peran yang sangat besar dalam aktivitas proteolisis post mortem.
Mikroorganisme dominan yang berperan penting di dalam proses penurunan kesegaran ikan adalah bakteri. Pada daging ikan yang masih segar bakteri dapat ditemukan di permukaan kulit, insang, dan saluran pencernaan. Pada ikan mati, bakteri yang terkonsentrasi pada ketiga tempat tersebut perlahan-lahan berpenetrasi dan bergerak aktif menyebar ke seluruh jaringan dan organ ikan selanjutnya mulai dijadikan tempat berkembangnya bakteri. Dekomposisi berjalan intensif, khususnya setelah ikan melewati fase rigor mortis, saat itu jaringan otot longgar dan jarak antar serta diisi oleh cairan (Irianto dan Giyatmi 2009).
2.3 Histologi
Histologi (Histos = jaringan, Logos = ilmu) mempelajari struktur jaringan tubuh hewan. Histologi adalah ilmu yang mempelajari struktur dari hewan atau tumbuhan secara terperinci dan hubungan antara pengorganisasian sel dan jaringan serta fungsi-fungsi yang dilakukannya. Histologi dapat juga disebut sebagai ilmu anatomi mikroskopis (Hartono 1989).
2.3.1 Jaringan otot
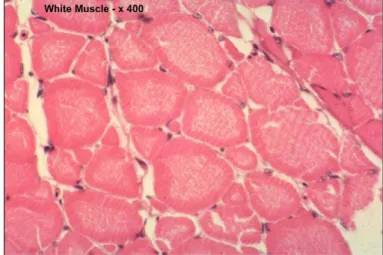
Peranan jaringan otot yang utama ialah sebagai alat gerak, karena sifatnya yang mampu berkontraksi. Kontraksi dapat berlangsung bila ada rangsangan (stimulus) dari syaraf atau pengaruh lain (Hartono 1989). Ikan seperti juga vertebrata lainnya memiliki tiga tipe sel otot: (1) lurik, tidak bercabang, bekerja secara sadar; (2) otot jantung yang terdiri dari serabut otot bercabang dan (3) otot halus yang bekerja secara tidak sadar. Otot lurik dibagi menjadi dua jenis, yaitu merah and putih. Otot merah (Gambar 2) memiliki jumlah mitokondria dan aktivitas respirasi yang lebih besar dibandingkan dengan otot putih (Gambar 3) (Morrison et al. 2007).
Gambar 2 Otot merah ikan (Morrison et al. 2007).
2.3.2 Mata
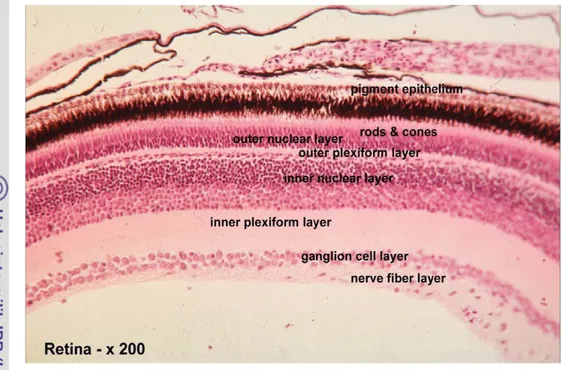
Mata terdiri dari tiga bagian dasar atau lapisan (Gambar 4). Bagian paling luar disebut fibrous tunic, yang dibagi menjadi kornea dan sklera. Fibrous tunic memberikan mata bentuk yang cocok sebagai sistem visual. Bagian luar dari fibrous tunic adalah kornea yang transparan sehingga memungkinkan cahaya masuk dan bentuknya cocok sebagai refraktor (pembelok) cahaya dengan tepat menuju retina mata (Samuelson 2007).
Bagian tengah mata (Gambar 4) terdapat uvea atau vaskular tunic atau pembungkus yang terdiri dari koroid, ciliary body dan iris. Koroid terletak pada pertengahan posterior mata diantara sklera dan retina. Fungsi koroid adalah menyediakan makanan untuk retina yang sangat tinggi metabolismenya. Ciliary body berfungsi sebagai tempat pelekatan lensa dan tempat produksi cairan aqueous humor. Bagian anterior dari vaskular tunic adalah iris, yaitu perpanjangan ciliary body. Iris sangat kaya pigmen dan otot (pupil) yang mampu mengatur jumlah cahaya untuk masuk ke bagian posterior (retina). Bagian ketiga dan yang paling sentral adalah retina (Gambar 5) dan saraf optik. Retina terdiri dari sel-sel sensitif cahaya dan fotoreseptor yang mentransmisikan rangsangan kepada otak melalui saraf optik. Bagian lainnya dari mata adalah cairan intraokular yang terdiri dari vitreous dan aquaeos humor yang bersama-sama menciptakan sebuah medium transparan untuk mentransmisikan cahaya (Samuelson 2007).
2.4 Pembuatan Preparat Histologi
Proses pembuatan preparat histologis disebut mikroteknik. Jaringan yang diambil kemudian diproses secara fiksatif untuk menjaga agar sediaan tidak rusak (bergeser posisinya, membusuk atau rusak). Proses ini juga dapat mengawetkan morfologi jaringan sehingga tetap seperti keadaan sewaktu hidup dan mengeraskan jaringan agar dapat diiris serta mencegah jaringan larut selama proses pembuatan preparat. Zat fiksatif yang baik adalah zat yang dapat mengeraskan jaringan dengan cukup cepat sehingga tidak terjadi perubahan bentuk pada saat proses-proses selanjutnya dilakukan (Tabel 3). Zat yang umum digunakan adalah formalin sebab memiliki karakteristik mampu menembus dan memfiksasi jaringan dengan cepat, menyimpan dan mempertahankan lemak, myelin, serabut-serabut saraf, amiloid, homosiderin dan komponen alat tubuh lainnya (Salim 2010; Rumawas et al. 1974).
Menurut Samuelson (2007), fiksasi dilakukan dengan mengekspos jaringan pada pengawet kimia seperti formaldehid. Pengeksposan ini dapat dilakukan dengan cara aktif dan pasif (Tabel 2).
Tabel 2 Perbedaan fiksasi aktif dan pasif
Kriteria Fiksasi aktif (perfusion fixation) Fiksasi pasif (immersion fixation)
Waktu relatif lebih cepat lebih lambat
Jumlah fiksatif (agen fiksasi)
relatif lebih sedikit perbandingan dengan
sampel 5:1 Cara fiksasi Fiksatif diinjeksi ke dalam
arteri utama
merendam sampel dalam fiksatif
Ukuran spesimen relatif besar kecil (ketebalan 2 cm
atau lebih kecil)
Sumber: Samuelson (2007)
Proses fiksasi dilanjutkan dengan dehidrasi yang merupakan proses menarik air dalam jaringan sehingga jaringan menjadi keras dan kadar airnya menjadi sangat kecil. Proses selanjutnya adalah clearing atau penjernihan yang bertujuan menarik alkohol dari jaringan sehingga jaringan menjadi jernih,lebih keras tetapi elastis (Rumawas et al. 1974).
Embedding merupakan proses memasukkan parafin cair ke dalam sel. Tujuannya adalah untuk memudahkan dalam pemotongan jaringan menjadi sangat tipis. Parafin menerobos masuk ke dalam jaringan tanpa mengganggu struktur sel-sel dan zat-zat dalam jaringan. Jaringan yang telah dibenamkan dalam parafin cair lalu diblok (dicetak agar mudah dipotong) dengan parafin cair yang kemudian dibekukan dan selanjutnya akan dipotong (Rumawas et al. 1974). Hidrasi merupakan proses pemasukan air ke dalam preparat jaringan pada gelas objek yang dilakukan setelah proses dewaxing (pengeluaran parafin).
Preparat siap diwarnai, pewarna yang sering digunakan adalah pewarna hematoksilin-eosin. Hematosikslin adalah zat warna alami yang pertama digunakan pada tahun 1863. Zat ini memiliki afinitas yang kecil terhadap jaringan jika digunakan sendiri, sehingga dikombinasikan dengan aluminium, besi, kromium, tembaga dan wolfram (yang berfungsi sebagai penajam atau katalisator) akan menjadi pewarnaan yang baik untuk inti dan kromatin. Bahan aktifnya, yaitu hematein, dibentuk dengan mengoksidasi hematosiklin. Proses ini dikenal dengan nama “pamatangan” selama beberapa hari/minggu jika tidak dipercepat dengan penambahan suatu bahan oksidator (oxydizing agent), seperti HgO dan H2O2.
adalah pengkombinasian dengan aluminim dalam bentuk tawas. Potongan jaringan yang diwarnai dengan hematosiklin ini biasanya ditambahkan dengan eosin, safranin atau pewarna kontras lainnya. Kombinasi hematosiklin dengan besi atau wolfram/tungsten sering digunakan dalam pewarnaan khusus. Preparat jaringan yang telah diwarnai dapat dibuat preparat yang lebih awet dengan cara mounting menggunakan mounting agent misalnya enthelan (Rumawas et al. 1974).
Tabel 3 Kelebihan dan kekurangan berbagai larutan pengawet Larutan
Pengawet Kelebihan Kekurangan
Formalin Cairan pengawet umum, pH netral, potongan jaringan dapat
ditinggalkan dalam pengawet tanpa terjadi perubahan berarti (sampai 1 tahun)
Waktu perendaman > 24 jam, terjadi pengerutan jaringan
Muller Daya penetrasi cepat dan baik, memfiksasi nukleus dan sitoplasma dengan baik
Jika sampel direndam dalam pengawet (> 24 jam), jaringan menjadi rapuh, tidak dapat dipakai untuk pewarnaan dengan metode histokimia, harus dicuci dulu dengan air kran mengalir sebelum dilakukan dehidrasi
Bouin Daya penetrasi cepat dan merata
tetapi menyebabkan pengerutan, memberikan warna cemerlang bila diwarnai dengan metode trichrome, sangat baik untuk nukleus dan kromoson, warna kuning membuat jaringan mudah dilihat saat
perendaman dan pengirisan jaringan
Bila direndam dalam
pengawet (> 24 jam), jaringan menjadi rapuh, harus dicuci dulu dengan air kran untuk menghilangkan kelebihan pikrat Zenker Formol (Cairan Helly)
Daya fiksasi cepat dan kuat, sangat baik untuk fiksasi sumsum tulang, limpa dan organ lain yang banyak mengandung darah, warna
sitoplasma menjadi lebih cemerlang
Pemaparan jaringan dalam larutan yang melebihi waktu yang ditentukan
mengakibatkan jaringan rapuh
Pada proses pembuatan preparat histologis sering terjadi beberapa kesalahan sehingga terjadi kegagalan. Samuelson (2007 menguraikan beberapa masalah yang mungkin terjadi beserta langkah koreksinya (Tabel 4).
Tabel 4 Masalah-masalah dalam preparasi histologis spesimen
Problem Penyebab Hasil Langkah koreksi
Fiksasi yang tidak cukup (inadequate fixation) Agen fiksasi yang tidak cocok, ukuran spesimen yang terlalu besar Kesulitan embedding (uneven embedding), lautan hipotonik akan mengembungkan spesimen, larutan hipertonik akan mengerutkan spesimen, improper staining Uukuran specimen diperkecil atau dilakukan fiksasi dengan metode perfusion, lihat kembali kekuatan agen fiksatif untuk mendapat tonisitas yang terbaik Improper
embedding
Fiksasi yang tidak cukup dan atau dehidrasi, medium embedding yang tidak cukup Specimens section unevenly, adanya lubang-lubang di dalam section Tingkatkan fiksasi, gunakan mediam embedding yang seharusnya Irregular sections Embedding yang tidak cukup, penggunaaan pisau yang tumpul, kesalahan microtome
Adanya bekas tekanan, spesimen terburai
Gunakan pisau sekali pakai yang baru atau pisau yang tajam, perbaiki mikrotom Inadequate staining Fiksasi yang tidak cukup, stain dan pewarna yang sudah lama
Sedikit atau didak ada warna yang terbagi oleh stain atau pewarna
Tingkatkan fiksasi, buat larutan stain dan pewarna yang baru
3 METODOLOGI
3.1 Waktu dan Tempat Penelitian
Penelitian dilaksanakan pada bulan Februari-Juni 2011 di Laboratorium Karakteristik Bahan Baku Hasil Perairan, Laboratorium Biokimia Hasil Perairan (Departemen Teknologi Hasil Perairan), Laboratorium Kesehatan Ikan (Departemen Budidaya Perairan), Laboratorium Teknik Pengolahan Pangan (Departemen Teknologi Pangan), dan Laboratorium Histopatologi (Fakultas Kedokteran Hewan), Institut Pertanian Bogor.
3.2 Bahan dan Alat Penelitian
Bahan-bahan yang digunakan dalam penelitian ini terdiri dari bahan utama berupa ikan bandeng (Chanos chanos) dengan ukuran 200-250 g/ekor. Ikan bandeng yang diamati adalah ikan bandeng yang disimpan pada suhu chilling. Bahan-bahan yang digunakan untuk analisis proksimat meliputi H2SO4
(MERCK p.a.), kjeltab Selenium (MERCK p.a.), NaOH (MERCK p.a.), H3BO3
(MERCK p.a.), n-heksana (MERCK p.a.), dan HCl (MERCK p.a.). Bahan-bahan yang digunakan untuk pembuatan preparat histologi terdiri dari larutan Buffer Normal Formalin 10% (MERCK p.a.), Bouin’s 10% (MERCK p.a.), alkohol 50-100% (MERCK p.a.), xylol (MERCK p.a.), parafin (MERCK p.a.), hematoksilin (MERCK), eosin (MERCK), dan mounting agent (MERCK).
Alat-alat yang digunakan dalam penelitian ini meliputi sokhlet (SIBATA SB 6), tabung kjehdahl (PYREX), tanur pengabuan (Yamato FM 38), timbangan analitik (AND HF 400), oven (Yamato DV 40), cetakan yang terbuat dari kertas kalender, rotary mikrotom (Yamato Kohki LR-85), Mikroskop Cahaya Olympus BX51, Microcular MD 130 Electron Eyepiece serta peralatan uji organoleptik, kamera digital canon A495, dan penetrometer (Precision, Scientific Petroleum Instruments).
3.3 Metode Penelitian
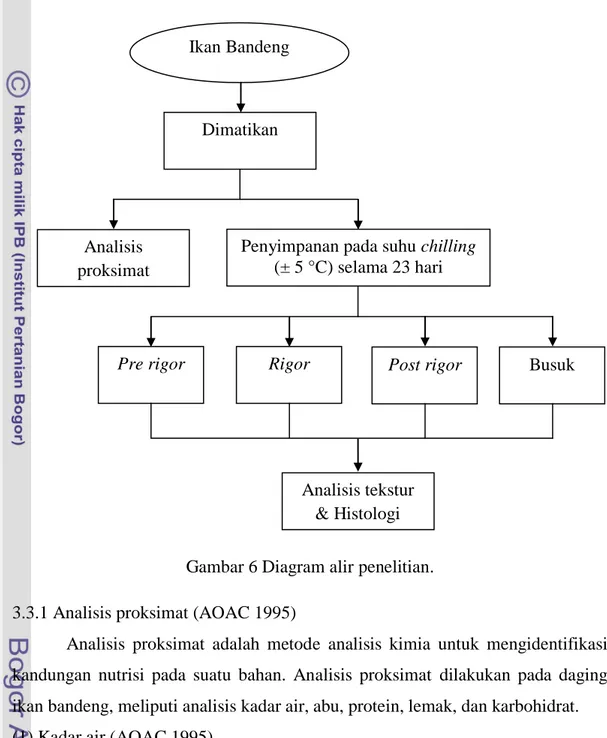
Sampel ikan bandeng dimatikan dengan menusuk oblongata setelah itu sebagian ikan diambil dan diuji proksimat. Ikan lainnya disimpan pada suhu chilling (±5°C) selama 23 hari (sampai ikan busuk). Ikan yang disimpan tersebut
diamati setiap hari dan dilakukan pengujian tekstur dan pengamatan histologis pada setiap fase kemunduran mutu (pre rigor, rigor, post rigor, dan busuk). Tahapan penelitian dapat dilihat pada Gambar 6.
Gambar 6 Diagram alir penelitian. 3.3.1 Analisis proksimat (AOAC 1995)
Analisis proksimat adalah metode analisis kimia untuk mengidentifikasi kandungan nutrisi pada suatu bahan. Analisis proksimat dilakukan pada daging ikan bandeng, meliputi analisis kadar air, abu, protein, lemak, dan karbohidrat. (1) Kadar air (AOAC 1995)
Sejumlah sampel (± 5 g) dimasukkan ke dalam cawan yang telah diketahui beratnya. Kemudian cawan dimasukkan ke dalam oven bersuhu 100 ºC hingga diperoleh berat yang konstan. Perhitungan kadar air dilakukan berdasarkan berat basah dengan menggunakan rumus :
Ikan Bandeng
Dimatikan
Analisis proksimat
Penyimpanan pada suhu chilling (± 5 °C) selama 23 hari
Pre rigor Rigor Post rigor Busuk
Analisis tekstur & Histologi
Kadar air (% bb) = x 100% Keterangan:
a = berat cawan dan sampel awal (g)
b = berat cawan dan sampel akhir (g)
c = berat sampel awal (g)
(2) Kadar lemak (AOAC 1995)
Labu lemak yang akan digunakan dikeringkan dalam oven bersuhu 110 ºC, didinginkan dalam desikator dan ditimbang. Sampel ditimbang sebanyak 5 gram, dibungkus dengan kertas saring dan dimasukkan ke dalam alat ekstraksi (soxhlet) yang telah berisi pelarut heksana. Proses reflux dilakukan sampai larutan jernih dan pelarut yang ada di dalam labu lemak terdistilasi. Selanjutnya labu lemak yang berisi lemak hasil ekstraksi dipanaskan dalam oven pada suhu 105 ºC hingga beratnya konstan, didinginkan dalam desikator dan ditimbang. Kadar lemak dihitung dengan rumus:
Kadar lemak = x 100%
(3) Kadar abu (AOAC 1995)
Cawan porselin dikeringkan dalam oven bersuhu 110 ºC, kemudian didinginkan dalam desikator dan ditimbang. Sebanyak 5 gram sampel ditimbang dan dimasukkan ke dalam cawan porselin. Selanjutnya sampel dipijarkan di atas nyala pembakar bunsen sampai tidak berasap lagi, kemudian dilakukan pengabuan di dalam tanur listrik pada suhu 400-600 ºC selama 4-6 jam atau sampai terbentuk abu berwarna putih. Kemudian sampel didinginkan dalam desikator, selanjutnya ditimbang. Perhitungan kadar abu dilakukan dengan rumus:
Kadar abu = x 100%
(4) Kadar protein, metode mikro-kjeldahl (AOAC 1995)
Tahap-tahap yang dilakukan dalam analisis protein terdiri dari destruksi, destilasi dan titrasi.
(a) Tahap destruksi
Daging ikan bandeng ditimbang sebesar 1 gram kemudian sampel tersebut dimasukkan ke dalam tabung kjehdahl. Sebanyak 0,25 gram selenium dan 25 ml H2SO4 pekat ditambahkan ke dalam tabung tersebut. Tabung yang berisi larutan
tersebut dimasukkan ke dalam alat pemanas. Proses destruksi dilakukan sampai larutan berwarna bening .
(b) Tahap destilasi
Sampel yang telah didestruksi dituangkan ke dalam labu destilasi lalu ditambahkan akuades 50 ml. Air bilasan juga dimasukkan ke dalam alat destilasi dan ditambahkan larutan NaOH 40% sebanyak 20 ml. Cairan dalam ujung tabung kondensor ditampung dalam erlenmeyer 10 ml berisi larutan H3BO3 dan 2 tetes
indikator (cairan methyl red dan brom creosol green) yang ada di bawah kondensor. Destilasi dilakukan sampai diperoleh 10 ml destilat dan berwarna hijau kebiruan.
(c) Tahap titrasi
Titrasi dilakukan dengan menggunakan HCl 0,1 N sampai warna larutan erlenmeyer berubah menjadi merah muda. Volume titran dibaca dan dicatat. Perhitungan kadar protein kulit ikan bandeng ditentukan dengan rumus :
(5) Kadar karbohidrat (by difference) (AOAC 1995) Kadar karbohidrat (%) = 100% - (P + KA + A + L) Keterangan: P = kadar protein (%) KA = kadar air (%) A = kadar abu (%) L = kadar lemak (%) 3.3.2 Uji organoleptik (BSN 2006)
Metode yang digunakan untuk uji organoleptik atau uji sensori adalah dengan menggunakan score sheet berdasarkan SNI 01-2729.1-2006. Pengujian menggunakan 15 panelis semi terlatih yang memiliki kriteria, antara lain tertarik
dan mau berpartisipasi dalam uji organoleptik, terampil, dan konsisten dalam mengambil keputusan, siap sedia pada saat dibutuhkan dalam pengujian, tidak menolak contoh yang akan diuji, berbadan sehat, bebas dari penyakit THT dan tidak buta warna, dan tidak merokok. Berdasarkan data yang diperoleh, kemudian dilakukan analisis kesegaran ikan dengan kriteria sebagai berikut (SNI 01-2729.1-2006):
Segar : nilai organoleptik berkisar antara 7-9 Agak segar : nilai organoleptik berkisar antara 5-6 Tidak segar : nilai organoleptik berkisar antara 1-3
3.3.3 Analisis kekerasan (Precision, Scientific Petroleum Instruments)
Prinsip pengukuran tekstur bahan pangan dengan penetrometer adalah dengan memberikan gaya tekan kepada bahan dengan besaran tertentu sehingga bahan dapat ditentukan. Ikan bandeng dengan ukuran 200-250 gram dianalisis menggunakan penetrometer.
3.3.4 Pembuatan preparat histologis (Angka et al. 1990)
Pembuatan preparat histopatologi terdiri dari tiga tahapan besar yaitu fiksasi jaringan dan parafinisasi, pemotongan jaringan, serta pewarnaan jaringan (Gambar 7).
Organ target, misal otot, diambil menggunakan alat bedah yang sesuai. Otot ikan disayat menggunakan pisau scalpel yang tajam agar jaringan otot tidak rusak. Ikan disayat membentuk persegi panjang dengan ketebalan 5 mm agar bahan fiksatif dapat meresap sempurna. Jaringan otot yang diperoleh direndam dalam larutan fiksatif selama 48 jam, perendaman dilakukan sebanyak 15-20 kali volume jaringan dan dilanjutkan dengan dehidrasi. Larutan fiksatif dibuang, kemudian alkohol 70% dimasukkan ke dalam botol film hingga jaringan terendam, selanjutnya organ diambil dari dalam botol film dan dibungkus menggunakan kain kasa lalu diikat menggunakan benang yang dibentuk seperti teh celup, agar memudahkan dalam proses pergantian alkohol setelah 24 jam, organ yang dibungkus kain kasa diambil dan ditiriskan di atas kertas tisu lalu dimasukkan ke dalam botol berisi alkohol 80%, 90%, 95% masing-masing selama
dua jam dan alkohol 100% selama 12 jam dengan cara yang sama. Perendaman dilakukan pada suhu ruang (Rumawas et al. 1974).
Proses selanjutnya adalah clearing. Jaringan direndam dalam alkohol-xylol (1:1) selama 30 menit, dilanjutkan dengan xylol I, xylol II dan xylol III masing-masing selama 30 menit. Perendaman dilakukan pada suhu ruang. Selanjutnya dilakukan tahap impregnasi, yaitu penggantian xylol dengan paraffin cair yang berlangsung di dalam oven dengan suhu 60 °C. Proses ini dilakukan dengan perendaman jaringan ke dalam xylol-parafin (1:1) yang diletakkan dalam gelas piala selama 45 menit. Proses perendaman dilakukan dengan cara yang sama seperti proses perendaman sebelumnya kemudian dilanjutkan dengan embedding yang merupakan proses memasukkan parafin cair ke dalam sel. Proses ini berlangsung di dalam oven dengan suhu 60 °C. Jaringan direndam secara berturut-turut ke dalam gelas piala yang berisi parafin I, parafin II dan parafin III masing-masing selama 45 menit. Proses perendaman dilakukan dengan cara sama, seperti proses perendaman sebelumnya.
Jaringan yang telah diembedding dalam parafin cair lalu diblok (dicetak agar mudah dipotong) dengan parafin cair, kemudian dibekukan. Proses ini membutuhkan cetakan yang dapat dibuat dari kertas kaku, seperti kertas kalender dengan ukuran 2x2x2 cm. Parafin cair dituangkan ke dalam cetakan hingga memenuhi 1/8 bagian cetakan dan dibiarkan hingga sedikit membeku. Proses selanjutnya, jaringan disusun dalam cetakan dengan bagian sayatan yang diperlukan menghadap dasar cetakan dan dituangi parafin cair hingga material jaringan terendam selanjutnya dibiarkan beku dalam suhu ruang selama 24 jam setelah parafin beku dengan sempurna, blok parafin dikeluarkan dari cetakan lalu dipotong tipis menggunakan silet bermata satu agar dapat disesuaikan dengan tempat blok pada alat pemotong.
Pemotongan jaringan dimulai dengan meletakkan blok parafin yang mengandung preparat pada tempat duduknya di mikrotom. Tempat duduk blok parafin beserta blok parafinnya kemudian diletakkan pada pemegangnya (holder) pada mikrotom dan dikunci dengan kuat. Mata pisau mikrotom harus tajam agar proses pemotongan dapat dilakukan dengan sempurna. Ketebalan potongan diatur dengan cara menggeser bagian pengatur ketebalan hingga ketebalan yang
diinginkan. Ketebalan sayatan yaitu 4 µm. Blok preparat digerakkan ke arah pisau sedekat mungkin lalu blok preparat dipotong secara teratur dan ritmis. Pita-pita parafin yang awal tanpa jaringan dibuang hingga diperoleh potongan yang mengandung preparat jaringan. Hasil irisan diambil dengan jarum lalu diletakkan di permukaan air hangat dalam 45-50 °C waterbath hingga mengembang setelah pita parafin terkembang dengan baik, pita parafin tersebut ditempelkan pada gelas objek yang telah diberi zat perekat, seperti albumin dengan cara memasukkan kaca objek itu ke dalam waterbath dan menggerakkannya ke arah pita parafin. Setelah melekat, gelas objek digerakkan keluar dari waterbath dengan hati-hati agar pita parafin tidak melipat dan dibiarkan hingga mengering setelah itu dilanjutkan dengan dewaxing yang dimulai dengan meletakkan gelas objek yang berisi jaringan dalam keranjang preparat yang ukurannya sesuai dengan gelas objek. Keranjang tersebut dapat diisi dengan 10 gelas objek. Jaringan pada gelas objek yang telah diletakkan dalam keranjang direndam ke dalam xylol I dan xylol II masing-masing selama 2 menit. Lilin akan terlepas dari jaringan dan jaringan akan tampak jernih selanjutnya dilakukan hidrasi yang merupakan proses pemasukkan air ke dalam preparat jaringan pada gelas objek setelah proses dewaxing. Jaringan pada gelas direndam dalam alkohol 100% dalam wadah perendaman, lalu secara berturut-turut dimasukkan ke dalam alkohol 95%, 90%, 80%, 70% dan 50% masing-masing selama dua menit dengan cara yang sama pula selanjutnya preparat jaringan direndam ke dalam akuades selama dua menit setelah hidrasi preparat jaringan diberi pewarna hematoksilin-eosin. Preparat jaringan direndam dengan pewarna hematoksilin selama 7 menit kemudian dicuci dengan air mengalir untuk menghilangkan kelebihan zat warna yang tidak diserap, lalu preparat jaringan direndam dengan pewarna eosin selama 3 menit dan dicuci dengan akuades. Preparat jaringan kemudian direndam dalam alkohol 70%, 85%, 90% dan 100% masing-masing dilakukan selama dua menit selanjutnya preparat jaringan lalu direndam dalam xylol I dan xylol II masing-masing selama dua menit.
Gambar 7 Diagram alir proses pembuatan preparat histologi (Angka et al. 1990) Pengamatan mikroskop (100x)
Preparat awetan
Pengambilan gambar
Perekatan jaringan dengan mounting agent Pewarnaan Hematoksilin-Eosin Pelekatan pita parafin pada gelas obyek Pemotongan dengan mikrotom ketebalan ± 4 µm
Ikan bandeng
daging dan mata
Fiksasi larutan Bouin’s
Dehidrasi alkohol (80%, 90%, 95%, 100%)
Trimming
Penjernihan (clearing) alkohol-xilol (1:1)
Impregnasi xilol-parafin (1:1)
Preparat jaringan yang telah diwarnai dapat dibuat preparat yang lebih awet dengan cara mounting menggunakan mounting agent seperti enthelan. Preparat jaringan ditutup dengan gelas penutup yang sudah ditetesi enthelan dan dikeringkan dalam oven pada suhu 40 °C selama 24 jam, kemudian diamati di bawah mikroskop. Preparat histologi diamati dengan menggunakan mikroskop dengan perbesaran mulai dari 40x hingga 1000x sesuai dengan kejelasan objek selanjutnya dilakukan dokumentasi menggunakan foto untuk dijadikan bahan analisis deskriptif.
3.3.5 Analisis data secara deskriptif
Data dianalisis dengan caradeskripsi kualitatif dengan melihat preparat histologi di bawah mikroskop selanjutnya dari preparat tersebut dianalisis perubahan yang terjadi dari setiap jaringan pada fase-fase pasca kematian (prerigor, rigor, postrigor, busuk) sebagai pendukung dalam analisis juga diikutsertakan hasil pengujian proksimat, organoleptik dan kekerasan.
4 HASIL DAN PEMBAHASAN
4.1 Komposisi Proksimat Ikan Bandeng
Tipe ikan bandeng yang ditemukan di Indonesia memiliki ciri adanya perpanjangan sirip dorsal dan pektoral. Tipe ikan dengan perpanjangan ini hanya ditemukan di Indonesia (Schuster 1959). Bandeng mampu mentolelir salinitas perairan yang luas (0-158 ppt) sehingga digolongkan sebagai ikan eurihalin. Ikan bandeng mampu beradaptasi terhadap perubahan lingkungan seperti suhu, pH, dan kekeruhan air serta tahan terhadap serangan penyakit (Ghufron dan Kardi 1997).
Hasil pengujian proksimat yang dilakukan pada daging ikan bandeng disajikan pada Tabel 5.
Tabel 5 Hasil pengujian proksimat daging ikan bandeng Komponen proksimat Rata-rata Air 77,54 ± 0,46% Protein 12,45 ± 1,79% Lemak 1,08 ± 0,12% Abu 1,55 ± 0,03% Karbohidrat 7,38 ± 2,10%
Kandungan protein ikan bandeng dari pengujian adalah 12,45 ± 1,79%. Kadar protein tersebut lebih rendah dibandingkan kadar protein yang diperoleh Wibowo (2000) yaitu 22,84%. Perbedaan tersebut dapat disebabkan pakan yang diberikan tidak mengandung jumlah protein yang cukup. Berdasarkan hasil penelitian Fatimatussholikhah (2007) diketahui bahwa pemberian bungkil kelapa yang memiliki kadar protein besar sangat berpengaruh terhadap kadar protein ikan lele dumbo. Murray et al. (1977) mengatakan bahwa peningkatan suplementasi lemak pada pakan ikan dapat meningkatkan jumlah protein jaringan ikan. Hal tersebut menunjukkan bahwa pemberian pakan yang cukup nutrisi sangat berpengaruh terhadap komposisi protein ikan. Menurut Burgess et al. (1967) ikan sangat beragam dalam konsumsi makanannya, tergantung dari musim dan lokasi dimana mereka hidup. Temperatur juga memiliki efek langsung selain musim dan geografis terhadap nafsu makan ikan.
Lemak merupakan bentuk cadangan energi. Lemak tidak dapat menggantikan protein untuk pertumbuhan tetapi dapat menjaga cadangan protein (Burgess et al. 1967). Kadar lemak ikan bandeng berdasarkan hasil penelitian adalah 1,08 ± 0,12%, sedangkan menurut Wibowo (2000) adalah 1,51%. Kandungan lemak yang kecil tersebut dapat disebabkan oleh komposisi pakan yang diberikan pembudidaya jumlah lemaknya sangat sedikit. Jumlah lemak pada ikan menurut Tarr (1954) dipengaruhi oleh spesies, musim, umur, lingkungan dan kematangan seksual. Faktor lingkungan dan pakan dapat menjadi kontributor utama rendahnya kadar lemak pada ikan bandeng yang diambil dari tambak ini. Burgess et al. (1967) mengatakan bahwa otot ikan yang diambil dari lokasi yang berbeda menunjukkan perbedaan dalam kandungan lemaknya. Faktor lain dari rendahnya komposisi lemak tersebut adalah distribusi lemak tidak sama pada tubuh ikan. Lemak paling banyak terdapat pada lapisan tipis dan dikenal dengan nama jaringan adiposa yang terdapat di bawah kulit. Pengujian proksimat lemak ikan pada penelitian ini tidak mengikutkan kulit ikan sehingga lemak di bawah kulit tidak diperhitungkan.
Karbohidrat dalam daging ikan merupakan polisakarida, yaitu glikogen yang terdapat dalam sarkoplasma diantara miofibril (Hadiwiyoto 1993). Komposisi karbohidrat dari hasil penelitian adalah 7,38 ± 2,10%. Perhitungan komposisi karbohidrat dilakukan berdasarkan metode by difference sehingga sangat tergantung pada jumlah protein dan lemaknya. Jumlah protein dan lemak yang kecil menyebabkan jumlah karbohidrat menjadi tinggi. Pakan merupakan faktor yang sangat penting terhadap komposisi ketiga unsur tersebut. Pakan yang diberikan pembudidaya kemungkinan memiliki kandungan karbohidrat tinggi, rendah lemak serta protein.
Air merupakan komponen sel hidup yang ada dimana-mana dan merupakan 60-95% dari berat organisme (Amstrong 1995). Air dalam makanan biasanya terbagi dua yaitu air imbibisi dan air kristal. Air imbibisi adalah air yang masuk ke dalam bahan pangan dan menyebabkan pengembangan volume. Air kristal merupakan air yang terikat dalam semua bahan, baik pangan maupun non pangan yang berbentuk kristal, yaitu gula, garam, dan CuSO4, dan lain-lain
0,46% sedangkan menurut Wibowo (2000) adalah 70,45%. Perbedaan kadar air tersebut diduga karena adanya kemampuan bahan mengikat air yang disebut water holding capacity (WHC). Molekul air akan terikat melalui ikatan hidrogen berenergi besar. Molekul air akan membentuk hidrat dengan molekul yang mengandung atom O dan N layaknya protein dan karbohidrat (Pearson dan Dutson 1999; Winarno 1997).
Mineral dalam makanan ditentukan dengan pengabuan atau insinerasi (pembakaran) (deMan 1997). Dalam proses pembakaran, bahan-bahan organik terbakar tetapi zat anorganiknya tetap yang disebut abu (Winarno 1992). Elemen-elemen yang termasuk mineral adalah potasium, sodium, kalsium, magnesium, besi, tembaga, mangan, zink, dan kobalt. Ada juga elemen yang tidak termasuk metal, yaitu fosfor, sulfur, klorin, iodin dan elemen lain dengan jumlah yang sangat kecil. Semua elemen di atas ditemukan dalam daging ikan. (Burgess et al. 1967). Kadar abu ikan bandeng yang didapat dari penelitian adalah 1,55 ± 0,03%, sedangkan Wibowo (2000) memperoleh kadar abu ikan bandeng 2,15 %. Perbedaan kadar abu ini diduga akibat perbedaan lingkungan ikan, sehingga mineral yang terakumulasi pun berbeda tergantung habitatnya.
4.2 Organoleptik Daging dan Mata Ikan Bandeng
Pengujian organoleptik adalah salah satu jenis pengujian kesegaran yang paling awal yang dikenal manusia. Uji ini menggunakan sensor (indera) yang dimiliki oleh manusia. Berdasarkan hasil pengujian organoleptik (Gambar 8) diketahui bahwa pada jam ke-0, kondisi mata dan daging ikan bandeng masih sangat segar yang ditunjukkan dengan penampakan mata yang cerah, bola mata menonjol, dan kornea jernih. Kondisi daging juga sangat baik yang dapat dilihat dari sayatannya yang sangat cemerlang dan dinding perut utuh. Pada jam ke-120 sampai 192, ikan berada dalam kondisi yang agak segar dengan ciri-ciri mata agak cerah, bola mata rata sampai agak cekung, pupil agak abuan sampai keabu-abuan dan kornea agak keruh, pada daging terlihat sayatan daging sedikit kurang cemerlang. Pada jam ke-264 sampai 480 ikan telah berada dalam keadaan tidak segar, bola mata telah cekung, pupil menjadi putih susu dan kornea keruh sampai agak kuning, sayatan daging terlihat sangat kusam dan dinding perut ikan sangat lunak. Pengelompokan tersebut dilakukan berdasarkan pada SNI 01-2346-2006.
0 2 4 6 8 10 0 120 192 264 336 480
Nilai Organoleptik Daging Nilai Organoleptik Mata
Gambar 8 Hasil pengujian organoleptik daging dan mata ikan bandeng. Menurut Sulaksana (1999) semakin lama waktu pengamatan (jam post-mortem) kecenderungan degenerasi serabut otot semakin meningkat, hal ini disebabkan oleh semakin banyaknya asam laktat yang tertimbun sehingga terjadi denaturasi protein otot dan menyebabkan degradasi serabut otot.
Selama proses kemunduran mutu mata ikan mengalami perubahan yang diakibatkan oleh berhentinya aliran darah yang menyumplai oksigen. Winkler dan Hopkins (1982) menyatakan bahwa aktivitas ATPase pada retina manusia menurun setelah 24 jam postmortem, mencapai titik stabil setelah 48 jam. Hal ini disebabkan oleh rendahnya aktivitas Mg2+ dan N+-K+ untuk menstimulasi ATPase. Hal yang sama terjadi pada vertebrata lainnya. Retina dan pigmen epitelium dari berbagai jenis vertebrata memiliki beberapa jenis ATPase yang aktivitasnya distimulasi oleh Mg2+, N+ dan K+, HCO3- (atau anion yang lain) dan
Ca2+.
4.3 Kekerasan Daging dan Mata Ikan Bandeng
Setiap fase kemunduran mutu memiliki karakteristik kekerasan daging yang berbeda akibat adanya perubahan kimia dan biologi pada daging ikan. Hasil pengujian kekerasan ikan bandeng dapat dilihat pada Tabel 6.
Tabel 6 Hasil pengujian kekerasan daging ikan bandeng Fase Pasca Kematian Rata-rata (mm/10''/50g) Prerigor 2,34 ± 0,08 Rigor 1,42 ± 0,17 Postrigor 3,75 ± 0,07 Busuk 33,00 ± 2,83
Hasil pengujian penetrometer fase prerigor menunjukkan nilai 2,34 ± 0,08 mm/10''/50g yang artinya bahwa penetrasi jarum pada daging ikan sampai kedalaman 2,34 mm dari permukaan dengan pemberat 50 g. Eskin (1990) menyatakan saat fase pre rigor kondisi daging ikan masih lembut dan lunak, secara kimiawi terjadi penurunan jumlah ATP dan kreatin fosfat yang disebabkan terhentinya suplai oksigen ke jaringan setelah ikan mati.
Hasil pengujian memperlihatkan bahwa pada fase rigor kondisi daging ikan paling keras dengan hasil penetrometer 1,42 ± 0,17 mm/10''/50g yang menunjukkan bahwa penetrasi jarum pada daging ikan hanya sampai kedalaman daging 1,42 mm dengan pemberat yang digunakan 50 g. Keadaan daging ikan yang keras tersebut menurut Eskin (1990) disebabkan oleh terjadinya ikatan elektrostatik antara filamen aktin dan miosin (aktomiosin) yang ditandai dengan terjadinya pengkerutan atau kontraksi serabut otot yang tidak dapat balik (irreversible) atau biasa disebut kejang otot (rigor mortis).
Nilai hasil uji penetrometer fase postrigor adalah 3,75 ± 0,07 mm/10''/50g. Pada post rigor terjadi kenaikan pH ikan secara perlahan-lahan dengan meningkatnya laju perubahan autolitik yang ditandai dengan proses pelunakan daging ikan (Govidan 1985). Menurut Dwiari et al. (2008) saat post rigor terjadi pelunakan daging yang disebabkan aktivitas enzim meningkat sehingga terjadi penguraian daging ikan yang selanjutnya menghasilkan substansi yang baik bagi pertumbuhan bakteri.
Keadaan daging paling lunak adalah saat busuk. Hasil pengujian penetrometer menunjukkan nilai 33,00 ± 2,83 mm/10''/50 g yang artinya bahwa jarum penetrometer dapat masuk ke sedalam 33 mm ke dalam daging ikan dengan berat pemberat 50 g. Keadaan ini disebabkan kondisi daging yang telah rusak
akibat serangan bakteri. Bakteri yang umum ditemukan pada ikan adalah bakteri dari golongan Pseudomonas, Alcaligenes, Micrococus, Sarcina, Flavobacterium, Serratia, Vibrio, dan Bacillus. Pada ikan segar yang baru ditangkap bakteri yang dominan adalah jenis Micrococus dan Flavobacterium, kemudian setelah pembusukan berlangsung dominasi beralih kepada jenis-jenis bakteri pembusuk seperti Pseudomonas dan Achromobacter (Ilyas 1983).
4.4 Histologis Daging dan Mata Ikan Bandeng
Sistem otot pada telestoi terdiri dari sel yang disebut serabut otot, yang elemen utamanya adalah miofibril. Miofibril terdiri dari ratusan protein miofilamen yang terbagi menjadi bagian tipis (aktin) dan bagian tebal (miosin). Jika dilihat secara longitudinal penampakan lurik pada serabut otot adalah akibat susunan aktin dan miosin ini (Chinabut et al. 1991).
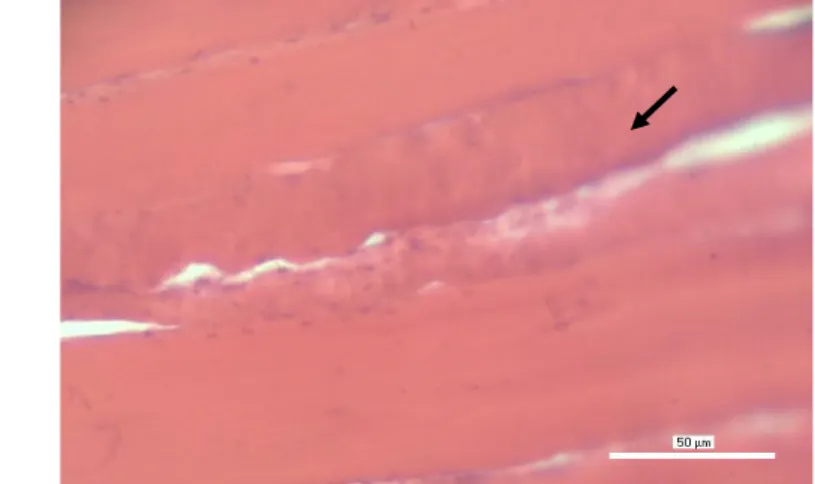
Jaringan otot pada fase prerigor (Gambar 9) terlihat sangat kompak. Sel otot menyatu dengan baik, hubungan antar sel otot atau biasa disebut serabut otot terlihat erat. Fase ini merupakan saat daging ikan berada dalam kondisi paling optimal. Jaringan otot juga nornal, tidak mengalami penebalan. Histologis jaringannya sama dengan saat ikan masih hidup karena belum mengalami perubahan kimia dan biologi yang dapat mengubah bentuk serta susunan sel dalam jaringan otot ikan bandeng. Menurut Eskin (1990), daging ikan pada fase ini lembut dan lunak seperti saat ikan masih hidup, kondisi daging paling ideal untuk konsumsi dan paling segar.
Gambar 9 Kondisi histologis daging ikan bandeng fase pre rigor; panah: serabut otot (H&E).
Gambar 10 Kondisi histologis daging ikan bandeng fase rigor; A: serabut otot (H&E); B: perenggangan.
Pada fase rigor (Gambar 10) mulai terjadi perenggangan jaringan otot ikan. Perenggangan serabut otot itu terlihat sangat jelas dengan adanya rongga-rongga antar serabut otot. Perubahan yang menarik pada fase ini dibandingkan dengan fase sebelum dan sesudahnya adalah serabut otot terlihat lebih tebal akibat penyatuan filamen aktin dan miosin membentuk aktomiosin yang ditandai dengan terjadinya pengkerutan atau kontraksi serabut otot yang tidak dapat balik (irreversible). Kondisi kejang penuh (full-rigor) ketika kandungan ATP sekitar 1 µmol/g (Eskin 1990). Pada fase ini juga mulai terlihat perjadi perenggangan jaringan otot, hal tersebut kemungkinan disebabkan karena terjadi penurunan pH yang meningkatkan kerja enzim autolisis. Menurut Haard (1994), enzim lisosomal proteinase aktif saat pH asam yang termasuk dalam tipe enzim ini adalah jenis-jenis enzim katepsin. Jiang et al. (1990) diacu dalam Haard (1994) mengatakan bahwa terdapat dua jenis enzim mirip katepsin A pada ikan bandeng.
Pada Gambar 11 dapat dilihat bahwa telah terjadi perenggangan yang jelas pada serabut-serabut otot. Jarak antarserabut otot semakin besar yang disebabkan aktifitas enzim autolitik meningkat (Govidan 1985). Pada fase ini serabut otot tidak tebal lagi seperti pada fase sebelumnya, mulai terlihat adanya kerusakan pada serabut otot, yakni serabut otot terlihat terpotong-potong.
A
Gambar 11 Kondisi histologis daging ikan bandeng fase post rigor.
Menurut Okitani et al. 1981 diacu dalam Haard (1994), katepsin D yang terdapat pada ikan dapat mendegradasi protein aktin dan miosin. Alkalin protease juga berperan dalam perubahan jaringan otot ikan fase post mortem. Enzim lain yang aktif adalah kalpain yang dapat dengan cepat mendegradasi miofibril dan protein sitoskeletal yang terdiri dari desmin, vimentin, gelsolin, spektrin, nebulin, vinkulin, dan troponin T.
Gambar 12 Kondisi histologis daging ikan bandeng fase busuk.
Fase terakhir dalam kemunduran mutu adalah kebusukan. Gambar 12 memperlihatkan keadaan serabut otot yang renggang. Jarak suatu serabut otot dengan serabut otot yang lain terlihat dengan jelas. Serabut otot tidak utuh lagi, telah terpotong-potong menjadi potongan kecil. Jaringan otot terlihat rusak dan sangat renggang. Fase busuk ini merupakan fase saat mikroorganisme telah