ISOLASI, IDENTIFIKASI, DAN UJI BIOAKTIVITAS METABOLIT SEKUNDER
EKSTRAK n-HEKSANA SPONS Petrosia alfiani DARI KEPULAUAN
BARRANG LOMPO
Muh. Syarif Aqa’id1), Hanapi Usman2), Hasna Nasir2) 1)ProgramSarjana Universitas Hasanuddin
2)Jurusan Kimia Universitas Hasanuddin
ABSTRACT
Sponge is one of the highly prospective marine biota as a source of compounds of natural product that has pharmacological activity. Isolation and identification of secondary metabolites from n-heksana extract of sponge Petrosia
alfiani from Spermonde Island, South Sulawesi had been done. Isolation techniques were using maceration, partition,
column chromatography vacuum, and gravity column chromatography. Pure compound was obtained as a needle crystals with a melting point 131-132 °C followed by identification using UV-Vis, FTIR, 1H-NMR, and 13C-NMR. Based on
analysis spectrophotometric, the isolat compound was β-sitosterol. Result of bioactivity test indicate that the compound was able to inhibit the growth of bacterial S. aureus, E. coli, and the fungus C. albicans. Toxicity tests were using larval shrimp
Artemia salina Leach showed the values of LC50was 5,69 mg/mL.
Keywords: Sponges Petrossian alfiani,β-sitosterol, Bioactivity
PENDAHULUAN
Berbagai senyawa kimia yang dihasilkan oleh organisme secara teratur dan bermakna bagi kelangsungan hidup organisme dimuka bumi ini. Keanekaragaman molekul organik bahan alam sesungguhnya menyimpan sejuta misteri yang harus dapat diungkap melalui penelitian dan kajian yang mendalam. Meskipun upaya untuk mencari, mengembangkan, dan memanfaatkan senyawa kimia organik bahan alam telah menjadi tradisi ilmiah yang cukup panjang, dan telah dirintis sejak abad ke 17, namun hingga saat ini hasil penelitian di bidang kimia organik bahan alam masih minim jika dibandingkan dengan kebutuhan dan tantangannya (Usman, 2005).
Secara geografis, Indonesia memiliki wilayah perairan yang luas sehingga tentunya mengandung kekayaan molekul organik bahan alam laut yang seharusnya dapat dijadikan sebagai objek penelitian dan pengembangan, mengingat banyaknya manfaat yang dapat diambil dari senyawa-senyawa metabolit sekunder yang terkandung di dalamnya terutama senyawa yang memiliki bioaktivitas tinggi. Salah satu invertebrata laut yang potensial sebagai penghasil senyawa bioaktif adalah spons. Telah diketahui beberapa sifat bioaktivitas senyawa yang terdapat dalam spons, antara lain sifat sitotoksik, antifungi, penghambat pembelahan sel, antitumor, antivirus, antiinflamasi, antimikroba dan aktivitas penghambat enzim “enzyme inhibitor”(Lee dkk., 2001).
Di perairan Sulawesi Selatan, empat spesies spons telah dilaporkan, yaitu: Halichondria sp.,
Callyspongia sp., Callyspongia pseudoreticulatta, dan Auletta sp., yang masing-masing memiliki ekstrak senyawa bioaktif bersifat bakterisida (Ahmad dkk., 1995).
Belakangan ini telah ditemukan spesies baru yaitu
Petrosia alfiani di temukan oleh Voogd dan Van Soest
(2002) yang tersebar di kawasan perairan Kepulauan Spermonde, Sulawesi Selatan. Beberapa hasil penelitian senyawa bioaktif dari genus Petrosia telah dilaporkan mengandung asam kortikatat sebagai antijamur dari spons
Petrosia cortikata (Soediro, 1999), sedangkan data dari
Van Soest dan Braekman (1999) menemukan beberapa senyawa bioaktif dari famili petrosidae diantaranya polihidroksilat asetilin, siklik 3-alkilpiperidin, dan siklopropenasterol. Selain itu beberapa senyawa aktif yang
telah ditemukan dan dilaporkan dari genus Petrosia adalah alkaloid manzamine-A bersifat sitotoksik (El sayed dkk., 2001). Pada Petrosia sp. ditemukan senyawa poliasetilen, dideoxypetrosynol A yang menunjukkan aktivitas antitumor pada sel melanoma kulit manusia (Cho dkk., 2004). Aktivitas antibakteri juga ditemukan pada hasil isolasi dari spons laut Petrosia contignata, yaitu, Taraxeron dan D-homoandrostan (Sutedja dkk., 2005). Senyawa antibakteri epidoksi sterol dari spons laut
Petrosia nigrans juga telah diisolasi dan dikarakterisasi
dengan nama 5,8-epidioksi-24-etilkolest-6-en-3-ol (Handayani dkk., 2008).
n-Heksana merupakan pelarut yang bersifat
non-polar. Oleh karena itu n-heksana diharapkan dapat
menarik senyawa-senyawa yang bersifat non-polar pada spons Petrosia yang belum pernah diteliti sebelumnya.
Berdasarkan informasi yang ada, menunjukkan bahwa metabolit sekunder yang terkandung dalam spons
Petrosia sangat banyak dan umumnya memiliki bioaktivitas yang kuat. Oleh sebab itu diperlukan penelitian yang lebih konperehensif.
Spons Petrosia alfiani adalah spesies yang baru ditemukan dan endemik di kepulauan Barrang Lompo, diduga spons Petrosia alfiani mengandung banyak metabolit sekunder yang berguna dan memungkinkan ditemukannya metabolit sekunder yang baru.
METODE PENELITIAN a. Bahan Penelitian
Bahan-bahan yang digunakan pada penelitian ini adalah serbuk spons P. alfiani, pelarut yang berkualitas teknis yang telah didestilasi seperti metanol (CH3OH),
kloroform (CHCl3), etil asetat (EtOAc), dan n-heksana
(C6H14). Pelarut metanol (CH3OH) dan n-heksana
(C6H14) yang berkualitas (p.a) digunakan pada proses
rekristalisasi. Adsorben kolom kromatografi seperti silika gel 60 GF254 (Merck), G 60 (230-400 Mesh), 60 PF254(Merck), kieselgel 60 F2540,25 mm (Merck), plat
KLT, dan FeCl3 5 % sebagai penampak noda. Dimetil
sulfoksida (DMSO), Natrium hipoklorit, bakteri E. coli,
Staphylcocus aureus, jamur Candida albicans, serta
b. Prosedur Penelitian
1. Penyiapan dan Pengolahan Sampel
Sampel yang telah diambil dari laut kemudian dipotong-potong lalu dikeringkan selama kurang lebih 1 minggu 2 hari. Sampel yang telah kering kemudian dipotong-potong menjadi potongan kecil agar nantinya mudah untuk dihaluskan menggunakan blender. Setelah halus, sampel kembali dikeringkan selama 3 hari dan berat kering sampel ditimbang. Berat sampel kering yang diperoleh sebanyak 969,32 gram.
2. Ekstraksi
Serbuk spons dimaserasi dengan metanol selama 1 x 24 jam pada suhu kamar. Maserasi diulangi dengan volume metanol yang sama 4 kali. Hasil maserasi kemudian ditampung untuk diuapkan menggunakan rotary evaporator. Hasil maserasi kemudian ditampung untuk diuapkan menggunakan rotary evaporator.
Ekstrak metanol hasil penguapan dipartisi dengan
n-heksana dan selanjutnya diuapkan lagi dengan
menggunakan evaporator. Jumlah ekstrak n-heksana yang diperoleh dalam proses ekstraksi ini sebanyak 7,4768 g.
Ekstrak metanol diekstraksi cair-cair dengan pelarut n-heksana kemudian dianalisis dengan KLT untuk mencari eluen yang dapat memisahkan komponen senyawa dengan baik.
3. Isolasi
Tahapan isolasi ini dimulai dengan melakukan kromatografi kolom gravitasi (KKG). Ekstrak yang sudah kering sebanyak 10 g kemudian diimprek dengan menggunakan silika gel tipe 7730. Setelah itu barulah dilakukan KKG untuk memisahkan senyawa menjadi beberapa fraksi-fraksi. Fraksi 21-30 disebut isolat 1 yang berpendar pada sinar short wave dan fraksi 31-59 yang tidak berpendar pada sinar UV short wave.
Fraksi dimurnikan dengan cara rekristalisasi maka diperoleh isolat 1 murni dengan titik leleh 131-132 °C. Hal ini dapat dikatakan murni karena jarak titik lelehnya tidak lebih dari 2 derajat dan berbentuk kristal jarum putih seperti yang terlihat pada Lampiran 6. Selanjutnya pengukuran dilakukan menggunakan instrument GC-MS, FT IR,1H NMR, dan 13C NMR serta dilanjutkan dengan
pengujian anti sitotoksik, anti jamur, dan anti bakteri.
4. Uji Bioaktivitas Antibakteri (Metode difusi)
Ekstrak uji yang diserap dengan kertas saring dimasukkan ke dalam silinder atau dimasukkan ke dalam lubang, dikontakkan dengan media yang telah diinokulasi. Kemudian setelah diinkubasi, diameter daerah bening disekitar reservoir diukur. Diameter daerah bening ini merupakan daerah inhibisi dari ekstrak sampel terhadap mikroba uji. Untuk menurunkan limit deteksi, sistem dibiarkan pada suhu rendah selama beberapa jam sebelum diinokulasi, yaitu untuk memberikan kesempatan kepada antibiotik untuk berdifusi sebelum mikroba tumbuh.
5. Uji Bioaktivitas Antijamur (Metode difusi)
Ekstrak uji yang diserap dengan kertas saring dimasukkan ke dalam silinder atau dimasukkan ke dalam lubang, dikontakkan dengan media yang telah diinokulasi.
Kemudian setelah diinkubasi, diameter daerah bening disekitar reservoir diukur. Diameter daerah bening ini merupakan daerah inhibisi dari ekstrak sampel terhadap mikroba uji. Untuk menurunkan limit deteksi, sistem dibiarkan pada suhu rendah selama beberapa jam sebelum diinokulasi, yaitu untuk memberikan kesempatan kepada antibiotik untuk berdifusi sebelum mikroba tumbuh.
6.
Uji Toksisitas
Uji bioaktivitas yang dilakukan adalah Brine Shrimp Lethality Test (BSLT) yang dilakukan terhadap A. salina, prosedur uji aktivitasnya sebagai berikut: Pengambilan sekitar 10-17 ekor Artemia salina berumur 48 jam ke dalam 100 mL air laut sintetik dilakukan secara acak, dimasukan dalam flakton-flakton yang telah diisi dengan sampel masing-masing 100 µL yang telah dilakukan pengenceran sebagai berikut: sebanyak 200 µL sampel 1000 µg/mL dari fraksi kloroform bioaktif yang diatur konsentrasinya dengan DMSO. Selanjutnya pengenceran dilakukan dalam mikroplate dengan konsentrasi yang divariasi (5, 50, 500) µg/mL dan volume sampel tiap lubang 100 µL secara triplo. Kemudian diikubasi selama 24 jam pada suhu kamar dan selanjutnya jumlah larva yang mati dan yang hidup dihitung dengan bantuan kaca pembesar serta ditentukan nilai LC50
(µg/mL) dengan program Bliss Method (Meyer, dkk., 1982).
HASIL DAN PEMBAHASAN
1. Spektrofotometer Fourier Transform Infra Red
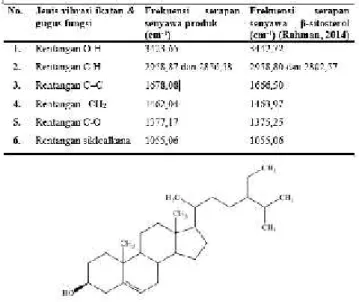
Meski spektrum IR spesifik untuk setiap molekul yang berbeda adalah spektrum IR lebih digunakan untuk mengidentifikasi keberadaan gugus fungsi yang memiliki pita spesifik yang menonjol, seperti: C=O, O-H, N-H, C-O, C=C, C≡N, dan NO2. Data pada Tabel 4 merupakan hasil pengukuran FTIR dari sampel yang telah dimurnikan yang dibandingkan dengan spektrum FTIR
senyawa β-sitosterol yang telah ditemukan oleh Rahman (2014).
Tabel 1. Hasil analisis perbandingan spectrum FTIR
antara senyawa produk dengan senyawa β -sitosterol (Rahman, 2014)
2. Spektrofotometer Proton dan Karbon Nuclear
Magnetic Resonance (1H-NMR) dan (13C-NMR)
Tabel 2. Hasil Pengukuran spektrum1H-NMR dan13
C-NMR pada sampel
3. Gas Chromatography-Mass Spectrometri (GC-MS)
Hasil identifikasi isolat 1 berdasarkan spektrum MS (Lampiran 5) menunjukkan Mr isolat isolat 1 = 414 dan hasil fragmentasi tahap 1 m/z 386, tahap 2 m/z 353, dan tahap 4 m/z 301 hal tersebut memperkuat bahwa isolat 1
adalah β-sitosterol.
4. Uji Toksisitas
Hasil uji bioaktivitas (toksisitas) menggunakan larva udang Artemia salina leach ditunjukkan pada Tabel 3. Pengujian diawali dengan mengairasi telur udang selama 2 × 24 jam.
Tabel 3. Hasil uji toksisitas dengan Artemia salina Leach
Berdasarkan data pada Tabel 3, diketahui bahwa senyawa isolat berpotensi sebagai anti sitotoksik disebabkan pada konsentrasi 5 ppm telah terjadi kematian larva udang dan peningkatan hingga 500 ppm masih mengalami peningkatan terhadap kematian larva. Tabel 3 menunjukkan rata-rata larva udang yang mati selama 1 x 24 jam, dari data tersebut kemudian dihitung persentase kematiannya dengan menggunakan rumus:
Dengan menggunakan rumus di atas didapatkan persentase masing-masing konsentrasi berturut-turut sebesar 0%; 46,7%; 20%. Menentukan log dosis tiap-tiap kelompok kemudian dibuat grafik dengan persamaan garis lurus hubungan antara nilai probit vs log konsentrasi, y = bx + a. Dimana y: angka probit dan x: log konsentrasi, kemudian ditarik garis dari harga probit 5 (= 50% kematian) menuju sumbu X, didapatkan log konsentrasi. Log konsentrasi diantilogkan untuk mendapatkan harga LC50atau LC50 dapat juga dihitung
dari persamaan garis lurus tersebut dengan memasukkan nilai 5 (probit dari 50 % kematian hewan coba) sebagai y sehingga dihasilkan x sebagai nilai log konsentrasi. LC50
dihitung dan diperoleh dari antilog nilai x tersebut. Berdasarkan pada pernyataan Meyer (1982) bahwa senyawa dikatakan toksik apabila mortalitas terhadap
Artemia salina Leach yang ditimbulkan memiliki nilai
LC50< 1000 μg/mL dan sangat toksik apabila ≤ 30
μg/mL. Berdasarkanperhitungan diketahui LC50sebesar
5,6872 µg/mL (ppm) dan dapat dikategorikan sangat toksik.
5. Anti Bakteri dan Anti Jamur
Pengujian anti bakteri dilakukan terhadap bakteri uji berupa E. coli dan S. aureus, sedangkan pengujian terhadap anti jamur dilakukan terhadap C. albicans.
Campuran bakteri dan sampel dimasukkan ke dalam inkubator suhu 37 oC selama 1 x 24 jam, lalu
kemudian diukur daya hambat sampel tehadap bakteri. Pengukuran menggunakan jangka sorong dengan cara mengukur kedua diameter hambatan dan ditentukan rata-ratanya.
Berdasarkan Tabel 5 menunjukkan bahwa sampel pada konsentrasi 100 ppm, 25 ppm, dan 10 ppm mampu menghambat pertumbuhan bakteri E. coli namun tidak sebesar diameter zona hambat kontrol positifnya (21,6 mm), dan konsentrasi 50 ppm tidak mampu menghambat pertumbuhan bakteri E. coli.
Diameter zona hambat sampel pada bakteri S.
aureus adalah 7,3 mm (100 ppm); 9,7 mm (50 ppm); 7,5
mm (25 ppm);7,2 mm (10 ppm); 6,4 mm (kontrol negatif). Dengan demikian senyawa tersebut mampu menghambat pertumbuhan bakteri S. aureus walaupun tidak sebaik kontrol positifnya yaitu sebesar 10,2 mm.
Pada jamur C. albicans dapat disimpulkan bahwa pada konsentrasi 100 ppm, 50 ppm, 25 ppm, dan 10 ppm mampu menghambat pertumbuhan jamur C. albicans
namun tidak sebesar diameter zona hambat kontrol positifnya (26 mm).
KESIMPULAN
Senyawa metabolit sekunder hasil ekstrak n-heksana dari spons P. alfiani diperoleh senyawa β -sitosterol sebanyak 39 mg berbentuk kristal jarum berwarna putih dengan titik leleh 131-132 °C. Hasil uji bioaktifitas senyawa isolat dari kandungan ekstrak n-heksana dari spons P. alfiani diperoleh aktif terhadap terhadap larva udang Artemia salina Leach dengan nilai LC50 sebesar 5,6872 µg/mL (ppm), dan juga aktif
terhadap bakteri E. Coli, bakteri S. aereus dan terhadap jamur C. albicans.
DAFTAR PUSTAKA
Ahmad, T., E., Suryati, and Muliani, 1995, Spons bioactive screening for bactericide in shrimp culture, IFRJ, 1 (1), 1-10.
Amir, I., 1991, Fauna Spons (Porifera) dari Terumbu Karang Genteng Besar Pulau-Pulau Seribu,
Oseanologi di Indonesia, (24), 41–54.
Amir, I., dan Budiyanto, 1996, Mengenal Spons Laut
(Demospongiae) Secara Umum, Oseana, 21
(2),15–31.
Aoki, S., Naka, Y., Itoh, T., Furukawa, T., Rachmat, R.,
Akiyama, S., and Kobayashi, M., 2002,
Lembehsterols A and B, Novel Sulfated Sterols Inhibiting Thymidine Phosphorylase, from the Marine Spons Petrosia strongylata, Chem. Pharm. Bull., 50 (6) 827—830.
Ashour, M. A. A., 2006, Structure Elucidation of Bioactive Marine Natural Products Using Modern Methods of Spectroscopy, Universitas Gadjah Mada, Yogyakarta.
Bergquist, P. R., 1978, Spons, Hutchinson, London. Braekman, J. C., and Daloze, D., 1986, Chemical
defence in sponss, Pure & Appl. Chem., 58 (3), 357-364.
Cimino, G., de Giulio, A., de Rosa, S., di Marzo, V., 1989, Tetrahedron Lett, 30, 3563–3566.
Cimino, G., de Giulio, A., de Rosa, S., di Marzo, V., 1990, J. Nat. Prod, 53, 345-353.
Cho, H. J., S. Ja Bae, N. D. Kim, J. H. Jung and Y.H.
Cho., 2004, Induction of Apoptosis by
Dideoxypetrosynol A, A Polyasetylene from Spons Petrosia sp., in Human Skin Melanoma Cells, International Journal of Molecular Medicine, 23 (8) 1091-1096.
El Sayed, K. L., Kelly, M., Kara, U. K., Ang, K. H., Katsuyama, I., Dunbar, D.C., Khan, A. A., and Hamann, M.T., 2001, New Manzamine Alkaloids with Potent Activity against Infectious Disease, J. Am. Chem. Soc., 123, 1804-1808. Fusetani, N., Shiragaki, T., Matsunaga, S., Hashimoto,
K., 1987, Tetrahedron Lett 28, 4313–4314.
Garson, M.J., 1994, The Biosynthesis of Secondary Metabolits: Why is Important. In: Sponss in
Timeand Space, pp: 428-429, edited by R.W.M.
van Soest, Th. M.G. Van Kempen and
J.CBraekman (eds.)., Proceeding 4th International
Porifera Conggress, Amsterdam/Netherland. Guo, Y., Gavagnin, M., Trivellone, E., Cimino, G, 1994,
Tetrahedron, 50, 13261–13268.
Handayani, D., Sayuti, N., dan Dachriyanus, 2008,
Isolasi dan Karakterisasi Senyawa Antibakteri Epidioksi Sterol dari Spons Laut Petrosia Nigrans, Asal Sumatra Barat, Prosiding Seminar
Nasional Sains Dan Teknologi-II
2008 Universitas Lampung, 17-18 November 2008.
Harrison, F. W., and De Vos, L., 1991, Porifera, Di dalam: Harrison FW, Westfall
JA(ed.). Microscopic Anatomy of
Invertebrates.Volume 2. Placozoa,
Porifera, Cnidaria, and Ctenophora.Wiley-Liss. A John Wiley & Sons, Inc., Publication. New York, Chicester, Brisbane, Toronto, Singapore, 28–89.
Higa, T., Tanaka,J., Kitamura, A., Koyama, T., Takahashi, M., and Uchida, T., 1994,
Bioactive compounds from marine sponss, Pure & Appl. Chern., 66 (10/11), 2227-2230.
Hosettman, K., 1991, Methods in Plant Biochemistry, Academic Press, New York, 6.
Ireland, C. M., Molinski, T. F., Roll, D. M., Zabriskie, T.
M., McKee, T. C., Swersey, J. C., and
Foster, M. P., 1989, Natural Product Peptides from Marine Organisms, Di dalam Scheuer PJ (ed.), Bioorganic Marine Chemistry, Springer –
Verlag, 3, 1-27.
Isaacs, S., Kashman, Y., Loya, S., Hizi, A., Loya, Y., 1993, Tetrahedron, 49, 10435–10438.
Kimura, J., Ishizuka E., Nakao Y. Yoshida W.Y, Scheuer, P.J., and Borges, K. 1998. Isolation of 1- methylherbipoline Salt of Halisulfate-1 and of Suvanine as Serine Protease Inhibitors from Marine Spons, Coscinoderma Mathewsi, J. Nat Prod 61 (28), 248- 250.
Kobayashi, M., dan Rachmaniar R., 1999, Overview of
Marine Natural Product Chemistry, Makalah disajikan dalam Seminar Bioteknologi Kelautan
Indonesia I, Lembaga Ilmu Pengetahuan
Indonesia Jakarta, Jakarta 14 Oktober.
Kunitz, M., and J.H. Northrop, 1936, Isolation from Beef Pancreas of Crystalline trypsinogen trypsin, a trypsin, and an Inhibitor- Trypsin Compound, J.Gen. Physio, 19 (31), 991–1007.
Lee KY, Lee HJ, Lee HK., 2001, Microbial Symbiosis in Marine Sponss, The Journal of Microbiology, 29
(4), 254-264.
Li, H., Matsunaga, S., Fusetani, N., 1994, J. Nat. Prod.,
57, 1464–1467.
Muliani, Suryati E., Tompo A., Parenrengi A., Rosmiati, 1998, Isolasi Bioaktif Bunga Karang Sebagai Fungisida pada Benih Udang Windu Penaeus
monodon, Jurnal Penelitian Perikanan Indonesia, 4 (2) 19-24.
Muniarsih T., dan Rachmaniar R., 1999, Isolasi Substansi Bioaktif Antimikroba dari Spons Asal Pulau Pari Kepulauan Seribu. Makalah disajikan
dalam Seminar Bioteknologi Kelautan Indonesia I, Lembaga Ilmu Pengetahuan Indonesia Jakarta, Jakarta 14 Oktober.
Munro M. H. G., Luibrand R. T., and Blunt J. W., 1989,
The Search for Antivaral and Anticancer
Compounds from Marine Organisms. Di dalam
Scheuer PJ (ed.), Bioorganic Marine
Chemistry, Springer -Verlag, 1, 94-176.
Murti, Y. B., 2006, Isolation and structure elucidation of
bioactive secondary metabolites from sponss collected at Ujungpandang and in the Bali Sea, Indonesia, Institut Pertanian Bogor, Bogor.
Nakagawa, N., Endo, M., Tanaka, N., and Pei, G. L., 1984, Tetrahedron Letters, 3227—3230.
O’Keefe, B. R., Erim,T., Beutler, J.A., Cardellina, J.H.,
Gulakowski, R.W.J., Krepps, B. L.,
Mcmahon, J. B., Sowder, R. C., Johnson, D. G., Buckheit, R.W.J., Halliday, S., And Boyd, M. R., 1998, Isolation and Characterization of adociavirin, a Novel HIV- Inhibitory Protein from
the Spons Adocia sp FEBS Lett, 431 (44), 85–90.
Parenrengi A., Suryati E., Dalfiah, dan Rosmiati, 1999, Studi Toksisitas Ekstrak Spons Auletta sp.
Callyspongia sp., dan C. Pseudoreticulata
terhadap Nener Bandeng (Chanos chanos), Jurnal
Penelitian Perikanan Indonesia 5 (4).
Pronzato, R., Bavestrello, G., Cerrano, C., Magnino, G., Manconi, R., Pantelis, J., Sara, A., and Sidri M., 1999, Spons Farming in the Mediterranian Sea New Perspectives, Memoir of the Queensland
Museum, 44, 485 - 491.
Rachmaniar, R., 1996, Penelitian Produk Alam Laut
Skreening Substansi Bioaktif, Laporan Penelitian
Tahun Anggaran 1995/1996, Lembaga Ilmu Pengetahuan Indonesia, Puslitbang Oseanologi. Rahman, A., 2014, Isolasi, Identifikasi dan Uji
Bioaktivitas Metabolit Sekunder Ekstrak kloroform spons Petrosia alfiani dari Kepulauan Barang Lompo, Jurusan Kimia Fakultas
Matematika dan Ilmu Pengetahuan Alam
Universitas Hasanuddin, Makassar.
Rasyid, A., 2009, Senyawa-senyawa Bioaktif dari Spons, Oseana, 34 (2), 25-32.
Reinheimer, G., 1991, Aquatic Microbiology, 4 th Ed, John Wiley and Sons, Chichester and New York. Romihmohtarto, K., dan Juwana, S., 1999, Biologi
Laut,Ilmu Pengetahuan tentang Biota Laut,
Pusat Penelitian dan Pengembangan Oseanologi-LIPI Jakarta, 115–128.
Ruppert, E. E., and Barnes, R. D., 1991, Invertebrates Zoology, Sixth Edition, Saunders College Publishing, Philadelphia, New York, Chicago, San Fransisco, Montreal, Toronto, London, Sidney, Tokyo, 68–91.
Sandoval, I. T., Davis, R. A., Bugni, T. S., Concepcion, G. P., Harper, M. K., and Ireland, C. M., (tanpa tahun), Cytotoxic Isoquinoline Quinones from Spons of the Genus Petrosia
Setyowati, E. P., Jenie, U. A., Sudarsono, Kardono, B.,
Rahmat, R., dan Meiyanto, E., 2007,
Isolation of Cytotoxic Substance From Kaliapsis Spons, Majalah Farmasi Indonesia, 18 (4), 183-189.
Soediro, I.S., 1999, Produk Alam Hayati Bahari dan
Prospek Pemanfaatannya di Bidang Kesehatan dan Kosmetika, Makalah disajikan dalam
Seminar Bioteknologi Kelautan Indonesia I, Lembaga Ilmu Pengetahuan Indonesia Jakarta, Jakarta 14 Oktober.
Soest, R. W. M., Van, and Braekman, J. C., 1999,
Chemosystematics of Porifera: A Review,
Memoir of the Queensland Museum, 44, 569
-589.
Suparno, 2005, kajian bioaktif spons laut
(forifera:Demospongiae) suatu peluang alternatif Pemanfaatan ekosistem karang Indonesia Dalam bidang farmasi, Sekolah Pasca Sarjana,
IPB-Bogor.
Suriani, 2006, Isolasi, Karakterisasi, dan Uji Bioaktivitas Metabolit Sekunder Spons Callyspongia sp., Tesis Tidak Diterbitkan, jurusan Kimia FMIPA Universitas Hasanuddin, Makassar.
Suryati, E., Parenrengi, A., dan Rosmiati, 2000, Penapisan Serta Analisis Kandungan Bioaktif
Spons Clathria sp. yang efektif
sebagaiAntibiofouling pada teritif (Balanus
amphitrit), Jurnal Penelitian Perikanan Indonesia, 5 (3).
Sutedja, L., Udin, L. Z., dan Manupputy, A., 2005,
Antimicrobial Activity of the Spons Petrosia contignata Thiele, Sistem Informasi Dokumen
Kegiatan Pusat Penelitian Kimia LIPI, Bandung.
Usman, H., Hakim, E. H., Achmad, S.A., Syah, Y. M., Harlim, T., Jalaluddin, M. N. 2005. 2’,4’ -Dihidroksi-3’,5’,6’-Trimetoksi Calkon suatu Senyawa Antitumor dari Kulit Batang Tumbuhan Cryptocarya costata (Lauraceae). Jurnal Matemaika dan Sains ITB. 10 (3): 97-100. Voogd, N. J., De., and Van Soest, R. W. M., 2002,
Indonesian Sponss of the Genus Petrosia, Zool.
Med. Leidan 76.
Warren, L., 1982, Encyclopedia of Marine Invertebrates, Di dalam: Walls JG (ed.), 15–28.