i
EFEK HEPATOPROTEKTIF JUS BUAH PEPAYA
(Carica papaya L.) PADA TIKUS JANTAN TERINDUKSI PARASETAMOL
SKRIPSI
Disusun untuk memenuhi salah satu syarat memperoleh gelar Sarjana Farmasi (S. Farm)
Program Studi Ilmu Farmasi
Oleh : Felix Manuel NIM : 068114136
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA
YOGYAKARTA
ii
Skripsi
EFEK HEPATOPROTEKTIF JUS BUAH PEPAYA
(Carica papaya L.) PADA TIKUS JANTAN TERINDUKSI PARASETAMOL
Yang diajukan oleh : Nama : Felix Manuel NIM : 068114136
telah disetujui oleh:
iii
HALAMAN PENGESAHAN
Pengesahan Skripsi Berjudul
EFEK HEPATOPROTEKTIF JUS BUAH PEPAYA (Carica papaya L.) PADA TIKUS JANTAN TERINDUKSI
iv
HALAMAN PERSEMBAHAN
“K e be rha sila n m e rupa k a n se sua t u ya ng
t ida k m uda h, da n m e m but uhk a n sua t u
pe rjua nga n. Ora ng ya ng be rusa ha t e rus
k e t ik a ga ga l buk a nla h ora ng ya ng ga ga l,
t e t a pi ora ng ya ng be rhe nt i be rusa ha
k e t ik a ia ga ga l a da la h ora ng ya ng ga ga l.”
(U nna m e d)
KARYA KECIL INI KUPERSEMBAHKAN UNTUK :
TUHAN YESUS KRISTUS SUMBER PENGHARAPANKU
PAPI DAN MAMIKU
v
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH
UNTUK KEPENTINGAN AKADEMIS
vi
PRAKATA
Penulis memanjatkan puji dan syukur ke hadirat Tuhan Yang Maha Esa oleh karena berkat dan rahmat-Nya, penulis dapat menyelesaikan skripsi dengan judul “Efek Hepatoprotektif Jus Buah Pepaya (Carica papaya L.) pada Tikus Jantan Terinduksi Parasetamol” ini dengan baik.
Skripsi ini disusun untuk memenuhi salah satu syarat untuk memperoleh gelar Sarjana Farmasi (S. Farm.) Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
Penyelesaian skripsi ini tentunya tidak lepas dari bantuan dari berbagai pihak, baik secara langsung maupun secara tidak langsung. Oleh karena itu, penulis hendak mengucapkan terima kasih kepada :
1. Dekan Fakultas Farmasi Fakultas Farmasi Universitas Sanata Dharma Yogyakarta
2. Yosef Wijoyo, M.Si., Apt, selaku pembimbing utama skripsi ini atas segala kesabaran untuk selalu mendukung, memotivasi, membimbing, dan memberi masukan kepada penulis dalam menyusun skripsi ini
3. Phebe Hendra, M.Si., Ph.D., Apt. selaku Wakil Dekan Fakultas Farmasi Universitas Sanata Dharma dan penguji skripsi atas bantuan, masukkan dan perhatian kepada penulis demi kemajuan skripsi ini.
4. Ipang Djunarko, M.Sc., Apt. selaku penguji skripsi atas bantuan, masukkan dan perhatian kepada penulis demi kemajuan skripsi ini.
vii
6. Bapak Yohanes Dwiatmaka, M.Si., selaku pimpinan laboratorium Farmasi yang telah memberikan ijin penggunaan semua fasilitas laboratorium guna penelitian skripsi ini.
7. Bapak dr. Yunadir yang telah membantu membuat preparat histologi dan memberikan tips-tips dalam pengambilan dan pemotongan organ, membuatkan preparat dengan cepat dan baik.
8. Bapak dr. Hadi Irawiraman M. Kes., Sp. P. A. selaku pembimbing yang telah membantu meneliti organ hasil penelitian ini dengan penuh kesabaran dan perhatiannya.
9. Mas Parjiman, Mas Heru, Mas Kayat, Mas Yuwono, dan semua staf laboratorium Farmasi yang telah bersedia membantu dan menemani selama penelitian berlangsung, atas segala bantuan dan dinamika selama di laboratorium.
10.Papi dan Mami, atas dukungan, kasih sayang, dan doa yang terbaiki sehingga penulis tetap bersemangat dalam penyusunan skripsi ini.
11.Dita Maria Virginia atas segala doa, dukungan, semangat, motivasi, perhatian, kasih sayang dan waktunya.
12.Rekan-rekan penelitian, Dewi, Tanti, Ricky, Jeffry, dan Gun atas bantuan, kerjasama, perjuangan, dan suka duka yang dialami selama penelitian.
13.Ngapak Team, Anton, Aan, Jimmy, Yoki, Pungki, Jati, Jeffry, Yacob dan Yosef atas kebersamaan, semangat, dan keceriaannya.
viii
15.Teman-teman UKF Basket Farmasi atas dukungan dan kebersamaan selama ini.
16.Pihak-Pihak lain yang turut membantu penulis namun tidak dapat disebutkan satu persatu..
Penulis menyadari bahwa setiap manusia tidak ada yang sempurna termasuk penulis. Oleh karena itu, penulis mengharapkan adanya kritik, saran dan masukan demi kemajuan di masa yang akan datang. Penulis juga berharap bahwa tulisan ini dapat memberikan sumbangan kecil bagi perkembangan ilmu pengetahuan serta masyarakat.
ix
PERNYATAAN KEASLIAN KARYA
Saya menyatakan dengan sesungguhnya bahwa skripsi yang saya tulis ini tidak memuat karya atau bagian karya orang lain, kecuali yang telah disebutkan dalam kutipan dan daftar pustaka, sebagaimana layaknya karya ilmiah.
x
INTISARI
Telah dilakukan penelitian tentang efek hepatoprotektif jus buah pepaya pada tikus jantan terinduksi parasetamol dengan tujuan memperoleh bukti ilmiah efek hepatoprotektif jus buah pepaya (Carica papaya L.) dan besarnya efek hepatoprotektif dari masing-masing dosisnya.
Penelitian ini termasuk penelitian eksperimental murni yang dikerjakan mengikuti rancangan acak lengkap pola satu arah. Tiga puluh ekor tikus jantan dibagi secara acak dalam 6 kelompok dengan jumlah yang sama. Kelompok I diberi CMC Na 0,7% 0,15 g/kgBB. Kelompok II diberi suspensi paracetamol 0,9500 g/kgBB. Kelompok III-IV diberi jus buah pepaya dosis 10,65; 13,28; 16,56; dan 20,65 g/kgBB selama 6 hari secara peroral dan pada hari ke-7 diberi suspensi parasetamol dosis 0,9500 g/kgBB secara intraperitonial. Kemudian setelah 18 jam tikus diambil darahnya lewat sinus orbitalis mata untuk ditetapkan aktivitas GPT-serum. Kemudian tikus dikorbankan dan hatinya diambil untuk pembuatan preparat histologi, kemudian diberi skor menurut derajat kerusakannya. Data yang diperoleh kemudian digunakan untuk mencari persentase efek hepatoprotektif dan angka proteksinya. Distribusi data dianalisis dengan uji Saphiro-Wilk, dilanjutkan dengan uji ANOVA satu arah yang dilanjutkan dengan uji Scheffe, dan uji Kruskal-Wallis yang dilanjutkan dengan uji Mann-Whitney dengan taraf kepercayaan 95%.
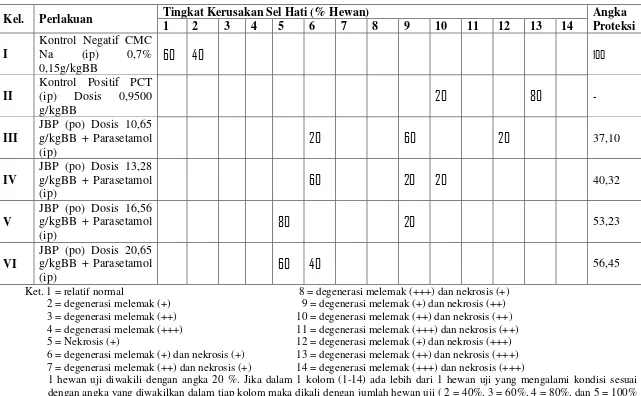
Hasil penelitian menunjukkan bahwa jus buah pepaya memiliki efek hepatoprotektif. Efek hepatoprotektif jus buah pepaya dosis 10,65; 13,28; 16,56; dan 20,65 g/kgBB secara berturut-turut adalah 9,07%, 71,54%, 78,35% dan 75,40% dan angka proteksinya secara berturut-turut adalah 37,10%; 40,32%; 53,23%; dan 56,45%.
xi
ABSTRACT
An experimental research on the hepatoprotective effect of papaya (Carica papaya L.) juice has been conducted on male rat induced by acetaminophen to get scientific evidence and the power of their respective dose.
This research was a pure experimental study of completely randomized one-way pattern design. Thirty male rats were randomly divided into 6 groups with the same amount. Group I was given 0,7% CMC Na 0,15 g/kgBW. Group II was given paracetamol suspension of 0,9500 g/kgBW. Group III-IV were given doses of papaya juice 10,65; 13,28; 16,56; and 20,65 g/kgBW for 6 days in peroral and on day 7 were given a dose of paracetamol suspension of 0,9500 g/kgBW in intraperitoneally. Then after 18 hours of rat blood drawn through the eye orbital sinus for serum GPT-determined activity. Then the rats were sacrificed and hearts were taken for making preparations for histology, then given a score according to the degree of damage. Distribution data were analyzed with Shapiro-Wilk test, followed by a one-way ANOVA followed by Scheffe test, and Kruskal-Wallis test followed by Mann-Whitney test with 95% confidence level..
The results showed that the papaya juice has a hepatoprotective effect. Hepatoprotective effects of papaya juice doses of 10,65; 13,28; 16,56; and 20,65 g/kgBB respectively are 9,07%, 71,54%, 78,35% and 75,40% and protection rates respectively are 37,10%, 40,32%, 53,23%, and 56,45%.
Key words: hepatoprotective effect, protection rates, papaya juice, Carica papaya
xii
DAFTAR ISI
HALAMAN JUDUL………... i
HALAMAN PERSETUJUAN PEMBIMBING………. ii
HALAMAN PENGESAHAN………... iii
HALAMAN PERSEMBAHAN……….. iv
PERNYATAAN PERSETUJUAN PUBLIKASI ... v
PRAKATA……….... vi
PERNYATAAN KEASLIAN KARYA………. ix
INTISARI………... x
ABSTRACT………... xi
DAFTAR ISI………... xii
DAFTAR TABEL………... xvi
DAFTAR GAMBAR... xx
DAFTAR LAMPIRAN………... xxii
BAB I. PENGANTAR………... 1
A. Latar Belakang………..……….... 1
1. Perumusan masalah...………...……….... 4
2. Keaslian penelitian………...…… 4
3. Manfaat penelitian………..…. 5
B. Tujuan Penelitian... 5
BAB II. PENELAHAAN PUSTAKA... 6
A. Tanaman Pepaya ... 6
xiii
2. Morfologi tanaman... 6
3. Nama daerah………... 7
4. Kandungan kimia……….. 7
5. Kegunaan ... 8
B. Vitamin C... 8
C. Vitamin E... 10
D. Karetenoid... 12
E. Anatomi dan Fisiologi Hati... 13
F. Patofisiologis Hepatitis... 16
1. Perlemakan hati……….. 18
2. Nekrosis hati………... 19
3. Kolestasis……… 21
4. Sirosis……….. 22
G. Terapi Hepatitis dan Hepatotoksin... 22
H. Parasetamol………... 24
I. Metode Uji Hepatotoksisitas…... 30
J. Landasan Teori... 32
K. Hipotesis ... 34
BAB III. METODE PENELITIAN... 35
A. Jenis dan Rancangan Penelitian... 35
B. Variabel Penelitian... 35
1. Variabel utama……….. 35
xiv
3. Variabel pengacau tak terkendali……… 36
C. Subyek dan Bahan Penelitian... 36
D. Alat Penelitian……... 37
E. Tata Cara Penelitian ... 38
1. Penetapan konsentrasi jus buah pepaya Bangkok dan dosis maksimal- nya………... 38
2. Penetapan dosis jus buah pepaya………. 39
3. Uji Pendahuluan……….. 39
a. Orientasi konsentrasi CMC Na sebagai pensuspensi parasetamol….. 39
b. Penetapan dosis hepatotoksik parasetamol………. 40
c. Penetapan waktu kehepatotoksikan parasetamol mencapai maksimal 41 d. Penetapan lama praperlakuan jus buah pepaya……… 42
4. Pengelompokan dan perlakuan hewan uji……… 43
5. Pembuatan serum………. 44
6. Penetapan aktivitas GPT-serum………... 44
7. Pembuatan preparat histology sel hati……….. 45
8. Pemeriksaan preparat histology sel hati……… 45
F. Analisis Hasil……….. 46
BAB IV . HASIL DAN PEMBAHASAN ... 47
A. Uji Pendahuluan………... 47
1. Penentuan dosis hepatotoksik………. 47
xv
4. Penetapan dosis jus buah pepaya………. 52
B. Perbandingan Aktivitas GPT-serum tiap Kelompok... 53
1. Kontrol negatif CMC Na 0,7% 0,15 g/kgBB……….. 53
2. Kontrol positif parasetamol 0,9500 g/kgBB……… 54
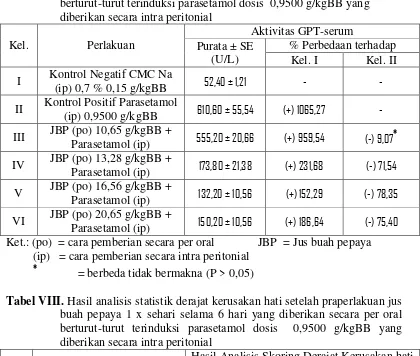
3. Efek hepatoprotektif jus buah pepaya dosis 10,65; 13,28; 16,56 dan 20,65 g/kgBB pada tikus jantan terinduksi parasetamol……… 60
C. Rangkuman Pembahasan... 72
BAB V. KESIMPULAN DAN SARAN... 74
A. Kesimpulan... 74
B. Saran... 74
DAFTAR PUSTAKA... 76
LAMPIRAN... 82
xvi
DAFTAR TABEL
Tabel I. Prosedur penetapan aktivitas GPT-serum ... 45 Tabel II. Aktivitas GPT-serum tikus pada selang waktu 24 jam setelah
pemberian parasetamol secara intra peritonial dengan dosis 0,750; 0,8255; 0,9086; 0,9500; 1,000 g/kgBB ... 47 Tabel III. Hasil analisis statistik aktivitas GPT-serum untuk menilai perbedaan
tiap 2 dosis... 48 Tabel IV. Derajat kerusakan sel hati tikus pada selang waktu 24 jam setelah
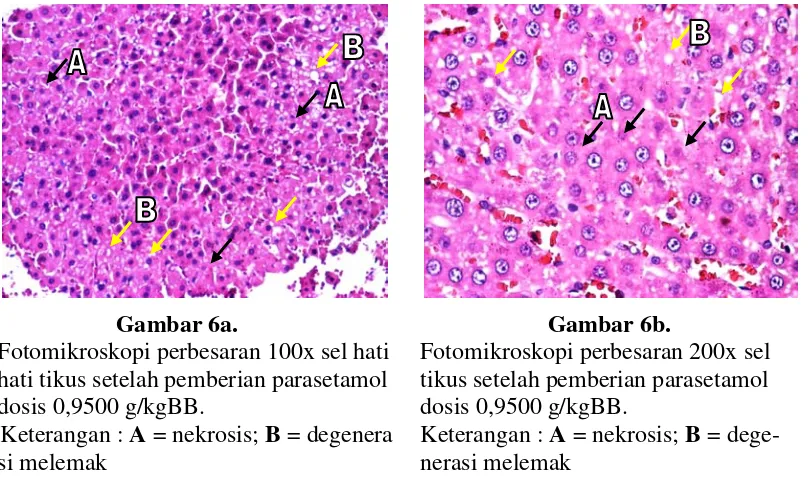
pemberian parasetamol secara intra peritonial dengan dosis 0,7500; 0,8255; 0,9086; 0,9500 dan 0,1000 g/kgBB ... 48 Tabel V. Aktivitas GPT-serum dan derajat kerusakan sel hati tikus setelah
pemberian parasetamol secara intra peritonial dengan dosis 0,9500 g/kgBB pada selang waktu 6, 12, 15, 18, 24 jam ………... 50 Tabel VI. Derajat kerusakan sel hati tikus setelah pemberian parasetamol
secara intra peritonial dengan dosis 0,9500 g/kgBB pada selang waktu 12 jam dan 18 jam ... 50 Tabel VII. Purata ± SE aktivitas GPT-serum tikus jantan setelah praperlakuan
xvii
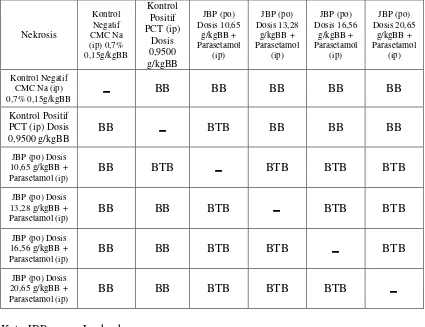
Tabel VIII. Hasil analisis statistik derajat kerusakan hati setelah praperlakuan jus buah pepaya 1 x sehari selama 6 hari yang diberikan secara per oral berturut-turut terinduksi parasetamol dosis 0,9500 g/kgBB yang diberikan secara intra peritonial……… 56 Tabel IX. Hasil uji statistik tingkat kerusakan hati berupa degenerasi melemak
pada tikus jantan setelah praperlakuan jus buah pepaya 1 x sehari selama 6 hari yang diberikan secara per oral berturut-turut terinduksi parasetamol dosis 0,9500 g/kgBB yang diberikan secara intra
peritonial……….. 57
Tabel X. Hasil uji statistik tingkat kerusakan hati berupa nekrosis pada tikus jantan setelah praperlakuan jus buah pepaya 1 x sehari selama 6 hari yang diberikan secara per oral berturut-turut terinduksi parasetamol dosis 0,9500 g/kgBB yang diberikan secara intra peritonial…... 58
Tabel XI. Pengaruh praperlakuan jus buah pepaya 1x sehari selama 6 hari berturut-turut terhadap histopatologi sel hati tikus terinduksi
parasetamol 0,9500 g/kgBB………. 59
Tabel XII. Data aktivitas GPT-serum pada sebelum (pre) dan sesudah (post) pemberian parasetamol dosis 0,7500 g/kgBB………... 92
xviii
Tabel XIV. Data aktivitas GPT-serum pada sebelum (pre) dan sesudah (post) pemberian parasetamol dosis 0,9086 g/kgBB………... 95
Tabel XV. Data aktivitas GPT-serum pada sebelum (pre) dan sesudah (post) pemberian parasetamol dosis 0,9500 g/kgBB ………. 96
Tabel XVI. Data aktivitas GPT-serum pada sebelum (pre) dan sesudah (post) pemberian parasetamol dosis 1,0000 g/kgBB ………. 98
Tabel XVII. Data aktivitas GPT-serum pada sebelum (pre) dan sesudah (post) pemberian parasetamol dosis 0,9500 g/kgBB ………. 108
Tabel XVIII. Data aktivitas GPT-serum pada pra perlakuan jus buah pepaya sebelum (pre) dan sesudah (post) pemberian parasetamol dosis
0,9500 g/kgBB ………. 120
Tabel XIX. Data skoring derajat kerusakan hati pada uji pendahuluan orientasi dosis hepatotoksik parasetamol ………... 128
Tabel XX. Data skoring derajat kerusakan hati pada uji pendahuluan orientasi waktu pengambilan cuplikan darah setelah pemberian parasetamol
dosis hepatotoksik ………... 144
xix
xx
DAFTAR GAMBAR
Gambar 1. Struktur dasar hati... ... 16
Gambar 2. Perlemakan hati makrovaskuler ... 18
Gambar 3. Tipe nekrosis... 20
Gambar 4. Struktur parasetamol... 24
Gambar 5. Rangkuman sistem perubahan hayati parasetamol dan aneka kemungkinan mekanisme kehepatotoksikan ... 29
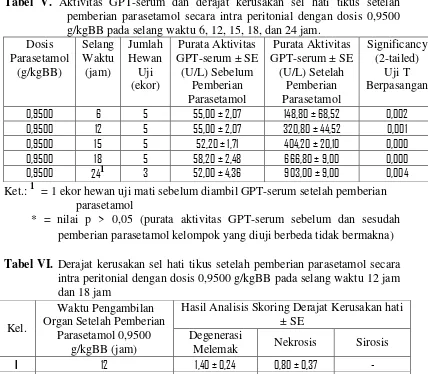
Gambar 6. Fotomikroskopi sel hati tikus jantan terinduksi parasetamol dosis 0,9500 g/kgBB... 55
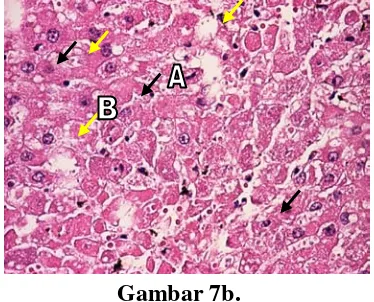
Gambar 7. Fotomikroskopi sel hati tikus jantan setelah praperlakuan jus buah pepaya dosis 10,65 g/kgBB terinduksi parasetamol dosis 0,9500 g/kgBB... 62
Gambar 8. Fotomikroskopi sel hati tikus jantan setelah praperlakuan jus buah pepaya dosis 13,28 g/kgBB terinduksi parasetamol dosis 0,9500 g/kgBB... 63
Gambar 9. Fotomikroskopi sel hati tikus jantan setelah praperlakuan jus buah pepaya dosis 16,56 g/kgBB terinduksi parasetamol dosis 0,9500 g/kgBB... 65
xxi
Gambar 11. Kemungkinan mekanisme reaksi penangkapan radikal bebas oleh vitamin E (tokoferol)... 69 Gambar 12. Kemungkinan mekanisme reaksi penangkapan radikal bebas oleh
β - karoten... 70 Gambar 13. Kemungkinan mekanisme reaksi penangkapan radikal bebas oleh
xxii
DAFTAR LAMPIRAN
Lampiran 1. Foto Buah Pepaya (Carica papaya L.)... 82 Lampiran 2. Foto Jus Buah Pepaya (Carica papaya L.)………. 82 Lampiran 3. Foto Penyuntikan Tikus……... 83 Lampiran 4. Foto Pengambilan Organ Hati…………... 83 Lampiran 5. Surat Keterangan Determinasi Tanaman Pepaya ... 84 Lampiran 6. Hasil Pemeriksaan Histopatologis………... 85 Lampiran 7. Data aktivitas gpt-serum dan hasil analisis statistik uji
pendahuluan penentuan dosis hepatotoksik parasetamol... 92 Lampiran 8. Data aktivitas gpt-serum dan hasil analisis statistik uji
pendahuluan penentuan waktu pengambilan cuplikan darah setelah pemberian parasetamol dosis toksik (0,9500 g/kgBB)…... 108 Lampiran 9. Data aktivitas gpt-serum dan hasil analisis statistik pra perlakuan
jus buah pepaya (Carica papaya L.) pada tikus terinduksi parasetamol... 120 Lampiran 10. Data dan hasil analisis statistik skoring derajat kerusakan hati
pada uji pendahuluan orientasi dosis hepatotoksik parasetamol... 128 Lampiran 11. Data dan hasil analisis statistik skoring derajat kerusakan hati
pada uji pendahuluan orientasi waktu pengambilan cuplikan darah setelah pemberian parasetamol dosis toksik (0,9500
xxiii
1
BAB I
PENGANTAR
A. Latar Belakang
Hati merupakan organ terbesar dan secara metabolisme paling kompleks di dalam tubuh (Lu, 1995). Fungsi hati sangat penting terutama dalam melaksanakan fungsi vital tubuh dan merupakan organ kunci regulasi homeostasis dalam tubuh (Ward dan Daly, 2000). Menurut Husadha (1996) fungsi hati dibagi atas empat macam : (1) fungsi pembentukan dan eksresi empedu, (2) fungsi metabolik, (3) fungsi pertahanan tubuh dan (4) fungsi vaskuler hati. Sedangkan fungsi utamanya adalah pembentukan dan ekskresi empedu (Price dan Wilson, 1984). Hati memegang peranan penting dalam proses metabolisme tiga bahan makanan utama yaitu karbohidrat, protein dan lemak. Selain itu hati juga memproduksi energi dan tenaga (Husadha, 1996). Contohnya, semua protein plasma kecuali gama globulin disintesis oleh hati. Detoksifikasi dan inaktivasi obat atau senyawa beracun lainnya dilakukan oleh hati. Dapat dikatakan bahwa hati mempunyai fungsi pertahanan dan perlindungan bagi tubuh (Price dan Wilson, 1994).
Menurut Cadman (cit., Ladoangin, 2004) penelitian yang dilakukan pada tahun 1960-1970 memberikan gambaran bahwa obat atau toksikan menyebabkan kira-kira 10% dari seluruh kasus hepatitis atau kira-kira 20-30% dari kasus penyakit hati akut. Hepatitis merupakan manifestasi klinis dari kerusakan hati berupa peradangan pada hati (Jungueira dan Carneiro, 1980). Hepatitis dibagi menjadi dua yaitu hepatitis akut dan kronik. Hepatitis akut merupakan proses inflamasi yang dapat menyebabkan nekrosis sel hati. Hepatitis jenis ini dapat disebabkan oleh adanya suatu infeksi virus, pemberian hepatotoksin atau zat yang mempunyai efek toksik pada hati dengan dosis berlebihan atau dalam jangka waktu lama (Zimmerman, 1978). Sedangkan hepatitis kronik merupakan kelainan hati yang memperlihatkan proses peradangan dan nekrosis. Parasetamol merupakan salah satu obat yang dapat menimbulkan kerusakan hati dan terbukti dapat menyebabkan nekrosis sentrolubuler baik pada hewan uji maupun pada manusia (Donatus, 1992). Dengan demikian, parasetamol dapat dipilih sebagai senyawa model hepatotoksik dalam penelitian ini.
preventif meliputi pencegahan komplikasi, pencegahan kekambuhan, dan perlindungan hati dari aneka hepatotoksin. Aspek suportif meliputi pengelolaan menu makanan, pemasokan sumber energi, pembangkit energi, dan pengelolaan keaktifan fisik. Idealnya, obat hepatitis mampu memperlihatkan semua sifat kuratif, preventif, dan suportif tersebut (Donatus,1992 cit., Linawati dkk, 2006).
Kerusakan hati dapat dicegah dengan mengkonsumsi buah buahan yang mengandung β-karoten, likopen, vitamin C dan vitamin E sebagai antioksidan. Senyawa antioksidan ini dapat mencegah kerusakan hati dengan cara menyumbangkan elektron kepada radikal bebas yang merupakan salah satu penyebab penyakit kanker hati.
Berdasarkan uraian di atas, maka peneliti tertarik untuk melakukan penelitian mengenai efek hepatoprotektif pada jus buah pepaya. Untuk menguji efek hepatoprotektif digunakan metode induksi menggunakan senyawa parasetamol sebagai senyawa hepatotoksik yang dapat menginduksi terjadinya kanker hati pada tikus jantan sebagai hewan uji dalam penelitian ini.
1. Perumusan masalah
Permasalahan yang akan diteliti adalah :
a. Apakah jus buah pepaya (Carica papaya L.) memiliki efek hepatoprotektif ? b. Seberapa besar efek hepatoprotektif dari jus buah pepaya (Carica papaya L.)
pada tiap dosis yang digunakan?
c. Seberapa besar angka proteksi dari jus buah pepaya (Carica papaya L.) pada tiap dosis yang digunakan?
2. Keaslian penelitian
3. Manfaat penelitian
a. Manfaat teoritis
Melengkapi informasi yang sudah ada tentang khasiat tanaman obat terutama buah pepaya (Carica papaya L.) yang bermanfaat bagi pengembangan ilmu kefarmasian.
b. Manfaat praktis
Penelitian ini diharapkan dapat memberikan informasi ilmiah dan kebenaran kepada masyarakat mengenai efek hepatoprotektif buah papaya (Carica papaya L.).
B. Tujuan Penelitian
Tujuan penelitian yang hendak dicapai adalah : 1. Tujuan umum
Penelitian ini bertujuan memberikan informasi tentang khasiat tanaman obat terutama buah papaya (Carica papaya L.).
2. Tujuan khusus
a. Penelitian ini bertujuan untuk membuktikan apakah jus buah pepaya (Carica papaya L.) mempunyai efek hepatoprotektif pada tikus jantan terinduksi parasetamol.
6
BAB II
PENELAAHAN PUSTAKA
A. Tanaman Pepaya
1. Sistematika tanaman pepaya
Dalam sistematika tumbuhan, tanaman pepaya (Carica papaya L.) diklasifikasikan sebagai berikut :
Kingdom : Plantae (tumbuh-tumbuhan) Divisio : Spermatophyta (tumbuhan berbiji) Subdivisio : Angiospermae (berbiji tertutup) Class : Dicotyledonae (biji keping dua) Ordo : Caricales
Familia : Caricaceae Genus : Carica
Species : Carica papaya L. (Warisno, 2003).
2. Morfologi tanaman
berwarna kekuningan. Buah pepaya memiliki eksokarp (kulit) yang halus dan tebal, mesokarp yang berdaging, dan dapat bentuk globose, ovoid, obovoid, dan
pyriform, panjangnya 7 – 35 cm, dan dengan bobot 0,25 – 10 kg (Ronse dan Smets, 1999).
3. Nama daerah
Pepaya disebut juga gedang (Sunda), kates (Jawa), peute, betik, ralempaya, punti kayu (Sumatra), pisang malaka, bandas, manjan (Kalimantan), kalujawa (Kalimantan) serta kapalaya kaliki dan uti jawa (Sulawesi). Selain nama daerah pepaya juga mempunyai nama asing yaitu : papaw tree, papaya, papayer,
melonenbaum, fan mu gua (Muhlisah, 2001).
4. Kandungan kimia
5. Kegunaan
Akar pepaya berguna untuk obat cacing, peluruh air seni, penguat lambung, perangsang kulit. Biji pepaya berguna untuk obat cacing, peluruh haid. Buah pepaya berguna memacu enzim pencernaan, serta daunnya berguna sebagai penambah nafsu makan dan peluruh haid. Selain itu berguna pula untuk menurunkan panas. Buah pepaya matang dikonsumsi dalam keadaan segar atau sebagai pencuci mulut (Muhlisah, 2001).
Daun pepaya berguna untuk obat panas yang memiliki khasiat menurunkan panas, obat malaria, menambah nafsu makan, meluruhkan haid dan menghilangkan sakit. Juga berguna untuk penyembuhan luka bakar. Selain itu dapat sebagai obat cacing kremi, desentri amoba, kaki gajah, perut mulas, kanker dan masuk angin (Wijayakusuma, Dalimartha, Wirian, Yaputra, dan Wibowo, 1994).
B. Vitamin C
Vitamin C atau L-asam askorbat merupakan antioksidan yang larut dalam air (aqueous antioxidant). Senyawa ini menurut Zakaria (1996) merupakan bagian dari sistem pertahanan tubuh terhadap senyawa oksigen reaktif dalam plasma dan sel. Dalam keadaan murni, vitamin C berbentuk kristal putih dengan berat molekul 176,13 dan rumus molekul C6H6O6. Vitamin C juga mudah teroksidasi
10-50 kali lebih besar dibandingkan dengan yang ada di dalam plasma (Winarsi, 2007).
Sebagai antioksidan, vitamin C bekerja sebagai donor elektron dengan cara memindahkan satu elektron ke senyawa logam Cu. Selain itu, vitamin C juga dapat menyumbangkan elektron ke dalam reaksi biokimia intraseluler dan ekstraseluler. Vitamin C mampu menghilangkan senyawa oksigen reaktif di dalam sel netrofil, monosit, protein lensa dan retina. Vitamin ini juga dapat berinteraksi dengan Fe-ferritin. Di luar sel, vitamin C mampu menghilangkan senyawa oksigen reaktif, mencegah terjadinya LDL teroksidasi, mentransfer elektron ke dalam tokoferol teroksidasi dan mengabsorbsi logam dalam saluran pencernaan (Levine dkk., 1995).
Vitamin C dapat menstimulasi kemotaksis dan respon proliferasi netrofil, serta melindungi sel dari serangan radikal bebas yang diproduksi oleh netrofil teroksidasi. Vitamin C mampu mereduksi radikal superoksida, hidroksil, asam hipoklorida dan oksigen reaktif yang berasal dari netrofil dan monosit yang teraktivasi. Reaksi askorbat dengan superoksida secara fisiologis mirip dengan kinerja enzim superoksida dismutase (SOD) sebagai berikut
2O2- + 2H+ + askorbat 2H2O2
(Winarsi, 2007) + dehidroaskorbat
Sedangkan reaksinya dengan hidrogen peroksida dikatalis oleh enzim askorbat peroksidase (Asada, 1992).
2H2O2 + askorbat 2H2
Pada umumnya, penggunaan vitamin C sebagai antioksidan berkombinasi dengan sumber antioksidan lain seperti vitamin E. Vitamin C bekerja sinergis dengan vitamin E. Vitamin E yang teroksidasi oleh radikal bebas dapat bereaksi dengan vitamin C kemudian akan berubah menjadi tokoferol setelah mendapat ion hidrogen dari vitamin C
Tokoferoksil radikal + askorbat tokoferol + monodehidroaskorbat (Belleville-Nabet, 1996) Monodehidroaskorbat secara spontan dapat mengalami dismutasi sebagai berikut.
2 Monodehidroaskorbat askorbat + dehidroaskorbat
Jika tidak, direduksi kembali menjadi askorbat oleh NADPH monodehidroaskorbat reduktase sebagai berikut.
Monodehidroaskorbat + NAD(P)H askorbat +NAD(P)
(Winarsi, 2007)
C. Vitamin E
Vitamin E adalah salah satu fitonutrien penting dalam minyak makan. Vitamin E merupakan vitamin yang larut dalam lemak yang terdiri dari campuran dan substansi tokoferol (α, β, γ dan δ) dan tokotrienol (α, β, γ dan δ). Menurut
Ascherio, Stampfer, Colditz, Rimm, Litin, dan Willet (1992), α-tokoferol merupakan bentuk suplemen vitamin E yang paling banyak. Vitamin ini banyak terdapat dalam membran eritrosit dan lipoprotein plasma (Winarsi, 2007).
tokoferol yang kurang reaktif, sehingga tidak mampu merusak rantai asam lemak (Winarsi, 2007).
Reaksi awal dari peroksidasi unsaturated fatty acid disebabkan serangan dari beberapa spesies radikal (seperti radikal hidroksil), yang memiliki reaktivitas yang cukup untuk menarik atom H dari karbon metilen rantai samping
unsaturated fatty acid, membentuk radikal lipid (L•) (1). Dengan keberadaan O2
HO•+ H → H2O + L•
(1)
, radikal lipid yang dihasilkan kemudian dapat bereaksi membentuk radikal peroksil lipid (LOO•) (2).
L•+ O2 → LOO• (2)
Radikal peroksil yang terbentuk sangat reaktif dan sangat mudah mengalami reaksi berantai. Radikal peroksil tersebut memerlukan tambahan atom H agar menjadi stabil. Atom H ini dapat diperoleh dari molekul asam lemak (LH) yang berada di dekatnya, yang kemudian akan terbentuk radikal lipid yang baru (L•) dan reaksi berantai selanjutnya akan terjadi (3).
LOO•+ α −T → LO2H + α −T• (4) Reaksi di atas menunjukkan aktivitas vitamin E (α-Tokoferol) terhadap radikal peroksil lipid (LOO•) (Pekimer, 2003).
Sedangkan radikal vitamin E diregenerasi oleh asam askorbat dengan reaksi sebagai berikut
Vit E-O• + Asam Askorbat Asam Askorbat• + Vitamin E-OH (Winarsi, 2007). Corwin dan Gordon (1982) melaporkan bahwa pemberian vitamin E pada tikus dapat meningkatkan sistem imun tubuh seperti terjadinya peningkatan respon limfosit terhadap mitogen.
D. Karotenoid
Karotenoid merupakan golongan pigmen yang larut lipid dan tersebar luas, terdapat dalam semua jenis tumbuhan. Pada tumbuhan, karotenoid mempunyai dua fungsi, yaitu sebagai pigmen pembantu dalam fotosintesis dan sebagai pewarna dalam bunga dan buah. Dalam bunga, karotenoid biasanya berwarna kuning, sedangkan dalam buah dapat juga berwarna jingga/merah (Harborne, 1987). Karotenoid tersusun atas β-karoten, likopen, lutein, zeaxanthin dan cryptoxanthin (Winarsi, 2007).
yaitu sebagai prekursor vitamin A dan antioksidan. Dilihat dari strukturnya, beta karoten mampu menangkal radikal bebas karena adanya ikatan rangkap konjugasi yang panjang. Beta karoten dilaporkan dapat menghambat oksidasi asam arakhidonat dan menurunkan aktivitas lipooksigenase (Lieber dan Leo, 1999).
Likopen merupakan kandungan karotenoid lain dalam buah pepaya. Likopen memiliki 40 karbon asiklik (C40H56) dengan 11 ikatan rangkap
terkonjugasi dan tidak mengandung cincin β-ionon dan sama sekali tidak memiliki aktivitas provitamin A. Secara kimia dan fisika, likopen mendegradasi karotenoid lain yang terpapar sinar, oksigen, suhu tinggi, pH ekstrem dan permukaan aktif (Crouzet dan Kanasawud, 1992). Menurut Tjandrawinata (2003), struktur molekul hidrokarbon likopen mempunyai banyak ikatan rangkap. Senyawa ini diketahui memiliki potensi antioksidan paling besar, dua kali lebih besar dibandingkan dengan β-karoten dan sepuluh kali lebih besar dibandingkan dengan vitamin E. Likopen dapat menetralisir reaksi oksidasi yang terjadi pada kolestrol LDL. Di samping itu data-data menunjukkan bahwa likopen juga dapat menurunkan derajat peroksidasi lipid serta melindungi membran sel dari serangan oksidan dan radikal bebas yang berasal dari NO2. Likopen juga dapat berinteraksi
dengan senyawa oksigen reaktif seperti H2O2 dan NO2 (Lu, Etoh, Watanabe, Ina,
Ukai, Oshima, Ojima, Sakamoto, dan Ishiguro, 1995)
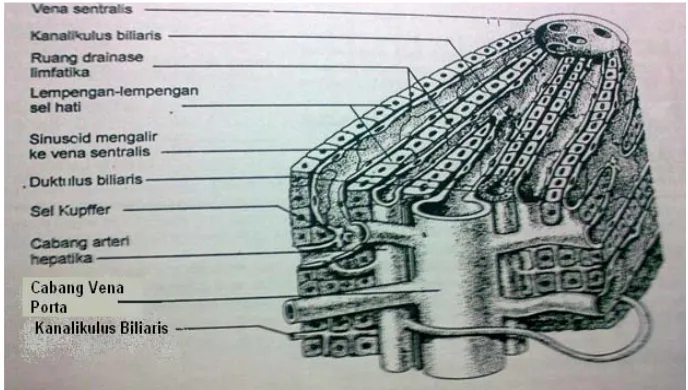
E. Anatomi dan Fisiologi Hati
dan merupakan kelenjar terbesar dalam tubuh , rata-rata sekitar 1500 g atau 2,5% berat badan pada orang normal (Price dan Wilson, 1994). Jika keadaan hati normal, maka permukaanya halus dan lunak (Chandrasoma dan Taylor, 1991). Hati memiliki dua sumber suplai darah, dari saluran cerna dan limpa melalui vena porta, dan dari aorta melalui arteria hepatika dan menerima 25% cardiac aoutput, kira-kira 1500 ml darah per menit (Price dan Wilson, 1994, Linggapa, 1995). Kedua pembuluh darah ini akan bertemu di hati, dan darah yang dbawa akan keluar melalui vena sentralis menuju vena hepatika dan akhirnya sampai di vena kava inferior (Linggapa, 1995).
hepatosit, berperan dalam sintesis kolagen dan merupakan tempat penyimpanan utama vitamin A dalam tubuh .
Gambar 1. Struktur dasar hati (Chandrasoma dan Taylor, 1991)
F. Patofisiologi Hepatitis
Hepatitis merupakan manifestasi klinis dari kerusakan hati berupa peradangan pada hati (Jungueira dan Carneiro, 1980). Secara popular dikenal juga dengan istilah penyakit hati, sakit liver atau sakit kuning (Dalimartha, 1999). Penyebabnya dapat berupa virus yaitu virus tipe A, tipe B, tipe non A, dan tipe non B. Sedangkan penyebab lain dapat berupa induksi senyawa kimia, kelainan proses fisiologis yang terjadi di dalam hati. Pada pemeriksaan klinik ditandai dengan penurunan pelepasan sekresi empedu atau produk sel-sel hati yang lain serta adanya pelepasan enzim-enzim tertentu dalam darah (Jungueira dan Carneiro, 1980).
Hepatitis dapat dibagi menjadi beberapa jenis, antara lain : 1. Hepatitis Akut
dengan dosis berlebihan atau dalam jangka waktu lama (Zimmerman, 1978). Hepatitis yang disebabkan oleh virus disebut sebagai hepatitis virus akut, Hepatitis virus akut adalah hepatitis yang disebabkan adanya suatu infeksi sistemik yang mempengaruhi hati. Agen virus yang telah diketahui yaitu : virus hepatitis A (HAV), virus hepatitis B (HBV), virus hepatitis C (HCV), virus hepatitis D (HDV) atau agen delta yang berhubungan dengan HBV dan virus hepatitis E (HEV) (Isselbacher, 1995).
2. Hepatitis Kronik
Hepatitis kronik merupakan kelainan hati yang memperlihatkan proses peradangan dan nekrosis. Hepatitis kronik merupakan suatu sindrom klinis dan patologis yang disebabkan oleh bermacam-macam etiologi. Sedangkan sirosis merupakan stadium akhir hepatitis kronik dan bersifat tidak terbalikkan yang ditandai oleh fibrosis yang luas dan menyeluruh pada jaringan hati disertai dengan pembentukan nodul. Hepatitis kronik pada pemeriksaan biokimiawi, menunjukkan adanya peningkatan kadar bilirubin, transaminase dan globulin serum (Abdurachman, 1996).
Menurut Zimmerman (1978), kerusakan hati akut dapat dibedakan menjadi tiga macam, yaitu :
a. sitotoksik (hepatoseluler) yang berhubungan dengan kerusakan parenkim sel hati, berupa steatosis (degenerasi melemak) dan atau nekrosis sel hati,
c. campuran, berupa kombinasi dari kedua macam kerusakan sitotoksisk dan kolestatik.
Sedangkan menurut Wenas (1996), perusakan hati dapat dibagi menjadi :
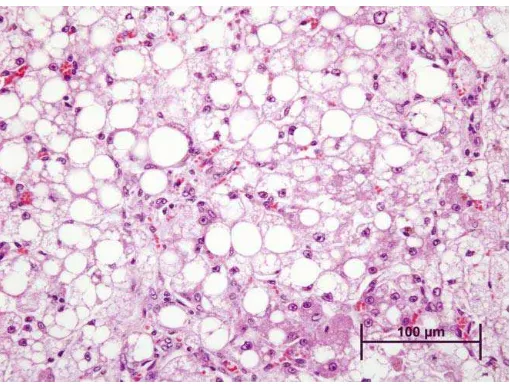
1. Perlemakan Hati
Perlemakan hati adalah keadaan dimana hati memiliki lemak melebihi 5% dari berat hati itu sendiri. Dalam keadaan normal hati memiliki lemak hanya 5% dari berat hati secara keseluruhan (Soemarto, 1996).
Gambar 2. Perlemakan hati makrovesikuler (Haschek, Wallig, dan Rousseaux, 2010)
Perlemakan hati dapat disebabkan oleh :
a. Alkohol atau biasa disebut perlemakan hati alkoholik (Alkoholic Fatty Liver (AFL)) biasanya berupa makrovesikuler.
b. Non alkohol atau biasa disebut perlemakan hati non alkoholik ( Non-Alkoholic Fatty Liver (NAFL)).
degenerasi melemak mikrovesikuler jika sel-sel hati terisi butiran-butiran lemak yang sangat kecil, yang tidak sampai mendesak inti sel. Sedangkan degenerasi melemak makrovesikuler jika seluruh sel hati terisi butiran-butiran lemak berukuran besar sehingga inti sel terdesak ke daerah perifer (Zimmerman, 1978).
2. Nekrosis Hati
Nekrosis hati merupakan kematian hepatosit. Perubahan morfologi awal berupa edema sitoplasma, dilatasi retikulum endoplasma, dan disagregasi polisom. Terjadi akumulasi trigliserida sebagai butiran lemak dalam sel (Soemarto, 1996).
Pada dasarnya nekrosis hati adalah rusaknya susunan enzim pada sel, dengan ciri adanya fragmen sel atau sel hati nekrotik tanpa pulasan inti atau tidak tampaknya sel disertai reaksi radang. Tampak atau tidak tampaknya sisa sel hati tergantung pada lama dan jenis nekrosis. Kelainan ini merupakan tingkat lanjut dari degenerasi dan tidak reversible. Malnutrisi, deplesi glikogen dan anoreksia menahun dapat merupakan predisposisi untuk nekrosis sel hati akobat hepatotoksin (Lu, 1995).
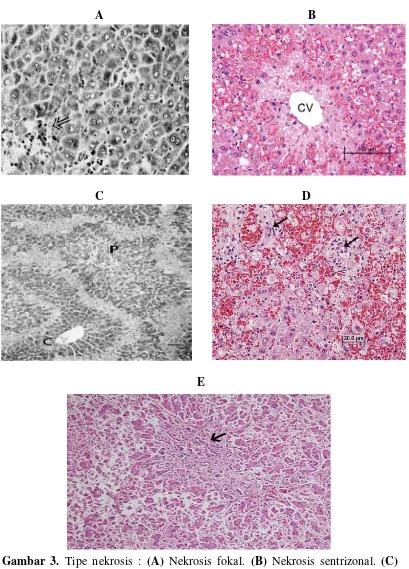
Perbedaan bentuk kematian sel hati (nekrosis) tergantung dari jenis penyakit hati (Chandrasoma, 1995). Chandrasoma (1995) membagi bentuk kematian sel hati menjadi :
pada hepatitis yang disebabkan oleh virus, kerusakan akibat toksin, dan infeksi oleh bakteri (Chandrasoma dan Taylor, 1991).
A B
C D
E
Gambar 3. Tipe nekrosis : (A) Nekrosis fokal. (B) Nekrosis sentrizonal. (C)
2. nekrosis zonal, merupakan kematian sel yang terjadi di daerah tertentu pada semua lobules hati. Jenis nekrosis zonal yaitu : nekrosis sentrizonal, nekrosis midzonal dan nekrosis zonal peripheral. Nekrosis sentrizonal kematian sel-sel termasuk sel-sel yang berada di sekeliling vena sentralis hepatika, terjadi pada hepatitis viral, keracunan karbon tetraklorida dan klorofom. Nekrosis midzonal terjadi pada penyakit kuning (yellow fever) dan jarang terjadi. Sedangkan nekrosis zonal peripheral terjadi kematian sel-sel hati yang terletak di sekeliling pembuluh porta, dan terjadi pada eklampsia dan keracunan fosfor Chandrasoma dan Taylor, 1991).
3. nekrosis submasif dan massif, merupakan kematian sel hati yang meluas melewati batas antara lobules, kadang menyebar antara area porta dan vena sentralis. Nekrosis massif umumnya ditandai dengan penurunan ukuran hati secara tiba-tiba, melunak, kuning dan lembek, dengan lapisan yang mengkerut. Nekrosis massif biasanya disebabkan oleh virus hepatitis dan jarang terjadi pada obat-obatan (seperti halotan, asetaminofen, isoniazid, metildopa) atau bahan kimia beracun (seperti jamur Amanita phalloides,
klorofom, dan karbon tetraklorida) (Chandrasoma dan Taylor, 1991).
3. Kolestasis
4. Sirosis
Sirosis hati merupakan penyakit hati yang ditandai dengan adanya pembentukan jaringan ikat diseertai nodul yang terbentuk dari kumpulan hepatosit. Sirosis biasanya dimulai dengan adanya proses peradangan, nekrosis sel hati yang luas, pembentukan jaringan ikat dan usaha regenerasi nodul (Tarigan, 1996). Kerusakan sirosis bersifat tak terbalikan (Treinen dan Moslen, 2001). Penyebab sirosis pada manusia biasanya disebabkan oleh konsumsi alkohol yang besar (Lu, 1995).
G. Terapi Hepatitis dan Hepatotoksin
Pada kasus penyakit hati tersedia pilihan sasaran terapi yaitu antara kuratif, preventif, suportif, atau menyeluruh. Terapi bersifat kuratif apabila terapi penyakit hati menunjukkan keaktifan antiradang dan perangsangan regenerasi sel. Bersifat preventif apabila terapi penyakit hati menunjukkan kemampuan mencegah atau melindungi sel hati terhadap serangan ulang virus atau senyawa endogen yang berpotensi sebagai hepatotoksin hakiki. Sedangkan terapi bersifat suportif apabila sifat terapi sebagai pemasok sumber energi atau lebih bersifat sebagai pendukung terapi utama, seperti kelaziman minum manis yang dianjurkan bagi penderita penyakit hati (Donatus, 1992).
demikian, diperlukan obat ideal penyakit hati yang bersifat komprehensif. Konsep obat tradisional mengarah pada penyembuhan yang komprehensif. Oleh karena itu, fitofarmaka mempunyai kemungkinan untuk berperan sebagai obat hepatitis (Donatus, 1992).
Hepatotoksin adalah zat yang mempunyai efek toksisk pada hati dengan dosis berlebih atau diberikan dalam jangka waktu lama sehingga dapat menimbulkan kerusakan hepar akut, subkronik, maupun kronik. Besar kemungkinan rusaknya hati oleh hepatotoksin muncul sebagai akibat konsekuensi logis peran utama hati dalam proses metabolism dan disposisi substansi asing (Zimmerman, 1978).
Zimmerman (1978) membagi klasifikasi hepatotoksin ke dalam dua golongan yang didasarkan pada mekanisme timbulnya penyakit hati, yaitu :
1. Hepatotoksin terramalkan
Ciri-ciri golongan hepatotoksin terramalkan adalah :
a. angka kejadian pada individu tinggi dan beberapa diantaranya menyebabkan luka pada ginjal dan organ lain
b. menghasilkan luka yang sama pada hewan percobaan
c. perkembangan dan tingkat kerusakan yang dihasilkan tergantung pada dosis yang diberikan
d. masa laten singkat dan konsisten 2. Hepatotoksin tak terramalkan
Merupakan golongan senyawa yang mempunyai sifat dasar tidak toksik, tetapi dapat menyebabkan penyakit hati pada individu yang hipersensitif terhadap senyawa tersebut yang diperantarai oleh mekanisme alergi (misalnya golongan sulfonamida dan halotan) atau karena keabnormalan metabolik menuju penumpukan metabolit toksik (misalnya iproniazid dan isoniazid) (Zimmerman, 1978; Donatus, 1992). Menurut Donatus (1992) kerusakan hati yang ditimbulkan oleh hepatotoksin golongan ini tidak dapat diprakirakan dan tak tergantung dosis. Golongan hepatotoksin tak teramalkan mempunyai cirri-ciri yang merupakan kebalikan dari senyawa hepatotoksin teramalkan (Zimmerman, 1978).
H. Parasetamol
Gambar 4. Struktur parasetamol (Anonim, 1979)
HO N C
H O
Parasetamol atau N-asetil-p-aminofenol merupakan derivat p-aminofenol yang berbentuk serbuk hablur putih, tidak berbau, dan rasanya pahit. Khasiatnya adalah sebagai analgetikum dan antipiretikum (Wilmana, 1995; Anonim, 1979). Parasetamol dapat terdistribusi ke dalam hampir seluruh jaringan dan cairan badan secara cepat dan luas (Wijoyo, 2001).
Parasetamol mengalami eleminasi terutama melalui proses bitransformasi di hati dan ekskresi melalui urin. Pada kisaran dosis terapi (0,5-1 g, 3-4 kali sehari) sebagian besar parasetamol terkonjugasi dengan asam glukoronat dan sulfat, sisanya oleh sistem sitokrom P-450 MFO hati, dioksidasi menjadi metabolit yang reaktif, N-asetil-para-benzokuinonimina (NAPBKI) (Grahame-Smith dan Aronson, 1992; Gibson dan Skett, 1991). Dalam keadaan normal, metabolit reaktif NAPBKI yang bersifat elektrofil tersebut secara prinsip dapat secara cepat dinonaktifkan melalui konjugasi dengan glutation (GSH) yang dikatalis oleh glutation S-tranferase (GST), misalnya GSTPi, menjadi produk yang lebih larut dalam air, konjugat sistein dan merkapturat (Henderson, Wolf, Kitteringham, Powel, Otto, dan Park, 2000; Waters, Wang, Redmond, Wu, Kay, dan Bouchier-Hayes, 2001).
Weisbrot-Lefkowitz, Reuhl, Chen, Yang, dan Inouye, 1999). Dengan kata lain jika kandungan GSH hati dapat dihabiskan atau paling tidak berkurang menjadi 20-30% harga normalnya, maka NAPBKI akan berikatan dengan makromolekul protein sel hati, mengawali mekanisme tingkat molekul ketoksikan sel (Wijoyo, 2001).
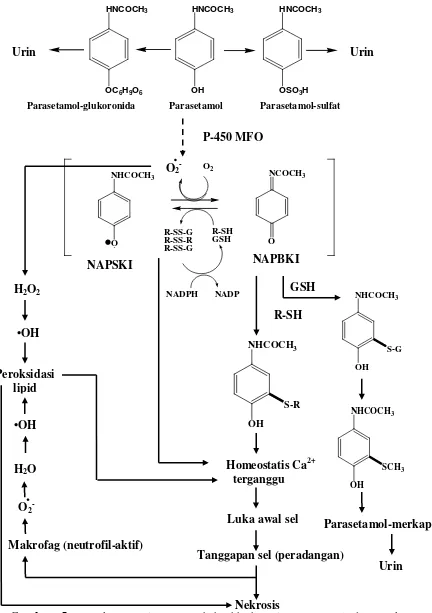
beberapa hipotesis mekanisme pembangkitan superoksida, yakni melalui jalur : (1) pembentukan radikal NAPSKI; (2) pembentukan radikal tiil; (3) tanggapan sel atas awal luka jaringan (Donatus, 1994).
Diduga radikal NAPSKI mampu memindahkan satu elektron ke molekul oksigen, menghasilkan anion superoksida dan NAPBKI (Rosen dkk, 1983 cit., Donatus, 1994). Superoksida kemudian dapat membangkitkan radikal hidroksil melalui reaksi Fenton atas bantuan ion besi. Lebih lanjut radikal hidroksil akan mengawali reaksi peroksidasi lipid (Younes dkk, 1986 cit., Donatus, 1994). Tetapi hipotesis ini mengandung kelemahan, ternyata sistem P-450 tidak mampu mengkatalis oksidasi satu elektron parasetamol menjadi radikal NAPSKI (van de Straat dkk, 1988 cit., Donatus, 1994). Selain itu karena potensial redoks NAPSKI relatif tinggi, reduksi oksigen menjadi superoksida sulit terjadi. Kemungkinan reaksi yang kedua adalah daur redoks. Karena itu Bisby dan Tobassum (cit., Donatus, 1994) mempostulatkan hipotesis alternatif yaitu oksidasi satu elektron tiol protein oleh NAPBKI akan menghasilkan suatu radikal tiil yang mampu mereduksi oksigen menjadi superoksida, lebih lanjut radikal hidroksil dan POL.
Hipotesis yang ketiga adalah tekanan oksidatif selular menuju gangguan homeostasis Ca2+ dalam sel. Mekanisme antaraksi nirkovalen ini berkaitan erat dengan oksidasi tiol protein dan status NADPH (Albano dkk, 1985 cit., Donatus, 1994). Peristiwa utamanya terjadi setelah kandungan glutation (GSH) –sitosol terkuras, sehingga memungkinkan perubahan kandungan tiol protein (karena arilasi atau oksidasi oleh toksin kimia) dan/atau status NADPH/ Nicotinamide adenine dinucleotide phosphate (NADP). Akibatnya homeostasis Ca2+ terganggu (Ca2+ sitosol naik), sehingga enzim degradatif (fosfolipase atau protease) aktif, lebih lanjut morfologi sitoskeletal hepatosit kacau (tersidik sebagai blebbing
membran plasma). Kenaikan Ca2+ mungkin juga mengaktifkan endonuklease, fragmentasi DNA yang ekstensif, gangguan fungsi mitokondria, dan akhirnya kematian sel (Orrenius dkk, 1989 cit., Donatus, 1994). Namun laporan Riley dkk (cit., Donatus, 1994) mungkin dapat menggagalkan hipotesis ini, karena kenaikan Ca2+ lebih mencerminkan fluoresensi produk peruraian NAPBKI daripada homeostasis Ca2+.
Peroksidasi lipid
GSH
terganggu
Luka awal sel
Tanggapan sel (peradangan)
NHCOCH3
Gambar 5. Rangkuman sistem perubahanhh hayati parasetamol dan aneka kemungkinan mekanisme kehepatotoksikan (Donatus, 1994)
P-450 MFO
NAPSKI NAPBKI
R-SH
Menurut Oldham dan Bowen (cit., Wijoyo, 2001) kehepatoksikan parasetamol dapat dicegah oleh senyawa antioksidan, seperti vitamin C, vitamin E, karotenoid, dan senyawa golongan flavonoid.
Berdasarkan penelusuran hipotesis mekanisme kesitotoksikan parasetamol (lihat gambar 5) maka pencegahan hepatotoksisitas parasetamol dapat dilakukan dengan dua kemungkinan : (1) penghambatan spesies oksigen reaktif, dan metabolit reaktif parasetamol (Wijoyo, 2001). (2) peningkatan proses penetralan metabolit reaktif parasetamol (Wijoyo, 2001). Menurut Oldham dan Bowen (cit., Wijoyo, 2001) penghambatan spesies oksigen reaktif dapat dilakukan dengan pemberian antioksidan, seperti vitamin C, vitamin E, karotenoid dan senyawa golongan flavonoid serta enzim antioksidan alamiah seperti superoksid dismutase (SOD) dan glutation peroksidase (GP) (Mirochnitche dkk, 1999).
I. Metode Uji Hepatotoksisitas
Kerusakan hati dapat dievaluasi dengan beberapa parameter, antara lain : (1) uji enzim serum; (2) pemeriksaan asam amino dan protein; (3) perubahan penyusun kimia dalam hati; (4) uji ekskretori hati; dan (5) analisis histologi (Zimmerman, 1978).
1. Uji enzim serum
hepatoseluler, terutama pada kasus hepatitis akut (Plaa dan Charbonneau, 2001). Transaminase terdiri dari glutamat piruvat transaminase (GPT) dan glutamat oksaloasetat transaminase (GOT). Sebagian besar GOT terdapat di hati dan otot rangka, serta tersebar ke seluruh jaringan. Meskipun enzim GPT terdapat pula pada beberapa bagian jaringan, konsentrasi terbesarnya pada semua spesies adalah di hati sehingga GPT merupakan petunjuk yang lebih spesifik terhadap nekrosis hati daripada GOT (Zimmerman, 1978; Plaa dan Charbonneau, 2001). Pada keadaan nekrosis, sel hati akan pecah sehingga enzim GPT yang terdapat di dalam sel hati keluar dan masuk ke dalam aliran darah. Peningkatannya bisa mencapai 10-100 kali lipat dari harga normal (Zimmerman, 1978).
2. Pemeriksaan asam amino dan protein
Menurut Zimmerman (1978) pemeriksaan asam amino dan protein penting dilakukan. Hal ini dikarenakan metabolisme asam amino di hati membentuk ammonia dan urem terjadi secara lebih lambat dan meningkatkan kadar globulin.
3. Perubahan penyusun kimia dalam hati
Pada kasus kerusakan hati, terjadi perubahan penyusun kimia di dalam hati. Salah satu contoh yaitu perubahan jumlah lemak di dalam hati terkait steatosis (Zimmerman, 1978).
4. Uji ekskretori hati
hati tersebut. Perubahan kecepatan metabolisme obat yang terjadi di hati dapat dijadikan parameter hepatotoksisitas (Zimmerman, 1978).
5. Analisis histologi hepatik
Sel hati yang mengalami kerusakan sitotoksik tampak berbeda dengan sel-sel hati normal. Perlemakan dalam sel hati terlihat sebagai ruang membulat yang tidak tercat hemaktosilin. Sel dari jaringan nekrotik seluruhnya berwarna kemerahan dan tidak mengambil warna hematoksilin eosin. Perubahan inti sel tersebut diantaranya disebabkan oleh pengumpulan kromatin dan pengerutan inti, sehingga inti tampak lebih kecil serta gelap (piknosis) atau pecahnya membran inti (karioreksis) sehingga inti sel yang berupa fragmen-fragmen kecil tumpah ke dalam sitoplasma. Menurut Wilson dan Lester (cit., Rambung, 2002) kemungkinan lainnya adalah kariolisis, yakni pelarutan kromatin secara enzimatis sehingga inti hanya terlihat sebagai ruangan kosong yang dikelilingi oleh membran inti.
J. Landasan Teori
Pada keadaan nekrosis, sel hati akan pecah sehingga enzim GPT yang terdapat di dalam sel hati keluar dan masuk ke dalam aliran darah. Peningkatannya bisa mencapai 10-100 kali lipat dari harga normal (Zimmerman, 1978).
maupun manusia (Waters dkk., 2001). Pada kisaran dosis terapi (0,5-1 g, 3-4 kali sehari) sebagian besar parasetamol terkonjugasi dengan asam glukoronat dan sulfat, sisanya oleh sistem sitokrom P-450 MFO hati, dioksidasi menjadi metabolit yang reaktif, N-asetil-para-benzokuinonimina (NAPBKI) (Grahame-Smith dan Aronson, 1992; Gibson dan Skett, 1991). Dalam keadaan normal, metabolit raeaktif NAPBKI tersebut secara prinsip dapat secara cepat dinonaktifkan melalui konjugasi dengan glutation (GSH) yang dikatalis oleh glutation S-tranferase (GST), misalnya GSTPi, menjadi produk yang lebih larut dalam air, konjugat sistein dan merkapturat (Henderson dkk., 2000; Waters dkk,2001). Pada pemberian dosis toksik, jalur glukoronidasi dan sulfatasi akan jenuh sehingga jumlah GSH hati yang terpakai lebih besar dari yang dibentuk ulang sehingga terjadi penumpukan metabolit reaktif NAPBKI (Katzung, 1989).
Metabolit reaktif NAPBKI dilaporkan dapat menimbulkan kerusakan hati melalui ikatan kovalen dengan makromolekul sel hati. Selain diperantarai oleh NAPBKI, kehepatoksikan parasetamol juga terjadi melalui jalur tekanan oksidatif. Melalui jalur tekanan oksidatif ini, kehepatotoksikan parasetamol diyakini diperantarai oleh adanya oksigen reaktif atau radikal bebas, seperti anion superoksida, hidrogen peroksida, dan radikal hidroksil (Wijoyo, 2001).
dugaan sementara bahwa jus buah pepaya dapat berkhasiat sebagai hepatoprotektor.
K. Hipotesis
35
BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini merupakan jenis penelitian eksperimental murni dengan rancangan acak lengkap pola satu arah.
B. Variabel Penelitian
1. Variabel utama
a. Variabel bebas : Dosis jus buah pepaya (Carica papaya L.). Dosis jus buah pepaya adalah sejumlah (gram) jus buah pepaya tiap satuan kg berat badan subjek uji yang bersangkutan. Jus buah pepaya dibuat dengan mem-blender
sejumlah (gram) buah pepaya bangkok (tidak termasuk biji) dalam sejumlah (ml) aquades sampai volume 100 ml
b. Variabel tergantung : efek hepatoprotektif jus buah pepaya bangkok terhadap sel hati tikus jantan terinduksi parasetamol, ditandai dengan tolak ukur kuantitatif berupa penurunan aktifitas Glutamat Piruvat Transaminase (GPT) serum dan tolak ukur kualitatif berupa gambaran histopatologi sel hati tikus.
2. Variabel pengacau terkendali
b. Bahan uji yang digunakan berupa buah pepaya bangkok yang baik (tidak busuk) dan diperoleh dari supermarket Lion Superindo daerah Seturan, Sleman, Yogyakarta yang dibeli pada bulan April dan Mei.
c. Frekuensi pemberian jus buah pepaya bangkok 1 x sehari selama 6 hari berturut-turut dengan waktu pemberian yang sama.
3. Variabel pengacau tak terkendali
a. Kondisi patologis hewan uji.
C. Subyek dan Bahan Penelitian
1. Subyek penelitian
Hewan uji yang digunakan berupa tikus jantan Wistar, umur 2-3 bulan dengan berat badan berkisar antara 180-230 gram, yang diperoleh dari seorang penjual tikus di jalan Parangtritis, Yogyakarta.
2. Bahan penelitian
a. Buah pepaya bangkok sebagai bahan yang akan diuji efek hepatoprotektifnya diperoleh dari supermarket Lion Superindo di daerah Seturan, Sleman, Yogyakarta.
b. Bahan hepatotoksikan yang digunakan berupa parasetamol yang, berwarna putih, tidak ada bintik-bintik hitam, tidak berbau, rasa sedikit pahit dan diperoleh dari P.T Konimex Solo
Farmakokinetika (Biofarmasetika), Fakultas Farmasi, Universitas Sanata Dharma, Yogyakarta.
d. Aquadest diperoleh dari Laboratorium Farmakologi dan Toksikologi, Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
e. Reagen siap pakai GPT-ALAT (Diasys Germany).
f. Formalin 10%, alkohol, dan lilin cetak diperoleh dari Laboratorium Farmakologi-Toksikologi Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
g. Zat warna hematoksilin dan eosin diperoleh dari Laboratorium Patologi Anatomi Fakultas Kedokteran Universitas Gadjah Mada Yogyakarta.
D. Alat Penelitian
E. Tata Cara Penelitian
1. Penetapan konsentrasi jus buah pepaya bangkok dan dosis maksimalnya
Konsentrasi jus buah pepaya yang akan digunakan dalam penelitian ini adalah konsentrasi maksimal jus buah pepaya yang dapat dipejankan pada tikus jantan melalui jarum oral. Orientasi awal dimulai dengan konsentrasi 100%, kemudian secara bertahap diturunkan hingga didapatkan konsentrasi optimal, yaitu konsentrasi maksimal yang dapat dipejankan pada tikus jantan melalui jarum oral. Berdasarkan orientasi yang dilakukan, jus buah pepaya dengan konsentrasi 95% (0,95 g/ml) merupakan konsentrasi maksimal yang dapat dipejankan pada tikus jantan melalui jarum oral.
Buah pepaya dicuci dan dibuang kulitnya. Kemudian dipotong kecil-kecil dan ditimbang sebanyak 190 g. Jus buah pepaya dibuat dengan cara mem-blender 190 g buah pepaya bangkok dalam 200 ml aquades selama 1 menit pertama dengan kecepatan 1 dan setelah menit pertama dilanjutkan dan diganti dengan kecepatan 2 selama 2 menit.
Dengan demikian, dosis maksimal jus buah pepaya yang dapat dipejankan pada tikus jantan dapat ditentukan dengan perhitungan sebagai berikut :
V = 𝐷𝐷𝐷𝐷𝐷𝐷𝐷𝐷𝐷𝐷.𝑥𝑥𝐵𝐵𝐵𝐵 𝐶𝐶
5 ml = 𝐷𝐷𝐷𝐷𝐷𝐷𝐷𝐷𝐷𝐷.𝑥𝑥 230 𝑔𝑔 95%
Jadi, dosis maksimal jus buah pepaya pada tikus jantan yang digunakan dalam penelitian ini adalah 20,65 g/kgBB.
2. Penetapan dosis jus buah pepaya
Penetapan dosis jus buah pepaya dilakukan berdasarkan penurunan dosis dari dosis tertinggi jus buah pepaya hasil orientasi yaitu 20,65 g/kgBB. Perhitungan dosis jus buah pepaya diuraikan sebagai berikut :
Dosis IV : 20,65 g/kg BB (dosis tertinggi)
Dosis III : 20,65 g/kgBB : 1,2469 = 16,56 g/kgBB Dosis II : 16,56 g/kgBB : 1,2469 = 13,28 g/kgBB Dosis I : 13,28 g/kgBB : 1,2469 = 10,65 g/kgBB
3. Uji pendahuluan
a. Orientasi konsentrasi CMC Na sebagai pensuspensi parasetamol
parasetamol dalam stamper dituang ke dalam gelas beker 250 ml dan stemper dibersihkan dengan larutan CMC Na yang tersisa dan di tuang ke dalam gelas beker parasetamol tadi. Larutan parasetamol dalam CMC Na 1% di dalam gelas beker diberi stirer magnetik dan diletakkan dalam pemanas yang memiliki magnet pemutar stirer. Biarkan stirer mengaduk selama beberapa saat dan ketika masih diaduk oleh stirer, ambil larutan parasetamol dalam mengguanakan spuit injeksi dan dikeluarkan melalui jarum suntik. Dari kelima konsentrasi CMC Na (1; 0,9; 0,8; 0,7% dan 0,6%) dalam larutan parasetamol, larutan parasetamol yang dapat disuntikkan melalui sputi injeksi pada larutan CMC Na konsentrasi 07% dan 0,6%. Oleh karena itu diambil larutan konsentrasi CMC Na yang paling besar untuk melarutkan parasetamol yaitu konsentrasi 0,7%.
b. Penetapan dosis hepatotoksik parasetamol
Peringkat dosis ini kemudian diujikan pada 15 ekor tikus jantan yang terbagi dalam 5 kelompok, masing-masing 3 ekor tikus, dengan pembagian sesuai dosis parasetamol yang akan diberikan pada tiap kelompok yaitu 0,750 g/kgBB, 0, 0,825 g/kgBB, 0,908 g/kgBB, 0,950g/kgBB dan 1,000g/kgBB. Cuplikan darah dan hati tikus diambil sebelum pemberian hepatotoksikan parasetamol secara intraperitonial (pre test) dan pada 24 jam setelah pemberian hepatotoksikan parasetamol (post test) dan dilakukan uji aktivitas GPT-serum. Selanjutnya, tikus-tikus tersebut dikorbankan dan diambil hatinya untuk dibuat preparat histologi. Tolak ukur dosis hepatotoksik parasetamol adalah peningkatan sepuluh kali lipat GPT-serum daro GPT-serum pre test dan adanya nekrosis pada sel hati tikus.
c. Penetapan waktu kehepatotoksikan parasetamol mencapai maksimal
secara intraperitonial. Setelah 6 jam seluruh hewan uji pada kelompok I diukur aktifitas GPT-serumnya. Kemudian ditunggu selama 6 jam lagi atau setelah 12 jam pemberian parasetamol dosis toksik, seluruh hewan uji pada kelompok I diukur lagi aktifitas GPT-serumnya. Sedangkan untuk kelompok II setelah 15 jam pemberian parasetamol, seluruh hewan uji pada kelompok II diukur aktifitas GPT-serumnya. Kemudian setelah jeda 3 jam pengukuran aktivitas GPT-serum yang pertama seluruh hewan uji pada kelompok II diukur lagi aktifitas GPT-serumnya sehingga pengukuran aktivitas GPT-serum pada kelompok II dilakukan pada jam ke-15 dan ke-18 setelah pemberian parasetamol dosis toksik.
d. Penetapan lama praperlakuan jus buah pepaya
Vogel (2007) mengatakan bahwa dalam melakukan uji suatu senyawa obat baru dalam pencegahan kerusakan hati yang diujikan pada tikus yang terinduksi CCl4 dapat dilakukan dalam waktu kurang lebih 8
minggu. Senyawa yang akan diuji diberikan pada kelompok-kelompok tikus dengan dosis yang berbeda-beda dengan pemberian 2 kali sehari. Tetapi model penelitian tadi dapat digunakan untuk kerusakan hati akut, dengan cara mempersingkat waktu penelitian pula. Yaitu waktu penelitian dipersingkat menjadi 5 hari, mulai hari pertama tikus-tikus diberi senyawa yang akan diuji dan pemberian CCl4 dosis hepatotoksik dilakukan pada
Sedangkan Linawati dkk (2006) dalam penelitian efek hepatoprotektif rebusan herba putri malu, kelompok tikus yang digunakan untuk menguji efek rebusan herba putri malu diberi rebusan herba putri malu selama 6 hari dan pada hari ke 7 diberi parasetamol dosis hepatotoksik.
Penetapan lama praperlakuan jus buah pepaya dilakukan melalui studi pustaka, dimana penulis mengambil model penelitian tikus diberi praperlakuan jus buah pepaya selama 6 hari dan pada hari ke 7 diberi parasetamol dosis hepatotoksik.
4. Pengelompokan dan perlakuan hewan uji
Kelompok III-IV beruturut-turut diberi jus buah pepaya dosis 20,65 g/kgBB, 16,56 g/kgBB, 13,28 g/kgBB, dan 10,65 g/kgBB 1 x sehari selama 6 hari secara oral. Hari ke-7 diberi suspensi parasetamol dosis hepatotoksik (hasil orientasi) yaitu 0,950 g/kgBB. Setelah 18 jam, tikus diambil darahnya melalui sinus orbitalis mata. Cuplikan darah diambil serumnya dan ditetapkan aktivitas GPT-serumnya secara spektrofotometri. Kemudian tikus dikorbankan untuk diambil hatinya, dimasukkan ke dalam formalin 10% untuk dibuat preparat histologi.
5. Pembuatan serum
Darah tikus diambil melalui dinus orbitalis mata dan ditampung dalam tabung ependroff kemudian dimasukan ke dalam tabung sentrifuge, kemudian dipusingkan dengan kecepatan 3000 rpm selama 15 menit dan diambil supernatannya (serum). Pembuatan serum dilakukan di Laboratorium Farmakologi-Toksikologi Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
6. Penetapan aktivitas GPT-serum
Alat yang digunakan untuk menganalisis aktivitas GPT-serum adalah vitalab-mikro. Pada analisis fotometri aktifitas GPT-serum ini dilakukan sejumlah reaksi seperti yang tersaji pada tabel I .
Aktivitas enzim dibaca pada panjang gelombang 340 nm, suhu 27
0
Tabel I. Prosedur Penetapan Aktivitas GPT-serum (DiaSys, 2009)
7. Pembuatan preparat histologi sel hati
Organ dipotong-potong dengan mikotom setebal 3 mm, kemudian difiksasi. Preparat dimasukkan ke dalam larutan etanol secara bertingkat berturut-turut etanol 50% selama 30 menit, etanol 90% selama 30 menit, etanol mutlak selama 30 menit, masing-masing dua kali perlakuan.
Preparat kemudian dimasukkan dalam xilol parafin, masukkan ke dalam oven selama 1,5 jam dalam suhu 60 0
8. Pemeriksaan histologi sel hati
C. Pindahkan preparat ke dalam parafin cair selama 1,5 jam dalam blok preparat. Setelah dicetak preparat dipotong setebal 5 mikron, masukkan dalam xilol murni selama 5-10 menit. Cuci preparat dengan air, kemudian dimasukkan ke dalam larutan eosin-alkohol selama 1-2 menit. Kemudian preparat dikeringkan pada suhu kamar dan ditutup dengan kanada balsem serta objek gelas. Pembuatan preparat dilakukan oleh Laboratorium Patologi Anatomi Fakultas Kedokteran Universitas Gadjah Mada Yogyakarta.
Pemeriksaan sel-sel organ hasil pengecatan hematoksilin-eosin dilakukan
Serum 100 μl
Larutan reagen 1 Larutan reagen 2
Dicampur dan didiamkan hingga 1 menit setelah pencampuran. Kemudian setelah 1 menit dibaca
absorbansinya
di bawah mikroskop. Kemudian hasilnya diberi skor menurut tingkat kerusakannya. Pemeriksaan ini dilakukan di Laboratorium Patologi Anatomi Fakultas Kedokteran Universitas Gadjah Mada Yogyakarta. Analisis dilakukan oleh dr. Hadi Irawiraman M. Kes., Sp. P.A.
F. Analisis Hasil
Data Aktivitas GPT-serum terlebih dahulu diuji datanya dengan uji Saphiro-Wilk untuk melihat distribusi data normal atau tidak. Jika data terdistribusi normal maka dilanjutkan dengan uji ANOVA dengan taraf kepercayaan 95% dan dilanjutkan dengan uji Sceffe untuk melihat perbedaan dari tiap kelompok apakah bermakna (p<0,05) atau perbedaan itu tidak bermakna (p>0,05). Jika distribusi data tidak normal maka dilanjutkan dengan uji Kruskal-Wallis dengan taraf kepercayaan 95% dan dilanjutkan dengan uji Mann-Whitney untuk melihat perbedaan dari tiap kelompok apakah bermmakna (p<0,05) atau perbedaan itu tidak bermakna (p>0,05).
47
BAB IV
HASIL PENELITIAN DAN PEMBAHASAN
A. Uji Pendahuluan
1. Penentuan dosis hepatotoksik parasetamol
Penentuan dosis hepatotoksik parasetamol bertujuan mengetahui besarnya dosis parasetamol yang dapat menyebabkan nekrosis pada sel hati mencit. Hal ini dapat diketahui dari adanya peningkatan aktivitas GPT-serum, minimal 10 kali lipat terhadap kontrol negatif. Diketahui pula dari gambaran histopatologinya. (Ladoangin, 2004)
Data aktifitas GPT-serum tikus akibat pemberian parasetamol dosis 0,7500; 0,8255; 0,9086; 0,9500 dan 1000 mg/kgBB tersaji pada tabel I
Tabel II. Aktivitas GPT-serum tikus pada selang waktu 24 jam sebelum dan setelah pemberian parasetamol secara intra peritonial dengan dosis 0,750; 0,8255; 0,9086; 0,950 dan 1,000 g/kgBB.
Dosis
= 1 ekor hewan uji mati sebelum diambil GPT-serum setelah pemberian 2
* = nilai p > 0,05 (purata aktivitas GPT-serum sebelum dan sesudah
pemberian parasetamol kelompok yang diuji berbeda tidak bermakna) = 1 ekor hewan uji mati sebelum diambil GPT-serum setelah pemberian
Tabel III. Hasil analisis statistik aktivitas SGPT-serum untuk menilai perbedaan
Tabel IV. Derajat kerusakan sel hati tikus pada selang waktu 24 jam setelah pemberian parasetamol secara intra peritonial dengan dosis 0,750; 0,8255; 0,9086; 0,9500 dan 1,000 g/kgBB
Kel. Dosis Parasetamol (g/kgBB)
Hasil Analisis Skoring Derajat Kerusakan hati ± SE Degenerasi
Melemak Nekrosis Sirosis
I 0,7500 1,000 ± 0,00 - -
II 0,8255 1,000 ± 0,00 0,33 ± 0,33 -
III 0,9086 1,33 ± 0,33 0,33 ± 0,33 -
IV 0,9500 1,67 ± 0,33 1,67 ± 0,33 -
V 1,000 2,00 ± 0,00 2,00 ± 0,00 -
aktivitas GPT-serumnya. Sehingga hasil analisis statistik yang didapat tidak lengkap. Berdasarkan tabel II terlihat bahwa aktivitas GPT-serum tikus pada 5 peringkat dosis parasetamol yang mengalami peningkatan aktivitas GPT-serum yang bermakna adalah pada dosis 0,9086 g/kgBB dan dosis 0,9500 g/kgBB. Tetapi hanya pada dosis 0,9500 g/kgBB seluruh hewan uji mengalami nekrosis walaupun 1 ekor hewan uji mengalami kematian. Hal ini disebabkan karena waktu pemejanan yang lama tanpa pemberian antidot sehingga organ hati hewan uji mengalami kerusakan yang berat sehingga tidak bisa berfungsi normal dan hewan uji mengalami kematian. Berdasarkan uji Kruskal-Wallis yang dilanjutkan dengan uji Mann-Whitney sebagai uji Post Hoc, dosis parasetamol 0,7500, 0,8255, 0,9086, 0,9500 dan 1,000 g/kgBB tidak menunjukkan adanya perbedaan harga aktivitas GPT-serum post test karena nilai p > 0,05. Hal ini disebabkan karena adanya kematian hewan uji sebelum pengambilan darah untuk dilihat aktivitas GPT-serumnya setelah pemberian parasetamol pada dosis 0,9500 dan 1,000 g/kgBB sehingga hasil analisis statistiknya tidak lengkap. Tetapi dosis 0,9500 g/kgBB yang paling memungkinkan untuk digunakan dalam menentukan waktu kehepatotoksikan parasetamol. Hal ini didasarkan pada aktivitas GPT-serum yang mencapai 10 kali lipat pada 70% hewan uji (tersaji pada keterangan tabel II dimana 1 dari 3 ekor hewan uji mengalami kematian) dan secara keseluruhan hewan uji mengalami nekrosis.
2. Penentuan waktu kehepatotoksikan parasetamol mencapai maksimal
g/kgBB (hasil orientasi) memberikan efek hepatotoksik yang maksimal. Hal ini ditunjukkan oleh aktivitas GPT-serum tertinggi pada selang waktu tertentu. Parasetamol dosis 0,9500 g/kgBB diujikan pada tikus jantan dengan selang waktu pengambilan cuplikan darah 6 jam, 12 jam, 15 jam, 18 jam dan 24 jam secara intra peritonial.
Data aktivitas GPT-serum dan derajat kerusakan hati tikus setelah pemberian parasetamol 0,9500 g/kgBB pada selang waktu 6, 12, 15, 18 dan 24 jam tersaji pada tabel V dan tabel VI.
Tabel V. Aktivitas GPT-serum dan derajat kerusakan sel hati tikus setelah pemberian parasetamol secara intra peritonial dengan dosis 0,9500 g/kgBB pada selang waktu 6, 12, 15, 18, dan 24 jam.
= 1 ekor hewan uji mati sebelum diambil GPT-serum setelah pemberian * = nilai p > 0,05 (purata aktivitas GPT-serum sebelum dan sesudah
pemberian parasetamol kelompok yang diuji berbeda tidak bermakna)
Tabel VI. Derajat kerusakan sel hati tikus setelah pemberian parasetamol secara intra peritonial dengan dosis 0,9500 g/kgBB pada selang waktu 12 jam dan 18 jam
Ket.: Nilai skoring derajat kerusakan hati 1 = ringan; 2 = sedang; dan 3 = berat Kel.
Waktu Pengambilan Organ Setelah Pemberian
Parasetamol 0,9500 g/kgBB (jam)
Hasil Analisis Skoring Derajat Kerusakan hati ± SE
Degenerasi
Melemak Nekrosis Sirosis
I 12 1,40 ± 0,24 0,80 ± 0,37 -
II 18 1,40 ± 0,24 1,40 ± 0,24 -
Berdasarkan tabel V dapat dilihat bahwa aktifitas GPT-serum pada selang waktu 18 jam dan 24 jam setelah pemberian parasetamol dosis 0,9500 g/kgBB secara intra peritonial mencapai lebih dari 10 kali lipat yaitu 666,80 ± 9,00 dan 903,00 ± 9,00 dan terjadi nekrosis pada keseluruhan organ hewan uji. Tetapi untuk waktu 24 jam setelah pemberian parasetamol 1 ekor hewan uji mengalami kematian sehingga selang waktu pengambilan cuplikan darah yang digunakan dalam penelitian ini adalah 18 jam setelah pemberian. Hal ini dikarenakan pada selang waktu 24 jam setelah pemberian parasetamol 1 dari 3 ekor hewan uji mengalami kematian sehingga kehilangan 1 data aktivitas GPT-serum, sehingga ada ± 30% kemungkinan hewan uji yang mengalami kematian pada saat penelitian dan akan kehilangan data aktivitas GPT-serum pada pengambilan cuplikan darah jika menggunakan selang waktu 24 jam untuk pengambilan cuplikan darah. Jadi dalam penelitian ini dosis hepatotoksik parasetamol yang digunakan pada tikus jantan adalah 0,9500 g/kgBB dengan selang waktu pengambilan cuplikan darah adalah 18 jam setelah pemberian hepatotoksikan parasetamol.
3. Penetapan lama preperlakuan jus buah pepaya
Vogel (2007) mengatakan bahwa dalam melakukan uji suatu senyawa obat baru dalam pencegahan kerusakan hati yang diujikan pada tikus yang terinduksi CCl4 dapat dilakukan dalam waktu kurang lebih 8 minggu. Senyawa yang akan
Yaitu waktu penelitian dipersingkat menjadi 5 hari, mulai hari pertama tikus-tikus diberi senyawa yang akan diuji dan pemberian karbon tetraklorida (CCl4)
Sedangkan Ladoangin (2004) dalam penelitian efek hepatoprotektif jus buah apel hijau dan Linawati dkk (2006) dalam penelitian efek hepatoprotektif rebusan herba putri malu, kelompok mencit dan tikus yang digunakan untuk menguji efek jus buah apel hijau dan rebusan herba putri malu diberi rebusan herba putri malu dan jus buah apel hijau selama 6 hari dan pada hari ke 7 diberi parasetamol dosis hepatotoksik. Hal ini didasarkan pada harga aktivitas GPT-serum setelah praperlakuan jus buah apel hijau dan rebusan herba putri malu selama 6 hari menunjukkan harga aktivitas GPT-serum yang mengalami kenaikan atau penurunan aktivitas GPT-serum yang tidak berbeda bermakna menurut hasil statistik jika dibandingkan dengan praperlakuan jus buah apel dan rebusan herba putri malu yang diberikan lebih dari 6 hari.
dosis hepatotoksik dilakukan pada hari ke 2 sampai hari ke 5 pada kelompok tikus yang diberi praperlakuan senyawa yang diuji.
Penetapan lama praperlakuan jus buah pepaya dilakukan berdasarkan penelitian yang dilakukan oleh Ladoangin (2004) dan Linawati dkk (2006), dimana penulis mengambil model penelitian tikus diberi praperlakuan jus buah pepaya selama 6 hari dan pada hari ke 7 diberi parasetamol dosis hepatotoksik.
4. Penetapan dosis jus buah pepaya