KOMPOSISI MIKROORGANISME PENYUSUN DAN
KANDUNGAN NUTRISI BIOFLOK DALAM MEDIA
PEMELIHARAAN INDUK IKAN NILA
Oreochromis niloticus
DENGAN APLIKASI TEKNOLOGI BIOFLOK
NORA PUTRI SARI
DEPARTEMEN BUDIDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
ii
PERNYATAAN MENGENAI SKRIPSI
DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi yang berjudul:
KOMPOSISI MIKROORGANISME PENYUSUN DAN KANDUNGAN NUTRISI BIOFLOK DALAM MEDIA PEMELIHARAAN INDUK IKAN NILA Oreochromis niloticus DENGAN APLIKASI TEKNOLOGI BIOFLOK Adalah benar merupakan hasil karya yang belum diajukan dalam bentuk apa pun pada perguruan tinggi mana pun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir Skripsi ini.
Bogor, Desember 2012
Nora Putri Sari
iii
ABSTRAK
NORA PUTRI SARI. Komposisi mikroorganisme penyusun dan kandungan nutrisi bioflok dalam media pemeliharaan induk ikan nila Oreochromis niloticus dengan aplikasi teknologi bioflok. Dibimbing oleh Dr.Widanarni dan Julie Ekasari, M.Sc.
Penelitian ini bertujuan untuk menganalisis komposisi mikroorganisme penyusun dan kandungan nutrisi bioflok dalam media pemeliharaan induk ikan nila Oreochromis niloticus dengan aplikasi teknologi bioflok. Sampel bioflok diambil dari 8 unit bak pemeliharaan induk ikan nila yang dipelihara selama 3 bulan dengan dua perlakuan yang berbeda yaitu perlakuan kontrol (tanpa penambahan molase) dan bioflok (dengan penambahan molase). Hasil penelitian menunjukkan bahwa kelimpahan bakteri dan plankton pada perlakuan bioflok cenderung meningkat seiring dengan masa pemeliharaan. Hasil identifikasi terhadap isolat bakteri yang terdapat pada media air pemeliharaan diperoleh 7 jenis bakteri pada bioflok yaitu Actinobacter sp., Listeria sp., Kurthia sp.,
Actinobacillus sp., Streptococcus sp., Bacillus sp., Micrococcus sp. dan 5 jenis
bakteri pada kontrol yaitu Actinobacter sp., Listeria sp., Kurthia sp.,
Actinobacillus sp., Streptococcus sp.. Jenis fitoplankton yang mendominasi
perlakuan bioflok pada akhir penelitian adalah kelompok Chlorophyceae dari genus Scenedesmus. sebanyak 1.936.804 sel/L. Sedangkan pada bak kontrol didominasi oleh kelompok Cyanophyceae dari genus Microcystis sebanyak 4.967.296 sel/L. Kandungan nutrisi bioflok yaitu protein sebesar 37,37 %, lemak sebesar 1,66%, serat kasar sebesar 2,05%, dan kadar abu sebesar 2,26%.
Kata Kunci : Nila, bioflok, bakteri, fitoplankton, nutrisi
---
ABSTRACT
This study aims to analyze the composition of microorganisms and primary nutrients in biofloc collected from tilapia Oreochromis niloticus broodstock tanks cultured with the application biofloc technology. Samples were taken from 8 biofloc bath unit tilapia maintained for 3 months with two different treatments ie control treatment (without the addition of molasses) and bioflok (with the addition of molasses). The results showed that the abundance of bacteria and plankton in biofloc treatment tends to increase with the maintenance period. The results of the identification of bacterial isolates found in water conservancy media obtained 7 types of bacteria in biofloc system are Actinobacter sp., Listeria sp., Kurthia sp.,
Actinobacillus sp., Streptococcus sp., Bacillus sp., Micrococcus sp. and 5 types of
bacteria in the control Actinobacter sp., Listeria sp., Kurthia sp., Actinobacillus sp., Streptococcus sp.. Types of phytoplankton that dominate biofloc treatment at the end of the study were a group of Chlorophyceae genus Scenedesmus as many as 1,936,804 cells/L. While in the control Cyanophyceae dominated by genus of Microcystis much as 4,967,296 cells/L. Contain of biofloc nutrition were 37.37 % protein, 1.66% of lipid, 2.05% of crude fiber, and 2.26% of ash.
iv
KOMPOSISI MIKROORGANISME PENYUSUN DAN
KANDUNGAN NUTRISI BIOFLOK DALAM MEDIA
PEMELIHARAAN INDUK IKAN NILA
Oreochromis niloticus
DENGAN APLIKASI TEKNOLOGI BIOFLOK
NORA PUTRI SARI
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Program Studi Teknologi dan Manajemen Perikanan Budidaya
Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan,
Institut Pertanian Bogor
DEPARTEMEN BUDIDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
v
PENGESAHAN
Judul : Komposisi Mikroorganisme Penyusun dan Kandungan Nutrisi Bioflok dalam Media Pemeliharaan Induk Ikan Nila Oreochromis niloticus dengan Aplikasi Teknologi Bioflok
Nama : Nora Putri Sari
NIM : C14080011
Departemen : Budidaya Perairan
Disetujui,
Pembimbing I Pembimbing II
Dr. Widanarni Julie Ekasari, M. Sc NIP. NIP 196709271994032001 NIP. 19770725 2005 01 2 002
Diketahui,
Ketua Departemen Budidaya Perairan
Dr. Sukenda
NIP. 19671013 199302 1 001
vi
KATA PENGANTAR
Segala puji dan syukur penulis panjatkan kehadirat Allah SWT, yang telah melimpahkan segenap rahmat dan karunia-Nya sehingga skripsi dengan judul “Komposisi Mikroorganisme Penyusun dan Kandungan Nutrisi Bioflok dalam Media Pemeliharaan Induk Ikan Nila Oreochromis niloticus dengan Aplikasi Teknologi Bioflok” dapat diselesaikan. Skripsi ini merupakan hasil dari penelitian yang berlangsung pada bulan April hingga Juli 2012 di Kolam Percobaan, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Banyak bantuan yang telah diberikan berbagai pihak dalam penyelesaian skripsi ini. Oleh karena itu, pada kesempatan ini penulis sampaikan ucapan terima kasih kepada Dosen Pembimbing Ibu Dr. Widanarni dan Ibu Julie Ekasari, M.Sc yang telah memberikan bimbingan dan arahan dalam menyelesaikan penelitian maupun penyusunan skripsi, serta Bapak Dr. Nur Bambang Priyo Utomo sebagai Dosen Penguji Tamu, atas arahan dan masukan untuk perbaikan dalam penyusunan skripsi ini.
Penulis juga mengucapkan terima kasih banyak kepada kedua orang tua (ibunda Muslimah dan ayahanda Ardi), kakak (Medi), adik (Gita Tri Utami), keluarga besar H. Mahmud, Yuk Atiek, Yesi, Yuk Rus/Aulia, serta Brilian Putra Perdana atas kasih sayang, dukungan, dan doanya. Selain itu, ucapan terima kasih kepada Dian Utami Putri atas kerjasama dan dukungannya, teman-teman LKI, nutrisi, reproduksi, lingkungan, maupun teman-teman BDP PATMO atas bantuan dan dukungannya dalam penyelesaian skripsi ini. Terakhir penulis ucapkan terima kasih kepada teman-teman di Wisma Bintang 27 B.
Semoga semua kebaikan yang telah dilakukan mendapatkan balasan yang setimpal dari Allah SWT. Penulis berharap mudah-mudahan skripsi ini bermanfaat bagi kita semua. Amin
Bogor, Desember 2012
Nora Putri Sari
vii
DAFTAR RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 21 Juli 1990 di Talang Balai, Sumatera Selatan (Palembang). Penulis merupakan anak kedua dari tiga bersaudara dari pasangan Bapak Ardi dan Ibu Muslimah. Penulis memulai pendidikan dasar di SD Negeri 3 Talang Balai dan lulus pada tahun 2002. Pendidikan lanjutan menengah pertama ditempuh di SMP Negeri 2 Tanjung Raja dan lulus tahun 2005. Pendidikan menengah atas ditempuh penulis di SMA Negeri 1 Tanjung Raja dan lulus pada tahun 2008.
Penulis diterima sebagai mahasiswa Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB (USMI) pada tahun 2008 dan penulis memasuki Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor pada tahun 2009. Selama masa perkuliahan, penulis aktif pada organisasi kemahasiswaan Koperasi Mahasiswa (KOPMA) sebagai anggota 2008/2009, organisasi kemahasiswaan Himpunan Mahasiswa Akuakultur (HIMAKUA) sebagai anggota 2009/2010. Penulis juga aktif menjadi asisten Praktikum pada mata kuliah Dasar-dasar Mikrobiologi Akuatik (2012).
Untuk meningkatkan ilmu pengetahuan dibidang perikanan budidaya, penulis mengikuti kegiatan Praktek Lapangan Akuakultur di PT. Surya Windu Kartika (2011) dan menghasilkan laporan praktek lapangan dengan judul “Pembesaran Udang Vanname Litopenaeus vannameiI di PT. Surya Windu Kartika, Banyuwangi, Jawa Timur. Sebagai salah satu syarat untuk memperoleh gelar sarjana pada Departemen Budidaya Perairan, FPIK, IPB, penulis melakukan penelitian yang berjudul “Komposisi Mikroorganisme Penyusun dan Kandungan Nutrisi Bioflok dalam Media Pemeliharaan Induk Ikan Nila Oreochromis niloticus dengan Aplikasi Teknologi Bioflok.
viii
DAFTAR ISI
Halaman DAFTAR TABEL………ix DAFTAR LAMPIRAN ... xi I. PENDAHULUAN ... 1II. BAHAN DAN METODE... 3
2.1 Sampel Bioflok ... 3
2.2 Prosedur Penelitian... 3
2.3 Parameter Penelitian... 4
2.3.1 Penghitungan Kelimpahan dan Identifikasi Mikroba ... 4
2.3.1.1 Kelimpahan dan Identifikasi Bakteri pada Media Budidaya dan Usus Ikan ... 4
2.3.1.2 Kelimpahan dan Identifikasi Plankton pada Media Budidaya ... 4
2.3.2 Kandungan Nutrisi Bioflok ... 5
2.3.3 Volume Flok ... 5
2.3.4 Kualitas Air ... 5
III. HASIL DAN PEMBAHASAN ... 6
3.1 Hasil ... 6
3.1.1 Komposisi Mikrooganisme Penyusun Bioflok ... 6
3.1.1.1 Kelimpahan dan Jenis Bakteri ... 6
3.1.1.2 Kelimpahan dan Jenis Plankton ... 8
3.1.1.2.1 Kelimpahan dan Jenis Fitoplankton ... 8
3.1.1.2.2 Kelimpahan dan Jenis Zooplankton ... 9
3.1.2 Kandungan Nutrisi Bioflok ... 10
3.1.3 Total Suspended Solid, Volatile Suspended Solid, Volume Flok ... 10
3.1.4 Kualitas Air ... 12 3.2 Pembahasan ... 14 IV. KESIMPULAN ... 22 4.1 Kesimpulan ... 22 DAFTAR PUSTAKA ... 23 LAMPIRAN ... 26
ix
DAFTAR TABEL
Halaman 1. Hasil identifikasi bakteri dalam air media pemeliharaan dan
pemijahan ikan nila Oreochromis niloticus pada perlakuan kontrol dan BFT pada hari ke 1 dan ke 84... 7
2. Hasil identifikasi bakteri dalam usus ikan nila Oreochromis niloticus pada perlakuan kontrol dan BFT pada hari ke 1 dan ke 84. ... 8
3. Komposisi proksimat bioflok dan kontrol dalam air media pemeliharaan dan pemijahan ikan nila Oreochromis niloticus pada perlakuan kontrol dan BFT pada hari ke 84. ... 10
4. Kualitas air dalam air media pemeliharaan dan pemijahan ikan nila Oreochromis niloticus pada perlakuan kontrol dan BFT. ... 12
x
DAFTAR GAMBAR
Halaman 1. Kelimpahan bakteri dalam air media pemeliharaan dan pemijahan ikan
nila Oreochromis niloticus pada perlakuan kontrol dan BFT pada hari ke 1 dan ke 84 ... 6
2. Kelimpahan bakteri dalam usus ikan nila Oreochromis niloticus pada perlakuan kontrol dan BFT pada hari ke 1 dan ke 84 ... 7
3. Kandungan klorofil-a dalam air media pemeliharaan dan pemijahan ikan nila Oreochromis niloticus pada perlakuan kontrol dan BFT pada hari ke 1 dan ke 84 ... 8
4. Kelimpahan fitoplankton dalam air media pemeliharaan dan pemijahan ikan nila Oreochromis niloticus pada perlakuan kontrol dan BFT pada hari ke 62 dan ke 84 ... 8
5. Kelimpahan zooplankton dalam air media pemeliharaan dan pemijahan ikan nila Oreochromis niloticus pada perlakuan kontrol dan BFT pada hari ke 62 dan ke 84 ... 9
6. Kandungan total padatan tersuspensi (TSS) dalam air media pemeliharaan dan pemijahan ikan nila Oreochromis niloticus pada perlakuan kontrol dan BFT pada hari ke 1, ke 62 dan ke 84 ... 11
7. Kandungan volatile suspended solid (VSS) dalam air media pemeliharaan dan pemijahan ikan nila Oreochromis niloticus pada perlakuan kontrol dan BFT pada hari ke 1, ke 62 dan ke 84 ... 11
8. Volume flok dalam air media pemeliharaan dan pemijahan ikan nila Oreochromis niloticus pada perlakuan kontrol dan BFT ... 12
9. Kualitas air media pemeliharaan dan pemijahan ikan nila Oreochromis niloticus pada perlakuan kontrol dan BFT ... 14
10.Mikrograf bioflok yang diambil dari media pemeliharaan induk ikan nila Oreochromis niloticus dengan aplikasi teknologi bioflok pada hari ke 14 (perbesaran 100 x). Tanda panah menunjukkan mikroalga yang terdapat dalam bioflok (a) Scenedesmus sp., (b) Pediastrum sp.. ... 16
xi
DAFTAR LAMPIRAN
Halaman
1. Prosedur Penambahan Karbon (Molase) ... 27
2. Prosedur Uji Fisiologis dan Biokimia Bakteri (Cowan & Steel 1974). ... 30
3. Prosedur Pengukuran Klorofil-a (APHA 1992) ... 32
4. Prosedur Analisis Proksimat ... 33
5. Kelimpahan dan Jenis Bakteri pada Media Pemeliharaan dan Usus Ikan ... 35
6. Kelimpahan dan Jenis Fitoplankton yang Ditemukan pada Media Pemeliharaan Ikan ... 36
7. Kelimpahan dan Jenis Zooplankton yang Ditemukan pada Media Pemeliharaan Ikan ... 36
8. Nilai TSS (mg/L) Selama Pemeliharaan Ikan Nila Oreochromis niloticus ... 38
9. Nilai VSS (mg/L) Selama Pemeliharaan Ikan Nila Oreochromis niloticus ... 38
10.Nilai Volume Flok (ml/L) Selama Pemeliharaan Ikan Nila Oreochromis niloticus ... 38
1
I. PENDAHULUAN
Ikan nila merupakan salah satu ikan konsumsi dari 10 jenis ikan yang menjadi target peningkatan produksi yang dicanangkan Kementerian Kelautan dan Perikanan (KKP) pada tahun 2014. KKP (2012) menargetkan produksi ikan nila pada tahun 2012 sebanyak 850.000 ton, jumlah tersebut meningkat dari tahun 2011 yaitu sebanyak 639.300 ton. Semakin tingginya permintaan pasar akan nila mendorong dilakukannya usaha yang bertujuan untuk meningkatkan produktivitas. Menurut Avnimelech (2007) ada pendekatan baru untuk meningkatkan tingkat kelangsungan hidup, efisiensi pakan dan pertumbuhan ikan serta mengurangi limbah kegiatan akuakultur yaitu teknologi bioflok (BFT- Bioflocs technology). Teknologi bioflok merupakan teknologi akuakultur yang didasarkan pada kemampuan bakteri heterotrof dalam mengkonversi nitrogen baik organik maupun anorganik yang terdapat dalam air menjadi biomassa bakteri (De Schryver dan Verstraete, 2009). Konversi akumulasi nitrogen anorganik menjadi biomassa bakteria heterotrof dapat dikontrol melalui penambahan karbon organik seperti molase pada rasio karbon nitrogen (C/N) tertentu, sedangkan bioflok merupakan suatu agregat yang tersusun atas bakteri pembentuk flok, bakteri filamen, mikroalga (fitoplankton), protozoa, bahan organik serta pemakan bakteri (Hargreavest, 2006; Avnimelech, 2007) dan dapat mencapai ukuran 1000 µm (De Schryver et al., 2008).
Penelitian mengenai teknologi bioflok pada budidaya ikan dan udang telah dilakukan. Namun, parameter yang diamati dari bioflok tersebut lebih banyak terhadap profil kualitas air. Selain berperan dalam menjaga kualitas air, beberapa penelitian menunjukkan bahwa bioflok dapat menjadi sumber pakan, menstimulasi sistem imun, serta berperan dalam reproduksi (Widanarni et al., 2012; Agustinus, 2010; Emerenciano et al., 2011). Penelitian mengenai kontribusi bioflok pada kinerja reproduksi telah dilakukan pada udang Litopenaeus
stylirostris, yang menunjukkan bahwa kinerja pemijahan L. stylirostris pada
kondisi flok lebih baik daripada kolam tanah (Emerenciano et al., 2011). Selain itu, pada penelitian Widanarni et al. (2011) ditemukan adanya jumlah rata-rata benih ikan nila merah pada perlakuan bioflok lebih tinggi dibanding perlakuan
2 kontrol. Peran bioflok tersebut diduga terkait dengan komposisi mikroorganisme dan kandungan nutrisi bioflok.
Penelitian ini bertujuan untuk mempelajari komposisi mikroorganisme penyusun dan kandungan nutrisi flok yang dihasilkan dalam bak pemeliharaan induk ikan nila Oreochromis niloticusdengan sistem teknologi bioflok.
3
II. BAHAN DAN METODE
2.1 Sampel Bioflok
Sampel air dan bioflok diambil dari bak pemeliharaan dan pemijahan ikan nila yang dipelihara dengan sistem yang berbeda, yaitu kontrol (tanpa penambahan molase) dan BFT (dengan penambahan molase). Ikan nila yang digunakan dalam penelitian ini adalah ikan nila Oreochromis niloticus yang berasal dari Balai Pengembangan Benih Ikan Air Tawar (BPBIAT) Wanayasa dengan bobot 84,56 + 4,81 g. Wadah budidaya ikan yang digunakan berupa kolam beton terbuka (outdoor) berukuran 3m x 2m x 0,7m sebanyak 8 unit. Ikan uji yang ditebar pada masing-masing bak pemeliharaan dengan kepadatan 60 ekor/bak dengan rasio jantan dan betina 1:4. Sumber karbon yang digunakan dalam bak BFT adalah molase dengan kandungan karbon sebesar 40%. Pakan yang diberikan berupa pelet tenggelam komersial dengan kandungan protein 30%. Sumber pakan lain pada perlakuan penambahan karbon diharapkan berasal dari bioflok yang tumbuh di dalam media pemeliharaan.
2.2 Prosedur Penelitian
Pemeliharaan induk ikan nila dilakukan dengan tahapan persiapan dan pemeliharaan. Pada masa persiapan, bak beton disikat dan dibersihkan dari lumut dan kotoran lain yang menempel kemudian dikeringkan selama 1 hari lalu diisi air hingga volumenya 3 m3. Air dibiarkan tergenang selama 3 hari sebelum ikan ditebar. Sebelum dipelihara, ikan diadaptasikan terlebih dahulu dalam bak pemeliharaan selama 3 hari.
Pada masa pemeliharaan dilakukan pemberian pakan dengan cara at satiation, penambahan molase (Lampiran 1), sampling bioflok, serta pengukuran kualitas air. Sampling bioflok dilakukan pada hari ke 1 dan ke 84 yang terdiri dari kelimpahan dan jenis bakteri pada air media dan usus ikan nila, sedangkan kelimpahan dan jenis plankton pada air media pemeliharaan dilakukan pada hari ke 62 dan ke 84. Pengukuran kualitas air berupa suhu dilakukan setiap hari, sedangkan pengukuran DO, pH, nitrit, nitrat, TAN, alkalinitas, dan volume flok dilakukan setiap seminggu sekali.
4 2.3 Parameter Penelitian
2.3.1 Penghitungan Kelimpahan dan Identifikasi Mikroba
2.3.1.1 Kelimpahan dan Identifikasi Bakteri pada Media Budidaya dan Usus Ikan
Pengambilan sampel air dan suspensi bioflok untuk penghitungan kelimpahan bakteri yang terdapat pada media budidaya dilakukan pada hari ke 1 dan ke 84. Air sampel diambil dari kolom air dengan sedikit pengadukan menggunakan botol film. Pengambilan sampel usus ikan nila untuk penghitungan kelimpahan bakteri dilakukan pada hari ke 1 dan ke 84. Usus ikan diambil dari kedua bak perlakuan dan ditimbang bobot rata-ratanya, kemudian digerus dan diambil sebanyak 1 g. Setelah itu dilakukan penghitungan kelimpahan bakteri dengan menggunakan metode cawan sebar. Air sampel diencerkan melalui pengenceran berseri 10-1, 10-2, 10-3, dan seterusnya, lalu disebar pada media TSA dalam cawan petri, diinkubasi selama 24 jam, dan dihitung jumlah koloni yang tumbuh. Kelimpahan bakteri pada media budidaya dihitung dengan menggunakan rumus:
Total Bakteri = ∑ Koloni x 1 x 1 Faktor pengencer ml sampel
Bakteri yang tumbuh dominan pada setiap pengambilan sampel diidentifikasi berdasarkan sifat fisiologi dan biokimia (Cowan & Steel, 1974) (Lampiran 2). Bakteri yang tumbuh dominan pada setiap pengambilan sampel dikarakterisasi secara morfologi (bentuk, tepian, elevasi, dan warna koloni, bentuk sel, dan sifat Gram dengan pewarnaan Gram) serta sifat fisiologi-biokimia yang meliputi uji oksidasi fermentasi, uji motilitas, dan uji katalase.
2.3.1.2 Kelimpahan dan Identifikasi Plankton pada Media Budidaya
Pengambilan sampel plankton dilakukan dengan cara memasukkan 10 L air ke dalam plankton net, sehingga plankton terkonsentrasi di dalam botol plankton net. Plankton bersama air dalam botol plankton net diukur volumenya dan ditempatkan pada botol sampel, diberi 0,25-0,4 mL lugol setiap 65 mL sampel. Setiap botol sampel kemudian disimpan dalam kotak tertutup pada suhu ruang dan dibawa ke Laboratorium Biologi Mikro untuk diamati. Pengambilan sampel dilakukan 2 kali, yaitu pada hari pemeliharaan ke 62 dan 84 pada 2 stasiun
5 dengan 4 kali ulangan. Kelimpahan tersebut dihitung dengan menggunakan metode Sedgewick Rafter Counting Cell dan mikroskop. Kelimpahan plankton pada media budidaya dihitung dengan menggunakan prosedur dalam APHA (1989):
N = n x
x
x
Keterangan :
N : Kelimpahan plankton
n : Jumlah Individu yang tercacah
A : Volume Sedgewick- Rafter counting cell (1000 mm2) B : Volume satu slide Sedgewick- Rafter counting cell (1 mL) C : Volume sampel yang tersaring (10 L)
Pengamatan klorofil-a pada perlakuan kontrol dan bioflok dilakukan pada hari ke 1 dan ke 84 dengan menggunakan prosedur APHA (1992).
2.3.2 Kandungan Nutrisi Bioflok
Analisa proksimat pada perlakuan bioflok dan perlakuan kontrol dilakukan pada hari ke 1 dan ke 84 dengan metode Kjehdal (Takeuchi, 1988) (Lampiran 4).
2.3.3 Volume Flok
Sebanyak 50 mL sampel air diendapkan selama 30 menit dalam tabung conical 50 mL. Volume flok yang mengendap dicatat dan selanjutnya dihitung dengan rumus :
Volume Flok (mL/L) = Vsampel air x 1000
Vendapan
2.3.4 Kualitas Air
Pengukuran DO dan suhu masing-masing dilakukan dengan menggunakan DO meter dan termometer, sedangkan pengukuran pH dengan pH meter. Alkalinitas, total amonia nitrogen, nitrit, nitrat, TSS, dan VSS diukur menggunakan prosedur dalam APHA (2005).
6
III. HASIL DAN PEMBAHASAN
3.1 Hasil
3.1.1 Komposisi Mikrooganisme Penyusun Bioflok
Komposisi mikroba penyusun bioflok yang diamati dalam penelitian ini meliputi kelimpahan dan jenis bakteri dalam air media pemeliharaan dan usus ikan nila, serta kelimpahan dan jenis plankton dalam air media pemeliharaan. 3.1.1.1 Kelimpahan dan Jenis Bakteri
Hasil pengamatan kelimpahan bakteri pada air media pemeliharaan ikan nila selama penelitian disajikan pada Gambar 1. Kelimpahan bakteri pada media pemeliharaan kedua perlakuan meningkat seiring dengan masa pemeliharaan. Pada perlakuan kontrol meningkat dari 2,1 x 104 CFU/mL menjadi 1,1 x 105 CFU/mL, sedangkan pada bioflok meningkat dari 2,1 x 104 CFU/mL menjadi 1,7 x 108 CFU/mL (Lampiran 5a).
Gambar 1. Kelimpahan bakteri dalam air media pemeliharaan dan pemijahan ikan nila Oreochromis niloticus pada perlakuan kontrol dan BFT pada hari ke 1 dan ke 84
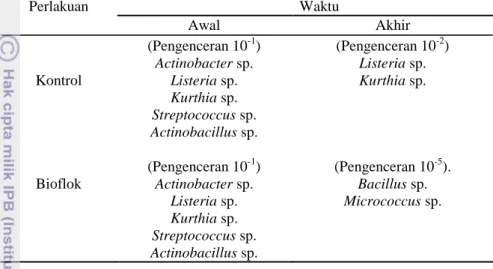
Hasil identifikasi terhadap isolat bakteri yang terdapat pada air media pemeliharaan (Tabel 1) diperoleh 7 jenis bakteri pada bioflok yaitu Actinobacter sp., Listeria sp., Kurthia sp., Streptococcus sp., Actinobacillus sp, Bacillus sp.,
Micrococcus sp., dan 5 jenis bakteri pada kontrol yaitu Actinobacter sp., Listeria
sp., Kurthia sp., Streptococcus sp., Actinobacillus sp.. Pada akhir masa pemeliharaan, bakteri yang tumbuh dominan pada kontrol yaitu Listeria sp. dan
Kurthia sp, sedangkan pada bioflok didominasi oleh bakteri Bacillus sp. dan
Micrococcus sp. Dari semua jenis bakteri yang berhasil diidentifikasi merupakan
4,33 4,33 5,05 8,25 0 1 2 3 4 5 6 7 8 9 AWAL AKHIR LO G (CFU /m L) Masa Pemeliharaan KONTROL BIOFLOK
7 dari kelompok bakteri heterotrof yaitu bakteri yang tumbuh dengan menggunakan karbon organik seperti molase sebagai sumber karbonnya.
Tabel 1. Hasil identifikasi bakteri dalam air media pemeliharaan dan pemijahan ikan nila Oreochromis niloticus pada perlakuan kontrol dan BFT pada hari ke 1 dan ke 84. Perlakuan Waktu Awal Akhir Kontrol (Pengenceran 10-1) Actinobacter sp. Listeria sp. Kurthia sp. Streptococcus sp. Actinobacillus sp. (Pengenceran 10-2) Listeria sp. Kurthia sp. Bioflok (Pengenceran 10-1) Actinobacter sp. Listeria sp. Kurthia sp. Streptococcus sp. Actinobacillus sp. (Pengenceran 10-5). Bacillus sp. Micrococcus sp.
Secara umum, kelimpahan bakteri pada usus ikan nila untuk semua perlakuan mengalami peningkatan. Pada akhir penelitian jumlah bakteri pada bioflok lebih tinggi dibandingkan dengan perlakuan kontrol. Jumlah bakteri pada perlakuan kontrol yaitu sekitar 2,26 x 105 CFU/g, sedangkan pada perlakuan bioflok 6,13 x 106 CFU/g (Gambar 2 dan Lampiran 5b).
Gambar 2. Kelimpahan bakteri dalam usus ikan nila Oreochromis niloticus pada perlakuan kontrol dan BFT pada hari ke 1 dan ke 84
Hasil identifikasi terhadap isolat bakteri yang terdapat pada usus ikan nila (Tabel 2) diperoleh 4 jenis bakteri pada bioflok yaitu Listeria sp., Arachnia sp.,
Rothia sp., Bacillus., sp. dan 5 jenis bakteri pada kontrol yaitu Listeria sp.,
Arachnia sp., Rothia sp., Bacillus sp., Streptobacillus sp. Secara umum, jenis
3,42 5,38 3,42 6,79 0 1 2 3 4 5 6 7 8 9 AWAL AKHIR L O G ( CF U/m L ) Masa Pemeliharaan KONTROL BIOFLOK
8 0 200 400 600 Kontrol Bioflok K el imp ah an ( x 10 4 se l/ L ) CyanophyceaeChlorophyceae Euglenophyceae Bacillariophyceae bakteri yang tumbuh pada kontrol lebih beragam dibanding bioflok. Pada akhir masa pemeliharaan, bakteri yang tumbuh dominan pada kontrol yaitu Listeria sp.,
Bacillus sp., dan Streptobacillus sp, sedangkan pada perlakuan bioflok hanya
didominasi oleh jenis Bacillus sp.
Tabel 2. Hasil identifikasi bakteri dalam usus ikan nila Oreochromis niloticus pada perlakuan kontrol dan BFT pada hari ke 1 dan ke 84.
Perlakuan Waktu Awal Akhir Kontrol (Pengenceran 10-2) Listeria sp. Arachnia sp. Rothia sp. (Pengenceran 10-3) Bacillus sp. Streptobacillus sp. Listeria sp. Bioflok (Pengenceran 10-2) Listeria sp. Arachnia sp. Rothia sp. (Pengenceran 10-4) Bacillus sp.
3.1.1.2 Kelimpahan dan Jenis Plankton 3.1.1.2.1 Kelimpahan dan Jenis Fitoplankton
Hasil pengamatan terhadap kelimpahan dan jenis fitoplankton ditunjukkan pada Gambar 3 dan Lampiran 6.
a. Tengah penelitian b. Akhir penelitian
Gambar 3. Kelimpahan fitoplankton dalam air media pemeliharaan dan pemijahan ikan nila Oreochromis niloticus pada perlakuan kontrol dan BFT pada hari ke 62 dan ke 84
Identifikasi jenis fitoplankton menunjukkan bahwa 4 kelompok fitoplankton yang terdapat dalam media pemeliharaan ikan nila baik perlakuan kontrol maupun bioflok yaitu Cyanophyceae, Chlorophyceae, Euglenophyceae, dan Bacillariophyceae (Lampiran 6). Adapun genus fitoplankton yang mendominasi perlakuan kontrol dan bioflok di akhir penelitian (Gambar 3b) adalah kelompok Cyanophyceae dari genus Microcystis sebanyak 4.967.296 sel/L.
0 200 400 600 Kontrol Bioflok K el im pa h a n ( x 10 4 s el /L ) Cyanophyceae Chlorophyceae Euglenophyceae Bacillariophyceae
9 Sedangkan pada perlakuan bioflok kelompok Chlorophyceae dari genus Scenedesmus sebanyak 1.936.804 sel/L.
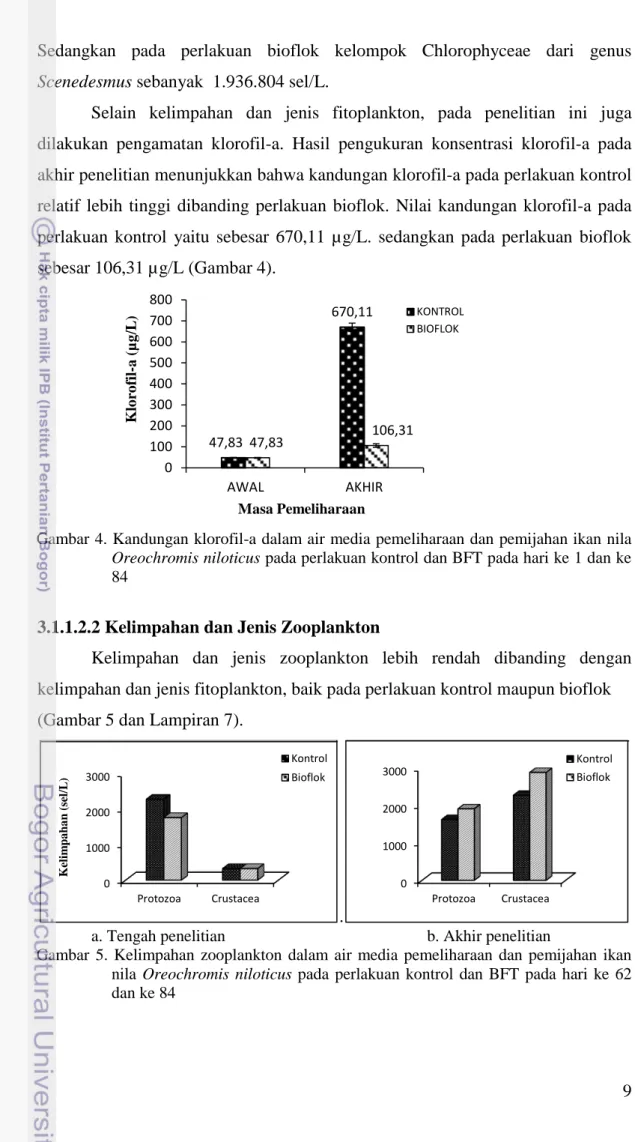
Selain kelimpahan dan jenis fitoplankton, pada penelitian ini juga dilakukan pengamatan klorofil-a. Hasil pengukuran konsentrasi klorofil-a pada akhir penelitian menunjukkan bahwa kandungan klorofil-a pada perlakuan kontrol relatif lebih tinggi dibanding perlakuan bioflok. Nilai kandungan klorofil-a pada perlakuan kontrol yaitu sebesar 670,11 µg/L. sedangkan pada perlakuan bioflok sebesar 106,31 µg/L (Gambar 4).
Gambar 4. Kandungan klorofil-a dalam air media pemeliharaan dan pemijahan ikan nila
Oreochromis niloticus pada perlakuan kontrol dan BFT pada hari ke 1 dan ke
84
3.1.1.2.2 Kelimpahan dan Jenis Zooplankton
Kelimpahan dan jenis zooplankton lebih rendah dibanding dengan kelimpahan dan jenis fitoplankton, baik pada perlakuan kontrol maupun bioflok (Gambar 5 dan Lampiran 7).
.
a. Tengah penelitian b. Akhir penelitian
Gambar 5. Kelimpahan zooplankton dalam air media pemeliharaan dan pemijahan ikan nila Oreochromis niloticus pada perlakuan kontrol dan BFT pada hari ke 62 dan ke 84 47,83 670,11 47,83 106,31 0 100 200 300 400 500 600 700 800 AWAL AKHIR K lo ro fil -a ( µg /L ) Masa Pemeliharaan KONTROL BIOFLOK 0 1000 2000 3000 Protozoa Crustacea Kel im p a h a n ( sel /L ) Kontrol Bioflok 0 1000 2000 3000 Protozoa Crustacea Kontrol Bioflok
10 Ada dua kelompok zooplankton yang diidentifikasi dari air pemeliharaan baik pada perlakuan kontrol maupun perlakuan bioflok yaitu protozoa dan crustacea. Dari dua kelompok zooplankton ini, baik pada perlakuan kontrol maupun bioflok lebih didominasi oleh kelompok protozoa pada tengah penelitian (Gambar 5a dan Lampiran 7). Pada akhir penelitian, jumlah tertinggi protozoa terdapat pada perlakuan kontrol yang didominasi oleh Nebela sp sebanyak 975 sel/L. Jumlah zooplankton terendah dari kelompok crustacean pada tengah penelitian terdapat pada kedua perlakuan yaitu sebanyak 325 sel/L. Namun, pada akhir penelitian jumlah zooplankton kelompok crustacea meningkat lagi terutama pada perlakuan bioflok yaitu sebanyak 975 sel/L.
3.1.2 Kandungan Nutrisi Bioflok
Komposisi proksimat bioflok pada akhir masa pemeliharaan disajikan pada Tabel 3.
Tabel 3. Komposisi proksimat bioflok dan kontrol dalam air media pemeliharaan dan pemijahan ikan nila Oreochromis niloticus pada perlakuan kontrol dan BFT pada hari ke 84.
Komposisi Nutrisi (%) Perlakuan Kontrol Bioflok Protein 34,31 ± 0,92 37,37 ± 0,20 Lemak 11,02 ± 0,96 11,88 ± 0,08 Serat Kasar 17,31 ± 0,56 16,01 ± 0,48 Kadar Abu 23,31 ± 0,96 17,7 ± 0,47
Berdasarkan Tabel 4 dapat diketahui bahwa perlakuan bioflok memiliki kandungan protein dan lemak yang lebih tinggi dibanding perlakuan kontrol. Jumlah protein yang terdapat pada perlakuan bioflok yaitu sebesar 37,37% dan lemak sebesar 11,88%, sedangkan pada perlakuan kontrol sebesar 34,31% dan 11,02%.
3.1.3 Total Suspended Solid, Volatile Suspended Solid, Volume Flok
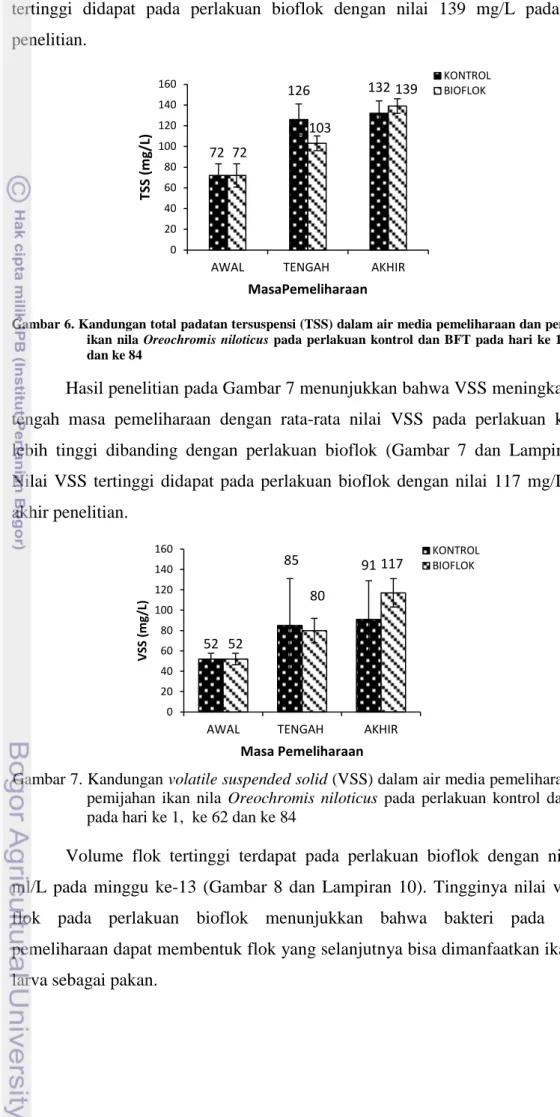
Hasil penelitian menunjukkan bahwa nilai TSS meningkat pada tengah masa pemeliharaan dengan rata-rata nilai TSS pada perlakuan kontrol lebih tinggi dibanding dengan perlakuan bioflok (Gambar 6 dan Lampiran 8). Nilai TSS
11 72 126 132 72 103 139 0 20 40 60 80 100 120 140 160
AWAL TENGAH AKHIR
TS S (m g/ L) MasaPemeliharaan KONTROL BIOFLOK 52 85 91 52 80 117 0 20 40 60 80 100 120 140 160
AWAL TENGAH AKHIR
V SS ( mg /L ) Masa Pemeliharaan KONTROL BIOFLOK
tertinggi didapat pada perlakuan bioflok dengan nilai 139 mg/L pada akhir penelitian.
Gambar 6. Kandungan total padatan tersuspensi (TSS) dalam air media pemeliharaan dan pemijahan ikan nila Oreochromis niloticus pada perlakuan kontrol dan BFT pada hari ke 1, ke 62 dan ke 84
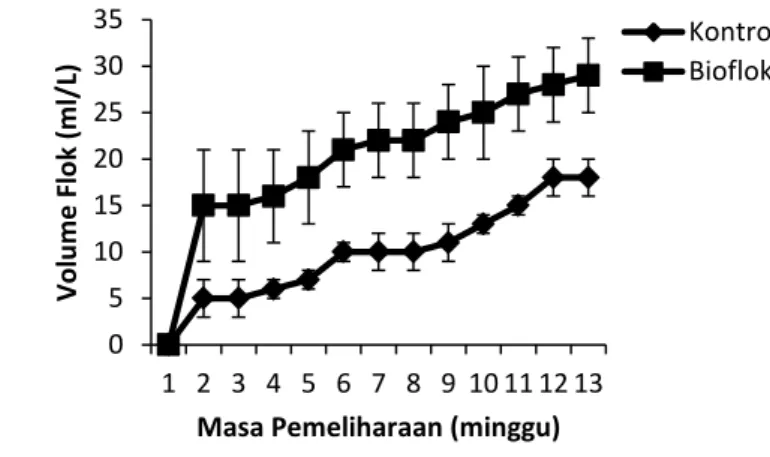
Hasil penelitian pada Gambar 7 menunjukkan bahwa VSS meningkat pada tengah masa pemeliharaan dengan rata-rata nilai VSS pada perlakuan kontrol lebih tinggi dibanding dengan perlakuan bioflok (Gambar 7 dan Lampiran 9). Nilai VSS tertinggi didapat pada perlakuan bioflok dengan nilai 117 mg/L pada akhir penelitian.
Gambar 7. Kandungan volatile suspended solid (VSS) dalam air media pemeliharaan dan pemijahan ikan nila Oreochromis niloticus pada perlakuan kontrol dan BFT pada hari ke 1, ke 62 dan ke 84
Volume flok tertinggi terdapat pada perlakuan bioflok dengan nilai 29 ml/L pada minggu ke-13 (Gambar 8 dan Lampiran 10). Tingginya nilai volume flok pada perlakuan bioflok menunjukkan bahwa bakteri pada kolam pemeliharaan dapat membentuk flok yang selanjutnya bisa dimanfaatkan ikan dan larva sebagai pakan.
12 0 5 10 15 20 25 30 35 1 2 3 4 5 6 7 8 9 10 11 12 13 Vo lu m e Fl o k (m l/ L)
Masa Pemeliharaan (minggu)
Kontrol Bioflok
Gambar 8. Volume flok dalam air media pemeliharaan dan pemijahan ikan nila
Oreochromis niloticus pada perlakuan kontrol dan BFT
3.1.4 Kualitas Air
Parameter kualitas air yang diamati dalam penelitian ini yaitu suhu, DO, pH, TAN, nitrat, nitrit, dan alkalinitas (Tabel 4).
Tabel 4. Kualitas air dalam air media pemeliharaan dan pemijahan ikan nila Oreochromis niloticus pada perlakuan kontrol dan BFT.
Perlakuan
Parameter Kualitas Air Suhu (oC) DO (mg/l) pH TAN (mg/l) Nitrat (mg/l) Nitrit (mg/l) Alkalinitas (mg/l) Kontrol 27,8-32,0 4,7-6,6 7,28-8,29 0,169-1,000 0,361-1,796 0,01-1,246 88-702 Bioflok 27,8-32,2 3,6-6,5 7,39-8,13 0,146 -0,847 0,111-0,956 0,023-1,025 94-846
Hasil pengamatan kualitas air menunjukkan bahwa semua parameter kualitas air selama pemeliharaan secara umum masih dalam kisaran optimal bagi ikan nila Oreochromis niloticus, kecuali nilai konsentrasi TAN. Nilai TAN tertinggi terdapat pada perlakuan kontrol dengan nilai 1,00 mg/L pada minggu ke 6, sedangkan nilai TAN terendah terdapat pada perlakuan bioflok pada minggu ke 13 dengan nilai 0,15 mg/L (Gambar 9a dan Lampiran 11).
Hasil pengamatan terhadap kandungan nitrit nitrogen pada air media pemeliharaan yang ditunjukkan pada Gambar 9b dan Lampiran 11 memperlihatkan bahwa nilai nitrit nitrogen semakin menurun hingga akhir penelitian. Secara umum nilai nitrit nitrogen perlakuan bioflok cenderung lebih rendah dibandingkan kontrol. Nilai nitrit tertinggi dan terendah terdapat pada perlakuan kontrol dengan nilai 1,25 mg/L dan 0,01 mg/L.
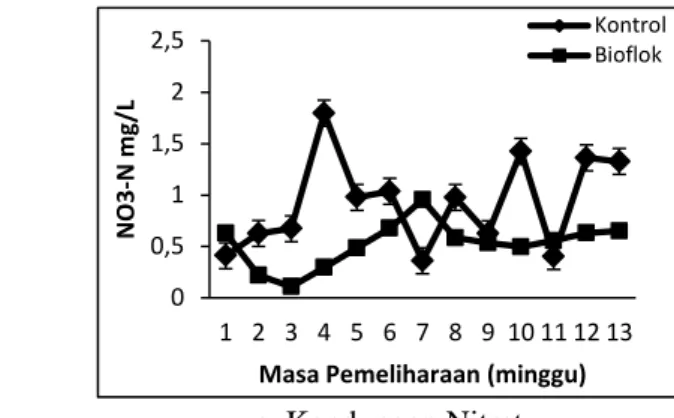
Hasil pengamatan terhadap nilai nitrat nitrogen air media pemeliharaan menunjukkan bahwa konsentrasi nitrat pada perlakuan kontrol lebih berfluktuatif dibanding perlakuan bioflok. Nilai nitrat tertinggi terdapat pada perlakuan kontrol
13 0 0,5 1 1,5 1 2 3 4 5 6 7 8 9 10 11 12 13 N O 2 -N ( mg /L )
Masa Pemeliharaan (minggu) Kontrol Bioflok
dengan nilai 1,80 mg/L pada minggu ke 4, sedangkan nilai nitrat terendah terdapat pada perlakuan bioflok dengan nilai 0,11 mg/L pada minggu ke 3 (Gambar 9c dan Lampiran 11).
Hasil pengamatan terhadap nilai pH air media menunjukkan bahwa nilai pH perlakuan bioflok dan kontrol cenderung sama hingga akhir penelitian. Nilai pH pada perlakuan kontrol berkisar antara 7,28-8,29, dan pada perlakuan bioflok berkisar antara 7,39-8,13 (Tabel 4 dan Lampiran 11) .
Hasil pengukuran suhu air menunjukkan bahwa suhu air media pada kedua perlakuan cenderung sama hingga akhir penelitian. Nilai suhu pada perlakuan kontrol berkisar antara 27,8-32,0oC, dan pada perlakuan bioflok berkisar antara 27,8-32,2 oC (Tabel 4 dan Lampiran 11).
Nilai DO untuk kedua perlakuan pada Tabel 4 dan Lampiran 11 menunjukkan bahwa selama pemeliharaan terjadi fluktuasi DO dengan kisaran 3,6-6,6 mg/L. Nilai DO perlakuan bioflok cenderung lebih rendah dibanding perlakuan kontrol hingga akhir penelitian. Nilai DO tertinggi terdapat pada perlakuan kontrol dengan nilai 6,6 mg/L pada minggu ke 12, sedangkan nilai DO terendah terdapat pada perlakuan bioflok dengan nilai 3,3 mg/L pada minggu ke 13.
Hasil pengamatan alkalinitas air media pemeliharaan pada kedua perlakuan menunjukkan perbedaan nyata (Tabel 4 dan Lampiran 11). Nilai alkalinitas pada perlakuan bioflok cenderung lebih tinggi dibanding perlakuan kontrol. Nilai alkalinitas pada perlakuan kontrol berkisar antara 88-702 mg/L, sedangkan pada perlakuan bioflok berkisar antara 94-846 mg/L.
a. Kandungan TAN b. Kandungan Nitrit
0 0,5 1 1,5 1 2 3 4 5 6 7 8 9 10 11 12 13 TA N ( mg /L )
Masa Pemeliharaan (minggu) Kontrol Bioflok
14 0 0,5 1 1,5 2 2,5 1 2 3 4 5 6 7 8 9 10 11 12 13 N O 3 -N mg /L
Masa Pemeliharaan (minggu) Kontrol Bioflok
c. Kandungan Nitrat
Gambar 9. Kualitas air dalam air media pemeliharaan dan pemijahan ikan nila Oreochromis niloticus pada perlakuan kontrol dan BFT
3.2 Pembahasan
Bakteri memegang peranan penting dalam dekomposisi nutrien organik di dalam kegiatan produksi akuakultur dan sedimen tambak (Hargreaves, 1998). Berdasarkan Gambar 1 dapat dilihat bahwa jumlah bakteri pada kedua perlakuan cenderung meningkat seiring dengan masa pemeliharaan. Pada perlakuan kontrol meningkat dari 2,1 x 104 CFU/mL menjadi 1,1 x 105 CFU/mL, sedangkan pada bioflok meningkat dari 2,1 x 104 CFU/mL menjadi,7 x 108 CFU/mL. Tingginya jumlah bakteri pada perlakuan bioflok pada akhir penelitian diduga karena adanya penambahan molase yang dilakukan secara terus-menerus hingga akhir pemeliharaan. Zhu dan Chen (2001) juga menyatakan bahwa bakteri heterotrof dominan pada sistem bioflok karena proses nitrifikasi dihambat oleh penambahan karbon organik sehingga penambahan pakan berbahan baku biji-bijian dan molase dapat meningkatkan pertumbuhan bakteri heterotrof dan membatasi nitrifikasi. Molase merupakan salah satu jenis sumber karbon yang dapat menstimulus pertumbuhan bakteri heterotrof (De Schryver et al., 2009). Liu dan Han (2004) menyatakan bahwa pertumbuhan bakteri dibatasi oleh keseimbangan nutrien dalam air. Nutrien yang diduga membatasi pertumbuhan bakteri dalam lingkungan budidaya adalah karbon. Bakteri heteretrof yang dominan di ekosistem kolam, ditandai dengan pembentukan suspensi berupa gumpalan flok secara kualitatif lebih menguntungkan, dengan stabilisasi pH (Widanarni et al., 2012). McIntosh (2001) dan Aiyushirota (2010) menyatakan bahwa beberapa faktor kunci pengembangan sistem heterotrof dalam budidaya yaitu: (1) padat tebar tinggi, (2) aerasi cukup untuk mempertahankan pengadukan air, dan (3) input bahan organik
15 yang tinggi yang akan dimanfaatkan sebagai sumber makanan oleh ikan dan bakteri, serta dapat menciptakan keseimbangan nutrien yang dibutuhkan bakteri seperti karbon dan nitrogen.
Secara umum, jenis bakteri yang berhasil diidentifikasi merupakan kelompok bakteri heterotrof yaitu bakteri yang tumbuh dengan menggunakan karbon organik seperti molase sebagai sumber karbonnya. Sterrit dan Lester (1988) menyatakan bahwa genus Bacillus merupakan salah satu kelompok bakteri heterotrof jenis mayor yang ditemukan sebagai penyusun flok dalam lumpur aktif (bioflok), sedangkan genus Micrococcus merupakan jenis bakteri heterotrof minor yang ada dalam bioflok.
Secara umum, kelimpahan bakteri pada usus ikan nila untuk semua perlakuan mengalami peningkatan seiring dengan masa pemeliharaan. Pengamatan kelimpahan bakteri pada usus ikan nila bertujuan untuk mengetahui jenis bakteri yang mendominasi usus ikan tersebut. Pada akhir penelitian jumlah bakteri di usus pada bioflok lebih tinggi dibandingkan dengan perlakuan kontrol. Jumlah bakteri pada perlakuan kontrol yaitu sekitar 2,26 x 105CFU/g, sedangkan pada perlakuan bioflok 6,13 x 106 CFU/g (Gambar 2). Tingginya jumlah bakteri pada perlakuan bioflok ini diduga pada perlakuan bioflok, ikan lebih banyak memanfaatkan flok sebagai sumber makanan dibanding dengan perlakuan kontrol. De Schryver et al. (2008) menyatakan bahwa biomassa bakteri heterotrof dapat membentuk agregat (flok) bersama dengan mikroba lain, yang selanjutnya dapat dimanfaatkan oleh organime budidaya. Bioflok mengandung protein, asam lemak tak jenuh, dan lipid yang tinggi (Tabel 3) sehingga cocok digunakan sebagai pakan untuk ikan. Bioflok juga dapat dikatakan sebagai SCP (Single Cell Protein). Menurut El-Sayed (1999), SCP dapat dipertimbangkan sebagai alternatif sumber protein bagi spesies ikan karena mengandung nutrisi dan dapat diproduksi dengan biaya murah. SCP terdiri dari mikroorganisme berupa unicellular alga, fungi, bakteri, cyanobacteria dan yeast. Eksperimen yang dilakukan oleh Avnimelech (1999), pemanfaatan protein oleh ikan pada sistem intensif bioflok hampir dua kali lipat lebih tinggi daripada penggunaan protein pada sistem akuakultur intensif secara konvensional disebabkan pengembalian ekskresi nitrogen menjadi protein mikroba.
16 Hasil identifikasi bakteri pada kedua perlakuan menunjukkan bahwa bakteri yang tumbuh dominan pada usus ikan kontrol yaitu Listeria sp., Bacillus sp., dan Streptobacillus sp., sedangkan pada perlakuan bioflok usus ikan hanya didominasi oleh jenis Bacillus sp. Hal ini menunjukkan bahwa ikan nila pada perlakuan bioflok memang benar memanfaatkan bioflok sebagai pakan ikan. Aiyushirota (2010) menyatakan bahwa Bacillus mampu menyeimbangkan mikroflora dalam usus yaitu untuk menekan bakteri yang merugikan dan meningkatkan kekebalan tubuh pada udang dan ikan.
Hasil pengamatan terhadap kelimpahan dan jenis fitoplankton menunjukkan bahwa tingginya kandungan klorofil-a pada kontrol sejalan dengan tingginya kelimpahan fitoplankton pada perlakuan tersebut (Gambar 3 dan Lampiran 6). Hal ini sesuai dengan penelitian yang dilakukan Widanarni et al. (2012) bahwa konsentrasi klorofil-a pada kontrol relatif lebih tinggi dibanding perlakuan bioflok.
Hasil pengamatan mikroskopis menunjukkan bahwa tampak plankton yang mengumpul bersama dengan bakteri pada perlakuan bioflok (Gambar 10). Avnimelech (2007) menyatakan bahwa pada kolam dengan sistem bioflok, bakteri heterotrof dan alga ditumbuhkan bersama-sama dalam flok di bawah kondisi terkontrol pada kolam budidaya dengan minimal pertukaran air.
(a). Scenedesmus sp.
(b). Pediastrum sp.
Gambar 10. Mikrograf bioflok yang diambil dari media pemeliharaan induk ikan nila
Oreochromis niloticus dengan aplikasi teknologi bioflok pada hari ke 14
(perbesaran 100 x). Tanda panah menunjukkan mikroalga yang terdapat dalam bioflok (a) Scenedesmus sp., (b) Pediastrum sp..
17 Menurut Nybakken (1988), di dalam kolom perairan, kuantitas dan kualitas fitoplankton selalu berubah-ubah sesuai dengan kondisi lingkungan hidupnya seperti suhu, salinitas, cahaya matahari, pH, kekeruhan, dan konsentrasi unsur hara serta berbagai senyawa lainnya. Jenis fitoplankton yang mendominasi perlakuan kontrol di akhir penelitian (Gambar 4b dan Lampiran 6) adalah kelompok Cyanophyceae dari spesies Microcystis sp.. Pada kondisi blooming ini
Microcystis dapat menghasilkan racun yang disebut microcystin. Microcystin
mempunyai sifat toksik tinggi baik terhadap tumbuhan maupun hewan sampai dapat menyebabkan kematian. Toksisitas Microcystis aeruginosa pada ikan ditandai dengan adanya perubahan histopatologi pada hati dan usus (Barnes & Mann, 1991; Retnaningdyah et al., 2007). Hati mempunyai peranan dalam sintesis material yang akan diakumulasikan pada ovarium saat siklus reproduksi (Ishibashi et al., 1994), oleh karena itu dapat dikatakan bahwa microcystin ini secara tidak langsung dapat menghambat sistem reproduksi pada ikan.
Pada perlakuan bioflok juga ditemukan fitoplankton yang didominasi oleh kelompok Chlorophyceae dari spesies Scenedesmus sp. sebanyak 1.936.804 sel/L. Rendahnya pertumbuhan fitoplankton pada perlakuan bioflok diduga karena adanya kompetisi nutrien antara bakteri dan fitoplankton. Kecepatan bakteri dalam mengambil nutrien lebih tinggi dibanding fitoplankton (Bolter et al., 2007). Secara alami, plankton berkumpul diantara bakteri dan nanoflagellata heterotrof kira-kira 10-70% di bawah kolom air (Bloem et al., 1989). Faktor-faktor pembatas penting bagi kehidupan penting fitoplankton diantaranya: sinar matahari, nutrient terpakai, dan pemangsaan (Basmi, 1995).
Kelompok zooplankton yang diidentifikasi pada perlakuan bioflok maupun kontrol yaitu protozoa dan crustacean. Secara umum, kelimpahan zooplankton pada perlakuan kontrol cenderung lebih rendah dibanding perlakuan bioflok. Davis (1995) menjelaskan dalam salah satu teori penting yang dapat menggambarkan hubungan terbalik antara fitoplankton dengan zooplankton, yaitu theory of animal exclusion, atau teori penyingkiran hewan. Teori ini menyatakan bahwa selama zooplankton melakukan migrasi vertikal harian akan menemui hambatan untuk mencapai permukaan jila berjumpa dengan populasi fitoplankton
18 yang sangat padat. Hal ini diduga karena fitoplankton menghasilkan suatu zat kimia sehingga zooplankton tidak bisa mendekati.
Hasil pengamatan terhadap kandungan nutrisi bioflok yang tumbuh pada air media pemeliharaan ikan antara perlakuan bioflok dan kontrol menunjukkan hasil yang hampir sama yaitu protein sebesar 37,37% dan lemak sebesar 11,88%, sedangkan pada perlakuan kontrol yaitu protein sebesar 34,31% dan lemak sebesar 11,02%. Hal ini sesuai dengan pernyataan De schryver et al. (2008) yang menyatakan bahwa bioflok mengandung protein, asam lemak tak jenuh, dan lipid yang tinggi sehingga cocok digunakan sebagai pakan untuk ikan. Pakan ikan umumnya mengandung protein 10-50%, lipid 10-25%, karbohidrat 15-20%, abu <8,5%, fosfor <1,5%, air kurang dari <10%, dan sedikit vitamin dan mineral. Demikian juga bioflok mengandung protein, asam lemak tak jenuh, dan lipid yang tinggi sehingga cocok digunakan sebagai pakan untuk ikan.
Padatan tersuspensi total (TSS) merupakan sejumlah bahan partikulat yang berada dalam air. Hasil penelitian menunjukkan bahwa nilai TSS semakin meningkat seiring dengan masa pemeliharaan. Nilai TSS tertinggi terdapat pada perlakuan bioflok dengan nilai 139 mg/L. Menurut De Schryver et al. (2008), nilai TSS pada teknologi bioflok dianjurkan berkisar 200-1000 mg/L. Namun, pada penelitian ini nilai TSS masih berada di bawah kisaran yang dianjurkan. Tingginya nilai TSS pada perlakuan bioflok dibanding dengan perlakuan kontrol diduga dikarenakan adanya penambahan molase sebagai sumber karbon yang menyebabkan lebih banyak koloni bakteri di air. Hal ini sesuai dengan penelitian yang dilakukan oleh Azim dan Little (2008) tentang budidaya ikan nila berbasis bioflok pada kolam indoor dimana nilai TSS pada kolam bioflok sebesar 597 mg/L dan kolam kontrol tanpa bioflok sebesar 16 mg/L.
Menurut Schneider et al. (2006), VSS merupakan hasil produksi bakteri yang produksinya dapat dihambat oleh keterbatasan nutrien seperti N dan P. Nilai VSS meningkat bersamaan dengan peningkatan pemberian sumber karbon pada media pemeliharaan ikan. Meskipun belum ada data yang dapat dianjurkan pada budidaya berbasis bioflok namun VSS dijadikan sebagai parameter utama dan penting bagi keberadaan bioflok pada sistem budidaya dengan teknologi bioflok (De Schryver et al., 2008). Hasil penelitian pada Gambar 7 dan Lampiran 9
19 menunjukkan bahwa nilai VSS semakin meningkat seiring dengan masa pemeliharaan. Nilai VSS tertinggi terdapat pada perlakuan bioflok dengan nilai 117 mg/L.
Volume flok merupakan salah satu indikator terjadinya flokulasi pada media pemeliharaan. Volume flok adalah jumlah padatan tersuspensi selama periode waktu tertentu pada wadah kerucut terbalik (Effendi, 2003). Gambar 8 dan Lampiran 10 menunjukkan bahwa volume flok pada perlakuan bioflok lebih tinggi dibanding dengan kontrol. Volume flok tertinggi terdapat pada perlakuan bioflok dengan nilai 29 ml/L pada minggu ke-13. Tingginya nilai volume flok pada perlakuan bioflok menunjukkan bahwa bakteri pada kolam pemeliharaan dapat membentuk flok yang selanjutnya bisa dimanfaatkan ikan sebagai pakan.
Hasil pengamatan kualitas air menunjukkan bahwa terjadi fluktuasi konsentrasi TAN selama pemeliharaan terutama pada perlakuan kontrol. Nilai tertinggi TAN terdapat pada perlakuan kontrol pada minggu ke 6 yaitu 1 mg/L. Sedangkan nilai terendah terdapat pada perlakuan bioflok pada minggu ke 13 dengan nilai 0,146 mg/L. Tingginya nilai TAN pada perlakuan kontrol diduga diakibatkan oleh akumulasi sisa pakan dan feses pada bak pemeliharaan. Sedangkan rendahnya nilai TAN pada perlakuan bioflok diduga dikarenakan TAN yang merupakan hasil dari dekomposisi pakan yang tidak termakan, feses serta ekskresi ikan, selain dimanfaatkan oleh bakteri nitrifikasi dan denitrifikasi yang mengkonversi TAN menjadi nitrit, nitrat, dan gas N2, juga dimanfaatkan oleh bakteri flok. Adanya penambahan bahan berkarbon pada perlakuan bioflok, akan mendorong pemanfaatan nitrogen yang terdapat dalam kolam budidaya oleh bakteri untuk memproduksi protein mikroba yang selanjutnya dapat dimanfaatkan oleh ikan. Penambahan bahan berkarbon ini terbukti mampu mengurangi nitrogen anorganik dan menggantikan protein pakan (Avnimelech, 1999).
Hasil pengamatan terhadap kandungan nitrit nitrogen pada media pemeliharaan cenderung berfluktuatif. Namun, secara umum nilai nitrit nitrogen pada perlakuan bioflok cenderung lebih rendah dibandingkan kontrol (Lampiran 11b). Hal ini karena teknologi bioflok berdasar pada konversi secara langsung amonia-nitrogen perairan oleh bakteri heterotrof menjadi biomassa atau protein mikroba (Ebeling et al., 2006). Adanya nitrit nitrogen pada perlakuan bioflok
20 mengindikasikan adanya proses nitrifikasi yang berlangsung dalam sistem budidaya.
Nitrat merupakan produk akhir dari proses nitrifikasi dan akan bersifat toksik pada konsentrasi di atas 300 ppm (Masser et al., 1999) . Hasil pengamatan terhadap kandungan nitrat nitrogen air media pemeliharaan ikan selama penelitian menunjukkan bahwa konsentrasi nitrat nitrogen pada perlakuan kontrol lebih berfluktuasi dibanding perlakuan bioflok (Lampiran 11c). Konsentrasi nitrat dan nitrit menunjukkan hubungan yang saling berlawanan, dimana saat nitrit rendah maka nitrat tinggi. Hal ini menunjukkan berlangsungnya proses nitrifikasi oleh bakteri yang mengoksidasi amonia menjadi nitrit dan nitrat. Proses nitrifikasi lebih banyak terjadi pada sistem autotrofik. Avnimelech (1999) menyatakan bahwa dengan adanya penambahan bahan organik dengan rasio C/N bahan organik lebih besar dari 10 akan menyebabkan pertukaran sistem autotrofik menjadi sistem heterotrofik.
Hasil pengukuran nilai pH air pada media pemeliharaan menunujukkan bahwa terjadi fluktuasi nilai pH pada kedua perlakuan. Nilai pH pada perlakuan kontrol berkisar antara 7,28 - 8,29, sedangkan pada perlakuan bioflok berkisar antara 7,39 – 8,13 (Lampiran 11f). Menurut Popma dan Masser (1999), umumnya ikan nila dapat hidup pada kisaran pH 5-10, tetapi untuk pertumbuhan terbaik yaitu pada kisaran pH 6-9. Hal ini menunjukkan bahwa pH air masih layak untuk kelangsungan hidup dan pertumbuhan ikan nila.
Hasil pengukuran suhu air pada semua bak perlakuan tidak menunjukkan perbedaan (Tabel 5 dan Lampiran 11e) dan berada dalam batas yang layak bagi pertumbuhan ikan nila. Menurut Hepher and Pruginin (1981), bahwa suhu yang optimal untuk budidaya ikan nila berkisar antara 25oC sampai dengan 32oC. Pengaruh suhu pada kolam bioflok relatif lebih komplek. Selain berpengaruh terhadap laju metabolisme bakteri, suhu juga mempengaruhi kelarutan oksigen dalam air, semakin meningkatnya suhu maka kelarutan oksigen akan semakin menurun.
Oksigen terlarut memegang peranan penting dalam sistem budidaya terutama pada sistem budidaya intensif yang menerapkan teknologi bioflok. Hasil pengukuran nilai DO pada semua bak perlakuan menunjukkan bahwa nilai DO
21 pada perlakuan kontrol cenderung lebih tinggi dibanding perlakuan bioflok. Popma dan Masser (1999) menyatakan bahwa kisaran DO selama pemeliharaan ikan nila diusahakan diatas 2,0-2,5 mg/L.
Hasil pengukuran alkalinitas pada semua bak perlakuan menunjukkan perbedaan (Tabel 5 dan Lampiran 11g). Nilai alkalinitas pada perlakuan bioflok cenderung lebih tinggi dibanding perlakuan kontrol. Menurut Mackay dan Van Toever (1981), adanya proses nitrifikasi akan diikuti pula oleh adanya penurunan nilai alkalinitas yang akan menurunkan pH. Hal ini disebabkan karena adanya proses nitrfikasi dari amonia oleh bakteri yang memanfaatkan sumber karbon akan membangun ion hidrogen, sehingga akan menurunkan nilai alkalinitas.
22
IV. KESIMPULAN
4.1 Kesimpulan
Kelimpahan bakteri dan plankton pada perlakuan bioflok cenderung meningkat seiring dengan masa pemeliharaan. Hasil identifikasi terhadap isolat bakteri yang terdapat pada media air pemeliharaan induk ikan nila diperoleh 7 jenis bakteri pada bioflok yaitu Actinobacter sp., Listeria sp., Kurthia sp.,
Streptococcus sp., Actinobacillus sp., Bacillus sp., dan Micrococcus sp.. Jenis
fitoplankton yang mendominasi perlakuan bioflok adalah kelompok Chlorophyceae dari spesies Scenedesmus sp. Bioflok memiliki komposisi proksimat yang cukup memadai sebagai sumber pakan ikan.
23
DAFTAR PUSTAKA
Agustinus F. 2010. Pemanfaatan bioflok sebagai pakan dan stimulus imun dalam budidaya super-intensif ikan nila merah (Oreochromis sp.) di kolam air tenang [tesis]. Bogor : Program Pascasarjana, Institut Pertanian Bogor. 69 hal.
Aiyushirota. 2010. Sistem budidaya akuakultur CV Aiyushirotabiota Indonesia. http://www.Aiyushirota.com. [21 Juli 2012].
American Public Health Association (APHA). 1989. Standar methods for examination of water and waste water, 17th ed. Washington, DC: American Public Health Association.
American Public Health Association (APHA). 1992. Standar methods for examination of water and waste water, 18th ed. Washington, DC: American Public Health Association.
American Public Health Association (APHA). 2005. Standar methods for examination of water and waste water, 21th ed. Washington, DC: American Public Health Association.
Avnimelech Y. 1999. Carbon/nitrogen ratio as a control element in aquaculture systems. Aquaculture 176: 227-178.
Avnimelech Y. 2007. Feeding with microbial flocs by tilapia in minimal discharge bio-flocs technology ponds. Aquaculture 264: 140-147.
Azim ME, Little DC. 2008. The biofloc technology (BFT) in indoor tanks: water quality, biofloc composition, and growth and welfare of Nile tilapia (Oreochromis niloticus). Aquaculture 283: 29-35.
Barnes RSK, Mann KH. 1991. Fundamentals of aquatic ecology. Blackwell Science. London. 270 Hal.
Basmi J. 1995. Planktonogi. Produksi Primer. Fakultas Perikanan. Institut Pertanian Bogor. 35 Hal.
Bloem J. Ellenbroek FM, Bar-Gillissen MJB, Cappenberg TE. 1989. Protozoan grazing and bacterial production in stratified Lake Vechten estimated with fluorescently labeled bacteria and by Thymidine incorporation. Applied Environmental Biology 55: 1787-1795.
Bolter M, Rheinheimer G R. 2007. Numerical Analysis of Microbial and chemical characters and saprophytic bacteria from the Baltic Sea. Botanica Marina 30: 535-544.
24 Cowan S, Steel K. 1974. Manual for the identification of medical bacteria second
edition. Cambrige. Cambrige University Press. 161-180p.
Davis CC. 1955. The marine and freshwater plankton. Michigan State University Press, USA. 562 hal.
De Schryver P, Crab R, Defoirdt T, Boon N, Verstraete W. 2008. The basics of bio-flocs technology: The added value for aquaculture. Aquaculture 277: 125-137.
De Schryver P, Verstraete W. 2009. Nitrogent removal from aquaculture pond water by heterotrophic nitrogen assimilation: in lab-scale sequencing batch reactors. Bioresource Tecnology 100: 1162-1167.
Ebeling JM, Timmons MB, Bisogni JJ. 2006. Engineering analysis of the stoichiometry of photoautotrophic, autotrophic, and heterotrophic removal of ammonia-nitrogen in aquaculture systems. Aquaculture 257: 346-358.
Effendi, H. 2003. Telaah kualitas air bagi pengelolaan sumber daya dan lingkungan. Kanisius. Yogyakarta. 257 hal.
El-sayed AFM. 1999. Alternative dietary protein sources for farmed tilapia Oreochromis sp. Aquaculture 179: 149-168.
Emerenciano M, Cuzon G, Goguenheim J, Gaxiola G. 2011. Floc contribution on spawning performance of blue shrimp Litopenaeus stylirostris. Aquaculture Research: 1-11.
Hagreaves JA. 2006. Photosynthetic suspended-growth system in aquaculture. Aquaculture 34: 344-363.
Hepher B, Pruginin Y. 1981. Commercial fish farming: with special reference to fish culture in Israel. New York.
Ishibashi YK, Kaito, Ikeda S. 1994. Effect of dietary ascorbic acid supplementation on gonadal maturation in Japanese parrot fish. Suisanzoshoku 42: 279-285.
Kementrian Kelautan dan Perikanan (KKP). 2012. Rencana strategis kementrian kelautan dan perikanan 2010-2014. Jakarta.
Liu F, Han W. 2004. Reuse strategy of wastewater in prawn nursery by microbial remediation. Aquaculture 230: 281-296.
Mackay KT, W. Van Toever. 1981. An ecological approach to a water recirculating system for salmonids: Preliminary Experience. Engineering Symposium for fish culture. 249-258 p.
25 Masser MP, James R, Thomas ML. 1999. Recirculating aquaculture tank production systems, management of recirculating systems. southern regional aquaculture center No. 452.
McIntosh RP. 2001. Changing paradigms in shrimp farming : Establishment of heterotrophic bacterial communities. Global Aquaculture Alliance.
Nybakken JW. 1988. Suatu pendekatan ekologis. Alih Bahasa : M.Eidman, Koesoebiono DG, Bengen, dan M.Hutomo. Jakarta : Gramedia.
Poernomo. 2009. Potensi ikan nila. http://www.potensiikannila/harianpagipadang ekspres.htm [30 Januari 2012].
Popma T, Masser M. 1999. Tilapia life history and biology. Southern Regional Aquaculture Center Publication No. 283.
Retnaningdyah C, Marwati U, Harnanto A, Samino S. 2007. Usaha peningkatan bioremediasi untuk pengendalian blooming cyanobacteria Microcystis spp. di perairan tawar. Laporan penelitian Program Insentif Riset Terapan. Penelitian dengan biaya Ristek.
Schneider O, Sereti V, Eding EH, Verreth JAJ. 2006. Molasses as C source for heterotrophic bacteria production on solid fish water. Aquaculture 261: 1239-1248.
Sterrit RM, Lester JN. 1988. Microbiology for environmental and public health engineers. Great Britian: Edmundsbury Press Ltd.
Takeuchi.1988. Labrotarywork-chemical evaluation of dietary nutriens. P.179-233, in Watanabe (Ed) Fish Nutrition And Marinculture. Kanagawa International fisheries Training. Japan: Japan International Cooperation Agency (JICA).
Widanarni, Ekasari J, Maryam S. 2012. Evaluation of biofloc technology application on water quality and production performance of red tilapia Oreochromis sp. cultured at different stocking densities. Hayati Journal of Biosciences 19: 73-80.
Zhu S, Chen S. 2001. Effects of organic carbon on nitrification rate in fixed film biofilters. Aquaculture Engineering 25: 1-11.
26
27 Lampiran 1. Prosedur Penambahan Karbon (Molase)
Penambahan karbon organik pada media budidaya dilakukan dengan mengadopsi perhitungan yang dilakukan oleh Avnimelech (1999). Kontrol akumulasi nitrogen anorganik di kolam dapat dilakukan dengan berdasar pada metabolisme karbon dan immobilisasi nitrogen oleh bakteri. Bakteri dan mikroorganisme yang lain menggunakan karbohidrat (gula, pati, selulosa) sebagai makanan guna mendapatkan energi dan tumbuh melalui pembentukan sel-sel baru (Avnimelech, 1999). Proses tersebut dapat dilihat pada persamaan berikut:
Corganik CO2 + Energi + Cterasimilasi dalam sel mikroba (1) Penambahan karbohidrat berpotensi untuk mengurangi konsentrasi nitrogen anorganik pada budidaya dengan sistem intensif. Berdasarkan persamaan (1) dan definisi efisiensi konversi mikroba (persentase karbon yang terasimilasi berdasarkan karbon pakan yang tercerna), maka jumlah potensial asimilasi karbon mikroba adalah sebagai berikut:
ΔCmik = ΔCH × %C ×E
Jumlah nitrogen yang dibutuhkan untuk memproduksi sel baru (ΔN) bergantung pada C/N rasio dari biomassa mikroba. Nilainya adalah sebagai berikut:
ΔNmik = ΔCmik [C/N]mik
ΔNmik = ΔCH ×%C ×E [C/N]mik
Ikan atau udang di tambak hanya memanfaatkan 25% nitrogen dalam pakan, sisanya diekskresikan sebagai NH4 atau sebagai N organik yang terdapat dalam feses dan residu pakan. Jumlah nitrogen yang terdapat dalam pakan dapat dihitung melalui persamaan berikut:
ΔN = pakan × %Npakan ×%Nekskresi
Berdasarkan persamaan-persamaan di atas, maka jumlah karbon yang harus ditambah untuk mendukung proses pertumbuhan bakteri, yaitu:
ΔCH = (pakan × Npakan × %Nekskresi) × [C/N]mik
28 Lanjutan Lampiran 1
Keterangan :
ΔCH : jumlah karbon yang harus ditambahkan Pakan : jumlah pakan yang diberikan
%N pakan : kandungan N dalam pakan
%N ekskresi : kandungan N yang dikeluarkan oleh tubuh ikan
[C/N]mik : kandungan karbon dari sumber karbon yang ditambahkan E : efisiensi konversi mikroba
Pada penelitian ini, penambahan molase pada sistem budidaya nila dengan kepadatan 20 ekor/m3 dan sistem aerasi ditetapkan pada C/N rasio 15. Asumsi- asumsi yang digunakan dalam perhitungan yaitu (Lampiran 1):
1. Kadar protein pakan (sesuai nilai yang tertera pada label pakan) 2. Efisiensi konversi mikroba (E) 40%
3. Kadar karbon dalam molase (%C) (sesuai nilai %C molase yang digunakan) 4. Kadar nitrogen dalam pakan (%N pakan) 16%
5. Nitrogen yang diekskresikan (%N ekskresi) 33% 6. C/N rasio target 15
Contoh Perhitungan Penambahan Karbon (Avnimelech, 1999) Jumlah pakan/hari yaitu
FR (%) x biomassa (g)
--- (Persamaan 1)
Persamaan 1 x 0,15 (kandungan C di pakan)
--- (Persamaan 2)
Persamaan 1 x kandungan protein pakan
--- (Persamaan 3)
29 --- (Persamaan 4)
Persamaan 4 x 75% (jumlah pakan yang menjadi limbah)
--- (Persamaan 5)
Persamaan 5 x rasio C/N yang ditentukan
--- (Persamaan 6)
59,40%/Persamaan 6 = 100/molase yang dibutuhkan
Berdasarkan alur perhitungan penambahan karbon, apabila jumlah pakan yang diberikan setiap hari sebanyak 100 g dengan kandungan protein sebesar 33% dan kandungan karbon di dalam molase sebesar 59,40%, maka penambahan molase yang ditambahkan setiap hari untuk 100 g pakan dengan C/N rasio 15 yaitu 111 g/hari.
30 Lampiran 2. Prosedur Uji Fisiologis dan Biokimia Bakteri (Cowan & Steel,
1974).
1. Uji Oksidasi Fermentasi
Pada uji O/F, pertama alkohol disemprotkan pada meja praktikum. Jarum ose dibakar di atas bunsen hingga memerah. Kemudian koloni bakteri diambil dari tempat biakan dengan cara menempelkan jarum ose pada tempat biakan yang tidak ada bakterinya terlebih dahulu. Setelah itu, bakteri diinokulasikan pada media uji O/F sedalam 2/3 bagian sebanyak 2 tabung reaksi. Pada salah satu tabung ditambahkan larutan parafin dan diinkubasi selama ±24 jam.
2. Uji Motilitas
Pada uji motilitas, pertama alkohol disemprotkan pada meja praktikum. Jarum ose dibakar di atas bunsen hingga memerah. Kemudian koloni bakteri diambil dari tempat biakan dengan cara menempelkan jarum ose pada tempat biakan yang tidak ada bakterinya trlebih dahulu. Setelah itu, bakteri diinokulasikan pada media uji motil sedalam 2/3 bagian dan diinkubasi selama ±24 jam.
3. Uji Katalase
Pada uji katalase, pertama alkohol disemprotkan pada meja praktikum. Jarum ose dibakar di atas bunsen hingga memerah. Kemudian koloni bakteri diambil dari tempat biakan dengan cara menempelkan jarum ose pada tempat biakan yang tidak ada bakterinya terlebih dahulu. Kemudian diambil gelas objek dan dibersihkan dengan alkohol. Larutan H2O2 ditetesi di atas gelas objek dan ditambahkan bakteri. Kemudian setelah ± 20 detik diperhatikan timbul gelembung atau tidak.
4. Uji Oksidase
Pada uji Oksidase, pertama alkohol disemprotkan pada meja praktikum. P-aminodimethylaniline-oxalat 1% diteteskan pada kertas saring. Kemudian jarum ose dibakar di atas bunsen hingga memerah. Lalu koloni bakteri diambil dari tempat biakan dengan cara menempelkan jarum ose pada tempat biakan yang tidak ada bakterinya terlebih dahulu dan diulaskan di atas tetesan
P-31 aminodimethylaniline-oxalat. Bila koloni berubah warna menjadi merah, berarti tes positif, dan bila berwarna ungu berarti tes negatif.
5. Pewarnaan Gram
Penyiapan gelas objek dan mengambil secara aseptik pupukan cairan bakteri. Lalu dibiarkan kering udara dan difiksasi di atas nyala api (± 10 cm). Kemudian digenangi dengan kristal violet 2 menit, dibuang kelebihannya lalu dibilas dengan akuades steril. Sampel kemudian digenangi dengan lugol iodine 1 menit, dibuang kelebihannya lalu dibilas dengan akuades steril. Setelah itu sampel digenangi dengan alkohol 1 menit, dibuang kelebihannya lalu dibilas dengan akuades steril. Terakhir, sampel digenangi dengan safranin 2 menit, dibuang kelebihannya lalu dibilas dengan akuades steril. Lalu sisa airnya diserap dengan kertas serap/tissu. Setelah itu diamati dengan perbesaran tinggi.
32 Lampiran 3. Prosedur Pengukuran Klorofil-a (APHA, 1992)
Sampel diambil menggunakan botol sampel lalu ditutup dengan plastik hitam (ice-box) dan langsung disaring menggunakan kertas penyaring milipore Whatman GF/C diameter 47 mm, dengan ukuran pori 0,04 m sebanyak 100 ml. Hasil saringan akan mengendap dikertas milipore. Setelah disaring, penyaring Whatman diambil, kemudian dibungkus dalam plastik dan ditutup dengan kertas timah, agar klorofil-a yang tersaring tidak dapat melakukan aktivitas fotosintesis. Setelah itu sampel digerus memakai Grinder (glas-col Terre Haute 6000 rpm) dengan ditambahkan larutan aseton pada setiap sampel yang ingin digerus sebanyak 10 ml aseton dan disimpan di refrigrator selama 24 jam dengan dilapisi alumunium foil dan plastik hitam. Kemudian sampel ditimbang menggunakan timbangan digital dengan berat 200 g (dihomogenkan). Lalu disentrifuge dengan kecepatan 2000-3000 rpm selama 15 menit agar kertas saring mengendap dan terpisah dari larutan klorofil. Penghitungan konsentrasi klorofil dilakukan dengan mengukur absorbansi larutan sampel dengan spektrometer dengan panjang gelombang 750, 664, 647, 630 nm.
33 Lampiran 4. Prosedur Analisis Proksimat (Takeuchi, 1988)
a. Kadar Protein
Bahan ditimbang sebanyak 0,5-1,0 g bahan, lalu dimasukkan ke dalam labu kjehdal. Salah satu labu tidak perlu dimasukkan bahan ke dalamnya karena akan digunakan sebagai blanko. Kemudian ditambahkan 3 g katalis (K2SO4 + CuSO4.5H2O) dengan rasio 9:1 dan 10 mL H2SO4 pekat. Labu dipanaskan selama 3-4 jam hingga cairan dalam labu berwarna hijau, setelah itu pemanasan dilanjutkan 30 menit lagi. Larutan didinginkan, kemudian ditambahkan air destilata sebanyak 30 mL. Larutan dimasukkan ke dalam labu takar dan ditambahkan air destilata hingga volume larutan menjadi 100 mL. labu destilasi disiapkan dan diisi 5 mL larutan no.4 lalu ditambahkan NaOH 30%. Labu Erlenmeyer diisi 10 mL H2SO4 0,05 N dan ditambahkan 2-3 tetes indikator (methyl red) yang disiapkan untuk menampung NH3 yang dibebaskan dari bahan no.4 selama proses destilasi berlangsung. Pemanasan dengan uap terhadap labu destilasi (n0.4) dilakukan minimal 10 menit setelah kondensasi. Larutan dalam labu Erlenmeyer dititrasi dengan larutan NaOH 0,05 N. Persentase (%) kadar protein dimasukkan dalam rumus sebagai berikut:
[ {0,0007* x (Vb-Vs) x F x 6,25**x 20}/ S] x 100% Keterangan:
Vs = M1 0,05 N titran NaOH untuk sampel Vb = M1 titran NaOH untuk blanko
F = faktor koreksi dari 0,05 larutan NaOH S = bobot sampel (g)
* = setiap mL 0,05 N NaOH ekuivalen dengan 0,0007 g nitrogen ** = faktor nitrogen
b. Kadar Lemak
Labu ekstraksi dipanaskan pada suhu 1100C selama satu jam, kemudian didinginkan selama 30 menit dalam eksikator dan ditimbang bobot labu tersebut (A). Kemudian dimasukkan petroleum benzen sebanyak 150-250 ml ke dalam labu reaksi. Bahan ditimbang sebanyak 5 g (a), dimasukkan ke dalam selongsong,