* Penulis untuk korespondensi. e-mail: dsukma70@yahoo.com
Induksi Poliploidi
Phalaenopsis amabilis
(L.) Blume dan
Phalaenopsis amboinensis
J. J. Smith dengan Kolkisin dalam Kultur
In Vitro
Polyploid Induction of Phalaenopsis amabilis (L.) Blume and Phalaenopsis amboinensis
J. J. Smith by Colchicine in In Vitro Culture
Eka Martha Della Rahayu
1, Dewi Sukma
2*, Muhamad Syukur
2, dan Irawati
11
Pusat Konservasi Tumbuhan Kebun Raya Bogor - LIPI, Jl. Ir. H. Juanda No. 13, Bogor, Indonesia
2Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor
(Bogor Agricultural University), Jl. Meranti, Kampus IPB Darmaga, Bogor 16680, Indonesia
Diterima 10 April 2015/Disetujui 2 November 2015
ABSTRACT
Phalaenopsis amabilis (L.) Blume and Phalaenopsis amboinensis J.J. Smith (diploid) are important in Phalaenopsis
breeding. Polyploid species are needed for crossing with polyploid hybrid varities of Phalaenopsis. The objectives of this
study were to obtain effective concentration of colchicine to induce polyploidy and to produce polyploid plantlets of P.
amabilis and P. amboinensis. Experiment was arranged in randomized complete block design with one factor, the colchicine
concentration. Protocorms of P. amabilis and P. amboinensis were immersed in half strength of Murashige-Skoog (1/2 MS)
liquid media added with colchicine (0; 0.5; 5; 25; 50, and 75 mg L
-1) for 10 days. The results showed that higher concentration
of colchicine on both species did not have significant effect on the survival of the plantlets at 24 weeks after treatment. The
average number of leaves and roots of colchicine treated planlets from both species were less than the control plantlets.
Immersing protocorm in colchicine at concentration of 50 mg L
-1for 10 days was effective in inducing polyploid plantlets of
P. amabilis and P. amboinensis with the frequency of 33.3% and 40%, respectively. Polyploid plantlet has larger stomata size
and lower stomata density than the diploid ones.
Keywords: chromosome number, colchicine, polyploid, protocorm, stomatal density, stomatal size
ABSTRAK
Phalaenopsis amabilis (L.) Blume dan Phalaenopsis amboinensis J.J. Smith (diploid) banyak digunakan sebagai tetua
dalam pemuliaan Phalaenopsis. Spesies dengan karakter poliploid dibutuhkan untuk persilangan dengan varietas hibrid yang
bersifat poliploid. Tujuan penelitian ini adalah untuk memperoleh konsentrasi kolkisin yang efektif untuk induksi poliploidi
serta untuk memperoleh planlet P. amabilis dan P. amboinensis poliploid. Percobaan disusun dalam rancangan kelompok
lengkap teracak dengan satu faktor, yaitu konsentrasi kolkisin. Protokorm P. amabilis dan P. amboinensis direndam dalam
media cair Murashige-Skoog setengah konsentrasi (1/2 MS) dengan penambahan kolkisin (0; 0.5; 5;25;50, dan 75 mg L
-1)
selama 10 hari. Hasil penelitian menunjukkan bahwa konsentrasi kolkisin yang semakin tinggi pada kedua jenis anggrek
tersebut tidak berpengaruh nyata terhadap persentase hidup planlet pada 24 minggu setelah perlakuan (24 MSP).
Rata-rata jumlah daun dan akar planlet yang berasal dari protokorm yang diberi perlakuan kolkisin lebih rendah dibandingkan
planlet kontrol. Perendaman protokorm dalam larutan kolkisin 50 mg L
-1selama 10 hari efektif untuk menginduksi planlet
P. amabilis poliploid dengan keberhasilan 33.3% dan P. amboinensis poliploid dengan keberhasilan 40%. Planlet poliploid
memiliki ukuran stomata lebih besar dan kerapatan stomata lebih rendah dibandingkan dengan planlet diploid.
Kata kunci: jumlah kromosom, kerapatan stomata, kolkisin, poliploid, protokorm, ukuran stomata
PENDAHULUAN
Indonesia memiliki 25 spesies anggrek bulan
dengan 10 spesies di antaranya adalah endemik Indonesia
(Christenson, 2001). Anggrek bulan memiliki berbagai
variasi bentuk, warna, dan ukuran bunga. Oleh karena itu,
anggrek bulan menjadi salah satu komoditi hias yang sangat
popular. Selain itu, anggrek bulan juga berpotensi sebagai
induk dalam pemuliaan untuk menghasilkan berbagai
anggrek bulan hibirida baru (Tang dan Chen, 2007).
Phalaenopsis amabilis
(L.) Blume dan
Phalaenopsis
amboinensis
J.J. Smith banyak digunakan sebagai tetua
220
Eka Martha Della Rahayu, Dewi Sukma, M. Syukur, dan Irawatimewariskan sifat bunga berukuran besar dan berwarna putih
sedangkan
P. amboinensis
berpotensi untuk menghasilkan
warna kuning, bintik coklat, tangkai bunga tegak, serta
aroma yang khas (Tang dan Chen, 2007).
Kromosom dasar dari spesies-spesies anggrek
Phalaenopsis
adalah diploid (2n=2x=38) (Lin
et al
.,
2001), sementara sebagian besar varietas komersial atau
hibrida adalah tetraploid (Chen
et al.,
2011). Persilangan
antara spesies dengan hibrida tetraploid menunjukkan
adanya hambatan dalam pembentukan biji, terutama jika
tanaman tetraploid digunakan sebagai donor polen dan
tanaman diploid sebagai betina (Tang dan Chen, 2007).
Oleh karena itu, dalam upaya melakukan persilangan antara
spesies diploid dengan hibrida tetraploid, diperlukan upaya
peningkatan ploidi dari spesies diploid.
Tang dan Chen (2007) menyatakan bahwa klon
superior dari
Phalaenopsis
Taisuco
berbunga putih besar
pertama kali dikembangkan melalui melalui perbaikan
genetik
Phalaenopsis
Doris
melalui penggandaan kromosom,
sehingga dihasilkan kapasitas genomik yang lebih besar
untuk mengakumulasi lebih banyak alel. Tanaman tetraploid
yang dihasilkan selanjutnya disilangbalik atau disilang
dengan kerabatnya untuk mengakumulasikan alel-alel
aditif untuk ukuran bunga dan karakter lainnya sehingga
telah dihasilkan lebih dari 30
Phalaenopsis
Taisuco
unggul. Poliploidi dapat meningkatkan keragaman genetik,
menghasilkan ukuran bunga yang lebih besar, bentuk bunga
yang lebih bulat dan warna bunga yang lebih pekat (Miguel
dan Leonhardt, 2011).
Pemuliaan tanaman dengan induksi mutasi merupakan
metode alternatif untuk pemuliaan konvensional, dapat
dilakukan dengan mutagen fisik dan kimia (van Harten
1998). Induksi mutasi dengan mutagen fisik iradiasi sinar
gamma pada tanaman hias antara lain telah dilaporkan pada
krisan oleh Aisyah
et al.
(2009) dan anggrek
Spathoglotis
plicata
oleh
Romeida
et al
. (2012). Mutasi kimia dengan
tujuan menghasilkan tanaman poliploid, yaitu tanaman
yang memiliki tiga set kromosom atau lebih, umumnya
menggunakan kolkisin (Dhooghe
et al
., 2011).
Kolkisin telah digunakan secara
in vitro
untuk
menghasilkan tanaman poliploid pada berbagai spesies
anggrek seperti
Phalaenopsis
(Griesbach, 1981 dan 1985),
Cattleya intermedia
Lindl. (Silva
et al
., 2000),
Dendrobium
secundum
(Blume) Lindl. (Atichart dan Bunnag, 2007),
Dendrobium scabrilingue
L. (Sarathum
et al
., 2010), dan
Rhyncostylis gigantea
var.
rubrum
(Kerdsuwan dan
Te-chato, 2012).
Griesbach (1981) melakukan induksi poliploidi pada
protokorm
Phalaenopsis equestris, Phalaneopsis fasciata,
dan
Phalaenopsis
Betty Hausermann menggunakan 50
mg L
-1kolkisin serta perendaman selama 10 hari. Penelitian
tersebut menghasilkan 50% protokorm yang kemudian
berkembang menjadi tanaman tetraploid. Penambahan 0.5
mg L
-1kolkisin ke dalam media kultur dapat menghasilkan
Phalaenopsis
Golden Sands ‘Canary’ heksaploid (Griesbach,
1985). Perendaman protokorm
D. secundum
dalam kolkisin
500 mg L
-1selama 1 hari menghasilkan tanaman poliploid
tertinggi (Atichart dan Bunnag, 2007). Planlet
D. scabrilingue
tetraploid dihasilkan dari perendaman protokorm dalam
kolkisin 750 mg L
-1selama 14 hari (Sarathum
et al.
,
2010). Silva
et al
. (2000) melaporkan bahwa perendaman
protokorm
C. intermedia
dalam kolkisin 500 dan 1,000 mg
L
-1selama 4 hari dapat menghasilkan tanaman tetraploid.
Tanaman
R. gigantea
var.
rubrum
tetraploid dihasilkan dari
perendaman protokorm dalam kolkisin 2,000 mg L
-1selama
3 hari.
Salah satu usaha yang dapat dilakukan untuk pemuliaan
P. amabilis
dan
P. amboinensis
adalah dengan melakukan
induksi poliploidi secara
in vitro
. Konsentrasi kolkisin
optimum untuk induksi poliploidi kedua spesies anggrek
tersebut belum diketahui. Tujuan penelitian ini adalah
mendapatkan konsentrasi kolkisin efektif (sekurangnya 30%
planlet poliploid) dalam induksi poliploidi pada protokorm
P. amabilis
dan
P. amboinensis.
BAHAN DAN METODE
Penelitian dilaksanakan di Laboratorium Kultur
Jaringan dan Laboratorium Treub Pusat Konservasi
Tumbuhan Kebun Raya Bogor - Lembaga Ilmu Pengetahuan
Indonesia (PKT KRB-LIPI) sejak bulan November 2012
sampai dengan Oktober 2013. Rancangan percobaan adalah
rancangan kelompok lengkap teracak dengan satu faktor,
yaitu konsentrasi kolkisin. Konsentrasi kolkisin yang
diujikan adalah 0; 0.5; 5; 25; 50 dan 75 mg L
-1. Larutan
kolkisin sesuai dengan perlakuan yang telah disterilisasi
dengan
millipore filter
0.2 μm, dimasukkan ke dalam
media cair Murashige-Skoog setengah konsentrasi (1/2MS)
steril dengan volume total untuk setiap perlakuan adalah
25 mL. Protokorm
P. amabilis
dan
P. amboinensis
yang
berumur 10 bulan dari semai biji, direndam dalam larutan
kolkisin selama 10 hari dalam erlenmeyer dan diletakkan
pada
shaker
dengan kecepatan rotasi 50 rpm. Setelah
perendaman, protokorm dibilas tiga kali dengan akuades
steril lalu disubkultur pada media pemulihan yaitu media1/
2MS yang ditambahkan 30 g L
-1gula, 2.02 g L
-1gelrite, 0.3
mg L
-1NAA, 2 g L
-1arang aktif, dan 2 g L
-1pepton selama
8 minggu setelah perlakuan (MSP). Selanjutnya protokorm
disubkultur pada media pembesaran, yaitu media 1/2MS
yang ditambahkan 30 g L
-1gula, 2.02 g L
-1gelrite, 100
g L
-1pisang ambon masak yang dihaluskan dengan
blender
dan 2 g L
-1arang aktif. Protokorm diinkubasi dalam
ruang kultur pada suhu 23-25
oC dengan fotoperiodisitas 12
jam terang dan 12 jam gelap.
Setiap perlakuan diulang sebanyak lima kali. Satu
ulangan terdiri atas tiga protokorm yang ditanam dalam satu
botol kultur. Peubah yang diamati adalah persentase hidup,
jumlah daun, akar, dan
protocorm like body
(plb) selama
24 MSP. Setelah 24 MSP, berdasarkan pengamatan visual
morfologi, planlet dengan morfologi abnormal (daun tebal
dan planlet pendek) dipilih untuk dilakukan analisis stomata
dan kromosom.
Analisis stomata dilakukan dengan metode Gantait
et al.
(2011) yang dimodifikasi. Daun dari internodus
teratas yang telah membuka sempurna diambil di dalam
Laminar Air Flow Cabinet
(LAFC). Permukaan atas daun
dikerik dengan pisau silet di luar LAF, sampai tersisa
lapisan epidermisbawah. Lapisan epidermis dipotong, lalu
diletakkan di atas kaca objek. Larutan gliserin diteteskan di
atas potongan epidermis, lalu ditutup dengan kaca penutup.
Tepi kaca penutup dilapisi cat kuku bening dan preparat
diamati di bawah mikroskop. Pengamatan kerapatan
stomata dilakukan dengan mikroskop OPTIKA M-699 pada
perbesaran 100x, sedangkan pengamatan ukuran stomata
dengan perbesaran 400x. Pengamatan kerapatan stomata
dilakukan pada sepuluh bidang pandang yang dipilih secara
acak, masing-masing seluas 3.79 mm
2. Sepuluh stomata
lalu dipilih secara acak untuk diukur panjang dan lebarnya
menggunakan piranti lunak Optika Vision Lite 2.1.
Analisis kromosom dilakukan menggunakan metode
Manton (1950) yang dimodifikasi. Ujung akaraktif dipotong
sekitar 1 cm, lalu difiksasi dalam larutan hidroksiquinolin
selama 24 jam pada suhu 4
oC. Akar lalu dimasukkan ke
dalam larutan asam asetat 45% selama 10 menit, selanjutnya
akar dipindahkan ke dalam larutan asam asetat 45% : HCl
(3:1), sambil dipanaskan dalam penangas air dengan suhu
60˚C selama 3 menit. Potongan akar lalu diletakkan pada
gelas arloji. Akar kemudian dipindahkan pada gelas preparat.
Bagian ujung akar dipotong 1-2 mm, lalu diteteskan orcein
secukupnya kemudian pasang kaca penutup. Selanjutnya
preparat diketuk-ketuk dan dipanaskan sekitar 5 detik.
Preparat lalu dibiarkan dingin kemudian ditekan halus dan
dipanaskan lagi sekitar 5 detik. Tepi kaca penutup diberi cat
kuku bening dan preparat siap untuk diamati. Pengamatan
kromosom dilakukan dengan menggunakan mikroskop
OLYMPUS U-TVO.5XC-35H 12344 pada perbesaran
1000x pada tiga sel dari setiap preparat yang dianalisis.
Data yang diperoleh dianalisis menggunakan analisis
ragam. Apabila terdapat data dengan keragaman tinggi
dan ragam tidak homogen maka dilakukan transformasi
menggunakan rumus . Apabila dari hasil analisis ragam
terdapat pengaruh nyata dari perlakuan maka dilakukan uji
lanjut dengan
Duncan Multiple Range Test
(DMRT) pada
taraf nyata 5% untuk mengetahui pengaruh beda antar
perlakuan. Penghitungan jumlah kromosom menggunakan
Microsoft Office Excel serta dihitung rata-rata dan standar
deviasinya. Untuk mengetahui adanya perbedaan antara
ukuran dan kerapatan stomata planlet diploid serta poliploid
digunakan uji-t pada taraf nyata 1%. Pengolahan data
menggunakan program SAS 9.1.3 Portable.
HASIL DAN PEMBAHASAN
Induksi poliploidi pada protokorm
P. amabilis
dan
P. amboinensis
menggunakan kolkisin pada konsentrasi
dan lama perendaman yang diujikan tidak berpengaruh
nyata terhadap persentase hidup dan rata-rata jumlah plb,
namun berpengaruh nyata terhadap rata-rata jumlah daun
dan akar pada 24 MSP (Tabel 1). Persentase hidup kedua
spesies anggrek tersebut berkisar dari 80-100% (Tabel 1).
Persentase hidup protokorm setelah perlakuan kolkisin
pada kedua spesies yang relatif tinggi menunjukkan bahwa
konsentrasi yang diujikan tidak mematikan sel atau jaringan
pada protokorm.
Protokorm dapat tumbuh menghasilkan
protocorm
like body
(plb) dan berkembang menjadi planlet dalam
24 MSP. Jumlah daun dan akar pada planlet dari kedua
spesies anggrek yang diberi perlakuan kolkisin tampak lebih
rendah daripada kontrol (Tabel 1). Keragaaan planlet
P.
amabilis
dan
P. amboinensis
yang dihasilkan dari protokorm
yang diberi perlakuan kolkisin menunjukkan morfologi yang
abnormal, terlihat dari daun baru yang tumbuh menebal dan
planlet menjadi pendek atau roset. Persentase planlet yang
menunjukkan morfologi daun menebal sebesar 46-84%
√𝑥𝑥 + 1
Spesies
Konsentrasi kolkisin
(mg L
-1)
Persentase hidup
(%)
jumlah daun
Rata-rata
jumlah akar
Rata-rata
jumlah plb
Rata-rata
P. amabilis
0.0
100.0
3.6(2.1)a
3.1(2.0)a
7.3(2.7)
0.5
100.0
1.5(1.6)b
1.1(1.4)b
7.3(2.8)
5.0
86.8
1.7(1.6)b
1.3(1.5)b
9.1(3.1)
25.0
86.8
1.8(1.7)b
1.5(1.6)b
3.8(2.2)
50.0
93.4
1.8(1.7)b
1.1(1.4)b
6.5(2.6)
75.0
86.8
1.5(1.6)b
1.2(1.5)b
3.4(2.0)
P. amboinensis
0.0
100.0
3.1a
2.4a
1.9(1.7)ab
0.5
100.0
2.0b
1.3bc
0.9(1.3)b
5.0
86.8
1.4b
0.9c
2.9(1.8)ab
25.0
93.4
2.3ab
1.6b
0.5(1.2)b
50.0
80.0
2.3ab
1.6b
4.2(2.2)a
75.0
93.4
2.1b
1.9ab
1.6(1.5)ab
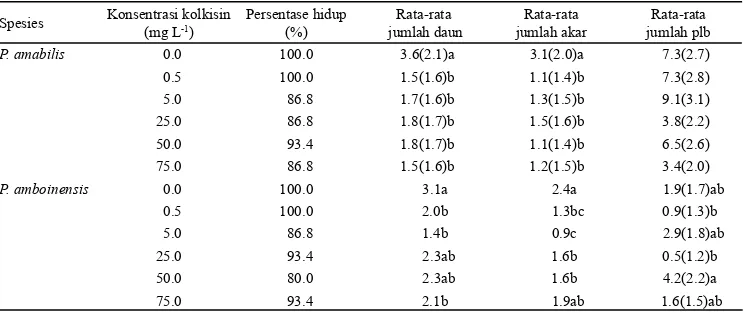
Tabel 1. Pengaruh kolkisin terhadap persentase hidup dan pertumbuhan protokorm
Phalaenopsis amabilis
dan
Phalaenopsis
amboinensis
pada 24 MSP
Keterangan: Angka yang diikuti huruf yang sama pada kolom yang sama pada masing-masing spesies menunjukkan hasil yang tidak berbeda nyata berdasarkan uji DMRT pada taraf 5%. Angka di dalam tanda kurung adalah hasil transformasi menggunakan rumus √𝑥𝑥 + 1
222
Eka Martha Della Rahayu, Dewi Sukma, M. Syukur, dan Irawatipada
P. amabilis
dan 26-57% pada
P. amboinensis
(Tabel
2). Semakin tinggi konsentrasi kolkisin yang diujikan,
persentase planlet dengan daun menebal juga semakin
tinggi.
Pertumbuhan yang lambat dan morfologi abnormal
merupakan gejala yang umum terjadi setelah perlakuan
kolkisin pada tanaman. Griesbach (1981) menemukan
bahwa pertumbuhan
Phalaenopsis
yang diberi perlakuan
kolkisin lebih lambat daripada planlet kontrol. Pertumbuhan
yang lebih lambat tersebut diduga disebabkan oleh
penetrasi dari kolkisin ke dalam lapisan sel apikal sehingga
mempengaruhi pembelahan sel (Thao
et al
., 2003;
Sarathum
et al
., 2010; Gantait
et al.
, 2011). Morfologi
yang abnormal juga dilaporkan oleh Zeng
et al.
(2006),
dimana kolkisin dapat menimbulkan efek samping, yaitu
morfologi abnormal seperti penebalan daun selama proses
mutagenesis. Penebalan daun tanaman tetraploid ditemukan
pada
Caladium
‘Tapestry’ (Cai
et al
., 2015) dan
Thymus
persicus
(Tavan
et al.,
2015).
Planlet
P. amabilis
dan
P. amboinensis
yang memiliki
daun baru yang menebal, berwarna lebih hijau, serta planlet
berukuran pendek diduga bersifat poliploid. Jaringan
poliploid diduga mengandung lebih banyak klorofil
sehingga warna daun terlihat lebih hijau. Kandungan klorofil
yang tinggi terdapat pada tanaman
Paulownia tomentosa
(Thunb.) tetraploid (Tang
et al
., 2010) dan semangka
poliploid (Pradeepkumar, 2011). Analisis stomata juga
merupakan merupakan salah satu cara untuk seleksi awal
tanaman poliploid dan untuk mengurangi ukuran populasi
yang dipertahankan setelah tahap kultur
in vitro
(Silva
et
al.,
2000; Miguel dan Leonhardt, 2011). Chen
et al.
(2009)
serta Miguel dan Leonhardt (2011) telah menggunakan
analisis stomata untuk menentukan tingkat ploidi pada
anggrek
Cymbidium
,
Dendrobium
,
Epidendrum
,
Odontioda
dan
Phalaenopsis
. Namun cara yang paling baik untuk
Spesies
Konsentrasi kolkisin
(mg L
-1)
dengan daun tebal (%)
Persentase planlet
xPersentase planlet poliploid
(%)
yP. amabilis
0.0
0.0 (0/15)
0.0 (0/0)
0.5
46.7 (7/15)
0.0 (0/7)
5.0
53.9 (7/13)
0.0 (0/7)
25.0
61.5 (8/13)
12.5 (1/8)
50.0
42.9 (6/14)
33.3 (2/6)
75.0
84.6 (11/13)
18.2 (2/11)
P. amboinensis
0.0
0.0 (0/15)
0.0 (0/0)
0.5
26.7 (4/15)
0.0 (0/4)
5.0
30.8 (4/13)
0.0 (0/4)
25.0
35.7 (5/14)
0.0 (0/5)
50.0
41.7 (5/12)
40.0 (2/5)
75.0
57.1 (8/14)
25.0 (2/8)
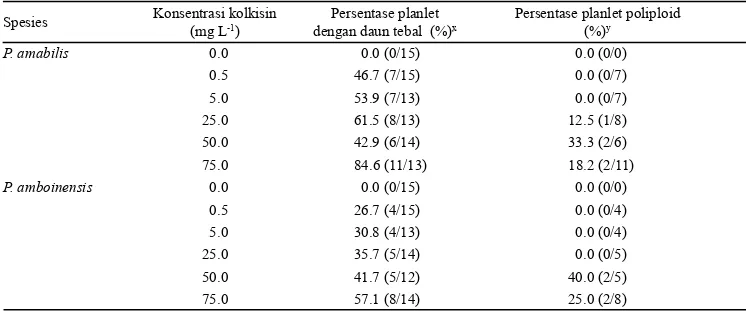
Tabel 2. Persentase planlet
Phalaenopsis amabilis
dan
Phalaenopsis amboinensis
dengan daun tebal dan planlet poliploid
Keterangan: xJumlah planlet dengan daun tebal/jumlah planlet yang hidup pada 24 MSP yJumlah planlet poliploid/jumlah planlet dengan
daun tebal
memastikan tingkat ploidi tanaman hasil perlakuan kolkisin
adalah dengan analisis jumlah kromosom.
Hasil analisis stomata dari planlet yang diduga
poliploid berdasarkan morfologi tanaman disajikan pada
Tabel 3 dan morfologi serta kerapatan stomata disajikan
pada Gambar 1. Hasil analisis ragam menunjukkan bahwa
perlakuan kolkisin 50 dan 75 mg L
-1berpengaruh nyata
terhadap panjang dan kerapatan stomata
P. amabilis
dan
P. amboinensis
(Tabel 3). Kedua perlakuan tersebut
menghasilkan planlet
P. amabilis
dan
P. amboinensis
yang
memiliki stomata lebih panjang dari kontrol. Menurut
Miguel dan Leonhardt (2011), tanaman dengan panjang
stomata lebih besar 1.25x dari panjang stomata tanaman
kontrol diduga sebagai tanaman poliploid. Berdasarkan hal
tersebut diduga perlakuan kolkisin 50 dan 75 mg L
-1dapat
menginduksi terbentuknya tanaman poliploid untuk kedua
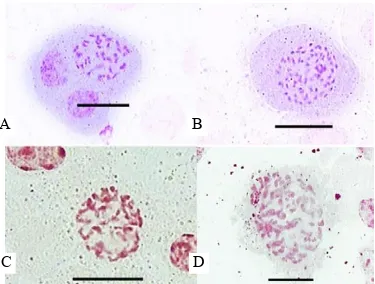
spesies. Berdasarkan hasil analisis kromosom pada planlet
P. amabilis
dan
P. amboinensis
, ditemukan beberapa planlet
dengan sel yang poliploid seperti terlihat pada Tabel 2 dan
Gambar 2.
Phalaenopsis amabilis
dan
P. amboinensis
memiliki
jumlah kromosom yang sama, yaitu 2n=2x=38 (Kao
et al.
2007). Berdasarkan Tabel 2 terlihat bahwa hasil pengamatan
morfologi berbeda dengan hasil analisis kromosom. Planlet
dengan daun tebal yang diduga poliploid ternyata tidak
semuanya terbukti poliploid setelah dilakukan analisis
kromosom. Hal yang sama dilaporkan Zeng
et al.
(2006)
pada
Citrus
yang diberi perlakuan kolkisin, awalnya 50%
sel menjadi tetraploid, namun satu bulan setelah perlakuan
kolkisin, hanya 16.7% sel yang tetap tetraploid. Hal tersebut
dapat disebabkan oleh sebagian besar sel yang diidentifikasi
sebagai tetraploid setelah perlakuan kolkisin mengalami
kematian dalam kultur
in vitro
atau sel-sel tetraploid
menunjukkan kemampuan pertumbuhan yang lebih rendah
jika dibandingkan sel-sel diploid.
223
Induksi Poliploidi Phalaenopsis amabilis (L.)...B
D
C
A
F
E
H
G
Spesies
Kolkisin
(mg L
-1)
Panjang stomata
(μm)
Lebar stomata
(μm)
(jumlah/3.79 mm
Kerapatan stomata
2)
P. amabilis
0.0
30.2b
30.3ab
9.4a
0.5
29.8b
29.2b
10.1a
5.0
30.2b
29.0b
9.0a
25.0
31.4b
31.2ab
9.0a
50.0
36.1a
32.6a
6.1b
75.0
36.5a
29.6b
5.7b
P. amboinensis
0.0
26.3bc
26.3bc
10.5a
0.5
27.0b
26.5bc
8.8b
5.0
24.7c
23.8d
10.0a
25.0
24.7c
24.6cd
9.4ab
50.0
31.3a
29.1a
6.0c
75.0
30.7a
26.8b
6.6c
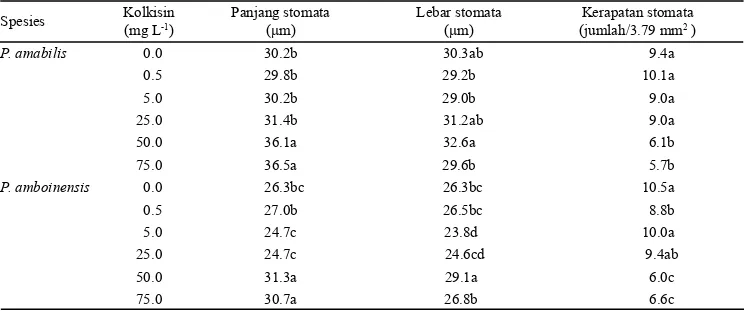
Tabel 3. Pengaruh perendaman protokorm dalam larutan kolkisin terhadap ukuran dan kerapatan stomata planlet
Phalae-nopsis amabilis
dan
Phalaenopsis amboinensis
Keterangan: Angka yang diikuti huruf yang sama pada kolom yang sama pada masing-masing spesies menunjukkan hasil yang tidak ber-beda nyata berdasarkan uji DMRT pada taraf 5%
Gambar 1. Ukuran dan kerapatan stomata Phalaenopsis amabilis dan Phalaenopsis amboinensis setelah perendaman protokorm dalam larutan kolkisin. Phalaenopsis amabilis diploid (A) dan poliploid (B) serta P. amboinensis diploid (C), dan poliploid (D) dengan perbesaran 400x, bar = 30 μm. Kerapatan stomata P. amabilis diploid (E), poliploid (F) serta P. amboinensis diploid (G), dan poliploid (H) dengan perbesaran 100x, bar = 100 μm
224
Eka Martha Della Rahayu, Dewi Sukma, M. Syukur, dan IrawatiPerendaman protokorm dalam larutan kolkisin
50 mg L
-1selama 10 hari efektif untuk menginduksi
pembentukan planlet
P. amabilis
poliploid dengan persentase
33.3% dan
P. amboinensis
poliploid dengan persentase
40% dari planlet yang memiliki daun menebal (Tabel 2).
Planlet
P. amabilis
poliploid yang dihasilkan memiliki
70-76 kromosom, sedangkan planlet
P. amboinensis
memiliki
72-76 kromosom (Tabel 4). Kromosom
P. amabilis
serta
P. amboinensis
diploid dan poliploid dapat dilihat pada
Gambar 2.
Hasil uji-t menunjukkan bahwa ukuran dan kerapatan
stomata planlet
P. amabilis
dan
P. amboinensis
poliploid
berbeda nyata dengan planlet diploid (Tabel 4). Planlet
P.
amabilis
dan
P. amboinensis
poliploid, memiliki ukuran
stomata yang lebih besar dari tanaman diploid [Gambar 1
(A, B, C, D)] sehingga memiliki rata-rata kerapatan stomata
lebih rendah daripada tanaman diploid [Gambar 1(E, F, G,
H)]. Hasil penelitian yang diperoleh sejalan dengan hasil
penelitian induksi poliploidi pada anggrek
C. intermedia
(Silva
et al
., 2000),
Anthurium andraeanum
“Arizona”
(Chen
et al
., 2011),
Dendrobium
,
Epidendrum
,
Odontioda
,
Phalaenopsis
(Miguel dan Leonhardt, 2011), serta
R. retusa
var.
rubrum
(Kerdsuwan dan Te-chato, 2012).
Planlet
P. amabilis
dan
P. amboinensis
tetraploid
yang dihasilkan masih perlu dilakukan evaluasi kecepatan
pertumbuhan dan morfologi bunganya. Program pemuliaan
untuk
Phalaenopsis
tetraploid dapat melalui persilangan
dengan varietas hibrida tetraploid ataupun melalui
persilangan dengan spesies atau hibrida diploid untuk
menghasilkan tanaman triploid. Menurut Syukur (2013),
tanaman triploid umumnya steril karena cara berpasangan
yang tidak seimbang pada waktu meiosis. Kondisi tersebut
dapat bermanfaat pada pemuliaan
Phalaenopsis
karena
dapat dihasilkan hibrida-hibrida dengan
vase life
tinggi
sehingga bunga tahan lebih lama. Pendekatan lain dalam
aplikasi tanaman tetraploid untuk pemuliaan tanaman
adalah penyerbukan untuk menghasilkan populasi
selfing
tetraploid dengan individu yang beragam.
D
C
B
A
Gambar 2. Kromosom Phalaenopsis amabilis dan Phalaenopsis amboinensis setelah perendaman protokorm dalam larutan kolkisin. Kromosom P. amabilis diploid (A) dan poliploid (B) serta kromosom P. amboinensis diploid (C) dan poliploid (D). Perbesaran 1000x, bar = 20 μm
Spesies
Planlet
Rata-rata jumlah
kromosom
Rata-rata panjang stomata
(μm)
Rata-rata lebar stomata
(μm)
kerapatan stomata
Rata-rata
(jumlah/3.79 mm
2)
P. amabilis
Diploid
36.7 ± 1.5
29.3b
28.2b
8.9a
Poliploid
73.2 ± 2.6
37.9a
32.7a
4.9b
P. amboinensis
Diploid
36.6 ± 1.6
25.4b
25.0b
9.4a
Poliploid
74.0 ± 1.9
34.8a
30.4a
5.6b
Tabel 4. Rata-rata jumlah kromosom planlet diploid dan poliploid serta ukuran dan kerapatan stomata planlet diploid dan
po-liploid setelah perendaman protokorm
Phalenopsis amabilis
dan
Phalaenopsis amboinensis
dalam larutan kolkisin
Keterangan: Angka yang diikuti huruf yang sama pada kolom yang sama pada masing-masing spesies menunjukkan hasil yang tidak berbeda nyata berdasarkan uji-t pada taraf 1%