“Menjadi lebih baik”. Itulah kalimat yang biasanya dibutuhkan oleh negara berkembang seperti Indonesia untuk lebih maju ,contohnya mengenai bidang kesehatan. Negara-negara maju gencar melakukan penelitian, terlebih menyangkut masalah kesehatan yang kini dihubungkan dengan teknologi. Salah satu faktor penyebab penghambat Indonesia dalam melaksanakan penelitian medis sehingga tidak banyak diminati adalah menyangkut perlindungan untuk subjek penelitian medis yang dirasa tidak cukup. Hal ini dapat disebabkan oleh beberapa hal, salah satunya tidak tersedianya dana yang besar untuk pelaksanaan penelitian medis. Salah satu cara mengatasi masalah pendanaan penelitian medis di Indonesia adalah dengan mengikutsertakan pihak asuransi yang dapat berperan dalam aspek pembiayaan untuk subjek penelitian medis (pasien). Selain hal-hal mengenai perlindungan dan peran asuransi, dikaji pula pengaturan penelitian medis di Indonesia yang perlu diperbaharui.
Penulisan skripsi ini menggunakan metode yuridis normatif yang difokuskan untuk mengkaji penerapan kaidah-kaidah atau norma-norma dalam hukum positif. Pendekatan yang digunakan adalah pendekatan undang-undang dan pendekatan konseptual dengan lebih mengacu pada bahan hukum primer (yaitu Undang Nomor 36 Tahun 2009 tentang Kesehatan, Undang-Undang Nomor 40 Tahun 2014 tentang Perasuransian, dan Peraturan Pemerintah Nomor 39 Tahun 1995 tentang Penelitian dan Pengembangan Kesehatan) dan bahan hukum sekunder (deklarasi-deklarasi internasional serta nasional yang berkaitan dengan pelaksanaan penelitian medis) sebagai data sekunder serta didukung oleh data primer (wawancara). Data-data yang digunakan dianalisis dengan cara analisis kualitatif dan dengan pola pikir logika deduktif, yaitu menarik kesimpulan dari kasus-kasus individual nyata menjadi kesimpulan yang bersifat umum.
Peraturan Pemerintah Nomor 39 Tahun 1995 tentang Penelitian dan Pengembangan Kesehatan perlu direvisi dengan melihat aspek-aspek yang dapat melengkapi aturan-aturan yang telah ada, seperti deklarasi-deklarasi internasional, terutama International Ethical Guidelines for Biomedical Research Involving Human Subjects sebagai pedoman yang dikhususkan untuk negara berkembang seperti Indonesia. Perlindungan terhadap pasien dilakukan berdasarkan hak asasinya, yaitu dengan mengedepankan keamanan dan kesehatan subjek penelitian and memberikan imbalan, kompensasi, dan/atau ganti rugi dalam bentuk finansial, asuransi, dan/atau bentuk lainnya.
ABSTRACT
“Be better”. That sentence is usually needed for developing countries like
Indonesia to be an advanced, for example on health sector. Developed countries doing research incessantly, especially health problem that linked with technologies. One of the reason that cumbering Indonesia on doing medical research, because not many people are interested with the protection for the subject of the medical research, that is not enough. That situation can be caused by several things, one of them is lack funding for doing medical research. One of the ways to fix the funding problem on medical research in Indonesia is involving insurance to cover the defrayal for the subject of medical research (a patient). For addition, besides the protection and insurance, it is important to review the
Indonesia’s regulation about medical research and need to be renewed.
This thesis is focused on juridical normative method to recite the application of the norms in positive law. The author uses regulation approach and conceptual approach, more focused on primary sources (Ordinance Number 36 of 2009 about Health, Ordinance Number 40 of 2014 about Insurance, and Government Regulation Number 39 of 1995 about Health Research and Development) and secondary sources (international and national declaration about the implementation of medical research) as secondary data and also looked at primary data (interview). The used data is analyzed by qualitative anilities and mind set by deductive logical thinking, that conclude from the real individual cases to general conclusion.
Government Regulation Number 39 of 1995 about Health Research and Development should be revised by looking at the aspects that can complement the existing rules, such the international declarations, especially International Ethical Guidelines for Biomedical Research Involving Human Subjects, as the guidance to developing countries like Indonesia. The protection of the patients is based on their human rights, namely by puts forward the security and health of the subject of the research and give in return, compensation, and/or financial compensation, insurance, and other form.
DAFTAR ISI
Pernyataan Keaslian ... i
Pengesahan Pembimbing ... ii
Persetujuan Panitia Sidang Ujian ... iii
Persetujuan Revisi ... iv
Abstrak ... v
Abstract ... vi
Kata Pengantar ... vii
Daftar Isi ... x
Daftar Tabel ... xv
Daftar Gambar ... xvi
BAB I PENDAHULUAN 1.1Latar Belakang Masalah ... 1
1.2Identifikasi Masalah ... 8
1.3Tujuan Penelitian ... 9
1.4Kegunaan Penelitian ... 9
1.5Kerangka Pemikiran ... 10
1.6Metode Penelitian ... 18
1.7Sistematika Penulisan ... 20
BAB II TINJAUAN PENGATURAN PENELITIAN MEDIS DI INDONESIA 2.1Sejarah Penelitian Medis ... 23
1. Amerika Serikat: American Cancer Society ... 37
2. Jerman ... 70
2.3Pelaksanaan Penelitian Medis di Indonesia ... 71
2.4Pengaturan Penelitian Medis di Indonesia ... 73
2.5Perlindungan Hukum Bagi Subjek Penelitian ... 75
1. Perlindungan Hukum Secara Umum ... 76
2. Perlindungan Hukum Secara Medis ... 78
BAB III HUBUNGAN PASIEN, PENELITI, DAN SPONSOR DALAM PENELITIAN MEDIS 3.1Pelaku Penelitian Medis ... 80
1. Pasien ... 81
2. Peneliti ... 82
3. Sponsor ... 87
4. Perusahaan Asuransi ... 89
3.2Pengajuan Dana Penelitian Medis di Luar Negeri ... 91
1. Proses Registrasi Grants.gov ... 92
2. Alur Registrasi IRB dan Mendapatkan FWA ... 96
3. Pengajuan Dana Penelitian Medis di European Commission ... 98
3.3Pengajuan Dana Penelitian Medis di Indonesia ... 99
3.4Peran Sponsor Dalam Pembiayaan Penelitian Medis ... 103
1. Hak Pasien... 105
2. Kewajiban Pasien ... 110
4. Kewajiban Peneliti ... 110
5. Hak Sponsor ... 112
6. Kewajiban Sponsor ... 113
7. Hubungan Pasien, Peneliti, dan Sponsor
a. Pasien dengan Peneliti ... 113
b. Peneliti dengan Sponsor ... 115
c. Sponsor dengan Pasien ... 119 BAB IV ANALISIS MENGENAI ASURANSI PASIEN SEBAGAI SUBJEK PENELITIAN MEDIS
4.1Pengaturan Terhadap Para Pihak yang Terlibat Dalam Penelitian Medis ... 123
4.1.1 Kekurangan Peraturan Pemerintah Nomor 39 Tahun 1995
tentang Penelitian dan Pengembangan Kesehatan ... 124
4.1.2Badan Penelitian dan Pengembangan Kesehatan ... 138
4.1.3Perlindungan Terhadap Pasien yang Menjadi Subjek Penelitian
Medis ... 145
1. Nuremberg Code ... 149
2. The Universal Declaration of Human Rights dan
International Covenant on Civil and Political Rights ... 149
3. The Declaration of Helsinki ... 152
4. The Belmont Report: Ethical Principle & Guidelines for the
5. International Ethical Guidelines for Biomedical Research
Involving Human Subjects ... 159
6. The Operational Guidelines for Ethics Committee that Review Biomedical Research ... 160
4.2Pembiayaan Penelitian Medis Oleh Perusahaan Asuransi ... 174
4.3.1 Pendanaan dan Pembiayaan Penelitian Medis ... 174
4.3.2 Asuransi Untuk Penelitian Medis ... 177
4.3.3 Hak Kekayaan Intelektual (HKI) ... 184
1. Hasil Penelitian ... 186
2. Keuntungan dari Segi Dana yang Tersisa ... 187
4.3.4 Penyelenggaraan Penelitian Medis di Indonesia ... 188
BAB V PENUTUP 5. 1 Kesimpulan ... 195
5. 2 Saran ... 197
Daftar Pustaka ... 200
Lampiran ... 205
1. Laporan Wawancara dengan Prof. Dr. dr. Susy Tjahjani, M.Kes.
2. Laporan Wawancara dengan dr. Budi Widyarto Lana, M.H.
3. Laporan Wawancara dengan Dr. Wahyu Widowati, M.Si.
4. Formulir Pengajuan Etik Penelitian Kesehatan untuk Survey,
Epidemiologi atau Sosial Budaya Fakultas Kedokteran Universitas
5. Formulir Pengajuan Etik Penelitian Fakultas Kedokteran Universitas
Indonesia (Rumah Sakit Cipto Mangunkusumo)
6. Prosedur Memperoleh Ethical Approval Fakultas Kedokteran Universitas
Padjajaran
7. Template Informed Consent dari World Health Organization (WHO)
8. Terjemahan Template Informed Consent dari World Health Organization
(WHO)
9. Informed Consent Form Example dari Newcastle University
10.Informed Consent Form dari University of Bolton
11.Unexpected Adverse Event Summary Report (Laporan Kejadian yang
Tidak Diharapkan)
12.IRB Registration Form
13.National Institute of Health (NIH) Summary Funding
14.Peraturan Pemerintah Nomor 39 Tahun 1995 tentang Penelitian dan
Pengembangan Kesehatan
15.Undang-Undang Nomor 40 Tahun 2014 tentang Perasuransian
DAFTAR TABEL
1. Konvensi Internasional... 70
2. Konvensi Internasional dan Peraturan di Indonesia ... 13
3. Imbalan, Kompensasi, dan Ganti Rugi ... 130
4. Usulan Tambahan atau Perubahan untuk Peraturan Pemerintah Nomor 39
DAFTAR GAMBAR
1. Statistik Pelaksanaan Pelaksanaan Penelitian Medis di Indonesia (Universitas
Indonesia) dan di Amerika ... 72
2. Statistik Biaya Untuk Penelitian Medis ... 92
3. Bagan Proses Registrasi IRB dan Mendapatkan FWA ... 95
4. Bagan Peran Pihak Peneliti, Pasien, dan Sponsor Dalam Pelaksanaan
Penelitian Medis ... 105
5. Bagan Posisi Badan Penelitian dan Pengembangan Kesehatan ... 139
6. Bagan Peran Pihak Peneliti, Pasien, Sponsor, dan Perusahaan Asuransi Dalam
BAB I PENDAHULUAN
A. Latar Belakang
Setiap manusia memiliki hak yang terus melekat pada dirinya sejak lahir.
Hak tersebut tidak dapat dikurangi, terlebih lagi dilanggar. Hak dasar tersebut
dikenal sebagai hak asasi. Pentingnya hak asasi yang dimiliki oleh setiap
orang menjadi dasar dibuatnya deklarasi-deklarasi yang berisi penghormatan
terhadap hak asasi manusia. Contoh: Universal Declaration of Human Rights
yang dibuat oleh Perserikatan Bangsa-Bangsa pada tahun 1948. Deklarasi ini
disusun sebagai bentuk reaksi terhadap keadaan yang terjadi selama Perang
Dunia II. Banyak sekali manusia yang diperlakukan tidak layak sehingga
mereka seakan tidak dianggap sebagai manusia. Deklarasi ini menjadi dasar
selanjutnya bagi pembuatan aturan yang berkaitan dengan hak asasi manusia.
Pengaturan dasar mengenai hak asasi manusia di Indonesia tercantum dalam
Pasal 28 Undang-Undang Dasar 1945. Hak asasi manusia tersebut mencakup
banyak hal, seperti hak atas hidup, hak atas rasa aman, hak atas kesehatan, dan
lainnya. Pemenuhan hak atas kesehatan ini memerlukan upaya tidak hanya
datang dari manusia itu sendiri tapi dari pihak yang terkait seperti pihak rumah
sakit atau bahkan pemerintah.
Kesehatan merupakan bagian dari kehidupan manusia yang tidak ternilai
harganya, baik itu dari segi jasmani maupun rohani. Semua manusia ingin
kenyataannya, manusia pasti pernah menderita sakit. Penyakit yang diderita
tersebut bermacam-macam, mulai dari sakit yang umum diderita seperti flu
hingga ada pula yang menderita penyakit langka seperti terdapat kawat di
perut manusia, kulit manusia yang menghitam dan bersisik, atau penyakit
langka yang menyebabkan wajah seseorang menghilang.1 Penyakit-penyakit
langka tersebut diderita oleh warga Indonesia. Hingga sekarang belum
diketahui penyebab munculnya penyakit tersebut dan obat yang dapat
menyembuhkannya.
Dalam hal ini, penderita penyakit langka atau penyakit lain yang belum
diketahui obatnya atau data mengenai penyakit tersebut diperlukan untuk
berpartisipasi menjadi pendukung penelitian. Penelitian ini disebut penelitian
medis. Subjek dari penelitian medis tersebut adalah penderita penyakit, yang
selanjutnya disebut subjek penelitian medis. Dinamakan subjek karena hukum
berada di dalam pribadi manusia, bukan hanya berfungsi sebagai aturan hidup
tetapi juga sebagai yang dihayati manusia melalui partisipasinya sebagai
subjek hukum.2 Sebaliknya, objek hukum menurut Pasal 499 KUHPerdata
adalah benda, yaitu segala sesuatu yang berguna bagi subjek hukum atau
segala sesuatu yang menjadi pokok permasalahan dan kepentingan bagi para
subjek hukum atau segala sesuatu yang dapat menjadi objek dari hak milik
(eigendom).3
1 http://www.ns19.kompas.web.id/2011/02/7-penyakit-langka-di-indonesia-yang.html, 5 Oktober
2014.
2 E. Sumaryono, Etika Profesi Hukum, Norma-Norma Bagi Penegak Hukum, Yogyakarta:
Kanisius, 2012, hlm 87.
3 Elsi Kartika Sari dan Advendi Simangunsong, Hukum Dalam Ekonomi, Cetakan Kelima Edisi II,
Manusia tidak dapat disebut objek penelitian berdasarkan analogi
penjelasan objek hukum. Jika manusia dianggap atau disebut sebagai objek
penelitian, maka peneliti dapat memperlakukan secara tidak manusiawi
manusia yang ikut serta dalam penelitian, seperti halnya yang dilakukan para
peneliti yang melanggar etika penelitian terdahulu. Seorang manusia harus
tetap diperlakukan sebagai manusia seutuhnya. Penelitian manusia yang
menderita suatu penyakit sangat penting dilakukan karena:
“ 1. Hasil penelitian jangka panjang, sejumlah besar pada hewan seringkali tak menggantikan hasil jangka pendek percobaan pada sedikit manusia; 2. Belum adanya model eksperimen pada hewan untuk penyakit tertentu;
dan
3. Adanya keuntungan bagi kemajuan ilmu kedokteran dengan baik
dengan risiko yang dapat dipertanggungjawabkan.”4
Terselenggaranya penelitian medis merupakan bagian dari pelaksanaan
pelayanan kesehatan yang menjadi hak setiap orang sebagaimana yang
disebutkan dalam Pasal 28H ayat (1) Undang-Undang Dasar Tahun 1945:
“Setiap orang berhak hidup sejahtera lahir dan batin, bertempat tinggal, dan
mendapatkan lingkungan hidup yang baik dan sehat serta berhak memperoleh
pelayanan kesehatan.” Selain itu, terselenggaranya penelitian medis sesuai
dengan poin 9 Strategi Rencana Pembangunan Jangka Menengah Nasional
(RPJMN) tahun 2015-2019, yaitu meningkatkan koordinasi dan efektifitas
penelitian dan pengembangan kesehatan dan Sasaran Strategis (Renstra)
Kementrian Kesehatan tahun 2015-2019, yaitu meningkatkan jumlah
rekomendasi kebijakan berbasis penelitian dan pengembangan keseehatan
4 Muchtan Sujatno, Bab II Etika Penelitian, In Metodologi Penelitian Biomedis, Edisi II,
yang diadvokasi ke pengelola program serta meningkatkan jumlah hasil
penelitian yang didaftarkan hak kekayaan intelektual.5
Pedoman internasional mengenai pelaksanaan penelitian medis, khususnya
dalam hal manusia sebagai subjek penelitiannya diatur dalam berbagai
[image:13.595.135.512.268.388.2]deklarasi, yaitu:6
Tabel 1 Deklarasi-Deklarasi Internasional
Tahun Konvensi
1947 Nuremberg Code
1948 Universal Declaration of Human Rights 1964 The Declaration of Helsinki
2000 Operational Guidelines for Ethics Committee that Review Biomedical Research
2002 International Ethical Guidelines for Biomedical Research Involving Human Subjects
Indonesia mengadopsi pedoman-pedoman tersebut untuk dijadikan dasar
pengaturan dan/atau pedoman pelaksanaan penelitian medis, termasuk uji
klinik yang melibatkan manusia. Pengaturan tersebut terdapat dalam Peraturan
Pemerintah Nomor 39 Tahun 1995 Tentang Penelitian dan Pengembangan
Kesehatan, Pedoman Etik Penelitian Kedokteran Indonesia, serta Pedoman
Cara Uji Klinik yang Baik (CUKB) yang dikeluarkan oleh Badan Pemeriksa
Obat dan Makanan tahun 2001.
Aturan dan/atau pedoman yang ada di Indonesia tersebut belum cukup
sebagai dasar dalam menyelenggarakan penelitian medis. Walaupun Indonesia
mengacu juga pada pedoman internasional, namun pengaturan dan/atau
5 Rancangan Teknokratik Renstra Kementerian Kesehatan 2015-2019, 16 Oktober 2014, hlm 13
dan 22.
6 M. Jusuf Hanafiah dan Amri Amir, Etika Kedokteran dan Hukum Kesehatan, Edisi 4, Jakarta:
pedoman tersebut belum mencakup semua aspek mengenai penelitian medis.
Sebagai contoh, tidak ada dasar hukum di Indonesia yang mengatur mengenai
sumber pendanaan penelitian dan perlindungan apa saja yang didapat oleh
subjek penelitian. Aturan yang ada lebih mengacu pada pedoman-pedoman
internasional, tanpa aturan jelas yang mengatur spesifik mengenai
penyelenggaraan penelitian medis di Indonesia.
Pengaturan mengenai subjek penelitian medis harus jelas dan tegas karena
dapat berdampak buruk bagi diri subjek penelitian tersebut. Berikut ini 5
(lima) kemungkinan atau probabilitas yang mungkin saja terjadi setelah
penelitian medis dilakukan, yaitu:
1. Penelitian berhasil dan kondisi subjek penelitian membaik;
2. Penelitian berhasil tapi kondisi subjek penelitian memburuk atau bahkan cacat;
3. Penelitian berhasil tapi subjek penelitian meninggal;
4. Penelitian gagal dan kondisi subjek penelitian memburuk atau cacat; dan 5. Penelitian gagal dan subjek penelitian meninggal.
Setiap orang yang menjadi subjek penelitian harus mengetahui manfaat
serta kemungkinan yang diramalkan dapat terjadi pada dirinya apabila mereka
bersedia secara sukarela menjadi subjek penelitian tersebut, seperti halnya
yang disebutkan dalam angka 18 Principles For All Medical Research The
Declaration of Helsinki:
“Every medical research study involving human subject must be preceded
by careful assessment of predictable risk and burdens to the individuals and communities involved in the research in comparison with foreseeable benefits to them or to other individuals or communities affected by the
condition under investigation.”7
Tujuan penelitian kesehatan ini adalah memberikan manfaat bagi banyak
pihak, yaitu bagi:
1. Pasien (pihak yang menjadi subjek penelitian), yang dalam hal ini
mendapat kemungkinan untuk sembuh tanpa mengeluarkan biaya
pengobatan;
2. Peneliti, yaitu untuk kepentingan ilmu pengetahuan;
3. Pihak perusahaan farmasi, yang dalam hal ini berkaitan dengan obat untuk
mengobati penyakit; dan
4. Pemerintah, yaitu kesejahteraan dan kesehatan masyarakat.
Demi terselenggaranya suatu penelitian medis, tentu memutuhkan dana.
Dana yang dibutuhkan tersebut sangat besar. Sebagai contoh, besar dana
investasi untuk penelitian kesehatan di National Institute of Health untuk
warga Amerika adalah mendekati $301.000.000.000 per tahun.8 Pendanaaan
penelitian medis yang sangat besar tersebut membutuhkan pihak-pihak yang
menjamin akan dibayarkannya dana kepada subjek penelitian apabila subjek
penelitian tersebut mengalami kemungkinan baik ataupun buruk, misalnya
saja dengan bekerja sama dengan pihak sponsor dan perusahaan asuransi.
Menurut Mark O. Hiepler, seorang pengacara California, pihak asuransi
menghindari kata-kata yang mengandung unsur pengeluaran dana cepat saat
kemungkinan buruk terjadi, seperti kata-kata menyangkut “penelitian”,
“percobaan”, dan “uji klinis”.9 Perusahaan asuransi sangat “sensitif” dengan
hal yang menyangkut pengeluaran biaya untuk klaim asuransi, sehingga
8 National Institute of Health, (http://www.nih.gov/about/budget.htm), 7 Oktober 2014.
9 Dapat dibaca pada
dibutuhkannya kata-kata sesuai fakta yang menunjukkan bahwa asuransi
dibutuhkan oleh pasien atau subjek penelitian.
Pihak yang menderita penyakit langka tersebut dialami oleh kelompok
manusia yang rentan (vurnerable).10 Dalam tulisan ini kelompok manusia
yang rentan dititikberatkan pada orang miskin. Mereka akan sangat terbantu
dengan diadakannya penelitian medis dengan mereka sebagai subjek
penelitiannya karena selain mereka tidak perlu mengeluarkan biaya untuk
pengobatan penyakit, mereka pun akan mendapat dana setelah mereka
berpartisipasi dalam penelitian. Kenyataan yang ada di Indonesia adalah sulit
menemukan pihak yang mau menjadi subjek penelitian karena tidak adanya
manfaat yang dapat diperoleh oleh subjek penelitian tersebut, yang dalam hal
ini adalah persoalan dana. Peningkatan peran perusahaan asuransi di
Indonesia, khususnya mengenai mengenai penelitian kesehatan sangat
membantu pihak peneliti dalam hal pendanaan dan terselenggaranya penelitian
medis. Hal ini dilakukan juga demi kemajuan penelitian di Indonesia.
Sejauh ini belum ada penelitian yang membahas atau meneliti mengenai
pengaturan dan perlindungan hukum pasien penelitian medis serta pembiayaan
penelitian medis oleh perusahaan asuransi. Adapun penelitian yang mendekati
topik penelitian penulis, seperti “Informed Consent Dalam Pelayanan dan
10
Manusia yang rentan (vulnerable) adalah manusia yang secara relatif atau absolut tidak mampu melindungi kepentingan sendiri. Karena itu, diperlukan pembenaran khusus untuk meminta manusia yang rentan untuk ikut serta sebagai subjek penelitian. Pihak yang termasuk dalam kategori ini adalah mereka yang takut menerima hukuman bila menolak ikut serta, seperti mahasiswa kedokteran dan keperawatan, karyawan rumah sakit, pegawai pabrik farmasi, tentara, dan polisi. Termasuk juga manusia usia lanjut dengan gejala demensia, orang miskin, tuna karya, kelompok minoritas etnik, tuna wisma, pengembara, pengungsi, narapidana, dan pasien penyakit yang tidak dapat disembuhkan, sebagaimana dikutip dari M. Jusuf Hanafiah dan Amri Amir,
Penelitian” yang dibuat oleh Eryati Darwin dari Fakultas Kedokteran
Universitas Andalas dan “Tinjuan Yuridis Terhadap Penelitian Kedokteran
Pada Manusia Dihubungkan Dengan Peraturan Pemerintah Nomor 39 Tahun
1995 Tentang Penelitian dan Pengembangan Kesehatan Juncto
Undang-Undang Nomor 23 Tahun 1992 Tentang Kesehatan” yang dibuat oleh Ika
Roseliyana tahun 2001. Penulis menyatakan bahwa penelitian-penelitian yang
disebutkan tersebut memiliki sudut pandang dan objek penelitian yang
berbeda dengan yang dilakukan penulis untuk penelitian ini.
Besarnya biaya untuk penelitian medis membuat peneliti mencari
tambahan dana dari pihak ketiga. Asuransi yang digunakan sebagai
pembiayaan penelitian medis memiliki peluang yang positif untuk dikaji
karena selain memiliki potensi bisnis yang baik, dapat berdampak baik pula
bagi banyak pihak yaitu berguna bagi kesejahteraan masyarakat. Berdasarkan
keadaan tersebut, penulis tertarik untuk melakukan penelitian yang dituangkan
dalam karya tulis berbentuk skripsi dengan judul “PROSPEK
PENGATURAN DAN PERLINDUNGAN HUKUM TERHADAP
PASIEN YANG MENJADI SUBJEK PENELITIAN MEDIS DAN
ASPEK PEMBIAYAAN OLEH PERUSAHAAN ASURANSI”.
B. Identifikasi Masalah
Berdasarkan latar belakang, identifikasi masalah yang didapat antara lain:
1. Bagaimana perlindungan hukum terhadap pasien yang menjadi subjek
2. Bagaimanakah akibat hukum pembiayaan penelitian medis yang dibiayai
oleh perusahaan asuransi?
C. Tujuan Penelitian
Berdasarkan rumusan masalah yang akan penulis bahas, tujuan dari penelitian
ini adalah:
1. Untuk mengetahui bagaimana perlindungan hukum terhadap pasien yang
menjadi subjek penelitian medis dan pengaturannya.
2. Untuk mengetahui bagaimanakah akibat hukum pembiayaan penelitian
medis yang dibiayai oleh perusahaan asuransi.
D. Kegunaan Penelitian
Kegunaan yang diharapkan dari penulisan ini antara lain:
1. Manfaat teoritis, yang terdiri dari:
a. Hasil penelitian ini diharapkan dapat berguna bagi pengembangan ilmu
pengetahuan di bidang ilmu hukum pada umumnya, khususnya
mengenai hukum kesehatan dan hukum asuransi; dan
b. Hasil penelitian ini diharapkan dapat memperkaya referensi dan
literatur dalam dunia kepustakaan mengenai pengaturan dan
perlindungan pasien dalam hal penelitian medis yang ditinjau dari
sudut perasuransian.
a. Hasil penelitian ini diharapkan dapat memberikan pengetahuan
mengenai perlu dikembangkannya penelitian medis di Indonesia; dan
b. Hasil penelitian ini diharapkan dapat memperhatikan hak-hak pasien
sebagai subjek penelitian dari sudut perasuransian.
E. Kerangka Pemikiran
“In much of society, research means to investigate something you do not
know or understand.”11
Kalimat mutiara dari Neil Armstrong ini
menggambarkan bahwa untuk memahami atau mengerti mengenai apa yang
ingin kita ketahui, kita harus melakukan penelitian. Penulis setuju dengan
pendapat Neil Amstrong tersebut karena hanya untuk mengetahui saja, kita
tidak perlu melakukan penelitian. Kita cukup mencari dari sumber lain,
bertanya ke orang lain atau mengetahui sendiri dari hal yang kita alami.
Contoh: saat kita menjatuhkan benda dari tempat tinggi, benda tersebut akan
jatuh ke tempat yang lebih rendah. Untuk mengetahui mengapa peristiwa itu
terjadi, kita perlu melakukan penelitian. Hasil yang didapat adalah bumi
memiliki gaya gravitasi sehingga semua benda yang dijatuhkan dari tempat
lebih tinggi pasti akan jatuh ke tempat yang lebih rendah. Hal ini diterapkan
pada kehidupan nyata dalam bidang penelitian terhadap makhluk hidup yang
tidak hanya dilakukan pada hewan dan tanaman saja, tapi pada manusia secara
langsung.
11
Penelitian yang dilakukan terhadap manusia sebagai subjeknya memang
bukanlah hal yang baru. Penelitian terhadap manusia telah dilakukan sebelum,
selama, dan setelah Perang Dunia II. Pada masa tersebut penelitian yang
dilakukan bermaksud untuk “pengobatan”. Penelitian pengobatan tersebut
salah satunya dikenal dengan nama “Lobotomy Transorbital”.12 Awalnya
lobotomi ini dilakukan oleh seorang psikiater bernama Walter Freeman.
Sebelum Perang Dunia II, praktik lobotomi dilakukan oleh Walter di 23
negara bagian Amerika Serikat. Selama dan setelah Perang Dunia II, praktik
ini dilakukan oleh pemerintah Amerika Serikat untuk menghilangkan
ketakutan, kecemasan, depresi, obsesi yang ditandai dengan kandungan
emosional tinggi, dan semua masalah kejiwaan yang telah menghancurkan
banyak orang. Dampak dari praktik ini adalah banyak manusia yang
mengalami kejang-kejang, amnesia, kehilangan kemampuan motorik, dan
bahkan beberapa orang meninggal dunia.13 Praktek lobotomy transorbital dan
praktek-praktek lain yang dilakukan oleh dokter-dokter pada zaman NAZI
yang mendasari dibuatnya Nuremberg Code dan deklarasi-deklarasi lainnya.14
Setiap penelitian memiliki prinsip dasar etika. Terlebih lagi penelitian yang
12 Lobotomy Transorbital adalah operasi dengan cara memotong jalur-jalur (serabut-serabut) urat
saraf yang terletak di antara lobus frontalis (dimana ditemukan tempat-tempat asosiasi untuk memonitor dan merencanakan tingkah laku) dan talamus serta hipotalamus dengan menyisipkan alat yang tajam dan tipis di antara bola mata melalui tulang rongga mata ke otak, sebagaimana dikutip dari Yustinus Semiun, Kesehatan Mental 3, Cetakan Kesatu, Yogyakarta: Kanisius, 2006, hlm 577.
13 'My Lobotomy': Howard Dully's Journey, 2005,
(http://www.npr.org/2005/11/16/5014080/my-lobotomy-howard-dullys-journey), 10 Oktober 2014.
Michael M. Phillips, (http://projects.wsj.com/lobotomyfiles/), 10 Oktober 2014.
14 NAZI adalah partai yang dipimpin oleh Adolf Hitler (1889-1945) dengan tujuan membuat
melibatkan manusia sebagai subjeknya, harus berdasarkan 4 (empat) prinsip
dasar etika penelitian, yaitu:
“ 1. Menghormati orang (respect for person), yang perlu
mempertimbangkan secara mendalam terhadap kemungkinan bahaya
dan penyalahgunakaan penelitian serta perlunya perlindungan terhadap
subjek penelitian yang rentan terhadap bahaya penelitian;
2. Manfaat (beneficence), untuk mengusahakan manfaat sebesar-besarnya
dan memperkecil kerugian atau risiko bagi subjek dan memperkecil
kesalahan penelitian;
3. Tidak membahayakan subjek penelitian (non-maleficence), dengan
mengurangi bahaya terhadap subjek serta melindungi subjek; dan
4. Keadilan (justice), dengan memperlakukan subjek dengan baik.”15
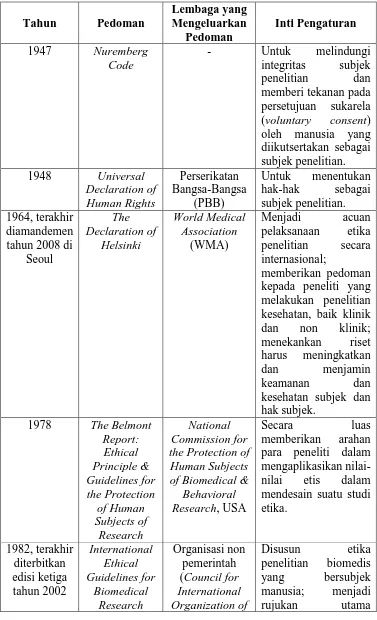
Berikut adalah pedoman-pedoman etik dalam penelitian medis secara
internasional dan yang ada di Indonesia:16
15 Muchtan Sujatno, op.cit., hlm 23.
16 Titiek Djannatun, Pengantar Etik Penelitian Kesehatan, Blok Metodologi Kesehatan, Prodi Gigi
– Fakultas Kedokteran Universitas YARSI
(https://www.academia.edu/7098960/Etik_Penelitian_Biomedik), 7 Oktober 2014.
Setyo Trisnandi, Etika Penelitian Kesehatan (https://www.scribd.com/doc/191733590/11-ETIKA-PENELITIAN), 7 Oktober 2014.
M. Jusuf Hanafiah dan Amri Amir, op.cit., hlm 185.
M. Sajid Darmadipura (eds), Isu Etik Dalam Penelitian di Bidang Kesehatan, Bab I: Strategi Etika
Penelitian Kesehatan, Jakarta: Asosiasi Ilmu Forensik Indonesia (AIFI) dan Universitas YARSI,
2013, hlm 2.
Tabel 2 Pedoman Penelitian Etik Dalam Penelitian Medis Secara Internasional dan Nasional
Tahun Pedoman
Lembaga yang Mengeluarkan
Pedoman
Inti Pengaturan
1947 Nuremberg
Code
- Untuk melindungi
integritas subjek
penelitian dan
memberi tekanan pada persetujuan sukarela (voluntary consent) oleh manusia yang diikutsertakan sebagai subjek penelitian.
1948 Universal
Declaration of Human Rights
Perserikatan Bangsa-Bangsa
(PBB)
Untuk menentukan
hak-hak sebagai
subjek penelitian. 1964, terakhir
diamandemen tahun 2008 di
Seoul The Declaration of Helsinki World Medical Association (WMA)
Menjadi acuan
pelaksanaan etika penelitian secara internasional;
memberikan pedoman kepada peneliti yang melakukan penelitian kesehatan, baik klinik dan non klinik; menekankan riset harus meningkatkan
dan menjamin
keamanan dan
kesehatan subjek dan hak subjek.
1978 The Belmont
Report: Ethical Principle & Guidelines for the Protection of Human Subjects of Research National Commission for the Protection of Human Subjects of Biomedical &
Behavioral Research, USA
Secara luas
memberikan arahan para peneliti dalam mengaplikasikan nilai-nilai etis dalam mendesain suatu studi etika. 1982, terakhir diterbitkan edisi ketiga tahun 2002 International Ethical Guidelines for Biomedical Research Organisasi non pemerintah (Council for International Organization of
Disusun etika
penelitian biomedis
yang bersubjek
manusia; menjadi
Involving Human Subjects Medical Science atau CIOMS) yang berafiliasi resmi dengan WHO
Penyusunan Pedoman
Nasional Etik
Penelitian Kesehatan di Indonesia; memberi perhatian khusus pada etik penelitian di negara berkembang.
2000 The
Operational Guidelines for Ethics Committee that Review Biomedical Subjects World Health Organization (WHO)
Membahas secara
rinci cara
pembentukan Komisi
Etik Penelitian
Kesehatan (KEPK), memberi petunjuk tentang keanggotaan, tata kerja komisi, cara pengajuan aplikasi, pengkajian protokol, pembuatan keputusan, tindak lanjut, dan dokumentasi.
1987 Pedoman Etik
Penelitian Kedokteran Indonesia Fakultas Kedokteran Universitas Indonesia Merumuskan
pedoman etik bagi peneliti yang memakai Deklarasi Helsinki sebagai dasar dan rekomendasi
pembentukan panitia etik penelitian di
semua fakultas
kedokteran.
2001 Pedoman Cara
Uji Klinik yang Baik
Badan Pengawas Obat dan Makanan
Standar etik dan ilmiah untuk mendesain, melaksanakan, mencatat, dan
Requirements for Registration of Pharmaceuticals for Human Use, 1966.
2004 Pedoman
Nasional Etik Penelitian Kesehatan
Komisi Nasional Etik Penelitian
Kesehatan
Berisi pedoman
nasional di bidang etik penelitian kesehatan yang
mengikutsertakan
manusia dan
menggunakan hewan percobaan.
Ketentuan-ketentuan di atas diciptakan untuk dijadikan pedoman terhadap
penelitian medis yang dilakukan terhadap subjek manusia dan sangat penting
sebagai dasar untuk menyelenggarakan penelitian medis. Terdapat 3 (tiga)
unsur esensial dalam hal pelaksanaan penelitian medis, yaitu:
Pertama, dibutuhkannya pihak peneliti yang melaksanakan penelitian
medis. Kedua, harus adanya manusia sebagai subjek penelitian. Pihak yang
setuju secara sukarela untuk menjadi subjek penelitian, wajib untuk mengisi
persetujuan setelah penjelasan (informed consent). Informed consent berisi
semua keterangan yang ilmuwan atau peneliti miliki mengenai eksperimen
yang akan dilaksanakan, manfaat yang akan diperoleh, nilai eksperimen bagi
masyarakat, dan risiko-risiko yang ada dan yang mungkin timbul.17 Jika
risiko-risiko yang mungkin timbul tersebut melebihi manfaat yang didapat,
maka penelitian lebih baik tidak dilakukan: “Medical research involving
17 Sri Oemijati (eds), Pedoman Etik Penelitian Kedokteran Indonesia, Jakarta: Fakultas
human subjects may only be conducted if the importance of the objective
outweighs the inherent risk and burdens to the subject.”18
Ketiga, terselenggaranya suatu penelitian medis dibutuhkan dana. Dana
tersebut dapat diperoleh dari berbagai sumber, misalnya mengajukan dana
melalui proposal penelitian kepada pemerintah, perusahaan farmasi atau
perusahaan asuransi. Dalam hal ini pemerintah dan perusahaan farmasi
bertindak sebagai sponsor. Tujuan diadakannya sponsor adalah sebagai
penunjang penelitian karena dana yang dibutuhkan untuk suatu penelitian
medis tidaklah sedikit. Apalagi penelitian tersebut melibatkan manusia dimana
tidak ada yang mengetahui pasti risiko yang terjadi terhadap diri manusia yang
menjadi subjek penelitian. Dalam hal inilah dibutuhkan peran perusahaan
asuransi untuk melindungi (cover) hak pasien dari kemungkinan baik maupun
kemungkinan buruk yang mungkin terjadi pada diri pasien setelah
dilaksanakannya penelitian medis.
Peneliti wajib melampirkan etchical clearance untuk pengajuan dana.19
Ethical clearance adalah pernyataan bahwa rencana kegiatan penelitian yang
tergambar dalam protokol telah dilakukan kajian dan telah memenuhi kaidah
etik sehingga layak dilaksanakan. Ethical clearance ini dikeluarkan oleh
Komisi Etik Penelitian agar menjamin subjek penelitian menjaga agar para
peneliti melakukan penelitian secara benar atau menjamin good practice of the
researchers.20
18 Angka 21 Principles for All Medical Research The Declaration of Helsinki, op.cit. 19 Muchtan Sujatno, op.cit., hlm 28.
20 Komisi Etik Penelitian Kesehatan, 2014, (www.ke.litbang.depkes.go.id/kom14/?p=82), 7
Kenyataan yang terjadi mengenai pelaksanaan penelitian di Indonesia
adalah belum memadai. Hal ini disebabkan oleh 2 (dua) hal. Pertama, sulitnya
mencari pihak yang secara sukarela hendak menjadi subjek penelitian. Berikut
adalah contoh penelitian biomedis yang kurang atau belum memadai dalam
hal pemeriksaan iodium yang telah dilakukan di Indonesia:
“Spesimen urin untuk pemeriksaan iodium dikumpulkan dari satu anggota
rukun tetangga adalah berumur 6-12 tahun dan satu anggota rukun tetangga wanita berusia 15-49 tahun. Untuk mengetahui kadar iodium dalam sampel garam, ditargetkan 25.000 sample sudah diperiksa di laboratorium. Sebanyak 21.741 sampel garam diterima dan 12.653 sampel sudah diperiksa di laboratorium. Hanya 11.430 hasil pemeriksaan yang dapat dianalisis, sedangkan 1.223 sampel tidak dapat dimasukkan ke dalam analisis karena identitas tidak lengkap. Pada pelaksanaan pengumpulan darah biomedis spesimen darah, dari 92.000 responden yang ditargetkan hanya 56.719 yang bersedia diambil darah untuk pemeriksaan biomedis. Dari responden yang telah bersedia dan menandatangani informed consent, hanya 50.912 yang datang ke laboratorium lapangan. Pada saat diterapkan kriteria inklusi atau eksekusi dalam pengambilan darah oleh dokter pendamping, jumlah responden yang berhasil diperiksa adalah 49.931. Berkurangnya jumlah responden yang diperiksa dibandingkan dengan target disebabkan terdapat dua responden yang menolak berpartisipasi, beberapa responden terpilih berasal dari rukun tetangga yang berjumlah kurang dari dua puluh lima orang, responden tidak mendapat izin untuk meninggalkan pekerjaan atau ujian sekolah, medan yang sulit dan cuaca buruk saat pengambilan atau pemeriksaan biomedis, adanya gangguan keamanan, dieksklusi oleh dokter
pendamping, atau responden mengundurkan diri.”21
Penelitian yang belum memadai tersebut dapat disebabkan oleh beberapa
faktor, antara lain: kurangnya inisiatif warga untuk menjadi subjek penelitian
biomedis, kurang efektifnya metode prosedur yang dilaksanakan dalam
penelitian, dan kurangnya kesiapan dalam menjalankan penelitian. Kedua,
sulitnya untuk mencari sumber dana. Perusahaan asuransi di Indonesia
21 Badan Penelitian dan Pengembangan Kesehatan Kementrian Kesehatan Republik Indonesia,
memang berkembang. Tapi bukan dalam hal pembiayaan asuransi kesehatan
untuk penelitian medis. Besarnya resiko yang belum pasti timbul dari
penelitian medis membuat perusahaan asuransi enggan untuk menyokong
pendanaan penelitian.
F. Metode Penelitian
Metode penelitian yang digunakan pada penulisan ini berupa metode
yuridis normatif dengan spesifikasi penelitian bersifat deskriptif analitis.
1. Tahap Penelitian dan Bahan Penelitian
Penelitian ini menggunakan metode yuridis normatif, yaitu penelitian yang
difokuskan untuk mengkaji penerapan kaidah-kaidah atau norma-norma
dalam hukum positif.22 Pendekatan yang digunakan dalam penelitian ini
adalah pendekatan undang-undang (statute approach), yaitu dengan
menelaah semua undang-undang dan regulasi yang berkaitan dengan
hukum kesehatan, hukum perdata, dan hukum asuransi, serta pendekatan
konseptual (conceptual approach) yang beranjak dari
pandangan-pandangan dan doktrin-doktrin yang berkembang di dalam ilmu hukum.23
Berdasarkan pendekatan-pendekatan tersebut, penulis meneliti bahan
pustaka atau data sekunder, yang terdiri dari:24
a. Bahan hukum primer
22
Johnny Ibrahim, Teori dan Metodologi Penelitian Hukum Normatif Edisi Revisi, Malang: Bayumedia Publishing, 2007, hlm 295.
23 Peter Mahmud Marzuki, Penelitian Hukum Edisi Revisi, Jakarta: Kencana Prenada Media
Group, 2013, hlm 133 dan 135.
24
Bahan hukum primer adalah bahan hukum yang terdiri atas peraturan
perundang-undangan yang diurut berdasarkan hirearki. Peraturan
perundang-undangan yang dipakai adalah Undang-Undang Nomor 40
Tahun 2014 tentang Perasuransian, Undang-Undang Nomor 36 Tahun
2009 tentang Kesehatan, dan Peraturan Pemerintah Nomor 39 Tahun
1995 tentang Penelitian dan Pengembangan Kesehatan.
b. Bahan hukum sekunder
Bahan hukum sekunder adalah bahan hukum yang terdiri atas
buku-buku (textbook) yang ditulis para ahli hukum yang berpengaruh (de
herseende leer), jurnal-jurnal hukum, pendapat para sarjana,
kasus-kasus hukum, yurisprudensi, dan hasil-hasil simposium mutakhir yang
berkaitan dengan topik penelitian. Bahan hukum sekunder yang
digunakan adalah deklarasi-deklarasi yang berhubungan dengan
penelitian terhadap manusia, seperti Nuremberg Code, Universal
Declaration of Human Rights, The Declaration of Helsinki,
International Ethical Guidelines for Biomedical Research Involving
Human Subjects, The Operational Guideline for Etchics Committee
that Review Biomedical Subjects, International Ethical Guidelines for
Biomedical Research Involving Human Subjects, The Belmont Report:
Ethical Principle & Guidelines for the Protection of Human Subjects
of Research, Pedoman Etik Penelitian Kedokteran Indonesia, Cara Uji
Klinik yang Baik (CUKB), dan Pedoman Nasional Etik Penelitian
c. Bahan hukum tersier
Bahan hukum tersier adalah bahan hukum yang memberikan petunjuk
atau penjelasan terhadap bahan hukum primer dan bahan hukum
sekunder, seperti kamus hukum, encyclopedia, dan lain-lain.
2. Teknik Analisis Data
Teknik analisis data yang digunakan dalam penelitian hukum ini
menggunakan cara analisis kualitatif dengan pola pikir logika deduktif,
yaitu pola pikir untuk menarik kesimpulan dari kasus-kasus individual
nyata menjadi kesimpulan yang bersifat umum. Pada penelitian hukum
yang berjenis normatif ini, bahan hukum primer, sekunder, dan tersier
tidak dapat lepas dari berbagai penafsiran hukum yang dikenal dalam ilmu
hukum yang diperoleh dengan cara membaca, mengkaji, dan mempelajari
bahan pustaka, baik berupa peraturan perundang-undangan, artikel,
internet, makalah seminar nasional, jurnal, dokumen, dan data-data lain
yang mempunyai kaitan dengan data penelitian ini.
G. Sistematika Penulisan
Untuk mendapatkan gambaran yang jelas mengenai keseluruhan isi, penulisan
hukum ini akan dibagi menjadi lima bab, yaitu pendahuluan, tinjauan pustaka,
objek penelitian, penelitian dan pembahasan, serta penutup dengan
BAB I PENDAHULUAN
Dalam bab ini akan dikemukakan mengenai latar belakang
masalah, identifikasi masalah, tujuan penelitian, kegunaan
penelitian, kerangka pemikiran, metode penelitian, dan sistematika
penulisan.
BAB II TINJAUAN PENGATURAN PENELITIAN MEDIS DI
INDONESIA
Bab kedua ini adalah bab mengenai tinjauan pustaka, membahas
mengenai uraian teori, asas, norma, doktrin yang relevan yang
diteliti, baik dari buku, jurnal ilmiah, yurisprudensi,
perundang-undangan, dan sumber data lainnya. Bab ini akan membahas
mengenai hal-hal apa saja yang berkaitan antara alasan
diadakannya penelitian medis dan deklarasi atau pedoman apa saja
yang manjadi landasan diadakannya penelitian medis, terutama
penelitian yang dilakukan terhadap manusia sebagai subjeknya.
Bab II ini meliputi sejarah penelitian medis, pelaksanaan penelitian
medis di Indonesia, pengaturan pelaksanaan medis di Indonesia,
dan perlindungan hukum bagi subjek penelitian.
BAB III HUBUNGAN PASIEN, PENELITI, PERUSAHAAN ASURANSI
DAN SPONSOR DALAM PENELITIAN MEDIS
Bab ini berisi uraian mengenai objek penelitian, yaitu mengenai
adanya hubungan hukum dalam hal penelitian medis antara pasien
mendanai penelitian medis. Hal-hal yang termasuk dalam bab ini
adalah mengenai pelaku-pelaku dalam penelitian medis,
pembiayaan penelitian medis di Indonesia, pembiayaan penelitian
medis di luar negeri, dan peran dari pihak ketiga dalam pembiayaan
penelitian medis.
BAB IV ANALISIS MENGENAI ASURANSI PASIEN SEBAGAI
SUBJEK PENELITIAN MEDIS
Bab ini merupakan penjelasan dari penelitian yang dilakukan
penulis mengenai pengaturan terhadap pasien yang menjadi subjek
penelitian medis, perlindungan terhadap pasien yang menjadi
subjek penelitian medis, dan pembiayaan penelitian medis oleh
perusahaan asuransi.
BAB V PENUTUP
Bab ini sebagai bagian akhir penulisan penelitian mengenai
kesimpulan dan saran sebagai suatu masukan maupun perbaikan
BAB V PENUTUP
5. 1 Simpulan
Berdasarkan pembahasan penulis, jawaban atas identifikasi masalah pada
Bab I skripsi ini adalah:
1. Melibatkan manusia sebagai subjek penelitian medis membutuhkan
aturan yang jelas dan perlindungan yang pasti karena berhubungan
dengan hak asasinya sebagai manusia. Aturan yang jelas tersebut
diwujudkan melalui peraturan yang terperinci mengatur suatu hal dan
dapat diaplikasikan secara nyata. Peraturan Pemerintah Nomor 39 Tahun
1995 tentang Penelitian dan Pengembangan Kesehatan belum mencakup
semua hal yang berkaitan dengan penelitian dan pengembangan
kesehatan dan harus diperbaharui.
Dibutuhkannya peran dari berbagai pihak, dapat datang dari pihak
akademisi, lembaga, atau pihak lain, yang melihat adanya hal yang harus
diubah dalam pengaturan dalam tata hukum di Indonesia agar menjadi
lebih baik atau berpotensi dalam pelaksanaannya, seperti halnya
pelaksanaan penelitian medis di Indonesia. Peraturan Pemerintah Nomor
39 Tahun 1995 tentang Penelitian dan Pengembangan Kesehatan perlu
direvisi dengan melihat aspek-aspek yang dapat melengkapi aturan-aturan
yang telah ada, seperti melihat deklarasi-deklarasi internasional, terutama
Subjek Manusia (International Ethical Guidelines for Biomedical
Research Involving Human Subjects) sebagai pedoman yang dikhususkan
untuk negara berkembang seperti Indonesia.
Perlindungan hukum terhadap pasien yang menjadi subjek penelitian
medis diaplikasikan melalui setidaknya 4 (empat) hal, yaitu:
a. Informed consent yang ditandatangani oleh pasien tersebut atau oleh
walinya;
b. Ethical clearance sebagai bukti bahwa penelitian yang akan
dijalankan telah memenuhi kriteria etis;
c. Menjalankan hak-hak subjek penelitian medis; dan
d. Mendapatkan imbalan, kompensasi, dan/atau ganti rugi.
Perlindungan bagi pasien diatur dalam pedoman-pedoman internasional
yang dijadikan dasar bagi pedoman-pedoman mengenai penelitian medis
di Indonesia. Pedoman-pedoman internasional dan nasional tersebut
meliputi: Nuremberg Code, Universal Declaration of Human Rights, The
Declaration of Helsinki, International Ethical Guidelines for Biomedical
Research Involving Human Subjects, The Operational Guidelines for
Ethical Committee that Review Biomedical Subjects, The Belmont Report:
Ethical Principle & Guidelines for the Protection of Human Subjects of
Research, Pedoman Etik Penelitian Kedokteran Indonesia, Pedoman Cara
Uji Klinik yang Baik, Pedoman Nasional Etik Penelitian Kesehatan, dan
Indonesia memiliki Peraturan Pemerintah Nomor 39 Tahun 1995 tentang
2. Akibat hukum pembiayaan penelitian medis yang dibiayai oleh
perusahaan asuransi adalah harus dipenuhinya prestasi setelah perusahaan
asuransi setuju untuk menjadi salah satu pihak penyelenggara penelitian
dan pengembangan kesehatan. Prestasi yang diberikan adalah dalam
bentuk:
a. Imbalan, yang diberikan sebelum penelitian medis dilakukan dan
digunakan sebagai bujukan untuk berpartisipasi;
b. Kompensasi, yang diberikan apabila subjek penelitian medis menderita
cedera; dan/atau
c. Ganti rugi, yang diberikan apabila terjadi kasus kematian pada subjek
penelitian medis.
Prestasi memberikan imbalan, kompensasi, dan/atau ganti rugi dialihkan
kepada pihak sponsor penelitian medis apabila perusahaan asuransi tidak
bersedia ikut ambil alih masalah pembiayaan penyelenggaraan penelitian
medis.
5. 2 Saran
Saran penulis mengenai penyelenggaraan penelitian medis di Indonesia
adalah:
1. Perlindungan bagi manusia atau pasien sebagai subjek penelitian medis
perlu diaplikasikan secara nyata dan dengan prosedur yang sesuai,
sehingga dapat meminimalisir kemungkinan buruk yang akan terjadi
perlu tertuang dalam suatu pengaturan yang menyeluruh dan terperinci.
Pedoman penyelenggaraan penelitian medis di Indonesia masih banyak
kekurangan, sehingga sebaiknya dilengkapi dan diperbaharui dengan
mengadopsi pedoman-pedoman internasional yang ada. Peraturan
Pemerintah Nomor 39 Tahun 1995 tentang Penelitian dan Pengembangan
Kesehatan pun perlu diperbaharui karena setidaknya terdapat 4 (empat)
alasan, yaitu:
a. Undang-Undang Nomor 23 Tahun 1992 tentang Kesehatan sudah
tidak berlaku, sehingga hal-hal yang diatur perlu disesuaikan dengan
peraturan baru;
b. Peraturan baru yang dimaksud pada poin a adalah Undang-Undang
Nomor 36 Tahun 2009 tentang Kesehatan. Pengaturan mengenai
penelitian dan pengembangan kesehatan terkini adalah turunan dari
Pasal 44 Undang-Undang Nomor 36 Tahun 2009 tentang Kesehatan;
c. Diperlukannya pengaturan mengenai penelitian dan pengembangan
kesehatan secara lengkap, jelas, dan rinci; dan
d. Sebagai dasar pedoman atau pengaturan lain yang berkaitan dengan
pelaksanaan atau penyelenggaraan penelitian medis.
2. Sebaiknya Indonesia menjalin kerjasama dengan pihak luar negeri sebagai
sponsor, yang dalam hal ini adalah mengenai penelitian dan
pengembangan kesehatan di Indonesia. Perlu diperhatikan juga mengenai
penelitian dan pengembangan kesehatan (penelitian medis) dengan pihak
luar negeri tersebut, contoh: berkaitan dengan:
a. Hak dan kewajiban masing-masing pihak;
b. Prosedur pelaksanaan;
c. Kerahasiaan data yang didapat selama dan setelah penelitian medis,
yang mencakup data subjek penelitian; dan
d. Pembagian hasil penelitian medis yang didapatkan;
e. Hal lain yang perlu diatur sehubungan dengan pelaksanaan penelitian
Identitas Diri
Nama : Shelly Kurniawan
Tempat, Tanggal Lahir : Bandung, 25 Agustus 1993
Jenis Kelamin : Perempuan
Alamat : Taman Kopo Indah III Blok E3 Nomor 21, Bandung
Telepon : 08987108385
E-mail : shlyfurryl@yahoo.com
Riwayat Pendidikan Formal
Tahun Periode Sekolah
1999 - 2005 SDN Negeri Pajagalan 58, Bandung 2005 - 2008 SMP Kristen Gracia, Bandung 2008 - 2011 SMA Katholik Trinitas, Bandung
2011 - 2015 Fakultas Hukum di Universitas Kristen Maranatha, Bandung
Riwayat Pendidikan Informal
Tahun Periode Pendidikan
2011 Peserta Seminar Call For Paper “Problematika Hukum Dalam Implementasi
Bisnis dan Investasi (Prespektif Multidisipliner)”
2012
Peserta Seminar The United Nations For You “UN4U” Campaign Peserta Seminar “Mediasi Sebagai Alternatif Penyelesaian Sengketa dan
Implementasinya di Indonesia”
Peserta Outbond Fakultas Hukum Universitas Kristen Marantha “Save the
Mountain and Green Action”
2013
Peserta Latihan Dasar Kepemimpinan
Peserta Lomba Legal Opinion “The 4th Business Law Competition 2013,
Business Law Society”– Fakultas Hukum Universitas Indonesia
2014
Peserta Lomba Pencarian dan Analisis Putusan Pengadilan – Universitas Islam Negeri Sunan Gunung Djati
Narasumber Radio Suara Indah Tema “Praktek Advokat di Indonesia” Narasumber Radio Suara Indah Tema “Hukum Media Massa”
Peserta Lomba Simulasi Mood Court Competition “Mutiara Djokosoetomo
2011-2012 Tim Legal Drafting Fakultas Hukum Universitas Kristen Maranatha
2012 Panitia Seminar Hukum Investasi dan Perdagangan Indonesia Dalam Menyongsong Era Perdagangan Bebas Kawasan Asia Tenggara
2013
Panitia Peserta Seminar Sosialisasi Surat Utang Negara (SUN) Panitia Lomba Debat Intern Fakultas Hukum
Panitia Bakti Sosial di Rumah Kasih
Panitia Bedah Buku “Women in the Glass” Panitia Seminar Pendidikan Elektronik
Panitia Lomba Debat Tingkat SMA dalam Memperingati Piala Dekan Fakultas Hukum
2013 - 2014
Tim Research Debate Fakultas Hukum Universitas Kristen Maranatha Divisi Keuangan Senat Mahasiswa Fakultas Hukum Universitas Kristen Maranatha
2014 Panitia Latihan Dasar Kepemimpinan (LDK) Senat-BPM Fakultas Hukum Universitas Kristen Maranatha
2014 - sekarang Anggota Moot Court Fakultas Hukum Universitas Kristen Maranatha
Contoh Kasus, Edisi Kedua, Cetakan Ke-4:Prenada Media Group, Jakarta, 2005.
Chidir Ali, Badan Hukum, Alumni, Bandung, 2005.
Desriza Ratman, Aspek Hukum Informed Consent dan Rekam Medis Dalam Transaksi Terapeutik, Keni Media, Bandung, 2013.
Djaja S. Meliala, Perkembangan Hukum Perdata Tentang Benda dan Hukum Perikatan, Nuansa Aulia, Bandung, 2008.
E. Sumaryono, Etika Profesi Hukum, Norma-Norma Bagi Penegak Hukum, Kanisius, Yogyakarta, 2012.
Elsi Kartika Sari dan Advendi Simangunsong, Hukum Dalam Ekonomi, Cetakan Kelima Edisi II, Grasindo, Jakarta, 2008.
Johnny Ibrahim, Teori dan Metodologi Penelitian Hukum Normatif Edisi Revisi, Bayumedia Publishing, Malang, 2007.
K. Bertens, Etika, Jakarta: PT. Gramedia Pustaka Utama, 2007.
________, Etika Biomedis, Kanisius, Yogyakarta, 2011.
Komnas Perempuan, Modul Pelatihan, Pemenuhan Hak-Hak Konstitusi Warga Negara, Komisi Nasional Anti Kekerasan Terhadap Perempuan (Komnas Perempuan), Jakarta, 2010.
M. Jusuf Hanafiah dan Amri Amir, Etika Kedokteran dan Hukum Kesehatan, Edisi 4, Buku Kedokteran EGC, Jakarta, 2008.
M. Sajid Darmadipura (eds), Isu Etik Dalam Penelitian di Bidang Kesehatan, Bab I: Strategi Etika Penelitian Kesehatan, Asosiasi Ilmu Forensik Indonesia (AIFI) dan Universitas YARSI, Jakarta, 2013.
University of Cambridge, United Kingdom, 2002.
Peter Mahmud Marzuki, Penelitian Hukum Edisi Revisi, Kencana Prenada Media Group, Jakarta, 2013.
Philipus M. Hadjon , Perlindungan Hukum Bagi Rakyat Indonesia, Bina Ilmu, Surabaya, 1987.
Saidin, Aspek Hukum Hak Kekayaan Intelektual (Intellectual Property Rights), PT. Raja Grafindo Persada, Jakarta, 2007.
Satrio, Hukum Perikatan: Perikatan Pada Umumnya, Alumni, Bandung, 1999.
Soekidjo Notoatmodjo, Etika & Hukum Kesehatan, Rineka Cipta, Jakarta, 2010.
Sri Oemijati (eds), Pedoman Etik Penelitian Kedokteran Indonesia, Fakultas Kedokteran Universitas Indonesia, Jakarta, 1987.
Subekti, Pokok-Pokok Hukum Perdata, Pembimbing Masa, Jakarta, 1996.
Yustinus Semiun, Kesehatan Mental 3, Cetakan Kesatu, Kanisius, Yogyakarta, 2006.
Perundang-undangan dan Deklarasi Internasional
Undang-Undang Dasar Tahun 1945.
Undang-Undang Nomor 39 Tahun 1999 tentang Hak Asasi Manusia.
Undang-Undang Nomor 36 Tahun 2009 tentang Kesehatan.
Undang-Undang Nomor 40 Tahun 2014 tentang Perasuransian.
Peraturan Pemerintah Nomor 39 Tahun 1995 tentang Penelitian dan Pengembangan Kesehatan.
Biomedis yang Melibatkan Subjek Manusia, Geneva, 1993
Nuremberg Code¸1947.
The Universal Declaration of Human Rights, 1948.
The Declaration of Helsinki, 2008.
International Ethical Guidelines for Biomedical Research Involving Human Subjects (CIOMS), 2002.
The Operational Guidelines for Ethics Committee that Review Biomedical Subjects, 2000.
The Belmont Report: Ethical Principle & Guidelines for the Protection of Human Subjects of Research, 1978.
Pedoman Etik Penelitian Kedokteran Indonesia, 1987.
Pedoman Cara Uji Klinik yang Baik (CUKB), 2001.
Pedoman Nasional Etik Penelitian Kesehatan, 2004.
Sumber Web
Administrator Etik Penelitian Kesehatan,
(http://www.ke.litbang.depkes.go.id/kepk13/index.php?view=article&catid=1% 3Alatest-news&id=46%3Aetikpenelitian&format=pdf&option=com_content)
Arief Suryono, Asuransi Kesehatan Berdasarkan Undang-Undang Nomor 3 Tahun 1992, Fakultas Hukum Universitas Jenderal Soedirman Purwokerto, (http://fh.unsoed.ac.id/sites/default/files/fileku/dokumen/JDHvol92009/VOL9S2 009%20ARIEF%20SURYONO.pdf)
Dyah Hapsari Prananingrum, Telaah Terhadap Esensi Subjek Hukum: Manusia dan Badan Hukum,
Kementerian PPN/Bapennas, Bapennas dan Kemenkes Matangkan RT-RPJMN
2015-2019 Bidang Kesehatan, 2014, (
http://www.bappenas.go.id/berita-dan- siaran-pers/bappenas-dan-kemenkes-matangkan-rt-rpjmn-2015-2019-bidang-kesehatan/)
Medical Research Unit (Medical Faculty University of Indonesia),
(http://mru.fk.ui.ac.id/index.php?uPage=dashboard.grafiktipe&smod=dashboard &sp=public)
National Institute of Health, Office of Extramural Research,
(http://nexus.od.nih.gov/all/2014/06/30/more-on-the-physician-scientist-workforce/)
The European Commission Framework Programme for Research and Innovation, (https://ec.europa.eu/programmes/horizon2020/en/how-get-funding)
U.S. Department of Health and Human Service,
(http://www.hhs.gov/ohrp/assurances/assurances/index.html)
US National Library of Medicine National Institute of Health, Evolution of Clinical Research: A History Before and Beyond James Lind, 2010, (http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3149409/)
Kbbi.web.id
http://www.aktual.co/teknoget/120435kejar-ketertinggalan-teknologi-indonesia-butuh-200000-peneliti-lagi
http://www.litbang.depkes.go.id/knepk
http://projects.wsj.com/lobotomyfiles/
http://wanbul.blogspot.com/2013/05/saat-klaim-asuransi-jangan-katakan-ini.html
http://www.nih.gov/about/budget.htm
www.goodreads.com/quotes/tag/history
http://www.goodreads.com/quotes/tag/insurance
https://www.scribd.com/doc/191733590/11-ETIKA-PENELITIAN
http://www.fk.ui.ac.id/?page=content.view&alias=ethic_commitee
http://www.grants.gov/web/grants/applicants/apply-for-grants.html
http://Report.nih.go
http://www.hhs.gov/ohrp/assurances/irb_fwa_steps_and_order_chart_text_11jan1 0.html
Sumber Lain
Agus Suwandono, The Dance of Minds: 35 Tahun Badan Litbangkes 1975-2010, Kementerian Kesehatan RI, Jakarta, 2010.
Komisi Etik Penelitian Kesehatan.
Rencana Pembangunan Jangka Menengah Nasional (RPJMN) Tahun 2015-2019.
Rencana Strategis (Renstra) Kementrian Kesehatan Tahun 2015-2019.
Riset Kesehatan Dasar Badan Penelitian dan Pengembangan Kesehatan Kementrian Kesehatan Republik Indonesia Tahun 2013.
Ross C. DeVol, (eds), The Global Biomedical Industry: Preserving U.S. Leadership, Santa Monica, Milken Institute, California, 2011.
Titiek Djannatun, Pengantar Etik Penelitian Kesehatan, Blok Metodologi
Kesehatan, Prodi Gigi – Fakultas Kedokteran Universitas YARSI.