commit to user
i
IDENTIFIKASI DAN UJI AKTIVITAS ANTIBAKTERI FRAKSI TERAKTIF DAUN SIRIH MERAH
(Piper crocatum Ruiz & Pav.)
Disusun oleh : RINA SEPTIANA S
M0305052
SKRIPSI
Ditulis dan diajukan untuk memenuhi sebagian persyaratan mendapatkan gelar Sarjana Sains Kimia
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SEBELAS MARET
commit to user
ii
HALAMAN PENGESAHAN
Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas
Sebelas Maret telah mengesahkan skripsi mahasiswa:
Rina Septiana Sumadi NIM M0305052, dengan judul ” Identifikasi dan Uji
Aktivitas Antibakteri Fraksi Teraktif Daun Sirih Merah (Piper crocatum Ruiz & Pav.)”
Skripsi ini dibimbing oleh:
Pembimbing I Pembimbing II
Ahmad Ainurofiq, M.Si. Apt. Soerya Dewi Marliyana, M.Si. NIP. 19780319 200501 1003 NIP. 19690313 199702 2001
Dipertahankan di depan Tim Penguji Skripsi pada:
Hari :
Tanggal :
Anggota tim Penguji :
1. Nestri Handayani, M.Si, Apt. 1. ... NIP. 19701211 200501 2001
2. Dr. Sayekti Wahyuningsih, M.Si. 2. ... NIP. 19711211 199702 2001
Ketua Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sebelas Maret Surakarta
commit to user
iii
PERNYATAAN
Dengan ini saya menyatakan bahwa dalam skripsi saya yang berjudul
“Identifikasi dan Uji Aktivitas Antibakteri Fraksi Teraktif Daun Sirih Merah
(Piper crocatum Ruiz & Pav.)” adalah benar – benar hasil penelitian sendiri dan tidak terdapat karya yang pernah diajukan untuk memperoleh gelar kesarjanaan di
suatu perguruan tinggi dan sepanjang pengetahuan saya juga tidak terdapat kerja
atau pendapat yang pernah ditulis atau diterbitkan oleh orang lain, kecuali yang
secara tertulis diacu dalam naskah ini dan disebutkan dalam daftar pustaka.
Surakarta, Maret 2011
commit to user
iv
IDENTIFIKASI DAN UJI AKTIVITAS ANTIBAKTERI FRAKSI TERAKTIF DAUN SIRIH MERAH (Piper crocatum Ruiz & Pav.)
Rina Septiana S
Jurusan Kimia. Fakultas Matematika dan Ilmu Pengetahuan Alam. Universitas Sebelas Maret.
ABSTRAK
Identifikasi dan uji aktivitas antibakteri fraksi teraktif daun sirih merah telah dilakukan. Pembuatan ekstrak menggunakan metode maserasi menggunakan pelarut etanol, kemudian dilanjutkan dengan heksana. Pemisahan ekstrak etanol menggunakan Kromatografi Vakum Cair (KVC) dengan pelarut organik, yaitu heksana, etil asetat, dan etanol. Uji antibakteri fraksi-fraksi dilakukan dengan metode difusi. Fraksi yang mempunyai aktivitas antibakteri tertinggi ditentukan komponen kimianya dengan skrinning fitokimia menggunakan Kromatografi Lapis Tipis (KLT) dan analisis Kromatografi Gas-Spektroskopi Massa (GC-MS). Selanjutnya, ditentukan Konsentrasi Hambat Minimum (KHM) dan uji banding terhadap standar amoksisilin.
Hasil penelitian menunjukkan bahwa fraksi heksana, etil asetat dan etanol daun sirih merah mempunyai aktivitas antibakteri terhadap Escherichia coli, Bacillus cereus, Staphylococcus aureus dan Pseudomonas aeruginosa. Fraksi heksana memiliki aktivitas antibakteri tertinggi terhadap E. coli, B. cereus, S. aureus dan P. aeruginosa. Fraksi heksana diidentifikasi dengan analisis skrinning fitokimia dan analisis GC-MS. Hasil skrinning fitokimia menunjukkan golongan senyawa terpenoid, steroid, asam lemak dan analisis GC-MS menunjukkan 14 senyawa golongan terpenoid teridentifikasi dengan komponen utamanya antara lain trans-kariofilen (19,21%), beta-farnesen (15,18%), germakren-D (13,86%) dan ar-kurkumen (9,93%). KHM fraksi heksana terhadap E. coli adalah 10% dan terhadap B. cereus, S. aureus, dan P. aeruginosa adalah 5%. Nilai uji banding fraksi heksana terhadap B. cereus 4,7.10-3%, terhadap P. aeruginosa 6,61.10-3%, terhadap S. aureus 4,19.10-3% dan terhadap E. coli 3,51.10-3% dibandingkan dengan amoksisilin.
commit to user
v
IDENTIFICATION AND ANTIBACTERIAL ACTIVITY OF SELECTED FRACTION FROM Piper crocatum Ruiz & Pav. LEAVE
Rina Septiana S
Department of Chemistry. Mathematics and Natural Sciences Faculty. Sebelas Maret University.
ABSTRACT
Identification and antibacterial activity of selected fraction from Piper crocatum Ruiz & Pav. leave have been done. The extracts of Piper crocatum Ruiz & Pav. were prepared by maceration using ethanol and then continued by hexane. Liquid vacuum chromatography with organic solvent; hexane, ethyl acetate, and ethanol was used to separate ethanol extract. The antibacterial activity of fractions were determined by using diffusion method. The composition of the highest active fraction was investigated by phytochemical screening method and Gass Chromatography-Mass Spectroscopy (GC-MS) analysis. Then, the minimum inhibitory concentration (MIC) and equivalent value were evaluated. The equivalent value was compared to amoxicilin.
The result of this research showed that hexane, ethyl acetate and ethanol fractions had antibacterial activity against Escherichia coli, Bacillus cereus, Staphylococcus aureus and Pseudomonas aeruginosa. The hexane fraction was the highest antibacterial activity. This fraction was identified by phytochemical screening and GC-MS analysis. The phytochemical screenings analysis showed terpenoids, steroids, and fatty acids compounds and the GC-MS analysis contained 14 terpenoid compounds with the major compounds were trans caryophyllene (19,21%), beta-farnesene (15,18%), germacrene-D (13,86%), and ar-curcumene (9,93%). The MIC of hexane fraction against E.coli was 10%, while B.cereus, S. aureus and P. aeruginosa were 5%. The equivalent value of hexane fraction compared to amoxicilin standards was 4,7.10-3%; 6,61.10-3%; 4,19.10-3%; 3,51.10-3% for B.cereus, P. aeruginosa, S. aureus, and E.coli, respectively.
commit to user
vi MOTTO
“Sesungguhnya sesudah kesulitan itu ada kemudahan”
(Q.S. Al-Insyirah : 6)
“Orang yang berhenti untuk menjadi lebih baik berarti dia berhenti untuk
menjadi orang yang baik”
( W. Churcil)
“maka apabila kamu telah selesai (mengerjakan urusan), kerjkanlah
dengan sungguh-sungguh (urusan) yang lain, dan hanya kepada
Tuhanmu-lah hendaknya kamu brharap”
(Q.S. Alam Nasyrah : 7-8)
“rasa ingin tahu akan mengalahkan rasa takut, bahkan melebihi keberanian yang
kita kehendaki”
(H. Bergson)
“you don’t choose your family, they are God’s gift to you, as you are to them”
commit to user
vii
PERSEMBAHAN
Puji syukur kehadirat Allah SWT sehingga aku dapat
menyelesaikan karya kecil ini.
Aku persembahkan karya sederhanaku ini untuk:
v Bapak (alm) yang tempatnya takkan tergantikan
dihatiku
v Ibu yang selalu menyayangiku sepanjang waktu
v Mba yuli sekeluarga (Mas Gufron & Opang) terima
kasih untuk doa, pengertian dan kesabarannya
v Mas dodo,terima kasih untuk segalanya. Darimu aku
belajar banyak hal..
commit to user
viii
KATA PENGANTAR
Puji syukur penulis panjatkan kepada Allah SWT yang telah memberikan
segala nikmat dan karunia-Nya, sehingga penulis dapat menyelesaikan skripsi
yang berjudul “ Isolasi dan Identifikasi Fraksi Teraktif Uji Antibakteri Ekstrak
Etanol Daun Sirih Merah (Piper crocatum Ruiz & Pav.)”
Penulis menyadari bahwa penulisan skripsi ini tidak akan selesai tanpa
adanya bantuan dari berbagai pihak. Untuk itu, penulis menyampaikan rasa terima
kasih kepada:
1. Bapak Prof. Drs. Sentot Budi Rahardjo, Ph.D. selaku Ketua Jurusan Kimia.
2. Bapak Achmad Ainurofiq, M.Si., Apt. selaku Dosen Pembimbing I dan Ibu
Soerya Dewi Marliyana, M.Si. selaku Dosen Pembimbing II, yang telah
meluangkan waktunya dan selalu sabar memberikan arahan dalam
membimbing penulis selama menyelesaikan skripsi.
3. Bapak Patiha, MS selaku Pembimbing Akademik yang telah memberikan
saran dan motivasi kepada penulis selama masa studi.
4. Para laboran di Laboratorium Kimia dan Laboran di Sub Laboratorium
Biologi terimakasih atas bantuan dan kerjasamanya dengan baik.
5. Keluarga Pondok 18 : mbak2q (tanti, nurul, ema, maxi). Terimakasih atas hari-hari bersama yang selalu menyenangkan. “I love you all”. Pondok 18 (new) : ornella, nita, wulan, farida, tia, uun, ayu, grecia..terimakasih atas doa dan dukungannya.
6. Teman-teman kimia’05. Terimakasih atas bantuan, doa dan dorongannya.
Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan. Oleh
sebab itu, saran dan kritik yang membangun sangat diharapkan untuk perbaikan di
masa mendatang. Semoga skripsi ini dapat bermanfaat dan berguna bagi yang
membacanya.
Surakarta, Maret 2011
commit to user
ix DAFTAR ISI
Halaman
HALAMAN JUDUL ... i
HALAMAN PENGESAHAN ... ii
HALAMAN PERNYATAAN KEASLIAN ... iii
ABSTRAK ... iv
ABSTRACT ... v
MOTTO ... vi
HALAMAN PERSEMBAHAN... vii
KATA PENGANTAR ... viii
DAFTAR ISI ... x
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... xiv
BAB I. PENDAHULUAN ... 1
A. Latar belakang masalah ... 1
B. Perumusan masalah ... 2
1. Identifikasi masalah ... 2
2. Batasan masalah ... 3
3. Rumusan masalah ... 4
C. Tujuan Penelitian ... 4
D. Manfaat penelitian ... 5
BAB II. LANDASAN TEORI ... 6
A. Tinjauan pustaka ... 6
1. Sirih Merah (Piper crocatum Ruiz & Pav.)... 6
a. Klasifikasi tanaman... 6
b. Deskripsi tanaman... 7
c. Kandungan dan manfaat tanaman……… 7
2. Bakteri... 8
a. Definisi………... 8
commit to user
x
c. Bakteri uji………. 9
3. Media Pertumbuhan Bakteri... 11
4. Antibakteri... 12
5. Senyawa-senyawa metabolisme sekunder yang mempengaruhi aktivitas antibakteri……… 13
6. Ekstraksi……….. 22
7. Kromatografi lapis tipis………... 23
8. Kromatografi vakum cair (KVC)……….. 24
9. GC-MS.……….... 25
10. Metode pengujian aktivitas antibakteri……… 28
11. Konsentrasi Hambat Minimum dan Uji banding…………. 30
B. Kerangka Pemikiran... 31
C. Hipotesis... 32
BAB III. METODOLOGI PENELITIAN... 33
A. Metode Penelitian... 33
B. Waktu dan tempat penelitian... 33
C. Alat dan bahan... 33
1. Alat... 33
2. Bahan... 34
D. Prosedur penelitian ... 35
1. Persiapan sampel sirih merah………... 35
2. Ekstraksi maserasi sampel daun sirih merah ... 35
3. Pengujian golongan senyawa ekstrak etanol... 35
4. Pengujian aktivitas antibakteri ekstrak etanol………. 37
5. Pemisahan ekstrak etanol………. 38
6. Pengujian aktivitas antibakteri terhadap fraksi-fraksi…… 39
7. Pengujian golongan fraksi teraktif antibakteri………. 39
8. GC-MS………. 39
E. Teknik Pengumpulan dan Analisis Data ... 39
BAB IV. HASIL DAN PEMBAHASAN ... 41
A. Identifikasi sampel ... 41
commit to user
xi
C. Pengujian golongan senyawa ekstrak etanol……… 42
D. Pengujian aktivitas antibakteri ekstrak etanol……….. 43
E. Pemisahan ekstrak etanol………..… 45
F. Pengujian aktivitas antibakteri fraksi-fraksi hasil pemisahan….. 46
G. Penetapan KHM dan Nilai Banding……….…. 48
a. Penetapan KHM fraksi heksana……… 48
b. Penetapan KHM amoksisilin………. 49
c. Penetapan nilai banding fraksi heksana……….…………... 51
H. Identifikasi Fraksi Teraktif Antibakteri……… 52
a. Skrining fitokimia fraksi heksana……….…………..…….. 53
b. Hasil analisis GC-MS……… 54
BAB V. PENUTUP ... 62
A. Kesimpulan ... 62
B. Saran ... 63
DAFTAR PUSTAKA ... 64
commit to user xii DAFTAR TABEL Tabel 1. Tabel 2. Tabel 3. Tabel 4. Tabel 5. Tabel 6. Tabel 7. Tabel 8.
Klasifikasi terpenoid...
Hasil skrinning fitokimia senyawa kimia ekstrak etanol daun
sirih merah...
Hasil pengujian aktivitas antibakteri ekstrak etanol sirih merah
(Piper crocatum Ruiz & Pav.) ... Hasil kromatografi vakum cair ekstrak etanol sirih merah
(Piper crocatum Ruiz & Pav.)... Hasil uji aktivitas antibakteri ekstrak etanol dan fraksi-fraksi
hasil KVC terhadap 4 bakteri...
Hasil pengujian penentapan KHM fraksi heksana terhadap 4
bakteri uji...
Hasil pengujian penetapan KHM amoksisilin terhadap 4
bakteri uji ...
Hasil penetapan nilai banding fraksi heksana untuk keempat
bakteri uji terhadap amoksisilin...
Halaman 16 42 43 46 47 48 51 52 53 55 Tabel 9.
Tabel 10.
Tabel 11.
Tabel 12.
Tabel 13.
Tabel 14.
Hasil skrining fitokimia senyawa kimia fraksi heksana daun
sirih merah (Piper crocatum Ruiz & Pav.)…...….………… Fragmentasi senyawa puncak 5 dibandingkan standar trans
kariofilen... Fragmentasi senyawa puncak 6 dibandingkan standar β -farnesen...
Fragmentasi senyawa puncak 10 dibandingkan standar
ar-kurkumen...
Fragmentasi senyawa puncak 11 dibandingkan standar
germakren D...
Komponen fraksi heksana daun sirih merah (Piper crocatum Ruiz & Pav.) ...
56
57
58
commit to user xiii DAFTAR GAMBAR Gambar 1. Gambar 2. Gambar 3. Gambar 4. Gambar 5. Gambar 6. Gambar 7. Gambar 8. Gambar 9. Gambar 10. Gambar 11. Gambar 12. Gambar 13. Gambar 14. Gambar 15. Gambar 16. Gambar 17. Gambar 18. Gambar 19.
Tanaman sirih merah...
Senyawa-senyawa golongan flavonoid...
Struktur senyawa patuloside A...
Struktur senyawa phytadiene dan 1,2 secocladiellan...
Struktur smilagenin...
Struktur asam glisiretat...
Struktur beberapa alkaloid...
Struktur ramiflorin A dan B...
Struktur golongan fenolik...
Struktur beberapa tanin...
Struktur epilogatekin galat...
Skema alat GC-MS...
Kromatogram fraksi heksana daun sirih merah...
a. Spektra massa senyawa puncak 5...
b. Spektra massa senyawa trans kariofilen...
a. Spektra massa senyawa puncak 6... b. Spektra massa senyawa β-farnesen... a. Spektra massa senyawa puncak 10...
b. Spektra massa senyawa ar kurkumen...
a. Spektra massa senyawa puncak 11...
b. Spektra massa senyawa germakren D...
Struktur seskuiterpenoid daun Piper crocatum Ruiz & Pav……….
Struktur diterpenoid daun Piper crocatum Ruiz & Pav..…..
commit to user DAFTAR LAMPIRAN Lampiran 1. Lampiran 2. Lampiran 3. Lampiran 4. Lampiran 5. Lampiran 6. Lampiran 7. Lampiran 8. Lampiran 9. . Lampiran 10. Lampiran 11. Lampiran 12. Lampiran 13. Lampiran 14.
Diagram alir prosedur penelitian………..…….
Hasil determinasi sirih merah (Piper crocatum Ruiz & Pav.)………....
Perhitungan rendemen ekstrak etanol
………...
Hasil pengujian aktivitas antibakteri ekstrak etanol
terhadap 4 bakteri uji………..………
Analis one-way anova pengaruh variasi bakteri pada
masing-masing konsentrasi ekstrak etanol………...
Hasil pengujian aktivitas antibakteri fraksi-fraksi hasil
kromatografi vakum cair………...…………..
Analisa one way-anova pengaruh variasi fraksi pada
masing-masing bakteri pada uji aktivitas antibakteri
fraksi-fraksi hasil kromatografi vakum
cair……….………
Hasil pengujian penetapan KHM fraksi heksana…...
Analisa one way anova pengaruh variasi bakteri pada
masing-masing konsentrasi fraksi pada penentuan
KHM fraksi heksana………...…
Penentuan KHM amoksisilin…….……….
Analisa pengaruh one way anova pengaruh variasi
bakteri amoksisilin pada masing-masing konsentrasi
pada uji aktivitas antibakteri amoksisilin…….……..
Hasil pengujian penentuan nilai banding fraksi
heksana terhadap amoksisilin………...
Hasil skrining fitokimia dengan KLT...
Analisis GC-MS fraksi heksana daun sirih merah
(Piper crocatum Ruiz & Pav...
commit to user
1 BAB I PENDAHULUAN
A.Latar Belakang Masalah
Penggunaan tanaman untuk pengobatan telah lama dikenal oleh
masyarakat. Usaha pengembangan tanaman untuk pengobatan perlu dilakukan
mengingat bahwa tanaman mudah diperoleh dan murah. Tetapi penggunaan
tanaman untuk pengobatan perlu ditunjang oleh data-data penelitian dari tanaman
tersebut sehingga khasiatnya secara ilmiah tidak diragukan lagi dan dapat
dipertanggungjawabkan. Hal ini tentu akan mendorong penggunaan tanaman
sebagai obat secara meluas oleh masyarakat (Soemiati, 2002).
Sebagian besar simplisia yang digunakan untuk obat tradisional adalah
suku Piperaceae. Pada umumnya tanaman yang termasuk suku Piperaceae mengandung senyawa golongan alkaloid, terpenoid, flavonoid, lignin dan minyak
atsiri (Sumarni, 1999). Banyak spesies dari suku Piperaceae digunakan sebagai obat tradisional dan menunjukkan fungsi aktivitas antibakteri, antijamur,
insektisidal dan antitumor. Tanaman dari suku Piperaceae juga digunakan untuk pengobatan batuk, bronchitis, penyakit pernapasan dan reumatik. Sejumlah
senyawa seskuiterpen telah diisolasi dari Piper cubeba (kemukus). Dari penelitian tersebut menunjukkan bahwa kemukus dapat menghambat penyakit tumor,
antileukimia dan aktivitas antibiotik (Bos, 2007). Secara tradisional daun sirih
merah dapat digunakan untuk pengobatan berbagai macam penyakit diantaranya
obat sakit gigi dan mulut, sariawan, abses rongga mulut, luka bekas cabut gigi,
penghilang bau mulut, batuk dan serak, hidung berdarah, keputihan, wasir, tetes
mata, gangguan lambung, gatal-gatal, kepala pusing dan jantung berdebar
(Sudewo, 2005).
Sirih merah (Piper crocatum Ruiz & Pav) mengandung beberapa senyawa aktif, antara lain flavonoid, alkaloid, saponin, polifenolat, tanin, terpenoid dan
minyak atsiri. Senyawa-senyawa tersebut memiliki aktivitas antibakteri
(Juliantina, 2008). Kandungan kimia lainnya yang terdapat di daun sirih merah
commit to user
karvakrol, eugenol, p-cimene, sineol, kariofelen, kadimen estragol, terpenena dan
fenil propana (Manoi, 2007).
Banyak obat telah digunakan untuk melawan infeksi bakteri dan penelitian
masih berlangsung sampai sekarang. Beberapa penelitian uji aktivitas antibakteri
ekstrak tanaman pada tumbuhan telah banyak dilakukan. Ekstrak etanol sirih
merah mempunyai kemampuan antibakteri bakteri gram positif dan bakteri gram
negatif khususnya terhadap Staphylococcus aureus dengan KHM 25 % dan Eschericia coli dengan KHM 6,25 % (Juliantina, 2008). Ekstrak heksana dan petroleum eter buah tanaman Piper sp mempunyai aktivitas antibakteri terhadap Staphylococcus aureus, Bacillus subtilis, Eschericia coli dan Pseudomonas pseudomallei pada konsentrasi 25% (Sumarni, 1999). Minyak atsiri daun sirih merah mempunyai aktivitas antibakteri terhadap Bacillus cereus dengan KHM 1% serta terhadap Eschericia coli dan Pseudomonas aeruginosa dengan KHM sebesar 0,75% (Ngaisah, 2010).
Berdasarkan informasi kandungan kimia sirih merah di atas, sirih merah
mengandung golongan senyawa yang mempunyai aktivitas antibakteri. Adapun
penelitian yang dilakukan ini untuk mengisolasi dan mengidentifikasi komponen
kimia yang terdapat dalam ekstrak daun sirih merah, kemudian menguji
aktivitasnya sebagai antibakteri terhadap bakteri yaitu Staphylococcus aureus, Bacillus cereus, Eschericia coli dan Pseudomonas aeruginosa sehingga nantinya diketahui senyawa aktif antibakteri apa saja yang ada di dalam ekstrak daun sirih
merah. Penelitian ini diharapkan dapat memberikan informasi kepada masyarakat
tentang pemanfaatan tanaman berkhasiat obat yaitu tanaman sirih merah.
B. Perumusan Masalah 1. Identifikasi Masalah
Sirih merah (Piper crocatum Ruiz & Pav) mempunyai kandungan kimia yang berbeda pada tiap bagiannya. Bagian yang biasa digunakan sebagai bahan
obat adalah daunnya. Selain itu tempat pengambilan tanaman daun sirih merah
commit to user
Isolasi komponen kimia dari suatu bahan alam dapat dilakukan dengan
metode ekstraksi, destilasi dan kromatografi. Pada tiap metode menggunakan
berbagai macam pelarut menurut kebutuhan. Pelarut yang digunakan untuk isolasi
perlu diperhatikan sebagai contoh senyawa yang kurang polar dapat diisolasi
dengan menggunakan pelarut heksana, petroleum eter, benzene dan toluen dan
senyawa yang lebih polar dapat diperoleh dengan pelarut etil asetat, butanol,
metanol, dan air. Hasil isolasi dengan pelarut yang berbeda akan menghasilkan
ekstrak dengan senyawa yang berbeda sehingga akan mempengaruhi aktivitas
antibakteri dari ekstrak. Dari hal diatas perlu diperhatikan cara isolasi senyawa
daun sirih merah dengan pelarut yang tepat. Senyawa-senyawa antibakteri
biasanya dapat diisolasi dengan pelarut organik polar yaitu metanol atau etanol.
Sirih merah mengandung berbagai macam komponen senyawa kimia
sehingga diperlukan suatu metode yang tepat untuk mengidentifikasi senyawa
kimia tersebut. Identifikasi komponen kimia dalam bahan alam dapat dilakukan
dengan berbagai metode seperti Kromatografi Lapis Tipis (Thin Layer Chromatography), Kromatografi Gas (Gas Chromatography), Kromatografi Gas-Spektrofotometer Massa (Gas Chromatography-Mass Spectrometry).
Pengujian aktivitas antibakteri dapat dilakukan dengan menggunakan
metode difusi dan dilusi. Pada metode difusi dapat dilakukan dengan difusi agar
yaitu dengan menggunakan lubang (perforasi) dan gores silang. Pemilihan metode
pengujian aktivitas antibakteri harus tepat dan disesuaikan dengan jenis bakteri
yang diuji. Jenis bakteri yang digunakan untuk pengujian aktivitas antibakteri
adalah bakteri patogen. Beberapa bakteri patogen yang dapat digunakan adalah
Staphylococcus aureus, Bacillus cereus, Eschericia coli dan Pseudomonas aeruginosa.
2. Batasan Masalah
Berdasarkan identifikasi masalah tersebut maka dibuat batasan masalah
sebagi berikut:
commit to user
b. Isolasi ekstrak polar daun sirih merah dari daerah Magelang dilakukan
dengan cara maserasi menggunakan pelarut etanol dilanjutkan dengan
ekstraksi partisi menggunakan pelarut heksana kemudian dilanjutkan dengan
pemisahan dengan Kromatografi Vakum Cair (KVC) menggunakan pelarut
secara berurutan yaitu heksana, etil asetat, dan etanol.
c. Identifikasi komponen senyawa kimia daun sirih merah dari fraksi hasil
pemisahan yang aktif antibakteri dilakukan dengan menggunakan analisis
skrining fitokimia dan analisis data GC-MS.
d. Pengujian aktivitas antibakteri dilakukan terhadap empat bakteri patogen,
yaitu bakteri gram positif: Staphylococcus aureus, Bacillus cereus, dan bakteri gram negatif: Eschericia coli dan Pseudomonas aeruginosa.
3. Rumusan Masalah
Rumusan masalah penelitian ini adalah sebagai berikut:
a. Apakah ekstrak etanol dan fraksi hasil pemisahan mempunyai aktivitas
antibakteri?
b. Komponen senyawa kimia apa sajakah yang terkandung dalam ekstrak etanol
dan fraksi hasil pemisahan yang mempunyai aktivitas antibakteri tertinggi
pada empat bakteri uji?
c. Bagaimanakah potensi fraksi yang mempunyai aktivitas antibakteri tertinggi
dilihat dari nilai uji bandingnya terhadap pembanding amoksisilin?
C. Tujuan Penelitian Tujuan penelitian ini adalah:
a. Mengetahui aktivitas antibakteri ekstrak etanol dan fraksi hasil pemisahan
daun sirih merah.
b. Mengetahui komponen senyawa kimia yang terkandung dalam ekstrak etanol
dan fraksi hasil pemisahan yang mempunyai aktivitas antibakteri tertinggi.
c. Mengetahui potensi fraksi yang mempunyai aktivitas antibakteri tertinggi
commit to user
D. Manfaat Penelitian
Manfaat yang dapat diambil dari penelitian ini adalah:
a. Dapat memberikan informasi mengenai komposisi kimia daun sirih merah
(Piper crocatum Ruiz & Pav.) yang aktif antibakteri sebagai salah satu tanaman obat.
commit to user BAB II
LANDASAN TEORI
A. Tinjauan Pustaka
1. Sirih merah (Piper crocatum Ruiz & Pav)
Sirih merah adalah salah satu tanaman obat potensial yang diketahui
secara empiris memiliki khasiat untuk menyembuhkan berbagai jenis penyakit dan
memiliki nilai spiritual tinggi. Sirih merah termasuk dalam satu elemen penting
yang harus disediakan dalam setiap upacara adat, khususnya Yogyakarta
(Juliantina, 2008).
a. Klasifikasi Tanaman
Tanaman sirih merah merupakan famili Piperaceae. Kedudukan tanaman sirih merah dalam taksonomi tumbuhan adalah sebagai berikut:
Kingdom : Plantae
Sub Kingdom : Tracheobionta
Super Divisio : Spermatophyta
Divisio : Magnoliophyta
Kelas : Magnoliopsida
Sub Kelas : Magnolidae
Ordo : Piperales
Familia : Piperaceae
Genus : Piper
Species : Piper crocatum Ruiz & Pav. (www.plantamor.com)
b. Deskripsi Tanaman
Tanaman sirih merah (Piper crocatum Ruiz & Pav.) termasuk dalam famili Piperaceae. Sirih merah merupakan tanaman merambat yang berbatang bulat
berwarna hijau keunguan dan tidak berbunga. Daunnya bertangkai membentuk
jantung hati dan bagian ujung daun meruncing. Daun tumbuh berselang-seling
dari batangnya, dan daun berwarna merah keperakan dengan permukaan daun
mengkilap dan tidak merata. Yang membedakan dengan sirih hijau adalah selain
commit to user
daunnya berwarna merah keperakan, bila daunnya disobek maka akan berlendir
serta aromanya lebih wangi (Manoi, 2007).
Tanaman sirih merah menyukai tempat teduh, berhawa sejuk dengan sinar
matahari 60-75%, sehingga dapat tumbuh subur dan bagus di daerah pegunungan.
Bila tumbuh pada daerah panas, sinar matahari langsung, batangnya cepat
mengering. Selain itu, warna merah daunnya akan pudar (Juliantina, 2008).
Tanaman sirih merah dapat dilihat pada Gambar 1.
Gambar 1. Tanaman Sirih Merah
c. Kandungan dan Manfaat Tanaman
Dalam daun sirih merah terkandung senyawa fitokimia yakni alkaloid,
saponin, polifenolat, tanin dan flavonoid. Kandungan kimia lainnya yang terdapat
di daun sirih merah adalah minyak atsiri, hidroksikavikol, kavikol, kavibetol,
allilprokatekol, karvakrol, eugenol, p-cimene, sineol, kariofelen, kadimen
estragol, terpenena dan fenil propada.
Karena banyaknya kandungan zat atau senyawa kimia bermanfaat inilah,
daun sirih merah memiliki manfaat yang sangat luas sebagai bahan obat.
Karvakrol bersifat desinfektan, anti jamur, sehingga bisa digunakan untuk obat
antiseptik pada bau mulut dan keputihan. Eugenol dapat digunakan untuk
commit to user
perut. Banyak pengalaman bahwa menggunakan sirih merah dalam bentuk segar,
simplisia maupun ekstrak kapsul dapat menyembuhkan penyakit diabetes melitus,
hepatitis, batu ginjal, menurunkan kolesterol, mencegah stroke, asam urat,
hipertensi, radang liver, radang prostat, radang mata, keputihan, maag, kelelahan,
nyeri sendi dan memperhalus kulit (Sudewo, 2005).
2. Bakteri a. Definisi
Bakteri merupakan mikroba prokariotik uniseluler, berkembang biak
secara aseksual dengan pembelahan sel. Semua bakteri memiliki struktur sel yang
relatif sederhana. Berdasarkan komposisi dan struktur dinding sel, maka bakteri
dibagi ke dalam dua golongan yaitu bakteri gram positif dan bakteri gram negatif.
Bakteri gram positif memiliki dinding sel yang terdiri atas lapisan peptidoglikan
yang tebal dan asam teikoat yang mengandung alkohol. Ada dua asam teikoat,
yaitu asam lipoteikoat yang merentang di lapisan peptidiglikon dan terikat pada
membran plasma dan asam teikoat dinding yang terikat pada lapisan
peptidiglikon. Sedangkan dinding sel bakteri gram negatif mengandung satu atau
beberapa lapis peptidoglikan dan membaran luar (outer membrane). Peptidoglikan terikat pada membran luar dan periplasma terdapat diantara membran plasma dan
membran luar (Pratiwi, 2008).
Beberapa bakteri gram negatif adalah Enterobacter cloacae, Legionella pneumophila, Proteus mirabilis, Pseudomonas aeruginosa, Moraxella catarrhalis, Haemophilus parainfluenzae, Escherichia coli, Klebsiella pneumoniae, sedangkan bakteri gram positif adalah Enterococcus faecalis, Bacillus subtilis, Staphylococcus aureus, Streptococcus pneumoniae, Streptococcus pyogenes.
b. Klasifikasi bakteri
Berdasarkan bentuknya bakteri dibagi menjadi tiga golongan besar, yaitu:
commit to user
2) Basil (Bacillus) adalah kelompok bakteri yang berbentuk batang atau silinder dan mempunyai variasi antara lain Diplobacillus dan Streptobacillus.
3) Spiril (Spirilum) adalah bakteri yang berbentuk lengkung dan mempunyai variasi yaitu Vibrio dan Spiral.
(Pratiwi, 2008)
c. Bakteri uji
1) Staphylococcus auerus
Klasifikasi Staphylococcus auerus adalah sebagai berikut: Divisi : Protophyta
Kelas : Schizomycetes
Bangsa : Eubacteryales
Suku : Mycrococcaceae
Marga : Staphylococcus Jenis : Staphylococcus aureus
(Salle, 1961) Staphylococus aureus merupakan bakteri gram positif yang berasal dari genus Staphylococcus. Staphylococcus aureus merupakan agen infeksi yang dapat menyerang setiap jaringan dan organ tubuh. Timbulnya
penyakit dengan tanda-tanda yang khas yaitu peradangan, nekrosis dan
pembentukan abses.
2) Bacillus cereus
Klasifikasi Bacillus cereus adalah sebagai berikut: Kingdom : Bacteria
Fillum : Firmicutes
Kelas : Bacilli
Order : Bacillales
Famili : Bacillaceae
commit to user
Bacillus cereus merupakan bakteri gram-positif, aerob fakultatif, dan dapat membentuk spora. Selnya berbentuk batang besar dan sporanya
tidak membengkakkan sporangiumnya. Bacillus cereus dapat tumbuh dalam makanan dan menghasilkan enterotoksin yang menyebabkan
keracunan makanan. Bakteri ini juga merupakan penyebab infeksi mata,
keratis berat, endoftalmitis dan panoftalmitis (Jawetz, et al, 2005). 3) Escherichia coli
Klasifikasi Escherichia coli adalah sebagai berikut:
Divisi : Protophyta
Subdivisi : Schizomycetea
Kelas : Schizomycetes
Bangsa : Eubacteriales
Suku : Enterobacteriaceae
Marga : Escherichia Jenis : Escherichia coli
Escherichia coli adalah bakteri gram negatif, berbentuk batang pendek, berderet seperti rantai, dapat memfermentasi glukosa dan laktosa
membentuk asam dan gas (Pelczar dan Chan, 1998). Bakteri ini dapat
menyebabkan penyakit seperti diare, infeksi saluran kemih, pneumonia,
meningitis pada bayi yang baru lahir dan infeksi luka (Jawetz, et al, 2005). 4) Pseudomonas aeroginosa
Klasifikasi pseudomonas aeruginosa adalah sebagai berikut: Kingdom : Bacteria
Fillum : Proteobacteria
Kelas : Gamma Proteobacteria
Order : Pseudomonadales
Famili : Pseudomonadaceae
Marga : Pseudomonas
Spesies : Pseudomonas aeruginosa
commit to user
bakteri tunggal, berpasangan dan kadang-kadang membentuk rantai yang
pendek, tidak mempunyai spora, tidak mempunyai selubung serta
mempunyai flagel monotrik (flagel tunggal pada kutub) sehingga selalu
bergerak (Mayasari, 2005).
Bakteri ini bersifat oksidase positif dan tidak meragikan karbohidrat.
Tetapi banyak strain yang mengoksidasi glukosa. Pengenalan biasanya
berdasarkan morfologi, sifat oksidase positif, adanya pigmen yang khas
dan pertumbuhan pada suhu 42°C. Untuk membedakan P. aeruginosa dari Pseudomonas yang lain berdasarkan pada aktivitas biokimiawinya yang membutuhkan berbagai substrat (Jawetz et al., 2005).
Pseudomonas aeruginosa adalah bakteri patogen oportunistik, yaitu memanfaatkan kerusakan pada mekanisme pertahanan inang untuk
memulai suatu infeksi. Bakteri ini dapat menyebabkan infeksi saluran
kemih, infeksi saluran pernapasan, dermatitis, infeksi jaringan lunak,
bakteremia, infeksi tulang dan sendi, infeksi saluran pencernaan dan
bermacam-macam infeksi sistemik, terutama pada penderita luka bakar
berat, kanker dan penderita AIDS yang mengalami penurunan sistem imun
(Mayasari, 2005).
Pseudomonas aeruginosa lebih resisten terhadap disinfektan dari pada kuman lain. Kebanyakan antibiotik dan antimikroba tidak efektif terhadap kuman ini. Fenol dan β-glutaradelhid biasanya merupakan disinfektan yang efektif. Selain itu, air mendidih juga dapat membunuh kuman ini
(Syahruracman et al., 1994).
3. Media Pertumbuhan Bakteri
Media adalah bahan yang terdiri atas campuran nutrisi yang dipakai untuk
menumbuhkan mikroba. Selain untuk menumbuhkan mikroba, media dapat
digunakan untuk mengisolasi mikroba, memperbanyak mikroba, pengujian
sifat-sifat fisiologi mikroba dan perhitungan jumlah populasi mikroba.
Pembuatan media harus memenuhi syarat antara lain harus steril,
commit to user
osmosa, tekanan permukaan, dan pH yang sesuai. Berdasarkan keadaan isi, media
dapat dibedakan menjadi dua, yaitu:
a. Media basal
Media ini digunakan sebagai bahan dasar untuk membuat media lain yang
lebih komplek. Media basal dibedakan menjadi 2, yaitu:
1) Media basal padat: kaldu agar, TSA (Tryptone Soya Agar).
2) Media basal cair: air peton, kaldu pepton, NA (Nutrien Agar).
Komposisi dari Nutrien Agar adalah ekstrak beef, pepton, agar, NaCl,
air desitilat dan berada pada PH 6,8-7,0.
b. Media campuran
Media campuran adalah media selain media basal juga ditambahkan berbagai
macam zat baik organik maupun anorganik sesuai dengan kebutuhan bakteri.
4. Antibakteri
Antibakteri adalah zat yang membunuh atau menekan pertumbuhan atau
reproduksi bakteri (Dorland, 2002). Secara umum, mekanisme kerja antimikroba
dapat dibagi menjadi lima cara, yaitu:
a. Denaturasi protein
Struktur protein dalam keadaan tiga dimensi ditentukan oleh ikatan
disulfida kovalen intramolekuler dan sejumlah ikatan hidrogen. Keadaan ini
mudah terganggu oleh sejumlah unsur fisik atau kimia sehingga protein
mengalami denaturasi.
b. Gangguan selaput atau dinding sel
Selaput sel berguna sebagai penghalang yang selektif meloloskan zat
terlarut lain. Konsentrasi beberapa zat yang diangkut secara aktif melalui sel
menjadi tinggi dalam sel. Zat-zat yang terkonsentrasi pada permukaaan mungkin
merubah sifat-sifat fisik normalnya serta membasmi dan menghambat sel.
Dinding sel sebagai struktur pemberi bentuk pada sel, melindungi terhadap lisis
osmotik. Dengan demikian, bila ada unsur yang merusak dinding sel atau
commit to user
c. Pemindahan gugus sulfihidril bebas
Protein-protein enzim yang mengandung sistein memiliki rantai samping
yang berakhir dalam gugus sulfihidril. Enzim yang terpenting terdiri dari gugus
sulfhidril bebas seperti koenzim A memerlukan sulfihidril untuk pemindahan
gugus etil. Enzim dan koenzin tidak dapat berfungsi kecuali jika gugus sulfihidril
dalam keadaan bebas dan dalam bentuk tereduksi. Zat pengoksidasi mengganggu
metabolisme dengan mengikat sulfihidril yang berdekatan dengan ikatan disulfida.
d. Antagonis kimiawi
Antagonis kimiawi adalah bahan kimia yang menggunakan reaksi normal
antar enzim spesifik dengan menggabungkan bagian-bagian holoenzim yang dapat
mencegah pertambahan hasil metabolisme secara normal. Beberapa holoenzim
memasukkan salah satu mineral sebagai jembatan antar enzim dan substrat. Bahan
atau senyawa kimia yang bergabung dalam mineral-mineral ini akan mencegah
penambahan enzim atau substrat lagi.
e. Degradasi DNA
Sejumlah unsur antimikroba bekerja dengan merusak DNA. Unsur ini
meliputi radiasi pengion, sinar UV dan zat kimia reaktif DNA. Kerusakan DNA
yang ditimbulkan karena penyinaran atau secara kimiawi akan mematikan sel
terutama karena mengganggu replikasi DNA.
(Jawetz, et al, 2005)
5. Senyawa-Senyawa Metabolisme Sekunder yang Mempunyai Aktivitas Antibakteri
Senyawa-senyawa metabolisme sekunder yang mempunyai aktivitas
antibakteri, antara lain:
a. Flavonoid
Flavonoid adalah suatu kelompok senyawa fenol yang terbesar yang
ditemukan di alam (Kristanti, 2008). Dalam tumbuhan flavonoid pada umumnya
merupakan pigmen-pigmen yang tersebar luas dalam bentuk senyawa glikon dan
aglikon. Flavonoid-flavonoid yang terdapat di alam antara lain adalah flavon,
commit to user
Sifat fisika dan kimia senyawa flavonoid antara lain adalah larut dalam air,
sedangkan dalam bentuk glikosida yang termetilasi larut dalam eter. Sebagai
glikosida maupun aglikon, senyawa flavonoid tidak dapat larut dalam petroleum
eter. Dari tumbuhan, glikosida dapat ditarik dengan pelarut organik yang bersifat
polar (Rusdi, 1988).
Flavonoid memiliki kerangka dasar karbon yang terdiri dari 15 atom
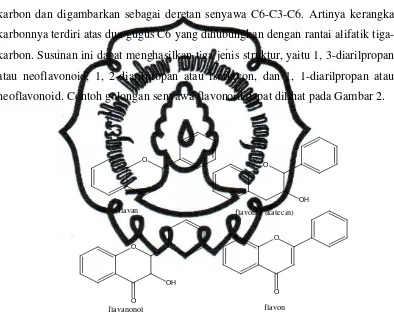
karbon dan digambarkan sebagai deretan senyawa C6-C3-C6. Artinya kerangka
karbonnya terdiri atas dua gugus C6 yang dihubungkan dengan rantai alifatik
tiga-karbon. Susunan ini dapat menghasilkan tiga jenis struktur, yaitu 1, 3-diarilpropan
atau neoflavonoid, 1, 2-diarilpropan atau isoflavon, dan 1, 1-diarilpropan atau
neoflavonoid. Contoh golongan senyawa flavonoid dapat dilihat pada Gambar 2.
O
flavan
O
OH
flavonol (katecin)
OH O
O
flavanonol
O
O
flavon
Gambar 2. Senyawa–senyawa golongan flavonoid (Kristanti, 2008)
Senyawa-senyawa ini merupakan zat warna merah, ungu, dan biru, serta
sebagian zat warna kuning yang terdapat dalam tanaman. Sebagai pigmen bunga,
flavonoid jelas berperan dalam menarik serangga untuk membantu proses
penyerbukan. Beberapa kemungkinan fungsi flavonoid yang lain bagi tumbuhan
adalah sebagai zat pengatur tumbuh, pengatur proses fotosintesis, sebagai zat
antimikroba, antivirus dan antiinsektisida. Beberapa flavonoid sengaja dihasilkan
commit to user
berfungsi menghambat fungi penyerangnya. Telah banyak flavonoid yang
diketahui memberikan efek samping fisiologi tertentu. Oleh karena itu, tumbuhan
yang mengandung flavonoid banyak dipakai dalam pengobatan tradisional
(Kristanti, 2008).
Patuloside A adalah senyawa glikosida xanton yang diisolasi dari tanaman
famili Piperaceae yaitu Peperomia pellucid. Patuloside A mampu menghambat pertumbuhan bakteri gram positif maupun gram negatif, dimana penghambatan
terhadap bakteri gram positif lebih baik dibandingkan dengan penghambatan
terhadap bakteri gram negatif (Khan, 2010). Struktur kimia patuloside A dapat
dilihat pada Gambar 3.
O H
OH H
H
OH H
OH CH2OH
H
O
O O
OH
OH
OH
Gambar 3. Struktur senyawa Patuloside A (Khan, 2010)
b. Terpenoid
Terpenoid adalah kelompok senyawa metabolit sekunder yang terbesar
dilihat dari jumlah senyawa maupun variasi kerangka dasar strukturnya.
Terpenoid ditemukan berlimpah dalam tanaman tingkat tinggi, meskipun
demikian, dari penelitian diketahui bahwa jamur, organisme laut, dan serangga
juga menghasilkan terpenoid. Selain dalam bentuk bebasnya, terpenoid di dalam
juga dijumpai dalam bentuk glikosida, glikosil ester dan iridoid. Terpenoid juga
merupakan komponen utama penyusun minyak atsiri (Kristanti, 2008).
Terpenoid adalah senyawa yang mengandung karbon dan hidrogen, atau
commit to user
senyawa-senyawa yang mudah menguap terdiri dari 10 atom C dan penyusun
minyak atsiri (Achmad, 1986).
Senyawa terpenoid tersusun atas karbon-karbon dengan jumlah kelipatan
atom lima. Diketahui juga bahwa sebagian besar terpenoid mempunyai kerangka
karbon yang dibangun oleh dua atau lebih unit C5 yang disebut unit isoprene
(Kristanti, 2008). Senyawa terpenoid terdiri atas beberapa unit isoprene,
mempunyai struktur siklik dengan satu atau lebih gugus fungsional berupa gugus
hidroksil dan gugus karbonil (Rusdi, 1988). Klasifikasi terpenoid dapat dilihat
[image:30.595.110.514.210.487.2]pada Tabel 1.
Tabel 1. Klasifikasi Terpenoid
Kelompok Terpenoid Jumlah atom C
Monoterpen Seskuiterpen
Diterpen Triterpen Tetraterpen
Politerpen
10 15 20 30 40 >40
(Kristanti, 2008)
Secara kimia terpenoid larut dalam lemak dan terdapat di dalam
sitoplasma sel tumbuhan. Biasanya terpenoid diekstrasi dari jaringan tumbuhan
dengan memakai eter atau kloroform, dan dapat dipisahkan secara kromatografi
pada silika gel atau alumina menggunakan pelarut eter atau kloroform (Harborne,
1996). Kebanyakan peneliti berpendapat bahwa fungsi terpenoid rendah dalam
tumbuhan, lebih bersifat ekologi daripada fisiologi. Banyak senyawa ini yang
menghambat pertumbuhan tumbuhan pesaingnya dan dapat bekerja sebagai
insektisida atau berdaya racun terhadap hewan tinggi (Robinson, 1991). Penelitian
Gunawan (2007) terpenoid yang diisolasi dari herba meniran (Phyllanthus niruri Linn), yaitu jenis phytadiene dan 1,2-seco cladiellan menunjukkan penghambatan
commit to user
(i)
O
O
OH OCH3
[image:31.595.120.511.109.487.2](ii)
Gambar 4. Struktur senyawa (i) phytadiene dan (ii) 1, 2-seco-cladiellan
(Gunawan, 2007)
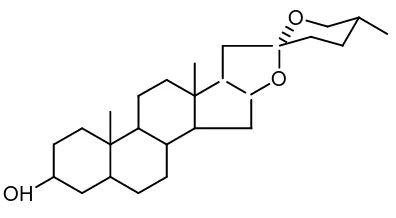
c. Saponin
Saponin adalah senyawa aktif permukaan yang menimbulkan busa jika
dikocok dalam air dan pada konsentrasi yang rendah sering menyebabkan
hemolisis sel darah merah. Dalam larutan yang sangat encer, saponin sangat
beracun untuk ikan, dan tumbuhan yang mengandung saponin telah digunakan
sebagai racun ikan selama beratus-ratus tahun. Beberapa saponin juga bekerja
sebagai antimikroba (Padmawinata, 1995). Contoh senyawa saponin yang dapat
bertindak sebagai antibakteri adalah smilagenin. Adapun strukturnya dapat dilihat
pada Gambar 5.
O O
OH
[image:31.595.232.430.577.686.2]commit to user
Saponin dapat dibedakan menjadi dua jenis yaitu glikosida triterpenoid
dan glikosida struktur steroid tertentu yang mempunyai rantai samping spiroketal.
Kedua jenis saponin ini larut dalam air dan etanol tetapi tidak larut dalam eter.
Contoh senyawa yang termasuk saponin adalah asam glisiretat. Adapun
strukturnya dapat dilihat pada Gambar 6.
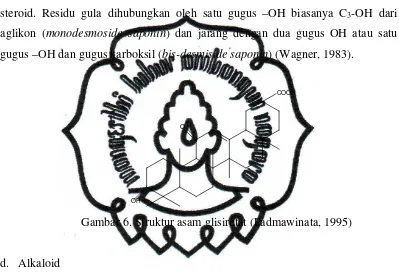
Saponin mempunyai bagian utama berupa turunan triterpen dengan sedikit
steroid. Residu gula dihubungkan oleh satu gugus –OH biasanya C3-OH dari
aglikon (monodesmoside saponin) dan jarang dengan dua gugus OH atau satu gugus –OH dan gugus karboksil (bis-desmiside saponin) (Wagner, 1983).
O
COOH
[image:32.595.113.512.232.504.2]OH
Gambar 6. Struktur asam glisiretat (Padmawinata, 1995)
d. Alkaloid
Alkaloid adalah suatu golongan senyawa organik yang terbanyak
ditemukan di alam. Hampir seluruh alkaloid berasal dari tumbuh-tumbuhan dan
tersebar luas dalam berbagai jenis tumbuhan. Ciri khas alkaloid adalah bahwa
semua alkaloid mengandung paling sedikit satu atom N yang bersifat basa dan
pada umumnya merupakan bagian dari cincin heterosiklik. Alkaloid dapat
ditemukan dalam berbagai bagian tumbuhan, tetapi sering kali kadar alkaloid
kurang dari 1% (Kristanti, 2008).
Senyawa alkaloid diklasifikasikan menurut jenis cincin heterosiklik
nitrogen yang merupakan bagian dari struktur molekul. Menurut klasifikasi ini,
alkaloid dapat dibedakan atas beberapa jenis, seperti alkaloid piridin, pirolidin,
indol, piperidin, kuinolin dan isokuinolin (Kristanti, 2008). Struktur dari
commit to user N
H N
Pirolidin Piperidin Piridin
N H
N
N
N
H
[image:33.595.114.510.102.494.2]indol kuinolin isokuinolin
Gambar 7. Struktur beberapa alkaloid (Kristanti, 2008)
Semua alkaloid mengandung paling sedikit satu atom nitrogen yang
biasanya bersifat basa dan dalam sebagian besar atom nitrogen ini merupakan
cincin aromatis (Achmad, 1986). Berdasarkan penyusun asam aminonya alkaloid
dibedakan menjadi alkaloid asiklis yang berasal dari asam amino ornitin dan lisin.
Alkaloid aromatis jenis fenilalanin berasal dari fenilalanin, tirosin dan 3,
4-dihidroksifenilalanin (Achmad, 1986). Salah satu senyawa alkaloid yang aktif
antibakteri adalah ramiflorin A dan ramiflorin B. Struktur ramiflorin A dan B
dapat dilihat pada Gambar 8.
HN
H N N
N H
H17 H H H3CO
H-17α, ramiflorin A H-17β, ramiflorin B
commit to user
e. Senyawa fenol
Senyawa-senyawa fenol yang terdapat dalam tumbuhan dapat merupakan
senyawa monohidroksi atau polihidroksi fenolik. Terikat sebagai senyawa
glikosida dimana terikat dengan protein, alkaloid atau terdapat sebagai senyawa
terpenoida. Senyawa ini pada proses ekstraksi akan dapat ditemukan dalam fraksi
air ataupun dalam fraksi pelarut-pelarut polar lainnya.
Jika murni, senyawa fenol berupa zat padat tak berwarna tetapi biasanya
teroksidasi dan berwarna gelap jika terkena udara. Kelarutan dalam air bertambah
jika gugus hidroksil makin banyak, tetapi kelarutan dalam pelarut organik yang
polar umumnya tinggi. Fenol yang kelarutannya dalam air kecil mudah larut
dalam natrium hidroksida encer, tetapi dalam suasana basa laju oksidasi sangat
meningkat, sehingga pada setiap perlakuan penggunaan basa kuat dihindari
(Padmawinata, 1995).
Senyawa fenolik mempunyai aktivitas antiinflamasi, karena senyawa ini
menghambat sintesis prostaglandin (Padmawinata, 1995). Tingkatan gugus fungsi
hidroksil pada golongan fenol berhubungan dengan toksisitas pada
mikroorganisme, dengan bukti bahwa bertambahnya hidroksilasi menghasilkan
penambahan toksisitas. Semakin tinggi fenol teroksidasi semakin kuat
menghambat pertumbuhan organisme. Mekanisme yang berhubungan dengan
toksisitas fenol terhadap mikroorganisme adalah penghambatan enzim oleh
senyawa teroksidasi kemungkinan lewat reaksi dengan gugus sulfihidril atau
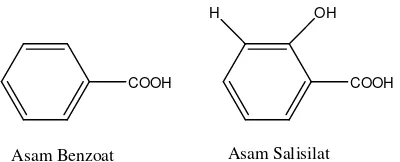
dengan interaksi yang tidak spesifik oleh protein (Cowan, 1999). Contoh struktur
senyawa fenol dapat dilihat pada Gambar 9.
COOH OH H
COOH
[image:34.595.231.431.608.689.2]Asam Benzoat Asam Salisilat
commit to user
f. Tanin
Tanin merupakan senyawa kimia komplek, terdiri dari beberapa senyawa
polifenol. Tanin tersebar luas pada seluruh bagian tumbuhan, terutama pada daun,
buah yang belum masak dan kulit kayu. Tanin berbentuk amorf dan tidak dapat
dikristalkan. Dalam air membentuk larutan kolodial, bereaksi asam dan
mempunyai rasa sepat (Rusdi, 1988). Berta molekul tanin antara 500 sampai
28000 dan ditemukan pada bagian tanaman kuncup, batang, daun, buah dan akar
(Cowan, 1999).
Tanin dibagi menjadi dua yaitu tanin terkondensasi dengan berat molekul
besar (1900-28000) dan tanin terhidrolisis yang mempunyai berat molekul rendah
[image:35.595.114.511.234.512.2](500-3000) (Padmawinata, 1995). Contoh senyawa tanin dapat dilihat pada
Gambar 10.
CHOH OH O
OH
OH
OH
HO
katekin/epikatekin
CHOH O
OH
OH OH
OH OH
OH
Leukoantosianin
Gambar 10. Struktur beberapa tanin (Cowan, 1999)
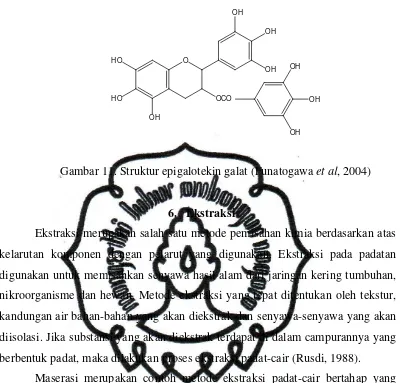
Contoh senyawa tanin yang mempunyai aktivitas antibakteri antara lain
katekin dan epigalotekin galat. Kedua senyawa ini diisolasi dari daun teh hijau
commit to user O
OCO OH
OH
OH OH OH OH
HO
HO
[image:36.595.114.516.105.488.2]OH
Gambar 11. Struktur epigalotekin galat (Funatogawa et al, 2004)
6. Ekstraksi
Ekstraksi merupakan salah satu metode pemisahan kimia berdasarkan atas
kelarutan komponen dengan pelarut yang digunakan. Ekstraksi pada padatan
digunakan untuk memisahkan senyawa hasil alam dari jaringan kering tumbuhan,
nikroorganisme dan hewan. Metode ekstraksi yang tepat ditentukan oleh tekstur,
kandungan air bahan-bahan yang akan diekstrak dan senyawa-senyawa yang akan
diisolasi. Jika substansi yang akan diekstrak terdapat di dalam campurannya yang
berbentuk padat, maka dilakukan proses ekstraksi padat-cair (Rusdi, 1988).
Maserasi merupakan contoh metode ekstraksi padat-cair bertahap yang
dilakukan dengan jalan membiarkan padatan terendam dalam suatu pelarut. Proses
perendaman dalam usaha mengekstraksi suatu substansi dari bahan alam ini bisa
dilakukan tanpa pemanasan (temperatur kamar), dengan pemanasan atau bahkan
pada suhu pendidihan. Salah satu keuntungan metode maserasi adalah cepat,
terutama jika maserasi dilakukan pada suhu didih pelarut. Waktu rendam bahan
dalam pelarut bervariasi antara 15-30 menit tetapi terkadang bisa sampai 24 jam.
Jumlah pelarut yang diperlukan juga cukup besar, berkisar antara 10-20 kali
jumlah sampel (Kristanti, 2008).
Ekstraksi biasanya dimulai dengan menggunakan pelarut organik secara
berurutan dengan kepolaran yang semakin meningkat. Digunakan pelarut heksana,
eter, petroleum eter atau kloroform untuk mengambil senyawa yang kepolarannya
commit to user
asetat untuk mengambil senyawa-senyawa yang lebih polar. Pemilihan pelarut
berdasarkan kaidah “like dissolve like“, yang berarti suatu senyawa polar akan larut dalam pelarut polar dan juga sebaliknya, senyawa non polar akan larut dalam
pelarut non polar. Pada proses maserasi, jika dilakukan dengan pelarut air, maka
diperlukan proses ekstraksi lebih lanjut, yaitu ekstraksi fasa air yang diperoleh
dengan pelarut organik (Padmawinata, 1995). Jika maserasi dilakukan dengan
pelarut organik maka filtrat hasil ekstraksi dikumpulkan menjadi satu kemudian
dievaporasi atau didestilasi. Selanjutnya dapat dilakukan proses pemisahan
dengan kromatografi atau rekristalisasi langsung (Kristanti, 2008).
7. Kromatografi Lapis tipis
Kromatografi merupakan salah satu metode pemisahan komponen dalam
suatu sampel dimana komponen tersebut didistribusikan di antara dua fasa yaitu
fasa gerak dan fasa diam. Fasa gerak adalah fasa yang membawa cuplikan,
sedangkan fasa diam adalah fasa yang menahan cuplikan secara efektif
(Sastrohamidjojo, 2004).
Ditinjau secara fisik, kromatografi lapis tipis merupakan salah satu jenis
kromatografi planar. KLT memiliki banyak kesamaan dengan kromatografi kertas
dalam penotolan sampel, pengembangan kromatogram dan cara deteksinya, tapi
proses pemisahan yang terjadi pada KLT dan kromatografi kertas berbeda. Pada
KLT, pemisahan yang terjadi secara adsorpsi sedangkan dalam kromatografi
kertas proses pemisahan terjadi secara partisi.
Fase diam dalam KLT berupa padatan penyerap yang dihasilkan pada
sebuah plat datar dari gelas, plastik atau alumina sehingga membentuk lapisan
tipis dengan ketebalan tertentu. Fase diam atau penyerap yang bisa digunakan
sebagai pelapis plat adalah silika gel (SiO2), selulosa, alumina (Al2O3) dan
kieselgur (tanah diatome). Kebanyakan penyerap yang digunakan adalah silika
gel, dimana telah tersedia plat yang siap pakai (Stahl, 1985).
Pelarut sebagai fasa gerak atau eluen merupakan faktor yang menentukan
gerakan komponen-komponen dalam campuran. Pemilihan pelarut tergantung
commit to user
gerak yang bersifat lebih polar digunakan untuk mengelusi senyawa-senyawa
yang adsorbsinya kuat, sedangkan fasa gerak yang kurang polar digunakan untuk
mengelusi senyawa yang adsorbsinya lemah (Sastrohamidjojo, 2004).
Analisis suatu senyawa dalam KLT biasanya dilakukan dengan
dibandingkan terhadap senyawa standarnya. Pengamatan yang lazim berdasarkan
pada kedudukan noda relatif terhadap batas pelarut yang dikenal sebagai Rf
(Retardation factor) yang didefinisikan sebagai berikut :
Rf = Jarak komponen yang bergerak
Jarak pelarut yang bergerak
Identifikasi senyawa pada kromatogram dapat dilakukan dengan melihat
warna noda di bawah sinar UV atau dengan menyemprotkan pereaksi warna
sesuai dengan jenis atau kelas senyawa yang dianalisis (Stahl, 1985).
8. Kromatografi Vakum Cair (KVC)
Kromatografi vakum cair merupakan salah satu kromatografi kolom
khusus yang biasanya juga menggunakan silika gel sebagai adsorben (silika gel
G60 62-200 µm). Alat yang digunakan adalah corong Buchner atau pompa vakum
dengan diameter yang cukup besar untuk mempercepat laju alir fasa gerak selama
proses pemindahan zat terlarut. Pada kromatografi vakum cair, fraksi-fraksi yang
ditampung biasanya bervolume jauh lebih besar dibandingkan dengan
fraksi-fraksi yang diperoleh dari kromatografi kolom biasa (Kristanti, 2008).
Prinsip kerja dari Kromatografi Vakum Cair (KVC) adalah adsorpsi atau
serapan, sedangkan pemisahannya didasarkan pada senyawa-senyawa yang akan
dipisahkan terdistribusi di antara fasa diam dan fasa gerak dalam perbandingan
yang berbeda-beda (Sastrohamidjojo, 2004). Kolom kromatografi dikemas kering
dalam keadaan vakum agar diperoleh kerapatan kemasan maksimum. Pompa
vakum dihentikan dan pelarut yang kepolarannya rendah dituangkan ke
permukaan penyerap lalu divakumkan kembali. Kolom dihisap sampai kering dan
commit to user
dengan pelarut yang kepolarannya rendah lalu kepolarannya ditingkatkan
perlahan-lahan. Kolom dihisap sampai kering pada setiap pengumpulan fraksi.
Oleh karena itu, kromatografi vakum cair menggunakan tekanan rendah untuk
meningkatkan laju aliran fase gerak (Pedersen, 2001)
9. Kromatografi Gas – Spektroskopi Massa (GC-MS)
Perkembangan teknologi instrumentasi menghasilkan alat yang merupakan
gabungan dari dua sistem dengan prinsip dasar yang berbeda satu sama lainnya
tetapi dapat saling melengkapi, yaitu gabungan kromatografi gas dan
spektrofotoskopi massa. Peubah utama dalam GC adalah sifat fasa diam dalam
kolom dan suhu kerja. Keduanya diubah menurut keatsirian senyawa yang
dipisahkan. Pada fasa diam terjadi pemisahan komponen-komponen dan cuplikan.
Dasar kerjanya adalah partisi antara fase diam dan fase gerak (gas). Jadi untuk
pemisahan senyawa-senyawa organik berlaku aturan “like dissolve like”. Polaritas dari komponen cuplikan harus sama dengan fase diam untuk memperoleh
pemisahan terbaik, sehingga senyawa polar akan terpisah pada fasa diam yang
polar dan senyawa non polar akan terpisah pada senyawa diam yang non polar
(Sudjadi, 1988).
Analisis kualitatif yang dilakukan dalam Kromatografi Gas adalah analisa
terhadap waktu retensi (tR) yaitu jarak dalam cm sepanjang garis dasar antara titik
penyuntikan sampel dan titik proyeksi puncak kurva yang dihasilkan oleh standar
internal yang tertera pada kromatogram, sedangkan analisis kuantitatif dengan
perhitungan luas puncak (Sastrohamidjojo, 2004).
Spektroskopi massa tidak seperti metode spektroskopi lainnya, tidak
melibatkan interaksi antara cahaya dengan materi. Spektroskopi massa
dikembangkan berdasarkan prinsip dengan memutus sesuatu menjadi
bagian-bagiannya untuk dilihat dari apa suatu materi tersusun. Pada spektroskopi massa,
sampel pada keadaan uap diionisasi dengan bombardir elektron yang berenergi
tinggi (10-70 eV). Elektron bertumbukan dengan materi sampel dan menyebabkan
commit to user
Molekul yang kekurangan satu elektron akan menjadi kation radikal yang
mengandung semua atom dari molekul awalnya, dan dinamakan ion molekul.
Sebagai akibat dari tumbukan elektron berenergi tinggi membuat ion molekul
mempunyai kelebihan energi yang memungkinkan untuk terjadinya pemutusan
ikatan menghasilkan kation yang lebih kecil, radikal, dan molekul netral. Kation
yang dibebaskan pada peristiwa ini dipisahkan dan dianalisis berdasarkan
perbandingan massa terhadap muatan (m/z) dengan menggunakan kombinasi
medan magnet dan medan listrik. Molekul tidak terpecah secara acak, tetapi
mengikuti beberapa prinsip. Kemudian hanya fragmen tertentu saja yang dapat
diberikan ion molekul.
Senyawa yang menguap dalam ruang hampa di dalam MS ditembak
dengan elektron sehingga elektron dalam molekul akan terlempar keluar dan akan
didapat kation molekul bermuatan positif tunggal dan ganda. Bagian dari kation
molekul ini pada waktu bertemu dengan elektron akan menerima energi yang
tinggi yang akan menyebabkan penguraian lebih lanjut kation molekul menjadi
fragmen yang lebih kecil (fragmentasi). Kation molekul dan fragmen yang
bermuatan positif akan dipercepat oleh tegangan tarikan dan dibelokkan dalam
ruang pengurai. Bagian ini terdiri dari tabung logam yang terdapat diantara dua
kutub magnet. Medan magnet akan membelokkan bagian yang bermuatan dari
arah garis lurus aliran menjadi pita yang melengkung yang dengan perubahan
kontinyu medan magnet atau tegangan tarikan kation sesuai dengan massanya
akan diregristrasi berurutan sebagai spektrum massa (Roth, 1988).
Instrumen GC-MS terdiri dari gas pengangkut (Carrier Gas), pengatur aliran dan pengatur tekanan, tempat injeksi, kolom serta detektor.
a. Gas pengangkut
Gas pengangkut yang sering dipakai dalam GC-MS adalah H2, N2, Ar dan
He. Gas ini berfungsi sebagai fase gerak, gas membawa cuplikan yang telah
teruapkan untuk masuk ke dalam kolom, dalam GC-MS gas pengangkut yang
digunakan harus memenuhi persyaratan dan dasar pemilihannya antara lain: inert
commit to user
mudah diperoleh serta murah, sesuai dengan detektor dan harus dapat mengurangi
difusi gas (Sastrohamidjojo, 2004).
b. Pengatur aliran dan tekanan
Pengatur aliran dan tekanan berfungsi untuk mengalirkan uap sampel
masuk ke dalam kolom.
c. Tempat injeksi
Pemisahan dengan GC sampel harus berada dalam fase uap. Teknik
menginjeksi tergantung pada jenis sampel, adapun jenis teknik injeksi sampel
dalam GC antara lain: split, dalam teknik injeksi ini sampel tidak langsung dimasukkan dalam kolom tetapi sebagian besar dibuang, sampel yang dimasukkan
hanya sekitar 0,1-1 %. Secara umum teknik ini banyak digunakan. Split less, dalam teknik injeksi ini sampel semuanya dimasukkan ke dalam kolom, biasanya
digunakan untuk sampel yang tidak diisolasi dalam jumlah yang besar serta
memiliki konsentrasi rendah. On colum, pada teknik ini merupakan tempat injeksi untuk sampel yang mudah rusak atau sampel yang tidak tahan pada suhu tinggi
dimana sampel tidak melewati suhu injektor yang tinggi tetapi hanya melewati
suhu kolom. Wet needle merupakan salah satu teknik injeksi dimana sampel diuapkan di dalam injektor sehingga sampel yang masuk ke dalam kolom sudah
berada dalam bentuk gas.
d. Kolom
Kolom merupakan jantung kromatografi, keberhasilan atau kegagalan
analisis tergantung dari pemilihan kolom dan kondisi kerja yang tepat. Kolom GC
dibedakan menjadi 2 yaitu: Packed dan capillary. Pada kolom jenis packed sangat bagus untuk sampel dalam skala besar namun kelemahannya lambat dan tidak
efisien, diameter partikel berukuran < 100-300 µm sedangkan pada capillary keuntungannya adalah cepat dan efisien karena menggunakan sampel dalam
jumlah yang sedikit.
e. Detektor
Detektor berfungsi sebagai pendeteksi komponen-komponen cuplikan
yang telah terpisah. Detektor yang baik memiliki sensitivitas yang tinggi, respon
commit to user
semua jenis senyawa. Jenis-jenis detektor antara lain: 1) Flame Ionization Detector (FID), detektor jenis ini efluen gas yang keluar dan kolom dicampur dengan gas H2 serta dibakar dengan O2, sehingga menjadi ion. Ion-ion tersebut
akan menyebabkan peningkatan arus, perubahan arus selanjutnya diukur dan
dikonversikan dalam GC-MS. Dalam FID ini memiliki sifat tidak sensitif terhadap
H2O, CO2 dan SO2. Selain itu, destruktif dan respon dipengaruhi oleh jumlah
atom C, FID ini memiliki sensitivitas 10-13 g/s, 2) Thermal Conductivity Detector (TCD) detektor jenis ini memiliki sifat nondestruktif dan tidak sensitif dengan
sensivitas 10-8 g/s, 3) Mass Spektrometri (MS) detektor jenis ini diset untuk mendeteksi ion fragmen tunggal yang spesifik untuk senyawa yang dianalisa.
Berdasarkan kecepatan pompa dari MS, lebih kurang 1-5% efluen GC displit ke
dalam MS, selanjutnya komponen yang telah terpisah ditembaki dengan elektron
terfragmentasi menjadi ion-ion radikal. Pada MS bagian molekul paling mudah
terfragmentasi adalah yang memiliki kerapatan elektron yang paling tinggi
(Sastrohamidjojo, 2004). Skema alat GC-MS digambarkan dalam Gambar 12
[image:42.595.112.516.170.603.2]berikut:
Gambar 12. Skema alat GC-MS
10.Metode Pengujian Aktivitas Antibakteri
Prinsip umum untuk menentukan aktivitas antibakteri adalah dengan
melihat adanya hambatan pertumbuhan bakteri. Zat antibakteri dapat diperoleh
commit to user
Penapisan zat antibakteri dilakukan secara in vitro. Metode ini dibagi menjadi 2
bagian yaitu metode difusi agar dan metode dilusi.
a. Metode difusi
Metode ini dibagi menjadi tiga yaitu metode perforasi, metode gores
silang dan metode cakram kertas.
1) Metode perforasi
Bakteri uji yang umurnya 18-24 jam disuspensikan kedalam media agar
pada suhu sekitar 45 oC. Suspensi bakteri dimasukkan ke dalam cawan petri,
kemudian dicampur dengan 15 mL media agar steril. Campuran tersebut
dihomogenkan dengan cara gerakan memutar. Setelah agar membeku, dibuat
lubang dengan menggunakan perforator berdiameter 6 mm, tiap lubang diisi
dengan 20 µL sampel ekstrak yang sebelumnya telah dilarutkan dalam larutan
DMSO dengan konsentrasi 10%, kemudian cawan diinkubasi pada suhu 37oC
selama 18-24 jam. Aktivitas antibakteri dapat dilihat daerah bening yang
mengelilingi lubang perforasi.
2) Metode Gores Silang
Zat yang akan diuji diserapkan ke dalam kertas saring (empat persegi
panjang) dengan cara meneteskan pada kertas saring kosong larutan antibakteri
sejumlah volume tertentu dengan kadar tertentu pula. Kertas saring tersebut
diletakkan dipermukaan agar padat, kemudian digores dengan suspensi bakteri
melalui kertas saring dan diinkubasikan selama 18-24 jam pada suhu 37oC.
Aktivitas antibakteri dapat dilihat dari daerah bening yang tidak ditumbuhi bakteri
dekat kertas saring.
3) Metode Cakram Kertas
Zat yang akan diuji diserapkan ke dalam cakram kertas dengan cara
meneteskan pada cakram kertas kosong larutan antibakteri sejumlah volume
tertentu dengan kadar tertentu pula. Cakram kertas diletakkan di atas permukaan
agar padat yang telah dituangkan bakteri sebelumnya. Cawan petri diinkubasi
pada suhu 30°C selama 2 hari sampai 4 hari. Aktivitas antibakteri dapat dilihat
commit to user
b. Metode dilusi
Metode dilusi dibedakan menjadi dua yaitu dilusi cair (broth dilution) dan dilusi padat (solid dilution).
1) Metode dilusi cair
Cara yang dilakukan adalah dengan membuat seri pengenceran agen
antibakteri pada medium cair yang ditambahkan dengan bakteri uji. Larutan uji
agen antibakteri pada kadar terkecil yang terlihat jernih tanpa adanya
pertumbuhan bakteri uji ditetapkan sebagai KHM. Larutan yang ditetapkan
sebagai KHM tersebut selanjutnya dikultur ulang pada media cair tanpa
penambahan bakteri uji ataupun agen antibakteri dan diinkubasi selama 18-24
jam.
2) Metode dilusi padat
Metode ini serupa dengan metode dilusi cair namun menggunakan media
padat (solid). Keuntungan metode ini adalah suatu konsentrasi agen antibakteri
yang diuji dapat digunakan untuk menguji beberapa bakteri uji (Pratiwi, 2008).
11. Konsentrasi Hambat Minimum (KHM) dan Uji Banding
Konsentrasi hambat minimum (KHM) adalah konsentrasi terkecil
(pengenceran terbesar) suatu obat yang masih menghambat pertumbuhan bakteri.
KHM sangat penting untuk menentukan dosis efektif terkecil dari obat dan
memberikan indek perbandingan dengan obat yang lain.
Uji potensi suatu sampel (zat antibakteri) bertujuan untuk mengetahui
sejauh mana kekuatan atau daya aktivitas antibakteri sampel tersebut bila
dibandingkan terhadap suatu zat pembanding. Metode yang digunakan adalah
dengan cara membandingkan respon yang dihasilkan oleh zat antibakteri yang
diperiksa terhadap respon suatu zat antibakteri pembanding. Respon tersebut
berupa hambatan terhadap pertumbuhan bakteri uji.
[image:44.595.110.515.225.484.2]Uji potensi suatu sampel dapat dilakukan dengan cara membuat suatu
grafik atau kurva standart dari zat pembanding, dimana logaritma konsentrasi zat
pembanding diplotkan terhadap sumbu x dan diameter daerah hambat diplotkan
commit to user
persamaan garis linier tersebut, nilai diameter daerah hambat pada konsentrasi
yang telah ditetapkan disubtitusikan ke y maka akan diperoleh nilai x. Antilog dari
nilai x merupakan nilai konsentrasi sampel yang setara dengan zat pembanding,
sehingga dapat ditetapkan nilai uji banding sampel terhadap zat pembanding, yaitu
dengan menggunakan rumus sebagai berikut.
%