Pengaruh pH, Lama Kontak, dan Konsentrasi
pada Adsorpsi Ion Logam Cd
2+Menggunakan
Kitosan-Silika
SKRIPSI
oleh:
RANI RISKADITA
135090201111055
JURUSAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS BRAWIJAYA
i
Pengaruh pH, Lama Kontak, dan Konsentrasi
pada Adsorpsi Ion Logam Cd
2+Menggunakan
Kitosan-Silika
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains dalam bidang Kimia
oleh:
RANI RISKADITA
135090201111055
JURUSAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS BRAWIJAYA
ii Pembimbing I
Darjito, S.Si, M.Si NIP. 197007081995031001
LEMBAR PENGESAHAN SKRIPSI
Pengaruh pH, Lama Kontak, dan Konsentrasi pada
Adsorpsi Ion Logam Cd
2+Menggunakan
Kitosan-Silika
oleh:
RANI RISKADITA
135090201111055
Setelah dipertahankan di depan Majelis Penguji
pada tanggal ……….
dan dinyatakan memenuhi syarat untuk memperoleh gelar Sarjana Sains dalam bidang Kimia
Mengetahui, Ketua Jurusan Kimia
Fakultas MIPA Universitas Brawijaya
Dr. Edi Priyo Utomo, MS NIP. 195712271986031 003
Pembimbing II
iii
LEMBAR PERNYATAAN
Saya yang bertanda tangan di bawah ini: Nama : Rani Riskadita
NIM : 135090201111055 Jurusan : Kimia
Penulis skripsi berjudul:
Pengaruh pH, Lama Kontak, dan Konsentrasi pada
Adsorpsi Ion Logam Cd
2+Menggunakan Kitosan-Silika
Dengan ini menyatakan bahwa:
1. Isi dari skripsi yang saya buat adalah benar-benar karya sendiri dan tidak menjiplak karya orang lain, selain nama-nama yang termaktub di isi dan tertulis di daftar pustaka dalam tugas akhir ini.
2. Apabila dikemudian hari ternyata skripsi yang saya tulis terbukti hasil jiplakan, maka saya akan bersedia menanggung segala resiko yang akan saya terima.
Demikian pernyataan ini dibuat dengan segala kesadaran.
Malang, Januari 2017 Yang menyatakan,
(Rani Riskadita)
iv
Pengaruh pH, Lama Kontak, dan Konsentrasi pada Adsorpsi Ion Logam Cd2+ Menggunakan Kitosan-Silika
ABSTRAK
Modifikasi kitosan-silika telah dibuat untuk meningkatkan kemampuan adsorpsi terhadap ion logam Cd2+ dalam larutan.
Penelitian ini mempelajari pengaruh pH dan lama kontak untuk menentukan kondisi optimum, serta penentuan kapasitas adsorpsi kitosan-silika terhadap ion logam Cd2+. Kitosan-silika dibuat dengan
perbandingan 1:8. Hasil sintesis dikarakterisasi dengan FTIR dan SEM. Kondisi optimum adsorpsi dipelajari dengan variasi pH dan lama kontak menggunakan 0,1 g kitosan-silika, volume larutan ion logam Cd2+ 25 mL dan kecepatan pengadukan 125 rpm. Kapasitas
adsorpsi dipelajari pada konsentrasi larutan 25 mg/L; 50 mg/L; 100 mg/L; 200 mg/L; 300 mg/L; 500 mg/L; 800 mg/L; 900 mg/L; dan 1000 mg/L. Konsentrasi larutan setelah adsorpsi ditentukan secara spektroskopi serapan atom (SSA). Hasil penelitian menujukkan bahwa kitosan-silika terindentifikasi memiliki gugus O – H dan N – H primer (3451,18 cm-1), C=O amida (2947,79 cm-1), Si – O – Si dan
Si – O – C alifatik (1094,33 cm-1), Si – OH (972,82 cm-1), dan C – O
– C (1555,28 cm-1). Morfologi permukaan kitosan-silika yang
tampak kasar dan tidak beraturan. pH optimum adsorpsi diketahui pada pH 3 dengan lama kontak optimum selama 45 menit. Kapasitas adsorpsi kitosan-silika terhadap ion logam Cd2+ sebesar 50,31 mg/g.
v
Effect of pH, Contacts Time, and Metal Ion Concentration on Cd2 + Adsorption using Chitosan-Silica
ABSTRACT
Chitosan–silica modifications have been made to improve the adsorption capability of the Cd2+ ions in solution. This research
studied the influence of pH and duration of contact to determine the optimum conditions, and the determination of the adsorption capacity of chitosan-silica to metal ions Cd2+. Chitosan-silica
prepared by a ratio of 1:8. The result of the synthesis is characterized by FTIR and SEM. The optimum condition of adsorption studied with variation of pH and duration of contact using 0.1 g of chitosan-silica, volume solution of metal ions Cd2+ 25 mL and stirring speed
of 125 rpm. Adsorption capacity were studied in solution concentration of 25 mg/L; 50 mg/L; 100 mg/L; 200 mg/L; 300 mg/L; 500 mg/L; 800 mg/L; 900 mg/L; and 1000 mg/L. The concentration of the solution after adsorption is determined by Atomic Absorption Spectroscopy (AAS). The results shows chitosan-silica have been identified O – H groups and N – H primer (3451.18 cm-1), C = O
amide (2947.79 cm-1), Si – O – Si and Si – O – C aliphatic (1094.33
cm-1), Si – OH (972.82 cm-1), and C – O – C (1555,28 cm-1). The
surface morphology of chitosan–silica looks rough and irregular. The optimum adsorption of pH is at pH 3 with optimum contact time for 45 minutes. The adsorption capacity of chitosan–silica to metal ions Cd2 + is 50.31 mg/g.
vi
KATA PENGANTAR
Puji syukur kehadirat Allah SWT atas nikmat, rahmat, hidayah, dan karunia-Nya diberikan pada penulis sehingga dapat menyelesaikan penelitian dan penulisan skripsi dengan baik, yang berjudul Pengaruh pH, Lama Kontak, dan Konsentrasi pada Adsorpsi Ion Logam Cd2+ Menggunakan Kitosan-Silika. Skripsi
ini ditulis sebagai salah satu syarat mendapatkan gelar Sarjana Sains dalam bidang Kimia Fakultas MIPA Universitas Brawijaya. Penulisan skripsi ini tak lepas dari bimbingan, bantuan, serta dukungan berbagai pihak, maka penulis mengucapkan terima kasih kepada:
1. Darjito, S.Si, M.Si selaku dosen pembimbing I atas segala bimbingan, saran, perhatian, dan doa yang telah diberikan. 2. Dr.rer.nat. Rachmat Triandi T., S.Si, M.Si selaku dosen
pembimbing II atas segala segala bimbingan, saran, perhatian, dan doa yang telah diberikan.
3. M. Farid Rahman, S.Si, M.Si selaku dosen penasehat akademik atas segala bimbingan, saran, perhatian, dan doa yang telah diberikan.
4. Dr. Edi Priyo Utomo, MS., selaku Ketua Jurusan Kimia, serta segenap staf pengajar Jurusan Kimia untuk bimbingan dan ilmu yang telah diberikan kepada penulis selama studi.
5. Kedua orangtua dan kakak tercinta Dany Satriya Kennedy yang telah mendukung, memberi kasih sayang, dan doa yang diberikan dalam menyelesaikan skripsi ini.
6. Teman-teman seperjuangan Kimia 2013 dan Kimia C 2013 yang telah menemani, memberi dukungan, dan doa dalam menyelesaikan skripsi ini.
7. Semua pihak yang tidak dapat disebutkan satu persatu yang telah membantu, memberi saran, dukungan, dan doa dalam menyelesaikan skripsi ini.
Akhir kata, semoga skripsi ini bermanfaat bagi para pembaca dan memberikan ilmu pengetahuan baru yang dapat dikembangkan dimasa yang akan datang.
Malang, Januari 2017
vii DAFTAR ISI
HALAMAN JUDUL i
LEMBAR PENGESAHAN SKRIPSI ii
LEMBAR PERNYATAAN iii
BAB I PENDAHULUAN 1
1.1 Latar Belakang 1
1.2 Rumusan Masalah 3
1.3 Batasan Masalah 3
1.4 Tujuan Penelitian 3
1.5 Manfaat Penelitian 3
BAB II TINJAUAN PUSTAKA 4
2.1 Silika 4
2.2 Kitosan 5
2.3 Adsorben Kitosan-Silika 7
2.4 Logam Berat Cd2+ 10
2.5 Adsorpsi Ion Logam Berat 12
BAB III METODE PENELITIAN 15
3.1 Tempat dan Waktu Penelitian 15
3.2 Alat dan Bahan Penelitian 15
3.3 Tahapan Penelitian 15
3.4 Prosedur Kerja 15
3.4.1 Pembuatan kitosan-silika 15
3.4.2 Karakterisasi kitosan-silika menggunakan FTIR 16 3.4.3 Karakterisasi kitosan-silika menggunakan SEM 16
3.4.4 Pembuatan kurva baku Cd2+ 16
3.4.5 Penentuan kondisi pH optimum adsorpsi ion logam Cd2+ 17
3.4.6 Penentuan lama kontak optimum adsorpsi ion logam Cd2+ 17
3.4.7 Penentuan kapasitas adsorpsi kitosan-silika terhadap logam
Cd2+ 18
3.4.8 Rumus penentuan %Cd2+ yang teradsorpsi 18
3.4.9 Rumus penentuan kapasitas adsorpsi 18
viii
3.5.1 Penentuan persamaan regresi linier 19 3.5.2 Uji statistik adsorpsi Cd2+ oleh kitosan-silika 19
BAB IV HASIL DAN PEMBAHASAN 22
4.1 Adsorben Kitosan-Silika 22
4.2 Penentuan pH Optimum Adsorpsi Ion Logam Cd2+ oleh
Kitosan-Silika 27
4.3 Penentuan Lama Kontak Optimum Adsorpsi Ion Logam Cd2+
oleh Kitosan-Silika 28
4.4 Kapasitas Adsorpsi Kitosan-Silika Terhadap Ion Logam Cd2+ 30
BAB V PENUTUP 33
5.1 Kesimpulan 33
5.2 Saran 33
DAFTAR PUSTAKA 34
ix
DAFTAR TABEL
Tabel 3.1: Tabel analisa data 21
Tabel 4.1: Analisis spektrum kitosan dan kitosan-silika 25 Tabel Lampiran G.1: Penentuan pH optimum 62 Tabel Lampiran G.2: Penentuan lama kontak optimum 63 Tabel Lampiran G.3: Penentuan kapasitas adsorpsi 65
Tabel Lampiran H.1: Uji beda nyata terkecil penentuan pH
optimum 67
Tabel Lampiran H.2: Uji beda nyata terkecil penentuan lama
kontak optimum 68
Tabel Lampiran H.3: Uji beda nyata terkecil penentuan
x
DAFTAR GAMBAR
Gambar 2.1: Struktur dari gugus silanol pada silika 5 Gambar 2.2: Struktur senyawa kitosan 6 Gambar 2.3: Pembuatan kelat oleh kitosan dan ion logam 6 Gambar 2.4: Skema ilustrasi dari fleksibilitas kitosan 7 Gambar 2.5: SEM kitosan-silika pada perbesaran 1.000x (A),
10.000x(B,C), dan 50.000x (D) 8 Gambar 2.6: Spektra FTIR kitosan (A) dan kitosan-silika (B) 9 Gambar 2.7: Ilustrasi proses adsorpsi pada permukaan adsorben 12 Gambar 4.1: Reaksi kitosan dalam larutan asam asetat 22 Gambar 4.2: Reaksi pembentukan molekul monomer dan dimer Dari asam ortosilikat 22 Gambar 4.3: Reaksi polimerisasi dimer asam ortosilikat 23
Gambar 4.4: Spektrum FTIR kitosan 23
Gambar 4.5: Spektrum FTIR kitosan-silika 24 Gambar 4.6: Struktur kitosan-silika 26 Gambar 4.7: Hasil SEM kitosan-silika pada perbesaran
7.000x (A) dan 20.000x (B) 26 Gambar 4.8: Kurva hubungan antara pH dengan %adsorpsi Cd2+ 27
Gambar 4.9: Kurva hubungan antara lama kontak dengan
%adsorpsiCd2+ 29
Gambar 4.10: Kurva hubungan antara konsentrasi Cd2+ saat
xi
DAFTAR LAMPIRAN
Lampiran A. Preparasi Larutan 40
A.1 Pembuatan larutan stok Cd2+ 1000 mg/L
dari CdCl2.2H2O 40
A.2 Pembuatan larutan stok Cd2+ 100 mg/L
dari larutan stok 1000 mg/L dalam 500 mL 40
A.3 Pembuatan larutan HCl 0,1 M 40
Lampiran B. Diagram Alur Penelitian 44
Lampiran C. Diagram Alir 45
C.1 Pembuatan adsorben kitosan-silika 45
C.2 Penentuan pH optimum terhadap adsorpsi Cd2+
oleh adsorben kitosan kitosan-silika 46
C3. Penentuan lama kontak optimum adsorpsi Cd2+
oleh adsorben kitosan-silika 47
C.4 Penentuan kapasitas adsorpsi kitosan-silika terhadap
variasi konsentrasi logam Cd2+ 48
C.5 Penentuan kurva baku Cd2+ 49
Lampiran D. Perhitungan Perkiraan Kedudukan Spektrum Inframerah dari Gugus Si-O 50
Lampiran E. Perhitungan Data Hasil Penelitian 51 E.1 Perhitungan konsentrasi dan massa natrium metasilikat 51
E.2 Perhitungan konsentrasi, %adsorpsi, dan jumlah ion Cd2+
teradsorpsi pada penentuan pH optimum 51
E.3 Perhitungan konsentrasi, %adsorpsi, dan jumlah ion Cd2+
teradsorpsi pada penentuan lama kontak optimum 52
E.4 Perhitungan konsentrasi, %adsorpsi, dan jumlah ion Cd2+
teradsorpsi pada penentuan kapasitas adsorpsi 53 E.5 Perhitungan uji statistik adsorpsi Cd2+ oleh kitosan-silika 55
Lampiran F. Kurva Baku Cd2+ 61
Lampiran G. Data Pengukuran SSA pada Adsorpsi Ion Cd2+ 62
Lampiran H. Uji Beda Nyata Terkecil 67 Lampiran I. Spektrum FTIR Kitosan dan Kitosan-Silika 70
I.1 Spektrum FTIR Kitosan 70
1 BAB I
PENDAHULUAN 1.1 Latar Belakang
Pencemaran lingkungan merupakan salah satu dampak negatif yang ditimbulkan oleh perkembangan teknologi industri yang sangat pesat. Salah satu pencemaran yang berbahaya adalah pencemaran logam berat diperairan. Kontaminasi logam berat di perairan merupakan permasalahan lingkungan yang sangat penting, dan perlu dilakukan berbagai upaya agar tidak membahayakan kehidupan yang ada di sekitar [1].
Logam berat merupakan istilah yang mengacu pada setiap elemen logam yang memiliki kepadatan atom lebih besar dari 4 g/cm3 dan bersifat beracun bahkan dalam konsentrasi yang sangat
rendah [2]. Logam berat yang termasuk elemen mikro dan tergolong dalam kelompok yang tidak memiliki fungsi biologik, salah satunya kadmium (Cd) [1]. Kadmium merupakan salah satu logam yang paling beracun bahkan dalam konsentrasi yang cukup rendah, secara alami menjadi kontaminan utama yang diproduksi oleh lingkungan. Jumlah yang cukup tinggi dalam tubuh seketika dapat menyebabkan kerusakan hati dan ginjal [3-6]. Upaya dilakukan untuk mencegah terjadinya penurunan kualitas kesehatan manusia oleh pencemaran logam berat Cd.
Metode-metode dikembangkan untuk mengatasi permasalahan tersebut, tetapi metode adsorpsi dianggap lebih menguntungkan dibandingkan dengan beberapa metode lainnya, karena ekonomis, sangat efisien, dan mudah diaplikasikan.
Adsorpsi didefinisikan sebagai proses dimana atom, ion atau molekul dari zat (gas, cairan atau padatan terlarut) atau adsorbat terkonsentrasi ke permukaan berpori dari suatu padatan (adsorben) [7]. Material yang diketahui dapat dimanfaatkan sebagai adsorben logam berat yaitu alumina, zeolit, karbon aktif, biomassa, polimer dan silika gel [8]. Selain itu, terdapat pula adsorben dari kitosan yang banyak dikembangkan.
2
dan bersifat sebagai pengkelat. Sifat tersebut sangat penting dalam proses penyerapan logam berat [9,10]. Kitosan dapat menyerap ion logam seperti Cu2+, Pb2+, Cr2+, Zn2+, Co2+, Fe2+, Pt2+, Mn2+, dan Cd2+
[11]. Namun, di berbagai aplikasi kitosan memiliki kelemahan dalam stabilitas pH dan suhu, menyebabkan kemampuan adsorpsi terhadap logam menjadi menurun [12].
Gugus amino dan kelompok hidroksil dengan reaktivitas tinggi memungkinkan berbagai modifikasi kimia yang dapat dilakukan terhadap kitosan untuk meningkatkan adsorpsi terhadap logam [13]. Kombinasi antara makromolekul organik dengan senyawa anorganik menunjukkan terjadi peningkatan sifat optik, katalitik, termal dan sifat mekanik [14]. Kombinasi polisakarida-mineral oksida telah banyak dilaporakan seperti selulosa-silika [15], selulosa-titania [16], kitosan-zeolite [17], dan kitosan-silika [18,19]. Kitosan-silika diketahui lebih unggul penggunaannya sebagai adsorben dan dapat meningkatkan sifat mekanik dalam proses adsorpsi.
Silika memiliki sifat biokompatibilitas, stabilitas mekanik, dan adsorpsi yang baik. Selain itu, gugus silanol (–SiOH) dalam silika berperan dalam pertukaran reversible dengan ion Cd2+. Namun, silika
kurang mampu berinteraksi dengan baik terhadap adsorpsi ion logam Cd2+ karena gugus silanol aktif cukup rendah untuk dapat mencapai
adsorpsi maksimum [20].
Kitosan bead memiliki kapasitas adsorpsi terhadap ion logam Cd2+ 4,123 mg/g, sedangkan kitosan-silika bead dapat mencapai
11,761 mg/g [21]. Selanjutnya, silika-kitosan bead 2:2 dapat menyerap ion logam Cd2+ sebesar 7,5558 x 10-6 mol/g [22]. Selain
itu, kapasitas adsorpsi ion logam Cd2+ menggunakan silika hanya
mencapai 1,95 mg/g, berbeda dengan penggunaan silika-kitosan 85% dapat mencapai 3,14 mg/g [20]. Data tersebut menunjukkan kombinasi silika dengan kitosan yang memiliki gugus amino dan hidroksil memungkinkan untuk membentuk ikatan yang sinergis dengan gugus silanol yang terdapat dalam silika untuk dapat meningkatkan kemampuan adsorben dalam menyerap ion logam Cd2+.
Oleh karena itu, dalam penelitian ini dipelajari pengaruh pH dan lama kontak untuk menentukan kondisi optimum kitosan-silika dalam penyerapan ion logam Cd2+. Kemudian konsentrasi optimum
3 1.2 Rumusan Masalah
1. Bagaimana pengaruh pH terhadap proses adsorpsi ion logam Cd2+ dengan menggunakan kitosan-silika
2. Bagaimana pengaruh lama kontak terhadap proses adsorpsi ion logam Cd2+ dengan menggunakan kitosan-silika
3. Bagaimana pengaruh konsentrasi ion logam Cd2+ terhadap
kapasitas adsorpsi dari kitosan-silika
1.3 Batasan Masalah
1. Pembuatan kitosan-silika menggunakan perbandingan jumlah kitosan dan silika yaitu 1:8.
2. Proses adsorpsi dilakukan pada temperatur ruang.
3. Proses adsorpsi dilakukan dengan kecepatan pengadukan 125 rpm.
1.4 Tujuan Penelitian
1. Mengetahui pengaruh pH terhadap proses adsorpsi ion logam Cd2+ dengan menggunakan kitosan-silika
2. Mengetahui pengaruh lama kontak terhadap proses adsorpsi ion logam Cd2+ dengan menggunakan
kitosan-silika
3. Mengetahui pengaruh konsentrasi ion logam Cd2+ terhadap
kapasitas adsorpsi dari kitosan-silika
1.5 Manfaat Penelitian
4
BAB II
TINJAUAN PUSTAKA 2.1 Silika
Silika adalah kuarsa (quartz) yang terdapat pada sebagian besar batu-batuan sedimen alam dari batuan metamorfik. Pasir juga merupakan bentuk lain dari silika [23]. Silika berbentuk padatan dengan titik leleh sebesar 1600oC dan mendidih pada 2230oC.
Modifikasi kristalin silika berupa senyawa polimerik tiga dimensi dengan jaringan ikatan kovalen Si–O membentuk suatu molekul besar, jaringan tersebut mengandung spesies penghubung berbentuk tetrahedral SiO4, dengan tiap atom Si diikat oleh empat atom O dan
tiap atom O diikat oleh dua atom Si [12].
Silika mempunyai kelebihan dibandingkan bahan lain, karena secara kimia bersifat inert hidrofobik. Selain itu, silika juga menunjukkan kekuatan mekanik dan stabilitas termal yang tinggi dan tidak mengembang dalam pelarut organik [24]. Oleh karena itu, silika dapat dimanfaatkan dalam berbagai aplikasi. Silika biasanya diaplikasikan dalam industri ban, karet, gelas, semen, beton, keramik, tekstil, kertas, kosmetik, cat, film, dan lain sebagainya. Pemanfaatan lain silika yaitu sebagai adsorben logam berat [22]. Hal tersebut didasarkan pada sifat unggul silika dalam biokompatibel, stabilitas mekanik, dan adsorpsi.
Permukaan dari silika memiliki peranan penting dalam proses adsorpsi. Gugus –OH dapat terbentuk dari permukaan silika melalui ikatan valensi dengan atom Si (hidroxyl coverage). Kemudian, pengembangan penelitian menunjukkan bahwa gugus hidroksil
(silanol) ≡Si–OH dapat terbentuk dipermukaan silika [25]. Partikel silika dalam bentuk sferis diperoleh pada rendang pH yang lebar yaitu pada 2 hingga 11. Sedangkan, partikel silika yang terbentuk pada rentang kondisi basa memiliki keseragaman ukuran yang baik. Namun, luas permukaan yang besar sekitar 350-400 m2/g dari
partikel silika, hanya dapat dibentuk pada kondisi asam [26].
5 1. Isolated silanol, pada keadaan tersebut atom Si membentuk tiga ikatan dengan struktur bulk, sedangkan satu ikatan terbentuk dengan gugus – OH
2. Vicinal/bridged silanol, dimana dua gugus dari isolated silanol
dapat membentuk ikatan dengan dua atom Si yang berbeda dan terjadi pembentukan jembatan oleh adanya iaktan hidrogen.
3. Geminal silanol, dimana dua gugus – OH yang terikat pada satu atom Si dan pembentukan ikatan hidrogen dapat terjadi.
Gambar 2.1 Struktur dari gugus silanol pada silika [27] Penelitian lain menunjukkan bahwa gugus silanol adalah gugus penentu sifat permukaan dan efektivitas penyerapannya. Silika juga merupakan adsorben anorganik yang cenderung bersifat polar. Gugus silanol dalam silika berperan dalam pertukaran kation reversible antara ion Cd2+ dan silanol (–SiOH) [20].
2.2 Kitosan
Kitosan merupakan senyawa polisakarida yang sangat melimpah kedua setelah selulosa, satu-satunya polisakarida basa di alam dan tidak beracun, mudah terbiodegradasi, dan harganya murah. Kitosan adalah biopolimer turunan kitin yang diperoleh melalui proses deasetilasi kitin yang mengandung lebih dari 500 unit glukosamin [28]. Kitosan memiliki derajat deasetilasi 80-90%, tetapi apabila derajat deasetilasi mencapai lebih dari 70% dapat dikatakan sebagai senyawa kitosan [29].
Rumus umum kitosan adalah C6H11NO4 atau disebut sebagai
6
Gambar 2.2 Struktur senyawa kitosan [29]
Sifat fisika dari kitosan yaitu tidak dapat larut dalam basa lemah, air atau pelarut organik, senyawa tersebut dapat larut dalam larutan asam seperti asam asetat (CH3COOH), asam nitrat (HNO3),
dan asam klorida (HCl) [30]. Keberadaan gugus amina yang menyebabkan kitosan larut dalam media asam.
Kitosan memiliki satu gugus amino utama (–NH2), dua gugus
hidroksil (–OH) bebas primer dan sekunder. Adanya gugus fungsi tersebut menyebabkan kitosan memiliki reaktivitas yang cukup tinggi [31]. Selain itu, gugus amina bebas juga berperan sebagai penukar ion. Sejumlah besar asam amino dan gugus hidroksil, menjadikan kitosan bersifat polielektrolit. Sifat tersebut sangat penting dalam proses penyerapan logam berat [13].
Gambar 2.3 Pembentukan kelat oleh kitosan dan ion logam [32] Atom nitrogen pada gugus amina memiliki pasangan elektron bebas yang dapat bereaksi dengan kation logam [31]. Gugus fungsi yang terdapat dalam polimer kitosan juga berfungsi sebagai situs
7 Fe2+, Pt2+, Mn2+, dan Cd2+ [11]. Adapun reaksi pengikatan logam
berat Cu2+ terhadap adsorben kitosan membentuk kelat pada
Gambar 2.3.
Gambar 2.4 Skema ilustrasi dari fleksibilitas kitosan [33] Gambar 2.4 menjelaskan bahwa pada pH > 6,5 kitosan menjadi senyawa yang tidak larut, gugus asam amino akan terdeprotonasi dan dapat terjadi interaksi hidrofobik. Sedangkan pada pH antara 6,0 dan 6,5 dalam larutan, asam amino menjadi kurang terprotonasi dan sifat hidrofobik sepanjang rantai menjadi meningkat. Sementara, pada pH < 6,5 kitosan dalam keadaan terlarut membawa muatan positif karena terportonasi dan sebagai molekul polielektrolit kationik, pada pH rendah kitosan akan berinteraksi dengan molekul bermuatan negatif [33,34]. Reaksi kesetimbangan saat terbentuknya polielektrolit pada kitosan dalam pelarut asam menggambarkan keadaan ionisasi [35].
Chitosan – NH2 + H3O+ Chitosan – NH3+ + H2O (2.1)
Reaksi tersebut menunjukkan bahwa terdapat persaingan antara ion logam dan proton pada situs adsorpsi yang tersedia ketika kondisi pH rendah, sehingga hal tersebut dapat menurunkan efisiensi adsorpsi. Sedangkan, ketika bekerja pada pH tinggi, hidrolisis ion logam dimungkinkan untuk terjadi [36]. Oleh karena hal tersebut, pH menjadi parameter penting untuk diteliti dalam menentukan efektivitas adsorben.
2.3 Adsorben Kitosan-Silika
8
dengan kualitas adsorbsi yang lebih tinggi. Kombinasi antara polisakarida dari kitosan dengan senyawa anorganik dari silika menjadi salah satu modifikasi adsorben yang dapat meningkatkan sifat mekanik dari adsorben.
Gambar 2.5 SEM kitosan-silika pada perbesaran 1.000x (A), 10.000x (B,C), dan 50.000x (D) [10]
Adsorben kitosan-silika dengan metode Brunauer-Emmett-Teller ( B.E.T ), memiliki luas permukaan sebesar 359 m2/g dan
9 murni dengan kitosan-silika menghasilkan luas permukaan spesifik sebesar 26,89 m2/g dan volume pori 0,2063 mL/g dengan struktur
berpori (diameter pori ≥ 50 nm, 67,8%) [38].
10
Kemudian, jika ditinjau dari karakterisasi menggunakan FTIR, kitosan murni memiliki beberapa serapan yaitu pada pita 3429 cm-1
merupakan serapa dari getaran peregangan gugus O – H dari gugus hidroksil yang terikat pada atom karbon, pita penyerapan tajam pada 2800 hingga 3000 cm-1 yang teramati sebagai vibrasi peregangan dari
gugus C – H. Selanjutnya, pita serapan di 1580 cm-1 sesuai dengan
getaran deformasi gugus – NH2, vibrasi bending dari C – H terlihat
pada 1420 dan 1380 cm-1, lalu pada pita 1310 cm-1 merupakan
asimetris dari gugus C – O – C, dan 1080 cm-1 untuk C – O vibrasi
stretching dari CH – OH dapat teramati pada Gambar 2.6 (A). Sedangkan hasil kitosan-silika dianalisis juga dengan FT-IR menghasilkan perbedaan spektra yang menghasilkan pergeseran pita pada 1528 cm-1 dari – NH
2 vibrasi deformasi dibandingkan dengan
spektra kitosan. Serapan tajam pada 1100 cm-1 merupakan vibrasi
peregangan dari gugus Si – O (Gambar 2.6 (B)) [10].
Selain itu, pada karakterisasi FT-IR dapat diketahui pula adanya gugus hidroksi dan silanol (Si – OH) pada 3425,58 cm-1, pita
serapan kuat dan tajam pada 1087,85 cm-1 yang merupakan vibrasi
ulur asimetris dari gugus Si – O dari gugus siloksan (Si – O – Si). Konfirmasi adanya silanol dapat diketahui dari pita serapan 956,69 cm-1 yang merupakan vibrasi ulur, lalu vibrasi tekuk dari – OH
silanol ditunjukkan dengan bilangan gelombang 1635,64 cm-1, dan
konfirmasi siloksan pada serapan 470,63 cm-1 [22].
2.4 Logam Berat Cd2+
Kadmium merupakan unsur golongan transisi blok d periode keempat dalam sistem periodik dengan nomor atom 48, titik didih 767oC, titik leleh 321,1oC, densitas sebesar 8,65 g/cm-3 yang
11 Lingkungan alami yang bersifat basa menyebabkan kadmium mengalami hidrolisis, teradsorpsi oleh padatan tersuspensi dan membentuk ikatan kompleks dengan bahan organik. Kadmium dalam bentuk Cd2+, Cd(OH)+, CdCl+, CdSO
4, CdCO3, dan Cd organik dapat
membentuk ikatan kompleks dengan ligan yang berasal dari senyawa organik maupun anorganik [41].
Keelektonegatifan memiliki peranan penting pada proses adsorpsi yang melibatkan pembentukan ikatan kimia antara logam berat dan gugus aktif pada adsorben. Kadmium memiliki elektronegatifitas sebesar 1,7 dan ukuran ionnya mencapai 0,94 Å [40]. Ikatan kimia yang terbentuk merupakan ikatan kovalen koodinasi dengan pasangan elektron bebas dari ligan yang berasal dari adsorben, ion Cd2+ dapat membentuk struktur tetrahedral dengan
4 ikatan dengan panjang 92 pm dan oktahedral dengan 6 ikatan dengan panjang 109 pm [39]. Kadmium yang menempati konfigurasi d10 menurut teori medan kristal, stereokimia kimia dari senyawa
bergantung pada ukuran dan kekuatan polarisasi dari kation M+ dan
sterik ligan. Dalam hal ini, Cd memiliki kestabilan membentuk kompleks tetrahedral 4-koordinat [40].
Selain itu, jika ditinjau dari kekuatan asam-basa, teori Hard Soft Acid Base (HSAB) oleh Person bahwa ion Cd2+ digolongkan
sebagai asam lunak yang lebih mudah berinteraksi dengan basa lunak seperti gugus aktif tiolat (–SH) seperti pada merkaptobenzotiazol dibandingkan asam keras Cr3+ [42]. Sehingga logam tersebut dalam
perairan dapat dengan mudah teradsorpsi untuk membentuk ikatan kimia dengan adsorben yang memiliki sifat basa lunak, dengan membentuk kompleks tetrahedral.
Kadmium bervalensi dua (Cd2+) adalah bentuk ion logam
12
2.5 Adsorpsi Ion Logam Berat
Adsorpsi didefinisikan sebagai proses dimana atom, ion atau molekul dari zat (gas, cairan atau padatan terlarut) atau adsorbat terkonsentrasi ke permukaan berpori dari suatu padatan (adsorben) [7].
Proses adsorpsi dapat terjadi karena adanya gaya tarik atom atau molekul pada permukaan padatan yang tidak seimbang. Suatu padatan akan cenderung menarik molekul-molekul lain yang bersentuhan dengan permukaan padatan, baik fasa gas atau fasa larutan kedalam permukaannya. Akibatnya konsentrasi molekul pada permukaan menjadi lebih besar dari pada fasa zat di sekitarnya. Pada adsorpsi interaksi antara adsorben dengan adsorbat hanya terjadi pada permukaan adsorben [43].
Gambar 2.7 Ilustrasi proses adsorpsi pada permukaan adsorben [43] Adsorpsi dibagi menjadi dua, yaitu adsorpsi secara kimia dan fisika [44].
1. Adsorpsi secara Fisika
13 2. Adsorpsi secara Kimia
Adsorpsi kimia terjadi karena adanya ikatan kimia berupa ikatan kovalen maupun ionik antara adsorbat dengan permukaan adsorben. Ikatan yang terbentuk cukup kuat, dengan diawali proses adsorpsi fisik melalui ikatan van der wall atau ikatan hidrogen, kemudian ikatan kimia terbentuk.
Selama proses adsorpsi berlangsung terdapat mekanisme yang mendasari terjadinya kontak antara adsorben dan adsorbat. Mekanisme proses adsorpsi terbagi menjadi 4 tahapan yaitu [45]:
1. Transportasi zat terlarut dalam larutan
2. Difusi zat terlarut malalui lapisan film dan mengelilingi bagian adsorben
3. Difusi zat terlarut ke dalam dinding pori adsorben (difusi intrapartikel)
4. Adsorpsi dan desorpsi molekul zat terlarut di atau dari permukaan adsorben
Adsorpsi dipengaruhi oleh parameter kimia dan fisika dari adsorben maupun adsorbat. Berikut merupakan faktor-faktor yang mempengaruhi proses adsorpsi [46,47]:
1. Agitation (Pengadukan)
Tingkat adsorpsi dikontrol oleh difusi film maupun difusi pori, tergantung pada tingkat pengadukan pada sistem.
2. Luas permukaan adsorben
Luas permukaan adsorben semakin besar makan adsorbat yang diadsorpsi akan semakin banyak, sehingga efektivitas adsorpsi tercapai.
3. Ukuran butir
Semakin kecil ukuran butiran, maka semakin besar permukaan sehingga penyerapan adsorbat semakin banyak. Kecepatan adsorpsi ditunjukkan oleh kecepatan difusi zat terlarut ke dalam pori-pori partikel adsorben. Ukuran partikel yang baik untuk proses adsorpsi ± 100/200 mesh.
4. Derajat keasaman (pH larutan)
Derajat keasaman menentukan tingkat ionisasi larutan. Keadaan pH rendah, ion H+ akan berkompetisi dengan
kontaminan yang akan diserap, sehingga efisiensi penjerapan akan menurun. Proses adsorpsi biasanya berjalan baik pada pH larutan yang tinggi.
14
5. Lama kontak
Lama kontak yang lebih lama memungkinkan proses difusi dan penempelan adsorbat berlangsung lebih baik. Konsentrasi adsorbat akan menurun dan pada titik tertentu akan mencapai kesetimbangan hingga konstan. Rata-rata lama kontak yang baik berkisar 10 hingga 15 menit.
6. Temperatur
Tingkat adsorpsi akan meningkat dengan kenaikan temperatur dan akan turun ketika terjadi penurunan temperatur. 7. Konsentrasi
Ketika konsentrasi larutan rendah, jumlah adsorbat akan sedikit yang teradsorpsi, sedangkan jika konsentrasi tinggi maka adsorbat yang teradsorpsi akan semakin bnayak. Hal tersebut disebabkan frekuensi tumpukan antar partikel semakin besar.
Faktor-faktor tersebut dapat mempengaruhi kapasitas adsorpsi dari suatu adsorben. Semakin efektif penyerapan yang terjadi maka kapasitas adsorpsi yang dicapai akan semakin tinggi. Kapasitas adsorpsi (q), diukur dengan kondisi optimum menggunakan rumus [48]:
= −
(2.3)
dimana, q (mg/g) merupakan jumlah ion logam yang teradsorpsi ke permukaan adsorben; Ci dan Cf (mg/L) masing-masing merupakan konsentrasi ion logam sebelum dan sesudah adsorpsi; V (mL) adalah volume larutan mengandung ion logam yang digunakan; dan W (g) adalah massa adsorben.
15 BAB III
METODOLOGI 3.1 Tempat dan Waktu Penelitian
Penelitian ini dilakukan di Laboratorium Kimia Anorganik dan Kimia Instrumen Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Brawijaya Malang. Penelitian ini dilaksanakan pada bulan Oktober hingga Desember 2016.
3.2 Alat dan Bahan Penelitian
Alat-alat yang digunakan pada penelitian ini antara lain pH meter, neraca analitik, pengaduk magnetik, shaker, ayakan ukuran 200 mesh, oven (Memmert), FTIR (Fourier-Transform Infrared Spectroscopy) 8400S, SEM (Mikroskop Pemindai Elektron) tipe
Inspect-S50, SSA (Spektroskopi Serapan Atom), dan peralatan gelas. Bahan-bahan yang digunakan dalam penelitian ini adalah kitosan, natirum metasilikat (Merck), serbuk KBr, HCl 37% (Merck), NaOH (Merck), asam asetat glasial 99,9% (Merck), dan kadmium(II) klorida dihidrat (CdCl2.2H2O) (Merck).
3.3 Tahapan Penelitian
Penelitian ini dilakukan melalui beberapa tahapan kegiatan, antara lain:
1. Pembuatan kitosan-silika
2. Karakterisasi kitosan-silika menggunakan FTIR dan SEM 3. Penentuan kondisi optimum pada proses adsorpsi logam
Cd2+ dengan menggunakan kitosan-silika
a. Pengaruh pH terhadap absorpsi logam Cd2+
b. Pengaruh lama kontak terhadap adsorpsi logam Cd2+
4. Penentuan kapasitas adsorpsi kitosan-silika terhadap logam Cd2+
5. Analisis data
3.4 Prosedur Kerja
3.4.1 Pembuatan kitosan-silika
16
pada suhu 105oC selama 60 menit, kemudian dinetralkan dengan
aquades. Gel yang diperoleh disaring dengan kertas saring dan dikeringkan kembali dalam oven pada suhu 105oC. Setelah itu,
padatan digerus hingga halus dan diayak dengan ayakan 200 mesh. Hasil tersebut kemudian dikarakterisasi menggunakan FTIR dan SEM.
3.4.2 Karakterisasi kitosan-silika menggunakan FTIR
Hasil sintesis kitosan-silika dikarakterisasi dengan menggunakan spektrofotometri inframerah. Preparasi untuk karakterisasi dilakukan dengan pembuatan pelet KBr. Pelet KBr dibuat dengan cara mencampurkan 0,5 g padatan hasil sintesis dan 0,07 g KBr. Kemudian campuran digerus, dimasukkan ke dalam
pellet press, dan dikompressi. Selanjutnya, pelet KBr yang mengandung sampel hasil sintesis diletakkan diantara dua celah yang dilewati berkas sinar inframerah dan dibuat spektrumnya pada rentang bilangan gelombang 4000-400 cm-1. Spesifikasi FT-IR antara
lain tipe Michelson sistem optik sinar tunggal, sumber inframerah keramik globular, S/N 20000:1 dan medium sampel pelet KBr.
3.4.3 Karakterisasi kitosan-silika menggunakan SEM
Karakterisasi dengan menggunakan Mikroskop Pemindai Elektron (SEM) dilakukan di Laboratorium Sentral Mineral & Material Maju Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Negeri Malang. Spesifikasi SEM antara lain merk FEI, tipe Inspect-S50, sampel berupa serbuk dan padatan dengan ukuran maksimal 1x1 cm yang tidak mengandung minyak dan air.
3.4.4 Pembuatan kurva baku Cd2+
Larutan baku Cd2+ 25 mg/L sebanyak 0,5 mL kemudian
dimasukkan ke dalam labu ukur 25 mL, lalu ditambahkan aquades hingga tanda batas. Selanjutnya dimasukkan ke dalam botol (0,5 mg/L). Perlakuan yang sama diulangi dengan pengambilan larutan baku Cd2+ 25 mg/L sebanyak 1,0; 2,0; 3,0; 5,0 dan 8,0 mL serta
dimasukkan dalam botol plastik dengan label 0,5 mg/L; 1,0 mg/L; 2,0 mg/L; 3,0 mg/L; 5,0 mg/L; dan 8 mg/L. Kemudian, seluruh botol plastik diukur adsorbansinya menggunakan SSA.
17 sebagai Y. Kurva baku tersebut digunakan untuk penentuan konsentrasi Cd2+ sebelum dan sesudah proses adsorpsi oleh adsorben
kitosan-silika.
3.4.5 Penentuan kondisi pH optimum adsorpsi ion logam Cd2+
Sebanyak 20 mL larutan Cd2+ 100 mg/L dimasukkan
kedalam gelas kimia 25 mL dan diatur pH 2 dengan penambahan NaOH 0,1 M atau HCl 0,1 M. Kemudian, dipipet 10 mL dan dimasukkan kedalam labu ukur 25 mL, ditambahakan 1 mL buffer pH, dan tambahkan dengan larutan pH 2 hingga tanda batas. Setelah itu, dimasukkan ke dalam erlenmeyer 100 mL dan ditambah 0,1 g kitosan-silika, lalu dikocok dengan menggunakan shaker pada kecepatan 125 rpm selama 40 menit. Selanjutnya, disaring menggunakan kertas saring. Filtrat yang diperoleh dipipet 5 mL ke dalam labu ukur 100 mL dan ditambah akuades dan HNO3 sebanyak
3 tetes, kemudian ditambah akuades kembali hingga tanda batas. Larutan dimasukkan ke dalam botol plastik dan diukur konsentrasi sisa dengan SSA. Prosedur tersebut diulangi secara triplo dan perlakuan yang sama dilakukan pada pH 2,5; 3; 4; 5; 5,5; dan 6.
3.4.6 Penentuan lama kontak optimum adsorpsi ion logam Cd2+
Larutan Cd2+ 100 mg/L sebanyak 20 mL dimasukkan ke
dalam gelas kimia 25 mL dan diatur pH optimum yang diperoleh pada perlakuan 3.4.4.1 sebelumnya. Selanjutnya, dipipet sebanyak 10 mL, dimasukkan labu ukur 25 mL, ditambah buffer pH 1 mL, lalu ditambahkan dengan larutan pH yang sama hingga tanda batas. Kemudian, dimasukkan ke dalam erlenmeyer 100 mL dan ditambahkan 0,1 g kitosan-silika, lalu dikocok dengan menggunakan
shaker pada kecepatan 125 rpm selama 5 menit. Setelah itu, larutan disaring dengan menggunakan kertas saring, fitrat yang diperoleh dipipet 5 mL ke dalam labu ukur 100 mL, ditambah akuades dan HNO3 sebanyak 3 tetes, kemudian ditambah aquades kembali hingga
18
3.4.7 Penentuan kapasitas adsorpsi kitosan-silika terhadap logam Cd2+
Larutan ion logam Cd2+ pH 3 diambil sebanyak 10 mL
masing-masing dengan konsentrasi 25, 50, 100, 150, 200, 300, 500, 800, 900 dan 1000 mg/L. Selanjutnya, dimasukkan kedalam labu ukur 25 mL, ditambah buffer pH 1 mL, lalu ditambah akuades hingga tanda batas. Kemudian, larutan dimasukkan kedalam erlenmeyer 250 mL dan di tambahkan dengan 0,1 g adsorben kitosan-silika. Campuran bahan tersebut diaduk selama lama kontak optimum yang telah ditentukan pada perlakuan 3.4.4.2 menggunakan
shaker dengan kecepatan 125 rpm. Larutan disaring menggunakan kertas saring. Filtrat yang diperoleh dipipet 5 mL ke dalam labu ukur 100 mL, ditambah akuades dan HNO3 sebanyak 3 tetes,
kemudian ditambah aquades kembali hingga tanda batas. Setelah itu, seluruh filtrat dimasukkan kedalam botol dan diukur menggunakan AAS pada panjang gelombang 228,8 nm. Prosedur tersebut dilakukan secara triplo.
3.4.8 Rumus penentuan %Cd2+ yang teradsorpsi
Penentuan kondisi optimum adsorpsi Fe2+ disajikan dalam
bentuk grafik sebagai berikut:
a. Variasi pH Vs % Cd2+ teradsorpsi
b. Variasi lama kontak Vs Cd2+ teradsorpsi
Prosentase % Cd2+ teradsorpsi dihitung dengan rumus
sebagai berikut:
% Cd2+ teradsorpsi = Co – Cs
Co x 100% (3.1) Keterangan:
Co = konsentrasi Cd2+ sebelum adsorpsi (mg/L)
Cs = konsentrasi Cd2+ sesudah adsorpsi (mg/L)
3.4.9 Rumus penentuan kapasitas adsorpsi
Penetuan kadar Cd2+ teradsorpsi disajikan dalam bentuk
garfik antara konsentrasi Vs Cd2+ teradsorpsi. Kadar Cd2+
teradsorpsi dapat dihitung dengan menggunakan rumus sebagai berikut:
19 Keterangan:
Co = Konsentrasi Cd2+ sebelum adsorpsi (mg/L)
Cs = Konsentrasi Cd2+ sesudah adsorpsi (mg/L)
V = Volume larutan total Cd2+ (L)
W = Massa adsorben (kitosan-silika) (g)
3.5 Pengolahan Data
3.5.1 Penentuan persamaan regresi linier
Penentuan persamaan regresi linier dari grafik kurva baku Cd2+ menggunakan hubungan antara konsentrasi dengan adsorbansi.
Persamaan yang digunakan sebagai berikut:
y = ax (3.3)
keterangan: y = adsorbansi x = konsentrasi
Nilai a dihitung dengan menggunakan persamaan berikut:
� = ∑∑ (3.4)
Koefisien korelasi ditentukan dengan persamaan berikut:
= ∑
√∑ ∑ (3.5)
Persamaan regresi linier dari larutan Cd2+ yang diperoleh
digunakan untuk menentukan konsentrasi Cd2+ yang telah teradsorpsi
kedalam adsorben kitosan-silika
3.5.2 Uji statistik adsorpsi Cd2+ oleh kitosan-silika
Data hasil penelitian dapat dibuat grafik hubungan antara pH terhadap % Cd2+ yang teradsorpsi, lama kontak terhadap % Cd2+
yang teradsorpsi, dan konsentrasi terhadap jumlah Cd2+ yang
teradsorpsi. Kondisi optimum meliputi pH, lama kontak dan konsentrasi optimum adsorpsi Cd2+ oleh kitosan-silika dapat
20
dan pengaruh dari tiap-tiap perlakuan terhadap adsorpsi ion logam Cd2+.
Data yang diperoleh dapat dianalisis dengan menggunakan Rancangan Acak Lengkap (RAL) untuk mengetahui pengaruh dari tiap perlakuan dengan uji F pada taraf nyata 5%. Jika terdapat perbedaan dilanjutkan dengan Beda Nyata Terkecil (BNT) untuk mengetahui perlakuan mana yang memberikan beda nyata dan tidak beda nyata. Pola analisis ditunjukkan pada Tabel 3.1.
Pengujian ada tidaknya pengaruh pH, lama kontak, dan perbedaan kapasitas adsorpsi Cd2+, maka dilakukan uji F dengan
mengikuti langkah berikut:
1. Menghitung faktor koreksi (FK)
� = ∑= ∑ = �
(3.6)
2. Menghitung jumlah kuadrat (JK) a. JK total (JKt)
� = ∑= ∑ = − � (3.7)
b. JK perlakuan (JKp)
= ∑= ∑= � − � (3.8)
c. JK galat (JKg)
= � − (3.9)
3. Menghitung Kuadrat Tengah (KT) pada setiap sumber keragaman
a. KT perlakuan (KTp)
=
21 b. KT galat (KTg)
=
− (3.11)
4. Menghitung nilah F
�ℎ = �� (3.12)
Tabel 3.1 Tabel analisa data
Perlakuan Pengulangan Total
, , ∑ =
=
, , ∑ =
=
, , ∑ =
=
, , ∑ =
=
, , ∑ =
=
, , ∑ =
=
, , ∑ =
22
BAB IV
HASIL DAN PEMBAHASAN 4.1 Adsorben Kitosan-Silika
Adsorben kitosan-silika dibuat dengan mencampurkan 80 mL larutan kitosan dengan 100 mL larutan Na2SiO3 6% (v/v) hingga
dihasilkan gel dengan pH 6 dan berat kering seberas 2,89 g.
Kitosan dalam larutan CH3COOH akan mengalami protonasi
karena adanya gugus amin menyebabkan kelarutannya menjadi meningkat seperti Gambar 4.1 berikut:
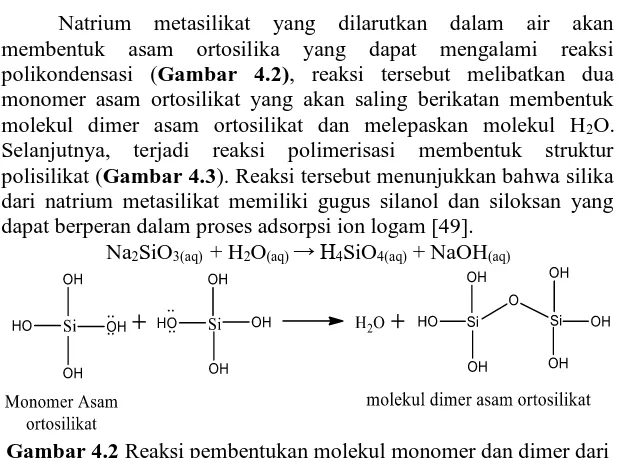
Gambar 4.1 Reaksi kitosan dalam larutan asam asetat Natrium metasilikat yang dilarutkan dalam air akan membentuk asam ortosilika yang dapat mengalami reaksi polikondensasi (Gambar 4.2), reaksi tersebut melibatkan dua monomer asam ortosilikat yang akan saling berikatan membentuk molekul dimer asam ortosilikat dan melepaskan molekul H2O.
Selanjutnya, terjadi reaksi polimerisasi membentuk struktur polisilikat (Gambar 4.3). Reaksi tersebut menunjukkan bahwa silika dari natrium metasilikat memiliki gugus silanol dan siloksan yang dapat berperan dalam proses adsorpsi ion logam [49].
Na2SiO3(aq) + H2O(aq) H4SiO4(aq) + NaOH(aq)
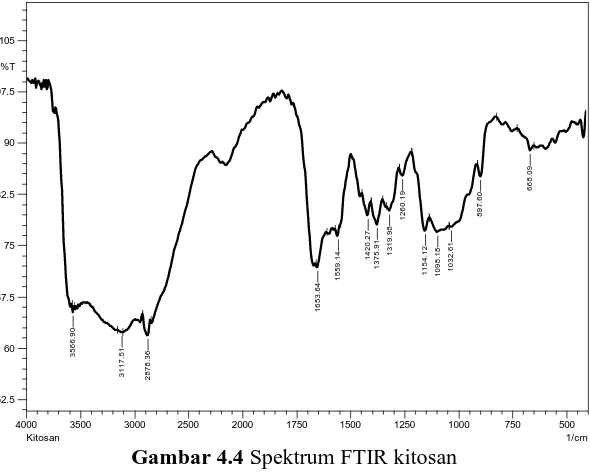
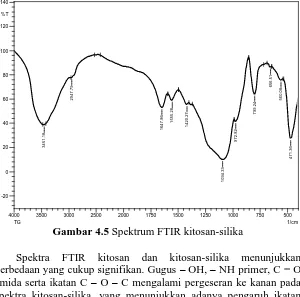
23 Gambar 4.3 Reaksi polimerisasi dimer asam ortosilikat Reaksi pengikatan antara kitosan dan silika dapat ditinjau dari karakterisasi gugus FTIR antara senyawa kitosan dengan senyawa kitosan-silika hasil sintesis. Hasil karakterisasi kedua senyawa seperti sesuai Gambar 4.4 dan 4.5.
Gambar 4.4 Spektrum FTIR kitosan
24
Hasil karakterisasi tersebut kemudian dianalisis untuk mengetahui gugus-gugus fungsi yang terdapat dalam senyawa kitosan maupun kitosan-silika. Analisis sesuai dengan Tabel 4.1, spektra FTIR pada kitosan menunjukkan adanya vibrasi gugus amina primer dan hidroksi yang merupakan gugus aktif penting dalam senyawa kitosan, kedua gugus tersebut bertindak sebagai ligan penjerap ion logam. Selain itu, terdeteksi juga adanya vibrasi C – H sp3 dan C – O – C dari gugus keton dari ikatan polimer kitosan.
Gugus C – N dari senyawa amina yang terikat terdeteksi pada bilangan gelombang 1260,19 cm-1. Sedangkan gugus amida C = O
terdeteksi pada 1653,64 cm-1 yang menandakan bahwa gugus amin
pada kitosan mengikat gugus asil (asetamida).
Gambar 4.5 Spektrum FTIR kitosan-silika
Spektra FTIR kitosan dan kitosan-silika menunjukkan perbedaan yang cukup signifikan. Gugus – OH, – NH primer, C = O amida serta ikatan C – O – C mengalami pergeseran ke kanan pada spektra kitosan-silika, yang menunjukkan adanya pengaruh ikatan antara kitosan dengan senyawa silika yang terikat. Perbedaan sangat
25 jelas terlihat pada daerah 1600 hingga 900 cm-1, menunjukkan
adanya gugus siloksan dari polimer silika dan gugus Si – O – C (alifatik) yang melebar pada daerah 1094,33 cm-1, sedangkan vibrasi
dari gugus C – N tidak terdeteksi akibat adanya tumpang tindih dengan vibrasi gugus siloksan dari senyawa silika. Selain itu, gugus silanol dari kitosan-silika terdeteksi pada bilangan gelombang 972,82 cm-1.
Tabel 4.1 Analisis spektrum kitosan dan kitosan-silika
Vibrasi
26
Gambar 4.6 Struktur kitosan-silika
Gambar 4.7 Hasil SEM kitosan-silika pada perbesaran 7.000x (A) dan 20.000x (B)
Selain dilakukan karakterisasi dengan menggunakan FTIR, dilakukan pula karakterisasi menggunakan Mikroskop Pemindai Elektron (SEM) untuk mengetahui secara umum morfologi dari adsorben kitosan-silika yang telah dibuat. Hasil SEM pada Gambar 4.7 menunjukkan morfologi permukaan yang kasar dan tidak teratur.
27 Pada perbesaran 7000x terlihat bahwa butiran tidak beraturan tersebar di permukaan, begitu pula dengan berbesaran 20.000x yang memperlihatkan partikel-partikel tidak beraturan tersebar. Hal tersebut bersesuaian dengan penelitian lain yaitu pada kitosan-silika tampak adanya partikel padat tidak merata tersebar dengan baik dipermukaan dengan tekstur kasar dan tidak teratur [10, 37].
4.2 Penentuan pH Optimum Adsorpsi Ion Logam Cd2+ oleh
Kitosan-Silika
Faktor adsorpsi yang penting untuk menentukan kondisi optimum dalam proses adsorpsi yaitu kondisi pH larutan. Derajat keasaman (pH) mempengaruhi kelarutan ion logam serta gugus aktif yang terdapat dalam senyawa adsorben. Sehingga analisis dilakukan untuk menentukan kondisi optimal dari penyerapan ion logam Cd2+
terhadap adanya adsorben kitosan-silika.
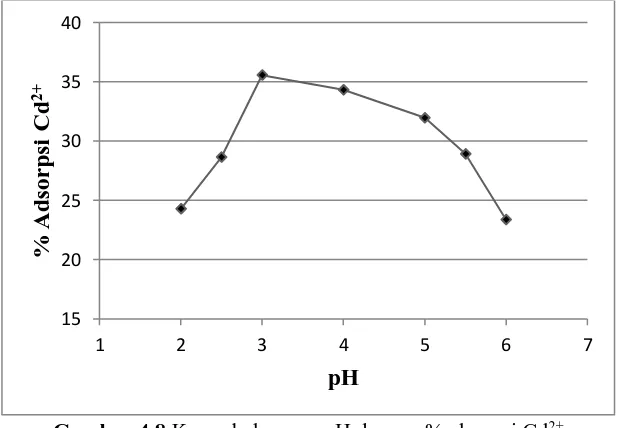
Gambar 4.8 Kurva hubungan pH dengan %adsorpsi Cd2+
Berdasarkan apa yang tampak pada Gambar 4.8 diketahui bahwa pH rendah 2 hingga 3 menunjukkan peningkatan adsorpsi ion logam Cd2+, kemudian penurunan adsorpsi terjadi pada pH 4 hingga
28
Fhitung (242,742) lebih besar dibandingkan dengan Ftabel (3,48). Hal
tersebut menunjukkan bahwa pH atau derajat keasaman memiliki pengaruh terhadap persentase adsorpsi ion Cd2+ oleh kitosan-silika.
Selanjutnya, uji BNT menunjukkan perbedaan proses adsorpsi yang nyata terhadap pada pH 2 hingga 6. Sehingga dapat diketahui bahwa pH optimum untuk proses adsorpsi ion logam Cd2+ oleh
kitosan-silika pada pH 3 dengan persentase adsorpsi sebesar 35,56%.
Konsentrasi ion H+ yang tinggi pada pH kurang dari 3,
menyebabkan terjadinya protonasi gugus-gugus aktif yang terdapat dalam adsorben kitosan-silika utamanya protonasi gugus – NH2
(amin) menjadi – NH3+. Semakin tinggi konsentrasi ion H+ maka
kecenderungan protonasi gugus aktif semakin besar menyebabkan adsorpsi terhadap ion Cd2+ menurun, karena tidak ada lagi pasangan
elektron bebas yang dapat berikatan. Sedangkan pada pH 3, ion Cd2+
diduga memiliki afinitas lebih tinggi untuk dapat berikatan dengan gugus aktif adsorben, sehingga terjadi peningkatan jumlah ion yang teadsorpsi. Hasil tersebut bersesuaian dengan penelitian yang dilakukan oleh Budyak, dkk. [51]. Selanjutnya, jumlah ion Cd2+ yang
teradsorpsi akan semakin menurun dengan kenaikan pH larutan. Hal tersebut terjadi akibat dari menurunnya kelarutan logam dalam larutan, karena ion logam Cd2+ masih dalam bentuk senyawa CdCl
2
yang stabil. Oleh karena hal tersebut, pasangan elektron bebas yang terdapat pada gugus aktif seperti silanol, siloksan, amina, dan hidroksi pada kitosan-silika kurang mampu mengikat ion Cd2+.
4.3 Penentuan Lama Kontak Optimum Adsorpsi Ion Logam Cd2+ oleh Kitosan-Silika
Penentuan lama kontak optimum terhadap adsorpsi ion logam Cd2+ pada adsorben kitosan-silika dilakukan pada pH optimum yaitu
pH 3. Variasi lama kontak adalah 5, 15, 30, 45, 50, dan 60 menit. Percobaan ini bertujuan untuk menentukan waktu yang dibutuhkan antara adsorben dan adsorbat untuk mencapai kesetimbangan adsorpsi, waktu tersebut sebagai waktu optimum adsorpsi Cd2+ oleh
adsorben kitosan-silika.
Uji statistik (Lampiran E.5.2), menunjukkan bahwa pada taraf nyata 0,05 diperoleh Fhitung (317,153) lebih besar dibandingkan
dengan Ftabel (3,48). Hal tersebut menunjukkan bahwa lama kontak
antara adsorbat ion Cd2+ dengan adsorben kitosan-silika memiliki
29 uji BNT menunjukkan bahwa pada waktu 5, 15, 30, dan 45 menit mempunyai pengaruh perlakuan yang berbeda nyata, sedangkan perlakuan tidak berbeda nyata terjadi pada lama kontak 45, 50, dan 60 menit. Oleh karena itu, lama kontak optimum untuk adosprsi ion Cd2+ oleh adsorben kitosan-silika adalah 45 menit dengan persentase
Cd2+ teradsorpsi sebesar 45,25%.
Gambar 4.9 Kurva hubungan lama kontak dengan %adsorpsi Cd2+
Berdasarkan hasil yang tampak pada Gambar 4.9, peningkatan jumlah ion logam Cd2+ yang teradsorpsi terjadi pada
lama kontak antara 5 hingga 45 menit. Hal tersebut terjadi karena proses difusi ion logam Cd2+ kedalam pori-pori adsorben akan
semakin baik seiring dengan semakin lama waktu interaksi. Selanjutnya, jumlah ion Cd2+ yang terserap memiliki kecenderungan
persentase adsorpsi yang konstan pada waktu kontak 45 hingga 60 menit. Konsentrasi ion Cd2+ dalam larutan akan semakin menurun
30
berlanjut terhadap pori-pori adsorben tidak menyebabkan ikatan antara ion logam dengan situs aktif yang terdapat pada adsorben [21,46,47].
4.4 Kapasitas Adsorpsi Kitosan-Silika Terhadap Ion Logam Cd2+
Penentuan kapasitas adsorpsi adsorben kitosan-silika terhadap ion Cd2+ dapat ditentukan dengan mempelajari pengaruh konsentrasi
ion Cd2+ pada saat mencapai kesetimbangan terhadap jumlah ion
logam Cd2+ yang dapat terserap oleh adsorben. Penentuan dilakukan
pada kondisi optimum yaitu pada pH 3 dan lama kotak 45 menit. Data penentuan kapasitas adsorpsi kitosan-silika terhadap ion logam Cd2+ terdapat pada Tabel Lampiran G.3.
Kurva hubungan antara konsentrasi ion Cd2+ saat
kesetimbangan dengan jumlah ion Cd2+ teradsorpsi sesuai Gambar
4.10, terlihat adanya peningkatan jumlah ion Cd2+ yang teradsorpsi
hingga mecapai angka 50 mg/g. Sedangkan, konsentrasi 598,78 mg/L hingga 798,26 mg/L diperoleh jumlah ion Cd2+ teradsorpsi
yang relatif konstan. Uji statistik (Lampiran E.5.3), menunjukkan bahwa pada taraf nyata 0,05 diperoleh Fhitung (15243,75) lebih besar
dibandingkan dengan Ftabel (3,48). Hal tersebut menunjukkan bahwa
konsentrasi ion Cd2+ dalam larutan berpengaruh nyata terhadap
kapasitas adsorpsi dari adsorben kitosan-silika terhadap ion Cd2+
yang dapat teradsorpsi. Kemudian, uji BNT menunjukkan bahwa konsentrasi ion Cd2+ saat kesetimbangan sebesar 13,53 mg/L hingga
598,78 mg/L mempunyai pengaruh perlakuan yang berbeda nyata, sedangkan perlakuan tidak berbeda nyata terjadi pada konsentrasi ion Cd2+ saat kesetimbangan dari 598,78 mg/L hingga 798,26 mg/L.
Berdasarkan yang tampak pada Gambar 4.10, peningkatan jumlah ion Cd2+ teradsorpsi hingga konsentrasi ion Cd2+ saat
kesetimbangan mencapai angka 598,78 mg/L, menunjukkan bahwa konsentrasi ion Cd2+ dalam larutan yang semakin tinggi akan
menyebabkan difusi terus-menerus ke permukaan adsorben kitosan-silika berlangsung semakin baik, hal tersebut dikarenakan konsentrasi partikel ion Cd2+ yang tinggi didalam larutan
31 Keadaan tersebut terus terjadi hingga adsorben kitosan-silika dalam keadaan jenuh.
Gambar 4.10 Kurva hubungan konsentrasi Cd2+ saat kesetimbangan
dengan jumlah ion Cd2+ teradsorpsi
Konsentrasi ion Cd2+ saat kesetimbangan dari 598,78 mg/L
hingga 798,26 mg/L menunjukkan jumlah ion Cd2+ teradsorpsi yang
relatif konstan. Berdasarkan penelitian yang dilakukan oleh Nisa [52], jumlah ion Cd2+ teradsorpsi kedalam kitosan-alumina akan
mencapai keadaan konstan disebabkan oleh gugus aktif pada permukaan adsorben telah terpenuhi dengan ikatan ion logam sehingga penambahan konsentrasi ion Cd2+ dalam larutan tidak akan
menambah jumlah ion Cd2+ yang teradsorpsi. Hal tersebut juga
terjadi pada adsorben kitosan-silika terhadap ion Cd2+, dimana
konsentrasi kesetimbangan diatas 600 mg/L tidak menunjukkan peningkatan jumlah ion teradsorpsi karena diduga seluruh gugus-gugus aktif dalam permukaan adsorben kitosan-silika telah berikatan pada dengan ion Cd2+. Keadaan tersebut menandakan bahwa
kitosan-silika telah mencapai jenuh, sehingga penambahan konsentrasi dari ion Cd2+ dalam larutan tidak meningkatkan peluang terjadinya ikatan
antara ion Cd2+ yang bertindak sebagai atom pusat, untuk berikatan
32
koordinasi dengan gugus aktif kitosan-silika yang bertindak sebagai ligan. Oleh karena itu kapasitas adsorpsi dari kitosan-silika terhadap ion logam Cd2+ sebesar 50,31 mg/g dengan pada pH optimum 3 dan
33 BAB V
PENUTUP 5.1 Kesimpulan
Berdasarkan hasil penelitian yang telah dilakukan dapat diambil kesimpulan sebagai berikut:
1. Penurunan pH dapat meningkatkan jumlah ion logam Cd2+ yang
teradsorpsi, hingga tercapai adsorpsi maksimum pada pH 3. 2. Semakin lama waktu interaksi antara adsorben kitosan-silika
dengan ion Cd2+ maka semakin banyak jumlah ion logam Cd2+
teradsorpsi. Lama kontak optimum tercapai pada menit ke-45. 3. Adsorpsi ion logam Cd2+ dapat meningkat dengan peningkatan
konsentrasi ion dalam larutan, dan mencapai maksimum pada konsentrasi ion Cd2+ dalam kesetimbangan sebesar 598,78
mg/L.
5.2 Saran
34
DAFTAR PUSTAKA
[1] Darmono, 2001, Logam dalam Sistem Biologi Hidup dan Pencemaran, Jakarta: UI-Press.
[2] Duruibe, J.O., M. O. C. Ogwuegbu, dan J. N. Egwurugwu, 2007, Heavy Metal Pollution and Human Biotoxic Effects,
International Journal of Physical Sciences, Vol.2 (5), 112-118.
[3] Deng, S. B. dan Y. P. Ting, 2005, Langmuir, 21, 5940.
[4] Mohan, D., K. P. Singh, dan V. K. Singh, 2005, Ind. Eng. Chem. Res., 44, 1027.
[5] Tsang, D. C. W., dan I. M. C. Lo, 2006, Environ. Sci. Technol., 40, 6655.
[6] Voegelin, A., dan R. Kretzschmar, 2003, Eur. J. Soil Sci., 54, 387.
[7] Hirasaki, 2005, Adsorption Process and Isotherms, [online] http://www.owlnet.rice.edu/~ceng402/
[8] Tripathi, A. dan M. R. Ranjan, 2015, Heavy Metal Removal from Wastewater Using Low Cost Adsorbents, Bioremed Biodeg, 6: 315.
[9] Xu, J., H. Zhao, Wen-Jie Lan, dan Guang-Sheng Luo, 2012, A Novel Microfluidic Approach for Monodispersed Chitosan Microspheres with Contrallable Structures, Adv. Healtcare Mater,1, 106-111.
[10] Budnyak, M. T., L. V. Pylypchuk, V. A. Tertykh, B. S. Yanovska, dan D. Kolodynska, 2015, Synthesis and Adsorption Properties of Chitosan-Silica Nanocomposite Prepared by Sol-Gel Method, Nanoscale Research Letters, 10:87.
[11] Schmuhl, R., HM. Krieg, dan Keizer K., 2001, Adsorption of Cu(II) and Cr(II) Ions by Chitosan: Kinetics and Equilibrium Studies, Water S. Afr., Vol. 27, No.1, 1-8.
35 dan Fe2+, Tugas Akhir, Jurusan Kimia, Fakultas Matematika
dan Ilmu Pengetahuan Alam, UNNES, Surakarta.
[13] Roosendael, S. V., 2015, Selective Adsorption of Scandium with Functionalized Chitosan-Silica Hybrid Materials in The Context of The Valorization of Bauxite Residue,
Molecular Design and Synthesis, Department of Chemistry Faculty of Science Ku Leuven.
[14] Romero, P. G. dan C. Sanchez (eds.), 2004, Functional Hybrid Material, Wiley-VCH, Weinheim.
[15] Sequeira, S., D. V. Evtuguin, I. Portugal, dan A. P. Esculcas, 2007, Synthesis and Characterisation of Cellulose/Silica Hybrids Obtained by Heteropoly Acid Catalysed Sol–Gel Process, Mater. Sci. Eng., C 27, 172-179.
[16] Marques, P. A. A. P., T. Trindade, dan C. P. Neto, 2006, Titanium Dioxide/Cellulose Nanocomposites Prepared by A Controlled Hydrolysis Method, Compos. Sci. Technol., 66, 1038-1044.
[17] Yu, L., J. Gong, C. Zeng, dan L. Zhang, 2012, Synthesis of Monodisperse Zeolite A/Chitosan Hybrid Microspheres and Binderless Zeolite A Microspheres, Ind. Eng. Chem. Res., 51, 2299-2308.
[18] Gandhi, M. R. dan S. Meenakshi, 2012, Preparation and Characterization of Silica Gel/Chitosan Composite for The Removal of Cu(II) and Pb(II), International Journal of Biological Macromolecules, 50, 650– 657
[19] Yeh, J. T., C. L. Chen, dan K. S. Huang, 2007, Synthesis and Properties of Chitosan/SiO2 Hybrid Materials, Mater. Lett.,
61, 1292-1295.
[20] Mohmed, M. A., A. Mulyasuryani, dan A. Sabarudin. 2012, Adsorption of Cadmium By Silica Chitosan, J. Pure App. Chem. Res., 2 (2), 62‐66.
36
Bead dan Kitosan Silika Bead, UNESA Journal of Chemistry, Vol. 2, No.1, 94-99.
[22] Ardana, S. K., 2013, Sintesis Silika-Kitosan Bead untuk Menurunkan Kadar Ion Cd(II) dan Ni(II) dalam Larutan,
Skripsi, Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, UNNS, Surakarta.
[23] Arifiani, N., 2012, Sintesis Membran Kitosan-Silika serta Aplikasinya dalam Proses Filtrasi Air Sadah, Skripsi, Semarang: Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, UNNS, Surakarta.
[24] Bhatia, R. B. dan C. J. Brinker, 2000, Aqueous Sol Gel Process for Protein Encapsulation, Chem. Mater., 12, 2434-2441. [25] Zhuravlev, L. V., 2000, The Surface Chemistry of Amorphus
Silica. Zhuravlec Model, Colloids and Surfaces A: Physicochem. Eng. Aspects, 173, 1-38.
[26] Gan, L. M., L. H. Zhang, H. S. O. Chan, C. H. Chew, dan B. H. Loo, 1996, A Novel Method for The Synthesis of Prevskite-type Mixed Metal Oxide by The Inverse Microemulsion Technique, Journal of Materials Science, 31, 1071-1079. [27] Jal, P. K., S. Patel, dan B. K. Mishra, 2003, Chemical
Modification of Silica Surface by Immobilization of Functional Groups for Extractive Concentration of Metal Ions, Talanta, 62, 1005-1028.
[28] Rebea, E. I., M. E. T. Badawy, C. V. Stevens, G. Smagghe, dan W. Steurbaut, 2003, Chitosan as Antimicrobial Agent: Applications and Mode of Action, Biomacromolecules, 4(6), 1457-1465.
[29] Kaban, J., 2009, Modifikasi Kimia dari Kitosan dan Aplikasi Produk yang Dihasilkan, Medan: Universitas Sumatera Utara. [30] Guibal, E., 2005, Heterogeneous Catalysis on Chitosan-based
Materials: A review, Prog. Polym. Sci., 30, 71-109.
37 [32] KAMIÑSKI, W. dan Z. MODRZEJEWSKA, 1997, Aplication of Chitosan Membranes in Separation of Heavy Metal Ions,
Sep. Sci. Technol, 32(16), 2659-2668.
[33] Elsabee, M. Z., R. E. Morsi, dan A. M. Al-Sabagh, 2009, Surface Active Properties of Chitosan and Its Derivatives,
Colloids Surf. B Biointerfaces, 74, 1-16.
[34] Dash, M., F. Chiellini, R. M. Ottenbrite, dan E. Chiellini, 2011, Chitosan – A versatile Semi-Synthetic Polymer in Biomedical Applications, Prog. Polym. Sci., 36, 981-1014. [35] Rinaudc, M., G. Pavlov, dan J. Desbrières, 1999, Solubilization
of Chitosan in Strong Acid Medium, International Journal of Polymer Analysis and Characterization, 5, 267.
[36] Repo, E., J. K. Warchol, A. Bhatnagar, dan M. Sillanpäa, 2011, Heavy Metals Adsorption by Novel EDTA-Modified Chitosan-Silica Hybrid Materials, Journal of Colloid and Interface Science, 358, 261.
[37] Nahrawy, A. M. E., A. B. Abou Hammad, G. Turky, M. M. M. M. Elnasharty, dan A. M. Youssef, 2015, Synthesis and Characterization of Hybrid Chitosan/Calcium Silicate Nanocomposite Preparated Using Sol-Gel Method,
International Journal of Advancement in Engineering, Technology and Computer Sciences, Vol.2, No.1, 9-14.
[38] Cahyaningrum, S. E. dan D. Kartika, 2014, Adsorption Rate Constant and Capacities of Lead(II) Removal from Synthetic Wastewater Using Chitosan Silica, Proceeding of International Conference On Research, Implementation And Education Of Matematics And Sciences, Yogyakarta State University, 18-20 May 2014.
[39] Enghag, P., 2004, Encyclopedia of the Elements, Jerman:
WILEY-VCH Verlag GmbH & Co KgaA.
[40] Greenwood, N. N. dan A. Earnshaw, 1998, Chemistry of the Elements, United Kingdom: Butterworth-Heinewann.
38
Teknologi Kelautan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor, Bogor.
[42] Amri, A., Supranto, dan M. Fahrurozi, 2004, Kesetimbangan Adsorpsi Optional Campuran Biner Cd(II) dan Cr(III) dengan Zeolit Alam Terimpregnasi 2-Merkaptobenzotiazol, Jurnal Natur Indonesia, Vol.6, No.2, 111-117.
[43] Edward, T., 2012, Kemampuan Adsorben Limbah Lateks Karet Alam Terhadap Minyak Pelumas Dalam Air, Jurnal Teknik Kimia USU, Vol.1, No.2, Departemen Teknik Kimia Fakultas Teknik USU.
[44] Shofa, 2012, Pembuatan Karbon Aktif Berbahan Baku Ampas Tebu dengan Aktivasi Kalium Hidroksida, Skripsi, Fakultas Teknik, Universitas Indonesia, Depok.
[45] Ho, Y. S., J. C. Y. Ng, dan G. McKay, 2000, Kinetics of Pollutant Sorption by Biosorbents: Review, Separation and Purification Methods, 29(2), 189-232.
[46] Benefield, Judkins, dan Weand, 1982, Process Chemistry For Water And Wastewater Treatment, New Jersey: Prentice Hall inc,.
[47] Reynolds, 1982, Unit Operation and Processes in Environmental Engineering, Texas A&M University, Brook/Cole Engineering Division, California.
[48] Liu, Y., Y. Zheng, dan A. Wang, 2009, Enhanced Adsorption of Methylene Blue from Aqueous Solution by Chitosan-g-poly (acrylic acid)/Vermiculite Hydrogel Composites,
Journal of Environmental Sciences, 22(4), 486-493.
[49] Oscik, J, 1982, Adsorption, Ellis Horwood Limited, England
[50] Berghuis, N. T., 2008, Sintesis Membran Kitosan-Tetraetilortosilikat (TEOS) sebagai Membran Fuel Cell pada Suhu Tinggi, Skripsi, Program Studi Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Teknologi Bandung, Bandung.
39 Treatment, Material Science (Medziagotyra), Vol.20, No.2, 177-182.
[52] Nisa, S. N., 2006, Karakterisasi Adsorpsi Ion Cd2+
40
LAMPIRAN Lampiran A. Preparasi Larutan
A.1 Pembuatan larutan stok Cd2+ 1000 mg/L dari CdCl 2
� � = � � . � � ,
� � = , /, / = , = , Pembuatan :
Padatan CdCl2 ditimbang sebanyak 0,9756 g dan dilarutkan
dengan aquades dalam gelas kimia 100 mL. Kemudian dimasukkan kedalam labu ukur 500 mL dan ditambah aquades hingga tanda batas.
A.2 Pembuatan larutan Cd2+ 100 mg/L dari larutan stok 1000 mg/L
dalam 500 mL
M1 . V1 = M2 . V2
1000 mg/L . V1 = 100 mg/L . 500 mL
V1 = 50 mL
Pembuatan:
Larutan stok Cd2+ 1000 mg/L dipipet sebanyak 50 mL dan
dimasukkan kedalam labu ukur 500 mL kemudian ditanda bataskan dengan aquades
A.3 Pembuatan larutan HCl 0,1 M
Berat jenis HCl pekat = 1,19 g/L
Kadar = 37% (v/v)
BM HCl = 36,461 g/mol
[�� ��] = , /, / = 12,076 mol/L
= 12,076 N HCl 0,1 N dalam 500 mL :
N1 . V1 = N2 . V2
12,076 N . V1 = 0,1 N . 500 mL
![Gambar 2.3 Pembentukan kelat oleh kitosan dan ion logam [32]](https://thumb-ap.123doks.com/thumbv2/123dok/2962028.1705566/19.420.73.319.49.122/gambar-pembentukan-kelat-kitosan-ion-logam.webp)
![Gambar 2.3. Gambar 2.4 Skema ilustrasi dari fleksibilitas kitosan [33]](https://thumb-ap.123doks.com/thumbv2/123dok/2962028.1705566/20.420.101.350.94.185/gambar-gambar-skema-ilustrasi-dari-fleksibilitas-kitosan.webp)
![Gambar 2.5 SEM kitosan-silika pada perbesaran 1.000x (A), 10.000x (B,C), dan 50.000x (D) [10]](https://thumb-ap.123doks.com/thumbv2/123dok/2962028.1705566/21.420.44.351.103.400/gambar-sem-kitosan-silika-pada-perbesaran-a-dan.webp)
![Gambar 2.6 Spektra FTIR dari kitosan (A) dan kitosan-silika (B) [10]](https://thumb-ap.123doks.com/thumbv2/123dok/2962028.1705566/22.420.75.362.59.525/gambar-spektra-ftir-dari-kitosan-dan-kitosan-silika.webp)