SISTEM PERIODIK UNSUR
Ahli kimia mengklasifikasikan jutaan zat ke dalam unsur, senyawa, dan campuran. Pada awalnya unsur-unsur dikelompokkan berdasarkan kemiripan sifat. Selanjutnya, seiring dengan semakin banyaknya penelitian yang dilakukan oleh para ahli maka unsur-unsur dikelompokkan berdasarkan kemiripan sifat dan kenaikan massa atom.
Pengertian Sistem Periodik Unsur
Sistem periodik memperlihatkan pengelompokkan atau susunan unsur-unsur dengan tujuan mempermudah dalam mempelajari sifat-sifat berbagai unsur yang berubah secara periodik.
Sejarah Perkembangan Sistem Periodik Unsur
Usaha-usaha untuk mengelompokkan unsur-unsur telah dimulai sejak para ahli menemukan semakin banyaknya unsur di alam. Pengelompokkan unsur-unsur ini dimaksudkan agar unsur-unsur tersebut mudah dipelajari. Beberapa ahli mengelompokkan unsur-unsur tersebut berdasarkan penelitian yang dilakukan.
1) Triade Dobereiner
Pada tahun 1829, Johann Dobereiner mengelompokkan unsure berdasarkan kemiripan sifat ke dalam tiga kelompok yang disebut triade. Dalam triade, sifat unsur kedua merupakan sifat antara unsur pertama dan unsur ketiga. Contohnya: suatu triade Li-Na-K terdiri dari Lithium (Li), Natrium (Na), Kalium (K) yang mempunyai kemiripan sifat. Dia juga menemukan bahwa massa atom unsur kedua adalah rata-rata massa atom unsur pertama dan unsur ketiga. Tabel pengelompokkan unsur dapat dilihat pada Tabel 1. Contohnya: massa atom unsur Na adalah rata-rata massa atom unsur Li dan massa atom unsur K.
Contoh triade yang lain adalah triade Ca-Sr-Ba, triade Cl-Br-I.
Tabel 1. Tabel Triade
Litium
(Li)
Kalsium
(Ca)
Klorin
(Cl)
Belerang
(S)
Mangan
(Mn)
Natrium
(Na)
Stronsium
(Sr)
Bromin
(Br)
Selenium
(Se)
Kromium
(Cr)
(K) (Ba) (I) (Te) (Fe)
2) Hukum Oktaf Newlands
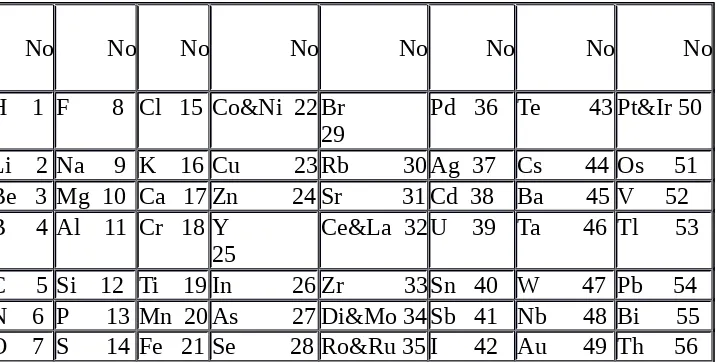
Pada tahun 1865, John Newlands mengklasifikasikan unsur berdasarkan kenaikan massa atomnya. Newlands mengamati ada pengulangan secara teratur keperiodikan sifat unsur. Unsur ke-8 mempunyai sifat mirip dengan unsur ke-1. Begitu juga unsur ke-9 mirip sifatnya dengan unsur ke-2, dan seterusnya. Karena kecenderungan pengulangan selalu terjadi pada sekumpulan 8 unsur (seperti yang telah dijelaskan) maka sistem tersebut disebut Hukum Oktaf.
Tabel 2. Tabel unsur Newlands
No No No No No No No No
H 1 F 8 Cl 15 Co&Ni 22Br 29
Pd 36 Te 43 Pt&Ir 50
Li 2 Na 9 K 16 Cu 23 Rb 30 Ag 37 Cs 44 Os 51 Be 3 Mg 10 Ca 17 Zn 24 Sr 31 Cd 38 Ba 45 V 52 B 4 Al 11 Cr 18 Y
25
Ce&La 32 U 39 Ta 46 Tl 53
C 5 Si 12 Ti 19 In 26 Zr 33Sn 40 W 47 Pb 54 N 6 P 13 Mn 20 As 27 Di&Mo 34 Sb 41 Nb 48 Bi 55 O 7 S 14 Fe 21 Se 28 Ro&Ru 35 I 42 Au 49 Th 56
Kelemahannya adalah Hukum Oktaf Newlands hanya berlaku untuk unsur-unsur dengan massa atom yang rendah.
3) Sistem Periodik Mendeleev
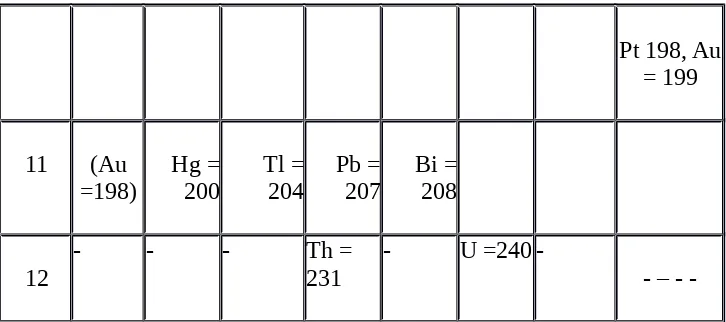
Sesuai dengan kegemarannya yaitu bermain kartu, ahli kimia dari Rusia, Dimitri Ivanovich Mendeleev (1869) mengumpulkan informasi sebanyak-banyaknya tentang unsur, kemudian ia menulis pada kartu-kartu. Kartu-kartu unsur tersebut disusun berdasarkan kenaikan massa atom dan kemiripan sifat. Kartu-kartu unsur yang sifatnya mirip terletak pada kolom yang sama yang kemudian disebut golongan. Sedangkan pengulangan sifat menghasilkan baris yang disebut periode. Alternatif pengelompokkan unsur-unsur lebih ditekankan pada sifat-sifat unsur tersebut daripada kenaikan massa atom relatifnya, sehingga ada tempat-tempat kosong dalam tabel periodik tersebut. Tempat kosong inilah yang oleh Mendeleev diduga akan diisi oleh unsur-unsur dengan sifat-sifat yang mirip tetapi pada waktu itu unsur tersebut belum ditemukan.
Tabel 3. Tabel Sistem Periodik Mendeleev
Pt 198, Au = 199
11 (Au =198)
Hg = 200
Tl = 204
Pb = 207
Bi = 208
12
- - - Th =
231 - U =240 - –
-Kelebihan sistem periodik Mendeleev adalah dapat meramalkan sifat unsur yang belum ditemukan pada saat itu dan telah mempunyai tempat yang kosong, penempatan gas mulia yang baru ditemukan tahun 1890–1900 tidak menyebabkan perubahan susunan sistem periodik Mendeleev, sedangkan kekurangannya yaitu adanya penempatan unsur yang tidak sesuai dengan kenaikan massa atom. Contoh: 127I dan 128Te. Karena sifatnya, Mendeleev
terpaksa menempatkan Te lebih dulu daripada I.
4) Sistem Periodik Modern
Pada tahun 1914, Henry G. Moseley menemukan bahwa urutan unsur-unsur dalam sistem periodik sesuai dengan kenaikan nomor atom unsur. Sistem periodik unsur modern disusun berdasarkan kenaikan nomor atom dan kemiripan sifat. Moseley berhasil menemukan kesalahan dalam tabel periodik Mendeleev, yaitu ada unsur yang terbalik letaknya. Penempatan Telurium dan Iodin yang tidak sesuai dengan kenaikan massa atom relatifnya, ternyata sesuai dengan kenaikan nomor atom. Sistem periodik modern bisa dikatakan sebagai penyempurnaan sistem periodik Mendeleev. Tabel Moseley atau yang dikenal dengan istilah Tabel Sistem Periodik Modern dapat dilihat pada Tabel 4.
Tabel 4. Tabel Sistem Periodik Modern
Jumlah periode dalam sistem periodik ada 7 dan diberi tanda dengan angka:
Periode 1 disebut sebagai periode sangat pendek dan berisi 2 unsur.
Periode 2 disebut sebagai periode pendek dan berisi 8 unsur.
Periode 3 disebut sebagai periode pendek dan berisi 8 unsur.
Periode 4 disebut sebagai periode panjang dan berisi 18 unsur.
Periode 5 disebut sebagai periode panjang dan berisi 18 unsur.
Periode 6 disebut sebagai periode sangat panjang dan berisi 32 unsur, pada periode ini terdapat unsur Lantanida yaitu unsur nomor 58 sampai nomor 71.