mengkuantifikasi reporter fluoresen. Sinyal fluoresen akan meningkat seiring dengan bertambahnya produk PCR dalam reaksi. Dengan mendeteksi jumlah emisi fluoresen pada setiap siklus, amplifikasi selama fase logaritmik dapat dipantau. Peningkatan produk PCR yang signifikan pada fase eksponensial berhubungan dengan jumlah inisiasi gen target. Semakin tinggi emisi fluoresen maka semakin banyak DNA yang diamplifikasi (Litbang 2010).
METODE PENELITIAN
Bahan dan Alat Penelitian
Bakteri yang digunakan pada penelitian ini adalah S. mutans XC (serotip C) yang terdapat di Laboratorium Biologi Oral FKG UI. Bahan-bahan yang digunakan dalam pembuatan permen (sebagai model uji) adalah isomalt, ekstrak kayu putih, ekstrak peppermint, perisa, dan air.
Bahan-bahan yang digunakan dalam eksperimen adalah medium kultur
Brain Heart Infusion (BHI) broth dan BHI agar, air destilata steril, gas CO2,
Phosphate Buffer Saline (PBS, pH 7,2) steril, kristal violet 0,5%, etanol 95%, Trizol® Reagent, DEP-C water, RNAse free water, chloroform, isopropanol,
etanol 75% (dalam DEP-C water), Invitrogen SuperScriptTM III cDNA synthesis
kit, primer gtfB dan gtfC, heksan (GC grade), 1,4-diklorobenzen, sulfat anhidrat,
dan standar alkana C8 s.d. C20
Peralatan penelitian yang digunakan adalah peralatan gelas, timbangan, pipet mikro, pipet tip, anaerobic jar, inkubator, cawan petri, bunsen,
6-24-96-multiwell plate, tube 1,5 ml, PCR-tube, centrifuge (SORVALL
.
®
Legend RT)
dengan kecepatan mencapai 12000 x g, microplate ELISA reader (BIORAD),
Real Time PCR (AB Applied Biosystem), Gas Chromatography-Mass Spectra
(Agilent) kolom DB-5.
Waktu dan Lokasi Penelitian
Penelitian dilaksanakan pada Juni hingga Desember 2012. Penelitian ini dilaksanakan di Laboratorium Pengolahan Bahan Pangan Departemen Ilmu dan Teknologi Pangan FATETA IPB; Laboratorium Biologi Oral FKG UI; dan Laboratorium Flavor Balai Besar Pusat Penelitian Padi – Sukamandi, Subang, Jawa Barat.
Prosedur Penelitian
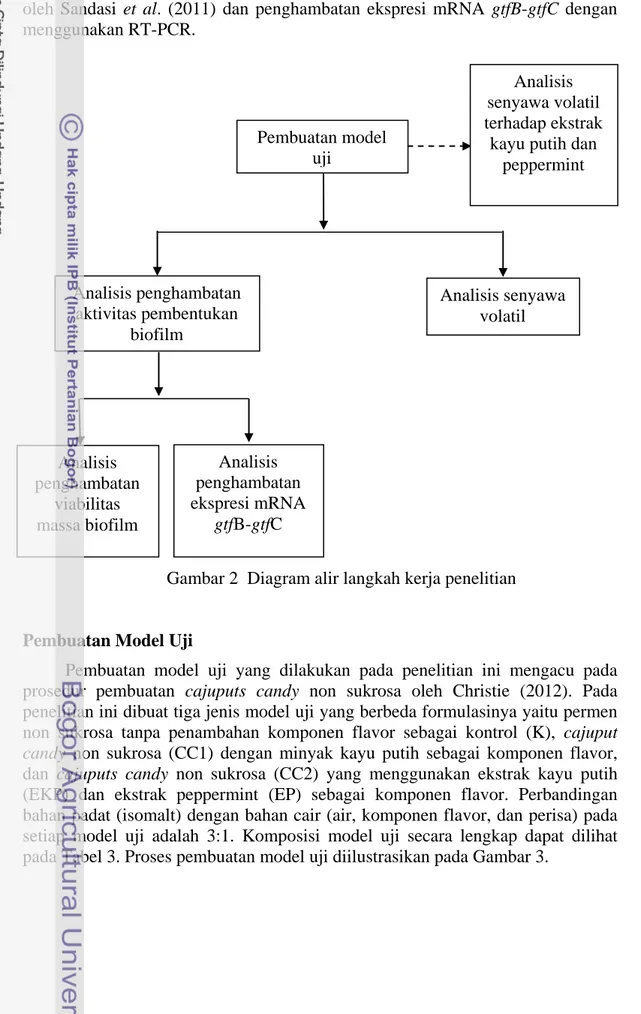
Penelitian ini dibagi menjadi dua tahapan, seperti diilustrasikan pada Gambar 2. Tahap pertama pada penelitian ini adalah pembuatan model uji. Tahap kedua merupakan pengamatan, yaitu pengamatan terhadap senyawa volatil potensi penghambatan pembentukan biofilm. Pengamatan senyawa volatil dengan menggunakan GC-MS terhadap ekstrak kayu putih dan ekstrak peppermint dilakukan di awal untuk mendapatkan informasi awal senyawa volatil, baru
pengamatan senyawa volatil terhadap model uji dilakukan setelahnya. Potensi penghambatan aktivitas pembentukan biofilm oleh model uji diamati melalui analisis penghambatan viabilitas massa biofilm sesuai prosedur yang dilakukan oleh Sandasi et al. (2011) dan penghambatan ekspresi mRNA gtfB-gtfC dengan menggunakan RT-PCR.
Gambar 2 Diagram alir langkah kerja penelitian
Pembuatan Model Uji
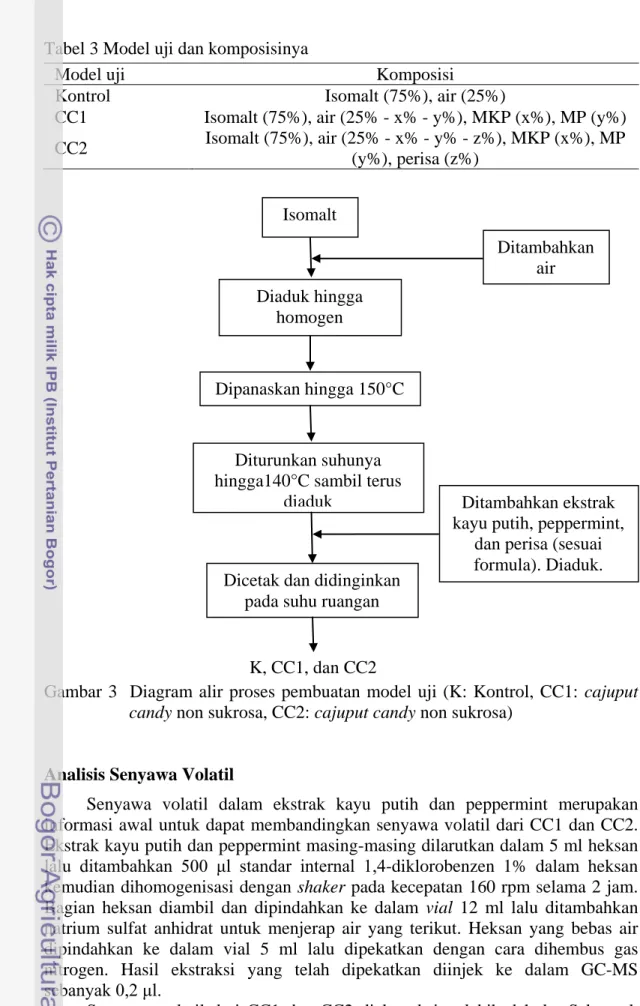
Pembuatan model uji yang dilakukan pada penelitian ini mengacu pada prosedur pembuatan cajuputs candy non sukrosa oleh Christie (2012). Pada penelitian ini dibuat tiga jenis model uji yang berbeda formulasinya yaitu permen non sukrosa tanpa penambahan komponen flavor sebagai kontrol (K), cajuput
candy non sukrosa (CC1) dengan minyak kayu putih sebagai komponen flavor,
dan cajuputs candy non sukrosa (CC2) yang menggunakan ekstrak kayu putih (EKP) dan ekstrak peppermint (EP) sebagai komponen flavor. Perbandingan bahan padat (isomalt) dengan bahan cair (air, komponen flavor, dan perisa) pada setiap model uji adalah 3:1. Komposisi model uji secara lengkap dapat dilihat pada Tabel 3. Proses pembuatan model uji diilustrasikan pada Gambar 3.
Analisis penghambatan viabilitas massa biofilm Analisis penghambatan ekspresi mRNA gtfB-gtfC Analisis senyawa volatil Pembuatan model uji Analisis penghambatan aktivitas pembentukan biofilm Analisis senyawa volatil terhadap ekstrak
kayu putih dan peppermint
Tabel 3 Model uji dan komposisinya
Model uji Komposisi
Kontrol Isomalt (75%), air (25%)
CC1 Isomalt (75%), air (25% - x% - y%), MKP (x%), MP (y%) CC2 Isomalt (75%), air (25% - x% - y% - z%), MKP (x%), MP
(y%), perisa (z%)
Gambar 3 Diagram alir proses pembuatan model uji (K: Kontrol, CC1: cajuput
candy non sukrosa, CC2: cajuput candy non sukrosa)
Analisis Senyawa Volatil
Senyawa volatil dalam ekstrak kayu putih dan peppermint merupakan informasi awal untuk dapat membandingkan senyawa volatil dari CC1 dan CC2. Ekstrak kayu putih dan peppermint masing-masing dilarutkan dalam 5 ml heksan lalu ditambahkan 500 μl standar internal 1,4-diklorobenzen 1% dalam heksan kemudian dihomogenisasi dengan shaker pada kecepatan 160 rpm selama 2 jam. Bagian heksan diambil dan dipindahkan ke dalam vial 12 ml lalu ditambahkan natrium sulfat anhidrat untuk menjerap air yang terikut. Heksan yang bebas air dipindahkan ke dalam vial 5 ml lalu dipekatkan dengan cara dihembus gas nitrogen. Hasil ekstraksi yang telah dipekatkan diinjek ke dalam GC-MS sebanyak 0,2 μl.
Senyawa volatil dari CC1 dan CC2 diekstraksi terlebih dahulu. Sebanyak 50 g CC1 dan CC2 masing-masing ditimbang ke dalam erlenmeyer 250 ml lalu
Dipanaskan hingga 150°C
Diturunkan suhunya hingga140°C sambil terus
diaduk Ditambahkan ekstrak kayu putih, peppermint,
dan perisa (sesuai formula). Diaduk. Dicetak dan didinginkan
pada suhu ruangan
Ditambahkan air Diaduk hingga homogen K, CC1, dan CC2 Isomalt
ditambahkan 20 ml air destilat dan 5 ml heksan (GC grade) kemudian dihomogenisasi dengan shaker pada kecepatan 160 rpm selama 15 jam 50 menit dan 1 μl standar internal 1,4-diklorobenzen 1% dalam heksan ditambahkan ke masing-masing erlenmeyer. Bagian heksan yang berada pada lapisan paling atas diambil dan dipindahkan ke dalam vial 15 ml, bagian air yang terikut dijerap dengan natrium sulfat anhidrat, bagian heksan dipindahkan ke dalam vial 5 ml lalu dipekatkan dengan cara dihembus gas nitrogen. Hasil ekstraksi yang telah dipekatkan kemudian diinjek ke dalam GC-MS sebanyak 1 μl.
Gambar 4 Diagram alir analisis senyawa volatil
Kondisi GC-MS mengacu pada jurnal Muchtaridi et al. (2004) dengan beberapa perubahan disesuaikan dengan kondisi alat GC-MS yang digunakan pada penelitian ini. Senyawa volatil dianalisis menggunakan GC-MS di laboratorium flavor Balai Besar Pusat Penelitian Padi, Sukamandi-Subang, Jawa Barat dengan kolom kapiler DB-5 MS (dimensi 30 m x 0,32 mm x 0,25 μm), injeksi split rasio 5:1 untuk CC1-CC2 dan 100:1 untuk minyak atsiri, gas pembawa Helium tekanan 80 kPa, program suhu 60°C ditahan selama 5 menit kemudian dinaikkan hingga suhu 250°C ditahan selama 2 menit (laju kenaikan 10°C/menit).
Perhitungan nilai LRI ditentukan dengan persamaan : LRIx
LRI
= 100 x
t
= indeks retensi linier komponen x (yang diperiksa) x = waktu retensi komponen x (menit)
CC1 - CC2 ditimbang 50 g, dilarutkan dalam aquadest
tn
t
= waktu retensi alkana standar, dengan n atom karbon yang muncul sebelum waktu komponen x
n+1
n = jumlah atom karbon alkana standar yang muncul sebelum komponen x = waktu retensi alkana standar, dengan n+1 atom karbon yang muncul
setelah waktu komponen x
Analisis Penghambatan Aktivitas Pembentukan Biofilm Pembiakan S. mutans
S. mutans XC diambil sebanyak 1 ose dari stok bakteri yang disimpan di
dalam lemari pendingin pada suhu -80°C, kemudian digoreskan pada medium BHI agar dan diinkubasi selama 48 jam pada suhu 37°C dengan kondisi mikroaerofilik (kadar CO2
S. mutans XC yang telah dibiakkan dalam BHI broth diambil sebanyak 200
μl lalu ditempatkan ke dalam 96-multiwell plate untuk ditentukan konsentrasinya dengan menggunakan microplate ELISA reader pada panjang gelombang 450 nm. Setelah diketahui konsentrasi S. mutans XC yang telah dibiakkan, selanjutnya konsentrasi awal S. mutans XC diseragamkan menjadi 10
5%) di dalam anaerobic jar. Diambil masing-masing 1 ose S. mutans XC dari 2 koloni berbeda dan ditumbuhkan pada 5 ml media kultur BHI broth untuk selanjutnya diinkubasi kembali selama 24 jam pada suhu 37°C dengan kondisi mikroaerofilik di dalam anaerobic jar.
6
V
CFU/ml dengan pengenceran menggunakan BHI broth. Untuk mengetahui jumlah BHI broth yang harus ditambahkan, dilakukan perhitungan dengan menggunakan rumus berikut,
1 x M1 = V2 x M V
2 1
M
= Volume awal S. mutans XC 1
V
= Konsentrasi S. mutans XC yang dibaca dengan microplate ELISA reader 2
M
= Volume BHI broth yang dibutuhkan untuk mengencerkan 2 = Konsentrasi S. mutans XC yang diharapkan (106 CFU/ml)
Analisis Penghambatan Viabilitas Massa Biofilm
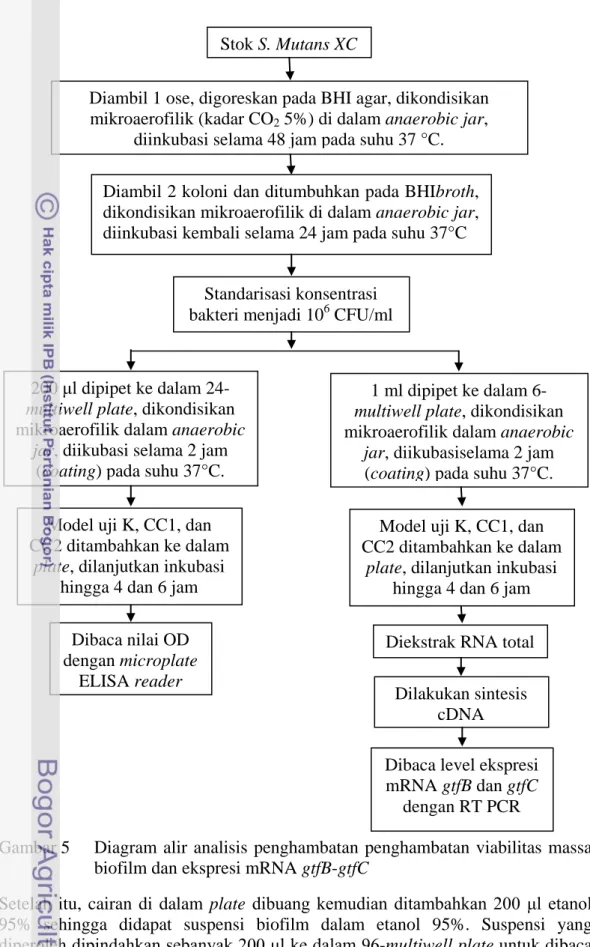
Analisis penghambatan viabilitas massa biofilm dilakukan sesuai prosedur Sandasi et al. (2011) dengan beberapa perubahan yang disesuaikan pada tujuan penelitian. S. mutans XC dengan konsentrasi awal 106 CFU/ml dipindahkan sebanyak 200 μl ke dalam 24-multiwell plate lalu diinkubasi pada kondisi mikroaerofilik (kadar CO2 5%), suhu 37°C selama 2 jam (coating). Coating dilakukan untuk mendapatkan biofilm awal sehingga dapat diketahui kemampuan pembentukan kembali biofilm oleh S.mutans setelah kontak dengan model uji. Model uji (K, CC1, dan CC2) yang telah dilarutkan dalam BHI broth (2:1) ditambahkan ke dalam 24-multiwell plate setelah coating kemudian diinkubasi kembali hingga 4 jam dan 6 jam. Setelah diinkubasi, semua cairan dalam plate dibuang sehingga hanya meninggalkan biofilm yang melekat pada dasar plate. Tiap plate kemudian dicuci sebanyak 3 kali dengan larutan PBS. Plate kemudian difiksasi di atas api agar biofilm melekat kuat pada plate lalu ditambahkan 200 μl
Gambar 5 Diagram alir analisis penghambatan penghambatan viabilitas massa biofilm dan ekspresi mRNA gtfB-gtfC
Setelah itu, cairan di dalam plate dibuang kemudian ditambahkan 200 μl etanol 95% sehingga didapat suspensi biofilm dalam etanol 95%. Suspensi yang diperoleh dipindahkan sebanyak 200 μl ke dalam 96-multiwell plate untuk dibaca nilai OD-nya dengan microplate ELISA reader pada panjang gelombang 450 nm. Metode yang sama namun tanpa model uji diterapkan pada blanko yang hanya terdiri dari BHI broth. Blanko digunakan sebagai kalibrator untuk setiap
Stok S. Mutans XC
Diambil 1 ose, digoreskan pada BHI agar, dikondisikan mikroaerofilik (kadar CO2 5%) di dalam anaerobic jar,
diinkubasi selama 48 jam pada suhu 37 °C. Diambil 2 koloni dan ditumbuhkan pada BHIbroth, dikondisikan mikroaerofilik di dalam anaerobic jar, diinkubasi kembali selama 24 jam pada suhu 37°C
Standarisasi konsentrasi bakteri menjadi 106 CFU/ml
200 μl dipipet ke dalam
24-multiwell plate, dikondisikan
mikroaerofilik dalam anaerobic
jar, diikubasi selama 2 jam
(coating) pada suhu 37°C.
1 ml dipipet ke dalam
6-multiwell plate, dikondisikan
mikroaerofilik dalam anaerobic
jar, diikubasiselama 2 jam
(coating) pada suhu 37°C. Model uji K, CC1, dan
CC2 ditambahkan ke dalam
plate, dilanjutkan inkubasi
hingga 4 dan 6 jam
Model uji K, CC1, dan CC2 ditambahkan ke dalam
plate, dilanjutkan inkubasi
hingga 4 dan 6 jam Dibaca nilai OD
dengan microplate ELISA reader
Diekstrak RNA total Dilakukan sintesis
cDNA
Dibaca level ekspresi mRNA gtfB dan gtfC
perlakuan. Persentase penghambatan pembentukan massa biofilm pada K, CC1, dan CC2 ditentukan dengan persamaan berikut
Persen penghambatan = x 100%
Analisis Penghambatan Ekspresi mRNA gtfB dan gtfC Ekstraksi RNA Total
Sebanyak 1 ml S. mutans dengan konsentrasi 106 CFU/ml dipindahkan ke dalam 6-multiwell plate kemudian diinkubasi selama 2 jam (coating) pada suhu 37°C dengan kondisi mikroaerofilik (kadar CO2
Ekstraksi RNA total S.mutans dilakukan berdasarkan panduan Trizol 5%). Coating dilakukan untuk mendapatkan biofilm awal sehingga dapat diketahui kemampuan pembentukan kembali biofilm oleh S. mutans setelah kontak dengan model uji. Model uji K, CC1, dan CC2 yang telah dilarutkan dalam BHI broth (2:1) ditambahkan ke dalam 6-multiwell plate setelah coating, selanjutnya diinkubasi kembali hingga 4 dan 6 jam. Metode yang sama namun tanpa model uji diterapkan pada blanko yang hanya terdiri dari BHI broth. Blanko digunakan sebagai kalibrator untuk setiap perlakuan. Setelah proses inkubasi selesai, tahap persiapan selanjutnya adalah ekstraksi RNA total S.mutans.
® Reagent yang digunakan. S. mutans dalam 6-multiwell plate disuspensikan dalam
Trizol® Reagent. Suspensi dipindahkan ke dalam tube 1,5 ml lalu ditambahkan
0,2 ml chloroform per 1 ml Trizol®
Lapisan RNA dipindahkan ke dalam tube baru kemudian ditambahkan 0,5 ml isopropanol 100% per 1 ml Trizol
yang digunakan, dihomogenisasi dengan tangan selama 15 detik lalu dikondisikan pada suhu ruang selama 2-3 menit. Suspensi disentrifugasi pada suhu 4°C dengan kecepatan 12000 x g selama 15 menit sehingga diperoleh bagian RNA (lapisan paling atas).
®
Pelet RNA kemudian dicuci dengan 1 ml etanol 75% per 1 ml Trizol
yang digunakan, dikondisikan pada suhu ruang selama 10 menit kemudian disentrifugasi kembali pada suhu 4°C dengan kecepatan12000 x g selama 10 menit. Bagian supernatan kemudian dibuang sehingga hanya menyisakan pelet RNA.
®
Amplifikasi dalam RT-PCR memerlukan template DNA, maka RNA yang diperoleh harus diubah terlebih dahulu menjadi cDNA. Untuk itu, perlu ditentukan terlebih dahulu konsentrasi RNA dengan menggunakan spektrofotometer. MiliQ water sebanyak 500μl digunakan sebagai blanko. Masing-masing suspensi RNA dipipet 495 μl ke dalam cuvet lalu ditambahkan 5 μl miliQ water ke dalamnya lalu dibaca sebagai sampel.
yang digunakan, lalu dihomogenisasi menggunakan vortex sebelum disentrifugasi dengan kecepatan 7500 x g pada suhu 4°C selama 5 menit, dan didiamkan di dalam lemari biohazard selama 30 menit. Pelet RNA kemudian disuspensikan kembali dengan penambahan RNase free water sebanyak 20-50 μl.
Sintesis cDNA
Konsentrasi RNA yang digunakan ditetapkan sebesar 5 μg/μl. RNA total sebanyak 5 μl dipindahkan ke dalam tube PCR lalu ditambahkan random
hexamers 50 ng/μl sebanyak 1 μl, 10mM dNTP mix sebanyak 1 μl, dan DEPC-water sebanyak 3 μl sehingga volume total yang diperoleh sebanyak 10 μl.
Campuran kemudian diinkubasi dalam PCR pada suhu 65°C selama 5 menit, setelahnya langsung ditempatkan dalam kotak es selama 1 menit. Setelah itu ditambahkan ke dalam tube PCR: 10 x RT buffer sebanyak 2 μl, 25 mM MgCl2 sebanyak 4 μl, 0,1 M DTT sebanyak 2 μl, RNase OUT (40U/μl) sebanyak 1 μl, dan Superscript III RT (200U/μl) sebanyak 1 μl. Setelah ditambahkan, campuran kemudian diinkubasi kembali pada suhu 25°C selama 10 menit, dilanjutkan pada suhu 50°C selama 50 menit lalu diterminasi pada suhu 85°C selama 5 menit. Kemudian ditambahkan 1 μl RNase H ke dalam masing-masing tube dan diinkubasi kembali selama 20 menit pada suhu 37°C. Hasil cDNA disimpan pada suhu -20°C atau langsung digunakan untuk analisis dengan RT-PCR.
Penentuan Level Ekspresi mRNA gtfB dan gtfC
Amplifikasi, deteksi, dan analisis mRNA dilakukan dengan AB Applied RT-PCR dengan SYBR Green RT-PCR master mix yang disesuaikan. cDNA yang diperoleh diencerkan terlebih dahulu dengan DEPC-water sehingga didapat konsentrasi cDNA sebesar 50 ng. Disiapkan campuran pereaksi terdiri dari 5 μl
SYBR Green PCR master mix, 1 μl forward primer gen (10μM), 1 μl reverse primer gen (10μM), dan 1 μl ddH2O. Campuran pereaksi yang telah disiapkan kemudian dipindahkan sebanyak 8 μl ke dalam tube PCR baru, lalu ditambahkan 2 μl cDNA (50 ng) sehingga diperoleh volume total dalam tube sebanyak 10 μl. Campuran yang telah disiapkan kemudian disentrifugasi dengan kecepatan 2000 rpm selama 1 menit sebelum dianalisis dengan RT-PCR.
Tabel 4 Sekuen nukleotida primer mRNA gtfB, mRNA gtfC, dan housekeeping
gene (mRNA 16S rRNA)
mRNA Sekuens Primer (5’-3’)
Forward Reverse
gtfB AGCAATGCAGCCAATCTACAAAT ACGAACTTTGCCGTTATTGTCA
gtfC GGTTTAACGTCAAAATTAGCTGTATTAGC CTCAACCAACCGCCACTGTT
16S Rrna CCGCCTAAGGTGGGATAGATGATT ACCTTCCGATACGGCTACCTTGTTAC
Sumber: Shemesh et al. (2007).
Selanjutnya dilakukan amplifikasi di dalam PCR dengan program awal sebagai berikut. Periode denaturasi pada suhu 95°C selama 10 menit, diikuti 40 siklus amplifikasi masing-masing pada suhu 95°C selama 15 detik dan annealing pada suhu 60°C selama 1 menit, dilanjutkan proses melting dengan menaikkan suhu kembali 95°C selama 15 detik lalu suhu diturunkan kembali hingga 60°C, ditahan selama 1 menit, lalu suhu dinaikkan kembali hingga 95°C selama 15 detik. Selama proses analisis dengan RT-PCR berlangsung, dilakukan pengamatan terhadap nilai Ct
Dalam penelitian ini, mRNA gtfB dan gtfC merupakan mRNA target dan mRNA16S Rrna S. mutans sebagai standar internal (mRNA referensi). Level