i
POTENSI OOSIT BERDASARKAN STATUS AKTIVITAS
OVARIUM UNTUK MENCAPAI TINGKAT KEMATANGAN
SECARA IN VITRO PADA SAPI BALI
SKRIPSI
ANDI MUTMAINNA I 11110901
PROGRAM STUDI PRODUKSI TERNAK JURUSAN PRODUKSI TERNAK
FAKULTAS PETERNAKAN UNIVERSITAS HASANUDDIN
MAKASSAR 2014
ii
POTENSI OOSIT BERDASARKAN STATUS
AKTIVITAS OVARIUM UNTUK MENCAPAI TINGKAT
KEMATANGAN SECARA IN VITRO PADA SAPI BALI
Oleh:
ANDI MUTMAINNA I 111 10 901
Sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana pada Fakultas Peternakan Universitas Hasanuddin
PROGRAM STUDI PRODUKSI TERNAK JURUSAN PRODUKSI TERNAK
FAKULTAS PETERNAKAN UNIVERSITAS HASANUDDIN
MAKASSAR 2014 SKRIPSI
iii
PERNYATAAN KEASLIAN
1. Yang bertanda tangan dibawah ini:
Nama : Andi Mutmainna
NIM : I 111 10 901
Menyatakan dengan sebenarnya bahwa: a. Karya skripsi yang saya tulis adalah asli
b. Apabila sebagian atau seluruhnya dari karya skripsi, terutama dalam Bab Hasil dan Pembahasan tidak asli atau plagiasi maka bersedia dibatalkan atau dikenakan sanksi akademik yang berlaku.
2. Demikian pernyataan keaslian ini dibuat untuk dapat dipergunakan sepenuhnya.
Makassar, Mei 2014 TTD
iv
HALAMAN PENGESAHAN
Judul Penelitian : Potensi Oosit Berdasarkan Status Aktivitas Ovarium Untuk Mencapai Tingkat Kematangan Secara In Vitro Pada Sapi Bali
Nama : Andi Mutmainna No. Pokok : I 111 10 901 Program Studi : Produksi Ternak Jurusan : Produksi Ternak Fakultas : Peternakan
Skripsi ini telah diperiksa dan disetujui oleh:
Pembimbing Utama
Prof.Dr.Ir. Herry Sonjaya, DEA, DES NIP. 19572901 198003 1 001
Pembimbing Anggota
Dr. Muhammad Yusuf, S.Pt Nip. 19700725 199903 1 001 Dekan Fakultas Peternakan
Prof. Dr. Ir. Syamsuddin Hasan, M.Sc NIP. 19520923 197903 1 002
Ketua Jurusan Produksi Ternak
Prof. Dr. Ir. Sudirman Baco, M. Sc NIP. 19641231 198903 1 025
v
ABSTRAK
Andi Mutmainna (I 111 10 901), Potensi oosit berdasarkan status aktivitas ovarium untuk mencapai tingkat kematangan secara in vitro pada sapi Bali. Dibawah bimbingan
Herry Sonjaya Sebagai Pembimbing Utama dan Muhammad Yusuf Sebagai Pembimbing Anggota.
Ovarium sapi betina yang dipotong di RPH dalam kondisi fisiologis yang berbeda-beda, seperti fase luteal, fase folikuler, dan belum siklus, namun pengaruhnya terhadap tingkat kematangan secara in vitro belum diketahui. Oleh karena itu penelitian ini bertujuan untuk melihat sejauh mana pengaruh perbedaan aktivitas ovarium terhadap potensi oosit sapi Bali dalam mencapai tingkat kematangan secara in vitro. Penelitian ini menggunakan Rancangan Acak Lengkap (RAL) dengan 3 status fisiologis reproduksi yang berbeda (fase luteal, fase folikuler, dan belum siklus) dengan masing-masing 4 ulangan. Koleksi oosit dilakukan dengan menyayat folikel yang terdapat pada permukaan ovarium. Pematangan oosit dilakukan dalam medium maturasi pada inkubator CO2 5% dengan temperatur 38,5oC. Sel-sel kumulus oosit dihilangkan, kemudian difiksasi, dan selanjutnya dilakukan pengamatan dibawah mikroskop. Hasil penelitian menunjukkan bahwa struktur populasi oosit kualitas A (sel kumulus yang kompak dan sitoplasma tebal) pada fase folikuler dan fase luteal adalah sama, tetapi kedua fase tersebut berbeda nyata lebih tinggi dibandingkan fase belum siklus. Persentase kematangan oosit M-II nyata (P0.05) lebih rendah pada fase belum siklus dibanding dengan fase luteal dan fase folikuler, sedangkan tahap GV, GVBD dan MI sama untuk ketiga perlakuan. Penelitian ini menyimpulkan bahwa struktur populasi kualitas oosit berkaitan erat dengan status ovarium dengan tingkat persentase kematangan oosit M-II lebih tinggi pada fase luteal dan fase folikuler.
vi
ABSTRACT
Andi Mutmainna (I11110901). The potential of oocytes based on the status of ovarian activity to achieve the level of in vitro maturation in Bali cattle. Under Herry Sonjaya as main supervisor and Muhammad Yusuf as co-supervisor.
The ovaries of slaughtered cows at the abattoir are having different physiological conditions, such as luteal phase, follicular phase, and acyclic, however, their effects on the level of oocytes in vitro maturation are still unknown. Therefore, this study aimed to examine the effect of different ovarian activities on the potential of Bali cattle oocytes in reaching a level of in vitro maturation. This study was arranged using a completely randomized design (CRD) with 3 different physiological reproductive statuses (luteal phase, follicular phase, and acyclic) with 4 replications. Oocytes collections were performed by slicing the follicles on the surface of ovary. The oocytes were cultured in the maturation medium in the incubator 5% of CO2, with temperature of 38.5 oC.The cumulus cells of oocytes were removed, fixated, and then observed under the microscope. The results showed that the structure population of oocyte quality A (Compact cumulus cells and cytoplasm thick) in the follicular phase and the luteal phase were relatively similar, but they were significantly (P0.05) higher than in acyclic one. The percentage of oocytes maturation in stage M-II were significantly (P <0.05) lower than in acyclic one in comparison to luteal phase and follicular phase, whereas the oocytes maturation in stage GV, GVBD and MI were relatively similar for all treatments. This study concluded that the structure population of oocytes quality was related to the ovarian activities that the percentage of oocytes maturation in stage M-II were showing higher in both the follicular phase and luteal phase.
vii
KATA PENGANTAR
Puji syukur kita panjatkan kehadirat Allah SWT, karena rahmat dan hidayah-Nya sehingga Tugas Akhir / Skripsi ini dapat terselesaikan. Skripsi dengan judul ” Potensi Oosit Berdasarkan Status Aktivitas Ovarium untuk Mencaai Tingkat Kematangan Secara In Vitro pada Sapi Bali”. Sebagai salah satu syarat untuk memperoleh gelar sarjana pada Fakultas Peternakan Universitas Hasanuddin, Makassar.
Pada kesempatan ini penulis menghantur ucapan terima kasih dan penghargaan setinggi-tingginya dengan penuh rasa hormat kepada:
1. Pada kedua orang tua tercinta, ayahanda H. Bachtiar dan ibunda Hj. Andi Ansa Page Makkaraka, serta saudara- saudari Hj. Andi Hidayah S.Sos, Andi Muhar ST., Andi Safri S.Fil., M.Fil., Andi Asma S.Pd., M.Pd., Andi Muhajirah S.Pd, Andi Mudassir, dan Andi Arya Nugraha, yang terus mendidik dan mendukung baik materil maupun moril, dan atas segala limpahan doa, kasih sayang, kesabaran, pengorbanan, dan segala bentuk motivasi yang telah diberikan tanpa henti kepada penulis.
2. Secara khusus penulis mengucapkan banyak terima kasih yang sebesar- besarnya kepada Prof. Dr. Ir. H. Herry Sonjaya, DEA, DES selaku Pembimbing Utama dan Dr. Muhammad Yusuf, S.Pt selaku Pembimbing Anggota, atas segala bantuan dan keikhlasannya untuk memberikan bimbingan, nasehat dan saran sejak awal penelitian sampai selesainya penulisan skripsi ini.
viii 3. Secara khusus penulis mengucapkan banyak terima kasih yang sebesar- besarnya kepada bapak Hasbi, S.Pt, M.Si dan ibu Sri Gustina, S.Pt, M.Si yang telah mengajarkan teknik mengkultur oosit sapi Bali secara in vitro dan membantu kami dalam penelitian ini.
4. DIKTI (Direktorat Jendral Pendidikan Tinggi) yang telah memberikan BIDIK MISI selaku Lembaga yang memberikan beasiswa yang menunjang dalam proses perkuliahan.
5. LIPI (Lembaga Ilmu Pengetahuan Indonesia) selaku Lembaga yang memberikan bantu baik alat maupun bahan yang menunjang dalam penelitian ini.
6. Laboratorium Terpadu PKP (Pusat kegiatan Penelitian) Universitas Hasanuddin yang telah digunakan dalam proses pelaksanaan dalam penelitian ini yang sangat menunjang dalam penelitian ini.
7. Bapak Direktur Rumah Pemotongan Hewan (RPH) Tamangapa, Makassar, terkhusus kepada Pak Syarir dan para pegawai RPH yang telah membantu kami untuk mendapatkan bahan utama yaitu Ovarium Sapi Bali sehingga proses penelitian ini selasai.
8. Muhammad Hatta S.Pt, M.Si selaku Penasehat Akademik penulis yang telah bersedia meluangkan waktunya selama penulis duduk dibangku perkuliahan dan senantiasa memberikan motivasi dan nasehat yang sangat berarti bagi penulis.
ix 9. Prof. Dr. Ir. Syamsuddin Hasan, M. Sc selaku Dekan Fakultas Peternakan Universitas Hasanuddin, dan Bapak wakil Dekan I, II, III, yang telah menyediakan fasilitas kepada penulis selama menjadi mahasiswa.
10.Prof. Dr. Ir. H. Sudirman Baco, M. Sc selaku Ketua Jurusan Produksi Ternak beserta seluruh dosen dan staf Jurusan Produksi Ternak atas segala bantuan kepada penulis selama menjadi mahasiswa.
11.Semua Dosen-Dosen Fakultas Peternakan Universitas Hasanuddin yang telah memberi ilmunya kepada penulis.
12.Tidak lupa penulis mengucapkan terima kasih kepada rekan-rekan sepenelitian Rahmi Syamsuddin, Andi Fausiah dan Ahmad Mujahid yang telah mencurahkan segenap tenaga dan perhatiannya, sekali lagi terima kasih banyak yang sebesar-besarnya.
13.kepada sahabat-sahabatku yang terbaik Andi Tenri B.M, Nurmiati, Andi Fausiah, Rahmi Syamsuddin, Wheny Dwi N, Dyan Anjanna Putri, dan terkhusus Keluarga besar Angkatan 2010 “L10N” yang telah membantu baik material maupun moril.
14.kepada Teman-teman Asisten Laboratorium Anatomi ternak potong dan kerja, Samsu Alam Rab, Ahmad David, Dyan Anjanna Putri, Darussalam,Abdi Eriansyah, St. Nur Ramadhani, Andi Nurul Ainun yang telah membantu baik material maupun moril dan memotivasi.
15.Serta tak lupa pula menghanturkan banyak terima kasih kepada teman-teman MATADOR dan SITUASI 2010, dan kepada para senior terutama RUMPUT
x 07, BAKTERI 08, MERPATI 09, dan Semua pihak yang tidak dapat penulis sebut satu persatu, terima kasih atas bantuannya.
Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan tapi penulis membuka diri terhadap kritik dan saran yang membangun demi kesempurnaan skripsi ini dan demi kemajuan ilmu pengetahuan nantinya. Akhir kata, semoga skripsi ini dapat bermanfaat bagi kita semua terutama bagi diri penulis sendiri. Amin.
Makassar, Mei 2014
xi
DAFTAR ISI
Halaman
HALAMAN SAMPUL ... i
HALAMAN JUDUL ... ii
PERNYATAAN KEASLIAN ... iii
HALAMAN PENGESAHAN ... iv
ABSTRAK ... v
ABSTRACT ... vi
KATA PENGANTAR ... vi
DAFTAR ISI ... xi
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... xiv
PENDAHULUAN ... 1
TINJAUAN PUSTAKA Status Aktivitas Ovarium Selama Siklus Berahi ... 3
Perkembangan Folikulogenesis Dan Oogenesis Berdasarkan Status Ovarium ... 4
Tingkat Kematangan Oosit Secara In Vitro ... 8
BAHAN DAN METODE PENELITIAN Waktu & Tempat Penelitian ... 13
Bahan dan Alat Penelitian ... 13
Metode Penelitian ... 14
xii HASIL DAN PEMBAHASAN
Tingkat Potensi Oosit untuk mencapai tingkat kematangan secara
in vitro ... 20
Tingkat Kematangan Oosit Berdasarkan Status Ovarium ... 22
KESIMPULAN DAN SARAN Kesimpulan ... 24
Saran ... 24
DAFTAR PUSTAKA ... 25
LAMPIRAN ... 29
xiii
DAFTAR TABEL
No. Halaman
Teks
1. Tingkat Rata-rata Kematngan Oosit Berdasarkan Aktivitas
xiv
DAFTAR GAMBAR
No. Halaman
Teks
1. Profil Hormonal Dan Aktivitas Ovarium pada Sapi Betina Selama
Satu Siklus Berahi ... 5 2. Tingkat Kualitas Potensi Oosit untuk Mencapai Tingkat Kematangan
Secara In Vitro ... 17 3. Tingkat Kematangan Inti Oosit ... 18 4. Histogram Rata-Rata Struktur Populasi Potensi Oosit Berdasarkan
xv
DAFTAR LAMPIRAN
No. Halaman
Teks
1. Tingkat Potensi Oosit Berdasarkan Aktivitas Ovarium ... 29 2. Tingkat Pematangan Inti Oosit untuk Mencapai Tingkat Kematangan
Secara In Vitro ... 30 3. Tingkat Rata-rata Potensi Oosit berdasarkan aktivitas Ovarium... 31 4. Tingkat Rata-rata Kematangan Oosit berdasarkan aktivitas Ovarium .... 32 5. Uji Chi-Square Tingkat Struktur Kualitas Oosit Berdasarkan
Aktivitas Ovarium ... 33 6. Tingkat kematangan Oosit dengan menggunakan Rancangan Acak
Lengkap (RAL) Analysis of variance ... 36 7. Dekumentasi Tahap-tahap Penelitian ... 41
1
PENDAHULUAN
Sapi Bali merupakan sapi pedaging asli Indonesia dan merupakan hasil domestikasi dari Banteng (Bos-bibos banteng) (Hardjosubroto, 1994), dan sapi asli Pulau Bali (Payne dan Rollinson, 1973). Sapi Bali menjadi primadona sapi pedaging di Indonesia karena mempunyai kemampuan reproduksi tinggi, serta dapat digunakan sebagai ternak kerja di sawah dan ladang (Putu, dkk, 1998), persentase karkas tinggi, daging tanpa lemak, heterosis positif tinggi pada persilangan (Pane, 1990), daya adaptasi yang tinggi terhadap lingkungan dan persentase kelahiran dapat mencapai 80 persen (Tanari, 2001).
Salah satu cara yang dapat dilakukan untuk meningkatkan produktivitasnya adalah melalui penerapan bioteknologi reproduksi, dengan kemajuan bioteknologi di bidang reproduksi melalui pemanfaatan ovarium di Rumah Potong Hewan (RPH), sebagai sumber sel gamet betina (oosit) melalui suatu bioteknologi dapat dijadikan suatu produk yang sangat berharga berupa produksi embrio ternak secara in vitro. Produksi embrio yang perlu diperhatikan secara in vitro adalah sistem yang dipakai. Sistem yang digunakan akhir-akhir ini telah dipermudah dengan tersedianya bahan-bahan kimia secara komersial (Spalding, et al., 1955)
Ovarium mampu menyediakan oosit dalam jumlah banyak, sehingga menjadi alternatif untuk memproduksi embrio secara in vitro. Oosit yang digunakan untuk memproduksi embrio in vitro harus dimatangkan terlebih dahulu. Maturasi in vitro merupakan pematangan oosit di dalam suatu media atau diluar
2 tubuh tetapi dapat menghasilkan embrio baru seperti pematangan di dalam tubuh (In vivo) (Frandson, 1996).
Materi untuk proses pematangan oosit biasanya berasal dari ovarium sapi betina yang dipotong di RPH Tamangapa Makassar. Sapi-sapi tersebut pada saat dipotong dalam kondisi fisiologis (aktivitas ovarium) yang berbeda-beda, ada yang dalam kondisi fase luteal, fase folikuler, bahkan ada yang belum siklus (pra puberitas atau post partum anestrus). Kondisi ini akan mempengaruhi populasi folikel dalam ovarium pada sapi betina yang dipotong termasuk oosit yang ada didalam folikel tersebut (Parker, et al., 2002). Oleh karena itu penelitian ini bertujuan untuk melihat sampai sejauh mana pengaruh perbedaan aktivitas ovarium, terhadap potensi oosit sapi Bali dalam mencapai tingkat kematangan secara in vitro dan diharapkan penelitian ini berguna untuk memberikan informasi kepada peneliti tentang pematangan oosit secara in vitro dalam mendukung produksi embrio.
3
TINJAUAN PUSTAKA
Status Aktivitas Ovarium Selama Siklus Berahi
Estrus yang dikenal dengan istilah berahi yaitu suatu periode secara psikologis maupun fisiologis pada hewan betina yang bersedia menerima pejantan untuk kopulasi. Siklus estrus dibagi menjadi beberapa fase yang dapat dibedakan dengan jelas yang disebut fase luteal dan fase folikuler (Frandson, 1996).
Fase folikular dimulai dengan penghilangan efek negatif dari progesteron sehingga konsentrasi GnRH kembali meningkat. Peningkatan konsentrasi GnRH akan menyebabkan peningkatan produksi FSH dan LH sehingga dapat mendukung pertumbuhan folikel. Folikel de Graaf akan menghasilkan lebih banyak estrogen. Jika estrogen telah mencapai batas ambang maksimal, maka akan memicu pengeluaran LH sehingga terjadilah ovulasi. Setelah terjadi ovulasi maka folikel yang pre-ovulasi akan muncul korpus luteum, pada fase luteal konsentrasi LH tidak dapat mencapai batas ambang maksimal, sehingga folikel dominan akan mengalami regresi dan penurunan sekresi estradiol dan inhibin menyebabkan terbentuknya gelombang folikel baru. Folikel dominan yang mengandung estradiol dan inhibin dengan konsentrasi tinggi berhubungan dengan penekanan konsentrasi FSH dalam sirkulasi darah (Parker, et al., 2002; Adams, et al., 1992).
Fase luteal terdapatnya CL (Corpus Luteum) yang menghasilkan progesteron yang dapat menghambat pertumbuhan folikel dominan mencapai ovulasi sehingga akan mengurangi pengaruh negatif dari inhibin dan estradiol
4 yang dihasilkan oleh folikel dominan dalam menghambat pertumbuhan folikel subordinat. Sehingga hal tersebut menyebabkan jumlah folikel subordinat yang tumbuh menjadi lebih banyak pada pasangan ovarium yang memiliki CL (Corpus Luteum) daripada ovarium yang memiliki FD (Folikel Dominan) (Boediono, et al., 1995) .
Perkembangan Folikulogenesis dan Oogenesis Berdasarkan status Ovarium
Proses pertumbuhan folikel, ovulasi dan pembentukan CL sangat dipengaruhi oleh sirkulasi hormon reproduksi dalam tubuh. Gonadotrophin releasing hormone (GnRH) yang dihasilkan oleh hypothalamus berfungsi menstimulasi pengeluaran folicle stimulating hormone (FSH) dan luteinizing hormone (LH) oleh hipofisa anterior sebagai respons terhadap estrogen atau progesteron. Ketika proses pertumbuhan folikel kecil (Recruitment) berlangsung, mRNA meningkat. Pada saat seleksi morfologis, folikel dominan mengandung estrogen dengan konsentrasi tinggi dalam cairan folikel dan segera setelah proses seleksi berakhir, maka folikel dominan banyak mengandung mRNA untuk
reseptor gonadotrophin dan hormon steroid (Fortune, et al., 2001).
Perkembangan folikel pada sapi dan domba ditandai dengan adanya gelombang pertumbuhan folikel. Satu gelombang didefinisikan sebagai suatu proses pertumbuhan folikel yang sinkron dari beberapa folikel kecil. Dari kelompok folikel kecil tersebut, salah satu diantaranya akan terseleksi dan tumbuh menjadi folikel dominan, sedangkan folikel lainnya akan terhenti pertumbuhannya dan menuju atresi. Setelah mencapai ukuran maksimal, folikel dominan juga akan
5 mengalami atresi dan regresi. Perkembangan folikel pada sapi dan domba ditandai dengan adanya gelombang pertumbuhan folikel. Pada gelombang yang kedua folikel dominannya akan menjadi folikel ovulatory sedangkan folikel dominan dari gelombang ketiga akan mengalami ovulasi (Rasby dan Vinton, 2001).
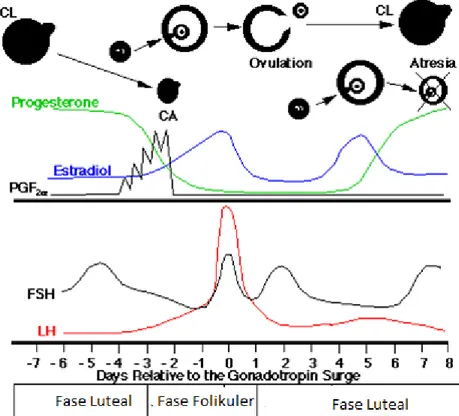
Gambar 1. Profil hormonal dan aktivitas ovarium pada sapi betina selama satu siklus berahi ( Sonjaya, 2005).
Satu siklus estrus terdiri dari fase folikular dan fase luteal. Fase folikular ditandai dengan pertumbuhan dan perkembangan folikel ovarium yang berlangsung selama 3-4 hari. Pada domba, sebanyak satu atau dua folikel besar menghasilkan estrogen yang dapat menekan pertumbuhan folikel kecil lainnya (Hafez 2000). Fase luteal berlangsung selama kurang lebih 13 hari dan ditandai dengan pematangan corpus luteum yang menghasilkan progesteron dengan konsentrasi yang mencapai puncak pada hari ke-6 setelah ovulasi. Selama periode
6 siklus estrus tidak ada perbedaan nyata antara jumlah folikel yang terdapat pada ovarium kiri dan kanan (Gordon 1997). Pada fase folikuler prostaglandin dihasilkan oleh endometrium uterus, sehingga corpus luteum lisis dan hormon progesteron (P4) menurun (Gambar 1), turunnya P4 menyebabkan kontrol umpan balik negatif terhadap hipotalamus dan hipofisa anterior tidak ada, sehingga hipotalamus mensekresikan GnRH dan hipofisa anterior mensekresikan FSH dan LH, tingginya sekersi FSH dan LH merangsang pertumbuhan folikel yang berdampak meningktanya hormon estrogen yang diproduksi oleh folikel. Folikel terus berkembang menjadi folikel antrum dan preovulasi sehingga estradiol mencapai level tertinggi dan menyebabkan kontrol umpan balik positif terhadap hipotalamus dan hipofisa sehingga level FSH dan LH mencapai puncaknya dan menyebabkan folikel preovulasi pecah dan terjadinya pelepasan oosit dari ovarium ke saluran alat reproduksi betina (prosesnya disebut ovulasi). Setelah ovulasi folikel yang pecah menjadi copus haemoragikum terus menjadi korpus luteum yang menghasilkan hormon Progesteron selama fase luteal. Fase luteal dimulai hari ke 5 s/d hari ke 18 setelah ovulasi dan selama fase ini P4 tinggi, folikel banyak yang atresi, hormon gonadotropin (FSH dan LH) rendah (Sonjaya, 2005).
Inhibin memperlihatkan pengaruh terhadap sirkulasi FSH selama tahap awal fase luteal. Inhibin dan estradiol mengkontrol pengeluaran FSH selama gelombang folikular pertama. Sekresi FSH tidak dipengaruhi oleh progesteron melainkan oleh estradiol dan inhibin yang diproduksi oleh folikel selama periode iklus (Souza, et al., 1998).
7 Oogenesis adalah suatu proses pembentukan, pertumbuhan dan pematangan dari gamet betina. Dimulai sejak embrional sampai setelah dilahirkan dan mencapai puncakya pada saat ovulasi (Austin dan short, 1982).
Proses pembentukan sel kelamin betina terdiri dari dua tahap. Tahap yang pertama adalah periode proliferasi yang terjadi pada saat prenatal sampai sebelum atau sesaat setelah fetus dilahirkan. Selama itu proses yang terjadi adalah sel benih primordial mengalami deferensiasi menjadi oogenia dan mengalami pembelahan mitosis. Beberapa oogenia akan terus bermitosis dan berdiferensiasi menjadi oosit primer. Oosit primer dengan inti pada tahap profase I dan dikelilingi sel epitel disebut folikel primordial (Hafez, 2000). Menjelang lahir semua inti oosit primer telah selesai membelah dan tertahan pada profase I tahap diploten. Inti oosit pada tahap ini dicirikan dengan adanya membrane inti yang utuh dan nucleolus yang jelas disebut germinal vesicle (GV) (Van den Hurk, et al., 1997).
Pertumbuhan oosit terbagi dua fase. Fase I oosit tumbuh cepat dan erat hubungannya dengan perkembangan folikel ovari. Pada folikel primordial aktivitas proliferasi sel epitel pipih yang mengelilingi sel telur akan dimulai dengan membentuk satu lapis sel kuboid yang mengelilingi sel telur dan disebut folikel primer. Sel kuboid akan terus berproliferasi membentuk multilayer sel granulosa yang akan mengelilingi sel telur dan tahap ini disebut dengan folikel sekunder. Proliferasi akan terus berlanjut hingga folikel membentuk antrum folikuli yang disebut folikel tersier (Van den Hurk et al., 1997). Folikel tersier akan dikelilingi oleh sel teka internal dan eksternal yang menghasilkan estrogen. Antrum folikuli akan bertambah besar seiring dengan perkembangan sel folikel
8 tersier. Pertumbuhan folikel selanjutnya akan tergantung pada hormon gonadotropin untuk mencapai folikel de graaf yang diakhiri dengan proses ovulasi. Bertambah besar diameter folikel ovari merupakan ciri dari fase II. Pertumbuhan folikel dalam ovarium dipengaruhi oleh hormon gonadotropin serta sekresi hormon dari sel granulosa dan sel teka (Hafez, 2000).
Tingkat Kematangan Oosit Secara In Vitro
Pematangan oosit diluar ovarium atau tubuh hewan disebut dengan pematangan in vitro atau In Vitro Maturation (IVM). Pematangan in vitro
merupakan salah satu tahap yang penting dari rangkaian produksi embrio in vitro.
Oosit untuk memroduksi embrio in vitro yang diperoleh dari ovarium hewan betina yang masih hidup maupun betina mati dari Rumah Potong Hewan (RPH) dengan tanpa memperhatikan fase siklus birahi (Ball, et al., 1984).
Maturasi oosit secara in vitro adalah pemasakan oosit muda atau pengaktifan oosit muda dalam medium diluar tubuh (Prochaska, et al., 1993). Keberhasilan pembuahan secara in vitro didukung oleh proses maturasi oosit in vitro yang baik (Down, 1993). Shamsuddin et al (1993) menyatakan bahwa maturasi oosit in vitro dimaksudkan agar oosit primer dapat berkembang menjadi oosit sekunder yang akan melakukan proses pembelahan meiosis dengan normal dan sempurna sehingga menghasilkan sel telur yang siap untuk dibuahi.
Oosit akan mengalami proses maturasi secara spontan dengan adanya media yang sesuai (Hafez, 2000). Proses pematangan oosit memerlukan medium yang berfungsi sebagai tempat penyediaan nutrisi dan sekaligus tempat pembuangan metabolit. Zat nutrisi yang diperlukan harus selektif dan mempunyai
9 konsentrasi yang sesuai, serta memiliki pH, susunan gas dan osmolaritas larutan fisiologis (Supriatna dan Pasaribu, 1992). pH harus dijaga tetap sekitar 7,2 dan 7,4, sedangkan osmolaritas ialah ukuran konsentrasi partikel terlarut dalam suatu larutan (osm/L).
Selama maturasi oosit sapi, struktur kromatin dalam oosit yang belum matang (Immature) berupa membran nukleus utuh (GV) dimulai dari pembelahan meiosis pertama dilanjutkan dengan pembelahan meiosis kedua, menurut Lu et al
(1988) menunjukkan bahwa 90% dari oosit sapi mengalami pematangan pada 24 jam setelah dilakukan kultur. Membran nukleus menghilang setelah 5-6 jam GVBD dan M-I dicapai setelah 12 jam dan M-II dicapai setelah 19 jam dan diperkirakan pematangan inti tersebut lebih cepat in vitro daripada in vivo
(Gordon, 1997).
Pada proses pematangan sel telur secara in vitro dipengaruhi oleh beberapa faktor diantaranya medium pematangan dan lingkungan penyimpanan (Incubator). Medium standar untuk pematangan in vitro sel telur sapi adalah TCM-199. Agar menunjang keberhasilan proses maturasi in vitro dilakukan inovasi komposisi dan penambahan suplemen untuk mendapatkan kondisi medium yang optimsl. Suplemen seperti serum, hormon estradiol, hormon gonadotropin (FSH dan LH), mineral, glukosa, piruvat dan asam amino ditambahkan untuk membantu transformasi inti (Sirard dan Blondin 1996).
Menurut Sirard dan Blondin (1996), lima faktor yang sangat berkompeten dalam keberhasilan pematangan oosit adalah morfologi cumulus, ukuran folikel, kesehatan folikel, stimulasi ovarium dan prosedur pematangan oosit sebelum
10 dimulainya inkubasi. Laju proses maturasi oosit sapi, domba dan babi relatif lambat karena membutuhkan waktu untuk sintesa protein aktif untuk persiapan pemulaan meiosis. Pada sapi proses maturasi inti secara in vivo membutuhkan waktu kurang lebih 24 jam. Selama maturasi, inti oosit sapi yang masuk tahap profase pada awal meiosis I mengalami pengurangan kompemen kromosom menjadi haploid (n=30 kromosom). Pada tahap molekuler, di dalam oosit mengalami banyak interaksi antara siklus molekuler dengan substrat target pada inti dan sitoplasma.
Penilaian terhadap kualitas oosit sebagai salah satu upaya melakukan seleksi terhadap oosit yang akan dimaturasi sangat mempengaruhi keberhasilan produksi embrio in vitro. Morfologi oosit berdasarkan kekompakan dan jumlah lapisan sel kumulus berakibat positif terhadap maturasi, fertilisasi dan pertumbuhan serta perkembangan embrio in vitro (De Wit, et al., 2000; Bilodeau- Goeseels dan Panich, 2002). Tidak satu pun oosit yang gundul mampu mencapai embrio tahap 8-16 sel (Khurana dan Niemann, 2000).
Pematangan oosit meliputi pematangan sitoplasma dan inti (Rahman et al.,
2001) yang merupakan proses yang sangat penting dalam mendukung keberhasilan fertilisasi dan perkembangan embrio selanjutnya. Proses pematangan inti yang berhubungan dengan aktivitas sintesis RNA, ditandai dengan perubahan inti dari fase diploten ke metafase II. Membran inti akan mengadakan penyatuan dengan vesikel membentuk Germinal Vesicle (GV) dan kemudian akan mengalami pelepasan membran inti Germinal Vesicle Break Down (GVBD). Setelah GVBD terbentuk, kromosom dibungkus oleh mikrotubulus dan
11 mikrofilamen yang sangat mempengaruhi keberhasilan pembelahan meiosis. Seiring dengan proses tersebut maka kebutuhan oksigen oosit akan meningkat. Oosit yang telah mengalami GVBD selanjutnya akan mencapai tahap metafase I. Metafase I (M-I) terjadi setelah 12-14 jam inkubasi dan diikuti oleh tahap anafase (A-I) dan telofase (T-I) yang berlangsung relatif sangat rendah dan berbeda nyata dengan kelompok lainnya. Hambatan terhadap perkembangan folikel yang dihasilkan oleh folikel dominan ternyata juga mempengaruhi kualitas oosit yang dihasilkan.
Faktor yang dapat mendukung keberhasilan tingkat pematangan inti oosit menurut Zheng and Sirard (1992) adalah terjadinya ekspansi sel-sel kumulus, pematangan inti yang mencapai M-II dan pematangan sitoplasma. Kualitas oosit juga dipengaruhi oleh suhu dan waktu penyimpanan ovarium sebelum dikoleksi. Umumnya oosit diambil dari ovarium dalam jangka waktu 1 sampai 2 jam setelah pemotongan, dengan suhu penyimpanan sekitar 30oC, karena penurunan suhu oosit yang diaspirasi dari folikel sampai jauh dibawah suhu fisiologik tubuh berpengaruh negatif pada viabilitas oosit, dalam bentuk abnormalitas pada semua fase meiosis. Hal ini didukung dengan penelitian Zhang et al (1990) yang menunjukkan bahwa ovarium yang dibawa pada suhu 0 sampai 2oC menghasilkan angka fertilisasi dan perkembangan embrio yang nyata lebih rendah dibandingkan dengan ovarium yang dibawa pada suhu 18 sampai 20 oC ataau 30 sampai 32 oC.
Hubungan yang sangat dekat antar sel-sel granulosa dan sel-sel kumulus disekitar oosit akan mengakibatkan pematangan oosit tertahan untuk tidak mengalami meiosis, apabila hubungan ini meregang oleh faktor-faktor
12 pematangan oosit atau sel-sel kumulus yang terekspansi, akan mengakibatkan gap junction dengan cepat menurun jumlahnya, sebagai akibat akses penghambatan berlangsungnya meiosis berkurang drastis. Oleh karenanya terjadi ekspansi sel-sel kumulus atau aktivasi sel-sel kumuluss, digunakan sebagai salah satu indikasi kematangan oosit (Pisastyani, 2003).
Peran sel kumulus setiap spesies berbeda, pada oosit tanpa sel-sel kumulus dapat berkembang sampai tingkat pematangan M-II dan dapat difertilisasi. Pematangan dapat dilakukan pada oosit yang gundul (tanpa sel-sel kumulus) asalkan keadaan sitoplasma tersebut masih bagus dan kompak (Cox, et al., 1993).
13
BAHAN DAN METODE PENELITIAN
Waktu dan Tempat Penelitian
Penelitian ini dilakukan di Laboratorium Terpadu, Di Gedung Pusat Kegiatan Penelitian (PKP), Universitas Hasanuddin pada bulan Desember 2013 sampai Januari 2014.
Bahan dan Alat Penelitian
Bahan yang digunakan adalah ovarium sapi Bali 120 buah yang diperoleh dari Rumah Potong Hewan (RPH) Tamangapa, Kota Makassar, Provinsi Sulawesi Selatan. Larutan 0,9% NaCl ,100 IU/ml penicillin , 100 µ/ml streptomycin sulfate, phosphate buffered saline (PBS; Gibco, Grand Island, NY, USA), Fetal Bovine Serum (FBS; Gibco, Grand Island, NY, USA) 10%, tissue culture medium (TCM) 199 (Sigma, USA), pregnant mare serum gonadotrophin (PMSG) (Intergonan, Intervet Deutschland GmbH), 10 IU/ml human chorionic gonadotrophin (hCG) (Chorulon, Intervet international B.V. Boxmeer-Holland) dan 50 µg/ml
gentamycin (Sigma, USA), mineral oil (Sigma Chemical Co. St. Louis MO, USA), enzim hyaluronidase (Sigma, USA) 0,25%, KCL 0.7%, parafin dan vaselin (1:9), ethanol dan asetat dengan perbandingan (3:1), ethanol absolute, aceto orcein 2%, asam asetat 25% larutan kutek bening.
Alat yang digunakan adalah Syringe, kaca arloji , petri dish, inkubator CO2 5%, temperature 38,5 oC, pipet, mikropipet, cawan petri, objek glass, kaca objek, dan mikroskop Axio Cam.
14 Metode Penelitian
a. Rancangan Penelitian
Penelitian menggunakan metode eksperimental laboratorium berdasarkan Rancangan Acak Lengkap (RAL) dengan 3 perlakuan dan 4 ulangan sehingga terdapat 12 perlakuan dengan susunan sebagai berikut :
T1 : Tingkat kematangan oosit pada belum siklus T2 : Tingkat kematangan oosit pada fase folikuler T3 : Tingkat kematangan oosit pada fase luteal
b. Prosedur Penelitian
Kegiatan meliputi 3 tahap kegiatan, yaitu koleksi oosit, pematangan oosit In Vitro, dan Evaluasi tingkat pematangan inti oosit.
1. Koleksi oosit
Ovarium sapi segar dikumpulkan di rumah potong hewan dan dibawa ke laboratorium dengan larutan 0,9% NaCl ditambah 100 IU/ml penicillin dan 100 µ/ml streptomycin sulfate. Koleksi oosit dilakukan dengan menyayat/mencacah
(Slicing) folikel yang ada di permukaan ovarium sehingga cairan folikel keluar. Selanjutnya dilakukan pembilasan (Flushing) dengan penyemprotan NaCl 0,9% menggunakann syringe ke dalam folikel bekas sayatan diharapkan oosit juga ikut keluar. Selanjutnya oosit diseleksi menggunakan mikroskop (hanya oosit dengan keadaan sitoplasma yang homogen dan dikelilingi ≥ 3 lapis sel kumulus yang digunakan) dan ditampung dalam petri dish yang berisi media phosphate buffered saline (PBS; Gibco, Grand Island, NY, USA) yang disuplementasi dengan Fetal
15
Bovine Serum (FBS; Gibco, Grand Island, NY, USA) 10%. Oosit hasil koleksi dicuci dalam medium koleksi yang terdiri atas PBS ditambah 10% FBS dan medium maturasi masing-masing dua kali pencucian, selanjutnya dilakukan maturasi dalam tissue culture medium (TCM) 199 (Sigma, USA) ditambahkan FBS 10%, 10 IU/ml pregnant mare serum gonadotrophin (PMSG) (Intergonan, Intervet Deutschland GmbH), 10 IU/ml human chorionic gonadotrophin (hCG) (Chorulon, Intervet international B.V. Boxmeer-Holland) dan 50 µg/ml
gentamycin (Sigma, USA).
2. Pematangan Oosit In Vitro
Oosit yang diseleksi dan telah melalui dua kali pencucian dengan beberapa media, pematangan oosit dilakukan dalam medium maturasi yang telah diequilibrasi dengan membuat empat tetesan (drop) , (50 µL/drop) pada petri dish
dan ditutup dengan mineral oil (Sigma Chemical Co. St. Louis MO, USA) selanjutnya dimasukkan ke dalam inkubator CO2 5%, temperature 38,5 oC selama 24 jam.
3. Evaluasi tingkat pematangan oosit
Oosit yang telah dimaturasi dibersihkan dari sel-sel kumulusnya
(denudase) dengan batuan enzim hyaluronidase (Sigma, USA) 0,25% dengan cara dipipet berulang-ulang menggunakan pipet berdiameter yang sesuai dengan ukuran oosit. Oosit yang telah bebas dari sel kumulusnya diletakkan pada drop
16 bantalan parafin dan vaselin (1:9) pada keempat sudutnya. Preparat oosit yang telah jadi, difiksasi pada ethanol dan asetat dengan perbandingan (3:1) selama 3-4 hari pada temperatur kamar. Setelah difiksasi preparat direndam terlebih dahulu dalam larutan ethanol absolute selama satu jam. Kemudian preparat dikeringkan menggunakan tissue sebelum diwarnai dengan aceto orcein 2% selama 5 menit. Kemudian zat pewarna dibersihkan dengan asam asetat 25% dan keempat sisi kaca penutup diberi larutan kuteks bening untuk selanjutnya dilakukan pengamatan dibawah mikroskop Axio Cam.
c. Parameter yang diamati
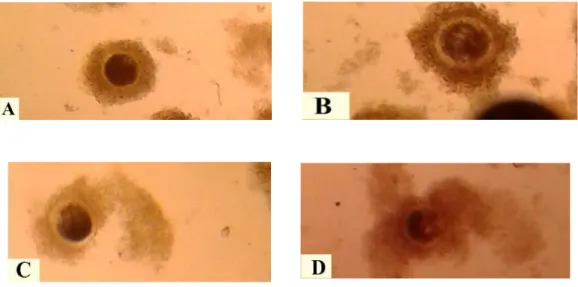
Pengamatan tingkat kualitas oosit dan pematangan oosit dilakukan dengan melihat kualitas oosit dan menghitung jumlah oosit, gambar kualitas oosit disajikan pada Gambar 2, kriteria disajikan sebagai berikut :
1. Kualitas A oosit yang dikelilingi oleh kumulus ooforus dan sel korona radiata kompak dan tebal
2. Kualitas B oosit yang dikelilingi oleh kumulus ooforus dan sel korona radiata yang kompak dan tidak tebal
3. Kualitas C oosit yang tidak dikelilingi kumulus ooforus dan sel korona radiate tidak kompak tapi tebal
4. Kualitas D oosit yang tidak dikelilingi kumulus ooforus dan sel korona radiate tidak kompak dan tidak tebal.
17
Gambar 2 Tingkat kualitas Potensi Oosit. A : Kualitas oosit kompak dan homogen, B: Kualitas oosit kompak dan tidak homogeny, C: Kualitas oosit yang tidak kompak tapi homogeny , D : Kualitas oosit yang tidak kompak dan homogeny.
Berdasarkan gambar 2 dapat dilihat jenis-jenis kualitas oositnya yang tentunya mempengaruhi tingkat pematangan oosit secara in vitro pada berbagai aktivitas ovarium. Bilodeau-Goeseels dan Panich (2002) menyatakan persentase tingkat pembelahan sel yang berasal dari oosit yang memiliki lebih dari lima lapis sel kumulus mencapai angka yang lebih tinggi dan berbeda nyata daripada tingkat pembelahan sel yang berasal dari oosit dengan lapisan sel kumulus kurang dari lima lapis, walaupun sitoplasmanya homogen.Untuk menghitung tingkat struktur populasi potensi kualitas oosit Dengan model matematika sebagai berikut :
Potensi Kualitas A (%)
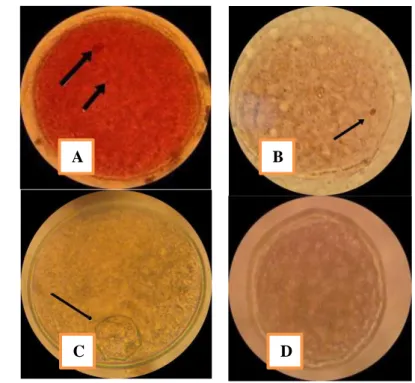
Pengamatan tingkat kematangan oosit disajikan pada gambar 3, kriteria tahap tingkat kematangan oosit disajikan sebagai berikut :
18 1. Fase Germinal Vesicle (GV) ditandai dengan adanya membrane
inti dan nukleolus terlihat dengan jelas ditepi
2. Fase Germinal Vesicle Breaking Down (GVBD) ditandai dengan robeknya membran inti sehingga nukleolus tidak terlihat jelas 3. Fase Metaphase–I (M-I) ditandai dengan adanya kromosom
homolog yang berpasangan dan berderet di bidang equator
4. dan pada fase Metaphase-II (M-II) ditandai adanya badan kutub I dan susunan kromosom yang sama dengan tahap M-I.
Untuk menghitung tingkat kematangan oosit dengan model matematika sebagai berikut :
Tingkat Kematangan (%)
061292Sengkang
Gambar 3. Tingkat Kematangan Inti Oosit, A: Metafase II, B: Metafase I, C:
Germinal Vesicle Break Dawn (GVBD), D: Germinal Vesicle (GV).
A B
19 Analisis Data
Data penelitian tingkat kematangan oosit menggunakan Rancangan Acak lengkap (RAL) dengan analysis of variance (ANOVA) terlebih dahulu ditransformasi dengan arsinx untuk memperoleh penyebaran data distribusi normal (Gaspersz, 1991), apabila terdapat perbedaan diantara perlakuan dilanjutkan dengan uji beda nyata terkecil (BNT) (Steel and Torrie 1981). Hubungan Tingkat Persentase struktur populasi dengan potensi oosit dianalisis menggunakan Uji Chi-Square. Data diolah menggunakan software SPSS 18.0 for windows. Dengan model matematika sebagai berikut :
Yij = µ + ᴛi + ɛi
i = 1,2,3 j = 1,2,3,4 Keterangan :
Yij = Hasil pengamatan dari tingkat pematangan oosit beberapa fase berdasarkan status ovarium ke-i dengan ulangan ke-j
µ = Rata-rata pengamatan
ᴛi = Pengaruh beberapa fase berdasarkan tingkat kematangan ovarium ke-i
20
HASIL DAN PEMBAHASAN
Tingkat Potensi Oosit untuk Mencapai Tingkat Kematangan Secara In Vitro
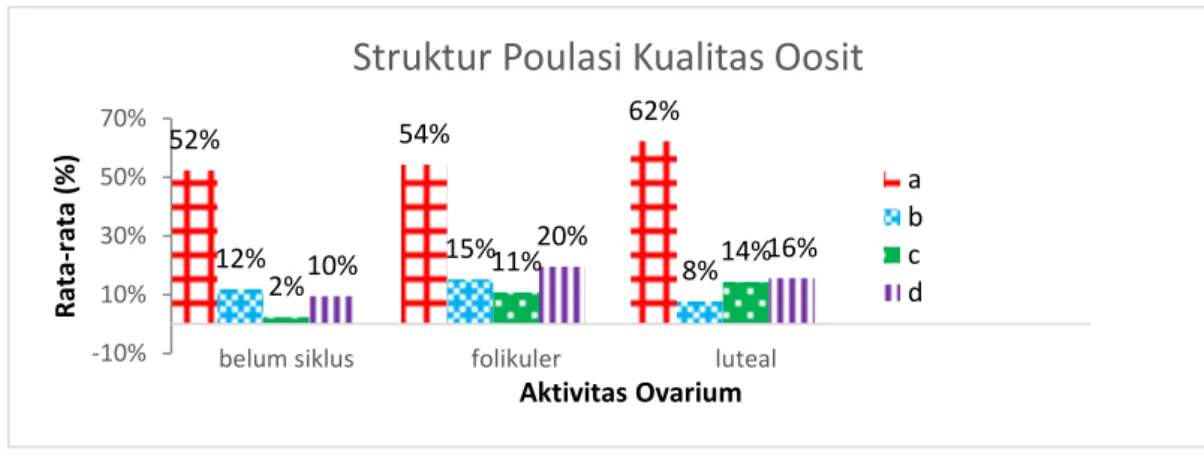
Hasil penelitian pada tingkat kualitas oosit dan struktur populasi oosit untuk mencapai tingkat kematangan oosit, disajikan pada gambar gambar 4.
Gambar 4. Histogram Rata-rata struktur populasi potensi oosit berdasarkan Aktivitas ovarium sapi Bali.
Keterangan : A. Oosit yang homogen dan kompak, B. Oosit yang homogen dan tidak Kompak, C. Oosit yang tidak homogen dan kompak, D. Tidak Kompak dan tidak homogen.
Gambar 4 menujukkan perbedaan struktur populasi dalam berbagai siklus status ovarium, distribusi populasi untuk fase folikuler dan luteal polanya sama sedangkan untuk belum siklus polanya berbeda. Berdasarkan hasil uji chi square (lampiran 3), menunjukkan adanya perbedaan distribusi populasi kualitas oosit antara ketiga kondisi aktivitas ovarium, struktur populasi kualitas oosit pada fase folikuler dan luteal tidak berbeda nyata (P0.05) sedangkan struktur populasi pada fase belum siklus berbeda nyata (P0.05) dibanding dengan fase folikuler dan luteal (Lampiran 3). Tidak berbedanya struktur populasi pada fase folikuler dan fase luteal disebabkan kondisi awal ovarium dengan tingkat pertumbuhan folikel
52% 54% 62% 12% 15% 8% 2% 11% 14% 10% 20% 16% -10% 10% 30% 50% 70%
belum siklus folikuler luteal
R ata -r ata (% ) Aktivitas Ovarium
Struktur Poulasi Kualitas Oosit
a b c d
21 pada fase folikuler dan fase luteal masih berkembang, sedangkan pada status aktivitas ovarium belum siklus pertumbuhan folikel sangat rendah dibandingkan dengan fase folikuler dan fase luteal. Hal ini diduga adanya perbedaan pada saat
in vivo antara status fisiologis ovarium aktif dan belum siklus, pada belum siklus adanya pengaruh hormononal yaitu poros hypothalamus-hipofisa-anterior belum berfungsi secara baik, kelenjar hipofisa anterior belum cukup mampu menghasilkan hormon gonadotropin sehingga ovarium juga belum mampu menghasilkan hormon estrogen (Ratnawati, et al., 2007)
Untuk kualitas oosit A (Oosit yang homogen dan kompak) relatif sama pada semua status aktivitas ovarium, sedangkan kualitas B (Oosit yang homogen dan tidak kompak), C (Oosit yang tidak homogen dan kompak), dan D (tidak kompak dan tidak homogen) lebih rendah pada belum siklus dibanding fase folikuler dan fase luteal. Hal ini disebabkan karena kondisi awal pada aktifitas ovarium berbeda. Fase luteal dengan adanya korpus luteum lebih banyak dan kualitas oosit yang lebih baik dibandingkan dengan ovarium tanpa korpus luteum. Keberadaan korpus luteum yang menghasilkan progesteron dalam sirkulasi tubuh akan menyebabkan hambatan pertumbuhan folikel dominan mencapai ovulasi sehingga dapat menekan pengaruh negatif folikel dominan terhadap pertumbuhan dan perkembangan folikel subordinat lainnya (Taylor dan Rajamahendran, 1991).
22 Tingkat Kematangan Oosit Berdasarkan status Ovarium
Hasil penelitian tingkat kematangan oosit, disajikan pada Tabel 1. Tabel 1. Tingkat Rata-rata Kematangan Oosit Berdasarkan Aktivitas Ovarium
Perlakuan Pematangan Inti (%)
GV GVBD MI MII
Belum Siklus 4.54±9.09 15.84±12.75 48.37±16.15 20.81±17.59a Fase Folikuler 0.00±0.00 0.00±0.00
46.73±2.43 53.26±2.43b Fase Luteal 1.38±2.78 8.61±13.59 29.26±11.96 60.73±23.67b Keterangan : Superskrip yang berbeda dalam kolom menunjukkan tidak berbeda
nyata (P>0.05).
Hasil analisis ragam menunjukkan perlakuan status ovarium berpengaruh nyata (P<0.05) terhadap tingkat kematangan oosit pada tahap M-II, tetapi tingkat kematangan pada tahap GV, GVBD, dan M-I perlakuan status aktivitas ovarium tidak berpengaruh nyata. Hasil analisis uji LSD tingkat kematangan M-II nyata lebih rendah (P<0.05) pada status belum siklus dbanding pada fase folikuler dan fase luteal (Tabel 1). Rendahnya tingkat kematangan oosit pada tahap MII pada perlakuan belum siklus disebabkan oleh kondisi awal aktivitas ovarium kurang aktif hal ini yang mempengaruhi tingkat maturasi oosit. Menurut Ratnawati et al
(2007), hal ini disebabkan karena pada fase belum siklus poros hypothalamus-hipofisa-anterior belum berfungsi secara baik, kelenjar hipofisa anterior belum cukup mampu menghasilkan hormon gonadotropin sehingga ovarium juga belum mampu menghasilkan hormon estrogen sebagai akibat belum terjadi pertumbuhan folikel dan oosit yang sempurna.
Tabel 1 menunjukkan pematangan inti pada perlakuan belum siklus dan fase luteal dimulai tingkat pematangan oosit pada GV, GVBD, MI dan MII, sedangkan fase folikuler dimulai tingkat pematangan oosit hanya pada MI dan
23 MII. Hal ini menunjukkan oleh tingkat pematangan oosit yang berbeda karena perlakuan aktivitas ovarium yang berbeda.
Fase folikuler tingkat kematangan lebih cepat, dimulai tingkat pematangan oosit langsung pada MI dan MII. Hal ini ini disebabkan pada kondisi awal (in vivo) terdapatnya pertumbuhan folikel primordial, preantrum, folikel antrum, dan sampai pada tahap folikel preovulasi. Berkembagnya folikel karena terdapatnya penghilangan efek negatif dari progesteron sehingga konsentrasi GnRH kembali meningkat. Peningkatan konsentrasi GnRH akan menyebabkan peningkatan produksi FSH dan LH sehingga dapat mendukung pertumbuhan folikel. Folikel de Graaf akan menghasilkan lebih banyak estrogen. Sehinggah oosit pada awal pematangan in vitro lebih cepat dimulai pada tahap MI dan MII (Parker, et al., 2002; Adams, et al,. 1992).
Pada Fase luteal tingkat kematangan oosit dimulai pada tingkat kematangan pada tahap GV, GVBD, M-I, dan M-II. Hal ini ini disebabkan pada kondisi awal (in vivo) masih terdapat pertumbuhan folikel primordial sampai pertumbuhan folikel preantrum tetapi tidak sampai pada tahap pertumbuhan folikel antrum dan preovulasi, kurang berkembagnya folikel karena terdapatnya CL (Corpus Luteum) yang menghasilkan progesteron yang dapat menghambat pertumbuhan folikel sampai preovulasi, sehinggah oosit pada awal pematangan in vitro dimulai pada tahap GV, GVBD, MI dan MII (Boediono, et al., 1995) .
24
KESIMPULAN DAN SARAN
Kesimpulan
1. Struktur populasi kualitas oosit berkaitan erat dengan status ovarium, struktur populasi pada fase folikuler dan fase luteal didominasi oleh kualitas oosit A (Oosit yang dikelilingi oleh kumulus ooforus dan sel korona radiata kompak dan tebal).
2. Tingkat persentase kematangan oosit M-II lebih tinggi pada fase luteal dan folikuler.
Saran
Berdasarkan penelitian yang telah dilakukan disarankan untuk melakukan kajian lebih lanjut mengenai hubungan status reproduksi ovarium untuk mencapai tingkat kematangan oosit sampai tahap produksi embrio secara in vitro.
25
DAFTAR PUSTAKA
Adams, G.P., R.L. Matteri, J.P. Kastelic, J.C. Ko, O.J. Ginther. 1992. Assosiationbetween surges of follicle -stimulating hormone and the emergence of follicular waves in heifers. J. Reprod. Fertil. 94: 177-188. Austin, C.R. and R. V. Short. 1982. Reproduction in Mammals. Book I.
University Press. Cambridge. 103.
Ball, G.D, M.L. Leibfreid, R.W.A.X. Lenz, B.D. Bavister and N.L. First. 1984. Factors affecting succcesfull in vitro fertilization of Bovine Follicular Oocyte. Biol. Reprod.28;717-725.
Bilodeau-Goeseels, S. and P. Panich 2002. Effects of oocyte quality on development and transcriptional activity in early bovine embryos. Anim. Reprod. Sci. 71 (3-4): 143-155.
Boediono, A., R. Rajamahendran, S. Saha, C. Sumantri, T. Suzuki. 1995. Effect of thepresence of a CL in the ovary on oocyte number, cleavage rate and blastocyst production in vitro in cattle. Theriogenology 43 (1): 169. [Abstr].
Cox, J.F., J. Hormazabal and A. Santa Maria. 1993. Effect of the cumulus on in vitro fertilization of bovine matured oocytes.Theriogenology, 40: 1259-1267.
De Wit, A.A., Y.A. Wurth, T.A. Kruip. 2000. Effect of ovarian phase and folliclequality on morphology and developmental capacity of the bovine cumulus- oocyte complex. J. Anim. Sci. 78(5): 1277-1283.
Down, S. M. 1993.Factors Effecting The Resumption of meiotic Maturation in Mammals Oocytes.Theriogenol.39;65-79.
Fortune, J.E., G.M. Rivera, A.C.O.Evans, A.M. Turzillo. 2001. Differentiation of dominant versus subordinate follicles in cattle. Biol. Reprod. 65: 648-654.
Frandson, R.D., 1996. Anatomi dan Fisiologi Ternak, Edisi ke-7, diterjemahkan oleh Srigandono, B dan Praseno, K, Gadjah Mada University Press, Yogyakarta.
26 Gaspersz, Vincent. 1991. Metode Perancangan Percobaan.CV. Armico, Bandung. Gordon, I. 1997. Controlled reproduction in sheep and goats. Cambridge: CAB
International. pp 53-85.
Hafez, E.S.E., dan B. Hafez. 2000. Folliculogenesis, egg maturation and ovulation. In: Hafez B and Hafez ESE. Reproduction in Farm Animals. 7th Ed. Philadelphia: Lea and Febiger. pp 68-81.
Hardjosubroto, W. 1994. Aplikasi Pemuliabiakan Ternak Di Lapangan. PT. Gramedia Widiasarana Indonesia, Jakarta.
Khurana, N.K. and H. Niemann. 2000. Effects of oocyte quality, oxygen tension,embryo density, cumulus cells and energy substrates on cleavage andmorula/blastocyst formation of bovine embryos. Theriogenology 54 (5): 741-756.
Lu, K.H., I. Gordon, H.B. Chen, M. Gallagher and H. M.C. Govern.1988. Birth of Twins After Transfer of Cattel Embrio Producced by in vitro Techniques. Vet Rec.36;125-132.
Pane, I. 1990. Upaya meningkatkan mutu genetik sapi Bali di P3Bali. Proc. Seminar Nasional Sapi Bali 20–22 September. hlm: A42.
Parker, K.I., D.M. Robertson, N.P. Groome, K.L. Macmillan. 2002. Plasma concentration of inhibin A and follicle stimulating hormone differ between cows with two or three waves of ovarian follicular development in a single estrous cycle. Biol. Reprod. 68: 822-828. Payne, W.J.A. and D.H .L. Rollinson, 1973. Bali Cattle. World Anim. Rev. 7:
13-21 .
Pisastyani, Herwin, 2003.Kompetensi tingkat kematangan oosit domba yang dimatangkan pada TCM 199 dan mem eagle in vitro.FKH.IPB.
Putu, I-G., P. Situmorang, P. Lubis, T.D. Chaniago, E. Triwulaningsih, T. Sugiarti, I-W. Mathius dan B. Sudaryanto.1998. Pengaruh pemberian pakan konsentrat tambahan selama dua bulan sebelum dan sesudah kelahiran terhadap performan produksi dan Reproduksi Sapi Potong. Pros. Seminar Nasional Peternakan dan Veteriner. Bogor 1 – 2 Desember 1998. Puslibang Peternakan, Bogor. hlm. 279 – 286.
Prochaska, R.,R. Durnford, P.S. Fiser And G.J. Marcus. 1993. Paerthenogenetic Development Of Activated in vitro Mtured Bovine Oocytes, Theriogenol.39;103-105.
27 Rasby,R.andR.Vinton.2001.Theestrouscycle.http://beef.unl.edu/learning/estrous.
shtm
Rahman, N.U., M. Sarwar, H.A. Samad. 2001. In vitro production of bovine embryos -a review. Asian-Aust. J. Anim. Sci. 14: 1342-1351.
Ratnawati, Dian., wulan cahya pratiwi dan lukman affandhy. S. 2007. Penanganan gangguan reproduksi pada sapi potong. Pusat Penelitian dan Pengembangan Peternakan. Depertemen Pertanian.
Sonjaya, H. 2005. Materi Mata Kuliah Ilmu Reproduksi Ternak. Fakultas Peternakan Universitas Hasanuddin, Makassar.
Sirard, M.A., and P. Blondin. 1996. Oocyte maturation and IVF in cattle. Anim. Reprod.Sci.442;417-426
Spalding, J.F., R.O. Berry and J.G. Moffit. 1995. The maturation process of the ovum of swine during normal and indereed ovulations. J.Animal Science 14:609.620.
Supriatna, I., dan F.H. Pasaribu. 1992. In vitro Fertilisasi,Transfer Embrio dan pembekuan embrio.Bogor;PAU Bioteknogi IPB.pp;1-56.
Shamsuddin, M.B., Larsson and H.R. Martinez. 1993. Maturation-related changes in Bovine Oocytes Under Different Culture Conditions.J.Anim. Reprod.Scl.31;49-58.
Souza, C.J.H., B.K. Campbell, D.T. Baird. 1998. Follicular waves and concentrations of steroid and inhibin A in ovarian venous blood during the luteal phase of the oestrous cycle in ewes with an ovarian autotransplant. J. Endocrinology 156: 563-572.
Steel, R.G.D., dan J.H. Torrie. 1993. Prinsip dan Prosedur Statistika: Suatu Pendekatan Biometric. Alih bahasa: B. Sumantri. Jakarta: Gramedia Pustaka Utama.
Tanari, M. 2001. Usaha pengembangan sapi Bali sebagai ternak lokal dalam menunjang pemenuhan kebutuhan protein asal hewani di Indonesia. http:// rudyct. 250x. com/ sem1_012/m_tanari.
Taylor, C., Rajamahendran R. 1991. Follicular dynamics and corpus luteum growth and function in pregnant versus nonpregnant dairy cows. J. Dairy Sci. 74: 115-123.
28 Van den Hurk, R.M. Bevers and J.F.Beckers. 1997. In vivo and in vitro
development of pre antral follicles, Theriogenology,47:73-82.
Zhang, L., E.G. Blakewood, R.S. Denniston and R.A. Goolke. 1990. The effect of ovary temperature on oocyte maturation in vitro fertilization and embryo development in cattle.Proc.So. Section Amer.Dairy Sci.Assoc.p:16
Zheng, Y.S., and M.A. Sirard.1992. The Effect of Sera, Bovine Serum Albumin and Follicular Cell on In Vitro Maturation and Fertilization of Porcine Oocyte. 3 Theriogenology.
Lampiran 1.
Tingkat Potensi Oosit Berdasarkan Aktivitas Ovarium
PERLAKUAN ULANGAN Tingkat Potensi Oosit (%) TOTAL
A B C D Belum siklus 1 4 3 - 1 8 2 7 1 - 2 10 3 5 5 - 1 11 4 6 3 1 3 13 Total 22 12 1 7 42 Rata-rata 52.38 28.57 2.38 16.67 Fase Folikuler 1 10 2 3 2 17 2 8 4 3 5 20 3 8 1 2 3 14 4 9 2 - 1 12 Total 35 9 8 11 63 Rata-rata 55.56 14.29 12.7 17.46 Fase Luteal 1 13 1 2 3 19 2 14 3 3 5 25 3 14 1 3 3 21 4 15 2 5 3 25 Total 56 7 13 14 90 Rata-rata 62.22 7.78 14.44 15.56
Lampiran 2.
Tingkat pematangan inti oosit secara
in vitro
pada sapi Bali
PERLAKUAN ULANGAN Tingkat Pematangan Inti
TOTAL GV GVBD MI MII Belum siklus 1 - - 4 3 7 2 - 1 6 2 9 3 2 3 4 2 11 4 - 3 4 0 12 Total 2 7 18 7 39 Fase Folikuler 1 - - 8 9 17 2 - 4 5 9 3 - - 5 6 11 4 - - 2 2 4 Total 0 0 19 22 41 Fase Luteal 1 1 4 13 18 2 - 1 6 10 17 3 - 0 1 5 6 4 2 3 2 7 Total 1 3 14 30 48 Rata-rata 2.34 7.81 39.84 46.09 128
Lampiran 3. Tingkat Rata-rata Potensi Oosit Berdasarkan Aktivitas Ovarium
Perlakuan
Tingkat Potensi Oosit
A B C D
Belum Siklus 52.38% 28.57% 2.38% 16.67%
Fase Folikuler 55.56% 14.29% 12.70% 17.46%
Lampiran 4.
Tingkat Rata-rata Kematangan Oosit Berdasarkan Aktivitas Ovarium
Perlakuan Pematangan Inti (%) GV GVBD MI MII Belum Siklus 4.54±9.09 15.84±12.75 48.37±16.15 20.81±17.59 a Fase Folikuler 0.00±0.00 0.00±0.00 46.73±2.43 53.26±2.43 b Fase Luteal 1.38±2.78 8.61±13.59 29.26±11.96 60.73±23.67 bLampiran 5.
Uji Chi-Square Tingkat Struktur Kualitas Oosit berdasarkan Aktivitas Ovarium pada Sapi Bali
Perlakuan Belum Siklus Dan Fase Folikuler
Chi-Square Tests
Value df Asymp. Sig. (2-sided)
Pearson Chi-Square 13.447a 3 .004
Likelihood Ratio 14.507 3 .002
Linear-by-Linear Association .191 1 .662
N of Valid Cases 200
Perlakuan Belum Siklus Dan Fase Luteal
Chi-Square Tests
Value df Asymp. Sig. (2-sided)
Pearson Chi-Square 21.826a 3 .000
Likelihood Ratio 23.692 3 .000
Linear-by-Linear Association .000 1 1.000
N of Valid Cases 200
Perlakuan Fase Folikuler Dan Fase Luteal
Chi-Square Tests
Value Df Asymp. Sig. (2-sided)
Pearson Chi-Square 2.009a 3 .571
Likelihood Ratio 2.030 3 .566
Linear-by-Linear Association .178 1 .673
N of Valid Cases 200
Lampiran 6.
Tingkat Kematangan Oosit dengan Menggunakan Rancangan Acak lengkap (RAL) dengan
analysis
of variance
(ANOVA)
Tests of Between-Subjects Effects
Dependent Variable: M2Source Type III Sum of Squares df Mean Square F Sig.
Corrected Model 1786.954a 2 893.477 5.331 .030 Intercept 19883.578 1 19883.578 118.628 .000 Perlakuan 1786.954 2 893.477 5.331 .030 Error 1508.512 9 167.612 Total 23179.044 12 Corrected Total 3295.465 11
Multiple Comparisons
Dependent Variable: M2 LSD
(I) Perlakuan (J) Perlakuan Mean Difference (I-J)
Std. Error Sig. 95% Confidence Interval Lower Bound Upper Bound 1.00 2.00 -23.1825* 9.15457 .032 -43.8916 -2.4734 3.00 -27.9325* 9.15457 .014 -48.6416 -7.2234 2.00 1.00 23.1825 * 9.15457 .032 2.4734 43.8916 3.00 -4.7500 9.15457 .616 -25.4591 15.9591 3.00 1.00 27.9325* 9.15457 .014 7.2234 48.6416 2.00 4.7500 9.15457 .616 -15.9591 25.4591
Based on observed means.
The error term is Mean Square(Error) = 167.612. *. The mean difference is significant at the .05 level.
Tests of Between-Subjects Effects
Dependent Variable: M1
Source Type III Sum of Squares df Mean Square F Sig.
Corrected Model 334.412a 2 167.206 .738 .505 Intercept 20036.110 1 20036.110 88.489 .000 Perlakuan 334.412 2 167.206 .738 .505 Error 2037.823 9 226.425 Total 22408.345 12 Corrected Total 2372.235 11
Tests of Between-Subjects Effects
Dependent Variable: GVBD
Source Type III Sum of Squares df Mean Square F Sig.
Corrected Model 822.283a 2 411.142 2.780 .115 Intercept 1344.930 1 1344.930 9.093 .015 Perlakuan 822.283 2 411.142 2.780 .115 Error 1331.232 9 147.915 Total 3498.445 12 Corrected Total 2153.515 11
Tests of Between-Subjects Effects
Dependent Variable: GV
Source Type III Sum of Squares Df Mean Square F Sig.
Corrected Model 82.645a 2 41.323 .587 .576 Intercept 128.446 1 128.446 1.825 .210 Perlakuan 82.645 2 41.323 .587 .576 Error 633.273 9 70.364 Total 844.364 12 Corrected Total 715.918 11
Lampiran 7.
Dekumentasi Tahap-tahap Penelitian
RIWAYAT HIDUP
Nama Andi Mutmainna Penulis dilahirkan pada tanggal 06 Desember 1991 di Piampo (Wajo), Sulawesi Selatan sebagai anak keenam dari delapan bersaudara melalui pasangan Bapak (H.Bachtiar) dan Ibu (Hj. Andi Ansa Page Makkaraka). Pendidikan Formal yang telah ditempuh penulis adalah Sekolah Dasar 259 Teddaopu Sengkang dari tahun 1998 sampai tahun 2004, kemudian dilanjutkan ke Sekolah Menengah Pertama di MTs As’adiyah Putri Sengkang dan lulus pada tahun 2007 dan selanjutnya diterima di Madrasah Aliyah As’adiyah Putri Sengkang 2010.
Penulis diterima di Perguruan Tinggi Negeri Universitas Hasanuddin (UNHAS), Jurusan Produksi Ternak, Fakultas Peternakan melalui jalur Seleksi Prestasi Olahraga Seni dan Keilmuan (POSK). Selama mengikuti perkuliahan penulis aktif sebagai pengurus Himpunan Jurusan (HIMAPROTEK) Fakultas Peternakan, Universitas Peternakan Universitas Hasanuddin Makassar.