i PENGARUH PENAMBAHAN INSULIN TRANSFERRIN SELENIUM (ITS)
PADA MEDIUM TERHADAP TINGKAT MATURASI DAN FERTILISASI OOSIT SAPI BALI SECARA IN VITRO
SKRIPSI Oleh: HIKMAYANI ISKANDAR I111 13 534 FAKULTAS PETERNAKAN UNIVERSITAS HASANUDDIN MAKASSAR 2017
ii PENGARUH PENAMBAHAN INSULIN TRANSFERRIN SELENIUM (ITS)
PADA MEDIUM TERHADAP TINGKAT MATURASI DAN FERTILISASI OOSIT SAPI BALI SECARA IN VITRO
SKRIPSI
Oleh:
HIKMAYANI ISKANDAR I111 13 534
Sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana Fakultas Peternakan Universitas Hasanuddin
FAKULTAS PETERNAKAN UNIVERSITAS HASANUDDIN
MAKASSAR 2017
iii PERNYATAAN KEASLIAN
1. Yang bertanda tangan dibawah ini :
Nama : Hikmayani Iskandar
NIM : I111 13 534
Menyatakan dengan sebenarnya bahwa : a. Karya skripsi yang saya tulis adalah asli
b. Apabila sebagian atau seluruhnya dari karya skripsi ini, terutama bab Hasil dan Pembahasan tidak asli atau plagiasi maka bersedia dibatalkan atau dikenakan sanksi akademik yang berlaku
2. Demikian pernyataan keaslian ini dibuat untuk dapat digunakan seperlunya.
Makassar, Agustus 2017
iv HALAMAN PENGESAHAN
Judul Penelitian : Pengaruh Penambahan Insulin Transferrin Selenium (ITS) Pada Medium Terhadap Tingkat Maturasi dan Fertilisasi Oosit Sapi Bali Secara In Vitro
Nama : Hikmayani Iskandar
Nomor Induk Mahasiswa : I111 13 534
Fakultas : Peternakan
Skripsi ini telah diperiksa dan disetujui oleh :
Pembimbing Utama
Prof. Dr. Ir. H. Herry Sonjaya, DEA,DES NIP. 19570129 198003 1 001 Pembimbing Anggota Dr. Muhammad Yusuf, S.Pt. NIP. 19700725 199903 1 001 Dekan Fakultas Peternakan
Prof. Dr. Ir. H. Sudirman Baco. M.Sc. NIP. 19641231 198903 1 025
Ketua Program Studi Peternakan
Prof.Dr. drh. Hj. Ratmawati Malaka, M.Sc. NIP. 19640712 198911 2 002
v KATA PENGANTAR
Assalamualaikum Warahmatullahi Wabarakatuh………
Segala puja dan puji bagi Allah SWT atas Rahmat dan Hidayah-Nya yang senantiasa tercurahkan kepada penulis sehingga dapat merampungkan penulisan Skripsi ini. Shalawat dan salam kepada junjungan Nabi Muhammad SAW yang telah menjadi panutan serta telah membawa ummat dari lembah kehancuran menuju alam yang terang benderang.
Dalam setiap helai kelopak bunga dan semerbak wangi yang dipancarkan olehnya, penulis haturkan terima kasih kepada Ibunda Ramliah, Ibu, yang telah memberikan penulis hidup, menegakkan punggung, melangkahkan kaki, menampung setiap keluh-kesah untuk kemudian menggantikannya dengan kasih sayang, yang rela menebus dirinya dengan kepayahan dan air mata sehingga penulis dapat tegap menelusuri jalan kehidupan, mampu pongah terhadap muslihat dunia, dan mencoba teguh berpegang pada kebenaran. Dan kepada Ayahanda Iskandar K, S.Ag. MM, Ayah, atas kepercayaan penuh yang diberikan kepada penulis sebagai “anak sejati”. Semoga ananda dapat mempersembahkan yang terbaik kepada Ayah dan Ibu.
Terima kasih tak terhingga kepada bapak Prof. Dr. Ir. H. Herry Sonjaya, DEA. DES selaku Pembimbing Utama yang telah membimbing penulis, memberi motivasi dan telah memberi/membagi pengetahuannya kepada penulis dan kepada bapak Dr. Muhammad Yusuf, S.Pt selaku Pembimbing Anggota yang bersahaja dalam mengoreksi dan memperbaiki tulisan skripsi ini.
Ungkapan terima kasih yang sebesar-besarnya penulis haturkan dengan segala keikhlasan dan kerendahan hati kepada:
vi 1. Ibu Rektor UNHAS, Bapak Dekan, Pembantu Dekan I, II dan III dan seluruh Bapak Ibu Dosen yang telah melimpahkan ilmunya kepada penulis, serta Bapak Ibu Staf Pegawai Fakultas Peternakan Universitas Hasanuddin yang selalu melayani kebutuhan administrasi penulis.
2. Bapak Dr. Hasbi, S.Pt, M.Si yang telah mengajarkan teknik mencacah ovarium hingga proses pengamatan inti dan membantu kami selama penelitian ini.
3. Ir. Veronica Lestari, M.Sc selaku penasehat akademik penulis yang telah memberikan bimbingan selama masa perkuliahan penulis.
4. Bapak Prof. Dr. Ir. Jasmal A. Syamsu, M.Si atas segala dukungan moril, materil sehingga melancarkan segala urusan dalam mengikuti kegiatan kemahasiswaan dan ibu Dr. Agustina Abdullah, S.Pt. M.Si yang selalu memberikan semangat dan dorongan selama di Fakultas Peternakan. 5. SUIJI-SLP UNHAS atas segala dukungan yang diberikan selama
menjalani penelitian terutama untuk sensei saya yang selalu memberikan pembelajaran arti kehidupan Prof. Dr. Ir. Dorothea Agnes Rampisela, M.Sc
6. Rekan-rekan sepenelitian yaitu Nasrullah, Nawawi Arfan, Andi Nurul Airin, Dewi Sartika, Asri Puspita dan Hilma Utami Putri yang telah mencurahkan segenap tenaga, waktu, materi dan perhatiannya selama penelitian ini.
7. Sahabat-sahabat terbaik penulis selama di Fakultas Peternakan, terutama Nur Astuti, Andi Nurul Airin, Purnama Isti Khaerani, Nur Fitriani Amir dan Asfianti.
vii 8. Adinda Ashariah Hapila di Fakultas Peternakan yang selalu memberikan
motivasi.
9. Teman-teman asisten di Laboratorium Fisiologi Ternak, Ilmu Ternak Unggas, dan Manajemen Ternak Unggas Fakultas Peternakan Universitas Hasanuddin Makassar angkatan 2013.
10. Organisasi tercinta selama menjadi mahasiswa di Fakultas Peternakan yaitu BEM PETERNAKAN-UH, HIMAPROTEK-UH, FOSIL, dan UKM TENIS MEJA-UH yang menjadi wadah bagi penulis untuk berproses dan belajar.
11. Teman-teman angkatan Larfa 2013, khususnya kelas D yang selalu mendoakan. Kepada semua senior khususnya angkatan Flock Mentality 2012, ucapan terima kasih atas semua wejangan dan ilmunya.
12. Buat semua kawan-kawan yang belum sempat tersebutkan nama-namanya, namun telah memberi andil kepada penulis dalam penyelesaian skripsi ini mohon maafku, dan terima kasihku untukmu semuanya.
Dengan sangat rendah hati, penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan. Oleh karena itu, kritik serta saran pembaca sangat diharapkan adanya oleh penulis demi perkembangan dan kemajuan ilmu pengetahuan nantinya, terlebih khusus di bidang peternakan. Semoga makalah skripsi ini dapat memberi manfaat bagi para pembaca terutama bagi penulis itu sendiri.
AAMIIN YA ROBBAL AALAMIN.
Akhir Qalam Wassalamualaikum Warahmatullahi Wabarakatuh.
Makassar, Agustus 2017
viii ABSTRAK
Hikmayani Iskandar I111 13 534. Pengaruh Penambahan Insulin Transferrin Selenium (ITS) Pada Medium Terhadap Tingkat Maturasi dan Fertilisasi Oosit Sapi Bali Secara In Vitro. Pembimbing : Herry Sonjaya dan Muhammad Yusuf
Penelitian ini bertujuan untuk mengetahui pengaruh penambahan Insulin
Transferrin Selenium (ITS) pada medium terhadap tingkat maturasi dan fertilisasi
oosit sapi Bali secara in vitro. Ovarium sapi Bali disayat untuk menghasilkan oosit, lalu oosit dikoleksi dan diseleksi berdasarkan kualitasnya. Oosit tersebut lalu dimaturasi 24 jam dan difertilisasi 18 jam di dalam inkubator 5 % CO2 dan 38,5oC. Oosit diwarnai dengan aceto orcein 2%, lalu diamati di bawah mikroskop. Penelitian ini menggunakan analisis dengan Chi Square 2x2 Contingency Table dengan 4 perlakuan dan 4 kali ulangan dengan penambahan ITS. Perlakuan ini terdiri dari, P0 kontrol; P1 (5 ng/ml); P2 (10 ng/ml); dan P3 (15 ng/ml). Parameter yang diamati yaitu tahap tingkat maturasi oosit yang terdiri dari germinal vesicle (GV), germinal
vesicle break down (GVBD), metaphase-I (M-I) dan metaphase-II (M-II), kemudian
tingkat fertilisasi yang terdiri dari 0 pronukleus (0 PN), 1 pronukleus (1 PN), 2 pronukleus (2 PN) dan lebih dari 2 pronukleus (>2 PN). Hasil penelitian menunjukkan bahwa persentase tingkat maturasi oosit tertinggi pada tahap M-II dicapai oleh oosit P1 dengan pemberian ITS sebanyak 5 ng/ml sedangkan persentase tingkat fertilisasi tertinggi pada tahap PN-2 dihasilkan oleh oosit P3 dengan pemberian ITS sebanyak 15 ng/ml.
ix ABSTRACT
Hikmayani Iskandar I111 13 534. The Effect of Adding Insulin Transferrin Selenium (ITS) in Medium on In Vitro Maturation and Fertilization Rates of Bali Cows Oocytes. Supervised by : Herry Sonjaya and Muhammad Yusuf.
The aim of this study was to determine the effect of adding Insulin Transferrin Selenium (ITS) in the medium on maturation and fertilization rates of Bali cows oocytes. The ovarium of Bali cows were sliced to produce oocytes, then the collected oocytes were subsequently selected based on their quality. Those oocytes were maturated for 24 hours and then fertilized for 18 hours in the incubators of 5% CO2 with temperature of 38.5ºC. Oocytes were stained using 2% of aceto orcein, and observed under a microscope. This study was divided into four treatments at different addition of ITS in the medium and replicated four times, and analized using Chi Squared 2x2 Contingency Table at each treatment. The treatments consisted of P0 as control, P1 (5 ng/ml), P2 (10 ng/ml), and P3 (15 ng/ml). Parameters observed in this study were the stages of oocytes maturation rate that consisted of germinal vesicle (GV), germinal vesicle break down (GVBD), metaphase I (M-I), and metaphase II (M-II), and fertilization rate that consisted of absence of pronucleus (P0), 1 pronucleus (PN1), 2 pronucleus (PN2), and more than two pronucleus (>2PN). The results of this study showed that addition of ITS at 5-15 ng/ml did not effect maturation and fertilization rates of Bali cows oocytes.
x
DAFTAR ISI
Halaman DAFTAR ISI ... x DAFTAR TABEL ... x DAFTAR GAMBAR ... xiDAFTAR LAMPIRAN ... xii
PENDAHULUAN ... 1
TINJAUAN PUSTAKA Ovarium ... . 4
Folikulogenesis ... . 5
Oogenesis ... . 8
Pematangan Oosit secara In Vitro ... . 10
Fertilisasi Oosit secara In Vitro ... . 12
Insulin Transferrin Selenium (ITS) ... . 13
METODE PENELITIAN Waktu dan Tempat ... . 15
Alat dan Bahan Penelitian ... . 15
Rancangan Penelitian ... . 15
Prosedur Penelitian ... . 16
Parameter yang Diukur ... . 18
Analisis Data ... . 19
HASIL DAN PEMBAHASAN Tingkat Maturasi Oosit Sapi Bali dengan Penambahan Insulin Transferrin Selenium (ITS) pada Media Maturasi yang Berbeda . . 20
Tingkat FertilisasiOosit Sapi Bali dengan Penambahan Insulin Transferrin Selenium (ITS) yang Berbeda ... . 25
KESIMPULAN DAN SARAN Kesimpulan ... . 29
Saran ... . 29
DAFTAR PUSTAKA ... . 30
LAMPIRAN ... . 36
xi
DAFTAR TABEL
No Teks Halaman
1. Pengaruh Penambahan ITS Pada Oosit Sapi Bali Terhadap
Rata-rata Persentase Tingkat Maturasi Oosit ... 20 2. Pengaruh Penambahan ITS Pada Oosit Sapi Bali Terhadap
Rata-rata Persentase Tingkat Fertilisasi Oosit ... 25 3. Pengaruh Tingkat Tahapan Maturasi dan Fertilisasi Oosit Pada
xii
DAFTAR GAMBAR
No Teks Halaman
1. Profil Hormonal dan Aktivitas Ovarium Pada Sapi Betina Selama
Satu Siklus Birahi ... 6 2. Proses Oogenesis ... 8 3. Diagram Alir Prosedur Penelitian ... 16 4. Perubahan Gambar Oosit Berdasarkan Tahapan dalam Penelitian .. 23 5. Tingkat Maturasi Oosit ... 24 6. Tingkat Pembentukan Pronukleus ... 27
xiii
DAFTAR LAMPIRAN
No Teks Halaman
1. Komposisi Media Maturasi Secara In Vitro ... 36
2. Komposisi Media Fertilisasi Secara In Vitro ... 36 6 3. Jumlah Oosit dari Beberapa Kualitas yang Berbeda ... 36
4. Konsentrasi Penggunaan ITS ... 37
5. Data Tingkat Maturasi Penambahan ITS dengan Konsentrasi Berbeda (%) ... 38
6. Data Tingkat Fertilisasi Penambahan ITS dengan Konsentrasi Berbeda (%) ... 39
7. Analisis 2x2 Contingency Table Data Tingkat Maturasi ... 40
8. Analisis 2x2 Contingency Table Data Tingkat Fertilisasi ... 43
1 PENDAHULUAN
Perkembangan bioteknologi reproduksi ternak banyak memberikan manfaat bagi kehidupan manusia khususnya dalam dunia peternakan diantaranya inseminasi buatan (IB) dan transfer embrio (TE). Untuk keperluan transfer embrio dibutuhkan embrio dalam jumlah banyak dengan aplikasi in vitro fertilization (IVF) meliputi
invitro maturation (IVM) dan in vitro culture (IVC).
Ovarium mengandung folikel yang mampu menyediakan oosit dalam jumlah banyak, sehingga menjadi alternatif untuk memproduksi embrio secara in vitro. Oosit yang ada pada ovarium tersebut dapat dimanfaatkan sebagai bahan mentah dalam proses IVM dan IVF. Fertilisasi in vitro ini diharapkan dapat memproduksi embrio sapi dalam jumlah massal untuk dititipkan pada induk resipien, sehingga dapat diperoleh ternak dalam jumlah banyak untuk meningkatkan populasi sapi di Indonesia. Proses fertilisasi in vitro meliputi pengambilan oosit dari folikel ovarium, maturasi oosit, kapasitasi sperma, fertilisasi in vitro, dan kultur oosit yang sudah difertilisasi untuk menjadi embrio (Boediono et al., 2000).
Pada saat maturasi secara in vitro, oosit mengalami metabolisme perkembangan dengan kondisi O2 pada konsentrasi yang lebih tinggi. Kondisi ini memicu peningkatan produksi radikal bebas (Reactive Oxygen Species/ROS) sehingga mengakibatkan kondisi stress oksidatif. Tingginya kadar ROS ini dapat merusak membran sel akibat perioksidasi lipid membran. Suatu sistem antioksidan enzimatik yang terdapat dalam sel mamalia, yaitu superokside dismutase, glutathione peroksidase, dan catalase dapat berfungsi sebagai ROS scavenger (Cetica, et al. 2001). Oleh karena itu dibutuhkan penambahan bahan antioksidan dalam proses
2 maturasi oosit untuk menghambat kerusakan sel akibat ROS dan dengan adanya penambahan antioksidan dapat meningkatkan laju pertumbuhan sel pada oosit.
Suplemen antioksidan seperti α-tocopherol, glutathione dan Insulin
Transferrin Selenium (ITS) ditambahkan dalam medium maturasi oosit dengan tujuan
menangkal (scavenging) radikal bebas. Penelitian Kim, et al. (2005) dan Lee, et al. (2005) menunjukkan pemberian insulin dan insulin like growth factor (IGF) ke dalam medium, dapat meningkatkan potensi pertumbuhan oosit, tingkat cleavage dan embrio selama in vitro maturation (IVM) dan in vitro Cultured (IVC).
Selenium dan Transferrin (IT) berperan sebagai antioksidan dalam sistem biologis (Wu, et al., 1973; Gutteridge, 1986). Penggunaan ITS sebagai suatu suplemen telah dilakukan untuk oosit tikus (De La Fuente, et al., 1999), ITS dan
epidermal growth factor (EGF) berhasil mematurasi oosit dan folikel preantral tikus
prepubertas sebanyak 92,2% (Gao, et al., 2007), kambing (Herrick, et al., 2004), oosit babi (Jeong, et al., 2008) secara signifikan dapat meningkatkan konsentrasi GSH. Kombinasi ITS dapat digunakan baik dalam media maturasi dan fertilisasi kompleks maupun nonkompleks, ITS merupakan suplemen yang dapat memacu pertumbuhan oosit. Namun studi dan informasi ilmiah mengenai pengaruh Insulin
Transferrin Selenium (ITS) pada sapi Bali masih sangat terbatas.
Permasalahan yang timbul yaitu rendahnya kualitas oosit hasil IVM dan IVF oleh kerusakan sel akibat stress oksidatif yang disebabkan karena meningkatnya produksi radikal bebas atau Reactive Oxygen Species (ROS) secara in vitro. Radikal bebas memiliki reaktifitas yang sangat tinggi, sifatnya menyerang atau menarik elektron di sekelilingnya. Reaksi seperti ini akan terus berlanjut dan baru berhenti apabila reaktivitasnya diredam (quenched) atau ditangkal (scavenged) dengan
3 senyawa yang bersifat antioksidan. Penambahan bahan suplementasi antioksidan seperti α-tocopherol, GSH, ITS ke dalam medium maturasi dan fertilisasi bertujuan untuk mencegah dampak dari ROS, sehingga proses metabolisme oosit dapat berlangsung normal.
ITS merupakan suplemen media dalam maturasi in vitro yang dapat menekan pengaruh senyawa radikal bebas yang memicu lingkungan oksidatif. Sehingga penelitian ini dilakukan untuk mengevaluasi efek ITS terhadap tingkat maturasi dan fertilisasi oosit sapi Bali secara in vitro. Berdasarkan uraian tersebut, maka dilakukanlah penelitian mengenai Pengaruh Insulin Transferrin Selenium (ITS) Terhadap Tingkat Maturasi dan Fertilisasi Oosit Sapi Bali Secara In Vitro.
4 TINJAUAN PUSTAKA
Ovarium
Ovarium adalah organ reproduksi betina yang paling penting karena menghasilkan sel gamet betina (ovum) dan hormon seks betina (estrogen dan progesteron) (Bearden et al., 2004). Ovarium termasuk organ reproduksi primer pada hewan betina. Disebut organ primer karena ovarium menghasilkan sel garnet betina (yaitu ovum) dan hormon kelamin betina. Hormon kelamin yang dihasilkan oleh ovarium dibedakan dalam dua kelompok yaitu hormon steroid dan hormon peptida. Hormon steroid terdiri dan progesteron dan estrogen, sedangkan hormon peptida terdiri dari inhibin, activin, relaxin, dan oxytocin. Ovarium terletak di ruang abdomen seekor hewan. Pada domba bentuk ovarium seperti kacang almond. Ovarium dapat bekerja sebagai organ eksokrin (menghasilkan sel telur) dan endokrin (menghasilkan hormon) (Thomas & Joanna, 2002).
Ovarium dibagi menjadi dua bagian, yaitu kortek dan medula. Sebagian besar ovarium didominasi oleh kortek. Kortek dilapisi oleh simple squamous dan epitelium kuboid. Di bagian yang lebih dalam terdapat jaringan yang tidak beraturan yang disebut tunika albuginea. Tunika albuginea berhubungan dengan stroma ovarium yang terdiri dari jaringan ikat longgar yang mengandung folikel dan korpus luteum. Sedangkan daerah medula terdiri atas pembuluh darah, pembuluh limfe, saraf, jaringan ikat dan otot polos (Schatten & Gheorghe, 2007).
Pada saat fetus, ovarium menghasilkan oogonia melalui pembelahan mitosis. Sekitar 1 (satu) juta oosit berkembang setelah fetus dilahirkan namun hanya beberapa
5 ratus oosit yang akan diovulasikan. Umumnya oosit akan berkurang karena mengalami degenerasi dan atresia (Schatten & Gheorghe 2007).
Folikel yang terkandung di dalam ovarium merupakan bentukan yang berisi sel telur (oosit). Oosit dikelilingi oleh sel-sel folikular yang serupa dengan sel granulosa, dimana sel-sel ini nantinya akan membentuk corona radiata dan cumulus oophorus. Sel-sel folikular dibedakan dalam beberapa tipe yaitu sel granulosa, sel theca interna dan sel theca externa. Folikel akan mengalami perkembangan yang prosesnya disebut folikulogenesis, dimana dan folikel awal yang disebut folikel primer akan berkembang menjadi folikel sekunder, kemudian folikel tertier, dan akhimya menjadi folikel graaf yang siap ovulasi. Perkembangan folikel tersebut diatur oleh hormon yang dilepaskan oleh kelenjar pituitaria anterior yaitu follicle stimulating hormone (FSH).
Folikulogenesis
Folikulogenesis adalah suatu perkembangan folikel dalam ovarium dari sudut besarnya, jumlah lapisan sel granulosa, perkembangan sel teka interna dan eksterna, posisi sel telur di sekeliling kumulus oophorusnya, dan peningkatan volume cairan rongga folikel. Folikulogenesis merupakan proses kompleks yang diatur oleh faktor parakrin dan autokrin (Demeestere, 2005) yang terdiri dari perkembangan ukuran folikel, penambahan jumlah lapisan sel granulosa, perkembangan sel teka interna dan sel teka eksterna, pembungkusan ovum oleh kumulus oophorus, serta peningkatan cairan rongga folikel (Hardjopranjoto, 1995). Beberapa endokrin dan faktor lokal ikut serta dalam proses kompleks pertumbuhan folikel ovari dan pematangan oosit (Demeestere, 2005).
6 Perkembangan folikel pada sapi dan domba ditandai dengan adanya gelombang pertumbuhan folikel. Satu gelombang didefinisikan sebagai suatu proses pertumbuhan folikel yang sinkron dari beberapa folikel kecil. Dari kelompok folikel kecil tersebut, salah satu diantaranya akan terseleksi dan tumbuh menjadi folikel dominan, sedangkan folikel lainnya akan terhenti pertumbuhannya dan menuju atresi. Setelah mencapai ukuran maksimal, folikel dominan juga akan mengalami atresi dan regresi. Perkembangan folikel pada sapi dan domba ditandai dengan adanya gelombang pertumbuhan folikel. Pada gelombang yang kedua folikel dominannya akan menjadi folikel ovulatory sedangkan folikel dominan dari gelombang ketiga akan mengalami ovulasi (Rasby dan Vinton, 2001).
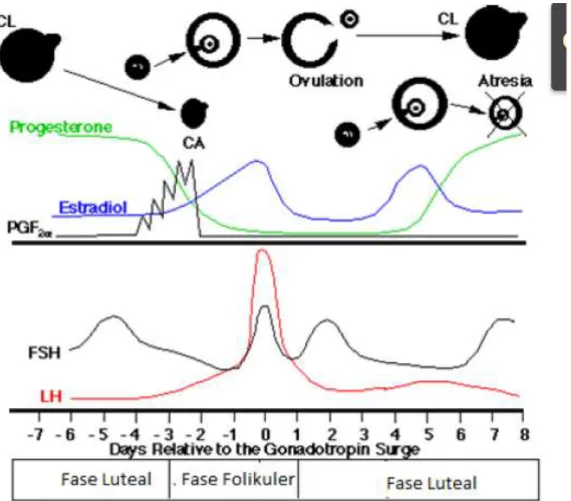
Gambar 1. Profil hormonal dan aktivitas ovarium pada sapi betina selama satu siklus berahi (Sonjaya, 2005).
7 Satu siklus estrus terdiri dari fase folikular dan fase luteal. Fase folikular ditandai dengan pertumbuhan dan perkembangan folikel ovarium yang berlangsung selama 3-4 hari. Pada domba, sebanyak satu atau dua folikel besar menghasilkan estrogen yang dapat menekan pertumbuhan folikel kecil lainnya (Hafez 2000). Fase luteal berlangsung selama kurang lebih 13 hari dan ditandai dengan pematangan corpus luteum yang menghasilkan progesteron dengan konsentrasi yang mencapai puncak pada hari ke-6 setelah ovulasi. Selama periode siklus estrus tidak ada perbedaan nyata antara jumlah folikel yang terdapat pada ovarium kiri dan kanan (Gordon, 1997).
Pada fase folikuler prostaglandin dihasilkan oleh endometrium uterus, sehingga corpus luteum lisis dan hormone progesteron (P4) menurun (Gambar 1), turunnya P4 menyebabkan control umpan balik negatif terhadap hipotalamus dan hipofisa anterior tidak ada, sehingga hipotalamus mensekresikan GnRH dan hipofisa anterior mensekresikan FSH dan LH, tingginya sekersi FSH dan LH merangsang pertumbuhan folikel yang berdampak meningktanya hormon estrogen yang diproduksi oleh folikel. Folikel terus berkembang menjadi folikel antrum dan preovulasi sehingga estradiol mencapai level tertinggi dan menyebabkan kontrol umpan balik positif terhadap hipotalamus dan hipofisa sehingga level FSH dan LH mencapai puncaknya dan menyebabkan folikel preovulasi pecah dan terjadinya pelepasan oosit dari ovarium ke saluran alat reproduksi betina (prosesnya disebut ovulasi). Setelah ovulasi folikel yang pecah menjadi copus haemoragikum terus menjadi korpus luteum yang menghasilkan hormon Progesteron selama fase luteal. Fase luteal dimulai hari ke 5 s/d hari ke 18 setelah ovulasi dan selama fase ini P4 tinggi, folikel banyak yang atresi, hormon gonadotropin (FSH dan LH) rendah (Sonjaya, 2005).
8 Inhibin memperlihatkan pengaruh terhadap sirkulasi FSH selama tahap awal fase luteal. Inhibin dan estradiol mengkontrol pengeluaran FSH selama gelombang folikular pertama. Sekresi FSH tidak dipengaruhi oleh progesterone melainkan oleh estradiol dan inhibin yang diproduksi oleh folikel selama periode siklus (Souza et al., 1998).
Oogenesis
Oogenesis adalah suatu proses pembentukan, pertumbuhan dan pematangan dari gamet betina yang dimulai sejak embrional sampai setelah dilahirkan dan mencapai puncaknya pada saat ovulasi (Austin dan short, 1982).
Tahap tumbuh dimulai setelah hewan mencapai usia dewasa kelamin. Tahap tumbuh ini berupa pembesaran diameter oosit menjadi dua sampai tiga kali lipat dan ditandai dengan isi sitoplasma bertambah banyak oleh penambahan kuning telur, bertambahnya membran sel (zona pelusida) dan poliferasi sel-sel granulosa. Proses oogenesis pada sapi berlangsung pada hari ke-45 sampai lebih dari 110 hari (Toelihere,1979).
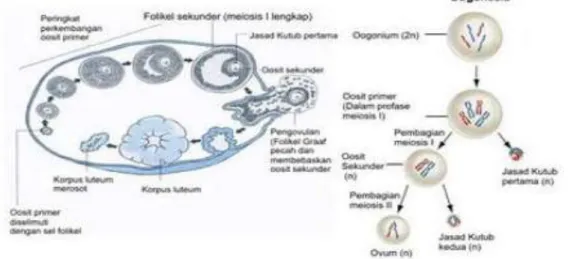
Gambar 2. Proses Oogenesis Sumber : Campbell et al., (2000)
9 Proses oogenesis (Gambar 2) terdiri dari beberapa tahap yaitu oogonium mengalami pembelahan mitosis berubah menjadi oosit primer, yang memiliki 46 kromosom. Oosit primer melakukan meiosis (tahap I), yang menghasilkan dua sel anak yang ukurannya tidak sama. Sel anak yang lebih besar adalah oosit sekunder yang bersifat haploid (n). Ukurannya lebih besar dari yang lain karena berisi lebih banyak sitoplasma dari oosit primer yang lain. Sel anak yang lebih kecil disebut badan polar pertama yang kemudian membelah lagi.
Oosit sekunder meninggalkan folikel ovarium menuju tuba fallopi. Apabila oosit sekunder dibuahi oleh sel sperma (fertilisasi), maka akan mengalami pembelahan meiosis yang kedua, begitu pula dengan badan polar pertama membelah menjadi dua badan polar kedua yang akhirnya mengalami degenerasi. Ketika inti nukleus sperma dan ovum siap melebur menjadi satu, saat itu juga oosit kemudian mencapai perkembangan akhir menjadi ovum yang matang. Peristiwa pengeluaran sel telur dikenal dengan istilah ovulasi. Pada setiap ovulasi hanya satu telur yang matang dan dapat hidup 24 jam (Campbell et al., 2000).
Perkembangan oosit terdiri dari tiga tahap yaitu proliferasi, pertumbuhan, dan pematangan. Pada tahap proliferasi terjadi proses mitosis oogonium menjadi beberapa oogonia yang terjadi pada saat pralahir atau sesaat setelah lahir kemudian oogonia berdiferensiasi menjadi oosit primer dengan inti tahap profase I. Inti oosit pada tahap ini disebut Germinal Vesicle (GV) yang ditandai dengan adanya membrane inti yang utuh dan nucleus yang jelas. Selanjutnya oosit akan memasuki tahap pertumbuhan dan pematangan yang berlangsung bersamaan dengan proses perkembangan folikel. Pertumbuhan oosit ditandai dengan peningkatan diameter oosit dan pertambahan ukuran dari organel-organel seperti
10 kompleks golgi, retikulum endoplasmik halus, butir lemak, peningkatan proses transkip untuk sintesis protein. Tahap pematangan oosit ditandai dengan beberapa proses perkembangan inti oosit (Hafez and Hafez, 2000).
Pematangan Oosit secara In Vitro (In Vitro Maturation, IVM)
Pematangan oosit diluar ovarium atau tubuh hewan disebut dengan pematangan oosit secara in vitro (In Vitro Maturation). Pematangan in vitro merupakan salah satu tahap yang penting dari rangkaian produksi embrio in vitro. Oosit untuk memproduksi embrio in vitro dapat diperoleh dari ovarium hewan betina yang masih hidup maupun ovarium hewan betina mati di Rumah Potong Hewan (RPH) dengan tanpa memperlihatkan fase siklus birahi (Ball et al. 1984). Pematangan oosit secarab in vitro membantu oosit agar mampu menyelesaikan proses meiosis sehingga bersifat haploid (setengah komponen kromosom) dan mampu mengalami ferilisasi (First et al. 1989).
In vitro maturation (IVM) juga merupakan salah satu tahap yang penting
pada proses fertilisasi in vitro dan keberhasilan proses maturasi sangat ditentukan oleh kualitas media kultur yang digunakan. Dua bahan utama yang umumnya digunakan untuk meningkatkan kualitas media maturasi adalah suplemen antioksidan dan hormon (Zeng & Sirard, 1992).
Selama maturasi oosit sapi, struktur kromati dalam oosit yang belum matang (immature) berupa membran nukleur utuh (GV) dimulai dari pembelahan meiosis pertama dilanjutkan dengan pembelahan meiosis kedua. Menurut Lu (1988) menunjukkan bahwa 90 % dari oosit sapi mengalami pematangan pada 24 jam setelah dikultur. Dari penelitian tersebut terlihat membran nuklear menghilang setelah 5-6 jam GVBD dan M-I dicapai setelah 12 jam dan M-II dicapai setelah 19 jam (Gordon,
11 1994). Diperkirakan pematangan inti tersebut lebih cepat pada in vitro daripada in
vivo menurut Gordon (1994).
Kesempurnaan pematangan sel telur sangat berpengaruh terhadap keberhasilan fertilisasi. Pada proses pematangan sel telur secara in vitro dipengaruhi oleh faktor diantaranya medium pematangan dan lingkungan penyimpanan (inkubator). Medium standar pematangan in vitro sel telur sapi adalah TCM-199. Maturasi in vitro dilakukan inovasi komposisi dan penambahan suplemen untuk mendapatkan kondisi medium yang optimal. Suplemen seperti serum, hormon estradiol, hormon gonadrotropin (FSH dan LH), mineral, glukosa, piruvat dan asam amino ditambahkan untuk membantu transformasi inti (Sirard and Blondin, 1996). Penambahan serum pada media akan memicu tingkat perkembangan oosit secara in
vitro. Serum yang sering digunakan antara lain Bovine Serum Albumin (BSA), Fetal Calf Serum (FCS), Fetal Bovine Serum (FBS).
Tang et al., (1995) mengungkapkan, media pematangan tanpa serum menyebabkan produksi blastosis yang lebih lambat. Disamping itu pada media yang disuplementasikan dengan serum perkembangan oosit lebih banyak dibandingkan medium tanpa serum (Setiadi, 1999). Menurut Gordon (1994) oosit domba yang dikultur pada medium TCM-199 yang disuplementasikan dengan Fetal Bovine Serum (FBS) ternyata mengalami perkembangan embrio lebih baik dibandingkan dengan oosit yang dikultur TCM-199 tanpa serum. Penambahan kombinasi antara Pregnant
Mare Serum Gonadrotropin (PMSG) dan Human Chorionic Gonadrotropin (hCG),
PMSG dan estradiol atau hCG dan estradiol pada media akan mengahsilkan ekspansi kimulus yang maksimal.
12 Fertilisasi Oosit secara In Vitro ( In Vitro Fertilization, IVF)
Dalam penerapan teknologi fertilisasi in vitro diperlukan oosit yang matang sehingga oosit yang berhasil dikoleksi harus melalui suatu tahap pematangan in vitro. Hasil penelitian yang dilakukan Handarini et al. (2014) menyebutkan bahwa oosit yang dikoleksi dari ovarium pada fase luteal mampu berkembang lebih baik dibandingkan oosit yang diperoleh pada fase folikuler. Hal tersebut disebabkan karena pada fase luteal terdapat korpus luteum yang akan menghasilkan oosit yang matang lebih banyak dengan adanya sekresi hormon progesteron yang dapat menghambat sekresi FSH dan LH sehingga oosit mengalami pematangan yang optimum.
Fertilisasi merupakan proses kompleks yang menghasilkan penggabungan dua gamet, penataan ulang jumlah kromosom dan dimulainya perkembangan individu baru. Proses fertilisasi ini hanya dapat terjadi setelah didahului proses kapasitasi spermatozoa (Gordon, 2003).
Proses fertilisasi in vitro meliputi pengambilan oosit dari folikel ovarium, maturasi oosit, kapasitasi sperma, fertilisasi in vitro, dan kultur oosit yang sudah difertilisasi untuk menjadi embrio (Boediono et al., 2000).
Keberhasilan FIV dipengaruhi oleh beberapa faktor antara lain kualitas oosit bangsa sapi (Bilodeau dan Panich, 2002). Kualitas oosit ditentukan berdasarkan kompleks lapisan kumulus oophorus (cumulus oocyte complex) yaitu sel-sel granulosa yang mengelilingi oosit dalam kondisi utuh (padat) atau tidak. Kualitas oosit dengan ekspansi optimal massa kumulus menyediakan faktor esensial selama proses maturasi, menjaga oosit dan berperan selama tahapan pembelahan meiosis serta mendukung maturasi sitoplasma (Adifa et al., 2010).
13 Pada saat fertilisasi in vitro dan perkembangan embrio, sel kumulus memberikan pengaruh positif. Tingkat pembelahan dan perkembangan embrio lebih rendah ketika oosit dibebaskan dari sel cumulus, namun tidak diikuti tingginya tingkat pembelahan dan perkembangan selanjutnya (Nandi et al., 1998). Sel-sel kumulus mampu meningkatkan area kontak antara spermatozoa dan oosit (Cox et al., 1993) dan dengan memilih subpopulasi sperma yang mampu berinteraksi dengan oosit (Gasparrini, 2002).
Insulin Transferrin Selenium (ITS)
Insulin Transferin Selenium (ITS) merupakan suplemen media dalam maturasi
in vitro yang dapat menekan pengaruh senyawa radikal bebas yang memicu lingkungan oksidatif. Tiga komponen yang dimiliki ITS adalah Insulin, Transferrin dan Selenium yang bekerja bersama dalam perbaikan sel dan saling berkaitan (Kurzawa et al., 2002). Transferrin dan Selenium, yang terkandung dalam ITS, membantu dalam pertumbuhan sel menjadi lebih baik karena Transferrin berperan sebagai protein transport zat besi ke dalam sel serta dapat mengoptimalkan pertumbuhan sel melalui proses detoksifikasi terhadap peroksidase dan radikal bebas dalam medium (Djuwita et al., 2012; Das et al., 2013).
Insulin Transferrin Selenium (ITS) bersama telah digunakan pada berbagai
program maturasi in vitro untuk mendukung pematangan oosit secara in vitro (Kim, 2008). Raghu (2002) menunjukkan bahwa penambahan Follice Stimulating Hormone (FSH) dan Epidermal Growth Factor (EGF) pada media kultur meningkatkan jumlah oosit yang matang, hasil panen tertinggi pada tahap blastosis pada media berisi EGF dan ITS. Insulin Transferrin Selenium (ITS) dalam medium pematangan oosit dapat meningkatkan jumlah oosit matang. Maturasi oosit turut dipengaruhi oleh peran
14 kalsium intraseluler. Aktivitas kalsium intraseluler yang tinggi merupakan salah satu penanda oosit berada pada Metafase II (M II) atau oosit telah matang dan siap untuk fertilisasi. Dengan penambahan FSH dan LH atau insulin pada media kultur dihasilkan oosit dengan M-II mencapai 90% (Djati, 1999). Penambahan hormon gonadotropin, ITS dan EGF ke kultur mempunyai peningkatan rata-rata kesuksesan pada pematangan oosit tikus (Gao et al., 2007). ITS digunakan sebagai suplemen pada pengkulturan oosit tikus (De La Fuente et al., 1999), kambing (Herrick et al,. 2004), dan babi (Jeong et al., 2008).
Suplementasi ITS pada medium maturasi dapat meredam reaksi oksidasi ROS, karena kandungan selenium didalam medium ITS merupakan unsur utama antioksidan gluthathione peroxidase (GSx) dan gluthathione tereduksi (GSH) yang berperan untuk mencegah kerusakan komponen seluler penting yang disebabkan oleh spesies oksigen reaktif seperti radikal bebas dan peroksida (Djuwita et al., 2012).
Selain berperan sebagai antioksidan ITS diketahui mampu meningkatkan daya hidup dan proliferasi sel. Secara umum, insulin-like growth factor-I (IGF-I), IGF-II dan insulin memiliki sekitar 50% susunan asam amino yang homolog dengan pro-insulin. IGF- I merupakan stimulator utama proliferasi seluler, diferensiasi dan perkembangan sel, regulasi proses steroidogenesis oleh sel granulosa dan apoptosis selama perkembangan folikel, tetapi sangat tergantung pada spesies dan tahap pertumbuhan folikel (Cordova et al,. 2010; Kristanti, 2014).
15 METODE PENELITIAN
Waktu dan Tempat
Penelitian telah dilaksanakan pada bulan Mei - Juni 2017 bertempat di Laboratorium Terpadu, Gedung Pusat Kegiatan Penelitian (PKP), Universitas Hasanuddin, Makassar.
Alat dan Bahan Penelitian
Bahan yang digunakan adalah ovarium sapi Bali yang diperoleh dari Rumah Potong Hewan (RPH) Tamangapa, Kota Makassar, provinsi Sulawesi Selatan. Bahan-bahan yang digunakan antara lain medium transportasi ovarium, medium IVF (in
vitro fertilization), medium IVM (in vitro maturation), aceto orcein 2 %, asam asetat
25 %, ethanol absolut, alkohol 70 %, tissue, mineral oil (Sigma Chemical Co. St. Louis MO, USA), Kcl 0,7%, paraffin, aluminium foil, vaselin, dan Insulin
Transferrin Selenium (ITS) dengan konsentrasi berbeda (5 ng/ml, 10 ng/ml dan 15
ng/ml).
Alat yang digunakan adalah inkubator CO2 (pada suhu 37o C, 5% CO2), pipet pasteur, tabung reaksi, mikroskop (ZEISS, image A2 : Axio Cam HRc), Syringe (10 ml), alat sterilisasi (oven dan autoklaf), scalpel, bunsen, water bath, laminar air flow, petri dish (Nunc, diameter 3,5 cm), gelas kimia, labu enlemeyer, freezer, timbangan analitik, kaca objek, kaca penutup, pipet tetes, mikropipet, cawan petri dan gunting bedah.
Rancangan Penelitian
Rancangan penelitian menggunakan metode eksperimental laboratorium berdasarkan Chi Square 2x2 Contigency Table dengan 4 perlakuan yaitu kontrol (0 ng/ml), 5 ng/ml, 10 ng/ml, dan 15 ng/ml masing-masing diulang 4 kali.
16 Prosedur Penelitian
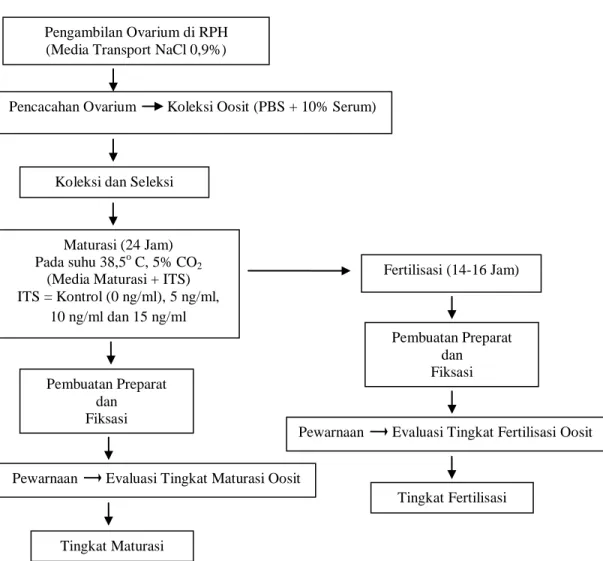
Diagram alir prosedur selama penelitian dapat dilihat pada gambar 3.
Gambar 3. Diagram Alir Prosedur Penelitian
Koleksi Oosit
Ovarium yang diperoleh dari RPH Tamangapa Makassar menggunakan larutan fisiologis NaCl 0.9%/ NaCl terlebih dahulu dibilas dua kali pada NaCl 0.9%. Dish kaca yang telah dicuci dan dikeringkan disiapkan, selanjutnya diisi dengan media untuk mencacah Phosphat Buffered Saline (PBS) secukupnya. Ovarium diletakkan pada dish kaca tersebut, kemudian dicacah. Oosit dikoleksi pada dish yang telah diisi media koleksi (Phosphat Buffered Saline/PBS + 10% Fetal Bovine Serum/FBS).
Pengambilan Ovarium di RPH (Media Transport NaCl 0,9%)
Pencacahan Ovarium Koleksi Oosit (PBS + 10% Serum)
Koleksi dan Seleksi
Maturasi (24 Jam) Pada suhu 38,5o C, 5% CO2
(Media Maturasi + ITS) ITS = Kontrol (0 ng/ml), 5 ng/ml, 10 ng/ml dan 15 ng/ml Fertilisasi (14-16 Jam) Pembuatan Preparat dan Fiksasi
Pewarnaan Evaluasi Tingkat Maturasi Oosit
Pembuatan Preparat dan Fiksasi
Tingkat Maturasi
Pewarnaan Evaluasi Tingkat Fertilisasi Oosit
17 Maturasi Oosit In Vitro
Oosit hasil koleksi dicuci dalam medium maturasi masing-masing dua kali, selanjutnya dilakukan pematangan dalam TCM-199 (Sigma, USA) yang disuplementasikan dengan 0,3% BSA, 10 IU/ml pregnant mare serum gonodrptropin (PMSG) (Intergonan, Intervet Deutschland GmbH), 10 IU/ml human chorionic
gonadrotropin (hCG) (Chorulon, Intervet international B.V. Boxmeer-Holland), 50
µg/ml gentamycin (Sigma, USA), serta penambahan Insulin Transferrin Selenium (ITS) dengan konsentrasi berbeda (kontrol (0 ng/ml), 5 ng/ml, 10 ng/ml dan 15 ng/ml).
Fertilisasi In Vitro
Untuk tahap fertilisasi pertama straw semen beku di thawing pada suhu 37o C selama 20 detik, selanjutnya dimasukkan ke dalam media pencuci spermatozoa yang telah disiapkan kemudian disentrifugasi selama 5 menit pada kecepatan 1800 rpm. Setelah disentrifugasi, supernatant dibuang. Selanjutnya sperma yang mengendap ditambahkan lagi dengan media pencuci yang kedua kemudian disentrifugasi kembali dengan waktu dan kecepatan yang sama. Setelah disentrifugasi, supernatant dibuang dan selanjutnya sperma diencerkan dengan media fertilisasi dan dibuat dalam bentuk drop pada dish fertilisasi. Lapisi menggunakan mineral oil ± 3 ml hingga menutupi seluruh permukaan media fertilisasi tersebut. Oosit yang telah dimaturasi dikeluarkan dari inkubator, selanjutnya diambil dan diletakkan pada media pencuci, kemudian dicuci sebanyak 2 kali. Oosit yang telah dicuci menggunakan media fertilisasi selanjutnya di masukkan ke dalam dish fertilisasi yang telah berisi drop sperma. Selanjutnya dimasukkan ke dalam inkubator selama ≥16 jam.
18 Fiksasi
Setelah ≥16 jam difertilisasi, dish fertilisasi di keluarkan dari inkubator. Oosit yang telah difertilisasi kemudian dikeluarkan dan dicuci tiga kali (diusahakan semua sperma tidak ada yang ikut dan sel-sel cumulus yang mengelilingi oosit disisakan hanya sedikit). Oosit yang telah difertilisasi dan dicuci kembali 2 – 3 kali kemudian pindahkan untuk menjadi preparat dan rekatkan objek glass dan cover glass menggunakan vaselin (perekat). Fiksasi menggunakan etanol (3) : asam asetat (1) selama 3 hari. Kemudian preparat dibilas menggunakan etanol absolut selama 1 jam.
Pewarnaan Sel
Sebelum diwarnai, preparat dikeringkan menggunakan tissue. Lalu warnai menggunakan aseto orcein 2% kemudian bilas kembali dengan asam asetat 25%. Oosit diperiksa di bawah mikroskop inverted untuk diamati.
Parameter yang diamati
Parameter yang diamati dalam penelitian ini yaitu tingkat maturasi oosit dan tingkat fertilisasi.
1. Tingkat maturasi oosit, meliputi (Syamsuddin, 2014) :
a. Fase germinal vesicle (GV) ditandai dengan adanya membran inti dan nukleolus terlihat jelas ditepi;
b. Fase germinal vesicle breaking down (GVBD) ditandai dengan robeknya membran inti sehingga nukleolus tidak terlihat jelas;
c. Fase metaphase-I (M-I) ditandai dengan adanya kromosom homolog yang berpasangan dan berderet di bidang equator;
19 d. Fase metaphase-II (M-II) ditandai adanya badan kutub I dan susunan
kromosom yang sama dengan tahap M-I, fase anaphase dan telofase. Tingkat maturasi oosit dapat dihitung berdasarkan rumus dibawah ini :
Tingkat maturasi = X 100%
2. Tingkat fertilisasi, meliputi (Syaiful et al., 2011) :
a. Oosit terfragmentasi atau oosit yang tidak mencapai perkembangan metafase II (0 PN);
b. Oosit yang mempunyai 1 pronukleus (1 PN) yang hanya terdiri atas pronukleus betina;
c. Oosit yang mempunyai 2 pronukleus (2 PN) yang terdiri atas pronukleus jantan serta betina;
d. Oosit terfertilisasi yang memiliki dua atau lebih pronukleus (>2 PN). Tingkat fertilisasi in vitro dapat dihitung berdasarkan rumus dibawah ini :
Tingkat fertilisasi = X 100%
Analisis Data
Tingkat kematangan dan fertilisasi oosit dianalisis dengan Chi Square 2x2
Contingency Table dengan rumus sebagai berikut :
[ ] PERLAKUAN X Y ITS 1 A B A+B ITS 2 C D C+D A+C B+D A+B+C+D=E
20 HASIL DAN PEMBAHASAN
Tingkat Maturasi Oosit Sapi Bali dengan Penambahan Insulin Transferrin Selenium (ITS) Pada Media Maturasi yang Berbeda
Hasil pengamatan tingkat maturasi dengan penambahan Inaulin Transferrin
Selenium (ITS) pada media maturasi yang berbeda disajikan pada Tabel 1.
Tabel 1. Tingkat tahapan maturasi oosit pada berbagai perlakuan Perlakuan Jumlah
oosit
Tingkat Pematangan Inti (%)
GV GVBD M-I M-II
P0 36 (0.0) (5.6) (22.2) (72.2)
P1 26 (0.0) (0.0) (19.2) (80.8)
P2 34 (11.8) (8.9) (17.6) (61.7)
P3 32 (6.2) (15.6) (18.8) (59.4)
Keterangan : P0 (Kontrol, tanpa ITS), P1 (penambahan ITS 5 ng/ml pada media maturasi), P2 (penambahan ITS 10 ng/ml pada media maturasi), P3 (penambahan ITS 15 ng/ml pada media). GV: germinal vesicle, GVBD: germinal vesicle break
down, M–I: metaphase I, M–II: metaphase II.
Hasil analisis Chi Square 2X2 Contingency table menunjukkan bahwa penambahan ITS pada oosit tidak berpengaruh nyata (P>0.05) terhadap tingkat maturasi oosit. Namun demikian, pada penambahan ITS 5 ng/ml kedalam media maturasi pada penelitian ini cenderung memiliki tingkat maturasi lebih tinggi dibandingkan dengan penambahan ITS 10 ng/ml dan 15 ng/ml. Hal ini berarti bahwa dengan penambahan ITS sebesar 5 ng/ml kedalam media maturasi sudah cukup untuk meningkatkan tingkat maturasi oosit dan mendukung perkembangan oosit mencapai tahap MII.
Pada proses pematangan oosit, tahap Germinal Vesicle (GV) tingkat kematangan oosit yang tertinggi pada oosit P2 (11.8%) kemudian oosit P3 (6.2%) sedangkan pada P0 dan P1 tidak terlihat pada tahap Germinal Vesicle (GV). Pada tingkat Germinal Vesicle Dreak Down (GVBD) oosit yang tertinggi pada oosit P3 (15.6%), kemudian P2 (8.9%) lalu P0 (5.5%), sedangkan untuk P1 tidak terlihat. Pada tahap M-1 (methapase-I) persentase tingkat kematangan oosit tertinggi terlihat
21 pada oosit P0 (22.2%) kemudian P3 (18.8%), lalu P2 (17.6%) dan P1 (9.2%). Pada tahap M-II (methapase-II) tingkat kematangan tertinggi terlihat pada oosit P1 yaitu mencapai 80.9% kemudian oosit P0 (72.2%), P2 (61.7%) dan P3 (59.4%).
Pada proses penambahan ITS pada media maturasi terlihat bahwa P1 lebih respon terhadap peran ITS dalam mendukung pematangan oosit secara in vitro sampai tahap M-II, sedangkan P2 dan P3 proses pematangan lambat diindikasikan karena adanya oosit pada tahap GV dan GVBD.
Jumlah oosit yang digunakan tiap perlakuan adalah 40 oosit, tetapi pada saat pengamatan ada beberapa oosit yang hilang dimana pada P0 jumlah oosit tersisa 36, P1 (26 oosit), P2 (34 oosit), dan P3 (32 oosit). Hal ini mungkin disebabkan oleh cover glass pada saat fiksasi tidak tertekan dengan baik sehingga pada saat pewarnaan sel terjadi kehilangan oosit.
Kecenderungan perbedaan presentase maturasi oosit tersebut menunjukkan bahwa suplementasi ITS pada media maturasi memiliki pengaruh terhadap pematangan oosit dan dapat dijadikan sebagai indikator peningkatan daya hidup sel, dengan meningkatnya oosit sampai tahap M-II. Hal ini berarti bahwa dengan suplementasi ITS 5 ng/ml kedalam media maturasi dapat menekan angka apoptosis.
Suplementasi ITS pada medium maturasi dapat meredam reaksi oksidasi ROS, karena kandungan selenium didalam medium ITS merupakan unsur utama antioksidan gluthathione peroxidase (GSx) dan gluthathione tereduksi (GSH) yang berperan untuk mencegah kerusakan komponen seluler penting yang disebabkan oleh spesies oksigen reaktif seperti radikal bebas dan peroksida (Djuwita et al., 2012).
Keadaan sitoplasma oosit sangat mendukung penyebaran organel dan interaksi antar organel yang lain, demikian pula dengan keberadaan sel kumulus yang kompak yang dapat mendukung pematangan oosit melalui zat metabolit yang
22 dihasilkan dan disekresikan melalui mekanisme gap junction ke sel oosit (De Loos et
al. 1989).
Pada penelitian ini hanya oosit yang mempunyai kumulus kompleks (kategori A dan B), yang digunakan dalam proses pematangan in vitro (Gambar 2). Menurut Loos et al., (1989) bahwa oosit yang termasuk baik adalah sel kumulus kompak, berlapis-lapis dan rapat, ooplasma yang homogeny, COC (Cumulus Oocyte
Complexe) total terang dan transparan. Keberadaan sel kumulus mendukung
terjadinya pematangan oosit secara in vitro sampai tahap M-II dan berkaitan dengan pematangan sitoplasma menurut Lapthitis et al., (2002). Hal tersebut didukung oleh Schroeter and Meinecke (1995) bahwa saat pematangan in vivo, sel-sel kumulus berperan dalam menyediakan nutrisi untuk oosit dan membantu sintesa protein untuk membentuk zona pelusida pada tahap profase. Sel telur tanpa kumulus, setelah dimaturasi banyak protein yang hilang sedangkan pada sel telur dengan kumulus yang intak, protein akan bertahan.
Selama pematangan in vitro pada oosit sapi keberadaan sel kumulus yang mengelilingi oosit tersebut sangat membantu sampai pada perkembangan blastosis (Boediono dan Suzuki, 1996).
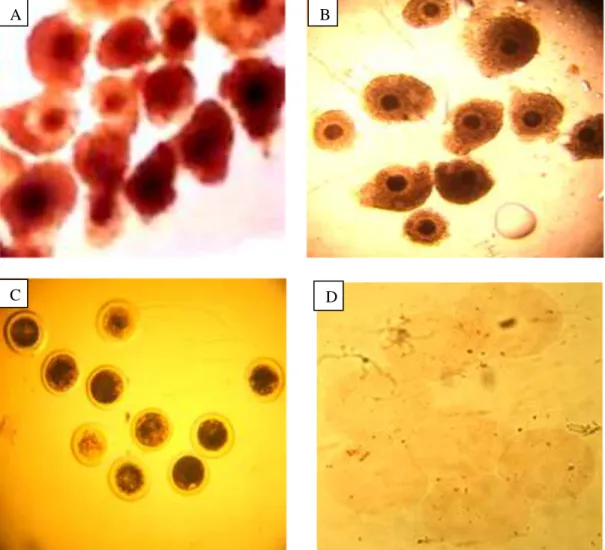
Hasil pengamatan pada oosit sapi Bali mulai dari oosit yang belum dimaturasi hingga oosit setelah pewarnaan dengan berbagai tingkat pematangan inti dapat dilihat pada Gambar 4 dan Gambar 5.
23
Gambar 4. Perbahan gambar oosit berdasarkan tahapan dalam penelitian
Keterangan : A : Oosit sebelum maturasi, B : Oosit setelah maturasi, C : Oosit setelah denudasi, D : Oosit setelah pewarnaan
Faktor yang dapat mendukung keberhasilan tingkat pematangan inti oosit menurut Zheng and Sirard (1992) adalah terjadinya ekspansi sel-sel kumulus pematangan inti yang mencapai M-II dan pematangan sitoplasma. Menurut Moltik and Fulka (1976) bahwa sel-sel cumulus yang mengelilingi oosit akan melebar dan berwarna cerah. Oosit telah mencapai pematangan yang maksimal dan siap untuk difertilisasi jika telah mencapai tahap M-II pada proses pembelahan secara meiosis (Gambar 5).
A B
24 Gambar 5. Tingkat maturasi oosit
Keterangan : Status inti oosit setelah pematangan in vitro. Tanda panah menunjukkan status inti pada tahap : A. Oosit tahap
germinalvesicle; B. Oosit tahap germinal vesicle break down;
C . Oosit tahap metaphase-I; D . Oosit matang tahap
metaphase-II
Proses meiosis diawali dengan tahap GV yaitu ditandai dengan membrane inti jelas dan nekloulus berbentuk cincin berwarna jelas kemudian dilanjutkan dengan pecahnya stadium inti atau GVBD, nekloulus menghilang dan badan kutub satu telah berbentuk (Tsafriri, 1985), sedangkan pematangan stoplasma meliputi penambahan
D A B C GV GVBD M-II M-I
25 butir-butir kuning telur didalam sitoplasma, pembentukan selubung zona pelusida, serta pembentukan granul-granul kortek (Djuwita et al., 2000).
Tingkat Fertilisasi Oosit Sapi Bali dengan Penambahan Insulin Transferrin Selenium (ITS) yang Berbeda
Hasil pengamatan tingkat fertilisasi dengan penambahan Insulin Transferrin
Selenium (ITS) yang berbeda disajikan pada Tabel 2.
Tabel 2. Tingkat tahapan fertilisasi oosit pada berbagai perlakuan Perlakuan Jumlah oosit Pembentukan Pronukleus (%) 0 PN 1 PN 2 PN >2 PN Tingkat Fertilisasi P0 36 (72.2) (5.6) (8.3) (13.9) (22.2) P1 26 (50.0) (7.7) (23.0) (19.3) (42.3) P2 34 (55.9) (5.9) (20.6) (17.6) (38.2) P3 32 (50.0) (6.2) (15.6) (28.2) (43.8)
Keterangan : P0 (Kontrol, tanpa ITS), P1 (penambahan ITS 5 ng/ml pada media maturasi), P2 (penambahan ITS 10 ng/ml pada media maturasi), P3 (penambahan ITS 15 ng/ml pada media). 0 PN: 0 pronukleus, 1 PN: 1 pronukleus, 2 PN: 2
pronukleus, >2 PN: lebih dari 2 pronukleus, tingkat fertilisasi: gabungan 2 PN
dan >2 PN.
Hasil analisis Chi Square 2X2 Contingency table menunjukkan bahwa pengaruh penambahan ITS pada oosit tidak berpengaruh nyata (P>0.05) terhadap tingkat fertilisasi oosit. Namun demikian dengan penambahan ITS 15 ng/ml tingkat fertilisasinya cenderung lebih tinggi dibandingkan dengan penambahan 5 ng/ml dan 10 ng/ml. Hal ini berarti bahwa dengan penambahan ITS sebesar 15 ng/ml dapat meningkatkan tingkat fertilisasi oosit dan lebih baik dibandingkan dengan perlakuan lainnya. Hasil penelitian Rusiyantono et al., (2000) mendapatkan nilai sebesar 65,4% dalam media TCM 199+ESS, sedangkan Djuwita et al., (1995) mendapatkan nilai sebesar 31,7% dalam media TCM 199+ewe fetal serum (EFS) dan 25,6% dalam media TCM 199 + FCS.
26 Sementara itu, peran ITS untuk P2 dan P0 dan yang tidak diberikan ITS (kontrol) tingkat maturasinya lebih tinggi namun tingkat fertilisasinya rendah. Hal ini diduga berkaitan dengan peran ITS yang dapat mengoptimalkan pertumbuhan sel lebih baik pada saat di fertilisasi. Lebih lanjut juga diduga rendahnya tingkat fertilisasi pada medium P2 yang di suplementasi dengan ITS atau tanpa penambahan ITS mengakibatkan perbedaan metabolisme protein yang diperlukan untuk meningkatkan kompetensi oosit (Orsi dan Leese 2004).
Kegagalan fertilisasi ditandai dengan adanya satu pronukleus dan pada penelitian ini bervariasi antara 5.6%-7.7% (Tabel 2). Kegagalan fertilisasi dipengaruhi oleh beberapa faktor antara lain: (1) tingkat maturasi oosit baik inti maupun sitoplasma tidak sempurna (Moore dan Trounson disitasi oleh Boediono et
al., 2000), (2) kemampuan spermatozoa membuahi oosit kurang optimal akibat
kapasitasi dan reaksi akrosom kurang memadai dan (3) kegagalan spermatozoa mengalami kondensasi dalam sitoplasma oosit sehingga menyebabkan kegagalan pembentukan pronukleus jantan (Crozet et al., 1995). Kejadian polispermi pada penelitian ini bervariasi antara 13.9-28.2% (Tabel 2). Kejadian polispermi kemungkinan disebabkan oleh berbagai faktor antara lain konsentrasi spermatozoa (Nadir et al., 1993; Long et al., 1994), lama waktu inkubasi spermatozoa dan oosit (Saeki et al., disitasi oleh Long et al., 1994) dan tidak sempurnanya blokade vitelin (Dandekar dan Talbot, 1992).
Faktor lain yang juga mempengaruhi kemampuan fertilisasi in vitro adalah dihasilkannya ROS. Spermatozoa mati menghasilkan ROS menyebabkan peroksidasi membran lipid, mengurangi fluiditas membran dan fungsi sperma. ROS yang tinggi
27 merusak metabolisme spermatozoa pada media fertilisasi in vitro Kim et al., (2002) mengatakan ROS meningkat di bawah kondisi in vitro yang menggunakan 5% CO2.
Oosit yang terfertilisasi dicirikan dengan terbentuknya PN (gambar 4). Oosit yang telah melalui proses maturasi selama 24 jam kemudian difertilisasi selama 18 jam di dalam inkubator dengan CO2 dan suhu yang sama saat dimaturasi. Sebelum proses fertilisasi, sperma beku terlebih dahulu di thawing dan diencerkan pada media fertilisasi.
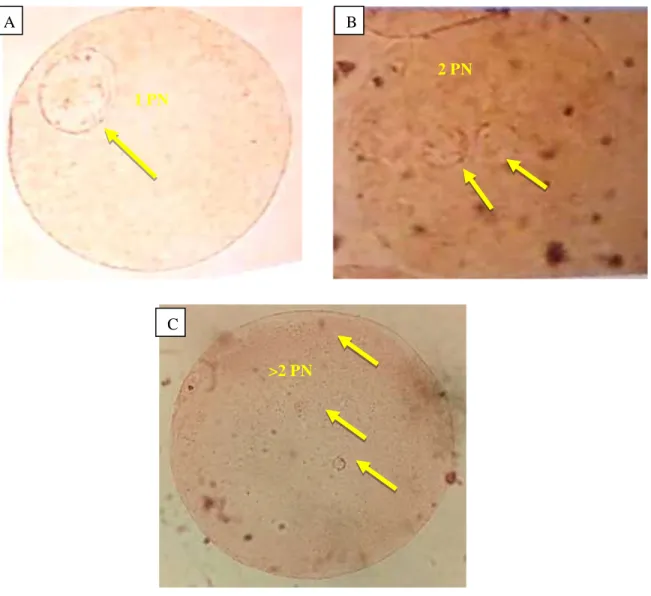
Gambar 6. Tingkat pembentukan pronukleus
Keterangan : A : Oosit tahap 1 pronukleus, B : Oosit fertil tahap 2 pronukleus, C : Oosit fertil tahap >2 pronukleus B A C 1 PN 2 PN >2 PN
28 Fertilisasi atau pembuahan secara in vitro melibatkan penetrasi ovum oleh spermatozoa, aktivitas ovum, pembentukan pronukleus jantan dan betina serta pertautan kromosommaternal paternal membentuk genom (Elder dan Dale, 2011). Tingkat fertilisasi adalah jumlah oosit yang mempunyai 2 pronukleus (2PN) yaitu jantan dan betina.
Tabel 3. Perhitungan tingkat tahapan maturasi dan fertilisasi oosit pada berbagai perlakuan Perlakuan Jumlah oosit Tingkat Pematangan Inti Pembentukan Pronukleus (%) Total M-II Tingkat Fertilisasi (M-IIxTingkat Fertilisasi: 100%) P0 36 (72.2) (22.2) (16.02) P1 26 (80.8) (42.3) (34.17) P2 34 (61.7) (38.2) (23.56 P3 32 (59.4) (43.8) (26.01)
Keterangan : P0 (Kontrol, tanpa ITS), P1 (penambahan ITS 5 ng/ml pada media maturasi), P2 (penambahan ITS 10 ng/ml pada media maturasi), P3 (penambahan ITS 15 ng/ml pada media). M-II: metaphase II, tingkat fertilisasi : gabungan 2 pn dan >2PN.
Berdasarkan persentase tingkat maturasi dan fertilisasi oosit bahwa perlakuan
yang terbaik adalah perlakuan yang menghasilkan nilai tinggi dari perkalian tingkat
maturasi dan tingkat fertilisasi. Dalam hal ini adalah P1 yang menghasilkan nilai
29 KESIMPULAN DAN SARAN
Kesimpulan
Penambahan Insulin Transferrin Selenium (ITS) pada medium sebanyak 5 – 15 ng/ml tidak berpengaruh nyata terhadap tingkat maturasi dan fertilisasi oosit sapi Bali
secara in vitro.
Saran
Sebaiknya ada kajian ilmiah lebih lanjut untuk mengetahui pengaruh penambahan Insulin Transferrin Selenium (ITS) pada medium terhadap tingkat maturasi dan fertilisasi oosit sapi Bali secara in vitro.
30 DAFTAR PUSTAKA
Adifa, N. S., P. Astuti, dan T. D. Widayati. 2010. Pengaruh penambahan chorionic gonadotrophin pada medium maturasi terhadap kemampuan maturasi, fertilisasi, dan perkembangan embrio secara in vitro kambing peranakan ettawa. Buletin Peternakan 34: 8-15.
Austin, C.R. and R. V. Short. 1982. Reproduction in Mammals. Book I. University Press. Cambridge. 103.
Ball GD, Leibfreid ML, Lenz RW Ax, Bavister BD and First NL. 1984. Factors Affecting Succesfull In Vitro Fertilization of Bovine Follicular Oocyte.
Biol. Reprod. 28: 717-725.
Bearden, J.H., J.W. Fuquay, and S.T. Willard. 2004. Applied Animal Reproduction. 6th Ed. Pearson Education, Inc., Upper Saddle River. New Jersey.
Bilodeau-Goeseels, S., and P. Panich. 2002. Effects of oocyte quality on development and transcriptional activity in early bovine embryos. Anim. Reprod. Sci. 71:143-155.
Boediono A and Suzuki T. 1996. In Vitro Development of Holste in and Japanese Black Breeds Embryo. Media Veteriner 3: 3-9.
Boediono A, Rusiyantono Y, Mohamad K, Djuwita I, Harliatien. 2000. Developmental competence of caprine oocyte after in vitro maturation, fertilization and culture. Media Veteriner. 7 (4): 11-17.
Campbell, N.A., Reece J. B., and Mitchel L. G. 2000. Biologi. Wasmen Manali. Erlangga. Jakarta.
Cetica PD, LN. Pintos LN, GC. Dalvit GC, MT. Beconi MT. 2001. Antioxidant enzyme activity and oxidative stress in bovine oocyte in vitro maturation (Abstact). CNBI Jan; 51 (1): 57-64. http://www.ncbi.nlm.nih.gov diakses pada 28 Januari 2017.
Córdova, B., R. Morató, D. Izquierdo, T. Paramio and T. Mogas. 2010. Effect of The Addition of Insulin-Transferrin-Selenium and/or L-Ascorbic Acid to The In Vitro Maturation of Prepubertal Bovine Oocytes on Cytoplasmic Maturation and Embryo Development. Theriogenology. 74:1341-1348. Cox JF, Hormazabal J, Santa Maria A. 1993. Effect of cumulus on in vitro
fertilization of bovine matured oocytes. Theriogenology 40:1259-1267. Crozet, N., M.A. Ali and M.P. Dubos. 1995. Developmental competence of goat
oocytes from follicles of different size categories following maturation, fertilization and culture in vitro. J. Reprod. Fertil. 103: 293-298.
31 Dalvit, G., SP. Lianes, A. Descalzo, M. Insane, M. Beconi, P. Cetica. 2005. Effect of alpha- tocopherol and ascorbic acid on bovine oocyte in vitro maturation. Reprod Domest Anim 40: 93-97
Dandekar, P. and P. Talbot. 1992. Perivitelline space of mammalian oocytes extra-cellular matrix of unfertilized oocytes and formation of a cortical granule envelope following fertilization. Mol. Reprod. Develop. 31: 135- 143. Das, Z.C., M.K. Gupta, S.J. Uhm and H.T. Lee. 2013. Supplementation of Insulin
Transferrin Selenium to Embryo Culture Medium Improves the in Vitro Development of Pig Embryos. Cambridge Journals Online [Abstract] 18 :1-8.
Demeestere, I., Centner, J., Gervy, C., Englert, Y., Delbaere, A. 2005. Impact of Various Endocrine and Paracrine Factors on In Vitro Culture of Preantral Follicle in Rodents. J.Repro. 130: 147-156.
De La Fuente, R., M.J. O’Brien and J.J. Eppig. 1999. Epidermal growth factor enhances preimplantation developmentalbcompetence of maturing mouse oocytes. Hum. Reprod. 14, 3060-8.
De Loos FD, Vliet CV, Maurik PV, Kruip ThAM. 1989. Morphology of immature bovine oocytes. Gamete Res 24: 197-204.
Djati, M.S. 1999. Optimalisasi Proses IVF dengan Suplementasi PMSG dan HCG serta Efisiensi Kultur Klon Embrio Sapi IGF-1. Disertasi. IPB. Bogor Djuwita I, Boediono A dan Mohammad K. 2000. Bahan Kuliah Embriology. Bogor:
Laboratorium Embriologi Bagian Anatomi FKH IPB. Pp: 10: 1-8.
Djuwita, I., B. Purwantara, M. Fahrudin and Y. Sukra. 1995. The effect of superovulated cow serum on in vitro maturation and fertilization in sheep. Symp. Biotechnol. Anim. Reprod. Bogor, 1 Agustus 1995. Faculty of Veterinary Medicine, Bogor Agricultural Institute. Bogor: 20-22.
Djuwita, I., Riyacumala, V., Mohamad, K., Prasetyaningtijas, WE., dan Nurhidayat. 2012. Pertumbuhan dan Sekresi Protein Hasil Kultur Primer Sel-sel Serebrum Anak Tikus. Jurnal Veteriner. 13(2):125-135.
Elder, K,and B. Dale. 2011. In Vitro Fertilzation, (ed) 3th.Cambridge University Press. Pp 50-81.
First NL, Lorraine and Florman HM. 1989. The Mollicular Biology of The Mamalian
Oocyte Fertilization. London: Academic Pr. Pp: 259-288.
Gao, Min-zhi, Yu-bao Wang and Xiao-yun Wu. 2007. In Vitro Maturation of Immature Oocyte from Preantral Follicles in Prepubertas Mice. Journal of
32 Gasparrini B. 2002. In vitro embryo production in buffalo species: State of the art.
Theriogenology 57:237-256.
Gordon, I. 1994. Laboratory Production of Cattle Embrios. Biotechnology in Agricultural Series. CAB. International.
Gordon, I. 1997. Controlled reproduction in sheep and goats. Cambridge: CAB International. pp 53-85.
Gordon, I. 2003. Laboratory production of cattle embryos. Dublin: CAB International. pp 30-142; 277-290.
Gutteridge, J.M., 1986. Antioxidant properties of the proteins caeruloplasmin, albumin and transferring. A study of their activity in serum and synovial fluid from patients with rheumatoid arthritis. Biochim. Biophys. Acta 869, 119-127.
Hafez, E.S.E., dan B. Hafez. 2000. Folliculogenesis, egg maturation and ovulation. In: Hafez B and Hafez ESE. Reproduction in Farm Animals. 7th Ed. Philadelphia: Lea and Febiger. pp 68-81.
Hafez B, Hafez ESE. 2000. Reproduction in Farm Animal. Hafez B, Hafez ESE, editor. Ed-7. USA: Lippincott Williams & Wilkins.
Handarini, R., D. Sudrajat dan D. Hardiansyah. 2014. Kualitas oosit dari ovarium sapi peranakan ongole (PO) pada fase folikuler dan luteal. Jurnal
Pertanian 5 (2): 89-94.
Hardjopranjoto, S. 1995. Ilmu Kemajiran Pada Ternak. Airlangga University Press. Surabaya.
Herrick, J.R., E. Behboodi, E. Memili, S. Blash, Y. Echelard and R.L. Krisher. 2004. Effect of macromolecule supplementation during in vitro maturation of goat oocytes on developmental potential. Mol. Reprod. Dev. 69, 338-46. Jeong, Y.W., M.S. Hossein, D.P. Bhandari, Y.W. Kim, J.H. Kim, S.W. Park, E. Lee,
S.M. Park, Y.I. Jeong, J.Y. Lee, S. Kimand W.S. Hwang. 2008. Effects of insulin-transferrin-selenium in defined and porcine follivular fluid upplemented IVM media on porcide IVF and SCNT embryo production.
Anim. Reprod. Sci. 106, 13-24.
Kim, B., Sang, C., Kwang, S., Bok, K., Chang-Hee, H., Jong-Heung, K., Chae-Sik, L., 2002, Effect of Medium Milieu on Sperm Penetration and Pronuclear Formation of Bovine Oocytes Matured In vitro. Theriogenology. 57: 2093–2104.
Kim S, Lee GS, Lee SH, Kim HS, Jeong YW, Kim JH, Kang SK, Lee BC, Hwang WS. 2005. Embryotropic effect of insulin-like growth factor (IGF)-I and
33 its receptor on development of porcine preimplantation embryos produced by in vitro fertilization and somatic cell nuclear transfer. Mol Reprod
Dev. 72: 88-97.
Kurzawa, R., W. Głabowski, T. Baczkowski , and P. Brelik. 2002. Evaluation of Mouse Preimplantation Embryos Exposed to Oxidative Stress Cultured with Insulin-Like Growth Factor I and II, Epidermal Growth Factor, Insulin, Transferrin and Selenium. [Abstract]. Reproductive Biology 2(2) : 143-162.
Kristanti, C. 2014. Efek Suplementasi Insulin Transferin Selenium (ITS) Pada Media Pembekuan Embrio Tahap Morula Terhadap Persentase Perkembangan Embrio Tahap Blastula [Skripsi]. Fakultas Kedokteran Hewan Universitas Airlangga Surabaya.
Lapathihis G, Miksik I, Pavlok A, and Moltik J. 2002. Improvement of In Vitro Maturation System for Bovine Oocytes and Intracelluler Glutathione Content. http://www.iapg.cas.cz/uzfg/u2.htm. (25 Juni 2017).
Lee, MS., SK. Kang, B.C. Lee, W.S. Hwang.2005. The beneficial effects of insulin and metformin on in vitro developmental potential of porcine oocytes and embryos. J. Biol Reprod 73: 1264-1268.
Long, C.R., P. Damiani, C.P. Correia, R.A. Maclean, R.T. Duby and J.M. Robl. 1994. Morphology and subsequent development in culture of bovine oocytes matured in vitro under various conditions of fertilization. J. Reprod. Fertil. 102: 361-369.
Loos de F, Vliet CV., Maurik VP and Kruip ThAM. 1989. Morphology of Immature Bovine Oocyte. Gamete Res. 24: 197-204.
Lu KH, Gordon I, Chen HB, Gallagher M and Mc Govern H. 1998. Birth of Twins After Transfer of Cattel Embrio Produced by In Vitro Techniques. Vet.
Rec. 36: 125-132.
Nadir, S., R.G. Saacke, J. Bame, J. Mullins and S. Degelos. 1993. Effect of freezing semen and dosage of sperm on number of accesory sperm, fertility and embryo quality in artificially inseminated cattle. J. Anim. Sci. 71: 199-204.
Nandi S. Chauhan MS, Palta P. 1998. Effect of cumulus cells and sperm concentration on cleavage rate and subsequent embryonic development of buffalo (Bubalus Bubalis) oocytes matured and fertilized in vitro.
34
Orsi NM, Leese HJ. 2004. Amino acid metabolism of preimplantation bovine embryos cultured with bovine serum albumin or polyvinyl alcohol.
Theriogenology. 61:561-572.
Rasby,R.andR.Vinton.2001.Theestrouscycle.http://beef.unl.edu/learning/estrous. Shtm.
Raghu, HM, Nandi S., Reddy SM. 2002. Effect of insulin, transferring and selenium and epidermal growth factor on developments of buffalo oocytes to blastocyts stage in vitro in serum-free, semidefined media. Vet. Rec. 151 (9): 260-5.
Rusiyantono, Y., I. Djuwita, B. Purwantara dan Y. Sukra. 2000. The influence of ewe serum on in vitro oocyte maturation and early development of ovine embryos. Media Vet. 7: 13-16.
Schatten H, Gheorghe M. 2007. Comparative Reproductive Biology. Blackwell Publishing. USA
Schroeter D dan Meinecke B.1995. Comparative Analysis of The Polipeptide Patern of Cumulus Cell During Maturation of Porcine Cumulus Oocyte Complexes In Vivo and In Vitro. Reprod. Nutr. Dev. 35: 85-94.
Setiadi MA, 1999. Kapasitas Perkembangan Oosit Babi yang Dimatangkan Secara
In Vitro pada Medium Tanpa Suplemen Serum. Prosiding Seminar
Nasional Peternakan dan Veteriner. 292-296.
Sirard MA and Blondin P. 1996. Oocyte maturation and IVF in cattle. Anim. Reprod. Sci. 442:417-426.
Sonjaya, H. 2005. Materi Mata Kuliah Ilmu Reproduksi Ternak. Fakultas Peternakan Universitas Hasanuddin, Makassar.
Souza, C.J.H., B.K. Campbell, D.T. Baird. 1998. Follicular waves and concentrations of steroid and inhibin A in ovarian venous blood during the luteal phase of the oestrous cycle in ewes with an ovarian autotransplant. J. Endocrinology 156: 563-572.
Steel, R.G.D., dan J.H. Torrie 1991. Prinsip dan Prosedur Statistika. Edisi 2. Gramedia. Jakarta.
Tang M, Vanderhyden BC and Armstrong DT. 1995. Role of Cumulus Cell and Serum on The In Vitro Maturation, Fertilization and Subsequent Development of Rat Oocytes. Biol. Reprod. 40: 720-728.
Toelihere, M. R. 1979. Fisiologi Reproduksi pada Ternak. Penerbit Angkasa. Bandung.
35 Tsafriri A. 1985. Oocyte Maturation in Mammals. In: RE Jones, editor. The
Vertebrata Ovary. New York: Plenum Press, pp: 27-37.
Thomas C, Joanna MB. 2002. Clinical Anatomy & Fisiologi for Veterinary technicians.. United State of America: Mosby, Inc
Wahjuningsih, S. M.S. Djati, G. Ciptadi, N. Isnaeni dan Suyadi. 2001. Perkembangan teknologi alternative produksi embrio sapi menggunakan oosit hasil pembekuan. Laporan Penelitian Lemlit Unibraw. Malang.
Winarsi, H. 2007. Antioksidan Alami & Radikal Bebas Potensi dan Aplikasinya dalam Kesehatan. Kanisius. Yogyakarta.
Wu, S.H., oldfield, J.E., Whanger, P.D., Weswig, P.H., 1973. Effect of selenium, vitamin E, and antioxidant on testicular function in rats. Biol. Reprod. 8, 625-629.
Zeng, Y.S. & M.A. Sirard. 1992. The Effect Of Sera, Bovine Serum Albumin And Follicular Cells On In Vitro Maturation And Fertilization Of Porcine Oocytes. Theriogenology 37: 779- 790.