Penelitian dilaksanakan di Laboratorium Fisiologi dan Farmakologi Fakultas Kedokteran Hewan, Kampus Dramaga Institut Pertanian Bogor selama 6 bulan mulai dari bulan Desember 2008 sampai bulan Mei 2009.
Bahan dan Alat Bahan yang digunakan dalam penelitian ini adalah : 1. Hewan coba
Hewan yang digunakan dalam penelitian ini adalah tikus putih jantan (Rattus norvegicus L) strain Sprague-Dawley berumur delapan minggu dengan berat badan ± 200 gr, berasal dari bagian hewan percobaan FKH-IPB.
2. Rokok
Rokok yang digunakan adalah rokok kretek (Gudang garam) dengan kandungan seperti yang terlihat dalam tabel 2.
Tabel 2 Kandungan asap rokok kretek gudang garam menurut Pusat Pengujian Obat dan Makanan Nasional Jakarta
Jenis Rokok Kandungan (mg/batang)
Nikotin CO Tar Eugenol Gudang Garam
Merah 2,76 16,66 45,77 14,70
Penetapan dosis ini ditentukan dengan melakukan percobaan pada 15 ekor tikus jantan yang dibagi menjadi tiga kelompok pemberian dosis yaitu delapan batang rokok per enam puluh menit/hari, enam batang rokok per enam puluh menit/hari dan empat batang rokok per enam puluh menit/hari, pemberian dilakukan selama enam minggu (tiga puluh hari). Hewan yang mati setiap hari dicatat sebagai tolak ukur untuk menentukan LD50. Hasil percobaan tersaji pada (Tabel 3). Pada percobaan ini, kematian tikus terjadi pada kelompok perlakuan pemaparan delapan dan enam batang rokok. Kematian terjadi pada minggu kedua, ketiga dan keempat pada dosis delapan batang rokok dan dosis enam batang rokok terjadi pada minggu ketiga, keempat dan
kelima. Untuk dosis empat batang rokok per enam puluh menit tidak terjadi kematian. Dari hasil tersebut diatas, ditetapkan bahwa pemberian empat batang rokok per enam puluh menit aman. Sehingga dosis pemaparan yang dipakai untuk penelitian selanjutnya adalah empat batang rokok per enam puluh menit/hari.
Tabel 3 Jumlah tikus yang mati pada percobaan pendahuluan penentuan dosis pemaparan asap rokok
Kelompok Pemaparan Letalitas minggu ke-
0 1 2 3 4 5 6 Rokok : 8 batang/60 menit/hari 6 batang/60 menit/hari 4 batang/60 menit/hari 0/5 0/5 1/5 3/5 4/5 4/5 4/5 0/5 0/5 0/5 2/5 3/5 4/5 4/5 0/5 0/5 0/5 0/5 0/5 0/5 0/5 Letalitas : Jumlah hewan yang mati/jumlah hewan uji.
3. Vitamin C
Penetapan dosis ditentukan dengan melakukan percobaan pada lima belas ekor tikus jantan yang dibagi menjadi tiga kelompok pemberian dosis yang biasa digunakan oleh manusia. Adapun dosis tersebut adalah 1500 mg/kg bb/hari, 3000 mg/kg bb/hari dan 4500 mg/kg bb/hari, pemberian selama enam minggu. Sehingga konversi dosis vitamin C yang diberikan untuk tikus mengikuti tabel 3 diatas. Nilai konversi dosis diperoleh dengan rumus : Berat badan tikus (gr) / berat badan manusia (gr) x dosis vitamin C yang diberikan (Hariyatmi 2004).
Tabel 4 Nilai konversi berat badan manusia ke berat badan tikus Dosis Manusia Dosis Tikus
1500 mg/kg/bb/hari 3000 mg/kg/bb/hari 4500 mg/kg/bb/hari 4,27 mg/kg/bb/hari 8,57 mg/kg/bb/hari 12,85 mg/kg/bb/hari
Hasil yang didapatkan adalah jumlah hewan yang mati setiap hari dicatat sebagai tolak ukur untuk menentukan LD50 (Tabel 4). Pada percobaan ini tikus
yang mati adalah tikus yang diberi vitamin C dengan dosis 4500 mg/kg bb/hari untuk manusia atau 12,85 mg/kg bb/hari untuk tikus. Kematian tikus tersebut terjadi pada minggu ketiga dan keempat dengan feases berbentuk cairan. Dengan demikian dosis yang dianggap aman untuk digunakan pada penelitian ini adalah dosis 3000 mg/kg bb/hari untuk manusia atau 8,57 mg/kg bb/hari untuk tikus.
Tabel 5 Jumlah tikus yang mati pada percobaan penentuan dosis vitamin C
Kelompok tikus Letalitas minggu ke-
0 1 2 3 4 5 6 Kontrol Vit.C: 4,27 mg/kg/bb/hari 8,57 mg/kg/bb/hari 12,85 mg/kg/bb/hari 0/5 0/5 0/5 0/5 0/5 0/5 0/5 0/5 0/5 0/5 0/5 0/5 0/5 0/5 0/5 0/5 0/5 0/5 0/5 0/5 0/5 0/5 0/5 0/5 1/5 3/5 3/5 3/5 Letalitas : Jumlah hewan yang mati/jumlah hewan uji
4. Bahan yang digunakan untuk analisis enzim SOD dan MDA adalah : SOD murni (Sigma, USA), larutan cytochrom c (Sigma, USA), larutan xantin (Sigma, USA), larutan xantin oksidase (Sigma, USA), TBA, BHT dan bahan-bahan kimia lainnya seperti buffer potasium fosfat, aquades dan khloroform/etanol serta bahan untuk mengukur hematologi seperti larutan hayem, larutan turk dan reagen drabkins.
Alat utama yang digunakan dalam penelitian ini adalah :
Smoking chamber (Gambar 3). Smoking chamber merupakan alat untuk memaparkan asap rokok pada hewan coba. Alat ini dirancang khusus dalam penelitian ini yang terbuat dari plastik dengan ukuran 38,5x28,5x22,5 cm yang dilengkapi dengan ventilasi, dua buah air pump, dua buah pipa plastik, tabung kecil berbentuk gelas, tabung oksigen, dan tempat pembakaran rokok.
d
d
g
c
a
b
d
e
f
A C E G B F DGambar 3 Skema dan seperangkat Smoking chamber. Keterangan gambar :
a. Kotak plastik dengan ukuran 38,5x28,5x22,5 tempat tikus selama proses pemaparan asap rokok;
b. Pipa plastik untuk mengalirkan asap rokok dari pembakaran rokok ke chamber;
c. Tempat pembakaran rokok;
d. Pipa plastik untuk mengalirkan udara ke tempat pembakaran rokok; e. air pump sebagai alat pemompa udara;
f. Pipa plastik untuk mengalirkan oksigen dari tabung oksigen ke chamber; g. Tabung oksigen.
Mekanisme kerja dari alat ini adalah rokok dibakar, setelah itu ditempatkan pada tempat pembakaran (c) secara terbalik, dimana batang rokok yang dibakar menghadap ke bawah dan batang rokok yang tidak terbakar menghadap ke atas dan ditempatkan tepat pada pipa plastik (b) yang terhubung langsung dengan Chamber, kemudian dengan menggunakan air pump (e) untuk mengalirkan udara agar terjadi pembakaran rokok dan mendorong asap rokok masuk ke dalam chamber (a) melalui pipa plastik yang dihubungkan dengan chamber (b). Pada saat asap rokok masuk ke dalam chamber, oksigen dialirkan dari tabung oksigen melalui pipa plastik yang dihubungkan dengan chamber (g) dengan tekanan 0,5 atmosfer. Bila satu batang rokok telah habis terbakar, dilanjutkan dengan rokok kedua hingga semua rokok habis terbakar.
Peralatan lain yang juga digunakan dalm penelitian ini adalah sonde, spektrofotometer digital double beam (Hitachi U-2001), jarum suntik,
hemasitometer, mikroskop, seperangkat alat bedah, lumpang kecil, sentrifuse, inkubator dan hematokrit reader.
Metode Penelitian
Penelitian ini dilakukan dalam beberapa tahap, yaitu tahap persiapan hewan coba, tahap perlakuan dan tahap analisis.
1. Tahap Persiapan
Dua puluh lima ekor tikus yang telah diadaptasikan selama satu minggu ditempatkan pada kandang individual berukuran 34 x 25 x 12 cm yang beralas sekam padi dengan penutup kawat ram (Gambar 3). Tikus diberi makan dan minum ad libitum yang ditempatkan pada ruangan khusus dengan suhu 20-25 °C. Penggantian sekam dan pencucian kandang dilakukan dua hari sekali setiap pagi untuk setiap kandang. Hal ini dilakukan agar tikus selalu dalam kondisi bersih.
Gambar 4 Lingkungan kandang tikus.
2. Tahap perlakuan
Setelah masa adaptasi, tikus tersebut dibagi menjadi lima kelompok yang terdiri dari lima ekor. Adapun kelompok tersebut adalah :
1. P0 : merupakan kelompok kontrol; kelompok yang tidak dipapar rokok dan tidak diberi vitamin C.
2. P1 : merupakan kelompok yang diberi vitamin C dan tidak dipapar asap rokok.
3. P2 : merupakan kelompok yang dipapar asap rokok dan tidak diberi vitamin C.
4. P3 : merupakan kelompok yang dipapar asap rokok dan diberi vitamin C secara bersamaan.
5. P4 : merupakan kelompok yang dipapar asap rokok dan diberi vitamin C secara tidak bersamaan.
Setelah dibagi dalam lima kelompok perlakuan, tikus-tikus tersebut diberi perlakuan sesuai dengan rancangan, yaitu :
a. Proses pemaparan
Proses pemaparan dilakukan dalam smoking chamber. Tikus dalam kandang individu dipindahkan ke dalam smoking chamber, katup oksigen dibuka dengan tekanan 0,5 atmosfer kemudian rokok dipasangkan pada pipa yang dihubungkan dengan pompa, selanjutnya rokok dibakar dan pompa dinyalakan. Biarkan asap rokok masuk kedalam chamber hingga asap tersebut habis terhirup. Pemberian dosis asap rokok adalah satu batang rokok per lima belas menit selama enam puluh menit. Pemaparan dilakukan setiap pagi mulai dari pukul 07.00 sampai 08.00 untuk satu kelompok pemaparan selama tiga puluh hari. Perlakuan ini diberikan pada semua kelompok perlakuan, kecuali kelompok kontrol (P0) dan kelompok perlakuan vitamin C (P1) Proses pemaparan terlihat pada (Gambar 4).
(a) (b) (c)
Gambar 5 Proses pemaparan dari awal hingga akhir. (a. Awal pemaparan) (b. Selama pemaparan), (c. Akhir pemaparan)
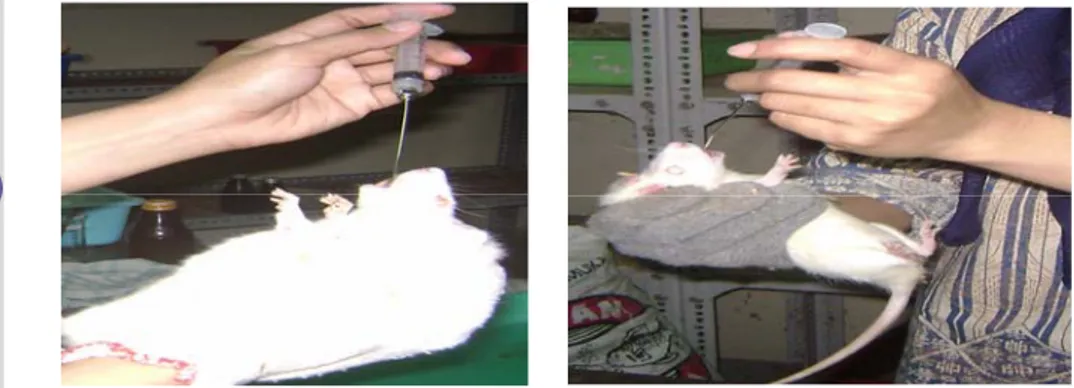
b. Proses pemberian vitamin C
Proses pemberian vitamin C dengan cara pencekokan dengan menggunakan sonde. Vitamin C tersebut dilarutkan dalam 1 ml aquades. Dosis pemberian vitamin C adalah sebanyak 8,57 mg/kg bb/hari dan diberikan setiap pagi pada jam sembilan untuk kelompok perlakuan P1, satu
jam setelah pemaparan untuk kelompok perlakuan P3 dan tiga puluh hari setelah pemaparan asap rokok untuk kelompok perlakuan P4. Proses pemberian vitamin C terlihat pada (Gambar 5).
Gambar 6 Pemberian vitamin C secara oral.
Diagram perlakuan proses pemaparan asap rokok, pemberian vitamin C dan waktu pengambilan sampel tertuang pada (Gambar 6).
Hari Penelitian Perlakuan 1 ... 30 31 ... 60 61 P0 P1 Ket. P2 P3 P4
Gambar 7 Proses pemaparan asap rokok, pemberian vitamin C dan waktu pengambilan sampel.
Pemberian vitamin C Hari pengambilan sampel Pemaparan asap rokok
3. Tahap Pengambilan Sampel
Pengambilan sampel dilakukan pada hari sesuai yang telah ditetapkan pada gambar. Ada pun parameter yang diukur adalah :
1. Kinerja atau aktivitas antioksidan dari vitamin C yang meliputi : a. Kadar malondialdehida (MDA)
2. Hematologi (gambaran darah) yang meliputi : a. Jumlah butir darah merah (BDM)
b. Jumlah butir darah putih (BDP) c. Jumlah hemoglobin (Hb) d. Jumlah hematokrit (PCV)
Pada akhir percobaan tikus dikorbankan dengan menggunakan eter kemudian darahnya diambil secara intrakardial sebanyak 2 ml untuk pemeriksaan gambaran darah (hematologi). Pembedahan segera dilakukan untuk mengambil organ hati dan ginjal selanjutnya hati dan ginjal dicuci dengan garam fisiologis 0,1 % kemudian dibagi menjadi dua bagian. Satu bagian ditimbang dengan berat organ 0,6 gr lalu dibungkus dengan aluminium foil dan disimpan difreezer pada suhu -20 °C yang nantinya digunakan untuk analisis MDA. Dan satu bagiannya lagi ditimbang dengan berat organ 0,5 gr lalu digerus dengan menggunakan tumbukan dan lumpang kemudian ditambahkan larutan buffer fosfat 1 ml lalu disentrifuse dengan kecepatan 10000 rpm selama 20 menit, diambil lisatnya lalu disimpan pada suhu -20° C dan siap dianalisi enzim SODnya.
4. Tahapan Analisis
a. Pengukuran kadar MDA (Malondialdehida) Hati dan Ginjal Tikus (Conti dan Sutherland 1991).
1. Persiapan larutan standar
Larutan kerja 10 μM dibuat dengan mengencerkan stok standar 2,5 mM 1,1,3,3 tetraetoksipropana (TEP). Kurva standar dibuat dengan mengencerkan larutan standar hingga menghasilkan beberapa konsentrasi yaitu 500, 1000, 2000, 2500, 3000, 4000 dan 5000 pmol/50µL (Lampiran 17).
2. Pengukuran Kadar MDA
Prinsip ini berdasarkan pada kemampuan pembentukan kompleks berwarna merah muda antara MDA dan asam tiobarbiurat (TBA). Hati dan ginjal yang telah disimpan dalam freezer -20ºC dicairkan terlebih dahulu sebelum dianalisis pada suhu ruang. Hati dan ginjal digerus dengan
menggunakan lumpang (digerus dalam keadaan dingin), dengan ditambahkan 1,25 ml buffer fosfat yang mengandung 11,5 g/L kalium klorida dalam kondisi dingin pH 7,4 (disimpan pada suhu 5ºC). Campuran ini disentrifuse 4000 rpm selama 10 menit, diambil supernatan keruh dan disentrifuse lagi 4000 rpm selama 10 menit, sebanyak 1 ml supernatan jernih diambil dan ditambahkan 1 ml campuran larutan asam klorida dingin 0,25 N (2,23 ml asam klorida pekat/100 ml) yang mengandung 15 % asam trikloroasetat (w/v);0,38 % asam tiobarbiurat dan 0,5% butilat hidroksitoluen). Campuran larutan asam klorida dan supernatan tersebut dipanaskan 80ºC (inkubator) selama 1 jam, selanjutnya didinginkan dengan air mengalir dan disentrifuse 3500 rpm selama 10 menit. Supernatan hasil sentifuse tersebut kemudian diukur absorbansinya pada panjang gelombang 532 nm.
MDA (μmol/g protein)= A(μmol/g) x 3,75 ml/0,6 g (bb)
A= Kadar MDA yang diperoleh dari persamaan regresi kurva standar.
b. Pengukuran aktivitas enzim SOD (Superoksida dismutase) Hati tikus (Chen et al. 1996).
1. Persiapan Larutan Standar
Larutan standar dibuat dengan melarutkan SOD (Sigma, USA) murni sehingga menghasilkan beberapa konsentrasi larutan, yaitu 0, 50, 100, 200, 250, 300 dan 500 unit/ml H2O dan larutan ini digunakan untuk membuat kurva standar (Lampiran 18).
2. Pengukuran Aktivitas SOD
Pengukuran aktivitas enzim SOD (Superoksida dismutase), ditentukan berdasarkan pengukuran enzim secara tidak langsung, dengan menggunakan spektrofotometer (Gambar 7). Untuk mengukur enzim ini dipakai sistem xantin/xantin (XO) yang menghasilkan anion superoksida (O2·) yang mereduksi ferrisitokrom c.
Aktivitas enzim SOD diukur berdasarkan laju penghambatan reduksi ferrisitokrom c oleh anion superoksida yang dihasilkan oleh xantin/xantin oksidase. Oksidasi xantin menghasilkan asam urat dan anion
superoksida, yang selanjutnya mereduksi ferrisitokrom c. Reduksi ferrisitokrom c diamati berdasarkan kenaikan absorbansi pada panjang gelombang 550 nm.
Reaksinya :
Xantin + O2 XO O2˙ + asam urat O2· + sitokrom c (Fe3+) O2 + sitokrom c 2O2 + 2H+ SOD H2O2 + O2
Gambar 8 Spectrofotometer digital double beam (Hitachi U-2001).
Pengukuran aktivitas enzim ini berlangsung pada suhu 25 ºC, larutan oksidase harus tetap dalam keadaan dingin (didinginkan selama 15 menit) sebelum digunakan. Medium reaksi segera dipersiapkan sebelum pengukuran dengan memasukan 2,9 ml larutan A (campuran larutan xantin dan larutan sitokrom c) ke dalam tabung reaksi 3 ml. Selanjutnya ditambahkan 50 μl larutan baku (kontrol) atau sampel/lisat lalu divorteks secara perlahan. Reaksi dimulai dengan larutan B (xantin oksidase) dan divorteks secara perlahan. Kemudian diamati perubahan absorbansi yang terjadi pada spektrofotometer. Untuk blanko digunakan buffer fosfat sebagai pengganti sampel dan sebagai kontrol digunakan air destilasi. Untuk mengambalikan ke konsentrasi awal yaitu dalam (gr) maka dikonversi dengan rumus :
SOD (U/g) = A (µ/ml) x 0,67/0,5 g (bb)
A= Aktivitas SOD yang diperoleh dari persamaan regresi kurva standar.
c. Pengukuran Hematologi
a. Pengukuran jumlah butir darah merah dengan metode Cuonting chamber-burker dan neubauer.
Darah diambil dengan menggunakan pipet eritrosit yang telah dihubungkan dengan aspirometer sampai menunjukkan angka 0,5, kemudian ditambahkan larutan Hayem sampai menunjukkan angka 101 lalu dikocok dengan gerakan seperti angka delapan setelah itu sebagian cairan pada ujung pipet dibuang dan sebagian larutan diteteskan ke dalam kamar hitung, kemudian hitung butir darah merah pada kotak R.
b. Pengukuran jumlah butir darah putih dengan metode Cuonting chamber-burker dan neubauer.
Untuk mengukur butir darah putih, prosedur kerjanya sama dengan mengukur butir darah merah, yang berbeda hanyalah pada larutan yaitu menggunakan larutan turk sebagai pengencer dan aspirometer menunjukkan angka 11 serta menghitungnya pada kotak W.
c. Pengukuran jumlah Hb dengan metode Cyan-methemoglobin
Untuk mengukur hemoglobin, digunakan reagen drabkins. Reagen drabkins dipipet sebanyak 5,0 ml dan masukkan kedalam tabung reaksi 1 dan 2, kemudian ditambahkan 0,02 ml darah ke tabung reaksi ke 2 dengan menggunakan pipet sahli atau pipet lain yang bervolume 0,02 ml, lalu dicampur dan dibiarkan selama 10 menit pada suhu kamar, agar terbentuk sianmethemoglobin, lalu dibaca transmittannya dengan spektrofotometer λ 540 nm.
d. Pengukuran jumlah hematokrit dengan metode Microhematokrit.
Darah diambil dengan menggunakan mikrokapiler, yang ujung disumbat dengan crestaseal kemudian disentrifuse dengan kecepatan 11.500 – 15.000 rpm selama 5 menit. Nilai hematokrit ditentukan dengan mengukur % volume eritrosit (lapisan yang berwarna merah), dan dibaca dengan hematokrit reader.
Analisis Data
Rancangan percobaan yang digunakan dalam penentuan kadar malondialdehida (MDA), aktivitas enzim superoksida dismutase (SOD), jumlah butir darah merah, jumlah butir darah putih, jumlah hemoglobin dan jumlah hematokrit adalah rancangan acak lengkap. Hasil yang diperoleh akan dianalisis dengan menggunakan ANOVA dan apabila terdapat perbedaan yang nyata antara perlakuan maka dilanjutkan dengan uji Duncan.
Model persamaan matematik dari percobaan ini adalah sebagai berikut : Yij =μ + Ti +∑ij (Mattjik & Sumertajaya 2006), dimana :
I = Banyaknya perlakuan,
J = Banyaknya ulangan dari setiap perlakuan, μ = Pengaruh rata-rata pengamatan,
Ti = Pengaruh adanya perlakuan ke-I, ∑ ij= Random error dari percobaan.