SKRIPSI
PENGARUH KOPIGMENTASI PEWARNA ALAMI ANTOSIANIN DARI ROSELA (Hibiscus sabdariffa L.) DENGAN ROSMARINIC ACID TERHADAP STABILITAS WARNA PADA MODEL MINUMAN RINGAN
Oleh CATRIEN F24050333
2009
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
Catrien. F24050333. Pengaruh Kopigmentasi Pewarna Alami Antosianin dari Rosela (Hibiscus sabdariffa L.) dengan Rosmarinic Acid terhadap Stabilitas Warna pada Model Minuman Ringan. Di bawah bimbingan Sukarno dan Dede R. Adawiyah. 2009.
RINGKASAN
Warna merupakan salah satu atribut sensori yang mempengaruhi kualitas dan penerimaan suatu produk pangan. Penggunaan pewarna untuk meningkatkan daya tarik produk pangan semakin meningkat dan berkembang pesat. Salah satu jenis warna yang banyak digunakan pada berbagai produk pangan adalah warna merah, yang dapat berasal dari antosianin.
Antosianin merupakan pigmen yang larut dalam air, menghasilkan warna dari merah sampai biru, dan tersebar luas dalam buah, bunga, dan daun (Jackman dan Smith, 1996). Antosianin memiliki spektrum warna merah yang kuat dan tajam pada pH 2-5, oleh sebab itu aplikasi antosianin sebagai pewarna pada produk pangan dapat dilakukan pada produk pangan yang memiliki pH rendah, seperti minuman ringan. Namun, sebagai pigmen atau pewarna merah alami, antosianin memiliki kelemahan, terutama dalam hal kestabilan warna. Warna merah dari antosianin sangat mudah terdegradasi, baik oleh peningkatan pH maupun peningkatan suhu. Upaya yang dapat dilakukan untuk meningkatkan kestabilan warna merah dari antosianin adalah dengan kopigmentasi.
Penelitian ini bertujuan mempelajari pengaruh kopigmentasi pewarna alami antosianin dari rosela (Hibiscus sabdariffa L.) dengan rosmarinic acid terhadap kualitas dan stabilitas warna merah pada model minuman ringan. Melalui penelitian ini diharapkan dapat diperoleh pewarna merah yang lebih aman dan lebih stabil untuk diaplikasikan pada produk pangan.
Penelitian diawali dengan mengekstrak pigmen antosianin dari kelopak kering bunga rosela (Hibiscus sabdariffa L.) dengan menggunakan pelarut air. Ekstrak antosianin rosela yang diperoleh selanjutnya dicampurkan dengan rosmarinic acid ke dalam model minuman ringan dengan lima perbandingan konsentrasi (M) (antosianin : rosmarinic acid 1:20, 1:40, 1:60, 1:80, dan 1:100). Kontrol yang digunakan adalah model minuman ringan antosianin tunggal atau tanpa penambahan senyawa kopigmen (rosmarinic acid). Kemudian dilakukan pengujian stabilitas warna merah pada model minuman ringan terhadap proses pemanasan dan penyinaran sinar ultraviolet (UV). Parameter yang diamati pada model minuman ringan meliputi absorbansi dan intensitas warna. Absorbansi model minuman ringan diamati dengan menggunakan spektrofotometer UV-Vis Spectronic 20D pada panjang gelombang 520 nm. Intensitas warna diamati dengan alat Chromameter Lab Minolta CR310 menggunakan sistem notasi warna Hunter (L, a, b).
Hasil penelitian menunjukkan bahwa proses pemanasan dan penyinaran UV mempengaruhi kestabilan warna merah pada model minuman ringan dan menyebabkan terjadinya degradasi warna merah pada model minuman ringan. Degradasi warna merah pada model minuman ringan ditandai dengan penurunan nilai absorbansi, penurunan nilai retensi warna, peningkatan nilai L (derajat kecerahan), penurunan nilai a (derajat kemerahan), dan peningkatan nilai b (derajat kekuningan) pada model minuman ringan, seiring dengan peningkatan
suhu dan waktu pemanasan, serta peningkatan waktu penyinaran UV. Degradasi warna ini disebabkan oleh terjadinya dekomposisi struktur antosianin dari kation flavilium yang berwarna merah, menjadi hemiasetal atau basa karbinol yang tidak berwarna, dan akhirnya menjadi kalkon yang tidak berwarna.
Penambahan rosmarinic acid sebagai senyawa kopigmen ternyata memberikan pengaruh yang cukup baik dalam peningkatan intensitas warna merah antosianin rosela pada model minuman ringan. Peningkatan intensitas warna ini ditandai dengan peningkatan nilai absorbansi (memberikan efek hiperkromik), penurunan nilai L (derajat kecerahan), dan peningkatan nilai a (derajat kemerahan) model minuman kopigmentasi antosianin-rosmarinic acid jika dibandingkan dengan model minuman kontrol (antosianin tunggal).
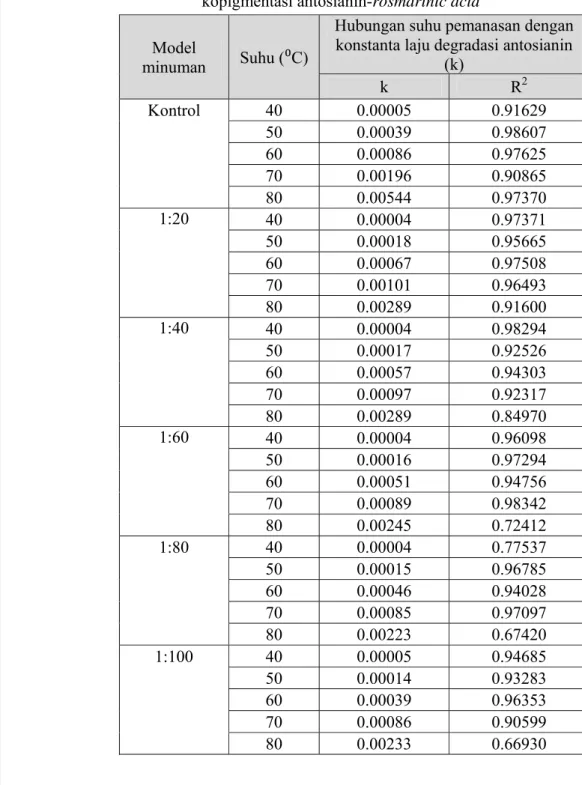
Penambahan rosmarinic acid sebagai senyawa kopigmen juga memberikan pengaruh yang cukup baik pada peningkatan kestabilan antosianin rosela terhadap degradasi warna merah akibat proses pemanasan dan penyinaran UV pada model minuman ringan. Model minuman kontrol (antosianin tunggal) lebih mudah dan lebih cepat mengalami degradasi warna merah, jika dibandingkan dengan model minuman kopigmentasi antosianin-rosmarinic acid. Hal ini dapat diamati dari penurunan nilai k (konstanta laju degradasi antosianin), peningkatan nilai t1/2 (waktu paruh degradasi antosianin), dan peningkatan nilai Ea (energi aktivasi) pada model minuman kopigmentasi antosianin-rosmarinic acid jika dibandingkan dengan model miniuman kontrol (antosianin tunggal) ringan. Nilai k, t1/2, dan Ea menggambarkan tingkat kemudahan terjadinya reaksi degradasi antosianin rosela pada model minuman ringan. Semakin kecil nilai k serta semakin besar nilai t1/2 dan Ea menandakan semakin sulit antosianin rosela terdegradasi, karena untuk reaksi degradasi tersebut dibutuhkan waktu yang lebih lama dan energi yang lebih besar.
Fenomena kopigmentasi rosmarinic acid terhadap antosianin rosela pada model minuman ringan memang terjadi atau terlihat, baik pada proses pemanasan maupun pada proses penyinaran UV. Pada pengamatan uji stabilitas warna model minuman ringan terhadap penyinaran UV, efek atau fenomena kopigmentasi antosianin-rosmarinic acid terjadi secara nyata (signifikan). Namun, pada pengamatan uji stabilitas warna model minuman ringan terhadap pemanasan, efek atau fenomena kopigmentasi antosianin-rosmarinic acid terlihat kurang signifikan. Hal ini disebabkan oleh kecilnya konsentrasi antosianin rosela yang diaplikasikan sebagai pewarna pada model minuman ringan, sebesar 3x10-5M.
Hasil penelitian menunjukkan bahwa model minuman kopigmentasi antosianin-rosmarinic acid 1:100, merupakan formula model minuman ringan yang memiliki efek kopigmentasi terbaik, dalam meningkatan kestabilan antosianin rosela pada proses pemanasan, karena mempunyai nilai energi aktivasi (Ea) yang paling besar, dibandingkan dengan model minuman kontrol (antosianin tunggal) dan keempat formula model minuman kopigmentasi antosianin-rosmarinic acid lainnya, yaitu 1:20, 1:40, 1:60, dan 1:80.
INSTITUT PERTANIAN BOGOR FAKULTAS TEKNOLOGI PERTANIAN
PENGARUH KOPIGMENTASI PEWARNA ALAMI ANTOSIANIN DARI ROSELA (Hibiscus sabdariffa L.) DENGAN ROSMARINIC ACID TERHADAP STABILITAS WARNA PADA MODEL MINUMAN RINGAN
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN pada Departemen Ilmu dan Teknologi Pangan
Fakultas Teknologi Pertanian Institut Pertanian Bogor
Oleh: CATRIEN F24050333
2009
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
INSTITUT PERTANIAN BOGOR FAKULTAS TEKNOLOGI PERTANIAN
PENGARUH KOPIGMENTASI PEWARNA ALAMI ANTOSIANIN DARI ROSELA (Hibiscus sabdariffa L.) DENGAN ROSMARINIC ACID TERHADAP STABILITAS WARNA PADA MODEL MINUMAN RINGAN
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN pada Departemen Ilmu dan Teknologi Pangan
Fakultas Teknologi Pertanian Institut Pertanian Bogor
Oleh: CATRIEN F24050333
Dilahirkan pada tanggal 18 Desember 1986 di Jakarta
Tanggal lulus : 20 November 2009
Menyetujui, Bogor, 10 Desember 2009
Dr. Ir. Sukarno, M. Sc Dr. Ir. Dede R. Adawiyah, M. Si Dosen Pembimbing I Dosen Pembimbing II
Mengetahui,
Dr. Ir. Dahrul Syah, M.Sc Ketua Departemen ITP
RIWAYAT PENULIS
Penulis dilahirkan di Jakarta pada tanggal 18 Desember 1986 sebagai anak pertama dari tiga bersaudara, pasangan Lie Han Fong dan Cicilia Soaniyati Nasim. Bangku sekolah penulis dimulai dari TK Santa Maria Fatima (Jakarta), SD Santa Maria Fatima (Jakarta), SMP Marsudirini (Jakarta), dan SMA Santa Theresia (Jakarta), kemudian penulis diterima menjadi mahasiswi Departemen Ilmu dan Teknologi Pangan Fakultas Teknologi Pertanian melalui jalur Seleksi Penerimaan Mahasiswa Baru (SPMB) pada tahun 2005.
Selama belajar di Departemen Ilmu dan Teknologi Pangan, IPB, penulis mengikuti beberapa kegiatan organisasi dan kemahasiswaaan seperti Keluarga Mahasiswa Katolik IPB (KEMAKI), Himpunan Mahasiswa Ilmu dan Teknologi Pangan (HIMITEPA), panitia Indonesian Food Expo (Ifoodex) 2007, dan panitia Natal Civitas Akademika IPB 2008.
Sebagai syarat untuk memperoleh gelar Sarjana Teknologi Pertanian, penulis menyelesaikan skripsinya dengan judul Pengaruh Kopigmentasi Pewarna Alami Antosianin dari Rosela (Hibiscus Sabdariffa L.) dengan Rosmarinic Acid terhadap Stabilitas Warna pada Model Minuman Ringan di bawah bimbingan Dr. Ir. Sukarno, M. Sc. dan Dr. Ir. Dede R. Adawiyah, M. Si.
Penulis juga pernah bekerja sebagai Asisten Praktikum Kimia Tingkat Persiapan Bersama Institut Pertanian Bogor (TPB IPB), Asisten Praktikum Organoleptik Supervisor Jaminan Mutu Pangan Institut Pertanian Bogor (SJMP IPB), dan asisten praktikum Teknologi Pengolahan Pangan Hewani Supervisor Jaminan Mutu Pangan Institut Pertanian Bogor (SJMP IPB).
KATA PENGANTAR
Puji dan syukur penulis panjatkan ke hadirat Tuhan Yang Maha Esa atas segala berkat dan rahmat-Nya sehingga penulis dapat menyelesaikan penelitian yang berjudul Pengaruh Kopigmentasi Pewarna Alami Antosianin dari Rosela (Hibiscus sabdariffa L.) dengan Rosmarinic Acid terhadap Stabilitas Warna pada Model Minuman Ringan.
Ucapan terima kasih penulis sampaikan kepada sejumlah pihak yang telah berkontribusi secara langsung maupun tidak langsung dalam penyelesaian tugas akhir ini. Semoga Tuhan membalas semua kebaikan pihak-pihak yang senantiasa membimbing, membantu, dan mendoakan penulis dalam menyelesaikan penelitian dan penyusunan skripsi ini. Perkenankanlah penulis untuk mengucapkan terima kasih kepada:
1. Orang tua tercinta (mami dan papi) dan adik-adik tersayang (Natalia dan Steffanie) yang selalu memberikan cinta dan kasih sayang kepada penulis. Terima kasih atas semua dukungan, perhatian, doa, dan semangat selama ini. 2. Dr. Ir. Sukarno, M. Sc dan Dr. Ir. Dede R. Adawiyah, M. Si, selaku
pembimbing akademik yang telah memberikan dukungan, motivasi, bimbingan, dan pengarahan kepada penulis sehingga tugas akhir ini dapat terselesaikan.
3. Ir. Elvira Syamsir, M. Si, terima kasih atas waktu dan kesediaannya sebagai penguji serta masukan-masukan berarti demi perbaikan skripsi ini.
4.
5. Tante Helly, Ku Oyu, Oma, dan Ayu. Terima kasih atas segala bentuk perhatian, dukungan, dan bantuan yang senantiasa diberikan selama ini. Semoga Tuhan senantiasa memberkati dan membalas semua kebaikan Tante Helly, Ku Oyu, Oma, dan Ayu.
6. Misereor dan Yayasan Bhumiksara, beserta para donatur beasiswa Misereor-Bhumiksara. Terima kasih atas kebaikan hati dan bantuan yang telah diberikan kepada penulis, sehingga penulis dapat menyelesaikan kuliah.
7. Seluruh pengurus Yayasan Bhumiksara, terutama Pak Djoko, Pak Lubis, dan Mas Eko. Terima kasih untuk bantuan, nasihat, masukan, sharing pengalaman, pelajaran, dan semua hal yang telah diberikan.
8. Komisi Pendidikan Jakarta, terutama Ibu Lis, Pak Dwi, dan seluruh pihak yang telah membantu penulis dalam penerimaan beasiswa Misereor-Bhumiksara. Terima kasih atas bantuan, dukungan, nasihat, dan masukan yang telah diberikan kepada penulis. I Love KAJ.
9. Teman-teman KomDik Jakarta: Belinda, Marcel, Tanti, Angel, Lea, Ocha, Noel, Ino, Nikson, Bobby, dan Leo. Terima kasih atas semua kebersamaan, dukungan, dan persahabatan yang telah terjalin. Aku cinta J. A. K. A. R. T. A. 10. Teman-teman di seluruh Indonesia, penerima beasiswa Misereor Bhumiksara.
Terima kasih atas semua kebersamaan dan persaudaraan yang indah.
11. Teman-teman satu bimbingan: Ayupri Dipthasari dan Ardi Ramdani. Terima kasih atas kerja sama, semangat, dan dukungannya.
12. Keluarga Rocang (Rosela-secang): Arya, Galih Ika, Galih Eka, dan Santi. Terima kasih atas segala bantuan, kerja sama, semangat, dan kekompakannya. 13. Sahabat-sahabat terbaik: Vania, Bonita, Karina. Terima kasih atas
persahabatan, perhatian, dan semangat yang senantiasa diberikan kepada penulis.
14. Teman-teman kuliah: Diana, Yusi, Astrisia, Belinda, Irene, Eveline, Tuti, dan Lusi. Terima kasih atas bantuan, perhatian, semangat, kebersamaan dan persahabatannya selama ini.
15. Seluruh teman-teman ITP 42. Seluruh kenangan indah, kebersamaan, suka, dan duka kita selama ini takkan pernah terlupakan.
16. Laboran dan teknisi laboratorium ITP, Pilot Plan, dan LJA: Pak Rojak, Pak Wachid, Pak Sidik, Pak Adi, Pak Sobirin, Pak Yahya, Mas Edi, Pak Iyas, Bu Rubiah, Bu Antin, Mba Darsih, Mbak Yane, Mbak Siti, Mbak Ririn, dan Mbak Yuli. Terima kasih atas segala bantuan yang telah diberikan kepada penulis selama penelitian.
17. Seluruh dosen dan staf Departemen ITP yang telah memberikan ilmu, pelajaran, nasihat, dan masukan yang berharga.
18. Pustakawan-pustakawan PITP, PAU, dan LSI, terimakasih atas segala bantuannya.
19. Serta seluruh pihak yang tidak dapat disebutkan satu persatu terima kasih atas bantuan dan dukungan yang telah diberikan sehingga tugas akhir ini dapat terselesaikan dengan baik.
Akhir kata, dengan segala kelebihan dan kekurangannya, penulis berharap semoga karya tulis ini dapat memberikan manfaat dan kontribusi bagi perkembangan ilmu pengetahuan dan teknologi, khususnya di bidang ilmu dan teknologi pangan.
Bogor, September 2009
DAFTAR ISI Halaman KATA PENGANTAR ... i DAFTAR ISI ... iv DAFTAR GAMBAR ... vi DAFTAR TABEL ... x DAFTAR LAMPIRAN ... xi I. PENDAHULUAN ... 1 A. LATAR BELAKANG ... 1 B. TUJUAN PENELITIAN ... 4 C. MANFAAT PENELITIAN ... 4
II. TINJAUAN PUSTAKA ... 5
A. ROSELA (Hibiscus sabdariffa L.) ... 5
B. PEWARNA MAKANAN ... 6 C. ANTOSIANIN ... 9 D. KOPIGMENTASI ... 15 E. ROSMARINIC ACID ... 17 F. MINUMAN RINGAN ... 18 G. SPEKTROSKOPI ... 20 H. KROMAMETER ... 20
III. METODOLOGI PENELITIAN ... 24
A. BAHAN DAN ALAT ... 24
1. Bahan ... 24
2. Alat ... 24
B. METODE PENELITIAN ... 24
1. Persiapan Sampel ... 24
2. Pembuatan Model Minuman Ringan dan Reaksi Kopigmentasi Antosianin-Rosmarinic Acid ... 25
3. Uji Stabilitas Warna ... 26
a. Analisis stabilitas warna terhadap suhu pemanasan ... 26
b. Analisis stabilitas warna terhadap penyinaran ultraviolet ... 26
4. Metode Analisis ... 28
a. Penentuan rendemen ekstrak ... 28
b. Penentuan total padatan (AOAC, 1995) ... 28
c. Penentuan total antosianin (modifikasi Iglesias et al., 2008) ... 29
IV. HASIL DAN PEMBAHASAN ... 30
A. EKSTRAKSI ANTOSIANIN DARI ROSELA ... 30
B. KARAKTERISTIK EKSTRAK ANTOSIANIN DARI ROSELA ... 31
C. PEMBUATAN MODEL MINUMAN RINGAN DAN REAKSI KOPIGMENTASI ANTOSIANIN-ROSMARINIC ACID ... 33
D. ANALISIS STABILITAS WARNA MODEL MINUMAN RINGAN . 33 1. Analisis Stabilitas Warna Model Minuman Ringan terhadap Pemanasan ... 34
a. Pengamatan stabilitas warna model minuman ringan terhadap pemanasan dengan menggunakan spektrofotometer ... 35
b. Pengamatan stabilitas warna model minuman ringan terhadap pemanasan dengan menggunakan kromameter ... 54
2. Analisis Stabilitas Warna Model Minuman Ringan terhadap
Penyinaran Ultraviolet (UV) ... 65
a. Pengamatan stabilitas warna model minuman ringan terhadap penyinaran UV dengan menggunakan spektrofotometer ... 66
b. Pengamatan stabilitas warna model minuman ringan terhadap penyinaran UV dengan menggunakan kromameter ... 74
V. KESIMPULAN DAN SARAN ... 78
DAFTAR PUSTAKA ... 80
DAFTAR GAMBAR
Halaman
Gambar 1. Tanaman Hibiscus sabdariffa ... 5
Gambar 2. Struktur kimia antosianidin ... 10
Gambar 3. Mekanisme reaksi kopigmentasi pada antosianin (Rein dan Heinonen, 2004) ... 15
Gambar 4. Rosmarinic acid ... 18
Gambar 5. Diagram warna Hunter L, a, b ... 21
Gambar 6. Bola imaginer Munsell ... 22
Gambar 7. Ekstrak antosianin dari rosela ... 31
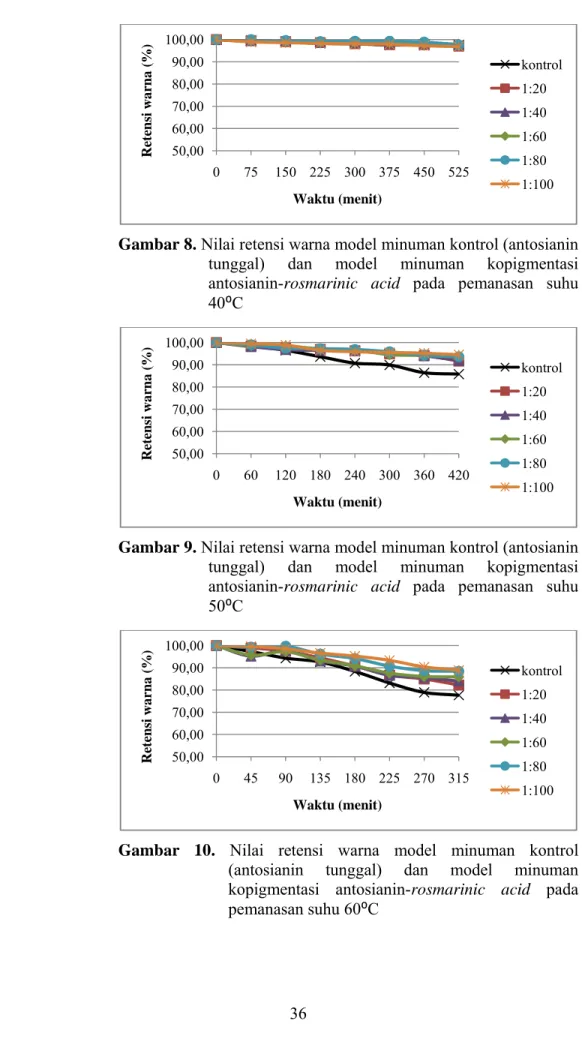
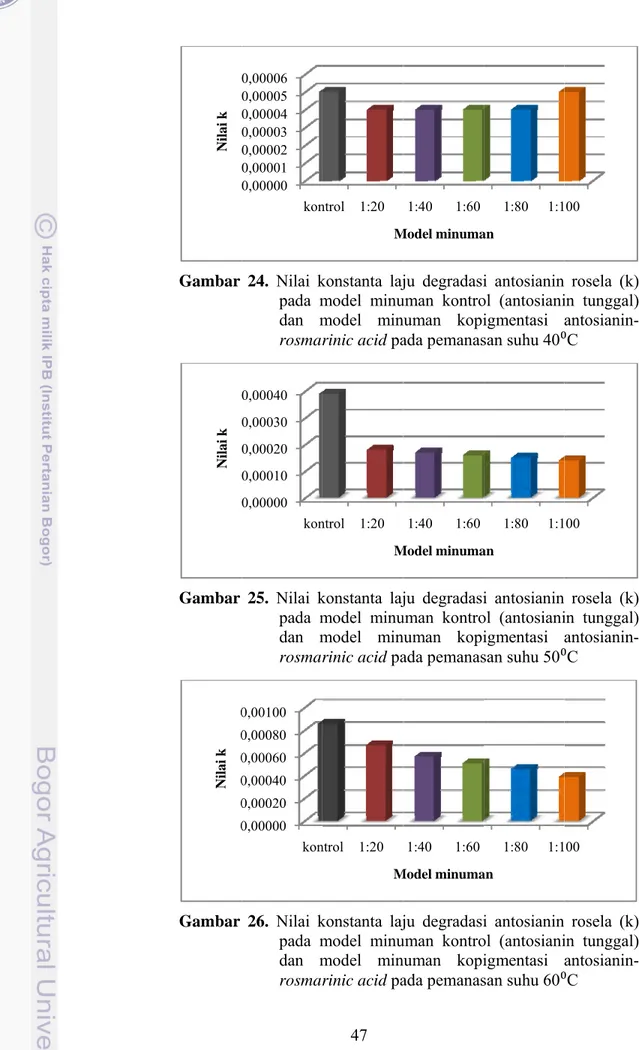
Gambar 8. Nilai retensi warna model minuman kontrol (antosianin tunggal) dan model minuman kopigmentasi antosianin-rosmarinic acid pada pemanasan suhu 40⁰C ... 36
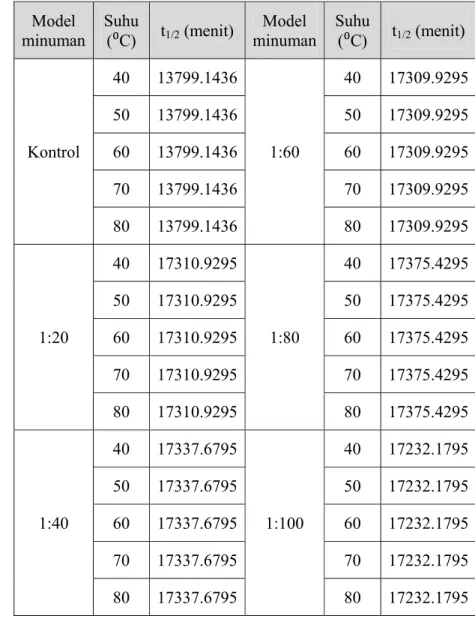
Gambar 9. Nilai retensi warna model minuman kontrol (antosianin tunggal) dan model minuman kopigmentasi antosianin-rosmarinic acid pada pemanasan suhu 50⁰C ... 36
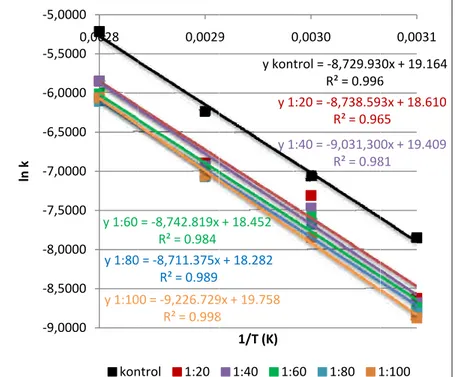
Gambar 10. Nilai retensi warna model minuman kontrol (antosianin tunggal) dan model minuman kopigmentasi antosianin-rosmarinic acid pada pemanasan suhu 60⁰C ... 36
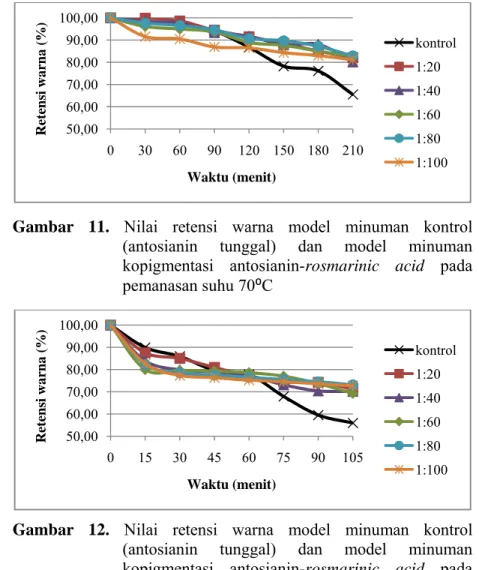
Gambar 11. Nilai retensi warna model minuman kontrol (antosianin tunggal) dan model minuman kopigmentasi antosianin-rosmarinic acid pada pemanasan suhu 70⁰C ... 37
Gambar 12. Nilai retensi warna model minuman kontrol (antosianin tunggal) dan model minuman kopigmentasi antosianin-rosmarinic acid pada pemanasan suhu 80⁰C ... 37
Gambar 13. Nilai retensi warna model minuman kontrol (antosianin tunggal) dan model minuman kopigmentasi antosianin-rosmarinic acid pada berbagai suhu pemanasan ... 40
Gambar 14. Warna model minuman kontrol (antosianin tunggal) dan model minuman kopigmentasi antosianin-rosmarinic acid (a) sebelum dipanaskan pada suhu 40⁰C dan (b) sesudah dipanaskan pada suhu 40⁰C selama 525 menit ... 41
Gambar 15. Warna model minuman kontrol (antosianin tunggal) dan model minuman kopigmentasi antosianin-rosmarinic acid (a) sebelum dipanaskan pada suhu 50⁰C dan (b) sesudah dipanaskan pada suhu 50⁰C selama 420 menit ... 41
Gambar 16. Warna model minuman kontrol (antosianin tunggal) dan model minuman kopigmentasi antosianin-rosmarinic acid (a) sebelum dipanaskan pada suhu 60⁰C dan (b) sesudah dipanaskan pada suhu 60⁰C selama 315 menit ... 41
Gambar 17. Warna model minuman kontrol (antosianin tunggal) dan model minuman kopigmentasi antosianin-rosmarinic acid (a) sebelum dipanaskan pada suhu 70⁰C dan (b) sesudah dipanaskan pada suhu 70⁰C selama 210 menit ... 42
Gambar 18. Warna model minuman kontrol (antosianin tunggal) dan model minuman kopigmentasi antosianin-rosmarinic acid
(a) sebelum dipanaskan pada suhu 80⁰C dan
(b) sesudah dipanaskan pada suhu 80⁰C selama 105 menit ... 42 Gambar 19. Hubungan antara ln (At/Ao) dengan waktu pemanasan model
minuman kontrol (antosianin tunggal) dan model minuman kopigmentasi antosianin-rosmarinic acid pada pemanasan suhu 40⁰C selama 525 menit ... 43 Gambar 20. Hubungan antara ln (At/Ao) dengan waktu pemanasan model
minuman kontrol (antosianin tunggal) dan model minuman kopigmentasi antosianin-rosmarinic acid pada pemanasan suhu 50⁰C selama 420 menit ... 43 Gambar 21. Hubungan antara ln (At/Ao) dengan waktu pemanasan model
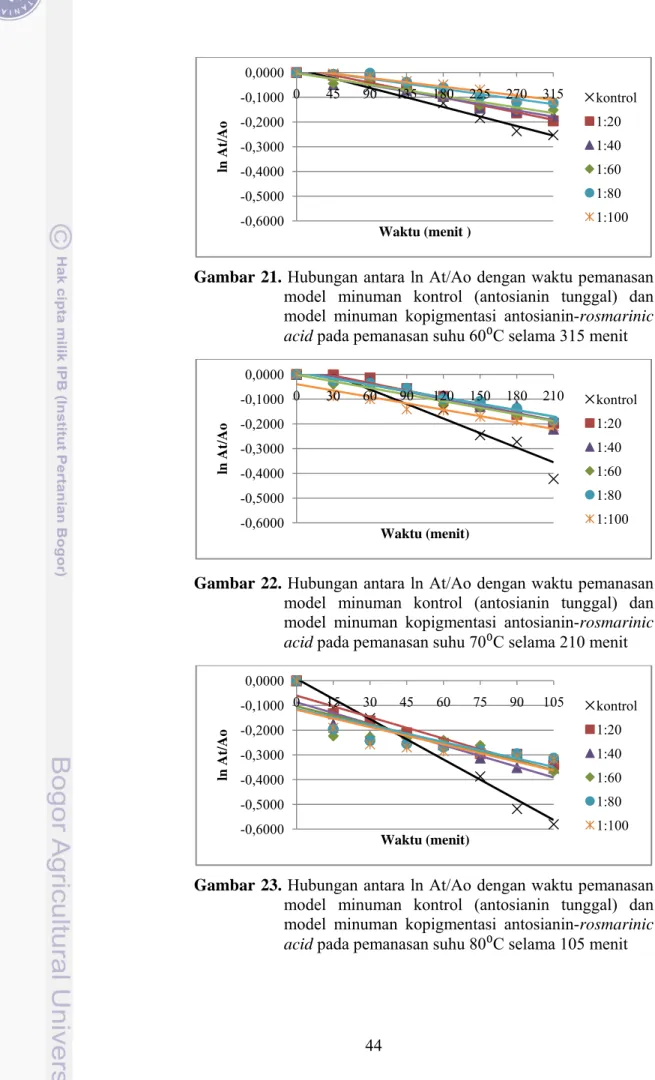
minuman kontrol (antosianin tunggal) dan model minuman kopigmentasi antosianin-rosmarinic acid pada pemanasan suhu 60⁰C selama 315 menit ... 43 Gambar 22. Hubungan antara ln (At/Ao) dengan waktu pemanasan model
minuman kontrol (antosianin tunggal) dan model minuman kopigmentasi antosianin-rosmarinic acid pada pemanasan suhu 70⁰C selama 210 menit ... 44 Gambar 23. Hubungan antara ln (At/Ao) dengan waktu pemanasan model
minuman kontrol (antosianin tunggal) dan model minuman kopigmentasi antosianin-rosmarinic acid pada pemanasan suhu 80⁰C selama 105 menit ... 44 Gambar 24. Nilai konstanta laju degradasi antosianin rosela (k) pada model minuman kontrol (antosianin tunggal) dan model minuman kopigmentasi antosianin-rosmarinic acid pada pemanasan suhu 40⁰C ... 47 Gambar 25. Nilai konstanta laju degradasi antosianin rosela (k) pada model minuman kontrol (antosianin tunggal) dan model minuman kopigmentasi antosianin-rosmarinic acid pada pemanasan suhu 50⁰C ... 47 Gambar 26. Nilai konstanta laju degradasi antosianin rosela (k) pada model minuman kontrol (antosianin tunggal) dan model minuman kopigmentasi antosianin-rosmarinic acid pada pemanasan suhu 60⁰C ... 47 Gambar 27. Nilai konstanta laju degradasi antosianin rosela (k) pada model minuman kontrol (antosianin tunggal) dan model minuman kopigmentasi antosianin-rosmarinic acid pada pemanasan suhu 70⁰C ... 48 Gambar 28. Nilai konstanta laju degradasi antosianin rosela (k) pada model minuman kontrol (antosianin tunggal) dan model minuman kopigmentasi antosianin-rosmarinic acid pada pemanasan suhu 80⁰C ... 48 Gambar 29. Hubungan antara nilai ln konstanta degradasi antosianin (ln k) pada model minuman kontrol (antosianin tunggal) dan model minuman kopigmentasi antosianin-rosmarinic acid) dengan
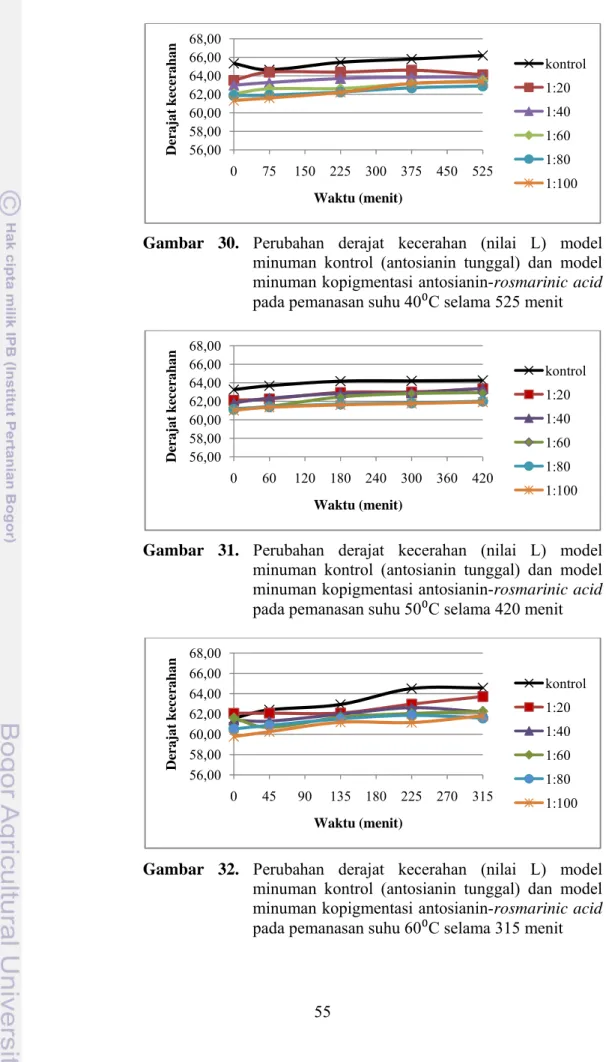
Gambar 30. Perubahan derajat kecerahan (nilai L) model minuman kontrol (antosianin tunggal) dan model minuman kopigmentasi
antosianin-rosmarinic acid pada pemanasan suhu 40⁰C selama 525 menit ... 55 Gambar 31. Perubahan derajat kecerahan (nilai L) model minuman kontrol (antosianin tunggal) dan model minuman kopigmentasi
antosianin-rosmarinic acid pada pemanasan suhu 50⁰C selama 420 menit ... 55 Gambar 32. Perubahan derajat kecerahan (nilai L) model minuman kontrol (antosianin tunggal) dan model minuman kopigmentasi
antosianin-rosmarinic acid pada pemanasan suhu 60⁰C selama 315 menit ... 55 Gambar 33. Perubahan derajat kecerahan (nilai L) model minuman kontrol (antosianin tunggal) dan model minuman kopigmentasi
antosianin-rosmarinic acid pada pemanasan suhu 70⁰C selama 210 menit ... 56 Gambar 34. Perubahan derajat kecerahan (nilai L) model minuman kontrol (antosianin tunggal) dan model minuman kopigmentasi
antosianin-rosmarinic acid pada pemanasan suhu 80⁰C selama 105 menit ... 56 Gambar 35. Perubahan derajat kemerahan (nilai a) model minuman kontrol (antosianin tunggal) dan model minuman kopigmentasi
antosianin-rosmarinic acid pada pemanasan suhu 40⁰C selama 525 menit ... 57 Gambar 36. Perubahan derajat kemerahan (nilai a) model minuman kontrol (antosianin tunggal) dan model minuman kopigmentasi
antosianin-rosmarinic acid pada pemanasan suhu 50⁰C selama 420 menit ... 58 Gambar 37. Perubahan derajat kemerahan (nilai a) model minuman kontrol (antosianin tunggal) dan model minuman kopigmentasi
antosianin-rosmarinic acid pada pemanasan suhu 60⁰C selama 315 menit ... 58 Gambar 38. Perubahan derajat kemerahan (nilai a) model minuman kontrol (antosianin tunggal) dan model minuman kopigmentasi antosianin-rosmarinic acid pada pemanasan suhu 70⁰C selama 210 menit ... 58 Gambar 39. Perubahan derajat kemerahan (nilai a) model minuman kontrol (antosianin tunggal) dan model minuman kopigmentasi
antosianin-rosmarinic acid pada pemanasan suhu 80⁰C selama 105 menit ... 59 Gambar 40. Perubahan derajat kekuningan (nilai b) model minuman kontrol (antosianin tunggal) dan model minuman kopigmentasi
antosianin-rosmarinic acid pada pemanasan suhu 40⁰C selama 525 menit ... 59 Gambar 41. Perubahan derajat kekuningan (nilai b) model minuman kontrol (antosianin tunggal) dan model minuman kopigmentasi
antosianin-rosmarinic acid pada pemanasan suhu 50⁰C selama 420 menit ... 59
Gambar 42. Perubahan derajat kekuningan (nilai b) model minuman kontrol (antosianin tunggal) dan model minuman kopigmentasi
antosianin-rosmarinic acid pada pemanasan suhu 60⁰C selama 315 menit ... 60 Gambar 43. Perubahan derajat kekuningan (nilai b) model minuman kontrol (antosianin tunggal) dan model minuman kopigmentasi
antosianin-rosmarinic acid pada pemanasan suhu 70⁰C selama 210 menit ... 60 Gambar 44. Perubahan derajat kekuningan (nilai b) model minuman kontrol (antosianin tunggal) dan model minuman kopigmentasi
antosianin-rosmarinic acid pada pemanasan suhu 80⁰C selama 105 menit ... 60 Gambar 45. Nilai retensi warna model minuman kontrol (antosianin tunggal) dan model minuman kopigmentasi antosianin-rosmarinic acid
pada proses penyinaran UV ... 67 Gambar 46. Warna model minuman kontrol (antosianin tunggal) dan model minuman kopigmentasi antosianin-rosmarinic acid
(a) sebelum kontak/terpapar sinar UV dan
(b) sesudah kontak/terpapar sinar UV selama 120 jam (5 hari) ... 69 Gambar 47. Hubungan antara ln (At/Ao) dengan waktu penyinaran UV model minuman kontrol (antosianin tunggal) dan model minuman
kopigmentasi antosianin-rosmarinic acid ... 70 Gambar 48. Nilai konstanta laju degradasi antosianin rosela (k) pada model minuman kontrol (antosianin tunggal) dan model minuman
kopigmentasi antosianin-rossmarinic acid pada proses penyinaran UV ... 71 Gambar 49. Perubahan derajat kecerahan (nilai L) model minuman kontrol
(antosianin tunggal) dan model minuman kopigmentasi antosianin- rosmarinic acid pada penyinaran UV selama 120 jam (5 hari) ... 74 Gambar 50. Perubahan derajat kemerahan (nilai a) model minuman kontrol (antosianin tunggal) dan model minuman kopigmentasi antosianin- rosmarinic acid pada penyinaran UV selama 120 jam (5 hari) ... 75 Gambar 51. Perubahan derajat kekuningan (nilai b) model minuman kontrol (antosianin tunggal) dan model minuman kopigmentasi antosianin- rosmarinic acid pada penyinaran UV selama 120 jam (5 hari) ... 75
DAFTAR TABEL
Halaman Tabel 1. Gugus pengganti pada struktur kation flavilium (antosianidin) untuk membentuk antosianin ... 10 Tabel 2. Interpretasi warna hue pada bola imajiner Munsell ... 23 Tabel 3. Karakteristik ekstrak antosianin rosela ... 32 Tabel 4. Pengaruh suhu pemanasan terhadap konstanta laju degradasi antosianin rosela (k) pada model minuman kontrol (antosianin tunggal) dan model minuman kopigmentasi antosianin-rosmarinic acid ... 46 Tabel 5. Pengaruh suhu pemanasan terhadap waktu paruh degradasi antosianin rosela (t1/2) pada model minuman kontrol (antosianin tunggal) dan model minuman kopigmentasi antosianin-rosmarinic acid ... 50 Tabel 6. Nilai energi aktivasi (Ea) antosianin rosela pada minuman kontrol (antosianin tunggal) dan model minuman kopigmentasi antosianin- rosmarinic acid ... 53 Tabel 7. Perubahan nilai ⁰hue model minuman kontrol (antosianin tunggal) pada berbagai suhu pemanasan ... 62 Tabel 8. Perubahan nilai ⁰hue model minuman kopigmentasi antosianin-
rosmarinic acid 1:20 pada berbagai suhu pemanasan ... 62 Tabel 9. Perubahan nilai ⁰hue model minuman kopigmentasi antosianin-
rosmarinic acid 1:40 pada berbagai suhu pemanasan ... 63 Tabel 10. Perubahan nilai ⁰hue model minuman kopigmentasi antosianin-
rosmarinic acid 1:60 pada berbagai suhu pemanasan ... 63 Tabel 11. Perubahan nilai ⁰hue model minuman kopigmentasi antosianin-
rosmarinic acid 1:80 pada berbagai suhu pemanasan ... 64 Tabel 12. Perubahan nilai ⁰hue model minuman kopigmentasi antosianin-
rosmarinic acid 1:100 pada berbagai suhu pemanasan ... 64 Tabel 13. Pengaruh penyinaran UV terhadap konstanta laju degradasi antosianin rosela (k) pada model minuman kontrol (antosianin tunggal) dan model minuman kopigmentasi antosianin-rosmarinic acid ... 72 Tabel 14. Pengaruh penyinaran UV terhadap waktu paruh degradasi antosianin rosela (t1/2) pada model minuman kontrol (antosianin tunggal) dan model minuman kopigmentasi antosianin-rosmarinic acid ... 73 Tabel 15. Perubahan nilai ⁰hue model minuman kontrol (antosianin tunggal) dan model minuman kopigmentasi antosianin-rosmarinic acid pada penyinaran UV selama 120 jam (5 hari) ... 76
DAFTAR LAMPIRAN
Halaman Lampiran 1. Tahapan ekstraksi antosianin dari kelopak kering bunga rosela (Hibiscus sabdariffa L.) ... 88 Lampiran 2. Perhitungan rendemen dan total padatan ekstrak antosianin
rosela ... 89 Lampiran 3. Pengukuran derajat keasaman (pH) ekstrak antosianin rosela ... 90 Lampiran 4. Penentuan total antosianin ekstrak ... 91 Lampiran 5. Pembuatan larutan stok ekstrak antosianin rosela dan penentuan total antosianin larutan stok ... 92 Lampiran 6. Perhitungan konsentrasi antosianin dan rosmarinic acid dalam model minuman ringan ... 94 Lampiran 7. Penentuan panjang gelombang maksimum model minuman
ringan ... 96 Lampiran 8. Data absorbansi model minuman ringan pada pemanasan suhu 40⁰C ... 97 Lampiran 9. Data derajat kecerahan (L), derajat kemerahan (a), dan derajat kekuningan (b) model minuman ringan pemanasan suhu 40⁰C ... 99 Lampiran 10. Data absorbansi model minuman ringan pada pemanasan suhu 50⁰C ... 103 Lampiran 11. Data derajat kecerahan (L), derajat kemerahan (a), dan derajat kekuningan (b) model minuman ringan pemanasan suhu
50⁰C ... 105 Lampiran 12. Data absorbansi model minuman ringan pada pemanasan suhu 60⁰C ... 109 Lampiran 13. Data derajat kecerahan (L), derajat kemerahan (a), dan derajat kekuningan (b) model minuman ringan pemanasan suhu
60⁰C ... 111 Lampiran 14. Data absorbansi model minuman ringan pada pemanasan suhu 70⁰C ... 115 Lampiran 15. Data derajat kecerahan (L), derajat kemerahan (a), dan derajat kekuningan (b) model minuman ringan pemanasan suhu
70⁰C ... 117 Lampiran 16. Data absorbansi model minuman ringan pada pemanasan suhu 80⁰C ... 121 Lampiran 17. Data derajat kecerahan (L), derajat kemerahan (a), dan derajat kekuningan (b) model minuman ringan pemanasan suhu
80⁰C ... 123 Lampiran 18. Data absorbansi model minuman ringan pada penyinaran UV ... 127 Lampiran 19. Data derajat kecerahan (L), derajat kemerahan (a), dan derajat kekuningan (b) model minuman ringan pada penyinaran UV .... 129
I. PENDAHULUAN
A. LATAR BELAKANG
Warna merupakan salah satu atribut sensori yang mempengaruhi kualitas dan penerimaan suatu produk pangan. Sebelum faktor-faktor lain, seperti cita rasa, tekstur, nilai gizi, dan sifat mikrobiologis dipertimbangkan, secara visual warna tampil lebih dulu dan terkadang sangat menentukan mutu bahan pangan. Produk pangan yang memiliki warna yang menarik akan memiliki peluang yang lebih besar untuk dibeli oleh konsumen. Hal ini menyebabkan penggunaan pewarna pada produk pangan semakin meningkat dan berkembang dengan pesat. Penggunaan pewarna pada produk pangan pada umumnya dimaksudkan untuk memperbaiki kualitas produk pangan, terutama dalam hal penampakan, dengan demikian daya tarik konsumen terhadap produk pangan tersebut dapat meningkat.
Berdasarkan sumbernya, pewarna dalam produk pangan dapat diklasifikasikan menjadi pewarna alami dan sintetik (DeMan, 1985; Winarno, 1997). Pada umumnya pewarna sintetik lebih banyak digunakan di industri pangan daripada pewarna alami. Hal ini dikarenakan pewarna sintetik lebih mudah dan murah untuk diproduksi. Selain itu pewarna sintetik juga memiliki kestabilan warna yang lebih baik dibandingkan pewarna alami. Namun penggunaan pewarna sintetik untuk produk pangan seringkali menimbulkan masalah kesehatan, seperti diare, keracunan, kanker, stroke, dan penyakit jantung. Keadaan ini menimbulkan perubahan tuntutan di kalangan masyarakat yang semakin sadar akan pentingnya faktor keamanan pangan. Sejalan dengan hal itu, penggunaan pewarna alami yang relatif lebih aman mulai banyak dikembangkan. Selain faktor keamanan, pemilihan pewarna alami sebagai pewarna pada berbagai produk pangan juga disebabkan oleh sifat fungsional yang terkandung dalam pewarna alami tersebut bagi kesehatan tubuh.
Salah satu jenis warna yang banyak digunakan pada berbagai produk pangan adalah warna merah, yang dapat diperoleh dari antosianin. Antosianin merupakan pigmen alami yang banyak ditemui pada tanaman
yang berwarna merah dan ungu. Pigmen antosianin memberikan warna merah yang kuat dan tajam pada pH asam, sehingga aplikasi antosianin sebagai pewarna makanan dan minuman dapat dilakukan pada pH produk yang memiliki pH asam, seperti untuk minuman ringan, minuman beralkohol, manisan, saus, pikel, makanan beku atau makanan kalengan, dan yoghurt.
Pigmen antosianin telah sejak lama dikonsumsi oleh manusia dan hewan bersamaan dengan buah atau sayuran yang mereka makan. Selama ini tidak pernah terjadi suatu penyakit atau keracunan yang disebabkan oleh pigmen ini (Brouillard, 1982). Bahkan menurut penelitian yang telah banyak dilakukan, pigmen antosianin terbukti memilki efek positif terhadap kesehatan (Timberlake dan Bridle, 1997). Banyak bukti telah menunjukkan bahwa antosianin bukan saja tidak beracun (non-toxic), tetapi juga memiliki sifat pharmacological dan theuraphetic yang positif. Oleh karena itu, pigmen ini dapat dikonsumsi tanpa menunjukkan efek negatif bagi kesehatan. Wagner (1985) mengungkapkan bahwa ekstrak pigmen antosianin memiliki aktivitas antiinflammatori dan antiodema. Sifat penting lain yang dimiliki pigmen antosianin adalah aktivitas antioksidan dan pencegahan pembentukan radikal bebas (Tsuda et al., 1996, Gabrielska et al., 1999, dan Sarma et al., 1997).
Salah satu tanaman yang dapat dijadikan sebagai sumber antosianin yang baik adalah rosela (Hibiscus sabdariffa L.). Sebanyak 85% dari total antosianin yang terdapat pada tanaman rosela diidentifikasi sebagai delfnidin-3-sambubiosida yang memberikan warna merah pada hasil ekstraksi rosela. Antosianin rosela juga terbukti memiliki efek positif bagi kesehatan manusia. Wang et al. (2000) menyatakan bahwa kelompok pigmen antosianin yang berasal dari tanaman rosela atau Hibiscus sabdariffa L. mampu menurunkan resiko luka pada hati, termasuk peradangan, perembesan sel leukosit, dan necrosis.
Sebagai pigmen atau pewarna merah alami, antosianin memiliki kelemahan, terutama dalam hal kestabilan warna. Warna merah dari antosianin sangat mudah terdegradasi, baik oleh peningkatan pH,
peningkatan suhu, maupun cahaya. Upaya yang dapat dilakukan untuk meningkatkan kestabilan warna merah dari antosianin adalah dengan kopigmentasi.
Efek kopigmentasi dapat dijabarkan sebagai suatu fenomena yang menyebabkan warna pigmen antosianin menjadi lebih merah dan lebih stabil. Hal ini terjadi karena adanya interaksi antara struktur antosianin dengan molekul lain yang disebut dengan senyawa kopigmen, yaitu flavonoid (flavon dan flavonol) dan polifenol lain (asam fenolik), alkaloid (kafein), asam amino, asam organik, nukleotida, polisakarida, logam (Al3+, Fe3+, Sn2+, Cu2+), dan bahkan antosianin itu sendiri. Interaksi komponen-komponen tersebut dapat terjadi melalui intermolecular copigmentation, intramolecular copigmentation, metal complexation, atau self association.
Senyawa kopigmen yang digunakan pada penelitian ini adalah rosmarinic acid. Rosmarinic acid (C18H16O8) merupakan golongan asam fenolik yang ditemukan pada tanaman herbal, seperti rosemary, oregano, sage, thyme, dan peppermint. Penggunaan rosmarinic acid sebagai senyawa kopigmen didasarkan pada penelitian Adawiyah et al. (2008) yang menggunakan empat jenis asam fenolik sebagai senyawa kopigmen, yaitu ferulic acid (asam ferulat), sinapic acid (asam sinapat), chlorogenic acid (asam klorogenat), dan rosmarinic acid (asam rosmarinat) untuk meningkatkan kestabilan antosianin dari ekstrak tanaman rosela. Berdasarkan hasil penelitian tersebut, jenis kopigmen yang memberikan hasil terbaik dalam meningkatkan kestabilan antosianin adalah rosmarinic acid.
Penghambatan degradasi warna antosianin akibat reaksi kopigmentasi antosianin-rosmarinic acid dapat diamati melalui perbandingan nilai energi aktivasi (Ea) reaksi degradasi antosianin tanpa dan dengan penambahan kopigmen rosmarinic acid. Semakin besar energi aktivasi, maka semakin sulit antosianin terdegradasi, karena energi yang dibutuhkan untuk reaksi degradasi tersebut semakin besar. Penambahan rosmarinic acid sebagai senyawa kopigmen diharapkan mampu meningkatkan energi aktivasi reaksi degradasi warna antosianin.
B. TUJUAN PENELITIAN
Penelitian ini bertujuan mempelajari pengaruh proses kopigmentasi pewarna alami antosianin dari rosela (Hibiscus sabdariffa L.) dengan senyawa kopigmen rosmarinic acid terhadap kualitas dan stabilitas warna merah yang dihasilkan pada model minuman ringan.
C. MANFAAT PENELITIAN
Manfaat dari penelitian ini adalah mendapatkan pewarna merah yang lebih aman dan lebih stabil untuk diaplikasikan pada produk pangan.
II. TINJAUAN PUSTAKA
A. ROSELA (Hibiscus sabdarifa L.)
Gambar 1. Tanaman Hibiscus sabdarifa Divisi : Spermatophyta
Sub Divisi : Angiospermae Kelas : Dicotyledonae Bangsa : Malvales Suku : Malvaceae Marga : Hibiscus
Jenis : Hibiscus sabdariffa L
Rosela adalah tumbuhan yang berasal dari India dan memiliki nama latin Hibiscus sabdariffa L. Tumbuhan ini dikenal sebagai penghasil serat bermutu yang dimanfaatkan untuk membuat karung goni. Rosela merupakan tumbuhan semak yang tingginya mencapai 3m. Batangnya bulat, tegak, percabangan simpodial, memiliki kambium, dan berwarna merah. Daunnya tunggal dengan bentuk bulat seperti telur. Tipe tulang daunnya adalah menjari. Ujung daun tumpul, tepinya beringgit, dan pangkalnya berlekuk. Panjang daun rosela sekitar 6-15cm dan lebarnya 5-8cm. Panjang tangkai daun 4-7cm dengan penampang bulat dan warna hijau.
Rosela memiliki bunga tunggal yang tumbuh di ketiak daun. Kelopak bunga berwarna merah, berbulu, terdiri dari delapan sampai sebelas daun kelopak dan pangkalnya berlekatan. Mahkota bunganya berwarna kuning berbentuk corong. Setiap bunga terdiri dari lima daun mahkota yang panjangnya 3-5cm.
Rosela merupakan tumbuhan yang berkembang baik di daerah beriklim tropis dan subtropis. Budidayanya dapat dilakukan di segala macam tanah, tetapi paling cocok pada tanah yang subur dan gembur. Tumbuhan ini dapat tumbuh di daerah pantai sampai daerah dengan ketinggian 900m di atas permukaan laut. Curah hujan yang dibutuhkan adalah 180cm. Jika curah hujan tidak mencukupi, irigasi akan memberikan hasil yang baik (Maryani dan Kristiana, 2005).
Rosela yang direbus dalam air panas, menghasilkan minuman yang berwarna merah. Warna merah ini dapat dimanfaatkan sebagai zat warna alami pada berbagai produk pangan. Komponen yang berperan memberikan warna merah pada hasil ekstraksi rosela ini merupakan pigmen dari golongan antosianin. Puckhaber (2002) menyatakan bahwa ekstrak bunga dari genus Hibiscus kebanyakan mengandung antosianin jenis delfinidin, sianidin, petunidin, miricetin, pelargonidin, malvidin, quercetin, dan kaempferol. Sebanyak 85% dari total antosianin yang
terdapat pada tanaman rosela diidentifikasi sebagai delfinidin 3-sambubiosida yang memberikan warna merah pada hasil ekstraksi
rosela. Selain itu, golongan antosianin lain yang juga terdapat pada tanaman rosela adalah sianidin 3-samubiosida yang memberikan warna pink pada hasil ekstraksi rosela (Hong dan Wrolstad, 1990, Tsai dan Ou, 1996; Tsai et al., 2002). Selain dua antosianin utama tersebut, ekstrak cair dari kelopak kering bunga rosela juga mengandung komponen antosianin minor, yaitu delfinidin 3-glukosida dan sianidin 3-glukoasida (Du dan Francis, 1973). Selain itu rosela juga mengandung komponen fenolik lainnya yang memiliki aktivitas antioksidan.
B. PEWARNA MAKANAN
Warna merupakan salah satu faktor penting yang menentukan penerimaan konsumen terhadap suatu produk pangan. Keinginan untuk mengkonsumsi dan membeli produk pangan seringkali ditentukan oleh warna produk pangan tersebut yang menarik perhatian. Warna dalam bahan pangan juga dapat menjadi ukuran terhadap mutu dari bahan pangan tersebut. Menurut Winarno (1997) apabila suatu produk memiliki nilai gizi
yang baik, rasa yang enak, dan tekstur yang baik tetapi memiliki warna yang kurang menarik akan memberikan kesan menyimpang pada produk pangan tersebut.
Pewarna makanan adalah zat warna alami maupun buatan yang boleh ditambahkan ke dalam makanan dan minuman untuk memperoleh warna yang diinginkan (Enie, 1987). Tujuan penambahan pewarna ke dalam makanan dan minuman antara lain adalah untuk memperbaiki penampakan produk pangan yang memudar akibat pengolahan, memperoleh penampakan warna yang seragam, memperoleh warna yang lebih tua dari aslinya, melindungi flavor dan vitamin yang peka terhadap cahaya selama penyimpanan, memperoleh penampakan yang lebih menarik dari aslinya, untuk memberi identitas produk, dan sebagai indikator visual dari kualitas (Tjahjadi, 1987).
Ketentuan mengenai penggunaan pewarna di Indonesia diatur dalam SK Menteri Kesehatan RI No. 722/Menkes/Per/IX/1988 dan dalam SNI (Standar Nasional Indonesia) 01-0222-1995 mengenai Bahan Tambahan Makanan (BTM). Pewarna makanan terbagi menjadi tiga golongan, yaitu pewarna alami, pewarna identik alami dan pewarna sintetik (Bauernfeind, 1981).
Pewarna alami merupakan bahan pewarna yang diperoleh dari bahan nabati, hewani, atau sumber-sumber mineral. Contoh pewarna alami antara lain curcumin, riboflavin, klorofil, antosianin, brazilein, dan karotenoid.
Pewarna identik alami merupakan pewarna yang disentetis secara kimia sehingga menghasilkan pewarna dengan struktur kimia yang sama/identik dengan pewarna alami. Yang termasuk golongan ini adalah karotenoid murni, antara lain: canthaxanthin (merah), apo-karoten (merah-oranye), beta-karoten (oranye-kuning). Semua zat warna ini memiliki batas konsentrasi maksimum penggunaan, kecuali beta-karoten yang boleh digunakan dalam jumlah tidak terbatas.
Pewarna sintetik merupakan bahan pewarna yang memberikan warna yang tidak ada di alam dan dihasilkan dengan cara sintesis kimia,
bukan dengan cara ekstraksi atau isolasi (Hendry, 1996). Berdasarkan rumus kimianya, pewarna sintetik dalam makanan menurut Joint FAO/WHO Expert Committee on Food Additive (JECFA) dapat digolongkan dalam beberapa kelas, yaitu azo, triarilmetana, quinolin, xanten, dan indigoid. Kelas azo merupakan pewarna sintetik yang paling banyak jenisnya dan mencakup warna kuning, oranye, merah, ungu, dan coklat, setelah itu kelas triarilmetana yang mencakup warna biru dan hijau. Berdasarkan kelarutannya dikenal dua macam pewarna sintetis, yaitu dyes dan lakes. Dyes adalah zat pewarna yang umumnya bersifat larut dalam air, sedangkan lakes merupakan zat pewarna yang tidak larut pada hampir semua jenis pelarut.
Bila dibandingkan dengan pewarna sintetik, penggunaan zat warna alami mempunyai beberapa keterbatasan, antara lain: memberikan rasa dan flavor khas yang tidak diinginkan, konsentrasi dan stabilitas pewarna yang rendah, keseragaman warna kurang baik, dan spektrum warna yang kurang luas. Pewarna sintetik lebih banyak digunakan dalam pembuatan berbagai macam produk pangan karena memiliki kestabilan warna yang baik dan memiliki spektrum warna yang luas.
Dalam daftar FDA (Food and Drug Administration), pewarna alami dan pewarna identik alami tergolong dalam uncertified color, karena tidak memerlukan sertifikat kemurnian kimiawi, sedangkan pewarna sintetik harus melalui berbagai prosedur pengujian atau proses sertifikasi sebelum akhirnya dapat digunakan sebagai pewarna makanan. Proses sertifikasi ini meliputi pengujian kimia, biokimia, toksikologi, dan analisis media terhadap pewarna tersebut. Pewarna makanan yang diijinkan penggunaannya dikenal dengan nama certified color atau permitted color. Sementara itu, pewarna makanan yang belum diijinkan penggunaannya dan masih perlu diuji aspek keamanannya terhadap kesehatan manusia digolongkan ke dalam provisional list.
C. ANTOSIANIN
Antosianin merupakan salah satu bagian penting dalam kelompok pigmen setelah klorofil. Antosianin berasal dari bahasa Yunani, anthos yang berarti bunga dan kyanos yang berarti biru gelap. Antosianin merupakan pigmen yang larut dalam air, menghasilkan warna dari merah sampai biru, dan tersebar luas dalam buah, bunga, dan daun (Jackman dan Smith, 1996). Antosianin umumnya ditemukan pada buah-buahan, sayur-sayuran, dan bunga, contohnya pada anggur, strawberry, blackberry, blueberry, raspberry, cherry, apel merah, bunga ros, bunga/kembang sepatu, kol ungu, pir merah, plum, cabai merah, dan sebagainya (Jackman dan Smith, 1996).
Warna yang diberikan oleh antosianin bervariasi dari merah, jingga, ungu, atau biru pada jaringan tanaman. Antosianin terdapat pada vakuola sel bagian tanaman. Vakuola adalah organel sitoplasmik yang berisikan air, serta dibatasi oleh membran yang identik dengan membran tanaman (Kimbal, 1993).
Antosianin tergolong ke dalam turunan flavonoid. Struktur utamanya ditandai dengan adanya dua cincin aromatik benzena (C6H6) yang dihubungkan dengan tiga atom karbon yang membentuk cincin (Jackman dan Smith, 1996). Secara kimia, antosianin merupakan hasil turunan dari glikosilasi polihidroksi dan/atau polimetoksi dari garam 2-benzopirilium atau dikenal dengan struktur kation flavilium atau benzilflavilum (3,5,7,4’-tetrahidroksiflavilum) yang merupakan struktur dasar dari antosianidin (Timberlake dan Bridle, 1997).
Menurut Markakis (1982), antosianin memiliki sifat mudah larut dalam air dan disusun dari sebuah aglikon (antosianidin) yang teresterifikasi dengan satu atau lebih gugus gula (glikon). Terdapat lima jenis gula yang biasa ditemui pada molekul antosianin, yaitu glukosa, ramnosa, galaktosa, xilosa, fruktosa, dan arabinosa. Apabila gugus glikon dihilangkan melalui proses hidrolisis maka dihasilkan antosianidin. Antosianidin ini berwarna merah di lingkungan asam, berwarna ungu di lingkungan netral, dan berwarna biru di lingkungan basa (Dwidjoseputro,
1990). Struktur kimia antosianidin dapat dilihat pada Gambar 2. Sampai saat ini terdapat lebih dari dua puluh jenis antosianidin yang telah diidentifikasi, namun hanya enam yang memegang peranan penting dalam bahan pangan, yaitu sianidin, malvidin, petunidin, pelargonidin, delfinidin, dan peonidin.
Gambar 2. Struktur kimia antosianidin (Castaneda-Ovando et al., 2009) Tabel 1. Gugus pengganti pada struktur kation flavilium (antosianidin)
untuk membentuk antosianin
Antosianidin Substitusi (R) Warna
3 5 6 7 3’ 5’ Pelargonidin OH OH H OH H H Oranye Sianidin OH OH H OH OH H Oranye-Merah Delfinidin OH OH H OH OH OH Biru-Merah
Peonidin OH OH H OH OMe H
Oranye-Merah
Petunidin OH OH H OH OMe OH
Biru-Merah
Malvidin OH OH H OH OMe OMe
Biru-Merah Umumnya antosianidin tidak ditemukan dalam tanaman (Harbone, 1967). Dalam tanaman antosianin biasanya berada dalam bentuk glikosida yaitu ester dengan satu molekul monosakarida disebut monoglukosida, biosida atau diglukosida jika memiliki dua molekul gula, dan triosida jika memiliki tiga molekul gula (Delgado-Vargas et al., 2000). Menurut Timberlake dan Bridle (1983), gula yang menyusun antosianin terdiri dari: (1) monosakarida, biasanya glukosa, ramnosa, dan arabinosa, (2)
disakarida, yang merupakan dua buah monosakarida dengan kombinasi dari keempat monosakarida di atas dan xilosa, seperti rutinosa, dan (3) trisakarida, merupakan tiga buah monosakarida yang mengandung kombinasi dari gula-gula di atas dalam posisis linear maupun rantai cabang.
Keragaman antosianin dapat terjadi karena perbedaan sifat gula, jumlah satuaan gula, dan letak ikatan gulanya. Glikosilasi dapat meningkatkan kestabilan dan kelarutan antosianin di dalam air, sebab antosianidin kurang stabil dan kurang larut air dibandingkan antosianin (Timberlake dan Bridle, 1966).
Molekul lain yang terdapat pada inti kation flavilium adalah p-coumaric, ferulic, cafeic, malonic, atau asam asetat. Satu atau lebih molekul tersebut dapat terasilasi pada molekul gulanya (Francis, 1985). Grup asil dengan jumlah dan posisi tertentu yang terikat dapat meningkatkan kestabilan antosianin terutama terhadap cahaya dan pH (Francis, 1982; Shi et al., 1992). Brouillard (1982) menyatakan bahwa dua grup asil dibutuhkan untuk retensi warna maksimum, di mana satu grup asil terletak di atas cincin pirilium dan yang satunya di bawahnya. Dengan adanya grup asil maka interaksi hidrofobik antara grup asil dengan cincin pirilium meningkat sehingga dapat mencegah hidrasi cincin pirilium. Semakin kuat interaksi hidrofobik ini maka cincin pirilium akan semakin tahan terhadap hidrasi sehingga pigmen antosianin akan lebih stabil.
Sifat dan warna antosianin dalam jaringan tanaman dipengaruhi oleh beberapa faktor, antara lain jumlah pigmen, letak dan jumlah gugus hidroksi dan metoksi, kopigmentasi, dan sebagainya (Markakis, 1982). Konsentrasi pigmen yang tinggi di dalam jaringan akan menyebabkan warna merah hingga gelap, sedangkan konsentrasi pigmen yang sedang akan menyebabkan warna ungu, dan konsentrasi pigmen yang rendah akan menyebabkan warna biru (Winarno, 1997). Penambahan gugus glikosida atau peningkatan jumlah gugus hidroksi bebas pada rantai karbon nomor 5 (cincin A) yang dominan menyebabkan warna cenderung biru dan relatif tidak stabil, sedangkan metilasi atau penambahan jumlah gugus metoksi
akan menyebabkan warna cenderung merah dan relatif stabil (Jackman dan Smith, 1996).
Warna pigmen antosianin juga dipengaruhi oleh pelarut. Warna antosianin akan menjadi lebih biru pada pelarut alkohol dibandingkan dengan pelarut air (Swain, 1976). Kondisi yang sedikit asam akan meningkatkan intensitas warna dari pigmen antosianin. Selain itu, terikatnya beberapa jenis gula juga dapat meningkatkan intensitas warna dan pigmen antosianin (Lewis et al., 1995).
Antosianin di alam terdapat dalam bentuk struktur primer, sekunder, tersier, kuartener. Dalam bentuk primer, struktur antosianin berbentuk kation falvium, yang terikat gugus hidroksi, metoksi, atau o-glikosil. Struktur sekunder merupakan struktur yang paling banyak ditemukan dalam tanaman. Struktur ini didapatkan melalui proses hidrasi, transfer porton, dan tautomerasi dari struktur primer. Struktur sekunder ini ditemukan saat antosianin dilarutkan dalam air. Struktur sekunder yang berwarna, biasanya tidak stabil atau mudah hilang dan pudar (Brouillard, 1982).
Akibat kekurangan elektron, maka kation flavilium menjadi sangat reaktif. Reaksi-reaksi yang terjadi pada umumnya mengakibatkan terjadinya degradasi warna. Degradasi warna dari pigmen antosianin disebabkan oleh berubahnya kation flavium yang berwarna merah menjadi basa karbinol yang tidak berwarna, dan akhirnya menjadi kalkon yang tidak berwarna (Francis, 1985). Palamidis dan Markakis (1975) menyatakan bahwa reaksi degradasi pada antosianin mengikuti laju reaksi yang termasuk dalam reaksi ordo pertama. Laju degradasi warna antosianin dipercepat dengan adanya asam askorbat, asam amino, fenol, dan gula. Senyawa-senyawa tersebut dapat berkondensasi dengan molekul antosianin melalui suatu reaksi yang kompleks (Francis, 1985). Salah satu senyawa hasil kondensasi ini adalah phlobafen yang berwarna coklat (Francis, 1985).
Ada beberapa hal yang dapat mempengaruhi kestabilan antosianin, antara lain pengaruh reaksi enzimatis dan non enzimatis. Faktor-faktor non enzimatis yang mempengaruhi kestabilan antosianin antara lain pH, cahaya, dan suhu (Elbe dan Schwartz, 1996).
Secara enzimatis, kehadiran enzim antosianase atau polifenol oksidase akan mempengaruhi kestabilan antosianin karena bersifat merusak antosianin. Menurut Rein (2005) beberapa enzim dapat berperan dalam proses degradasi antosianin misalnya glukosidase dan PPO (polyphenol oxidase). Enzim glukosidase mampu menstimulasi terjadinya hidrolisis pada ikatan gula antara gugus aglikon dengan gugus glikon. Hidrolisis tersebut menyebabkan terbukanya cincin aromatik sehingga membentuk senyawa kalkon (Markakis, 1982). Menurut Jackman dan Smith (1996), adanya enzim glukosidase yang ditambahkan pada jus blueberry yang mengandung sianidin 3-glukosida menyebabkan pemudaran warna akibat hidrolisis ikatan glikosidik.
Pada medium air, antosianin terdapat dalam empat bentuk struktur kesetimbangan yaitu, basa quinonoidal berwarna ungu, kation flavium berwarna merah, basa karbinol/hemiasetal/pseudobasa, dan kalkon yang tidak berwarna. Bentuk kesetimbangan ini dipengaruhi oleh pH. Pada pH rendah (pH < 2), struktur kation flavium (merah) dominan. Pada pH 3-6, struktur kation flavilium mengalami serangan nukleofilik oleh molekul air, menghasilkan struktur basa karbinol/hemiasetal (tidak berwarna). Selanjutnya struktur basa karbinol/hemiasetal yang terbentuk ini dapat mengalami kesetimbangan tautomerik (kesetimbangan antara bentuk keto dan enol) menghasilkan struktur kalkon (tidak berwarna). Pada pH yang lebih tinggi (pH 6-8) terjadi reaksi deprotonisasi menghasilkan struktur basa quinonoidal (ungu). Peningkatan pH lebih lanjut (pH > 10) akan mengakibatkan terjadinya reaksi deprotonisasi lanjutan pada basa quinonoidal (ungu) menghasilkan struktur basa quinonoidal terionisasi (biru).
Peningkatan suhu pengolahan hingga penyimpanan dapat menyebabkan kerusakan dan perubahan struktur antosianin. Tinsley dan
Bockian (1960), menyatakan bahwa suhu mempunyai pengaruh yang nyata sekali terhadap destruksi antosianin. Markakis (1982), mengemukakan bahwa kerusakan atau perubahan struktur antosianin akibat peningkatan suhu terjadi melalui tahapan: (1) terjadinya hidrolisis pada ikatan glikosidik antosianin pada posisi 3 dan menghasilkan aglikon-aglikon yang labil, (2) terbukanya cincin aglikon-aglikon sehingga terbentuk gugus karbinol dan kalkon yang tidak berwarna. Degradasi lebih lanjut dari antosianin ini akan menghasilkan produk yang berwarna coklat terutama jika terdapat molekul oksigen.
Brouillard (1982), mengemukakan bahwa reaksi kesetimbangan di antara struktur basa quinonoidal (ungu) ↔ kation flavilium (merah) ↔ basa karbinol/hemiasetal/pseudobasa (tidak berwarna) ↔ kalkon (tidak berwarna) adalah bersifat endotermik jika berjalan dari kiri ke kanan. Dengan demikian, adanya panas akan menggeser kesetimbangan menuju ke kanan, yaitu kalkon. Senyawa kalkon mampu terdegradasi membentuk senyawa yang lebih sederhana yang meliputi asam karboksilat seperti asam benzoat tersubtitusi dan karboksil aldehid seperti 2,4,6-trihidroksibenzaldehid (Jackman dan Smith, 1996).
Cahaya merupakan faktor yang turut berperan dalam proses degradasi antosianin. Cahaya memiliki energi tertentu yang mampu menstimulasi terjadinya reaksi fotokimia (fotooksidasi) dalam molekul antosianin (Jackman dan Smith, 1996). Reaksi fotokimia dapat menyebabkan pembukaan cincin aglikon pada antosianin yang diawali oleh pembukaan cincin karbon no. 2. Pada akhirnya reaksi fotooksidasi ini akan membentuk senyawa yang tidak berwarna seperti kalkon sebagai indikator degradasi antosianin. Degradasi lanjutan dapat membentuk senyawa turunan lain seperti 2,4,6-trihidroksibenzaldehid dan asam benzoat tersubtitusi (Jackman dan Smith, 1996).
Pada suasana asam antosianin akan berwarna merah, oleh karena itu aplikasi antosianin sebagai pewarna produk pangan dapat dilakukan untuk produk-produk yang memiliki pH rendah, seperti minuman ringan, manisan, saus, pikel, makanan beku atau makanan kalengan, dan yoghurt.
D. KOPIGMENTASI
Stabilitas warna antosianin dapat dipertahankan atau ditingkatkan dengan reaksi kopigmentasi. Fenomena kopigmentasi pertama kali teramati pada tahun 1916 oleh Willstätter dan Zollinger yang mengamati warna pigmen anggur yang berubah warna dari merah menjadi merah kebiruan dengan penambahan asam tanat dan asam galat (Rein, 2005).
Kopigmentasi merupakan interaksi antara struktur antosianin dengan molekul lain seperti logam (Al3+, Fe3+, Sn2+, Cu2+) dan molekul organik lain seperti senyawa falvonoid (flavon, flavonon, dan flavonol), senyawa alkaloid (kafein), dan sebagainya. Adanya kopigmentasi antara antosianin dengan logam molekul organik lain cenderung meningkatkan stabilitas warna antosianin (Jackman dan Smith, 1996).
Kopigmentasi secara alami dapat memperbaiki warna antosianin pada produk pangan. Menurut Castaneda-Ovando et al. (2008), reaksi kopigmenatsi dapat terjadi melalui empat mekanisme interaksi, yaitu intermolecular copigmentation, intramolecular copigmentation, metal complexation, ataupun self association. Keempat mekanisme tersebut pada antosianin digambarkan oleh Rein dan Heinonen (2004) seperti dapat dilihat pada Gambar 3.
Gambar 3. Mekanisme reaksi kopigmentasi pada antosianin (Rein dan Heinonen, 2004)
Mekanisme self association, yaitu interaksi antara antosianin dengan antosianin lain sebagai senyawa kopigmen dengan bantuan gugus gula sebagai pengikat. Mekanisme metal complexation merupakan interaksi pembentukan kompleks antara antosianin dengan logam sebagai senyawa kopigmen.
Pada mekanisme intermolecular copigmentation, interaksi terjadi antara antosianin dengan senyawa flavonoid atau komponen fenolik sebagai senyawa kopigmen. Pada mekanisme intramolecular copigmentation, interaksi terjadi antara antosianin dengan bagian dari molekul antosianin itu sendiri, misalnya dengan gugus asil melalui reaksi kimia atau dengan bantuan perlakuan fisik. Pengikatannya dapat terjadi dengan bantuan gugus gula.
Fenomena kopigmentasi teramati sebagai pergeseran panjang gelombang maksimum yang dikenal dengan nama efek batokromik atau efek hiperkromik. Efek batokromik (Δλmax) ialah pergeseran absorpsi panjang gelombang maksimum (λmax). Pada antosianin teramati pergeseran warna dari merah menjadi merah kebiruan (bluing effect) akibat adanya kopigmentasi. Efek hiperkromik (ΔA), ialah peningkatan intensiatas warna antosianin setelah kopigmentasi.
Pada anggur, ketidakstabilan dan reaktivitas antosianin bersama-sama dengan reaksi kopigmentasi diperkirakan bertanggung jawab terhadap perubahan warna pada proses pemeraman anggur. Pada buah dan produk berry, warna juice, puree, jam, dan sirup dapat dipertajam dan distabilkan dengan kopigmentasi, sehingga meningkatkan penerimaan konsumen dan memperpanjang umur simpan produk (Viguera et al., 1999; Rein dan Heinonen, 2004).
Senyawa yang digunakan untuk proses kopigmentasi disebut kopigmen. Kopigmen adalah suatu senyawa yang tidak berwarna yang biasanya terdapat secara alami dalam sel tanaman. Jenis senyawa kopigmen yang umumnya digunakan adalah flavonoid (termasuk di dalamnya adalah flavon dan flavonol) dan polifenol lain (asam fenolik), alkaloid, asam amino dan asam organik (Markakis, 1982).
Dari jenis flavonol, rutin dan quercetin merupakan jenis kopigmen yang menghasilkan efek kopigmentasi kuat. Rutin menginduksi pergeseran batokromik 30nm dan quercetin 28nm terhadap malvidin 3.5-diglukosida pada pH 3.2 (Chen and Hrazdina, 1981).
Dari golongan asam fenolik, ferulic acid merupakan salah satu yang tergolong efisien sebagai kopigmen (Markovic et al., 2000). Rein dan Heinonen (2004) menggunakan ferulic acid, sinapic acid, dan rosmarinic acid untuk memperbaiki kualitas juice berry. Selain itu gallic acid (Rein, 2005), tanin (Cai et al., 1990), dan chlorogenic acid (Brouillard et al., 1991) juga dapat digunakan sebagai kopigmen. Rein dan Heinonen (2004) menyatakan bahwa intensitas pelargonidin 3-glukosida yang dikopigmentasi oleh ferulic acid dan caffeic acid meningkat dan mampu bertahan selama penyimpanan.
Seperti halnya reaksi pada antosianin umumnya, reaksi kopigmentasi juga dipengaruhi oleh pH (Wilska-Jeszka dan Korzuchowaka, 1996), temperatur (Ba Kowska et al., 2003), pelarut (Brouillard et al., 1991) dan struktur molekulnya. Efek kopigmentasi akan lebih efisien jika konsentrasi kopigmentasi lebih besar dibandingkan konsentrasi antosianin (Asen et al., 1972; Scheffeldt dan Hrazdina, 1978). Pada pH rendah, karena dominasi utama kation flavium (pH < 2), reaksi kopigmentasi kurang efektif dibandingkan pada pH 2-5, yaitu ketika terjadi kesetimbangan dengan bentuk quinoidalnya (Williams dan Hrazdina, 1979).
E. ROSMARINIC ACID
Rosmarinic acid (C18H16O8,) merupakan antioksidan alami dalam bentuk asam karboksilat, memiliki bentuk dimer caffeic acid, yang berwarna merah oranye yang sedikit larut dalam air, tetapi mudah larut pada pelarut organik. Parnham dan Kesselring (1985) mengungkapkan bahwa rosmarinic acid mampu berperan sebagai antioksidan, antiinflamatori, antimutagen, antibakteri, dan antivirus.
Gambar 4. Rosmarinic acid
Rosmarinic acid banyak ditemukan pada tanaman herbal dari suku Boraginaceace dan Lamiaceae (Litvinenko et al., 1975), seperti rosemary, oregano, sage, thyme, dan peppermint. Hasil penelitian Olah et al., (2003) menunjukkan bahwa daun tanaman kumis kucing (Orthosiphon stamineus Benth.) mengandung komponen/senyawa turunan caffeic acid, salah satunya rosmarinic acid.
F. MINUMAN RINGAN
Minuman ringan didefinisikan sebagai minuman tak beralkohol yang mengandung sirup, esens, atau konsentrat buah yang dicampur dengan air atau air berkarbonasi (carbonated water) dengan proporsi tertentu (Thorner dan Herzberg, 1978). CODEX General Standard for Food Additives Online Database (2009) menggolongkan minuman ringan menjadi beberapa kategori, yaitu: (1) air minum, (2) jus buah dan sayur, (3) nektar buah dan sayur, (4) minuman bercita rasa, termasuk minuman berenegi dan minuman berelektrolit, serta (5) kopi, teh, minuman herbal, minuman sereal dan minuman dari biji-bijian termasuk biji coklat.
Persyaratan minuman ringan menurut Green (1981), antara lain: 1. Campuran minuman tidak menimbulkan after taste yang kurang
disukai.
2. Menggunakan air yang memenuhi standar. 3. Disuguhkan dalam keadaan yang cukup dingin.
4. Jika digunakan es sebagai pendingin maka digunakan es yang tidak mudah mencair.
5. Karbonasi yang cukup memberikan efek yang menyegarkan. 6. Wadah yang jernih dan bersih.
Bahan-bahan penyusun minuman ringan antara lain air, pemanis, asam, pewarna, dan pengawet. Air merupakan komponen terbesar dari minuman ringan. Persentase air dalam minuman ringan bisa mencapai 90% sehingga kualitas air yang digunakan dalam industri minuman ringan harus benar-benar terkontrol (Hougton dan Mc Donald, 1978). Air yang digunakan untuk minuman ringan harus melalui test potability sehingga dapat diminum dan bebas dari kontaminan. Di samping itu untuk mendapatkan produk akhir yang jernih dan menarik, air harus memiliki kekeruhan yang rendah (Thorner dan Herzberg, 1978). Air yang digunakan dalam industri minuman ringan telah melalui tahapan penghilangan kesadahan, penghilangan koloid dan padatan terendap, penghilangan warna, rasa, dan bau menyimpang, serta pengurangan alkalinitas, dan telah mengalami sterilisasi (Hougton dan Mc Donald, 1978).
Pemanis yang digunakan untuk minuman ringan bisa berupa gula atau pemanis buatan. Gula yang digunakan untuk minuman ringan antara lain gula kristal, gula invert, maupun gula cair (Woodroof dan Philips, 1981). Pemanis alami yang paling banyak digunakan dalam industri minuman ringan adalah sukrosa yang biasanya berupa sirup dengan konsentrasi tinggi. Konsentrasi sukrosa yang biasa ditambahkan pada minuman ringan berkisar antara 10-13% (Woodroof dan Philips, 1981).
Asam merupakan komponen penting ketiga setelah air dan gula dalam pembuatan minuman ringan. Jenis asam yang biasa digunakan dalam pembuatan minuman ringan antara lain asam sitrat. Konsentrasi asam sitrat yang biasa digunakan dalam minuman ringan adalah 1.285g/l (Woodroof dan Philips, 1981).
Pewarna digunakan dalam pembuatan minuman ringan untuk meningkatkan daya tarik konsumen. Pewarna yang ditambahkan dalam minuman ringan sebaiknya memiliki stablitas yang baik terhadap pengaruh komponen seperti gula, asam, dan flavor. Pewarna alami cendrung lebih aman bila dibandingkan pewarna sintetik (Jackman dan Smith, 1996). Namun demikian harga pewarna sintetik cendrung lebih ekonomis dibandingkan pewarna alami. Beberapa pewarna alami yang sering
digunakan adalah antosianin, karoten, dan krolofil, sedangakan pewarna sintetik yang digunakan misalnya FD&C (Food and Drugs Colorant) dalam berbagai jenis warna (Winarno, 1997).
G. SPEKTROSKOPI
Prinsip spektroskopi didasarkan pada adanya interaksi dari energi radiasi elektromagnetik dengan zat kimia. Hasil interaksi tersebut dapat menimbulkan satu atau lebih peristiwa, seperti pemantulan (refleksi), pembiasan (refraksi), interferensi, difraksi, penyerapan (absorpsi), flouresensi, fosforesensi, dan ionisasi. Dalam analisis kimia, peristiwa absorpsi merupakan dasar dari cara spektroskopi.
Spektroskopi dapat digunakan dalam aplikasi kualitatif, karena proses absorpsi tersebut bersifat unik/spesifik untuk setiap zat kimia atau segolongan zat kimia. Spektroskopi juga dapat digunakan dalam aplikasi kuantitatif, karena banyaknya absorpsi berbanding lurus dengan banyaknya zat kimia. Instrumen yang digunakan dalam metode analisis dengan prinsip spektroskopi ini disebut dengan spektrofotometri.
Spektroskopi absorpsi memiliki prinsip dasar apabila suatu cahaya putih atau radiasi dilewatkan melalui larutan berwarna maka radiasi melalui larutan berwarna akan diserap secara selektif dan radiasi lainnya akan diteruskan. Absorbansi maksimum larutan berwarna terjadi pada daerah yang berlawanan. Karena warna yang diserap adalah warna komplementer dari warna yang diamati. Contohnya larutan yang berwarna merah akan menyerap radiasi maksimum warna hijau.
H. KROMAMETER
Kromameter merupakan alat analisis warna secara tristimulus untuk mengukur warna yang dipantulkan oleh suatu permukaan. Prinsip kerja alat ini adalah mengukur perbedaan warna melalui pantulan cahaya oleh permukaan sampel (Hutching, 1999).
Sistem notasi warna adalah cara sistematik dan obyektif dalam menyatakan dan mendeskripsikan suatu jenis warna. Di antara sistem warna terdapat tiga macam notasi warna, yaitu ICI, Munsell, dan Hunter.
Sistem ICI (International Comission on Ilumination) didasarkan pada semua warna dapat dibentuk tiga warna dasar, yaitu merah, hijau, dan biru. Masing-masing warna dinyatakan sebagai X untuk warna merah, Y untuk hijau, dan Z untuk biru (Soekarto,1997).
Sistem notasi warna yang paling banyak digunakan adalah sistem Hunter yang memiliki tiga parameter untuk mendeskripsikan warna, yaitu L, a, dan b. Nilai L menunjukkan cerah atau gelapnya sampel dan memiliki skala dari 0 sampai 100. Nilai 0 menyatakan sampel sangat gelap (warna hitam) dan 100 menyatakan sampel sangat cerah (warna putih) untuk menyatakan kecerahan yang memiliki nilai 0-100. Nilai a menunjukkan derajat merah atau hijau sampel, dengan a positif menunjukkan warna merah dan a negatif menunjukkan warna hijau. Nilai a memiliki skala dari -80 sampai 100. Nilai b menunjukkan derajat kuning atau biru, dengan b positif menunjukkan warna kuning dan b negatif menunjukkan warna biru. Nilai b memiliki skala dari -70 sampai 70 (Francis, 1996).
Gambar 5. Diagram warna Hunter L, a, b
Pengukuran warna dengan sistem Munsell didasarkan pada tiga atribut subyektif warna, yaitu warna kromatik (hue), kecerahan (value), dan intensitas warna (chroma atau saturation). Warna kromatik (hue) meliputi warna monokromatik yang terdiri dari warna-warna pelangi dan warna campurannya. Kecerahan (value) menyatakan warna akromatik (gelap dan terangnya warna) yang berkisar dari warna hitam pekat sampai
putih bersih. Nilai intensitas warna (chroma) berkisar dari nilai tidak berwarna sampai warna penuh.
Nilai chroma (C) merupakan resultan dari nilai a dan b yang dihitung berdasarkan rumus C = √a2+b2. Semakin tinggi nilai C maka warna akan terlihat semakin tua karena intensitasnya yang meningkat. Nilai hue menunjukkan posisi warna sampel dalam diagram warna. Nilai hue menyatakan panjang gelombang dominan yang menentukan apakah warna tersebut merah, kuning, atau hijau. Nilai hue dihitung dengan rumus hue = (arctan (b/a)).
Nilai hue yang diperoleh kemudian dicocokkan dengan nilai hue yang ada pada bola imajiner Munsell (Gambar 6), sehingga diperoleh data warna secara obyektif yang merupakan kisaran warna yang mendekati warna sampel sebenarnya. Nilai hue yang diperoleh harus berada dalam bentuk nilai derajat radian agar dapat diinterpretasikan ke dalam bola imajiner Munsell, setiap derajat radian tertentu menyatakan warna visual yang dilihat.
Gambar 6. Bola imajiner Munsell
Di dalam bola imajiner Munsell telah terdapat pembagian wilayah warna pada sudut-sudut tertentu. Wana merah (R) berada pada wilayah 210 sampai 520 pada kuadran satu, warna kuning-merah (YR) berada pada wilayah 530 sampai 840 pada kuadran satu, warna kuning (Y) berada pada wilayah 850 pada kuadran satu sampai 210 pada kuadran dua, warna hijau-kuning (GY) berada pada wilayah 220 sampai 610 pada kuadran dua, warna hijau (G) berada pada wilayah 620 pada kuadran dua sampai 00 pada
kuadran tiga, warna biru-hijau (BG) berada pada wilayah 10 pada kuadran tigasampai 350 pada kuadran tiga, warna biru (B) berada pada wilayah 360 sampai 810 pada kuadran tiga, warna ungu-biru (PB) berada pada wilayah 820 pada kuadran tiga sampai 36 0 pada kuadran empat, warna ungu (P) berada pada wilayah 370 sampai 710 pada kuadran empat, dan warna merah-ungu (RP) berada pada wilayah 720 pada kuadran empat sampai 200 pada kuadran satu.
Interpretasi warna hue pada bola imajiner Munsell juga dipengaruhi oleh nilai a dan b-nya. Jika nilai hue yang diperoleh pada metode Hunter bernilai negatif maka untuk menginterpretasikan warnannya pada diagram Munsell, nilai negatifnya dihilangkan terlebih dahulu, kemudian diukur pada kuadran yang paling tepat atau sesuai dengan nilai a dan b-nya. Pada kuadaran satu, a dan b bernilai positif. Pada kuadran dua, a bernilai negatif dan b bernilai positif. Pada kuadran tiga, a dan b bernilai negatif. Pada kuadran empat, a bernilai positif dan b bernilai negatif. Setelah didapatkan interpretasi warna pada diagram Munsell maka data ini dapat dibandingkan dengan penampakan visual yang ada.
Tabel 2. Interpretasi warna hue pada bola imajiner Munsell
Hue (⁰) Warna
21 (kuadran I) - 52 (kuadran I) Merah 53 (kuadran I) – 84 (kuadran I) Merah-Kuning 85 (kuadran I) – 21 (kuadran II) Kuning 22 (kuadran II) – 61 (kuadran II) Hijau-Kuning 62 (kuadran II) – 0 (kuadran III) Hijau 1 (kuadran III) – 35 (kuadran III) Biru-Hijau 36 (kuadran III) – 81 (kuadran III) Biru 82 (kuadran III) – 36 (kuadran IV) Ungu-Biru 37 (kuadran IV) – 71 (kuadran IV) Ungu