13
Fotokatalitik Dekomposisi Air Menjadi Hidrogen Sebagai Energi Bersih
dan Ramah Lingkungan
Husni Husin1,2
1 Laboratorium Teknik Reaksi Kimia dan Katalisis Jurusan Teknik Kimia,
Fakultas Teknik, Universitas Syiah Kuala
2 Program Magister Teknik Kimia Program Pascasarjana Universitas Syiah Kuala
Gedung Teknik Kimia Fakultas Teknik, Kampus Darussalam Banda Aceh, Indonesia
Abstract - This study was investigated the production of hydrogen from pure water over La-doped-NaTaO3
photocatalyst. The aimed of this work was to evaluate the effect of lanthanum doped (La3+) at different
concentration on NaTaO3 photocatalyst. The photocatalyst samples were synthesized by mean of a technique of
sol-gel synthesis. The phases of LaxNa(1-x)TaO3 were characterized by analysis of X-ray diffractometer (XRD). It
can be observed from the XRD results that the diffraction peaks at 2θ 32,6o became sharper and the peak
intensities increased after doping lanthanum. The effect of doping at different concentrations on the photocatalytic activity of LaxNa(1-x)TaO3 for splitting of water into hydrogen and oxygen was studied under UV
light irradiation. The results revealed that the LaxNa(1-x)TaO3 exhibit higher photocatalytic activity than the
non-doped NaTaO3. The highest gas (H2 and O2) evolution was observed with metal doping level at 2.0 mol %. Keywords: hydrogen, clean energy, water-splitting, LaxNa(1-x)TaO3.
I. PENDAHULUAN
Energi berkelanjutan dan lingkungan bersih adalah dua perhatian penting masyarakat modern. Dewasa ini, sumber utama energi untuk keperluan industri dan lainnya adalah dari bahan bakar fosil. Penurunan cadangan minyak bumi dan meningkatnya masalah lingkungan telah merangsang para pakar energi untuk mencari sumber-sumber bahan bakar alternatif baru menggantikan bahan bakar berbasis minyak bumi. Hidrogen dari air merupakan salah satu energi alternatif untuk mengurangi ketergantungan pada bahan bakar fosil serta mengurangi masalah polusi. Hal ini dikarenakan air tergolong sumber energi bersih, tersedia dalam jumlah melimpah, mudah didapat, dan terjamin kontinuitasnya, selain itu yang tak kalah pentingnya adalah ramah lingkungan. Alasan ini menjadi faktor utama, air dipertimbangkan sebagai bahan baku energi masa depan dalam rangka mewujudkan teknologi hijau (green
technology). Para pakar energi dunia telah
memprediksi hidrogen merupakan kandidat pengganti energi fosil di masa depan (Pagliaro et al. 2010). Produksi bahan bakar hidrogen telah mendapat banyak perhatian karena harga minyak dan bahan bakar tak terbarukan semakin habis dan mahal. Selama ini, 95% produksi H2
berasal dari steam reforming gas alam, yang memiliki ketergantungan langsung pada bahan bakar fosil (Bowker 2011, Chen et al. 2010).
Fotokatalis adalah zat yang dapat mempercepat laju reaksi kimia dengan menggunakan energi foton dari cahaya matahari. Sejak penemuan evolusi hidrogen melalui elektroda kristal semikonduktor TiO2 tunggal (Fujishima
and Honda 1972), teknologi semikonduktor berbasis fotokatalitik water
splitting telah dianggap sebagai salah satu
pendekatan yang paling penting untuk memecahkan krisis energi dunia (Mao and Chen 2007). Teknologi ini sedang dikembangkan oleh para pakar energi untuk menuju kelayakan ekonomi yang
14
menguntungkan. Diperkirakan reaksi ini bisa menjadi topik hangat dan akan memberikan kontribusi dalam mendapatkan energi bersih dan berkelanjutan, serta memecahkan masalah energi dunia. Para pakar energi memprediksi hidrogen mampu menggantikan ketergantungan kita terhadap bahan bakar fosil yang memproduksi banyak CO2.
Reaksi water splitting pada fotokatalis atau semikonduktor terjadi dalam tiga langkah seperti ditampilkan pada Gambar 1. Semikonduktor memiliki potential reduksi (valence band,VB) atau dan potensial oksidasi (conduction band,
CB). Prinsip dasar water splitting
didasarkan pada konversi energi cahaya menjadi energi listrik ketika cahaya diserap oleh semikonduktor. Cahaya memiliki photon (hv) menyebabkan ionisasi intrinsik material semikonduktor tipe-n, selanjutnya meregenerasi elektron (-) pada conduction
band dan hole (+) pada valence band
(pers. 1). Cahaya mendorong elektron (-) dan hole (+) memecah molekul air menjadi gas oksigen dan ion hidrogen (pers. 2 dan 3).
Gambar 1. Mekanisme reaksi fotokatalitik water splitting menjadi hidrogen pada fotokatalis Tahapan reaksi fotokatalitik water
splitting menjadi hidrogen pada fotokatalis
adalah sebagai berikut:
Fotokatalis + 2hv 2e- + 2h+ (1) H2O + h+ H+ + OH (2) OH + h+ H+ + ½O 2 (3) 2H+ + 2e- H 2 (4) Reaksi total: H2O + 2hv H2 + ½O2 (5)
Secara bersamaan, elektron yang dihasilkan sebagai hasil dari persamaan (1) mereduksi ion hidrogen menjadi gas hidrogen (pers. 4). Untuk menfasilitasi reduksi dan oksidasi H2O oleh foto eksitasi
elektron dan hole, kedua potential reduksi dan oksidasi harus berada di antara band
gap fotokatalis. Band gab (BG) adalah
energi diantara valence band dan
conduction band semikonduktor. Untuk
menginduksi reaksi ini, energi foton diserap harus minimal 1,23 eV(Bak et al. 2002). Menurut persamaan ini, band gap optimal untuk produksi hidrogen adalah di bawah 2,0 eV. Elektron dan holes dapat saja bergabung (rekombinasi) di bulk atau permukaan semikonduktor dalam waktu yang sangat singkat melepaskan energi dalam bentuk panas atau foton (Kudo and Miseki 2009). Hal ini harus dihindari agar reaksi pembentukan H2 dari air dapat
berlangsung dengan baik.
Fotokatalitik produksi H2
menggunakaan semikonduktor telah dipelajari secara ekstensif sebagai alat potensial untuk memproduksi H2 energi
bersih. Beberapa fotokatalis seperti: Sr2Nb2O7 (Kudo, Kato and Nakagawa
1999), NaTaO3 (Kato, Asakura and Kudo
2003), TiO2 (Zou et al. 2007), SrTiO3
(Domen et al. 1986), K4Nb6O17 (Kudo et
al. 1989) telah disintesis dan terbukti mampu menghasilkan hidrogen. Diantara berbagai oksida logam, NaTaO3
merupakan fotokatalis yang paling efisien untuk dekomposisi air di bawah iradiasi sinar ultraviolet ( <300nm) (Kato and Kudo 2003).
Ada beberapa strategi dasar untuk meningkatkan efisiensi fotokatalis dalam upaya meminimalkan elektron dan holes bergabung di bulk atau permukaan. Kristalinitas tinggi mutlak diperlukan
15 untuk mengurangi rekombinasi antara
photogenerated elektron dan hole di
permukaan fotokatalis. Makin tinggi kristalinitas suatu fotokatalis makin kecil kemungkinan terjadinya rekombinasi atara
elektron (e-) dan hole (h+) pada permukaan atau bulk fotokalatis, dengan kata lain efisiensi fotokatalitik semakin tinggi. Salah satu cara untuk meningkatkan kristalinitas fotokatalis adalah dengan menambahkan doping seperti La, Bi, Sm, dan lain-lain.
Oleh karena itu, kajian ini mempelajari pengaruh doping lanthanum terhadap karakteristik dan kinerja NaTaO3
yang dihasilkan. Data karakteristik struktur kristalnya ditentukan dengan menggunakan difraktogram yang diperoleh dari X-Ray diffractometer (XRD). Pengaruh penambahan doping La3+ dalam berbagai konsentrasi terhadap kinerja fotokatalis NaTaO3 dalam reaksi water
splitting atau dekomposisi air murni
menjadi hidrogen (H2) dan oksigen (O2)
juga dievaluasi.
II. METODELOGI PENELITIAN Bahan-bahan yang digunakan
Bahan-bahan yang digunakan dalam penelitian ini adalah sebagai berikut: tantalum klorida (TaCl5, 99.9%): Acros
Organics, sodium hidroksida (NaOH, 99.9%): Acros Organics, asam sitrat
anhydrous (C6H8O7, 99.5%): Acros
Organics, hidrogen peroksida (H2O2,
35%):Showa Chemical Co. Ltd, larutan ammonia (NH4OH, 35%): Fisher
Scientific, metanol (CH3OH, 99.5%)
solution: Acros Organics, (NO3)2.2H2O
(Acros Organik; 99,9%) air suling, gas argon (Ar 99.99%), dan gas helium (He 99.99%).
Preparasi Katalis
La-doped NaTaO3 (LaxNa(1-x)TaO3)
disiapkan melalui prosedur sol-gel menggunakan larutan hidrogen peroksida sebagai pelarut . Sintesis dilakukan dengan
cara berikut ini: TaCl5 dilarutkan dalam
hidrogen peroksida dan kemudian NaOH dilarutkan dalam aquades (NaOH berlebih 5-6%) alkali untuk mengimbangi kehilangan Na karena penguapan pada proses kalsinasi. Larutkan La(NO3)2.2H2O
ke dalam beaker glass sesuai jumlah mol yang diinginkan (0,5; 1,0; 2,0; 5,0; dan 8,0% mol) menggunakan aquades. Campuran diaduk menggunakan magnetic
stirrer (dilambangkan: larutan I). Sambil
diaduk terus, siapkan lautan 50 ml asam sitrat, selanjutnya teteskan perlahan-lahan ke dalam larutan I di atas untuk menghasilkan larutan sol pada suhu kamar. pH larutan diatur sampai 4 menggunakan larutan NH4OH untuk mengionisasi asam
sitrat. Campuran tersebut kemudian dipanaskan dan temperatur dipertahankan konstan pada 90 oC sampai terbentuk gel putih. Kemudian gel dikeringkan dalam oven pada suhu 100 oC selama lebih kurang 5 jam, selanjutnya dilakukan pre-kalsinasi pada suhu 450 oC dan akhirnya dilanjutkan kalsinasi pada suhu 900 oC
selama 12 jam dengan dialiri udara untuk meningkatkan kristalinitas LaxNa(1-x)TaO3.
Sampel fotokatalis dikarakterisasi dengan X-ray diffractometer (XRD), bertujuan untuk mengetahui struktur kristal fotokatalis yang terbentuk.
Uji Kinerja Katalis
Reaksi fotokatalitik dilakukan dalam reaktor gelas pyrex. Air murni atau aquades sebanyak 1000 ml dimasukkan ke dalam reaktor. Fotokatalis dalam bentuk bubuk sebanyak 0,5 g didispersi ke dalam air menggunakan pengaduk magnetik. Sebelum disinari cahaya, udara di dalam reaktor dibersihkan dengan dialirkan gas Ar. Selanjutnya larutan dalam reaktor disinari dengan sinar ultra violet (UV) untuk menyerap elektron dan proton oleh fotokatalis. Sumber radiasi menggunakan lampu merkuri 400 W bertekanan tinggi. Laju alir gas H2 dan O2 di alirkan ke
16
kolektor gas untuk mengetahui jumlah produksi gas selama reaksi berlangsung. III. HASIL DAN PEMBAHASAN X-ray difraktometer (XRD) NaTaO3
analisis
Karakterisasi dengan XRD bertujuan untuk memperoleh informasi perubahan struktur mikro dan kristalin yang terjadi selama proses sintesis. Sampel
discan dari 2 20o - 700. Data yang diperoleh berupa jarak antar bidang, intensitas dan sudut (2θ) yang kemudian dicocokkan dengan data pola difraksi sinar-X JCPDS (Joint Committee for
Powder Difraction Standard), sehingga
senyawa yang terdapat dalam sampel dapat diidentifikasi. Difraktogram yang diperoleh dari sampel NaTaO3 tanpa
doping disajikan pada Gambar 2.
Gambar 2. Difraktogram XRD sampel NaTaO3 tanpa doping
lanthanum
Gambar 2 memperlihatkan pola difraksi sinar-X sampel NaTaO3 tanpa
doping lantanum. Tiga puncak utama karakteristik NaTaO3 terindikasi pada 2θ
22,9o; 32,6o; dan 52,7o; sesuai dengan JCPDS No. 25-0863. Puncak-puncak lainnya juga merupakan pola difraksi
NaTaO3 dengan intensitas yang lebih
rendah. Dari pola difraksi tampak bahwa NaTaO3 memiliki derajat kristal yang
tinggi terindikasi dari pola puncak yang runcing dan sempit.
Pengaruh doping lantanum
Difraktogram hasil perlakuan penambahan lantanum (2% dan 5% mol) pada pembuatan NaTaO3 disajikan pada
Gambar 3 dan 4. Berdasarkan Gambar 3 dan 4 tampak bahwa pola difraksi LaxNa (1-x)TaO3 sama dengan pola difraksi NaTaO3
tanpa doping. Posisi puncak masih berada pada 2θ yang sama. Perbedaan nyata yang terlihat dari difraktogram LaxNa(1-x)TaO3
adalah pada intensitasnya.
Gambar 3. Difraktogram XRD sampel LaxNa(1-x)TaO3 (x = 0.02)
Intensitas Puncak pada 2θ 22,9o terlihat menurun, sedangkan intensitas pada 2θ 32,6o tampak meningkat. Selain
itu, intensitas 5 puncak karakteristik kekanan meningkat dibanding pada NaTaO3 tanpa doping. Fakta ini
menunjukkan bahwa dengan pemberian doping lanthanum tidak menyebabkan perubahan struktur kristal NaTaO3.
17 Gambar 4. Difraktogram XRD sampel
LaxNa(1-x)TaO3 (x= 0,05)
Pemberian doping diharapkan untuk meningkatkan derajat kristalinitas sampel. Seperti yang didemontrasikan dari pola difraksi sinar-x, meski intensitas puncak tertinggi pada 2θ 22,9o menurun, tetap saja derajat krintalinitasnya makin tinggi, terindikasi dari makin menyempitnya bentuk pola puncak difraksi. Derajat kristal yang tinggi dari sampel akan menghasilkan pemisahan muatan elektron dan proton lebih baik, dengan demikian diharapkan reaksi pembentukan H2 dari air dapat berlangsung
dengan mudah. Dari difraktogram juga terlihat jelas bahwa tidak ada pengotor yang terbentuk setelah penambahan lantanum (La3+). Peningkatan intensitas
puncak karakteristik NaTaO3 pada 2θ 32,6o
dan puncak lainnya disebabkan karena ion La3+ tersubtitusi pada kisi atom Na+. Dari difraktogram tersebut dapat dikatakan bahwa penambahan La3+ pada NaTaO3
tidak menyebabkan perubahan struktur kristal NaTaO3.
Aktivitas Fotokatalis
Aktivitas fotokatalis didefinisikan sebagai ukuran terbentuknya gas hidrogen dan oksigen per satuan waktu yang dipengaruhi oleh konsentrasi lantanum
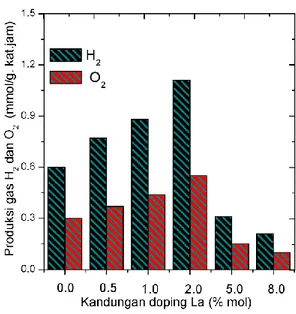
yang digunakan pada preparasi katalis. Gambar 5 menampilkan hubungan antara kadar doping La terhadap laju produksi gas H2 dan O2 dari air. Dari Gambar 5 tampak
bahwa NaTaO3 tanpa doping lantanum
menunjukkan evolusi gas H2 dan O2
masing-masing 0.61 dan 0, 31 (mmol/g.kat jam).
Gambar 5. Produksi gas H2 dan O2 pada
berbagai kandungan doping ions La3+ (fotokatalis (0,5 g) didispersi dalam air murni (1 L).
Kinerja fotokatalis terlihat meningkat proporsional ketika ditambahkan doping lantanum mulai dari 0,5%; 1,5%, dan 2% mol, di mana gas tertinggi diperoleh pada konsentrasi La 2% mol. Fenomena ini mengisyaratkan bahwa ketika lantanum ditambahkan pada kisi NaTaO3, derajat kristalinitas sampel
fotokatalis meningkat. Hal ini berpengaruh nyata terhadap pemisahan muatan elektron dan proton pada permukaan NaTaO3 dan dengan sendirinya
reaksi dekomposisi H2O menjadi H2 dan
O2 semakin efisien. Akan tetapi,
peningkatan doping 5% dan 8% mol menyebabkan evolusi H2 dan O2 menurun
18
kemungkinan karena pada konsentrasi La yang lebih tinggi dari 2% mol, sebagian dari doping lantanum tidak tersubtitusi ke dalam kisi NaTaO3 seperti yang dilaporkan
oleh group lain (Kato et al. 2003). Pada kondisi ini lantanum bertindak sebagai pengotor dan dapat mempengaruhi rekombinasi antara electron (e-) dan hole
(h+) pada permukaan NaTaO3 sehingga
mengganggu reaksi dekomposisi air menjadi hidrogen. Pengotor ini kemungkinan bersifat amorphous dan konsentrasinya kecil sehingga tidak terdeteksi pada pola difraksi sinar-X.
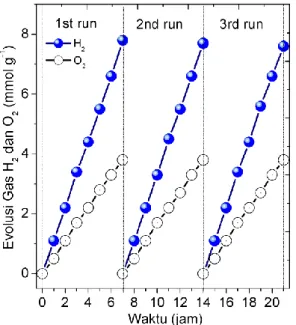
Gambar 6 mendemonstrasikan hubungan antara produksi gas terhadap waktu reaksi dekomposisi air. Reaksi berlangsung hingga 21 jam, diulangi tiap 3 kali 7 jam. Produksi gas meningkat secara proporsional seiring dengan bertambahnya waktu reaksi. Kinerja fotokatalis LaxNa (1-x)TaO3 terlihat stabil sampai reaksi
dihentikan.
Gambar 6. Hubungan antara waktu kon-tak dan produksi gas (fotokatalis (0,5 g) didispersi dalam air murni (1 L), reaksi dihentikan selama 7 jam.
IV. KESIMPULAN
Penelitian tentang fotokatalitik dekomposisi air pada fotokatalis LaxNa (1-x)TaO3 menjadi hidrogen sebagai energi
bersih dan ramah lingkungan telah dilakukan. Penggunaan NaTaO3 tanpa
doping La3+ menunjukkan aktivitas yang rendah. Ketika La3+ disubtitusi ke dalam
kisi NaTaO3 derajat kristalilnitas sampel
meningkat. Konsentasi doping berpengaruh nyata terhadap aktifitas fotokatalitik dekomposisi air menjadi hydrogen dan oksigen. Produksi gas tertinggi diperoleh pada konsentrasi doping 2% mol. Fotokatalis LaxNa(1-x)TaO3 sangat
potensial untuk kandidat dekomposisi H2O
menjadi H2 sebagai energy bersih.
Ucapan Terima Kasih
Penulis mengucapkan terima kasih kepada Prof. Bing-Joe Hwang, Ph.D dan Dr. Wei-Nien Su dari National Taiwan University of Science and Technology (NTUST) atas diskusi yang sangat berharga mengenai penelitian ini.
DAFTAR PUSTAKA
Bak, T., J. Nowotny, M. Rekas & C. C.
Sorrell 2002,
Photo-electrochemical hydrogen generation from water using solar energy. Materials-related aspects
International Journal of Hydrogen Energy, 27, 991-1022.
Bowker, M. 2011, Sustainable hydrogen production by the application of
ambient temperature
photocatalysis. Green Chemistry, 13, 2235-2246.
Chen, X., S. Shen, L. Guo & S. S. Mao 2010, Semiconductor-based Photocatalytic Hydrogen Generation. Chemical Reviews,
19 Domen, K., A. Kudo, T. Onishi, N. Kosugi
& H. Kuroda 1986, Photocatalytic decomposition of water into hydrogen and oxygen over nickel(II) oxide-strontium titanate (SrTiO3) powder. 1. Structure of
the catalysts. The Journal of
Physical Chemistry, 90, 292-295.
Fujishima, A. & K. Honda 1972, Electrochemical photolysis of water at a semiconductor electrode.
Nature 238, 37.
Kato, H., K. Asakura & A. Kudo 2003, Highly Efficient Water Splitting into H2 and O2 over
Lanthanum-Doped NaTaO3 Photocatalysts with
High Crystallinity and Surface Nanostructure. Journal of the
American Chemical Society, 125,
3082-3089.
Kato, H. & A. Kudo 2003, Photocatalytic water splitting into H2 and O2 over
various tantalate photocatalysts.
Catalysis Today, 78, 561-569.
Kudo, A., H. Kato & S. Nakagawa 1999, Water Splitting into H2 and O2 on
New Sr2M2O7 (M = Nb and Ta)
Photocatalysts with Layered Perovskite Structures: Factors Affecting the Photocatalytic Activity. The Journal of Physical
Chemistry B, 104, 571-575.
Kudo, A. & Y. Miseki 2009, Heterogeneous photocatalyst materials for water splitting.
Chemical Society Reviews, 38,
253-278.
Kudo, A., K. Sayama, A. Tanaka, K. Asakura, K. Domen, K. Maruya & T. Onishi 1989, Nickel-loaded K4Nb6O17 photocatalyst in the
decomposition of H2O into H2 and
O2: Structure and reaction
mechanism. Journal of Catalysis, 120, 337-352.
Mao, S. S. & X. Chen 2007, Selected nanotechnologies for renewable energy applications. International
Journal of Energy Research, 31,
619-636.
Pagliaro, M., G. Athanasios, Konstandopoulos, R. Ciriminnaa & G. Palmisanoa 2010, Solar hydrogen: fuel of the near future.
Energy & Environmental Science,
3, 279-287.
Zou, J. J., H. He, L. Cui & H. Y. Du 2007, Highly efficient Pt/TiO2
photocatalyst for hydrogen generation prepared by a cold plasma method. International Journal of Hydrogen Energy, 32,