LETHAL TIME 50 CENDAWAN Beauveria Bassiana DAN
METARHIZIUM ANISOPLIAE TERHADAP SARCOPTES
SCABIEI
(Lethal Time 50 of Beauveria bassiana and Metarhizium anisopliae Fungy
on Sarcoptes scabiei)
R.Z.AHMAD,D.HARYUNINGTYAS danA.WARDHANA
Balai Besar Penelitian Veteriner, Jl. R.E. Martadinata No. 30, Bogor 16114
ABSTRACT
Beauveria bassiana and Metarhizium anisopliae fungi were entomophagous fungi. These fungi belong to
Deuteromycetes. The aim of this experiment is to study lethal time 50 (LT50) ofB. bassiana and M. anisopliae
isolates against S. scabiei mites from goat by in vitro test. After multiplication these isolates were tested with the addition of 105, 106 and 107 spores (conidias) of B. bassiana and M. anisopliae to S. scabiei mite in counting chamber. The killed mites were counted in specific times. The results showed that LT50 of M.
anisopliae was different from B. bassiana in reducing S. scabiei mites.
Key Words: Beauveria bassiana, Metarhizium anisopliae, Sarcoptes scabiei, Lethal Time
ABSTRAK
Cendawan Beauveria bassiana dan Metarhizium anisopliae diketahui sebagai cendawan entomofagus. Cendawan ini tergolong Deuteromycetes. Tujuan dari percobaan ini adalah mempelajari Lethal time 50 (LT50) isolat B. bassiana dan M. anisopliae terhadap tungau S. scabiei dari kambing melalui uji in vitro.
Setelah kedua isolat diperbanyak, isolat tersebut diuji dengan cara menambahkan spora B.bassiana dan M.
anisopliae sebanyak 105, 106 dan 107 pada tungau S. scabiei. yang tersedia pada kamar hitung. Tungau yang mati dihitung selama waktu tertentu. Hasil menunjukkan LT50 M. anisopliae mempunyai perbedaan waktu
dengan B.bassiana dalam mereduksi tungau S. scabiei.
Kata Kunci: Beauveria bassiana, Metarhizium anisopliae, Sarcoptes scabiei, Lethal Time
PENDAHULUAN
Ternak ruminansia kecil domba dan kambing adalah komoditas ternak yang dipelihara oleh petani-petani kecil di pedesaan. Pemeliharaannya dilakukan secara tradisional dengan menggantungkan kebutuhan hidupnya pada potensi alam disekitarnya. Beberapa masalah yang sering muncul dan dapat menjadi kendala adalah penyakit. Salah satu penyakit yang sering menyerang ternak ruminansia kecil adalah skabies. Penyebab skabies adalah tungau Sarcoptes scabiei. S. scabiei hidup, berkembang biak di lorong-lorong lapisan tanduk kulit hewan di bawah permukaan kulit. Gejala klinis yang ditimbulkan mulai dari kegatalan sampai dengan menyebabkan kematian. Masalah lain yang ditimbulkan
penyakit ini adalah penularannya kepada manusia (zoonosis). Pada kambing dan domba yang terkena skabies mengakibatkan penurunan kualitas kulit maupun woolnya (SEDDON 1968; SWARUP et al., 1983) sehingga nilai jual kulit
dan wool akan menurun. Mortalitas dapat mencapai 67% pada anak kambing penderita skabies (PUTRA dan GUNAWAN,1983).
Seperti di bagian dunia seperti Eropa, Asia dan Afrika, kejadian kudis pada ternak telah tersebar luas juga di seluruh Indonesia, terutama pada keadaan kekurangan pakan, di musim kemarau dan di lingkungan kandang yang kotor dengan prevalensi 4 – 11%. Adapun prevalensinya selama periode 5 tahun pada tahun 2004 kasus skabies di Indonesia adalah 0,022% (BUDIANTONO, 2004). Menurut SURATNO (2000) kerugian akibat skabies pada
kambing di pulau Lombok kurang lebih Rp 1.633.158.750/ tahunnya.
Pemakaian obat-obatan untuk skabies umumnya dengan akarisida seperti benzena hexa chlorida (BHC), Coumaphous dan ivermectin dapat juga belerang, olie bekas dan ketepeng (MANURUNG dan KUSUMANINGSIH, 1996). Aplikasi obat dilakukan melalui perendaman (Dipping), disikat (Brushing), penyemprotan (Spraying), oral dan parenteral. Pemakaian cendawan Beauveria bassiana dan
Metarhizium anisopliae dapat merupakan salah
satu pilihan pengendalian penyakit skabies yang baik, selain pemakaian insektisida organokhlorin yang sudah umum dipakai dan mulai menimbulkan masalah resistensi dan efek residu (OBRIEN,1999). Pemakaian cendawan entomofagus seperti M. anisopliae sebagai kontrol biologis mempunyai prospek pengembangan cukup cerah seperti pada penggunaan kapang Duddingtonia flagrans unuk mereduksi H. contortus (AHMAD, 2004).
Cendawan B.bassiana dapat ditemukan di seluruh dunia. Inangnya yang dapat di infeksi meliputi Lepidoptera, Coleoptera dan Homoptera dan beberapa inang tersebut adalah hama serangga menyebabkan kerugian ekonomi (TECHNICAL BULLETIN, 2007). Cendawan imperfecti bahwa potensi sebagi agen mikroba untuk perkembangan komersial termasuk B.bassiana, M. anisopliae dan N.
rileyi. (MCCOY, 1990). Meskipun demikian,
samapi sejauh yang penulis ketahui penelitian dengan menggunakan M.anisopliae dan B.
bassiana untuk pengendalian S. scabei adalah
yang pertama di lakukan di dunia, namun kiranya cukup memberi harapan yang cerah untuk digunakan sebagai salah satu pengendali parasit S. scabei pada kambing. Tujuan dari percobaan ini untuk mempelajari lethal time 50
B. bassiana dan M anisopliae di dalam
mereduksi S. scabies secara in vitro. MATERI DAN METODE
Dalam percobaan in vitro untuk mengetahui
lethal time 50ini dipersiapkan isolat cendawan
B. bassiana dan M. anisopliae, tungau S. scabiei dari kambing donor, dan kamar hitung;
Perbanyakan kapang B. bassiana dan M.
anisopliae
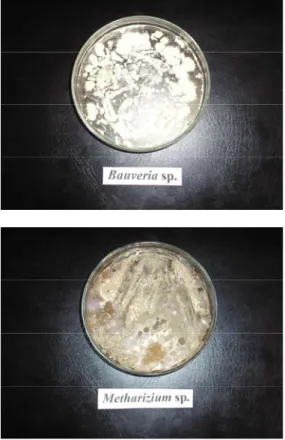
Isolat kapang B. bassiana dan M anisopliae (Gambar 1) diperbanyak dengan menginokulasikan pada media Potato Dextrose
Agar (PDA) pada suhu 25°C selama 7 hari,
setelah itu konidia (spora) dipanen dengan menambahkan air steril. Kemudian dikerok dengan kaca penutup dan konidia ditampung pada tabung serta dihitung jumlahnya sesuai keperluan dengan hemositometer.
Gambar 1. Isolat B. bassiana (a) dan M.anisopliae
(b) pada media PDA dengan inkubasi 7 hari pada suhu 25°C
Koleksi Sarcoptes scabiei
Kulit dari kambing yang terinfestasi S.
scabiei dikerok hingga menimbulkan rembesan
darah; selanjutnya diletakkan dibagian tepi cawan Petri. S. scabiei diisolasi dari kerokan
kulit dengan cara dilakukan penyinaran dengan lampu. Tungau akan menuju ke arah datangnya sinar lampu dengan kondisi yang hangat sehingga terpisah dari kerokan, selanjutnya dikoleksi untuk dilakukan pengujian.
Persiapan gelas kamar hitung
Gelas kamar hitung S. scabiei dirancang khusus berdasarkan penelitian SMITH et al.
(1999) dan digunakan untuk uji biologis (Gambar 2). Gelas kamar hitung dibuat dari balok kaca yang berukuran 35 x 75 mm dengan ketebalan 6 mm. Lubang berdiameter 20 mm dibuat di bagian tengahnya. Bagian bawah ditutup dengan kain katun yang dilekatkan menggunakan perekat sehingga menutupi lubang yang telah dibuat. Bagian atas ditutup dengan gelas obyek yang telah dilubangi berdiameter 5 mm dan dilekatkan menggunakan vaselin. Lubang pada gelas obyek tersebut ditutup dengan kain katun menggunakan perekat. Hal ini dimaksudkan untuk menjaga kelembaban dibagian dalam lubang. Selanjutnya, gelas kamar hitung diletakkan di dalam cawan petri berdiameter 90 mm. Sebelum tungau dimasukkan ke dalam lubang gelas kamar hitung, kain katun pada bagian bawah ditetesi dengan 500 µl serum yang akan diuji.
Pengujian tungau dengan kapang
Uji dilakukan berdasarkan metoda SMITH et
al. (2000) yang telah dimodifikasi. Cendawan M.anisopliae dan B. bassiana disiapkan
dengan cara memperbanyak konidianya dalam media agar lalu konidia tersebut dipanen dan dihitung dengan hemositometer, masing-masing cendawan yang akan digunakan adalah konsentrasi 0 x 106 (kontrol), 1x105, 1x106, 1x107dalam larutan Tween-80 (0,03%) hingga volume 500 µl. Sebagai kontrol katun lain direndam serum yang ditambah 500 µl 0,03% Tween 80. Setiap konsentrasi (3 ml) diuji pada kamar hitung masing-masing dengan 20 tungau. Tungau–tungau tersebut ditetesi larutan-larutan cendawan selama 10 menit pada cawan petri yang dilapisi kertas saring, lalu dipindahkan pada kamar hitung, setiap 24 jam tungau diperiksa dan yang mati dipindahkan. Mikrotiter plate kemudian ditutup
dan diinkubasi pada 30°C. Petri diperiksa terhadap infeksi oleh cendawan setiap hari selama 2 minggu mengikuti terjadinya infeksi pertama. Bila tungau mati karena cendawan akan tumbuh pada tungau tersebut, sehingga infeksi oleh cendawan diketahui ketika hifa eksternal dapat diobservasi pada kutikula tungau (ada bercak berwarna putih). Untuk membedakan tungau mati karena cendawan, lalu tungau tersebut diberi larutan sodium hipoklorit 2% selama 1 menit (tungau yang ada cendawannya tetap tumbuh cendawan), kemudian dipindah ke kertas saring yang lembab pada petri dish berdiameter 50mm. Sehingga setiap cawan Petri yang berisi tungau mati pada hari tertentu adalah dari satu kamar inkubasi. kemudian gelas inkubasi dilekatkan pada kamar hitung dan dipertahankan kelembabannya pada 80% mm/Hg dan suhu 25 – 27 C. Gelas inkubasi diperiksa setiap 24 jam untuk mengetahui jumlah tungau yang mati. Kematian diidentifikasi berdasarkan tidak adanya pergerakan ketika tungau disentuh dengan kuas/jarum. Cawan Petri tersebut selanjutnya dilekatkan dengan parafilm dan diinkubasi 30°C selanjutnya tungau yang mati diperiksa setiap hari untuk melihat hifa dari cendawan. Tungau yang mati karena hifa eksternal dicatat waktu kematiannya dalam satuan hari, dan untuk mengurangi adanya kontaminasi silang tungau yang mati tersebut dipindahkan ke Petri dish yang lain. Percobaan ini dilakukan 5 ulangan. Data yang didapat dihitung LT50 nya dengan bantuan program.
Gambar 2. Uji in vitro cendawan entomofagus
terhadap S. scabiei
HASIL DAN PEMBAHASAN
Lethal Time 50 (LT50) adalah waktu dalam
hewan percobaan dalam kondisi tertentu. Lebih rinci lagi dijelaskan ALABAMA (2008) Lethal
Time adalah waktu yang dihitung dengan suatu
konsentrasi kimiawi yang mengakibatkan kematian 50% populasi hewan percobaan. Sedangkan Lethal Dose 50 atau LD50 adalah
jumlah/tingkatan dosis dari suatu bahan yang dapat mematikan dengan dosis tunggal bahan kimia atau bahan lain yang diturunkan secara statistik yang dapat diduga menyebabkan kematian 50% dari organisme dalam serangkaian kondisi percobaan yang telah ditentukan. Antara LT50 dan LD50 berhubungan
erat karena antara waktu dan dosis yang akan dipakai menyebabkan kematian dan dapat berkorelasi. Kedua cendawan ini digolongkan entomofagus sehingga pada percobaan ini dapat dipelajari LT 50 pada masing-masing
cendawan, (Tabel 1) diperoleh jumlah dosis konidia (spora) antara 105, 106 dan 107 pada perlakuan isolat B. bassiana belum menunjukkan waktu LT50 yang berbeda
dibandingkan dengan perlakuan isolat M.
anisopliae. Pada perlakuan M. anisopliae
dengan dosis 107 lebih singkat waktu LT50
(1,78 hari) dibandingkan dosis 105, dan 106 (> 2 hari). Namun dibandingkan dengan Kontrol dosis (0 spora) sangat berbeda (LT50 > 4 hari).
Hal yang sama juga ditunjukkan pada perlakuan B. bassiana dengan dosis 107 lebih singkat waktu LT50 (2,24 hari) dibandingkan
dosis 105, dan 106(> 2,4 hari). Data di atas menunjukkan kedua isolat tersebut dapat membunuh tungau S. scabiei.
Bila dibandingkan dengan waktu kematian (hari) Tabel 1 juga menunjukkan B. bassiana lebih cepat membunuh tungau dibandingkan dengan M. anisopliae, pada dosis perlakuan 105, 106 namun pada dosis 107 lebih cepat waktu membunuh pada perlakuan M.
anisopliae. Hal ini sejalan dengan beberapa
percobaan telah dilakukan dengan M.
anisopliae sebagai pengendali Psoroptes ovis,
dengan dosis infeksi 104 sampai dengan 106
konidia/ml menunjukkan tungau dapat terinfeksi sebesar 2-25%, sedangkan dengan dosis tinggi 107 dapat mencapai 71 % (SMITH et al. 2000). Dari hasil kedua percobaan
perlakuan di atas menunjukkan semakin besar dosis maka semakin cepat waktu membunuhnya.
Pada percobaan ini serum yang digunakan adalah serum asal kambing yang terbukti lebih berkompeten untuk kelangsungan hidup S.
scabei setelah diuji bila dibandingkan dengan
serum asal hewan kelinci, sapi dan domba (HARYUNINGTYAS et al., 2007). Sedangkan cendawan entomofagus yang digunakan adalah isolat lokal dengan karakterisasi tumbuh pada media PDA sebagai berikut; Cendawan M.
anisopliae berwarna hijau permukaan
koloninya, seprti beludru, sedangkan B.
Bassiana berwarna putih. Daya
pertumbuhannya sedang, dengan jumlah konidia yang banyak dihasilkan. (AHMAD, 2008a). Di dalam membunuh tungau B.
Bassiana dan M. anisopliae mempunyai proses
membunuh dalam bentuk mekanisme sehingga menghasilkan nilai LT 50. Adapun
mekanismenya secara umum dapat dideskripsikan menurut STEETT dan WOOD (2008) pada serangga yang juga berlaku sama terhadap tungau S. scabiei.
1. Perlekatan pada stadium infeksi untuk kutikula serangga.
2. Germinasi dari konidium dan penetrasi kutikula serangga melalui sebuah germ tube dari konidium.
3. Pertumbuhan dari cendawan di dalam badan serangga (hemosel )dan penyebab kematian kematian serangga.
4. Penetrasi dari cendawan untuk permukaan serangga dan pembentukan dari konidia (dengan kelembaban dan suhu yang cocok). 5. Penghilangan dari konidia untuk lokasi saat
menginfeksi serangga yang dihinggapi dan memulai proses infeksi lagi.
Tabel 1. Lethal time 50 B. bassiana dan M. anisopliae terhadap S. scabiei
Lethal time 50 (hari) Dosis konidia Isolat
0 105 106 107
B. bassiana 4,1 ± 0,01 2,45 ± 0,01 2,43 ± 0,02 2,24 ± 0,01 M. anisopliae 4,3 ± 0,01 2,69 ± 0,02 1,78 ± 0,01 2,46 ± 0,02
Cendawan B. bassiana secara umum menginfeksi melalui integumen. Cendawan juga menyerang saluran pencernaan pupa H.
zea yang menyebabkan gangguan penyerapan
hingga akhirnya mati. B. bassiana menghasilkan toksin yang disebut beauvericin. Toksin tersebut membuat serangga kehilangan kesadaran setelah terjadi invasi sistem hemolimpha. Larva mati, pupa dan dewasa aslinya dari B. bassiana yang diinfeksi serangga tumbuh dg eksternal miselium dan berkembang menghasilkan konidia berwarna putih dengan satu atau dua hari sesudah serangga mati. Konidia dihasilkan melalui pertumbuhan konidiofor pada permukaan serangga (TECHNICAL BULLETIN, 2007).
Hal yang hampir sama juga dilakukan oleh
M. anisopliae. Infeksi dimulai melalui melalui
integument. Namun infeksi tergantung dari jenis serangga, kondisi lingkungan dan waktu infeksi. Kutikula dipenetrasi dengan bantuan enzim yang dihasilkan dari ujung hifa penetrasi. Hifa penetrasi akan meningkatkan jumlah hifa sebelum kematian dari inang. Miselium kemudian didistribusikan keseluruh bagian bawah badan serangga, kemudian akan meningkatkan jumlah hifa sekunder. Kelembaban, suhu lingkungan akan membantu hifa dalam beberapa hari sesudah serangga terinfeksi, umumnya melalui bagian yang lemah dari integument dan konidia dihasilkan oleh konidiofor dalam jumlah jutaan. Cendawan juga menghasilkan beberapa campuran toksin yang dapat membunuh inang. Siklus hidup dari cendawan ini dapat digambarkan sebagai berikut; (1) attachment(penempelan, pelampiran) konidia, (2) germinasi,(3) penetrasi germ tube, (4) pertumbuhan vegetative dan (5) pembentukan konidia (MCCOY, 1990)
Menurut NAHAR (2004) dan KUCERA (1990) di dalam melakukan infeksi serangga cendawan entomofagus memerlukan enzim hidrolisis (kitinase dan protease) hal ini perlunya dipelajari aktivaitas enzim protease dan kitinase yang mungkin dimiliki oleh isolat lokal. Hasil uji pemeriksaan terhadap aktivitas enzim hidrolisis seperti kitinase dan protease yang menunjukkan isolat lokal B. bassiana dan
M. anisopliae mempunyai aktivitas enzim
kitinase sebesar 0,026 unit/g dan 0,043 unit/g sedangkan protease sebesar 0,71 unit/g dan 0,35 unit/g (AHMAD, 2008b), hal tersebut
mendukung mekanisme infeksi cendawan entomofagus ini terhadap parasit penyebab skabies.
Sehubungan dengan adanya aktivitas enzim yang dimiliki kedua cendawan entomofagus dan ketersediannya sebagai isolat lokal, LT50
nya yang singkat dan berbeda nyata dengan kontrol maka B. bassiana dan M. anisopliae dapat digunakan sebagai pengendali hayati tungau S. scabiei. Untuk itu perlu dilanjutkan dengan uji in vivo.
KESIMPULAN
Pada percobaan ini LT50 B. bassiana adalah
2,24 hari pada dosis 107 spora, sedangkan LT50
M. anisopliae adalah selama 1,78 hari.
UCAPAN TERIMA KASIH
Ucapan ini terima kasih ini ditujukan kepada Badan Litbang Deptan yang telah memberikan dana penelitian melalui APBN 2005 dari BBalitvet. Terima kasih ditujukan pula pada Peneliti dan Teknisi yang telah memberi masukan saran, membantu penelitian, memelihara hewan hingga terlaksananya penelitian skabies ini yaitu Dr. Beriajaya, Drh. J. Manurung, Setianingsih, Aos dan Opik.
DAFTAR PUSTAKA
AHMAD, R.Z. 2004. Cendawan Metarhizium
anisopliae sebagai pengendali hayati ektoparasit caplak dan tungau pada ternak.
Wartazoa 14(2): 73 – 78.
AHMAD. 2008a. Isolasi dan Identifikasi Cendawan Entomofagus Beauveria bassiana dan Metarhizium anisopliae dari Daerah Bogor
Pros. Seminar Entomologi Seminar Nasional V PEI Cabang Bogor. Pemberdayaan Keaneka ragaman serangga untuk peningkatan LIPI Cibinomg. Bogor, 18 – 19 Maret 2008 (abstrak).
AHMAD.2008b. Enzim Aktivitas Enzim Kitinase dan Protease yang Terkandung pada Beauveria
bassiana dan Metarhizium anisopliae.
Seminar Nasional V PEI Cabang Bogor. Pemberdayaan Keanekaragaman Serangga untuk Peningkatan LIPI Cibinong. Bogor, 18 – 19 Maret 2008 (abstrak).
ALABAMA. 2008. State Water Program.A partnership of USDA CSREES & LandGrant Collagues and Universities. http:www.aces.edu/water quality/glosary-result.php3?rowid=930es (15 Oktober 2008).
BUDIANTONO. 2004. Kerugian ekonomi akibat scabies dan kesulitan dalam pemberantasannya. Pros. Seminar Parasitologi dan Toksikologi Veteriner. Bogor, 20 – 21 April 2004. Balitvet-DFID. hlm. 51 – 63. HARYUNINGTYAS, D, R.Z.AHMAD, BERIAJAYA dan
MANURUNG. 2006. Uji Daya Hidup Tungau
Sarcoptes scabies pada Berbagai Macam
Serum. Pros. Seminar Nasional Teknologi Peternakan dan Veteriner. Bogor 5 – 6 September 2006. Puslitbang Peternakan Bogor. hlm. 1026 – 1031.
KUCERA, M. 1980. Proteases from the fungus
Metarhizium anisopliae toxic for Galleria melonella larvae. J. Invertebre. Pathol. 35: 304
– 310.
MANURUNG, J. dan A. KUSUMANINGSIH. 1996. Pengaruh kudis pada kambing terhadap minat peternak untuk beternak kambing di Desa Cigombong dan Desa Srogol Kecamatan Cijeruk, Kabupaten Bogor, Jawa Barat. Prosiding Temu Ilmiah Nasional Bidang Veteriner, Bogor, 12 – 13 Maret 1996. Balitvet, Bogor.
MCCOY, C.W. 1990. Entomogenous fungi as microbial pesticides. In: New directions in Biological Control. BAKER, R.R. and P.E. DUNN (Eds). Alan R. Liss, New York. pp. 139 – 159.
NAHAR, P.B. 2004. Development of biocontrol agents for the control of pest in Agricultural using chitin metabolism as target. Thesis pH D. division of biochemical Science National Chemical Laboratory Pune. India. Http:// displacencl.res.in/displace/bitstream/2948/229 /1/th1419.pdf. (20 Juni 2006).
OBRIEN, D..J.1999. Treatment of Psoroptes mange with reference to epidemiology and history. Vet. Parasitol. 83: 177 – 185.
PUTRA, A.A.G. dan M.GUNAWAN. 1983. Laporan pengendalian kasus skabies pada kandang. Efikasi Coumaphous 0,1% terhadap Sarcoptes
scabiei var caprae dan gambaran
haematologik. Laporan Tahunan Hasil Penyidikan Penyakit Hewan di Indonesia periode tahun 1981 – 1982. Dirkeswan Direktorat Jenderal Peternakan, Jakarta. hlm. 30 – 36.
SEDDON,H.R. 1968. Disease of Domestic Animals in Australia. Part:3: Arthropods Infestation (Ticks and Mange). 2nd Service Publication
No. 7 Commonwealth of Australia Department of Health. pp. 98 – 101.
SMITH,K.E,R.WALL and N.P.FRENCH. 2000. The control of sheep scab mite Psoroptes ovis with entomopathogenic fungi. Vet. Parasitol. 92: 97 – 105.
STEETT, D.A. and S.A. WOOD. 2008. Beauveria
bassiana for Mormon Crickets. Hand Book.
Section VII: Future Directions. Grasshoppers: Their Biology, Identification and Management. 1 – 7. http://www.Sidney.ars.usda.gov/grass hopper/handbook/VII/Vii_6.htm. (26 Januari-2008).
SURATNO. 2000. Pemberantasan penyakit skabies pada kambing di Pulau Lombok NTB. Periode II TA 2000. Laporan Pelaksanaan Rapat Koordinasi Kesehatan Hewan Wilayah Nusa Tenggara. Balai Penyidikan Penyakit Hewan Wilayah VI Denpasar.
SWARUP, D.J, T.P. PARAI and M. LAL. 1983. A report on clinical trial with malathion againts sarcoptic mange in Pasmina bearing Goats. Indian Vet. J. 60: 399 – 401.
TECHNICAL BULLETIN. 2007. Fungal Diseases. http://msucares.com/pubs/techbulletins/tb218 fungal.htm. (23 Pebruari 2008).