BAB 2
TINJAUAN PUSTAKA
2.1. Anatomi
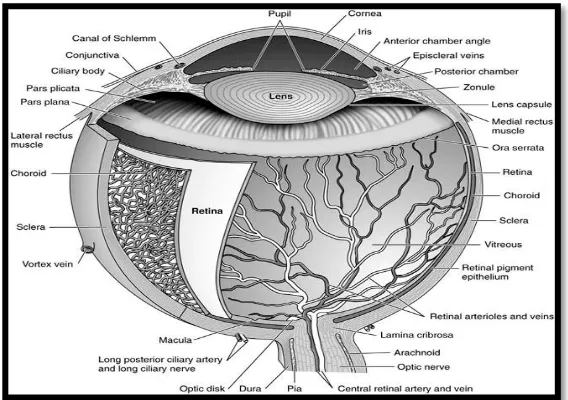
Struktur mata yang berkaitan erat dengan retinoblastoma adalah retina,
vitreus, koroid, dan sklera. Hal ini dikarenakan pola pertumbuhan retinoblastoma
yang berasal dari sel-sel retina dan dapat bersifat eksofilik (pertumbuhan ke arah
luar) dan endofilik (pertumbuhan ke arah dalam) (Shetlar, 2010).
Gambar 1. Anatomi Mata (Riordan-Eva, 2010)
Retina
Retina adalah lembaran jaringan saraf berlapis yang tipis dan semi
transparan yang melapisi bagian dalam dua pertiga postrerior dinding bola mata.
Retina membentang ke anterior hampir sejauh corpus ciliare dan berakhir pada ora
serrata dengan tepi yang tidak rata. Permukaan luar retina sensoris bertumpuk
dengan lapisan epitel berpigmen retina sehingga juga berhubungan dengan
Lapisan-lapisan retina, mulai dari sisi dalam, adalah sebagai berikut: (1)
membran limitans interna; (2) lapisan serat saraf, yang mengandung akson-akson
sel ganglion yang menuju nervus optikus; (3) lapisan sel ganglion; (4) lapisan
pleksiform dalam, yang mengandund sambungan sel ganglion dengan sel amakrin
dan sel bipolar; (5) lapisan inti dalam badan-badan sel bipolar, amakrin dan
horisontal; (6) lapisan pleksiform luar yang mengandung sambungan sel bipolar
dan sel horisontal dengan fotoreseptor; (7) lapisan inti luar sel fotoreseptor; (8)
membran limitans eksterna; (9) lapisan fotoreseptor segmen dalam dan luar
batang dan kerucut; dan (10) epitel pigmen retina. Lapisan dalam membran Bruch
sebenarnya merupakan membran basalis epitel pigmen retina (Riordan-Eva,
2010).
Gambar 2. Lapisan Retina (Riordan-Eva, 2010)
Retina mempunyai tebal 0,1 mm pada ora serrata dan 0,56 mm pada kutub
posterior. Di tengah-tengah retina posterior terdapat makula berdiameter 5,5-6
mm, yang secara klinis dinyatakan sebagai daerah yang dibatasi oleh
cabang-cabang pembuluh retina temporal. Darerah ini ditetapkan sebagai area centralis,
yang secara histologis merupakan bagian retina yang ketebalan lapisan sel
ganglionnya lebih dari satu lapis (Riordan-Eva, 2010).
Retina menerima darah dari dua sumber: koriokapilaris yang berada tepat
pleksiform luar dan lapisan inti luar, fotoreseptor, dan lapisan epitel pigmen retina
serta cabang-cabang dari arteria centralis retinae, yang mendarahi dua pertiga
dalam retina (Riordan-Eva, 2010).
Vitreus
Vitreus adalah suatu badan gelatin yang jernih dan avaskular yang
membentuk dua pertiga volume dan berat mata. Vitreus mengisi ruangan yang
dibatasi oleh lensa, retina, dan diskus optikus. Permukaan luar vitreus, membran
hyaloid, normalnya berkontak dengan struktur-struktur berikut: Kapsul lensa
posterior, serat-serat zonula, pars plana lapisan epitel, retina, dan caput nervi
optici (Riordan-Eva, 2010).
Basis vitreus mempertahankan penempelan yang kuat seumur hidup ke
lapisan epitel pars plana dan retina tepat dibelakang ora serrata. Di awal
kehidupan, vitreus melekat kuat pada kapsul lensa dan caput nervi optici, tetapi
segera berkurang di kemudian hari (Riordan-Eva, 2010).
Vitreus mengandung air sekitar 99%, sisa 1% meliputi dua komponen,
kolagen dan asam hialuronat, yang memberi bentuk dan konsistensi mirip gel
pada vitreus karena kemampuannya mengikat banyak air (Riordan-Eva, 2010).
Koroid
Koroid adalah segmen posterior uvea, diantara retina dan sklera. Koroid
tersusun atas tiga lapis pembuluh darah koroid; besar, sedang, dan kecil. Semakin
dalam pembuluh terletak di dalam koroid, semakin lebar lumennya (Riordan-Eva,
2010).
Bagian dalam pembuluh darah koroid dikenal sebagai koriokapilaris.
Darah dari pembuluh koroid dialirkan melalui empat vena vorticosa, satu di tiap
kuadran posterior. Koroid di sebelah dalam dibatasi oleh membran Bruch dan di
sebelah luar oleh sklera. Koroid melekat erat ke posterior pada tepi-tepi nervus
optikus. Di sebelah anterior, koroid bergabung dengan corpus ciliare
Sklera
Sklera adalah pembungkus fibrosa pelindung mata di bagian luar, yang
hampir seluruhnya terdiri atas kolagen. Jaringan ini padat dan berwarna putih
serta berbatasan dengan kornea di sebelah anterior dan duramater nervus optikus
di posterior. Pita-pita kolagen dan jaringan elastin membentang di sepanjang
foramen sklera posterior, membentuk lamina cribrosa, yang diantaranya dilalui
oleh berkas akson nervus optikus (Riordan-Eva, 2010).
Permukaan luar sklera anterior dibungkus oleh sebuah lapisan tipis
jaringan elastik halus, episklera, yang mengandung banyak pembuluh darah yang
mendarahi sklera. Lapisan berpigmen coklat pada permukaan dalam sklera adalah
lamina fusca, yang membentuk lapisan luar ruang suprakoroid (Riordan-Eva,
2010).
Pada tempat insersi musculus recti, tebal sklera sekitar 0,3mm, di tempat
lain tebalnya sekitar 0.6mm. Di sekitar nervus optikus, sklera ditembus oleh
arteria ciliaris posterior longa dan brevis, serta nervus ciliaris longus dan brevis.
Arteria ciliaris posterior longa dan nervus ciliaris longus melintas dari nervus
optikus ke corpus ciliare di sebuah lekukan dangkal pada permukaan dalam sklera
di meridian jam 3 dan jam 9. Sedikit posterior dari ekuator, empat vena vorticosa
mengalirkan darah keluar dari koroid melalui sklera, biasanya satu disetiap
kuadran. Sekitar 4 mm di sebelah posterior limbus, sedikit anterior dari insersi
tiap-tiap musculus rectus, empat arteria dan vena ciliaris anterior menembus
sklera (Riordan-Eva, 2010).
2.2. Retinoblastoma 2.2.1. Definisi
Retinoblastoma adalah keganasan neuroektodermal yang berasal dari
sel-sel embriyonik retina sensoris (Augsburger dan Asbury, 2010). Retinoblastoma
merupakan keganasan intraokular primer yang paling sering terjadi pada masa
2.2.2. Epidemiologi
Retinoblastoma mewakili sekitar 3 % dari semua keganasan pada masa
kanak-kanak (Kanski,2007). Frekuensi retinoblastoma 1 : 14.000 sampai 1 :
20.000 kelahiran hidup, bergantung pada masing-masing negara. Di negara
Amerika Serikat diperkirakan bahwa 250-300 kasus baru terjadi setiap tahun. Di
negara Meksiko dilaporkan 6,8 kasus per juta populasi dibandingkan dengan 4
kasus per juta populasi di Amerika Serikat. Pada 30-40% kasus, tumor terjadi
secara bilateral (American Academy of Ophthalmology, 2007). Pada 90% kasus,
diagnosis ditegakkan sebelum akhir tahun ketiga (Fredrick, 2010). Tumor
unilateral dijumpai pada 70% kasus (Friedman dan Kaiser, 2007).
Tabel 2.1. Epidemiologi Retinoblastoma
Sumber : (American Academy of Ophthalmology, 2007)
Sekitar 60% kasus bersifat unilateral dan non-herediter, 15 % unilateral
dan herediter, dan 25% bilateral dan herediter. Keterlibatan yang bersifat bilateral
ditemukan sebanyak 42% pada usia kurang dari 1 tahun. (Herzog, 2004). Di kota Epidemiologi Retinoblastoma
Tumor intraokular terbanyak pada anak
Tumor intraokular terbanyak ketiga setelah melanoma dan metastasis
Insiden 1:14.000 – 1:20.000 kelahiran hidup
90% kasus dijumpai sebelum umur 3 tahun
Terjadi sama pada pria dan wanita
Terjadi sama pada mata kiri dan kanan
Tidak ada predileksi ras
60-70% unilateral (usia rata-rata saat diagnosis, 24 bulan)
Medan, Sebuah penelitian deskriptif yang dilakukan oleh Selvi dengan melihat
rekam medik kasus retinoblastoma yang berobat ke Subbagian
Hematologi-Onkologi Anak Bagian Ilmu Kesehatan Rumah Sakit Haji Adam Malik periode
1999-2003 memperlihatkan kejadian retinoblastoma unilateral dan bilateral paling
banyak pada kelompok usia 0-5 tahun sebesar 40,6% dan 46,9%. Laki-laki lebih
banyak dari perempuan pada unilateral (34,4% vs 12,5%) dan bilateral (34,4% vs
18,7%).
2.2.3. Etiologi
Retinoblastoma merupakan hasil dari transformasi keganasan sel-sel retina
primitif sebelum mencapai diferensiasi tahap akhir (Kanski, 2007). Keganasan ini
terjadi karena adanya mutasi pada gen RB1 yang terletak pada lengan panjang
kromosom 13 pada lokus 14 (13q14) (American Academy of Ophthalmology,
2008).
Gen retinoblastoma normal (RB1), yang terdapat pada semua orang adalah
suatu gen supresor atau anti-onkogen (Shetlar, 2010). Gen ini berperan
menghasilkan suatu fosfoprotein inti dengan aktivitas pengikat DNA. Hilangnya
alel yang disebabkan oleh mutasi dapat terjadi pada sel-sel somatik saja
(retinoblastoma non-herediter) atau juga di sel-sel germinativum (retinoblastoma
herediter) (Fredrick, 2010).
Individu dengan bentuk penyakit yang herediter memiliki satu alel yang
terganggu di setiap sel tubuhnya, apabila alel pasangannya di sel retina yang
sedang tumbuh mengalami mutasi spontan maka terbentuklah tumor. Pada bentuk
yang nonherediter, kedua alel gen retinoblastoma normal di sel retina yang sedang
tumbuh di nonaktifkan oleh mutasi spontan. (Shetlar, 2010).
2.2.4. Genetika
Gen RB1 merupakan gen supresor yang pertama kali ditemukan (Robbins,
2003). Berbeda dengan onkogen yang produk proteinnya berperan dalam
meneruskan sinyal-sinyal pertumbuhan sel pada semua tahap, produk gen
Setiap gen supresor menyandi signal transducing protein yang membawa pesan
menghambat pertumbuhan (growth inhibition) dari bagian sel yang satu ke bagian
sel yang lain melalui suatu signaling cascade dan disampaikan kepada responder
protein. Bila salah satu protein supresor hilang atau tidak berfungsi, maka salah
satu mata rantai sinyal hilang sehingga pesan yang dibawanya tidak sampai ke
tujuan (Kresno, 2010).
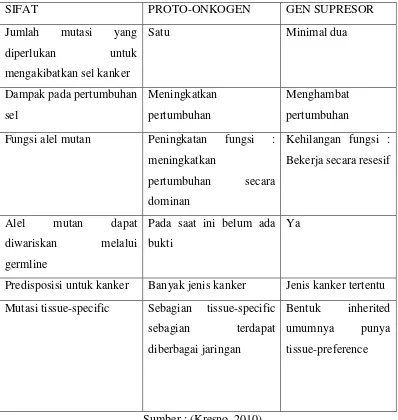
Tabel 2.2. Perbedaan Sifat-Sifat Onkogen dan Gen Supresor
SIFAT PROTO-ONKOGEN GEN SUPRESOR
Jumlah mutasi yang
Fungsi alel mutan Peningkatan fungsi :
meningkatkan
Predisposisi untuk kanker Banyak jenis kanker Jenis kanker tertentu
Mutasi tissue-specific Sebagian tissue-specific
Dari tabel 2.2. tampak bahwa ada beberapa sifat yang membedakan gen
supresor dari onkogen. Mutasi gen yang mengaktivasi proto-onkogen menjadi
onkogen terletak pada gen struktural yang secara langsung menghasilkan produk
gen (protein) abnormal, atau pada kasus-kasus tertentu mutasi itu terdapat pada
bagian regulator dari gen sehingga menghasilkan protein normal secara
berlebihan. Kedua hal tersebut menyebabkan peningkatan fungsi dan peningkatan
fungsi ini seringkali mengakibatkan sinyal pertumbuhan terus-menerus atau
proliferasi yang abnormal. Jenis mutasi ini dominan untuk alel wild-type (Kresno,
2010).
Sebaliknya, produk gen supresor bekerja untuk menghentikan
pertumbuhan, terutama apabila sinyal pertumbuhan yang sampai pada “mesin pengatur siklus sel” adalah abnormal. Produk gen supresor dapat mendeteksi adanya sinyal pertumbuhan abnormal atau keadaan abnormal dalam siklus sel
misalnya adanya kerusakan DNA atau produk replikasi DNA yang salah. Pada
keadaan ini gen supresor bekerja sebagai regulator negatif bagi berlangsungnya
proliferasi dan siklus sel. Sebagai regulator negatif dari proses proliferasi sel,
kehilangan satu alel akibat mutasi diharapkan tidak berpengaruh pada fungsi alel
kedua (alel normal/wild type), sehingga mutasi ini merupakan loss of function
mutation dan bersifat resesif. Produk gen supresor baru menjadi inaktif apabila
kedua alel mengalami mutasi. Tetapi pada umumnya yang sering terjadi adalah
mutasi pada satu alel diikuti dengan hilangnya alel wild-type hingga menjadi
homozigot (loss of heterozygosity/ LOH) (Kresno, 2010).
Mutasi resesif gen supresor pada beberapa kasus tidak menimbulkan
fenotip pertumbuhan abnormal pada keadaan heterozigot, tetapi mutasi ini dapat
diwariskan melalui sel-sel germinal (germline cells). Germline mutation gen
supresor baru menunjukkan manifestasi bila alel wild-type yang kedua oleh salah
satu sebab hilang. Hilangnya alel wild-type biasanya terjadi lama setelah lahir.
Individu-individu dengan mutasi germinal gen Rb dan p53 biasanya berkembang
normal, walaupun individu-individu ini berisiko tinggi untuk menderita kanker
Banyak jenis tumor yang dikaitkan dengan defek atau disfungsi gen
supresor. Disfungsi atau inaktivasi gen suoresor karena delesi atau mutasi genetik
dapat mengakibatkan sel kehilangan kontrol pertumbuhan, sehingga terjadi
pertumbuhan tidak terkendali. Mutasi dapat terjadi karena banyak hal, misalnya
akibat virus, bahan kimia karsinogenik atau radiasi. Walaupun gen Rb ditemukan
pertama kali pada pasien-pasien yang rentan terhadap retinoblastoma, mutasi gen
Rb tidak hanya dijumpai pada retinoblastoma tetapi juga dapat ditemukan pada
berbagai jenis kanker lain pada orang dewasa, misalnya kanker paru, payudara,
ginjal, dan lain-lain. Pada tumor-tumor ini mutasi Rb terjadi somatik dan bukan
karena diwariskan. Gen Rb juga berperan penting pada tumor yang diinduksi oleh
berbagai virus, khusunya SV40, adenovirus dan HPV (Kresno, 2010).
Mutasi pertama, apakah itu mutasi germline maupun somatik,
menghasilkan sel dengan satu alel mutan dan satu alel wild type. Mutasi kedua
akan menginaktivasi copy normal sehingga gen tidak berfungsi. Inaktivasi alel
wild type kedua dalam sel yang telah mengandung satu alel mutan dapat terjadi
karena mutasi somatik yang independent atau karena hilangnya kromosom yang
mengandung lokus normal yang tinggal. Peristiwa terakhir yang dapat terjadi
akibat rekombinasi mitotik maupun hilangnya kromosom dengan atau tanpa
duplikasi kromosom yang tinggal, dapat menyebabkan tumor dengan gen Rb
(Kresno, 2010).
Gen RB1 menduduki sepanjang 200 kb DNA dan terdiri atas 23 exon.
Produknya, yaitu protein Rb yang besarnya 105-110 kDa bergantung pada jenis
spesies. Protein ini merupakan protein nukleus yang terlibat dalam proses siklus
sel. Dalam sel yang beristirahat (fase G0 dan G1) protein Rb dapat ditemukan
dalam bentuk kompleks dengan faktor transkripsi seluler yang disebut E2F.
Protein Rb sendiri berfungsi sebagai regulator transkripsi, walaupun protein ini
sendiri tidak berikatan langsung dengan sekuen DNA sasaran. E2F memperantarai
aktivitas transkripsi beberapa gen seluler yang terlibat dalam proliferasi sel dan
sintesis DNA termasuk gen yang menyandi timidin-kinase dan DNA polimerase
Gambar 3. Interaksi Rb dengan faktor trankripsi E2F (emedicine.medscape.com)
Selama fase G0 dan awal fase G1 protein Rb tidak terfosfolirasi, tetapi
pada akhir fase G1 atau awal fase S terjadi fosfolirasi protein Rb secara progresif
pada berbagai sisi protein Rb. Kinase yang menyebabkan reaksi fosfolirasi ini
adalah Cdk yang diaktifkan oleh cyclin dan mengatur siklus sel. Tingkat
fosfolirasi protein Rb tetap tinggi sampai fase akhir mitosis pada saat enzim
fosfatase memecah kompleks ini (defosfolirasi) dan siklus sel masuk ke fase G0/
G1. Dengan demikian diduga bahwa fosfolirasi protein Rb merupakan mekanisme
yang mengatur aktivitas Rb dan interaksinya dengan protein lain. Jadi fungsi Rb
dalam siklus sel adalah berinteraksi dengan faktor transkripsi dan mengatur fungsi
gen lain yang diperlukan untuk memasuki fase S (Kresno, 2010).
Aktivitas Rb diatur melalui fosfolirasi oleh kinase dan aktivitas Cdk
sehingga terjadi interaksi antara Rb dengan proses lain dalam siklus sel. Pada fase
awal G1 protein Rb tidak difosofolirasi, tetapi pada akhir fase G1 pRb
difosfolirasi secara ekstensif pada semua sisi dan tetap terfosfolirasi hingga akhir
fase mitotik, dimana segera terjadi defosfolirasi. Faktor transkripsi E2F lebih suka
berikatan dengan Rb pada saat Rb tidak tidak terfosfolirasi pada fase G1. E2F
adalah suatu faktor transkripsi positif bila ia tidak terikat pada protein Rb, tetapi
menjadi elemen negatif bila ia terikat pada Rb. Kompleks E2F dengan Rb
merupakan kompleks stabil yang menghambat kemampuan E2F untuk
mengaktivasi berbagai gen promoter untuk sintesis DNA. Kompleks Rb-E2F
menghambat gen yang mengatur sel keluar dari fase G1. Fosfolirasi Rb maupun
E2F terlepas sehingga ia bisa berinteraksi dengan gen promoter yang diperlukan
untuk masuk dalam fase S (Kresno, 2010).
Ekspresi berlebihan dari E2F dapat menstimulasi proliferasi sedangkan
aktivitas Rb sebagai gen supresor berkolerasi dengan pengikatannya dengan E2F,
sehingga disimpulkan bahwa salah satu fungsi Rb adalah menghambat fungsi E2F
sebagai transkriptor (Kresno,2010).
2.2.5. Patogenesis
Retinoblastoma dapat tumbuh ke luar (eksofitik) atau ke dalam (endofitik)
atau kombinasi keduanya. (Shetlar, 2010). Tumor endofilik muncul dari
permukaan dalam retina, tumbuh ke arah vitreus, dan cenderung menyebar ke area
lain dari retina. Tumor eksofitik tumbuh dari lapisan retina luar dan dapat
menimbulkan ablasi retina (Herzog, 2004).
Gambar 4. Perluasan Ekstraokular Tumor (emedicine.medscape.com)
Retinoblastoma mungkin tampak sebagai suatu tumor tunggal dalam
dalam retina tetapi khas mempunyai fokus ganda. Jika timbul dalam lapisan inti
mudah dilihat dengan oftalmoskop. Tumor eksofitik (yang timbul dalam lapisan
inti eksterna dan tumbuh ke dalam ruang subretina, dengan ablasi retina)
tersembunyi, dan diagnosis lebih sukar (Pratt, 2000).
Perluasan Retinoblastoma ke dalam koroid biasanya terjadi pada tumor
yang masif dan mungkin menunjukkan peningkatan kemungkinan metastasis
hematogen. Perluasan tumor melalui lamina kribrosa dan sepanjang saraf mata
dapat menyebabkan keterlibatan susunan saraf pusat. Invasi koroid dan saraf mata
meningkatkan resiko penyakit metastasis (Pratt, 2000).
Kedua jenis Retinoblastoma, secara bertahap, akan mengisi mata dan
meluas bersama nervus opticus ke otak di sepanjang saraf dan
pembuluh-pembuluh emisari di sklera ke jaringan orbita lainnya. Tumor ini terkadang
tumbuh secara difus di retina, melepaskan sel-sel ganas ke dalam vitreus dan bilik
mata depan dan menimbulkan proses pseudoinflamasi yang dapat menyerupai
retinitis, vitritis, uveitis, atau endoftalmitis (Shetlar, 2010).
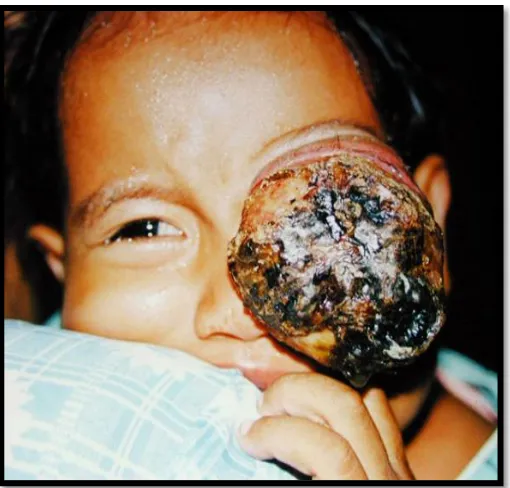
2.2.6. Manifestasi Klinis
Tanda dan gejala Retinoblastoma ditentukan oleh tingkat dan lokasi tumor
pada saat terdiagnosis. Di Amerika Serikat, tanda-tanda retinoblastoma yang
paling banyak dijumpai adalah leukokoria, strabismus, dan inflamasi okular.
Gambaran lain yang dijumpai, seperti Heterokromia, Hyfema Spontan,
dan sellulitis. Dalam kasus yang jarang terjadi, lesi kecil dapat ditemukan dalam
pemeriksaan rutin. Keluhan visual jarang terjadi karena sebagian besar pasien
adalah anak-anak usia pra sekolah (American Academy of Ophthalmology, 2007).
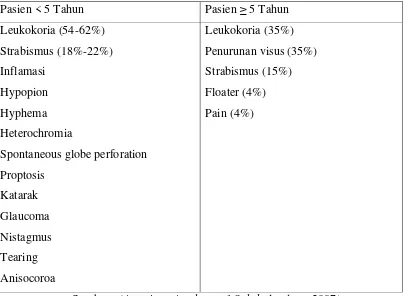
Tabel 2.3. Manifestasi Klinis Retinoblastoma
Pasien < 5 Tahun Pasien ≥ 5 Tahun
Sumber : (American Academy of Ophthalmology, 2007)
2.2.7. Klasifikasi
Klasifikasi klinis Reese-Ellworth merupakan metode penggolongan
retinoblastoma intraokular yang paling sering digunakan, tetapi klasifikasi ini
tidak menggolongkan retinoblastoma ekstraokular. Klasifikasi diambil dari
perhitungan jumlah, ukuran, lokasi tumor, dan ada atau tidaknya vitreous seeds.
Klasifikasi ini tidak memberikan informasi prognostik tentang kelangsungan
Children’s Oncology Group (COG) mengevaluasi sistem klasifikasi internasional yang baru, yang akan digunakan dalam serangkaian uji klinis yang
akan datang. Harapannya adalah untuk mengembangkan skema yang lebih baik
untuk memprediksi rspon mata terhadap kemoterapi (American Academy of
Ophthalmology, 2007).
Tabel 2.4. Klasifikasi Retinoblastoma Reese-Ellsworth
Grup A B
Tumor Multipel, beberapa besarnya
lebih dari 10 DD
Tabel 2.5. Sistem Klasifikasi Internasional
Grup A Tumor kecil (≤3 mm) terbatas pada retina, >3 mm dari fovea,
>1,5 mm dari optic disc.
Grup B
Grup C
Grup D
Grup E
Tumor (>3 mm) terbatas pada retina dengan cairan subretina
jernih ≤6 mm dari batas tumor.
Terlokalisasi di vitreus dan/atau adanya subretinal seeding (total
<6 mm dari batas tumor). Jika lebih dari satu sisi
subretinal/vitreous seeding, maka keseluruhan harus >6 mm.
Penyebaran difus dan /atau adanya subretinal seeding (≥6 mm
keseluruhan batas tumor). Jika lebih dari satu sisi
subretinal/vitreous seeding, maka keseluruhan harus ≥6 mm.
Cairan subretina >6 mm dari batas tumor.
Tidak ada potensi visual; atau
Keberadaan satu atau lebih hal berikut :
Tumor di segmen anterior
Tumor di dalam ciliary body
Glaukoma Neovaskular
Perdarahan vitreus yang mengaburkan tumor hyphema signifikan
Phthisical or pre-phthisical eye
Selulitis Orbita
Sumber : (American Academy of Ophthalmology, 2007)
2.2.8. Diagnosis
Retinoblastoma biasanya tidak disadari sampai tumbuh cukup besar dan
strabismus atau peradangan intraokular harus dievaluasi untuk mencari adanya
retinoblastoma (Shetlar, 2010).
Anak yang menderita Retinoblastoma harus mendapatkan pemeriksaan
fisik dan laboratorium serta pemeriksaan penunjang yang lengkap oleh onkologis
anak (Aventura dalam Hidayat, 2010). Pemeriksaan dengan anestesi (Examination
Under Anesthesia / EUA) diperlukan pada semua pasien untuk mendapatkan hasil
yang lengkap dari perkembangan penyakit sebelum dilakukan penatalaksanaan.
Lokasi tumor harus didokumentasikan secara jelas. Tekanan intraokular dan
diameter kornea harus diukur ketika operasi (American Academy of
Ophthalmology, 2007).
Ultrasonografi dapat membantu dalam dalam menegakkan diagnosis
Retinoblastoma dengan menunjukkan karateristik kalsifikasi dalam tumor.
Meskipun kalsifikasi ini juga dapat terlihat pada CT Scan, MRI telah menjadi
modalitas diagnostik yang lebih diutamakan untuk menilai nervus optikus, orbita,
dan otak. MRI tidak hanya menghasilkan resolusi jaringan lunak yang lebih baik,
tetapi juga menghindarkan terpaparnya bahaya radiasi (American Academy of
Ophthalmology, 2007).
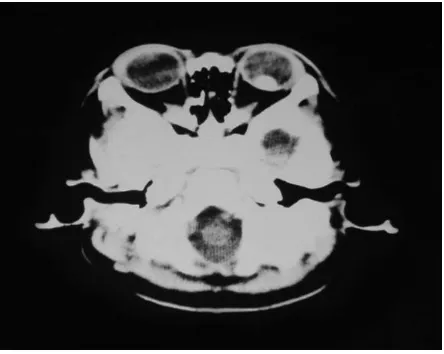
Gambar 6. Tampilan CT-Scan Retinoblastoma Ekstraokular
Studi terbaru meunjukkan bahwa evaluasi metastasis sistemik, khusunya
sumsum tulang dan lumbal punksi, tidak diindikasikan pada anak tanpa
abnormalitas neurologis atau bukti perluasan ekstraokular. Jika dicurigai
perluasan ke bagian saraf optikus, maka dianjurkan untuk dilakukan lumbal
punksi. Orang tua dan saudara kandung harus diperiksa untuk membuktikan
retinoblastoma atau retinoma, karena hal ini akan memberikan bukti untuk
predisposisi herediter terhadap penyakit (American Academy of Ophthalmology,
2007).
2.2.9. Histopatologi
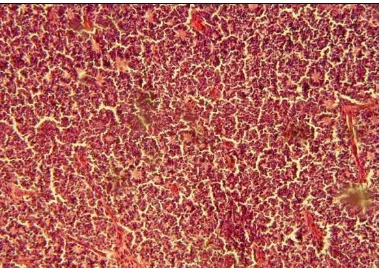
Tumor terdiri dari sel-sel basofilik kecil dengan nukleus hiperkromatik
besar dan sedikit sitoplasma. Retinoblastoma banyak yang tidak berbeda, tetapi
pada berbagai tingkat diferensiasi dapat dibedakan dengan pembentukan rosettes,
yang terdiri dari tiga tipe :
1. Flexner-Wintersteiner rosettes, terdiri dari lumen pusat yang dikelilingi
oleh sel-sel kolumnar tinggi. Inti sel-sel ini terletak jauh dari lumen.
Gambar 7. Gambaran Histopatologi Flexner-Wintersteiner
Rosettes (emedicine.medscape.co)
2. Homer-Wright rosettes, tidak memiliki lumen dan sel terbentuk di sekitar
3. Fleurettes, fokus dari sel tumor, yang menunjukkan diferensiasi
fotoreseptor, kelompok sel dengan proses panjang pembentukan
sitoplasma dan tampilan seperti karangan bunga (Kanski, 2007).
2.2.10. Diagnosis Banding
Tabel 2.6. Diagnosis Banding
1 Congenital cataract
2 Persistent anterior fetal vasculature
3 Coats disease
4 Retinopathy of prematurity
5 Toxocariasis
6 Uveitis
7 Retinal dysplasia
8 Incontinentia pigmenti
9 Retinoma (retinocytoma)
10 Retinal astrocytoma
Sumber : (Clinical Ophthalmology, 2007)
Sebagian besar kondisi ini dapat dibedakan dengan retinoblastoma
berdasarkan riwayat yang komperhensif, pemeriksaan klinis, dan tes diagnostik
tambahan yang sesuai (American Academy of Ophthalmology, 2007).
2.2.11. Penatalaksanaan
Dalam menangani retinoblastoma, hal pertama dan yang paling penting
untuk difahami adalah bahwa Retinoblastoma merupakan suatu keganasan. Dalam
menentukan strategi pengobatan, tujuan pertama adalah untuk menyelamatkan
kehidupan, selanjutnya menyelamatkan mata, dan terakhir untuk menyelamatkan
1. Enukleasi
Enukleasi masih menjadi terapi definitif untuk retinoblastoma. Walaupun
beberapa dekade terakhir terjadi penurunan frekuensi enukleasi baik pada kasus
unilateral maupun bilateral (Honavar dalam Hidayat, 2010).
Biasanya, enukleasi dianggap sebagai intervensi yang tepat jika :
Tumor melibatkan lebih dari 50% bola mata
Diduga adanya keterlibatan orbita dan saraf optik.
Melibatkan segmen anterior dengan atau tanpa Glaukoma Neovaskular (American Academy of Ophthalmology, 2007).
Enukleasi diindikasikan jika terdapat rubeosis, perdarahan vitreus atau
invasi saraf optik. Hal ini juga dilakukan jika kemoreduksi gagal atau mata yang
normal membuat kemoterapi agresif sulit dilakukan. Enukleasi juga berguna pada
resiko tinggi kekambuhan dengan modalitas terapi lain (Kanski, 2007).
2. Kemoterapi
Kemajuan yang signifikan dalam penanganan retinoblastoma intraokular
bilateral dalam beberapa dekade terakhir telah menggunakan kemoterapi sistemik
primer. Pemberian kemoterapi sistemik mengurangi ukuran tumor,
memungkinkan untuk penggabungan fokal terapi dengan laser, krioterapi, atau
radioterapi. Saat ini digunakan kombinasi berbagai regimen seperti Carboplatin,
Vincristine, Etoposide dan Cyclosporine. (American Academy of Ophthalmology,
2007).
Pada tumor berukuran besar, kemoterapi berguna untuk mengecilkan
ukuran tumor, memfasilitasi terapi lokal berikutnya sehingga menghindari
enukleasi atau external beam radiotherapy. Pada tumor berukuran kecil,
kemoterapi dapat digunakan tanpa terapi lainnya, juga untuk melindungi visus
Keberhasilan pengobatan dengan kemoterapi dipengaruhi beberapa faktor yaitu:
Beban tumor
Suatu masa tumor yang mencapai berat 1 kg yang terdiri dari sekitar 1012
sel umumnya menyebabkan kematian pasien. Pemberian kemoterapi tunggal
umumnya tidak dapat membasmi seluruh sel ganas ini. Obat kemoterapi tidak
membasmi sel tumor menurut jumlah absolut, tetapi menurut presentasi tertentu.
Bila diumpamakan pemberian satu kemoterapi dapat membasmo 90% sel tumor
dari jumlah 109 sel, maka tersisa sel 108 yang tidak mati dan kemudian akan
tumbuh kembali. Makin besar masa tumor pada awal pengobatan, makin buruk
pula hasil pengobatannya (Setiabudi, 2010).
Bila pemberian satu obat kemoterapi menyisakan 10% sel tumor, maka
pemberian kombinasi 2 macam obat dengan mekanisme kerja yang berbeda akan
menyisakan 1% sel tumor yang tidak mati. Dan pemberian 3-4 macam kemoterapi
dengan mekanisme kerja yang berbeda, sepanjang dapat ditoleransi pasien dan sel
tumor sensitif terhadap obat itu, akan menyisakan sel tumor yang masih hidup
masing-masing 0,1 dan 0,01%. Teori bahwa terapi kombinasi kemoterapi yang
memberikan hasil lebih baik dari obat tunggal ini telah terbukti pada berbagai
penelitian klinik (Setiabudi, 2010).
Heterogenitas sel tumor
Suatu masa tumor terdiri dari sel-sel yang heterogen. Secara genetik sel
tumor kurang stabil dibandingkan dengan sel biasa, karena itu selama pembelahan
sel seringkali terjadi mutasi sehingga terbentuk berbagai subpopulasi sel tumor.
Sel-sel tumor yang sensitif umumnya mati pada tahap awal pemberian keomterapi
sehingga hanya subpopulasi sel resisten yang bisa hidup. Lama-kelamaan tumor
yang berukuran besar didominasi oleh sel yang resisten. Fenomena ini juga
menjelaskan mengapa respon pengobatan yang baik terlihat pada awal pemberian
kemoterapi kemudian memburuk dalam terapi lanjutan walaupun obat yang
Resistensi terhadap kemoterapi
Kebanyakan resistensi tumor terhadap kemoterapi disebabkan karena sel
kanker secara genetik tidak stabil. Sifat ini menyebabkan laju mutasi pada sel
tumor ini tinggi dan hal ini mengakibatkan terbentuknya berbagai subpopulasi sel
yang heterogen. Sebagian subpupolasi sel ini bersifat resisten terhadap obat
(Setiabudi, 2010).
Beberapa mekanisme penting dalam timbulnya resistensi ini ialah:
a. Pengeluaran obat dari dalam sel (efluks) dengan P-glycoprotein pada
membran sel. Mekanisme ini menggunakan energi dan dikenal sebagai
mekanisme multidrug resistance (MDR). Obat kemoterapi yang dipompa
keluar dari sel dengan mekanisme ini mengenai banyak obat, antara lain
golongan alkaloid dan antrasiklin.
P-glycoprotein secara fisiologis ada di mukosa usus, ginjal, dan pleksus
koroideus sebagai mekanisme tubuh untuk mencegah masuknya zat toksik
ke dalam bagian tubuh tertentu. Beberapa tumor yang pada awal terapi
tidak mempunyai P-glycoprotein dapat berubah menjadi mempunyainya
setelah diberi terapi dengan golongan obat tersebut di atas dan mengalami
kekambuhan (Setiabudi, 2010).
b. Penegluaran obat dari dalam sel dengan mekanisme multidrug resistance
protein (MRP) yang juga menggunakan energi. MRP ini terdapat pada
membran sel dan juga retikulum endoplasmik, tapi tidak mempunyai
P-glycoprotein. Obat dikeluarkan setelah dikonjugasi dengan glutation.
Spektrum obat yang dikeluarkan oleh MRP cenderung mengeluarkan
leukotrien yang telah terkonjugasi dari sel (Setiabudi, 2010).
c. Mutasi yang menyebabkan perubahan pada reseptor obat dapat
menyebabkan berkurangnya afinitas antara reseptor dengan obat dan
menimbulkan resistensi sel tumor. Fenomena ini terlihat pada :
- Mutasi pada topoisomerase I dan II yang mengakibatkan timbulnya
- Mutasi pada enzim dihidrofolat reduktase yang menyebabkan
metotreksat sulit bergabung dengan resptornya.
- Mutasi pada tubulin menyebabkan alkaloid vinka sulit bergabung
dengan reseptor ini (Setiabudi, 2010).
d. Meningkatkan produksi zat yang menetralisasi obat atau meningkatkan
produksi enzim yang menginaktifkan obat. Fenomena ini terlihat pada
resistensi terhadap obat golongan alkilator. Di sini sel tumor meningkatkan
aktivitas glutation S-transferase yang mengkatalisasi pengikatan obat
dengan glutation (Setiabudi, 2010).
Intensitas dosis
Intensitas dosis adalah dosis kemoterapi yang diberikan kepada pasien
dalam kurun waktu tertentu. Dalam pemberian kemoterapi, dosis seringkali tidak
dapat diberikan secara optimal karena terhambat oleh toksisitas obat atau
pemberian obat terhambat karena pulihnya kondisi pasien tidak secepat seperti
yang diharapkan sehingga pemberian dosis berikutnya terpaksa ditunda. Hal ini
dapat mengakibatkan berkurangnya efikasi pemberian kemoterapi (Setiabudi,
2010).
Faktor spesifik pada pasien
Meskipun sensitivitas sel tumor merupakan determinan utama dalam
menentukan keberhasilan pengobatan kanker, berbagai aspek farmakokinetik
yaitu cara pemberian, bioavailabilitas, metabolisme, dan eliminasi obat juga
memegang peran penting. Banyak obat kemoterapi mempunyai batas keamanan
yang sempit dan ini berarti bahwa dosis yang terlalu kecil mungkin tidak memberi
efek terapi, tetapi pada dosis yang sedikit terlalu tinggi sudah dapat menimbulkan
3. Periocular Chemotherapy
Periocular chemotherapy sudah dicantumkan dalam uji COG mendatang
berdasarkan pada data terakhir penggunaan Carboplatin Subkonjungtiva sebagai
terapi retinoblastoma. Dalam fase 1 dan 2 percobaan klinis, baik vitreous seeds
maupun tumor retina didapati respon terhadap penggunaan terapi ini. Toksisitas
lokal minor dalam bentuk orbit mysotisis pernah dilaporkan dan respon
kortikosteroid lokal, juga reaksi yang lebih parah termasuk atrofi optik pernah
dilaporkan (American Academy of Ophthalmology, 2007).
4. Photocoagulation and Hyperthermia
Xenon dan laser argon (532nm) sudah lama digunakan untuk terapi
retinoblastoma dengan tinggi apek kurang dari 3mm dengan dimensi basal kurang
dari 10mm. Dua sampai tiga siklus Photocoagulation merusak suplai darah tumor
yang selanjutnya mengalami regresi. Laser yang lebih baru memungkinkan untuk
terapi langsung pada permukaan tumor. Laser diode (810nm) digunakan untuk
menghasilkan hipertermia. Pemakaian langsung meningkatkan temperatur tumor
hingga 45o-60o C dan memiliki pangaruh langsung sitotoksik, yang dapat
bertambah dengan kemoterapi dan radiasi (American Academy of Ophthalmology,
2007).
5. Cryotherapy
Juga efektif untuk tumor dengan ukuran dimensi basal kurang dari 10mm.
Krioterapi digunakan dengan visualisasi langsung dengan Triple Freeze-Thaw
Technique. Secara khusus, Laser photoablation dipilih untuk tumor yang terletak
pada bagian posterior dan cryoablation untuk tumor yang terletak pada bagian
anterior. Terapi tumor berulang sering memerlukan kedua tehnik tersebut,
bersama dengan pemantauan pertumbuhan tumor atau komplikasi terapi
6. External-Beam Radiation Therapy
Tumor retinoblastoma responsif terhadap radiasi. Saat ini tehnik terbaru
yang dipusatkan pada terapi radiasi megavoltase, sering kali menggunakan
lens-sparing techniques, untuk melepaskan 4000-4500 cGy dengan interval terapi lebih
dari 4-6 minggu (American Academy of Ophthalmology, 2007).
Bukti menunjukkan kombinasi modalitas terapi menggunakan dosis
rendah external-beam radiotherapy digabungkan dengan kemoterapi
dimungkinkan untuk meningkatkan keselamatan bola mata dengan menurunkan
morbiditas radiasi. Sebagai tambahan, penggunaan kemoterapi sistemik dapat
memperlambat kebutuhan untuk external-beam radiotherapy, memungkinkan
perkembangan orbita yang lebih baik, dan bermakna menurunkan resiko dari
keganasan sekunder sewaktu anak berumur lebih dari satu tahun (American
Academy of Ophthalmology, 2007).
7. Plaque Radiotherapy (Brachytherapy)
Plaque Radioactive therapy dapat digunakan pada terapi penyelamatan
mata dimana terapi penyelamatan bola mata gagal untuk menghancurkan semua
tumor aktif dan sebagai terapi utama terhadap beberapa anak dengan ukuran
tumor yang relatif kecil hingga sedang (American Academy of Ophthalmology,
2007) .
Follow up
Setelah radioterapi atau kemoterapi, tumor mengalami regresi menjadi
massa kalsifikasi „cottage-cheese‟, „fish-flesh‟, gabungan keduanya atau skar atrofik datar.
Tumor baru dapat berkembang pada pasien retinoblastoma herediter,
khususnya yang diterapi pada usia yang sangat muda. Kecenderungan
pertumbuhan ke anterior dan tidak dapat dicegah dengan kemoterapi
karena tidak ada pasokan darah. Kekambuhan tumor lokal biasanya
Jika retinoblastoma diterapi secara konsevatif, pemeriksaan tanpa anestesi
dilakukan setiap 2-8 minggu hingga usia 3 tahun, setelah periode ini,
setiap 6 bulan dilakukan pemeriksaan tanpa anestesi hingga umur sekitar
5 tahun, kemudian setiap tahun hingga usia 10 tahun.
Orbital MR diindikasikan pada kasus resiko tinggi pada usia sekitar 18
bulan. Jika anak memiliki resiko perkembangan neoplasma ganas
sekunder, orang tua harus diberikan informasi untuk waspada terhadap
rasa sakit, nyeri dan bengkak, serta berhak mendapatkan bantuan medis
jika tidak ada perbaikan dalam satu minggu (Kanski, 2007)
2.2.12. Prognosis
Anak-anak dengan retinoblastoma yang memiliki akses terhadap
pelayanan medis modern memiliki prognosis yang sangat baik untuk bertahan
hidup, dengan angka keseluruhan lebih dari 95% di negara maju. Faktor resiko
tersering yang berhubungan dengan kematian adalah penyebaran tumor ke
ekstraokular, secara langsung melalui sklera atau yang lebih sering dengan invasi
saraf optikus, khususnya pada pembedahan reseksi margin (American Academy of
Ophthalmology, 2007).
Diperkirakan sebanyak 10%-20% pasien yang mengalami retinoblastoma
bilateral akan berkembang menjadi neoplasma yang tidak berhubungan dalam 20
tahun dan 20%-40% akan mengembangkan keganasan ketiga dalam 30 tahun.
Prognosis untuk bertahan hidup pada pasien retinoblastoma yang kemudian
mengembangkan sarkoma kurang dari 50% (American Academy of
Ophthalmology, 2007).