MATA KULIAH MODEL DAN KOMPUTASI PROSES
Perancangan dan Simulasi Reaktor CSTR Non Adiabatis Untuk
Reaksi Dehidrogenasi Isopropanol Menjadi Aseton Menggunakan
Program Scilab 5.1.1.
Disusun oleh :
1. Annizah Rahmatya Gerhana NIM 2103013120076
2. Bastian Widodo
NIM 2103013120083
JURUSAN TEKNIK KIMIAFAKULTAS TEKNIK
UNIVERSITAS DIPONEGORO
SEMARANG
2015
Model dan Komputasi Proses ii
HALAMAN PENGESAHAN
LAPORANTUGAS BESAR MATA KULIAH MODEL DAN
KOMPUTASI PROSES
Judul :Perancangan dan Simulasi Reaktor CSTR Non Adiabatis Untuk Reaksi Dehidrogenasi Isopropanol Menjadi Aseton Menggunakan Program Scilab 5.1.1.
Nama/NIM : Annizah Rahmatya Gerhana /21030113120076
Nama/NIM : Bastian Widodo /21030113120083
Semarang, 18 Desember 2015 Telah Menyetujui Asisten Pengampu
Cynthia Santoso
Model dan Komputasi Proses iii
KATA PENGANTAR
Puji syukur kami panjatkan kepada Tuhan Yang Maha Esa berkat rahmat dan hidayahnya sehingga kami dapat menyelesaikan Laporan Tugas Besar Mata Kuliah Model dan Komputasi Proses dengan judul “Perancangan Dan Simulasi Reaktor CSTR Non Adiabatis Untuk Reaksi Dehidrogenasi Isopropanol Menjadi Aseton Menggunakan Program Scilab 5.1.1.”.
Penulis menyadari bahwa tanpa bantuan dan kerjasama dari berbagai pihak, maka laporan ini tidak akanterselesaikan. Oleh karena itu dalam kesempatan ini penulis mengucapkan terimakasih kepada :
1. BapakDr. Ir. Setia Budi Sasongko dan Luqman Buchori, S.T., M.T. selaku dosen mata kuliah Model dan Komputasi Proses.
2. M. Barin Elyasa selaku koordinator asisten Laboratorium Komputasi Proses. 3. Cynthia Santoso selaku asisten pembimbing.
4. Segenap teman-teman yang telah memberikan dukungan baik materil maupun spiritual.
Penulis berharap laporanini dapat bermanfaat dan menambah wawasan bagi segenap pembaca umumnya.Penulis menyadari bahwa laporanini masih jauh dari sempurna, oleh karena itu kritik dan saran dari berbagai pihak sangat diharapkan untuk menuju kesempurnaan laporanini.
Semarang, November 2015
Model dan Komputasi Proses iv
DAFTAR ISI
HALAMANJUDUL ……….………...i
HALAMAN PENGESAHAN ... ii
KATA PENGANTAR ... iii
DAFTAR ISI ... iv DAFTAR TABEL ... v DAFTAR GAMBAR ... vi INTISARI ... vii BAB IPENDAHULUAN ... 1 1.1 Latar Belakang ... 1 1.2 Rumusan Masalah ... 2 1.3 Tujuan ... 2 1.4 Manfaat ... 2
BAB II TINJAUAN PUSTAKA ... 3
2.1 Dasar Teori... 3
2.2. Studi Kasus Pembuatan Aseton dari Dehidrogenasi Isopropanol... 6
BAB III METODE PENYELESAIAN ... 11
3.1 Permodelan ... 11
3.2 Algoritma Penyelesaian ... 12
3.3 Logika Pemrograman ... 16
3.4 Bahasa Pemrograman... 17
BAB IV HASIL SIMULASI DAN ANALISA ... 19
4.1Hasil Simulasi ... 19 4.2Analisa Hasil ... 21 BAB V PENUTUP ... 24 5.1Kesimpulan ... 24 5.2Saran ... 24 DAFTAR PUSTAKA ... 25
Model dan Komputasi Proses v
DAFTAR TABEL
Model dan Komputasi Proses vi
DAFTAR GAMBAR
Gambar 2.1 Tiga jenis reaktor ideal: (a) reaktor BR, (b) reaktor PFR, (c) reaktor CSTR 6
Gambar 3. 1 Pemodelan reactor CSTR dengan jaket pendingin 11
Gambar 3. 2 Logika pemograman...16
Gambar 4. 1 Deklarasi console scilab 5.1.1 hubungan konversi dengan volume 19
Gambar 4. 2 Deklarasi console Scilab 5.1.1 grafik hubungan konversi dengan volume...19
Gambar 4. 3 Deklarasi console Scilab 5.1.1 hubungan konversi dengan suhu...20
Model dan Komputasi Proses vii
INTISARI
Dalam teknik kimia, reaktor kimia adalah suatu bejana tempat berlangsungnya reaksi kimia. Rancangan dari reaktor ini tergantung dari banyak variabel yang dapat dipelajari di teknik kimia. Sarjana teknik kimia diharapkan memiliki kualitas dalam konsepsi dan perancangan proses kimia untuk tujuan produksi, transformasi dan penanganan material, memiliki wawasan ilmu yang luas sehingga mampu mengembangkan sumberdaya alam baik fosil (minyak bumi, gas bumi, batubara) maupun non-fosil, menjadi komoditi yang bernilai tambah tinggi.
Dalam perancangan reaktor harus menentukan ukuran reaktor, tipe reaktor dan metode operasi paling tepat untuk menghasilkan kinerja reaktor terbaik.Selain itu juga dibutuhkan bentuk matematis yang dapat mendiskripsikan reaksi yang terjadi didalam reaktor.Salah satunya adalah persamaan laju reaksi, dari integral persamaan tersebut dapat diketahui waktu tinggal didalam reaktor. Berdasarkan uraian diatas, akan dilakukan perancangan dan simulasi reaktor tangki alir berpengaduk atau juga sering disebut CSTR pada kondisi non adiabatis untuk reaksi dehidrogenasi isopropanol menjadi aseton yang reaksinya bersifat endotermis dan irreversible. Perancangan dan simulasi disebut dilakukan menggunakan program Scilab 5.1.1.
Jenis reactor ideal ada tiga diantaranya Batch Reactor, Plug Flow Reaktor dan Continous Stirred Reactor. Klasifikasi jenis reaksi dibagi menjadi reaksi irreversible dan reversible, reaksi endothermis dan eksothermis, reaksi monomolekuler dan bimolekuler, reaksi adiabatic dan non adiabatic. Berdasar reaksi sampingnya dibagi menjadi reaksi seri dan reaksi parallel. Reaksi yang digunakan adalah reaksi dehidrogenasi isopropanol menjadi acetone. Diperoleh ∆H = +54.89 kJ/mol sehingga reaksi merupakan reaksi endotermis. Nilai K atau konversi keseimbangan lebih dari 1 maka reaksi irreversible.
Simulasi dilakukan dengan memperhitungkan neraca massa dari reactor CSTR, stoikiometri, dan neraca energy CSTR. Algoritma yang telah diperoleh dikonversi menjadi bahasa pemograman di Scilab 5.1.1 dengan menambah variable yang diinginkan adalah konversi dengan range 0.5-0.95. Variabel yang dicari adalah hubungan konversi terhadap volume reactor CSTR dan suhu dari reactor tersebut.
Hasil simulasi menunjukan bahwa untuk konversi yang lebih tinggi maka diperlukan volume dan suhu yang lebih besar pada kondisi operasi dari reactor tersebut.
Sebagai saran, diperlukan simulasi dengan reactor jenis yang lain sehingga dapat diperoleh hasil jenis reactor yang efisien dan optimal untuk digunakan dalam produksi acetone dari isopropanol dengan proses dehidrogenasi.
Model dan Komputasi Proses 1
BAB I
PENDAHULUAN
1.1 Latar Belakang
Dalam teknik kimia, reaktor kimia adalah suatu bejana tempat berlangsungnya reaksi kimia. Rancangan dari reaktor ini tergantung dari banyak variabel yang dapat dipelajari di teknik kimia. Perancangan suatu reaktor kimia harus mengutamakan efisiensi kinerja reaktor, sehingga didapatkan hasil produk dibandingkan masukan (input) yang besar dengan biaya yang minimum, baik itu biaya modal maupun operasi (Anggieta, 2014).. Perubahan energi dalam suatu reaktor kimia bisa karena adanya suatu pemanasan atau pendinginan, penambahan atau pengurangan tekanan dan gaya gesekan.
Teknik Kimia adalah suatu cabang ilmu teknik/rekayasa yang mempelajari pemrosesan barang mentah menjadi barang yang berguna secara ekonomis, dengan langkah-langkah yang melibatkan peristiwa kimia, biologis dan /atau fisis sehingga mengalami perubahan tingkat wujud, kandungan energi, atau komposisi (HMTK AKPRIND, 2015). Sarjana teknik kimia diharapkan memiliki kualitas dalam konsepsi dan perancangan proses kimia untuk tujuan produksi, transformasi dan penanganan material, memiliki wawasan ilmu yang luas sehingga mampu mengembangkan sumberdaya alam baik fosil (minyak bumi, gas bumi, batubara) maupun non-fosil, menjadi komoditi yang bernilai tambah tinggi (Teknik Kimia UI, 2011). Saat ini kebutuhan dunia akan Industri terus meningkat sehingga peran sarjana Teknik Kimia dalam perancangan pabrik sangat dibutuhkan untuk pembangunan berkelanjutan (sustainable development). Pabrik yang dirancang dapat berupa pabrik kimia, bioproses, makanan, dan masih banyak lainnya namun lebih fokus ke arah proses, baik meningkatkan kapasitas produksi maupun memperbaiki proses yang ada (FTI ITB, 2015). Salah satu perancangan yang dilakukan ialah perancangan reaktor.
Dalam perancangan reaktor harus menentukan ukuran reaktor, tipe reaktor dan metode operasi paling tepat untuk menghasilkan kinerja reaktor terbaik.Selain itu juga dibutuhkan bentuk matematis yang dapat mendiskripsikan reaksi yang terjadi didalam reaktor.Salah satunya adalah persamaan laju reaksi, dari integral persamaan tersebut dapat diketahui
Model dan Komputasi Proses 2 waktutinggal didalam reaktor.Namun, hal ini tidak dapat memprediksi secara keseluruhan kinerja reaktor.Temperatur dan komposisi fluida yang bereaksi perubahannya sangat bervariasi dari titik ke titik dalam reaktor, tergantung pada sifat reaksi yaitu endotermis atau eksotermis, ada tidaknya penambahan atau penghilangan panas pada sistem, dan pola aliran fluida dalam bejana.Beberapa uraian diatas, menunjukan bahwa banyak faktor yang mempengaruhi kinerja reaktor.Perlakuan paling tepat pada faktor-faktor tersebut merupakan masalah utama dalam perancangan reaktor (Levenspiel, 1999). Pada beberapa perancangan reaktor yang telah ada, perhitungan berbagai macam data dilakukan dengan metode numerik secara manual. Perhitungan tersebut merupakan masalah numerik yang kompleks. Sebagai perbaikan metode yang telah ada, akan dilakukan perancangan dan simulasi reaktor secara numerik menggunakan perangkat lunak yang disebut Scilab. Perangkat lunak ini hampir menyerupai Matlab, sebagai sebuah program interaktif untuk komputasi numerik dan visualisasi data (Sasongko, 2010).
1.2 Rumusan Masalah
Berdasarkan uraian diatas, akan dilakukan perancangan dan simulasi reaktor tangki alir berpengaduk atau juga sering disebut CSTR pada kondisi non adiabatis untuk reaksi dehidrogenasi isopropanol menjadi aseton yang reaksinya bersifat endotermis dan irreversible. Perancangan dan simulasi disebut dilakukan menggunakan program Scilab 5.1.1.
1.3 Tujuan
1. Dapat mengoperasikan software Scilab 5.1.1 dengan benar
2. Dapat mensimulasikan dan menentukan profil hubungan konversi terhadap volume
3. Dapat mensimulasikan dan menentukan profil hubungan suhu terhadap konversi
1.4 Manfaat
1. Mampu mengoperasikan software Scilab 5.1.1 dengan benar
2. Mampu mensimulasikan dan menentukan profil hubungan konversi terhadap volume
3. Mampu mensimulasikan dan menentukan profil hubungan suhu terhadap konversi.
Model dan Komputasi Proses 3
BAB II
TINJAUAN PUSTAKA
2.1 Dasar Teori
2.1.1 Jenis Reaktor
Ada berbagai jenis reaktor, hal yang paling mendasar dalam penggolongan reactor adalah kondisi operasi dari reaksi yang diinginkan untuk dioperasikan. Reaktor yang sering digunakan bias dibag imenjadi 3 jenis reactor utama diantaranya Batch Reaktor (BR), Plug Flow Reaktor (PFR), dan Continuous Stirred
Tank Reaktor (CSTR).
Batch Reactor (BR)
Dalam BR, bahan baku atau reaktan dimasukkan semua pada awal proses dalam container, kemudian dicampur dengan merata, dan dibiarkan bereaksi pada jangka waktu tertentu. Setelah reaksi selesai, produk dikeluarkan. Proses yang terjadi merupakan proses unsteady state atau tidak tetap dimana komposisi berubah bergantung waktu, akan tetapi komposisi saat berada dalam reactor tetap konstan(Levensiel, 1999).
Plug Flow Reactor (PFR)
Salah satu contoh jenis reactor alir steady ideal biasanya sering disebut plug flow, slug flow, piston flow, ideal tubular, dan unmixed flow reaktor. Secara umum, jenis reactor inidisebut PFR. Reaktor jenis ini ditandai dengan adanya aliran fluida di dalam reactor tanpa adanya pencampuran dengan pengadukan atau difusi dari satu senyawa dengan senyawa lain. Kondisi yang perlu diperhatikan dalam PFR adalah waktu tinggal senyawa didalamnya (Levensiel, 1999).
Continous Stirred Tank Reactor (CSTR)
Mixed reaktor, backmixed reactor atau CSTR sesuai dengannamanya, dalam reactor ini terdapat pengadukan yang mencampur dan membuat campurannya homogen. Oleh karena itu produk yang keluar dari reactor ini memiliki komposisi yang sama dengan fluida yang berada dalam reaktor.
Model dan Komputasi Proses 4 Gambar 2.1 Tiga jenis reaktor ideal: (a) reaktor BR, (b) reaktor PFR, (c) reaktor CSTR
2.1.2 Reversibel - Irreversibel
Konstanta keseimbangan merupakan indicator dari arah suatu reaksi.Ada 2 jenis arah reaksi yaitu irreversible dan reversible. Reaksi irreversible adalah reaksi 1 arah dimana reaksi bergerak dari reaktan kearah produk sedangkan reaksi reversible adalah reaksi 2 arah dimana reaksi dapat bergerak dari reaktan kearah produk. Dalam reaksi reversible biasanya dipengaruhi oleh suhu, tekanan, dan komposisi dari senyawa yang terlibat dalam reaksi (Smith, et al., 2001).
Dalam simulasi ini digunakan reaksi irreversible yaitu (CH3)2CHOH (CH3)2CO + H2
Reaksi tersebut dikatakan irreversible karena memiliki harga konstanta keseimbangan yang sangat besaryaitu 3.1x1023.
2.1.3 Eksotermis - Endotermis
Dalam sebuah reaksi ada yang disebut dengan reaksi endotermis atau reaksi eksotermis. Hal tersebut ditinjau dari entalpi atau panas yang dihasilkan atau diserap dalam sebuah reaksi. Reaksi endotermis adalah reaksi yang menyerap panas dari lingkungan ke dalam reaksi, sedangkan reaksi eksotermis adalah reaksi yang melepas panas dari reaksi ke lingkungan. Reaksi endotermis dan eksotermis dapat dilihat darinilai ΔH-nya atau entalpinya. Jika positif maka reaksi endotermis, jika negative maka reaksi eksotermis. Dalam reaksi yang disimulasikan merupakan reaksi endotermis dimana proses reaksi membutuhkan panas atau dapat menyerap panas dari lingkungan dengan nilai ΔH =+66.6 KJ/mol
Model dan Komputasi Proses 5 2.1.4 Adiabatis – Non Adiabatis
Panas dapat dihasilkan atau diserap ke dalam sebuah reaksi. Panas tersebut dilihat dari ΔQ atau kalor yang berpindah dalam sebuah reaksi. Dalam perancangan reactor ada reaksi yang adiabatic dan non adiabatic. Adiabatic adalah reaksi dimana terdapat perpindahan panas dari reaksi kelingkungan sekitar, sedangkan non adiabatic adalah reaksi dimana tidak ada perpindahan panas dari reaksi ke lingkungan (Smith, et al., 2001). Dalam simulasi kali ini dimaksudkan untuk merancang reaktor yang non adiabatic.
2.1.5 Monomolekuler – Bimolekuler
Berdasarkan jumlah reaktannya, reaksi dibagi menjadi 2 yaitu reaksi monomolekuler dan reaksi bimolekuler. Reaksi monomolekuler adalah reaksi dengan 1 jenis reaktan saja sedangkan reaksi bimolekuler adalah reaksi dengan jumlah jenis reaktan 2 sesuai dengan namanya. Dalam simulasi kali ini digunakan reaksi monomolecular yaitu isopropanol (CH3)2CHOH).
2.1.6 Seri – Parallel
Dalam sebuah reaksi hampir tidak mungkin ditemukan bahwa reaksi akan bergerak kearah 1 produk saja namun akan terdapat reaksi samping atau produk samping dari sebuah reaksi. Produk samping yang terbentuk dapat terjadi melalui reaksi parallel atau reaksi seri. Reaksi parallel adalah reaksi dimana reaktan akan bergerak ke 2 arah reaksi yang berbeda seperti
A B A C
Reaksi seri adalah reaksi dimana produk yang dihasilkan akan mengalami reaksi lebih lanjut dan berubah menjadi produk lain (Fogler, 2004). Reaksi seri digambarkan sebagai berikut
A B C
Dalam simulasi kali ini digunakan jenis reaksi parallel dimana reaktan isopropanol bergerak kedua reaksi yang berbeda.
Model dan Komputasi Proses 6
2.2. Studi Kasus Pembuatan Aseton dari Dehidrogenasi Isopropanol
2.2.1. Reaksi Pembuatan Aseton (CH3COCH3) dengan Isopropil Alkohol
((CH3)2COCH3).
Reaksi monomolekuler merupakan reaksi berlangsung dengan molekul reaktan yang sama. Sebagai contoh adalah reaksi polimerisasi kondensasi, dekomposisi, dan dehidrogenasi (cracking).
Reaksi paralel merupakan reaksi dimana suatu reaktan akan menghasilkan produk yang berbeda, sehingga ada selektivitas reaktan untuk menghasilkan produk yang satu terhadap yang lain.
Salah satu pembuatan aseton adalah dengan reaksi dehidrogenasi isopropyl alkohol :
(CH3)2CHOH(g)CH3COCH3(g)+ H2(g)
Reaksi dekomposisi ini juga menimbulkan reaksi samping sebagai berikut: (CH3)2CHOH(g)CH3CH=CH2(g) + H2O(g)
(Yuliani, 2014) 2.2.2. Tinjauan Termodinamika
Tinjauan secara termodinamika ditujukan untuk mengetahui sifat reaksi (endotermis/eksotermis) dan arah reaksi (reversible / irreversible).
Reaksi utama: (CH3)2CHOH(g)CH3COCH3(g)+ H2(g)
∆H reaksi = ∆H produk- ∆H reaktan = (∆Ho
f298CH3COCH3(g) – (∆Hof298(CH3)2CHOH(g))
=( -217.71+272.6) kJ/mol = 54,89 kJ/mol
Dengan demikian reaksi yang berlangsung adalah reaksi endotermis yang menghasilkan panas.
Reaksi Samping : CH3)2CHOH(g)CH3CH=CH2(g) + H2O(g)
ΔHf (CH3)2CHOH(g) = -272.6 kJ/mol ΔHfH2O(g) = -241,8 kJ/mol ΔHfC3H6 (g) = 19.71 kJ/mol ΔHf =ΔHf H2 + ΔHf CH3COCH3- ΔHf (CH3)2CHOH = (-241.8+19.71+272.6) kJ/mole = 50,51 kJ/mol ∆Go = ∆Go produk - ∆Go reaktan
Model dan Komputasi Proses 7 = -153,15 + 173,5 = 20,35 kJ/mol ∆Go = -RT ln K ln K = -∆Go / RT = -20,35 kJ/kmol / (8,314 kJ/kmol K x 298 K) = -8,21 x 10-3 = 0,00821 K = 0,991 reversible
Karena harga kosntanta kesetimbangan lebih besar dari 1, maka reaksi berlangsung secara searah (irreversible).
Data Termodinamika lainnya adalah : -Panas Spesifik : 𝐶𝑝𝐴 = 140,67 𝐽 𝑚𝑜𝑙 𝐾 𝐶𝑝𝐵 = 798,144 𝐽 𝑚𝑜𝑙 𝐾 𝐶𝑝𝐶 = 28,83 𝐽 𝑚𝑜𝑙 𝐾 𝐶𝑝𝐷 = 64,78 𝐽 𝑚𝑜𝑙 𝐾 𝐶𝑝𝐸 = 33,52 𝐽 𝑚𝑜𝑙 𝐾
-Perhitungan nilai Cp &∆𝐻
𝑇𝑅 = 298 𝐾 ∆𝐻𝑅𝑋1 𝑇𝑅 = 54.890 J/mol ∆𝐻𝑅𝑋2 𝑇𝑅 = 50.490 J/mol ∆𝐶𝑝1 = 𝐶𝑝𝐵 + 𝐶𝑝𝐶 − 𝐶𝑝𝐴 ∆𝐶𝑝1 = 798,144 + 28,83 − 140,67 = 686,304 𝐽 𝑚𝑜𝑙 𝐾 ∆𝐶𝑝2 = 𝐶𝑝𝐷 + 𝐶𝑝𝐸 − 𝐶𝑝𝐴 ∆𝐶𝑝2 = 64,78 + 33,52 − 140,67 = −42,37 𝐽 𝑚𝑜𝑙 𝐾 ∆𝐶𝑝 = ∆𝐶𝑝1+ ∆𝐶𝑝2 ∆𝐶𝑝 = 686,304 − 42,37 = 643,934 𝐽 𝑚𝑜𝑙 𝐾 𝑛𝑖=1𝜃𝑖𝐶𝑝𝑖 = 2𝐶𝑝𝐴
Model dan Komputasi Proses 8 𝑛𝑖=1𝜃𝑖𝐶𝑝𝑖 = 2 × 140,67 = 281,34 𝐽 𝑚𝑜𝑙 𝐾 𝜃 = 0 (𝑚𝑜𝑛𝑜𝑚𝑜𝑙𝑒𝑘𝑢𝑙𝑒𝑟) 2.2.3. Tinjauan Kinetika
Tinjauan secara kinetika dimaksudkan untuk mengetahui pengaruh perubahan suhu terhadap kecepatan reaksi. Secara kinetika, reaksi pembentukan asam asetat merupakan reaksi orde dua dengan persamaan kecepatan reaksi sebagai berikut :
Reaksi utama: (CH3)2CHOH(g)CH3COCH3(g)+ H2(g)
Reaksi samping (CH3)2CHOH(g)CH3CH=CH2(g) + H2O(g)
Laju reaksi: -rA = k1.CA+ k2.CA
dimana :
CA = konsentrasi etilen
k1 = konstanta kecepatan reaksi utama
k2 = konstanta kecepatan reaksi samping
Menurut persamaan Arhenius :
k = A e-E/RT Dalam hubungan ini :
k = konstanta kecepatan reaksi A = factor frekuensi tumbukan
E/R = faktor energy aktivasi/tetapan gas ideal T = temperature mutlak
Dari persamaan Arhenius, diketahui bahwa dengan bertambahnya suhu reaksi maka akan memperbesar harga konstanta kecepata reaksi (k), yang berarti mempercepat kecepatan reaksinya.
2.2.3. Kondisi Operasi
Reaksi pembentukan aseton dengan proses degidrogenasi senyawa isopropanol dengan kondisi operasi:
Suhu operasi: 350oC atau 623 K (Yuliani, 2014).
Model dan Komputasi Proses 9
Reaktor beroperasi dengan kondisi nonadiabatis dan isotermal (adanya perpindahan kalor).
Dengan adanya kondisi operasi ini maka didapatkan:
Nilai konstanta kecepatan reaksi utama berdasarkan refferensi irda (2015) dengan kondisi Isotermal:
𝑘1 = 3,51 × 105 𝑚
3 𝑔𝑎𝑠
𝑚3𝑏𝑢𝑙𝑘 𝑠
𝑘1 = 5,85 𝑙 𝑚𝑜𝑙 𝑠 dimana : k = konstanta kecepatan reaksi
Nilai konstanta kecepatan reaksi samping berdasarkan refferensi Yaws (1999) dengan kondisi Isotermal :
𝑘2 = 929,36 𝑘𝑚𝑜𝑙 𝑚3 𝑗𝑎𝑚
𝑘2 = 0,25 𝑙 𝑚𝑜𝑙 𝑠 dimana : k = konstanta kecepatan reaksi
2.2.4 Perhitungan parameter yang dibutuhkan
Dalam perhitungan variabel volume serta suhu reaktor CSTR, dibutuhkan beberapa parameter yang digunakan untuk menghitung variabel yang telah ditentukan. Antara lain :
𝐹𝐴𝑜 = 5 𝑚𝑜𝑙/𝑑𝑒𝑡 𝐹𝐴 = 𝐹𝐴𝑜 1 − 𝑋𝐴 𝐹𝐴 = 5 1 − 0,95 = 0,25 𝑣0 = 15 𝑙𝑖𝑡𝑒𝑟/𝑑𝑒𝑡 𝑅 = 8,314 𝐽 𝑚𝑜𝑙𝐾 𝑑 = 1 𝑈 = 110 J m2 s K(𝑐𝑎𝑟𝑏𝑜𝑛𝑠𝑡𝑒𝑒𝑙) 𝐷 = 1,5 𝑚 𝑎 = 4 1,5= 2,67 𝑚 −1
Model dan Komputasi Proses 10 𝑈𝑎 = 293,7 J m3 s K= 0,2937 J lt s K 𝐶𝐴𝑜 = 𝐹𝐴𝑜 𝑣𝑜 = 5 15= 0,33
Model dan Komputasi Proses 11
BAB III
METODE PENYELESAIAN
3.1 Permodelan
Simulasi dan perancangan reaktor yang akan dibuat adalah CSTR (Continuous Stirred
Tank Reactor), non-adiabatis dari reaksi yang bersifat irreversible, endotermis,
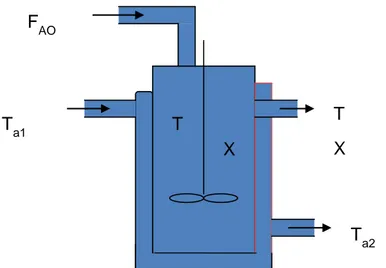
monomolecular dan reaksi paralel. Suhu reaktor dijaga dengan cara menambahkan pemanas. Reaksi1: (CH3)2CHOH(g)CH3COCH3(g)+ H2(g) A→ B+ C Reaksi2: (CH3)2CHOH(g)CH3CH=CH2(g) + H2O(g) A → D + E FAO Ta1 T X T X Ta2 k1 k2
Gambar 3. 1 Pemodelan reactor CSTR dengan jaket pemanas
Model dan Komputasi Proses 12 3.2 Algoritma Penyelesaian Neraca massa CSTR : 𝐾𝑒𝑐𝑒𝑝𝑎𝑡𝑎𝑛 𝑎𝑙𝑖𝑟𝑎𝑛 𝐴 𝑚𝑎𝑠𝑢𝑘 𝑠𝑖𝑠𝑡𝑒𝑚 + 𝐾𝑒𝑐𝑒𝑝𝑎𝑡𝑎𝑛 𝑝𝑒𝑟𝑢𝑏𝑎ℎ𝑎𝑛 𝐴 𝑑𝑎𝑙𝑎𝑚 𝑠𝑖𝑠𝑡𝑒𝑚 − 𝑘𝑒𝑐𝑒𝑝𝑎𝑡𝑎𝑛 𝑎𝑙𝑖𝑟𝑎𝑛 𝐴 𝑘𝑒𝑙𝑢𝑎𝑟 𝑠𝑖𝑠𝑡𝑒𝑚 = [𝐴𝑘𝑢𝑚𝑢𝑙𝑎𝑠𝑖 𝐴 𝑑𝑎𝑙𝑎𝑚 𝑠𝑖𝑠𝑡𝑒𝑚] −𝐹𝐴+ 𝐹𝐴𝑜 + (−𝑟𝐴𝑣) = 0 𝐹𝐴 − 𝐹𝐴𝑜 = −𝑟𝐴𝑉 −𝐹𝐴𝑜(1 − 𝑋𝐴) + 𝐹𝐴𝑜 = −𝑟𝐴𝑉 𝐹𝐴𝑜𝑋𝐴 = −𝑟𝐴𝑉 𝑉 = 𝐹𝐴𝑋𝐴 −𝑟𝐴 Lajureaksi : a. −𝑟𝐴 = 𝑘1. 𝐶𝐴 + 𝑘2. 𝐶𝐴 Persamaan diubahmenjadi : 𝑑𝐶𝐴 𝑑𝑡 = −𝑘1. 𝐶𝐴− 𝑘2. 𝐶𝐴 b. 𝑟𝐵 = 𝑘1. 𝐶𝐴 + 𝑘2. 𝐶𝐴 Persamaandiubahmenjadi 𝑑𝐶𝐵 𝑑𝑡 = 𝑘1. 𝐶𝐴+ 𝑘2. 𝐶𝐴 c. 𝑟𝐶 = 𝑘1. 𝐶𝐴 Persamaandiubahmenjadi 𝑑𝐶𝐶 𝑑𝑡 = 𝑘1. 𝐶𝐴 d. 𝑟𝐷 = 𝑘2. 𝐶𝐴 Persamaandiubahmenjadi 𝑑𝐶𝐷 𝑑𝑡 = 𝑘2. 𝐶𝐴
Model dan Komputasi Proses 13
Stoikiometri :
Jika Spesies A(Isopropanol) dianggap sebagai pereaktan pembatas, maka stoikiometri untuk setiap spesies pada fase gas:
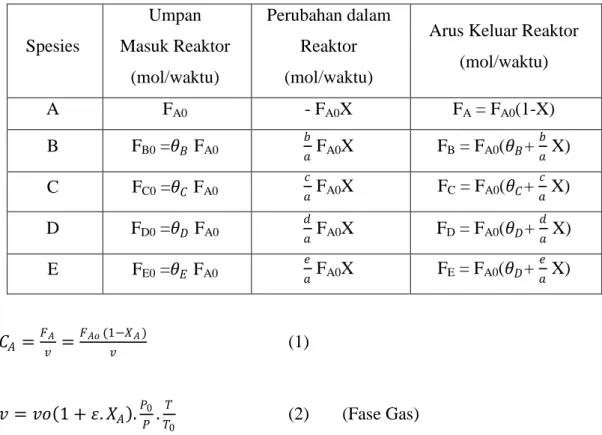
Tabel 3. 1 Persamaan stoikiometri
Spesies Umpan Masuk Reaktor (mol/waktu) Perubahan dalam Reaktor (mol/waktu)
Arus Keluar Reaktor (mol/waktu) A FA0 - FA0X FA = FA0(1-X) B FB0 =𝜃𝐵 FA0 𝑏 𝑎 FA0X FB = FA0(𝜃𝐵+ 𝑏 𝑎 X) C FC0 =𝜃𝐶 FA0 𝑐 𝑎 FA0X FC = FA0(𝜃𝐶+ 𝑐 𝑎 X) D FD0 =𝜃𝐷 FA0 𝑑 𝑎 FA0X FD = FA0(𝜃𝐷+ 𝑑 𝑎 X) E FE0 =𝜃𝐸 FA0 𝑒 𝑎 FA0X FE = FA0(𝜃𝐷+ 𝑒 𝑎 X) 𝐶𝐴 = 𝐹𝐴 𝑣 = 𝐹𝐴𝑜(1−𝑋𝐴) 𝑣 (1) 𝑣 = 𝑣𝑜 1 + 𝜀. 𝑋𝐴 .𝑃0 𝑃 . 𝑇 𝑇0 (2) (Fase Gas)
Karena perubahan tekanan dianggap kecildansuhu reactor dengan keluar sama, maka
𝑣 = 𝑣𝑜 1 + 𝜀. 𝑋𝐴 (3)
𝐶𝐵0 = 𝐶𝐶0 = 𝐶𝐷0 = 𝐶𝐸0 = 0 (4) Jika:
𝑦𝐴0= 0,99 (Kemurnian Reaktan Isopropyl 99%)
𝛿 = 1 + 1 − 1 = 1 𝜀 = 𝑦𝐴0𝛿 = 0,99.1
𝜀 = 0,99
Persamaan(3) disubstitusikankepersamaan (1), menjadi 𝐶𝐴 = 𝐹𝐴𝑜 1−𝑋𝐴
𝑣𝑜 1+𝜀.𝑋𝐴 =
𝐶𝐴𝑜 1−𝑋𝐴
1+𝜀.𝑋𝐴 (5)
Persamaan (4) disubtitusikan ke persamaan (5) masing-masing spesies menjadi : 𝐶𝐴 = 𝐶𝐴0 (1 − 𝑋𝐴)
Model dan Komputasi Proses 14 𝐶𝐵 = 𝐶𝐴0 𝐶𝐵 𝐶𝐴− 1 2𝑋𝐴 1 + 0,99𝑋𝐴 𝐶𝐶 = 𝐶𝐴0 𝐶𝐶 𝐶𝐴+ 1 2𝑋𝐴 1 + 0,99𝑋𝐼 𝐶𝐷 = 𝐶𝐴0 𝐶𝐷 𝐶𝐴 + 1 2𝑋𝐴 1 + 0,99𝑋𝐴 𝐶𝐸 = 𝐶𝐴0 𝐶𝐸 𝐶𝐴 + 1 2𝑋𝐴 1 + 0,99𝑋𝐴 Kombinasi −𝑟𝐴 = 𝑘1𝐶𝐴+ 𝑘2𝐶𝐴 −𝑟𝐴 = 𝑘1. 𝐶𝐴0 (1 − 𝑋𝐴) (1 + 𝜀𝑋𝐴)+ 𝑘2𝐶𝐴0 (1 − 𝑋𝐴) (1 + 𝜀𝑋𝐴) 𝑉 = 𝐹𝐴𝑜𝑋𝐴 𝑘1. 𝐶𝐴0 (1−𝑋𝐴) (1+0,99𝑋𝐴)+ 𝑘2𝐶𝐴0 (1−𝑋𝐴) (1+0,99𝑋𝐴) 𝑉 = 5. 𝑋𝐴 5,85. 𝐶𝐴0 (1−𝑋𝐴) (1+0,99𝑋𝐴)+ 0,25𝐶𝐴0 (1−𝑋𝐴) (1+0,99𝑋𝐴) Neraca EnergiCSTR:
Untuk reaksi ganda dengan nilai Cp berbeda tiap spesies: Q - 𝑊𝑆 -𝐹𝐴0 𝜃𝑖 𝑇 𝑇0 𝐶𝑝𝑖𝑑𝑇 + ∆𝐻𝑅𝑋 (𝑇𝑅)+ ∆𝐶𝑝(𝑇 − 𝑇𝑅) [𝑟𝐴𝑉] = 0 Jika : Q = 𝑈𝐴 (𝑇𝑎 − 𝑇) karena non-adiabatis Ws = 0 karenakerjapengadukkecil Maka : UA(Ta-T)-𝐹𝐴0 𝑛𝑖=1𝜃𝑖𝐶𝑝𝑖 𝑇 − 𝑇0 + ∆𝐻𝑅𝑋 (𝑇𝑅)+ ∆𝐶𝑝(𝑇 − 𝑇𝑅) 𝑟𝐴𝑉 = 0
Model dan Komputasi Proses 15 Reaksi berjumlah 2 dan paralel :
𝑈𝐴 𝑇𝑎 − 𝑇 − 𝐹𝐴0 𝜃𝑖 𝑛 𝑖=1 𝐶𝑝𝑖 𝑇 − 𝑇0 + 𝑉𝑟1𝐴∆𝐻𝑅𝑋1𝐴 𝑇𝑅 + 𝑉𝑟2𝐴∆𝐻𝑅𝑋2 𝑇𝑅 + 𝑉𝑟𝐴∆𝐶𝑝(𝑇 − 𝑇𝑅) = 0 Dimana: r1A = k1.CA r2A = k2.CA
Model dan Komputasi Proses 16 3.3 Logika Pemrograman 𝑇 = 𝑈𝐴 𝑇𝑎 + 𝑉𝑟1𝐴∆𝐻𝑅𝑋1𝐴 𝑇𝑅 + 𝑉𝑟2𝐴∆𝐻𝑅𝑋2𝐴 𝑇𝑅 − 𝑉𝑟𝐴∆𝐶𝑝(𝑇𝑅) + 𝐹𝐴0 𝜃𝑖 𝐶𝑝𝑖 𝑇𝑜 𝑛 1 𝑈𝐴 − 𝑉𝑟𝐴∆𝐶𝑝 + 𝐹𝐴0 𝜃𝑖𝐶𝑝𝑖𝑛1
Didapat grafik hubungan V terhadap X pada range tertentu
𝑉 = 𝐹𝐴𝑜𝑋𝐴 𝑘1. 𝐶𝐴0 (1−𝑋𝐴) (1+0,99𝑋𝐴)+ 𝑘2𝐶𝐴0 (1−𝑋𝐴) (1+0,99𝑋𝐴) Neraca Massa = 𝑉 =𝐹𝐴 0𝑋𝐴 −𝑟𝐴 Kecepatanreaksi =−𝑟𝐴=𝑘1. 𝐶𝐴+ 𝑘2. 𝐶𝐴 Stokiometri = 𝐶𝐴= 𝐶𝐴0 1−𝑋𝐴 1+𝑋𝐴 Kombinasi=
Reaksi fase gas, paralel, Monomolekular
A B+C
A D+E
T didapat dari X tertentu
Mencari Parameter yang diperlukan dari Studi Pustaka/Literatur
Didapat nilai V pada X tertentu
X ditentukan T dihitung
CSTR
Didapat Hubungan T vs X pada range terntentu
Model dan Komputasi Proses 17
3.4 Bahasa Pemrograman
a. Menentukan hubungan konversi terhadap volume reactor pada rentang konversi 0,5-0,95 dengan range 0,05 : clc clear FAo=5; k1=5.85; k2=0.25; K1=3997.51; XA=[0.5;0.55;0.6;0.65;0.7;0.75;0.8;0.85;0.9;0.95]; vo=15; E=0.99; CAo=FAo/vo;
CA=(CAo.*(1-XA))./(1+(E.*XA)); ra=(k1*CA)+(k2*CA);
V=(FAo.*XA)./(ra);
disp('Tabel Hubungan Konversi dengan Volume')
disp(' XA V(lt) CA')
disp([XAVCA])
clf
plot2d(XA,V,[2,5,-1])
xtitle('Hubungan Konversi terhadap Volume(liter)','Konversi','Volume')
b. Menentukan hubungan konversi terhadap volume reactor pada rentang konversi 0,5-0,95 dengan range 0,05 clc clear function y = CSTR (T) UA=0.2937; FAo=5; Ta=700; Tr=298; To=623; sigmatetacp=281.34; deltaCp=643.934; deltaH1=54890; deltaH2=54490; k1=5.85; k2=0.25; K1=3997.51; vo=15; E=0.99; CAo=FAo/vo;
CA=(CAo.*(1-XA))./(1+(E.*XA)); ra=(-k1*CA)+(-k2*CA); V=(FAo.*XA).*((ra)^-1); r1=k1.*CA; r2=k2.*CA; y=(UA.*(Ta-T))-(FAo.*sigmatetacp.*(T-To))+(V.*r1.*deltaH1.*Tr)+(V.*r2.*deltaH2.*Tr) endfunction XA=[0.5;0.55;0.6;0.65;0.7;0.75;0.8;0.85;0.9;0.95]; Ttebak=[1000;298;300;312;213;273;300;312;312;300]; Treaktor=fsolve(Ttebak,CSTR) disp(' XA T(K)') disp([XA Treaktor])
Model dan Komputasi Proses 18 clf
plot2d(XA,Treaktor,[2,5,-1])
Model dan Komputasi Proses 19
BAB IV
HASIL SIMULASI DAN ANALISA
3.1 Hasil Simulasi
3.1.1 Hubungan Konversi dengan Volume(lt)
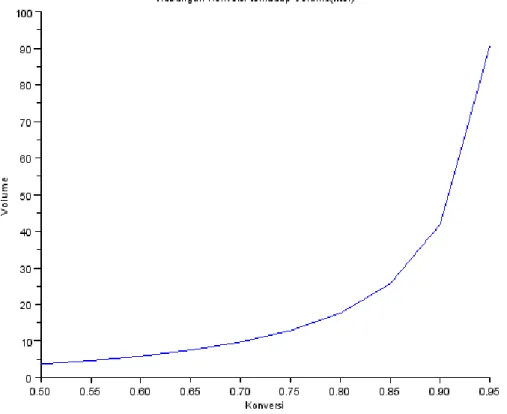
Gambar 4. 1 Deklarasi console scilab 5.1.1 hubungan konversi dengan volume
Model dan Komputasi Proses 20 3.1.2 Hubungan Konversi dengan Suhu (K)
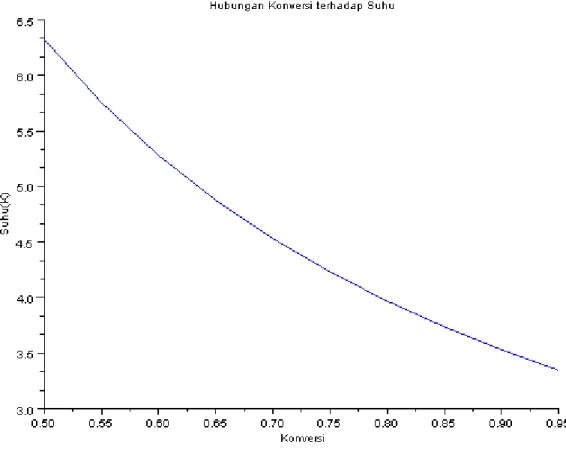
Gambar 4. 3 Deklarasi console Scilab 5.1.1 hubungan konversi dengan suhu
Model dan Komputasi Proses 21
3.2 Analisa Hasil
3.2.1 Hubungan Konversi (Xa) terhadap Volume Reaktor
Berdasarkan persamaan Volume Reaktor dan kecepatan reaksi monomolekuler-parallel fase gas :
𝑉 = 𝐹𝐴𝑋𝐴 −𝑟𝐴 −𝑟𝐴 = 𝑘1𝐶𝐴+ 𝑘2𝐶𝐴 −𝑟𝐴 = 𝑘1. 𝐶𝐴0 (1 − 𝑋𝐴) (1 + 𝜀𝑋𝐴) + 𝑘2𝐶𝐴0 (1 − 𝑋𝐴) (1 + 𝜀𝑋𝐴)
Dilakukan perhitungan Volume reaktor pada rentang 0,5-0,95 dengan range 0,05 menggunakan prinsip deklarasi Scilab AAP (Akar-Akar Persamaan), Sehingga didapatkan hubungan Xa dengan V pada rentang tersebut sesuai dengan tabel :
Hubungan yang didapatkan ialah semakin besar nilai konversi, maka volume reaktor menjadi naik. Volume pada konversi paling tinggi yaitu 0,95 adalah 90,66 lt. Setelah mendapatkan hubungan Xa dengan V pada rentang tertentu, dengan memplotkan pada grafik didapatkan Grafik Hubungan Volume dengan suhu :
Model dan Komputasi Proses 22 3.2.2 Hubungan Konversi (Xa) terhadap Suhu Reaktor
Berdasarkan persamaan Suhu Reaktor pada RATB (Reaktor Alir Tangki Berpengaduk) reaksi parallel :
𝑇 = 𝑈𝐴 𝑇𝑎 + 𝑉𝑟1𝐴∆𝐻𝑅𝑋1𝐴 𝑇𝑅 + 𝑉𝑟2𝐴∆𝐻𝑅𝑋2𝐴 𝑇𝑅 − 𝑉𝑟𝐴∆𝐶𝑝(𝑇𝑅) + 𝐹𝐴0 𝜃𝑖 𝐶𝑝𝑖 𝑇𝑜
𝑛 1
𝑈𝐴 − 𝑉𝑟𝐴∆𝐶𝑝 + 𝐹𝐴0 𝜃𝑖𝐶𝑝𝑖𝑛 1
kukan perhitungan Suhu reaktor pada rentang 0,5-0,95 dengan range 0,05 menggunakan prinsip deklarasi Scilab AAP (Akar-Akar Persamaan), Sehingga didapatkan hubungan Xa dengan T pada rentang tersebut sesuai dengan tabel :
Dapat disimpulkan bahwa semakin tinggi konversi, maka suhu dalam reaktor semakin rendah karena sifat reaksi yang endotermis. Suhu pada Konversi paling tinggi yaitu 0,95 adalah 3,34 K. Setelah mendapatkan hubungan Xa dengan T pada rentang tertentu, dengan memplotkan pada grafik didapatkan Grafik Hubungan Volume dengan suhu :
Model dan Komputasi Proses 24
BAB V
PENUTUP
3.1 Kesimpulan
Pada perancangan dan simulasi reaktor cstr non adiabatis untuk reaksi dehidrogenasi isopropanol menjadi aseton menggunakan program scilab 5.1.1.diperoleh :
1. Volume Reaktor pada konversi 0,95 adalah 90,66 liter
2. Hubungan konversi terhadap volume reaktor adalah, semakin besar konversi maka semakin besar pula volume reaktor.
3. Suhu Reaktor Isotermal pada konversi 0,95 adalah 3,34 K.
4. Hubungan konversi terhadap Suhu Reaktor adalah, semakin besar konversi, maka suhu reaktor menjadi turun karena sifat reaksinya ialah endotermis
3.2 Saran
Perlu dilakukan perancangan dan simulasi reaktor dengan jenis reaktor lain pada kondisi operasi sama agar dapat mengetahui jenis reaktor yang paling tepat dan efisien pada reaksi dehidrogenasi isopropanol menjadi aseton
Model dan Komputasi Proses 25
DAFTAR PUSTAKA
Agustina, Irda.2015.Pembuatan Aseton dari Isopropil Alkohol.Palembang: Politeknik Negeri Sriwijaya.
Fogler. H Scout, 2004, Element of Chemical Reaction Engineering 3rded, India : Prentice-Hall of India
Himpunan Mahasiswa Teknik Kimia AKPRIND.2015. Teknik Kimia
AKPRIND.http://hmtk-akprind.blogspot.co.id/2013/05/apa-itu-teknik-kimia-dan-pentingnya.html diakses pada tanggal 26 November 2015 pukul 21.00 WIB
Levenspiel, Octave.1999. Chemical Reaction Engineering 3st Edition. Newyork
:John Wiley & Sons, Inc.
Program Sarjana Teknik Kimia Institut Teknologi Bandung.2015. Fakultas
Teknologi Industri Institut Teknologi Bandung.http://usm.itb.ac.id/Prodi/130.htm diakses pada tanggal 26 November pukul 21.00 WIB
Program Sarjana Teknik Kimia Universitas Indonesia.2011.Teknik Kimia
Universitas
Indonesia.https://www.ui.ac.id/akademik/kelas-internasional/program-sarjana-teknik-kimia-kki.html diakses pada tanggal 26 November 2015 pukul 21.00 WIB
Sasongko, Budi Setia. 2010. Metode Numerik dengan Scilab.Yogyakarta : ANDI Yogyakarta
Smith. J M et all. 2001. Introduction to Chemical Engineering Thermodynamic 6th
edition, Mc. Graw Hill BookKogakusha Ltd, Tokyo