PEMANFAATAN DAUN SIRIH (Piper betle) SEBAGAI BAHAN
ANESTESI PADA PROSES TRANSPORTASI
IKAN NILA (Oreochromis niloticus)
INTAN KARTIKA OKTAVIANI
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Pemanfaatan Daun Sirih (Piper betle) sebagai Bahan Anestesi pada Proses Transportasi Ikan Nila (Oreochromis niloticus) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juni 2016
Intan Kartika Oktaviani NIM C34120061
*Pelimpahan hak cipta atas karya tulis dari penelitian kerja sama dengan pihak luar IPB harus didasarkan pada perjanjian kerja sama yang terkait
ABSTRAK
INTAN KARTIKA OKTAVIANI. Pemanfaatan Daun Sirih (Piper betle) sebagai Bahan Anestesi pada Proses Transportasi Ikan Nila (Oreochromis niloticus). Dibimbing oleh RUDDY SUWANDI dan PRIADI SETYAWAN.
Daun sirih (Piper betle) dapat digunakan sebagai bahan anestesi alami pada proses pemingsanan ikan nila (Oreochromis niloticus). Senyawa aktifnya yaitu eugenol, kavikol, kavibetol, metil eugenol, karvakol dan sineol. Tujuan dari penelitian ini adalah untuk menentukan konsentrasi terbaik dari ekstrak kasar daun sirih untuk pingsan ikan nila diamati pada waktu pingsan kurang dari 3 menit dengan tingkat kelangsungan hidup tertinggi dari 100% selama proses transportasi. Metode penelitian ini menggunakan konsentrasi ekstrak daun sirih untuk pemingsanan yaitu 1,25%, 1,75% dan 2,25%. Konsentrasi terbaik yang digunakan yaitu 1,75% dengan waktu pemingsanan 1,58 menit dan waktu pembugaran 6,24 menit denagan tingkat kelangsungan hidup pada ikan nila yaitu 100% dengan waktu pingsan 0, 30, 60, 90 dan 120 menit. Tingkat kelangsungan hidup ikan nila pada 150 menit yaitu 80%. Transportasi ikan nila selama 120 menit menghasilkan tingkat kelangsungan hidup 100% untuk perlakuan anestesi dan kontrol memiliki tingkat kelangsungan hidup 60%.
Kata kunci: Anestesi, ektstrak daun sirih, imotilisasi, nila, survival rate (SR)
ABSTRACT
INTAN KARTIKA OKTAVIANI. Utilization Process Betel Leaf (Piper betle) as an Anesthetics Substances on Transportation of Tilapia (Oreochromis niloticus). Supervised by RUDDY SUWANDI and PRIADI SETYAWAN.
Betel leaf (Piper betle) can be used as a natural anesthetic subtances for fainting tilapia (Oreochromis niloticus). The active subtances are eugenol, kavikol, kavibetol, metil eugenol, karvakol and sineol. The purpose of this research was to determin the best concentration of betel leaf’s crude extract for fainting of tilapia observed on fainted time less then 3 minutes with the higest survival rate of 100% during transportation process. Method of this research used concentration of betel leaf crude extract for fainting of 1.25%, 1.75% and 2.25%. The best concentration used 1.75% with fastest fainting time of 1.58 minutes and recovery time 6.24 minutes. Survival rate of tilapia 100% unconscious time 0, 30, 60, 90 and 120 minutes. Survival rate of tilapia on unconscious time 150 minutes was 80%. Transporting of tilapia for 120 minutes resulted the survival rate of 100% for anesthetic treated sample and only 60% survival rate of control sample.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan
pada
Departemen Teknologi Hasil Perairan
INTAN KARTIKA OKTAVIANI
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
2016
PEMANFAATAN DAUN SIRIH (Piper betle) SEBAGAI BAHAN
ANESTESI PADA PROSES TRANSPORTASI
Judul Skripsi : Pemanfaatan Daun Sirih (Piper betle) sebagai Bahan Anestesi pada Proses Transportasi Ikan Nila (Oreochromis niloticus)
Nama : Intan Kartika Oktaviani NIM : C34120061
Disetujui oleh
Dr Ir Ruddy Suwandi MS MPhil Pembimbing I
Priadi Setyawan SPi MSi Pembimbing II
Diketahui oleh
Prof Dr Ir Joko Santoso MSi Ketua Departemen
PRAKATA
Puji syukur penulis panjatkan kehadirat Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Juni 2015 sampai Februari 2016 ini ialah transportasi biota perairan, dengan judul Pemanfaatan Daun Sirih (Piper betle) sebagai Bahan Anestesi pada Proses Transportasi Ikan Nila (Oreochromis niloticus).
Penulis mengucapkan terima kasih kepada pihak-pihak yang telah membantu penulis dalam menyelesaikan skripsi ini, antara lain kepada:
1 Bapak Dr Ir Ruddy Suwandi MS MPhil selaku dosen pembimbing I dan pembimbing akademik, atas segala bimbingan, motivasi, dan pengarahan yang telah diberikan kepada penulis.
2 Bapak Priadi Setyawan SPi MSi selaku pembimbing II, atas bimbingan, motivasi, dan pengarahan yang telah diberikan.
3 Ibu Dra Ella Salamah MSi selaku dosen penguji atas bimbingan dan arahan yang telah diberikan kepada penulis.
4 Bapak Prof Dr Ir Joko Santoso MSi selaku Ketua Departemen Teknologi
Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
5 Ibu Prof Dr Ir Nurjanah MS selaku komisi pendidikan terima kasih atas
segala bimbingan dan arahannya.
6 Keluarga dan orang tua (Ibu Titi Sumarni dan Bapak Pepen Apendi Alm.) yang selalu memberi kasih sayang, dukungan, saran, dan motivasi.
7 Keluarga besar THP 49 yang telah mendukung penulis dalam menyusun skripsi ini.
8 Balai Penelitian Pemuliaan Ikan (BPPI) Sukamandi yang telah memberikan izin dan kesempatan kepada penulis untuk melaksanakan penelitian.
9 Staf peneliti (Pak Adam, Pak Manto, Ibu Nunuk) dan Staf teknisi (Pak Oman, Pak Hari, Pak Ifan, Pak Bisri) Hatchery Nila yang telah membantu dalam pelaksanaan penelitian.
10 Arman Dea Nugraha beserta keluarga yang membantu dan mendukung penulis dalam segala kegiatan penelitian ini.
Penulis menyadari bahwa masih terdapat kekurangan dalam penulisan skripsi ini, sehingga kritik dan saran yang dapat membangun dalam penulisannya. Semoga tulisan ini bermanfaat bagi pihak-pihak yang membaca dan membutuhkan.
Bogor, Juni 2016
DAFTAR ISI
DAFTAR TABEL ... vi DAFTAR GAMBAR ... vi DAFTAR LAMPIRAN ... vi PENDAHULUAN ... 1 Latar Belakang ... 1 Perumusan Masalah ... 2 Tujuan Penelitian ... 2 Manfaat Penelitian ... 2Ruang Lingkup Penelitian ... 2
METODE PENELITIAN ... 2
Waktu dan Tempat ... 3
Bahan dan Alat ... 3
Prosedur Penelitian ... 3
HASIL DAN PEMBAHASAN ... 8
Konsentrasi Terbaik Ekstrak Daun Sirih sebagai Bahan Anestesi ... 8
Tingkat Kelangsungan Hidup Ikan Nila ... 10
Penelitian Utama ... 11
Analisis Glukosa Darah Ikan Nila ... 13
Analisis Kualitas Air ... 14
KESIMPULAN DAN SARAN ... 16
Kesimpulan ... 16
Saran ... 16
DAFTAR PUSTAKA ... 16
LAMPIRAN ... 23
DAFTAR TABEL
1 Hasil analisis glukosa darah ... 13
2 Hasil analisis kualitas air ... 14
DAFTAR GAMBAR
1 Diagram alir proses ekstraksi daun sirih dan pengujian konsentrasi terbaik ikan nila ... 42 Diagram alir pengujian tingkat kelangsungan hidup ikan nila dalam kondisi statis dan transportasi ... 5
3 Diagram alir penelitian utama ... 7
4 Diagram batang pengaruh konsentrasi ekstrak daun terhadap waktu pingsan dan waktu bugar ... 9
5 Diagram batang hasil pengujian tingkat kelangsungan hidup (survival rate) ikan nila dalam kondisi statis ... 10
6 Diagram batang pengaruh waktu pemingsanan pada waktu pembugaran... 12
7 Diagram batang pengaruh waktu pemingsanan terhadap survival rate ikan nila ... 13
DAFTAR LAMPIRAN
1 Tabel ANOVA data penelitian ... 232 Uji lanjut tukey data penelitian ... 24
3 Dokumentasi hasil penelitian ... 25
1
1
PENDAHULUAN
Latar Belakang
Ikan nila merupakan salah satu komoditas unggulan dalam bidang perikanan. Hal ini dapat dilihat dari volume produksi yang meningkat setiap tahunnya. KKP (2015a) melaporkan bahwa volume produksi ikan nila mengalami peningkatan pada tahun 2010 hingga 2014. Tahun 2010 sebanyak 464.191 ton dan tahun 2014 mencapai 912.613,29 ton dengan kenaikan rata-rata 19,03% tiap tahunnya. KKP (2015b) juga melaporkan bahwa meningkatnya volume produksi ikan juga berbanding lurus dengan tingkat permintaan pasar dan tingkat konsumsi ikan di Indonesia meningkat selama 5 tahun terakhir. Tingkat konsumsi ikan di Indonesia pada tahun 2009 sebesar 28,00(kg/kap/th) dan tahun 2014 mencapai 38,00(kg/kap/th). Kendala yang dihadapi dalam kegiatan transportasi adalah stres dan kematian ikan sehingga perlu penanganan yang lebih baik agar ikan dapat tetap hidup dan sehat ketika sampai pada konsumen (Ilhami et al. 2015).
Penanganan dalam sistem transportasi menurut Abid et al. (2014) diperlukan untuk menjaga tingkat kelangsungan hidup ikan tetap tinggi sampai tempat tujuan. Stres dan aktivitas fisik selama proses transportasi ikan dapat mengurangi kesegaran ikan, pelunakan tekstur otot dan menurunkan kualitas hasil fillet. Akibat yang dapat ditimbulkan dari stres akan berdampak ekonomis pada hasil produksi budidaya ikan. Sulmartini et al. (2009) menyatakan bahwa transportasi akan membuat ikan menjadi stres dan berakibat pada penurunan kondisi fisiologis bahkan kematian. Terjadinya kematian tidak hanya terjadi saat transportasi akan tetapi juga terjadi pada pasca transportasi, sehingga kehidupan ikan beberapa hari pasca transportasi merupakan masa kritis bagi ikan yang telah diangkut. Kondisi ikan saat transportasi dapat dilihat dari perubahan respon fisiologis tubuh ikan melalui kemampuan daya cerna dan juga respirasi.
Salah satu upaya yang dapat dilakukan untuk mengantisipasi ikan stres adalah dengan menekan aktivitas metabolisme tubuh ikan serta konsumsi oksigen selama transportasi namun tetap mempertimbangkan aspek keamanan dan kesehatan ikan (Aini et al. 2014). Sulmartini et al. (2009) melaporkan bahwa tingginya metabolisme ikan mas mengakibatkan ikan menjadi stres selama transportasi. Metabolisme yang tinggi selama transportasi dapat diminimalkan dengan metode imotilisasi. Imotilisasi merupakan suatu kegiatan untuk menurunkan atau menekan aktivitas metabolisme dan respirasi biota perairan menggunakan suhu rendah dan bahan antimetabolit (Suryaningrum et al. 2005).
Daun sirih dapat dimanfaatkan sebagai bahan anestesi alami dalam teknik imotilisasi ikan dan memiliki komponen bioaktif yang tersusun atas 82,8% senyawa-senyawa fenol, dan hanya 18,2% merupakan senyawa bukan fenol dan secara umum daun sirih mengandung minyak atsiri 1-4,2% yang terdiri dari 7,2–16,7% kavikol, 2,7-6,2% kavibetol, 4,2-15,8% metil eugenol, 2,2-5,6 karvakol, 26,8-42,5% eugenol, dan 2,4-4,8% sineol (Novalny 2006). Eugenol dalam jumlah besar mempunyai sifat sebagai stimulan, anestetik, karminatif, antiemetik, antiseptik, dan antispasmodik (Nurdjannah 2004). Senyawa antibakteri dapat bersifat bakterisidal dan fungisidal (Achmad dan Suryana 2009).
2
Daun sirih juga berfungsi sebagai obat analgetik yang berfungsi menghilangkan rasa sakit dan juga sebagai bahan pada anestesi (Sengupta dan Banik 2013).
Penelitian sebelumnya yang dilakukan oleh Handayani (2014) menyatakan bahwa penggunaan umbi rumput teki dapat meningkatkan tingkat kelangsungan hidup ikan nila dengan konsentrasi 9% dengan rata-rata waktu pingsan yaitu 8,31 menit dan waktu pembugaran yaitu 4,22 menit. Waktu pemingsanan selama 90, 100, dan 110 menit menghasilkan tingkat kelangsungan hidup ikan nila yaitu 100%.
Perumusan Masalah
Proses transportasi ikan nila dengan sistem basah tanpa pemingsanan menghasilkan tingkat kelangsungan hidup yang kurang dari 100%. Bahan anestesi sintetis yang digunakan dapat meninggalkan residu sehingga membahayakan ikan, manusia dan lingkungan. Teknik pemingsanan dengan bahan anestesi alami terutama dengan pemanfaatan daun sirih belum dilakukan.
Tujuan Penelitian
Menentukan konsentrasi larutan ekstrak daun sirih terbaik untuk pemingsanan ikan nila agar mencapai tingkat kelangsungan hidup (survival rate) 100% selama proses transportasi. Tujuan lainnya adalah mengkaji hubungan antara proses transportasi ikan nila dalam keadaan pingsan dengan kadar glukosa darah.
Manfaat Penelitian
Manfaat dari penelitian ini adalah penyediaan referensi mengenai jumlah konsentrasi ekstrak daun sirih yang dapat digunakan dalam pemingsanan. Hal ini bermanfaat untuk mengurangi tingkat kematian ikan dan menghasilkan tingkat kelangsungan hidup ikan 100% dalam transportasi.
Ruang Lingkup Penelitian
Ruang lingkup penelitian adalah persiapan hewan uji, preparasi daun sirih, ekstraksi daun sirih, pengujian efektivitas ekstrak daun sirih terhadap ikan nila sebagai bahan anestesi, analisis kandungan glukosa darah, analisis kualitas air, analisis data dan penulisan laporan.
METODE PENELITIAN
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Juni 2015 sampai Februari 2016. Preparasi daun sirih dan analisis kandungan glukosa darah dan pemingsanan pada ikan nila dilakukan di Hatchery Nila Balai Penelitian Pemuliaan Ikan (BPPI)
3 Sukamandi Kementerian Kelautan dan Perikanan (KKP). Analisis pengujian kualitas air dilakukan di Laboratorium Lingkungan Balai Penelitian Pemuliaan Ikan Sukamandi (BPPI) Kementerian Kelautan dan Perikanan.
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini adalah ikan nila (120-220 gram) dan bahan anestesi yang digunakan yaitu daun sirih hijau. Daun sirih yang digunakan yaitu sirih hijau pada daun ke-3 hingga ke-7 berdiameter 4-7cm. Suliantari et al. (2008) menyatakan bahwa daun sirih hijau atau sirih jawa memiliki daun berwarna hijau tua dan rasa yang tajam yang di ambil dari Dusun Sengon, Desa Sukamandi Jaya, Kecamatan Ciasem, Kabupaten Subang. Bahan lainnya yaitu akuades, es batu, larutan fenol, larutan nitroprusid, larutan oksidan, indikator phenolphthalein (PP), Na2CO3 0,0454 N, dan larutan amoniak.
Alat yang digunakan meliputi bak fiber, styrofoam, aerator, gelas ukur, kain belacu, panci, kompor gas, corong, Water Quality Checker (WQC) (Merk TOA DKK-Japan type: WQC-22A), alat suntik, Gluco-DR AGM-2100, termometer, botol sampel, timbangan, dan spektrofotometer.
Prosedur Penelitian
Penelitian ini terdiri dari dua tahap yaitu tahap penelitian pendahuluan dan tahap penelitian utama. Tahap penelitian pendahuluan meliputi persiapan hewan uji, ekstraksi daun sirih dengan konsentrasi yang berbeda, pengujian konsentrasi terbaik, pengujian kelangsungan hidup dengan suhu 10 °C pada kondisi statis dan transportasi. Penelitian utama meliputi perhitungan waktu pembugaran dan tingkat kelangsungan hidup ikan dengan perlakuan konsentrasi terbaik pada suhu 10 °C. Pengujian glukosa darah dan analisis kualitas air yang meliputi pengujian kadar pH, Diseolved Oxygen (DO), CO2, suhu, dan Total Amoniak Nitrogen (TAN) .
Persiapan Hewan Uji
Ikan nila sebanyak 235 ekor dengan bobot 120-220 gram per ekor dipindahkan dari kolam ke bak penampungan yang ada didalam hatchery. Bak penampungan berukuran 120x120x60 cm3 yang telah diisi air dan diberi aerasi. Ikan tersebut diaklimatisasi terlebih dahulu.
Ekstraksi Daun Sirih dengan Konsentrasi yang Berbeda
Daun sirih yang telah ditimbang, dipreparasi terlebih dahulu. Ekstraksi daun sirih diawali dengan menyiapkan daun sirih yang telah dibersihkan dan dipotong-potong kecil. Ektraksi dilakukan dengan menggunakan pelarut air. Pembuatan konsentrasi ekstrak daun sirih yang mengacu pada Birdi et al. (2010) dengan konsentrasi 1,25%, 1,75%, dan 2,25%. Pembuatan larutan stok ekstrak daun sirih ekstrak daun sirih dilakukan pencampuran 4200 mL akuades 262,5 gram daun sirih dan perebusan dilakukan hingga mencapai 1050 mL. Pembuatan konsentrasi 1,25% yaitu dilakukan dengan melakukan pencampuran 250 mL larutan stok dengan ke dalam air 5 liter. Pembuatan ekstrak daun sirih 1,75% yaitu dilakukan pencampuran 350 mL larutan stok kedalam 5 liter air. Konsentrasi 2,25% yaitu
4
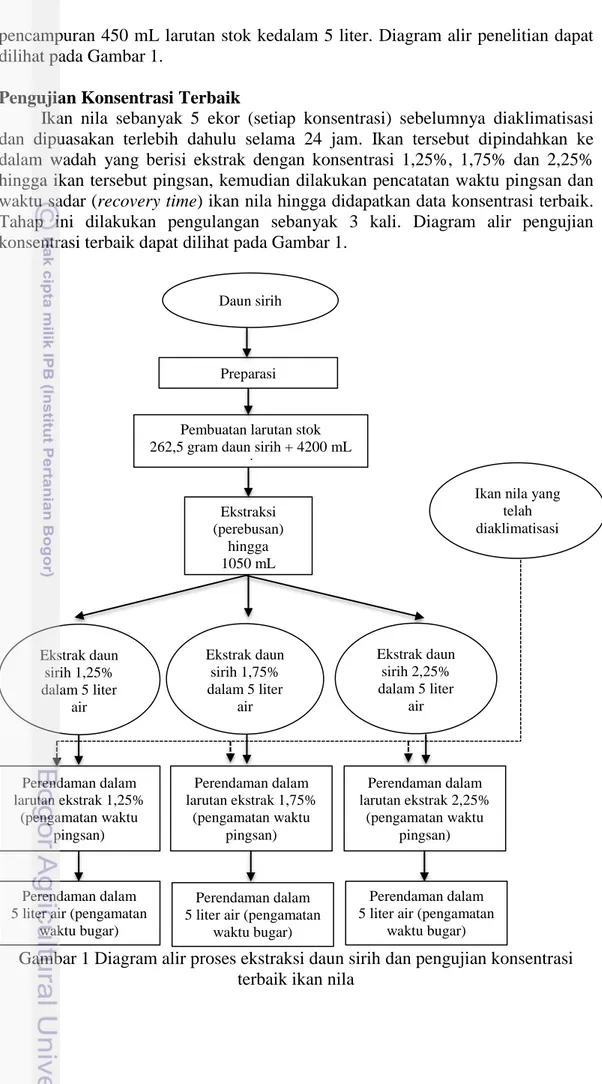
pencampuran 450 mL larutan stok kedalam 5 liter. Diagram alir penelitian dapat dilihat pada Gambar 1.
Pengujian Konsentrasi Terbaik
Ikan nila sebanyak 5 ekor (setiap konsentrasi) sebelumnya diaklimatisasi dan dipuasakan terlebih dahulu selama 24 jam. Ikan tersebut dipindahkan ke dalam wadah yang berisi ekstrak dengan konsentrasi 1,25%, 1,75% dan 2,25% hingga ikan tersebut pingsan, kemudian dilakukan pencatatan waktu pingsan dan waktu sadar (recovery time) ikan nila hingga didapatkan data konsentrasi terbaik. Tahap ini dilakukan pengulangan sebanyak 3 kali. Diagram alir pengujian konsentrasi terbaik dapat dilihat pada Gambar 1.
Gambar 1 Diagram alir proses ekstraksi daun sirih dan pengujian konsentrasi terbaik ikan nila
Ekstrak daun sirih 1,75% dalam 5 liter air Ekstrak daun sirih 2,25% dalam 5 liter air Perendaman dalam larutan ekstrak 1,25% (pengamatan waktu pingsan) Perendaman dalam larutan ekstrak 1,75% (pengamatan waktu pingsan) Perendaman dalam larutan ekstrak 2,25% (pengamatan waktu pingsan) Perendaman dalam 5 liter air (pengamatan
waktu bugar)
Perendaman dalam 5 liter air (pengamatan
waktu bugar)
Perendaman dalam 5 liter air (pengamatan
waktu bugar)
Ikan nila yang telah diaklimatisasi Ekstraksi (perebusan) hingga 1050 mL Daun sirih Preparasi
Pembuatan larutan stok 262,5 gram daun sirih + 4200 mL
air
Ekstrak daun sirih 1,25% dalam 5 liter
5
Pengujian Tingkat Kelangsungan Hidup Ikan dalam Kondisi Statis
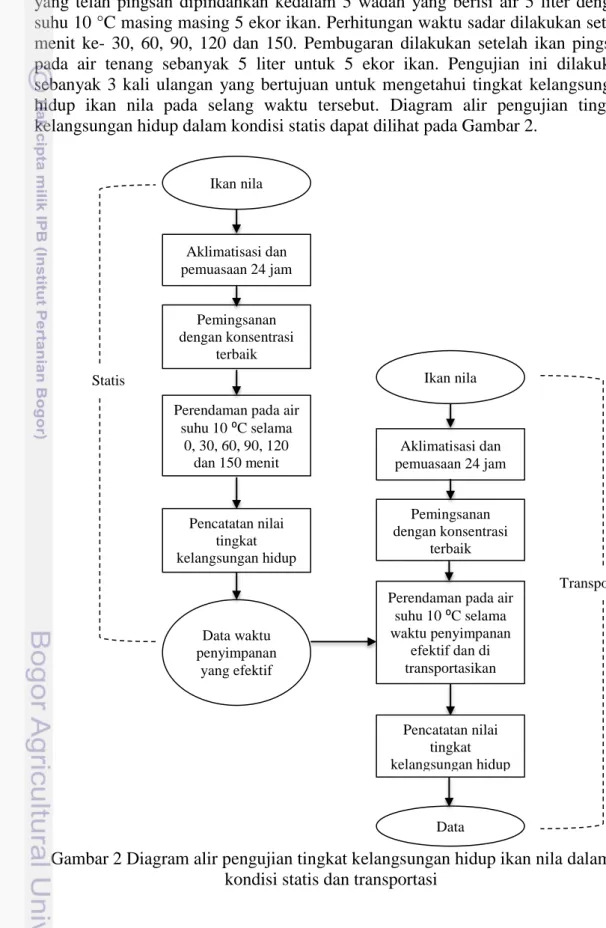
Pengujian tingkat kelangsungan hidup ikan nila dilakukan menggunakan konsentrasi terbaik yaitu konsentrasi yang memiliki waktu pemingsanan tercepat. Ikan nila sebanyak 25 ekor diaklimatisasi terlebih dahulu dan dipuasakan selama 24 jam. Ikan nila dilakukan pemingsanan pada ekstrak sebanyak 25 liter. Ikan yang telah pingsan dipindahkan kedalam 5 wadah yang berisi air 5 liter dengan suhu 10 °C masing masing 5 ekor ikan. Perhitungan waktu sadar dilakukan setiap menit ke- 30, 60, 90, 120 dan 150. Pembugaran dilakukan setelah ikan pingsan pada air tenang sebanyak 5 liter untuk 5 ekor ikan. Pengujian ini dilakukan sebanyak 3 kali ulangan yang bertujuan untuk mengetahui tingkat kelangsungan hidup ikan nila pada selang waktu tersebut. Diagram alir pengujian tingkat kelangsungan hidup dalam kondisi statis dapat dilihat pada Gambar 2.
Gambar 2 Diagram alir pengujian tingkat kelangsungan hidup ikan nila dalam kondisi statis dan transportasi
Ikan nila Aklimatisasi dan pemuasaan 24 jam Pemingsanan dengan konsentrasi terbaik
Perendaman pada air suhu 10 ⁰C selama 0, 30, 60, 90, 120 dan 150 menit Pencatatan nilai tingkat kelangsungan hidup ikan nila Data waktu penyimpanan yang efektif Ikan nila Aklimatisasi dan pemuasaan 24 jam Pemingsanan dengan konsentrasi terbaik
Perendaman pada air suhu 10 ⁰C selama waktu penyimpanan efektif dan di transportasikan Pencatatan nilai tingkat kelangsungan hidup ikan nila Data Transportasi Statis
6
Pengujian Tingkat Kelangsungan Hidup Ikan dalam Kondisi Transportasi
Transportasi dilakukan menggunakan kendaraan motor jenis roda tiga yang dilengkapi bak dibagian belakang dengan estimasi jalan yang bergelombang. Transportasi digunakan sistem basah dengan air 2 liter dan suhu 10 °C. Wadah pengemas transportasi yang digunakan adalah styrofoam dengan ukuran 32x24x28 cm. Jumlah ikan per wadah 5 ekor ikan nila. Ikan sebelum ditransportasikan diaklimatisasi terlebih dahulu dan dipuasakan selama 24 jam, kemudian dipingsankan menggunakan ekstrak daun sirih konsentrasi terbaik. Pembugaran dilakukan pada menit 90 dan 120. Pengujian ini dilakukan sebanyak 3 kali ulangan bertujuan untuk mengetahui tingkat kelangsungan hidup ikan nila pada waktu tersebut. Diagram alir pengujian tingkat kelangsungan hidup ikan dalam kondisi transportasi dapat dilihat pada Gambar 2.
Pengujian Tingkat Kelangsungan Hidup dan Waktu Pembugaran Ikan Setelah Transportasi
Penelitian utama dilakukan untuk menguji tingkat kelangsungan hidup ikan nila terbaik dari penelitian pendahuluan dan analisis waktu pembugaran setelah ditransportasikan. Ikan nila sebanyak 30 ekor diaklimatisasi terlebih dahulu, kemudian ikan dipuasakan selama 24 jam. Penimbangan dan pengujian glukosa darah dilakukan kepada setiap ikan sebelum proses pemingsanan. Pengisian air pada styrofoam ukuran 32x24x28 cm sebanyak 2 liter dengan suhu 10 °C. Pengujian kualitas air dilakukan sebelum proses transportasi. Ikan kemudian dipingsankan dengan ekstrak daun sirih menggunakan konsentrasi terbaik pada saat penelitian pendahuluan. Ikan yang telah pingsan dipindahkan ke wadah styrofoam dengan ukuran 32x24x28 cm yang telah diisi air 2 liter dengan suhu 10 °C masing masing 5 ekor per wadah baik yang telah dipingsankan dengan ekstrak daun sirih maupun kontrol. Ikan ditransportasikan selama 90 dan 120 menit dengan wadah berbeda yang bertujuan untuk membedakan pengujian kualitas air. Ikan dibugarkan sesuai waktu yang telah ditentukan. Ikan yang telah dibugarkan dilakukan pengujian glukosa darah dan pengujian kualitas air pada air yang telah digunakan untuk transportasi. Pengujian ini dilakukan sebanyak 3 kali ulangan. Diagram alir penelitian dapat dilihat pada Gambar 3.
Analisis Kualitas Air
Analisis kualitas air dilakukan pada air hatchery yang bersumber dari tanah. Kulitas air diukur sebelum dan setelah proses transportasi ikan. Analisis kualitas air tersebut meliputi suhu, kadar oksigen terlarut atau Dissolved Oksigen (DO), pH, TAN dan CO2.
Pengukuran pH, Suhu dan Kadar Oksigen Terlarut (DO)
Pengukuran pH, suhu, dan DO menggunakan Water Quality Checker (WQC) (Merk TOA DKK-Japan type: WQC-22A). WQC merupakan alat yang yang digunakan untuk mengukur pH, DO, suhu, konduktivitas dan turbiditas (Wijana 2010).
Pengukuran Total Amoniak Nitrogen (TAN) (SNI 06-6989.30-2005)
Sampel diukur sebanyak 25 mL dan dimasukkan ke dalam tabung reaksi. Larutan fenol 10% sebanyak 1 mL ditambahkan ke dalam sampel. Larutan
7 nitroprusid 0,5% sebanyak 1 mL dan larutan oksidan 25% sebanyak 2,5 mL ditambahkan ke dalam sampel. Tabung reaksi dikocok dan dibiarkan selama 1 jam. Sampel dimasukkan ke dalam kuvet dan dimasukkan ke dalam spektrofotometer dengan panjang gelombang 640 nm, serapannya dibaca dan dicatat. Larutan standar dibuat dengan menggunakan amoniak dengan konsentrasi 0,1, 0,2, 0,3, dan 0,5 sebanyak 25 mL dimasukkan ke dalam erlemeyer. Larutan fenol 10% sebanyak 1 mL ditambahkan kedalam larutan standar. Larutan nitroprusid 0,5% sebanyak 1 mL dan larutan oksidan 25% sebanyak 2,5 mL ditambahkan ke dalam larutan standar. Larutan standar disimpan di ruang gelap dengan suhu 22-27 ⁰C. Larutan standar dimasukkan ke dalam kuvet lalu dimasukkan ke dalam spektrofotometer dan dicatat nilai absorbansinya dengan panjang gelombang 640 nm (BSN 2005).
Gambar 3 Diagram alir penelitian utama Penghitungan waktu pembugaran ikan
Aklimatisasi Ikan Nila
Pemuasaan 1x24 jam
Pengujian glukosa darah dan kualitas
air (DO, TAN, pH dan CO2) sebelum
transportasi
Transportasi selama 90 dan 120 menit
Pengukuran glukosa darah dan kualitas air (DO, TAN, pH dan CO2)
setelah transportasi
Data
Pemingsanan dengan konsentrasi terbaik
Penyimpanan dalam boks styrofoam dengan suhu 10 ⁰C
8
Pengukuran CO2 (Boyd 1982)
Air uji sebanyak 25 mL dipipet dan dimasukkan ke dalam erlenmeyer. Indikator fenolftalein sebanyak 2-3 tetes ditambahkan ke dalam masing-masing erlenmeyer. Air sampel dititrasi dengan Na2CO3 0,0454 N hingga terjadi
perubahan warna menjadi merah muda. Volume titran yang digunakan kemudian dicatat. Prinsip pengujian CO2 ion hidroksil yang berada di dalam sampel
merupakan hasil dari disosiasi atau hidrolisis zat terlarut yang bereaksi dengan penambahan asam standar. Jumlah alkalinitas tergantung pada pH titik akhir yang digunakan. Alkalinitas pada pengujian CO2 merupakan jenis karbonat atau
bikarbonat yaitu Na2CO3, pH pada titik ekivalen titrasi ditentukan oleh
konsentrasi karbon dioksida (CO2). Fenolftalein digunakan untuk titik ekivalen
titrasi pada pH 8,3 (Eaton et al. 1995).
Analisis Glukosa Darah
Pengukuran glukosa darah ikan dilakukan dengan cara mengambil darah ikan dengan mengunakan syiringe. Pemasangan strip glukosa darah dilakukan pada alat pengecekan glukosa darah Gluco-DR AGM 2100. Darah ikan yang berada di dalam pada syiringe dimasukan ke dalam celah strip Gluco-DR AGM 2100. Hasil dapat dilihat pada layar Gluco-DR AGM 2100 setelah 9 detik.
Analisis Data
Analisis yang digunakan untuk mendapatkan kesimpulan dari percobaan yang dilakukan adalah Rancangan Acak Lengkap (RAL). Analisis data yang dilakukan yaitu untuk mengetahui pengaruh beberapa konsentrasi ekstrak terhadap waktu pingsan dan waktu sadar ikan nila.
Yij = µ + τij+ εij
Keterangan :
Yij =nilai pengamatan pada taraf ke-i dan ulangan ke-j
µ = nilai tengah atau rataan umum pengamatan τij = pengaruh perlakuan pada taraf ke-i
εij = galat atau sisa pengamatan taraf ke-i dengan ulangan ke-j
Data yang diperoleh diolah menggunakan microsoft excel 2010 dan dilakukan pengujian dengan uji ANOVA dengan SPSS 15.0 for windows dengan analisis post hoc. Apabila hasil perhitungan menunjukkan pengaruh yang nyata maka akan di uji lanjut dengan uji lanjut Tukey.
HASIL DAN PEMBAHASAN
Penelitian Pendahuluan
Konsentrasi Terbaik Ekstrak Daun Sirih sebagai Bahan Anestesi
Konsentrasi ekstrak daun sirih yang digunakan yaitu 1,25%, 1,75% dan 2,25%.. Ekstrak daun sirih dilarutkan dalam 5 liter air dengan jumlah ikan
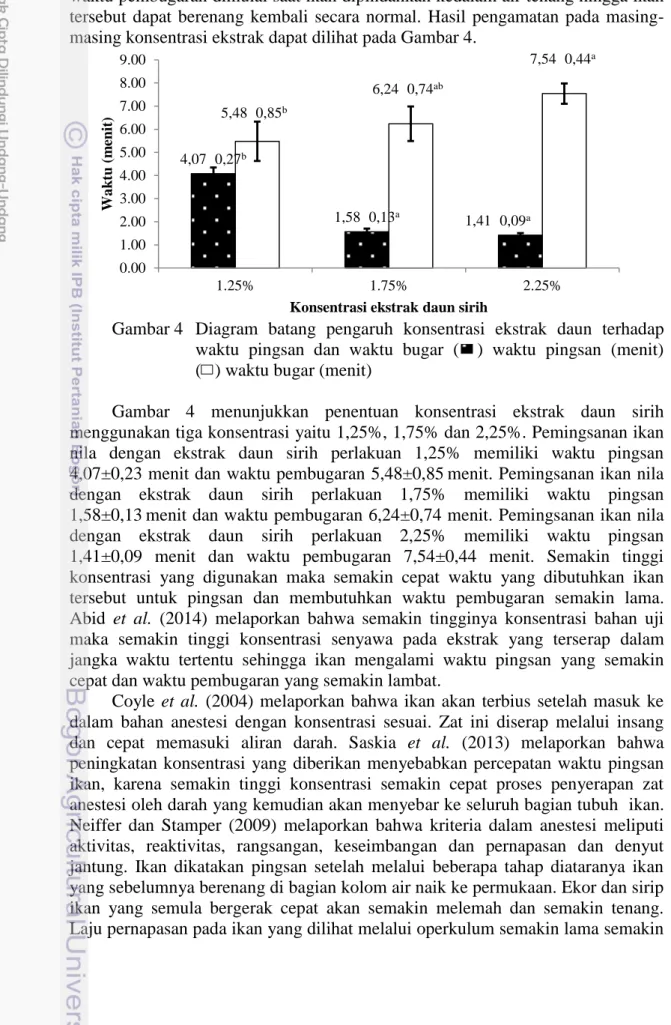
9 sebanyak 5 ekor ikan. Penghitungan waktu pemingsanan ikan saat ikan dipindahkan kedalam larutan ekstrak hingga ikan tersebut pingsan. Perhitungan waktu pembugaran dimulai saat ikan dipindahkan kedalam air tenang hingga ikan tersebut dapat berenang kembali secara normal. Hasil pengamatan pada masing-masing konsentrasi ekstrak dapat dilihat pada Gambar 4.
Gambar 4 Diagram batang pengaruh konsentrasi ekstrak daun terhadap waktu pingsan dan waktu bugar ( ) waktu pingsan (menit) ( ) waktu bugar (menit)
Gambar 4 menunjukkan penentuan konsentrasi ekstrak daun sirih menggunakan tiga konsentrasi yaitu 1,25%, 1,75% dan 2,25%. Pemingsanan ikan nila dengan ekstrak daun sirih perlakuan 1,25% memiliki waktu pingsan 4,07±0,23 menit dan waktu pembugaran 5,48±0,85menit. Pemingsanan ikan nila dengan ekstrak daun sirih perlakuan 1,75% memiliki waktu pingsan 1,58±0,13menit dan waktu pembugaran 6,24±0,74 menit. Pemingsanan ikan nila dengan ekstrak daun sirih perlakuan 2,25% memiliki waktu pingsan 1,41±0,09 menit dan waktu pembugaran 7,54±0,44 menit. Semakin tinggi konsentrasi yang digunakan maka semakin cepat waktu yang dibutuhkan ikan tersebut untuk pingsan dan membutuhkan waktu pembugaran semakin lama. Abid et al. (2014) melaporkan bahwa semakin tingginya konsentrasi bahan uji maka semakin tinggi konsentrasi senyawa pada ekstrak yang terserap dalam jangka waktu tertentu sehingga ikan mengalami waktu pingsan yang semakin cepat dan waktu pembugaran yang semakin lambat.
Coyle et al. (2004) melaporkan bahwa ikan akan terbius setelah masuk ke dalam bahan anestesi dengan konsentrasi sesuai. Zat ini diserap melalui insang dan cepat memasuki aliran darah. Saskia et al. (2013) melaporkan bahwa peningkatan konsentrasi yang diberikan menyebabkan percepatan waktu pingsan ikan, karena semakin tinggi konsentrasi semakin cepat proses penyerapan zat anestesi oleh darah yang kemudian akan menyebar ke seluruh bagian tubuh ikan. Neiffer dan Stamper (2009) melaporkan bahwa kriteria dalam anestesi meliputi aktivitas, reaktivitas, rangsangan, keseimbangan dan pernapasan dan denyut jantung. Ikan dikatakan pingsan setelah melalui beberapa tahap diataranya ikan yang sebelumnya berenang di bagian kolom air naik ke permukaan. Ekor dan sirip ikan yang semula bergerak cepat akan semakin melemah dan semakin tenang. Laju pernapasan pada ikan yang dilihat melalui operkulum semakin lama semakin
4,07 0,27b 1,58 0,13a 1,41 0,09a 5,48 0,85b 6,24 0,74ab 7,54 0,44a 0.00 1.00 2.00 3.00 4.00 5.00 6.00 7.00 8.00 9.00 1.25% 1.75% 2.25% Wa k tu (m enit )
10
melemah dan selanjutnya ditandai oleh hilangnya keseimbangan ikan tersebut namun terdapat beberapa spesies panik ketika berada didalam larutan anestesi sebelum pingsan. Hal ini tergantung pada spesies, bahan anestesi dan konsentrasi yang digunakan.
Neiffer dan Stamper (2009) melaporkan bahwa pembugaran terjadi dengan mekanisme yang berbeda-beda. Ikan dipindahkan dari air yang mengandung bahan anestesi ke air yang tidak mengandung bahan anestesi. Bahan anestesi yang ada di dalam tubuh ikan akan dikeluarkan di air pembugaran. Air akan keluar masuk melalui mulut ikan. Mulut ikan berfungsi sebagai sistem ventilasi. Air akan terus dikeluar masukkan hingga seluruh bahan anestesi yang terdapat dalam tubuh ikan tersebut dapat dikeluarkan melalui operkulum dan mulut. Ikan yang telah bugar memiliki ciri-ciri sebagai berikut; meningkatnya tingkat respirasi, otot kembali bergerak seperti semula, gerakan sirip yang normal, ikan berenang secara normal dan memiliki tingkat keseimbangan penuh.
Konsentrasi ekstrak daun sirih terbaik yang digunakan sebagai bahan anestesi yaitu 1,75%. Ekstrak daun sirih dengan perlakuan 1,75% dapat memingsankan ikan dalam waktu 1,57 menit dengan tingkat kelangsungan hidup 100%, sedangkan ekstrak daun sirih dengan perlakuan 2,25% dapat memingsankan ikan dalam waktu 1,41 menit. Hal ini tidak memiliki perbedaan yang signifikan dengan perlakuan 1,75% dan pada perlakuan 2,25% terdapat tiga ikan yang mati beberapa menit setelah pembugaran seadangkan 1,75% tidak ada ikan yang mati. Aini et al. 2014 menyatakan bahwa waktu pingsan yang ideal yaitu kurang dari 3 menit. Neiffer dan Stamper (2009) menyatakan bahwa pembugaran ikan dari bahan anestesi rata-rata dalam waktu 5 menit. Pembugaran lebih dari 10 menit menunjukkan dosis anestesi yang berlebihan. Waktu pembugaran ikan nila dengan kosentrasi 1,25%, 1,75% dan 2,25% kurang dari 10 menit.
Tingkat Kelangsungan Hidup Ikan Nila
Pengujian tingkat kelangsungan hidup ikan nila dilakukan dengan memberikan bahan anestesi yaitu ekstrak daun sirih dengan perlakuan 1,75%. Hal ini dikarenakan perlakuan tersebut memiliki waktu pingsan tercepat dan tingkat kelangsungan hidup yang tinggi. Pengujian tingkat kelangsungan hidup dilakukan dengan cara menyimpan ikan nila di wadah styrofoam dengan suhu 10 °C.
Pratisari (2010) melaporkan bahwa suhu pembiusan ikan nila yaitu 9-10 °C menghasilkan tingkat kelangsungan hidup yang lebih tinggi dibandingkan dengan ikan nila yang dibius dengan suhu 7-9 °C dan 6-7 °C. Tingkat kelangsungan hidup ikan nila dari hasil peneitian ditunjukkan pada Gambar 5.
Gambar 5 Diagram batang hasil pengujian tingkat kelangsungan hidup (survival rate) ikan nila dalam kondisi statis
100 100 100 100 100 80 0 20 40 60 80 100 120 ke 0 ke 30 ke 60 ke 90 ke 120 ke 150 Su rv iv a l r a te ( %)
11 Hasil penelitian menunjukkan bahwa semakin meningkatnya waktu pemingsanan maka tingkat kelangsungan hidup ikan nila semakin menurun. Sumahiradewi (2014) melaporkan bahwa ikan nila yang sudah terlebih dahulu dalam keadaan pingsan sepenuhnya sebelum dilakukan pengangkutan memiliki tingkat kelangsungan hidup yang lebih tinggi. Kondisi ikan pingsan ini dapat mengurangi kondisi stres sebelum pengangkutan sehingga mempengaruhi kondisi selama proses transportasi berlangsung.
Kelangsungan hidup ikan dengan ekstrak daun sirih perlakuan 1,75% sebagai bahan anestesi dapat menekan metabolisme ikan nila. Yanto (2012) menyatakan bahwa metabolisme yang rendah tersebut menyebabkan konsumsi oksigen menurun dan laju pengeluaran hasil ekskresi dan metabolisme juga berkurang. Kondisi demikian sangat menguntungkan bagi ikan untuk dapat bertahan hidup selama transportasi pada akhirnya dapat membantu peningkatan kepadatan ikan selama transportasi. Turunnya tingkat metabolisme ikan pada suhu rendah juga akan menghasilkan kebutuhan energi untuk aktivitas juga rendah. Hal ini berarti bahwa perombakan adenosin triphosphat (ATP) menjadi adenosin diphosphat (ADP), adenosin monophosphat (AMP), dan inosin monophosphat untuk menghasilkan energi sangat rendah, sehingga oksigen yang digunakan untuk merombak ATP untuk menghasilkan energi juga sangat rendah. Kadar oksigen dalam darah ikan pada akhirnya tidak turun secara drastis, sehingga ikan mampu hidup lebih lama selama proses transportasi (Karnila dan Edison 2001).
Berbeda halnya pada menit ke 150 yang memiliki tingkat kelangsungan hidup sebesar 80%. Handayani (2014) menyatakan tingkat kelangsungan hidup ikan nila menurun signifikan pada menit ke 120 dan menit 150. Hal ini disebabkan oleh tubuh ikan yang sudah tidak dapat mentolerir saat dibiarkan terlalu lama dalam air dingin. Kematian pada ikan nila tersebut dapat disebabkan oleh beberapa stres, antara lain daya tubuh ikan, kondisi ikan sebelum dipingsankan, keadaan stres menjelang pingsan, dan suhu media, dan lamanya penyimpanan di dalam media air dingin. Menurut Suwandi et al. (2012) kematian ikan disebabkan oleh konsentrasi bahan yang digunakan yang mengakibatkan meningkatnya turbiditas, sehingga ikan menjadi stres dan sulit beradaptasi. Kondisi stres dalam waktu tertentu dapat menyebabkan kematian. Hal tersebut disebabkan oleh ikan yang sudah tidak dapat lagi mempertahankan keadaan homeostasisnya
Penelitian Utama
Penelitian utama dilakukan dengan cara mempersempit waktu pingsan dari penelitian pendahuluan. Ikan yang telah dipingsankan dengan ekstrak daun sirih perlakuan 1,75% disimpan dalam air dengan suhu 10 °C dan ditransportasikan dalam waktu tertentu. Waktu yang digunakan yaitu 90 menit dan 120 menit dengan 3 kali ulangan. Ikan yang telah ditransportasikam tersebut kemudian dibugarkan kembali dengan air yang sebelumnya telah diberi airasi. Analisis yang digunakan dalam tahap ini yaitu waktu pembugaran, glukosa darah dan kualitas air. Hasil pembugaran ikan nila dapat dilihat pada Gambar 6.
12
Gambar 6 Diagram batang pengaruh waktu pemingsanan pada waktu pembugaran ( ) ekstrak daun sirih perlakuan 1,75% ( ) Kontrol Gambar 6 menunjukkan waktu hasil pembugaran ikan nila setelah proses transportasi selama 90 dan 120 menit. Waktu pembugaran ikan nila yang dipingsankan menggunakan ekstrak daun sirih dengan perlakuan 1,75% membutuhkan waktu 6,40 menit pada waktu pemingsanan 90 menit dan 7,64 menit pada waktu pemingsanan 120 menit. Kontrol (tanpa pemberian ekstrak daun sirih) memiliki waktu pembugaran 20,56 menit untuk waktu pemingsanan 90 menit dan 34,44 menit untuk waktu pemingsanan 120 menit. Waktu yang dibutuhkan untuk pembugaran pada kontrol lebih lama dibandingkan ikan yang dipingsankan terlebih dahulu dengan ekstrak daun sirih perlakuan 1,25%.
Harmon (2009) menyatakan bahwa perubahan suhu secara mendadak dapat berperan sebagai stressor (penyebab stres) pada ikan, sehingga ikan mengalami kehilangan ion dan mengalami kerusakan sistem syaraf yang lebih banyak. Hal tersebut diduga menjadi penyebab lamanya waktu pembugaran yang dibutuhkan ikan pada kontrol.
Berbeda halnya dengan kontrol, hasil penelitian menunjukkan ikan yang dipingsankan terlebih dahulu dengan ekstrak daun sirih perlakuan 1,75% memiliki waktu pembugaran lebih cepat. Hal ini karena ikan yang dipingsankan terlebih dahulu tidak mengalami respon stres saat disimpan dalam air dengan suhu 10 °C. Harmon (2009) menyatakan anestesi yang digunakan sebelum dan selama proses transportasi dapat menurunkan metabolisme ikan dan mengurangi respon stres yang diakibatkan oleh peningkatan aktivitas.
Hasil penelitian juga menunjukkkan bahwa semakin lama waktu pemingsanan maka waktu pembugaran juga semakin lama. Semakin lama pemingsanan akan menyebabkan ikan lebih lama beradaptasi dalam proses penyadaran. Lamanya proses penyadaran disebabkan karena kekurangan oksigen dalam waktu yang lama, sehingga akan menyebabkan tubuh ikan menjadi lemas sehingga untuk memulihkan kembali membutuhkan waktu yang lebih lama (Junianto 2003).
Penggunaan suhu 10 °C dan waktu pingsan selama 90 menit dan 120 menit bertujuan untuk membuat ikan tenang dengan aktivitas metabolisme dan konsumsi oksigen yang rendah. Pratisari (2010) melaporkan bahwa suhu merupakan salah satu faktor yang mempengaruhi tingkat keberhasilan dalam transportasi ikan hidup. Tingkat kelangsungan hidup (survival rate) ikan nila disajikan pada Gambar 7.
6,40±0,90a 7,64±0,41a 20,56±0,53a 34,44±0,58b 0.00 5.00 10.00 15.00 20.00 25.00 30.00 35.00 40.00 90 menit 120 menit w a k tu pem bu g a ra n (m enit ) Perlakuan
13
Gambar 7 Diagram batang pengaruh waktu pemingsanan terhadap survival rate ikan nila ( ) perlakuan ekstrak sirih 1,75% ( ) kontrol Gambar 7 menunjukkan bahwa ikan nila pada menit ke 90 menghasilkan tingkat kelangsungan hidup 100% baik ikan yang dipingsankan terlebih dahulu dengan menggunakan daun sirih maupun kontrol yang hanya menggunakan es. Tingkat kelangsungan hidup ikan nila pada menit 120 yang dipingsankan terlebih dahulu dengan ekstrak daun sirih sebesar 100%, namun pada kontrol mengalami penurunan yaitu sebesar 60%. Hal ini diduga disebabkan oleh meningkatnya tingkat stres pada ikan seiring dengan bertambahnya waktu pemingsanan. Harmon (2009) menyatakan bahwa kondisi stres pada ikan dapat mengakibatkan kematian melalui kehilangan ion dan menyebabkan fungsi kekebalan tubuh terancam. Ikan air tawar bersifat hipertonik, karena itu kondisi stres dapat menyebabkan kehilangan ion darah pada ikan, sehingga ikan mengalami gangguan homeostasis.
Analisis Glukosa Darah Ikan Nila
Glukosa darah merupakan salah satu indikator untuk mengetahui tingkat stres pada ikan. Darwisto (2006) menyatakan bahwa stres menyebabkan peningkatan kortisol plasma, dimana tingkat kortisol yang tinggi mempengaruhi limfosit dan sistem kekebalan seluler serta menghasilkan hambatan pada sistem kekebalan. Stres menyebabkan peningkatan kortisol (glukokortikoid), dengan demikian stres dapat meningkatkan glukosa darah. Hasil analisis glukosa darah dapat dilihat pada Tabel 1.
Tabel 1 Hasil analisis glukosa darah
Sumber : *Bittencourt et al. (2003)
Nilai glukosa darah pada ikan nila sebelum dan sesudah proses pemingsanan mengalami kenaikan baik kontrol maupun pada perlakuan anestesi
100 100 100 60 0 20 40 60 80 100 120 90 120 Su rviva l ra te ( % )
Waktu pemingsanan (menit)
Nilai Glukosa Darah (mg/dL) Waktu
Pingsan
Kontrol Perlakuan Anestesi Rata-rata
Normal
Sebelum Sesudah Selisih Sebelum Sesudah Selisih
90 menit 91,60 186,75 +95,2 112,80 167,36 +54,6
22,7-107*
14
dengan menggunakan daun sirih perlakuan 1,25%. Sulmartiwi et al. (2013) menyatakan bahwa rendahnya nilai glukosa darah ikan sebelum ditransportasikan atau dipingsankan antara lain disebabkan oleh dilakukan pemberokan ikan yang akan ditransportasikan. Hal ini bertujuan untuk mengosongkan makanan yang ada di dalam lambung dan usus ikan sehingga selama pengangkutan aktivitas metabolisme ikan akan tetap rendah. Kenaikan nilai glukosa darah pada kontrol lebih tinggi dibandingkan pada perlakuan anestesi. Porchas et al. (2009) menyatakan bahwa anestesi dapat mengurangi tingkat stres dan mengurangi tingkat kenaikan glukosa darah. Suatu organisme ketika mengalami kondisi stres, sel-sel kromafin meningkat melepas katekolamin, adrenalin dan non adrenalin sehingga meningkatkan aktivasi kortisol dan produksi glukosa darah melalui jalur glikogenolisis dan glukoneogenesis di dalam tubuh ikan. Seluruh proses ini meningkatkan glukosa darah untuk menghasilkan energi yang cukup sesuai dengan permintaan Tingkat stres ikan dan kenaikan glukosa darah juga dapat dipengaruhi oleh lingkungan yaitu faktor suhu. Hastuti et al. (2003) menyatakan bahwa perubahan suhu dingin secara mendadak dapat menghasilkan peningkatan kadar glukosa darah. Perubahan suhu lingkungan akan berpengaruh langsung terhadap proses metabolisme pada ikan. Semakin besar perubahan suhu yang terjadi maka kadar glukosa darah semakin tinggi. Semakin tinggi perubahan glukosa darah maka level stres pada ikan semakin meningkat.
Analisis Kualitas Air
Kondisi stres dari lingkungan mencakup kondisi kimia air. Polutan umumnya yang menjadi penyebab stres pada lingkungan. Perubahan kualitas parameter air seperti dissolved oxygen (DO), amonia, pH, kesadahan, tekanan parsial, dan suhu dapat menyebabkan meningkatnya stres pada ikan (Iwama et al. 2004). Analisis kualitas air dilakukan sebelum dan sesudah ikan dipingsankan dan ditransportasikan. Hasil analisis kualitas air dapat dilihat pada Tabel 2.
Tabel 2 Hasil analisis kualitas air
Parameter Sebelum 90 Menit 120 Menit Standar
Kontrol Perlakuan Kontrol Perlakuan
pH 7,01±0,10 6,44±0,02 6,48±0,12 5,87±0,04 6,08±0,03 4,2-7,4*
DO (ppm) 5,46±0,15 5,0±0,10 5,26±0,05 1,93±0,05 2,43±0,05 1,4-6,6*
CO2 (ppm) 3,99±0,00 15,89±0,00 9,98±0,00 21,97±0,00 15,89±0,00 0-10*
TAN (ppm) 0,04±0,00 1,50±0,25 1,43±0,05 2,52±0,03 2,32±0,03 0-65*
Sumber: *Colt (2014)
Tabel 2 merupakan hasil analisis kualitas air yang dilakukan sebelum proses pemingsanan dan setelah proses pemingsanan dan transportasi. Parameter yang diukur yaitu DO, pH, CO2 dan TAN. Hasil penelitian menunjukan bahwa nilai
DO atau oksigen terlarut pada perlakuan anestesi lebih tinggi dibanding kontrol baik perlakuan 90 menit maupun 120 menit. Hal ini diduga karena ikan dipingsankan terlebih dahulu saat disimpan dalam air suhu 10 °C sehingga konsumsi oksigen menurun. Yanto (2012) menyatakan bahwa dengan menurunnya metabolisme ikan, maka laju konsumsi oksigen menurun dan laju pengeluaran eksresi juga menjadi berkurang. Kondisi ini sangat menguntungkan
15 bagi ikan untuk dapat bertahan hidup selama pengangkutan dan peningkatan kepadatannya.
Hasil penelitian juga menunjukkan bahwa semakin lama waktu pemingsanan maka nilai DO semakin rendah. Sagita et al. (2008) menyatakan bahwa kandungan oksigen terlarut dalam air akan menurun sejalan dengan lamanya transportasi dan adanya konsumsi oksigen oleh ikan. Yanto (2008) juga menyatakan bahwa oksigen terlarut mengalami penurunan setelah pengangkutan dibandingkan sebelum pengangkutan. Penurunan oksigen terlarut tersebut adalah sebagai akibat penggunaannya oleh ikan selama transportasi. Riyadi (2006) menyatakan bahwa ketersediaan oksigen di perairan sangat diperlukan untuk aktivitas ikan. Nilai ambang batas (NAB) kadar oksigen terlarut untuk perikanan budidaya 4 ppm, namun kandungan oksigen sebesar 2 ppm sudah cukup untuk mendukung jika perairan tidak toksik atau tercemar.
Hasil penelitian menunjukkan bahwa nilai CO2 pada kontrol lebih tinggi
dibandingkan perlakuan dan semakin lama waktu pemingsanan nilai CO2 semakin
meningkat. Yanto (2012) menyatakan bahwa laju produksi CO2 berkurang pada
ikan yang pingsan selama transportasi, tetapi ikan yang pingsannya tidak sempurna pembuangan sisa ekskresi berupa CO2 akan meningkat lebih banyak
dibandingkan yang pingsan sempurna. Yanto (2008) juga menjelaskan bahwa metabolisme ikan yang tinggi menyebabkan penggunaan atau pemecahan energi dalam tubuh juga tinggi, sehingga ekskresi CO2 juga menjadi tinggi.
Suwandi et al. (2011) menyatakan bahwa peningkatan nilai CO2 yang semakin
tinggi disebabkan oleh pengeluaran hasil dari respirasi ikan. Penurunan nilai karbondioksida mempunyai pengaruh langsung terhadap nilai DO media air. Jika konsumsi DO meningkat maka akan meningkatkan nilai karbondioksida. Hasil juga menunjukan bahwa peningkatan CO2 lebih tinggi dibanding penurunan DO.
Molleda (2007) menyatakan bahwa rasio produksi CO2 ketika oksigen dikonsumsi
yaitu 1,0 mg/L per menit oksigen yang dikonsumsi oleh ikan dapat menghasilkan 1,3 mg CO2.
Nilai Total Amoniak Nitrogen (TAN) pada hasil penelitian menunjukan semakin lama waktu pemingsanan maka semakin naik dan nilai TAN pada kontrol lebih tinggi dibanding perlakuan. Suwandi et al. (2012) menyatakan bahwa kenaikan nilai TAN mengindikasikan bahwa terjadi akumulasi buangan yang dihasilkan ikan. Suwandi et al. (2011) menjelaskan bahwa nilai konsentrasi total amoniak nitrogen rata-rata meningkat seiring bertambahnya waktu. Tinggi rendahnya amonia dalam air dipengaruhi oleh suhu, nilai karbondioksida dan pH. Nilai total amoniak nitrogen dalam air dipengaruhi oleh kandungan produksi karbondioksida, peningkatan nilai karbondioksida akan membuat nilai total amoniak nitrogen meningkat juga. Nirmala et al. (2012) menyatakan bahwa kematian yang terjadi pada kegiatan transportasi ikan salah satunya disebabkan oleh kandungan NH3 dan CO2 yang melebihi batas toleransi.
Hasil penelitian menunjukkan bahwa pH pada kontrol lebih rendah dibandingkan perlakuan dan pH semakin menurun seiring dengan pertambahan waktu pingsan. Suwandi et al. (2011) menyatakan bahwa penurunan pH terhadap ikan akan berpengaruh terhadap laju resiprasi. Semakin padat suatu wadah transportasi maka hasil respirasi dan CO2 bebas akan semakin meningkat, selain
itu waktu transportasi, dan keasaman suatu media air juga dapat mempengaruhi nilai pH air. Suwandi et al. (2013) menyatakan bahwa faktor yang mempengaruhi
16
tingginya pH media selama simulasi diduga akibat akumulasi nilai total amino nitrogen (TAN). Yanto (2012) melaporkan bahwa nilai pH air menurun setelah transportasi dibanding sebelum transportasi. Penurunan pH ini berkaitan dengan peningkatan hasil ekskresi ikan dan penambahan bahan anestesi pada media transportasi. Mjoun et al. (2010) menyatakan bahwa nilai ambang batas pH ikan nila untuk hidup adalah 3,7-11 sedangkan pH optimum untuk ikan nila tumbuh yaitu 7-9. Hasil penelitian ini memiliki derajat keasaman (pH) air yang masih dalam batas aman untuk memungkinkan ikan nila hidup.
KESIMPULAN DAN SARAN
Kesimpulan
Konsentrasi ekstrak daun sirih yag terbaik untuk bahan anestesi yaitu 1,75% dengan waktu pemingsanan 1,58 menit dan waktu pembugaran 6,24 menit dengan tingkat kelangsungan hidup (survival rate) 100% setelah dibugarkan kembali. Ikan nila yang dipingsankan dengan ekstrak daun sirih terlebih dahulu memiliki ketahanan hidup selama 120 menit dalam kondisi pingsan selama transportasi. Ikan nila yang tidak dipingsankan dengan daun sirih memiliki ketahanan hidup selama 90 menit dalam kondisi pingsan selama transportasi. Semakin lama proses transportasi ikan nila dalam keaadaan pingsan maka nilai glukosa darah ikan semakin meningkat.
Saran
Pengujian transportasi kering dengan tambahan bahan pengisi terhadap ikan nila yang dipingsankan dengan ekstrak daun sirih. Saran lainnya dengan penggunaan metode ekstraksi lain. Metode ektraksi yang dapat digunakan yaitu pemblenderan.
DAFTAR PUSTAKA
Abid MS, Mashithah ED, Prayogo. 2014. Potensi senyawa metabolit sekunder infusum daun durian (Durio zibethinus) terhadap kelulushidupan ikan nila (Oreochromis niloticus) pada transportasi ikan hidup sistem kering. Jurnal Ilmiah Perikanan dan Kelautan. 6(1):93-99.
Achmad, Suryana I. 2009. Pengujian aktivitas ekstrak daun sirih (Piper betle Linn.) terhadap Rhizoctonia sp. secara in vitro. Bul. Littro. 20(1):92–98. Aini M, Ali M, Putri B. 2014. Penerapan teknik imotilisasi benih ikan nila
17 conyzoides) pada transportasi basah. Jurnal Rekayasa dan Teknologi Budidaya Perairan. 2(2):217-226.
[BSN] Badan Standarisasi Nasional. 2005. SNI 05-6989.30-2005 Air dan Air Limbah Bagian 30: Cara Uji Kadar Amonia dengan Spektrofotometer secara Fenat. Jakarta (ID): Badan Standarisasi Nasional.
Birdi T, Daswani P, Brijesh S, Tetali P, Natu A, Antia N. 2010. Newer insights into the mechanism of action of Psidium guajava L. leaves in infectious diarrhoea. BMC Complementary and Alternative Medicine. 10:33.
Bittencourt NLR, Monari LM, Scoaris DO, Pedroso RB, Nakamura CV. 2003. Haematological and biochemical values for nile tilapia Oreochromis niloticus cultured in semi intensive system. Acta Scientiarum Biological Sciences. 25(2):385-389.
Boyd. 1982. Water Quality Management for Pond Fish Culture. USA (US): Departement of Fisheries and Apllied Aquaculture, Agricultural Experiment Station Auburn University, Alabama..
Colt J. 2014 Juni. Water quality in tilapia transport from farm to retail. Global Aquacultur Advocate, forthcoming.
Coyle SD, Robert MD, James HT. 2004. Anestheetics in aquaculture. Southern Regional Aquaculture Center No. 3900.
Darwisto S. 2006. Kinerja reproduksi ikan nila (Oreochromis niloticus) yang mendapat tambahan minyak ikan dan vitamin E dalam pakan yang dipelihara pada salinitas media berbeda [tesis]. Bogor (ID): Sekolah Pascasarjana, Institut Pertanian Bogor.
Eaton AD, Clesceri LS, Greenberg AE, Franson MAH. 1995. Standard Methods for
The Examination of Water and Wastewater. Ann Harbor (US): American
Public Health Association.
Handayani MT. 2014. Teknik imotilisasi ikan nila menggunakan ekstrak umbi rumput teki [skripsi]. Bogor (ID): Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Harmon TS. 2009. Methods for reducing stressors and maintaining water quality associated with live fish transport in tanks: a review of the basics. Review in Aquaculture. 1:58-66.
Hastuti S, Supriyono E, Mokoginta I, Subandiyono. 2003. Respon glukosa darah ikan gurami (Osphronemus gouramy, LAC.) terhadap stres perubahan suhu lingkungan. Jurnal Akuakultur Indonesia. 2(2):73-77.
Ilhami R, Ali M, Putri B. 2015. transportasi basah benih nila (Oreochromis niloticus) menggunakan ekstrak bunga kamboja (Plumeria acuminata). Jurnal Rekayasa dan Teknologi Budidaya Perairan. 3(2):389-396.
Iwama GK, Afonso LOB, Todgham A, Ackerman P, Nakano K. 2004. Are hsps suitable for indicating stressed states in fish ? The Journal of Experimental Biology. 207:15-19.
18
Karnila R, Edison. 2001. Pengaruh suhu dan waktu pembiusan bertahap terhadap ketahanan hidup ikan jambal siam (Pangasius sutchi F) dalam transportasi sistem kering. Jurnal Natur Indonesia. 3(2):151-167.
[KKP] Kementerian Kelautan dan Perikanan. 2015a. Laporan Kinerja Kementerian Kelautan dan Perikanan Tahun 2014. Jakarta (ID): Kementerian Kelautan dan Perikanan.
[KKP] Kementerian Kelautan dan Perikanan. 2015b. Statistik Konsumsi ikan, Statistik dan Informasi Kementerian Kelautan dan Perikanan 2013 [Internet]. [diunduh 22 juni 2016]. Tersedia pada: http://www.statistik.kkp.go.id.
Mjoun K, Rosentrater KA, Brown ML. 2010. Tilapia: environmental biology and nutritional requirements. South Dakota Cooperative Extension Service. 2:1-7.
Molleda MI. 2007. Water Quality Recirculating aquacultire system for arctic charr (Salvelinus alpinus L.) culture. Ciudad de la Habana (CU). UNU Fisheries Training Programme, forthcoming.
Mukhriani. 2014. Ekstraksi, pemisahan senyawa, dan identifikasi senyawa aktif. Jurnal Kesehatan. 7(2):361-367.
Neiffer DL, Stamper MA. 2009. Fish Sedation, Anesthesia, Analgesia, and Euthanasia: Considerations, Methods, and Types of Drugs. ILAR journal. 5(4):344-360.
Nirmala K, Hadiroseyani Y. Widiasto RP. 2012. Penambahan garam dalam air media yang berisi zeolit dan arang aktif pada transportasi sistem tertutup benih gurami Osphronemus goramy Lac. Jurnal Akuakultur. 11(2):190-201. Novalny D. 2006. Pengaruh ukuran rajangan daun dan lama penyulingan
terhadap rendemen dan karakteristik minyak sirih (Piper betle L.) [skripsi]. Bogor (ID): Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
Nurdjannah N. 2004. Diversifikasi penggunaan cengkeh. Perspektif. 3(2):61-70. Porchas MM, Cordova LRM, Enriquez RR. 2009. Cortisol and glucose: reliable
indicators of fish stress ? Pan-American Journal of Aquatic Sciences. 4(2):158-178.
Pratisari D. 2010. Transportasi ikan nila (Oreochromis niloticus) hidup sistem kering dengan menggunakan pembiusan suhu rendah secara langsung [skripsi]. Bogor (ID): Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Riyadi A. 2006. Kajian kualitas air Waduk Tirta Shinta di Kotabumi Lampung. J.Hidrosfir. 1(2):75-82.
Sagita TF, Sulmartiwi L, Rahardja BS. 2008. Penggunaan zeolit dengan dosis dan waktu pengamatan berbeda terhadap sintasan benih ikan mas (Cyprinus carpio L) dan perubahan parameter kimia air media dalam transportasi sistem tertutup. Berkala Ilmiah Perikanan. 2(3):15-22.
Saskia Y, Esti H, Tutik K. 2013. Toksisitas dan kemampuan anestetik minyak cengkeh (Sygnium aromaticum) terhadap benih ikan pelangi merah
19 (Glossolepis incisus). Jurnal Ilmu Perikanan dan Sumberdaya Perairan. 2(1):83-87.
Sengupta R, Banik JK. 2013. A review on betel leaf (PAN). International Journal of Pharmaceutical Science and Research. 4(12):4520-4524.
Suliantari, Jenie BSL, Suhartono MT, Apriyantono A. 2008. Aktivitas antibakteri ekstrak sirih hijau (Piper betle L.) terhadap bakteri patogen pangan. Jurnal Teknologi dan Industri Pangan. 19(1):1-7.
Sulmartini L, Chotimah DN, TjahjaningsihW, Widianto TV, Tiastuti J. 2009. Respon daya cerna dan respirasi benih ikan mas (Cyprinus carpio) pasca transportasi dengan menggunakan daun babandotan (Ageratum conyzoides) sebagai bahan antimetabolik. Jurnal Ilmiah Perikanan dan Kelautan. 1(1):79-86.
Sulmartiwi L, Harweni T, Mukti AT, Triastuti JR. 2013. Pengaruh penggunaan larutan daun bandotan (Ageratum conyzoides) terhadap kadar glukosa darah ikan koi (Cyprinus carpio) pasca transportasi. Jurnal Ilmiah Perikanan dan Kelautan. 5(1):73-76.
Sumahiradewi LG. 2014. Pengaruh konsentrasi minyak cengkeh (Eugenia aromatica) terhadap kelangsungan hidup ikan nila (Oreochromis sp.) pada proses transportasi. Media Bina Ilmiah. 8(1):42-45.
Suryaningrum TD, Utomo BSD, Wibowo S. 2005. Teknologi Penanganan dan Transportasi Krustasea Hidup. Badan Riset Kelautan dan Perikanan. Slipi: Jakarta.
Suwandi R, Jacoeb AM, Muhammad V. 2011. Pengaruh cahaya terhadap aktivitas metabolisme ikan lele dumbo (Clarias gariepinus) pada simulasi transportasi sistem tertutup. Jurnal Pengolahan Hasil Perikanan Indonesia 14(2):92-97.
Suwandi R, Nugraha R, Novila W. 2012. Penurunan metabolisme ikan nila (Oreochromis niloticus) pada proses transportasi menggunakan ekstrak daun jambu biji (Psidium guajava var. pyrifera). Jurnal Pengolahan Hasil Perikanan Indonesia. 15(3):252-260.
Suwandi R, Nugraha R, Zulfahmi KE. 2013. Aplikasi ekstrak daun jambu Psidium guajava var. pomifera pada proses transportasi ikan Nila (Oreochromis niloticus). JPHPI. 16(1):69-78.
Wijana N. 2010. Penentuan kualitas air Danau Batur melalui indeks pencemaran biologik dan non biologik. Jurnal Bumi Lestari. 10(2):236-241.
Yanto H. 2008. Penggunaan MS-222 dan larutan garam pada transportasi ikan jelawat (Leptobarbus hoevenii Blkr.) ukuran sejari. Jurnal Ilmu-ilmu Perairan dan Perikanan Indonesia. 16(1):47-54.
Yanto H. 2012. Kinerja MS-222 dan kepadatan ikan botia (Botia macracanthus) yang berbeda selama transportasi. Jurnal Penelitian Perikanan. 1(1):43-51.
21
21
23 Lampiran 1 Tabel ANOVA data penelitian
a) Waktu pemingsanan ikan nila
Sumber keragaman Jumlah
kuadrat Db Kuadrat tengah F Sig. Perlakuan 13,372 2 6,686 197,647 0,000 Sisa 0,203 6 0,034 Total 13,575 8
b) Waktu pembugaran ikan nila
Sumber keragaman Jumlah
kuadrat Db Kuadrat tengah F Sig. Perlakuan 6,528 2 3,264 6,657 0,030 Sisa 2,942 6 0,490 Total 9,470 8
c) Waktu pembugaran penelitian utama
Sumber keragaman Jumlah
kuadrat Db Kuadrat tengah F Sig. Perlakuan 2,306 1 2,306 4,719 0,096 Sisa 1,955 4 0,489 Total 4,261 5
24
Lampiran 2 Uji lanjut tukey data penelitian
a) Waktu pemingsanan ikan nila Perlakuan N Taraf nyata = .05
1 A B
2,25% 3 1,415
1,75% 3 1,568
1,25% 3 4,074
Sig. 0,591 1,000
Rerata kelompok dalam taraf nyata homogen ditampilkan. a Menggunakan Ukuran Rerata Contoh yang Harmonis = 3,000.
b) Waktu pembugaran ikan nila
Perlakuan N Taraf nyata = .05
1 a B
2,25% 3 5,479
1,75% 3 6,239 6,239
1,25% 3 7,542
Sig. 0,432 0,135
Rerata kelompok dalam taraf nyata homogen ditampilkan. a Menggunakan Ukuran Rerata Contoh yang Harmonis = 3,000.
25 Lampiran 3 Dokumentasi hasil penelitian
Daun sirih
Panci perebusan
Ekstrak daun sirih
Ekstrak dan ikan pingsan
Timbangan
Kain blacu
Ikan nila
26
Syiringe
Alat uji kualitas air
Alat uji glukosa darah
27
27
Lampiran 4 Contoh perhitungan
Perhitungan konsentrasi 1,25% = 1,75% = 2,25 % = Perhitungan CO2 Diketahui:
Ditanyakan: Kandungan CO2? mL titran = 0,4 N titran = 0,0454 mL sampel = 25 mL Penyelesaian: CO2 = = = 15,9808 ppm Perhitungan TAN Diketahui : y = 0,8653x – 0,0010 y = absorbansi sampel x = Hasil TAN (ppm) y = 0.8653x - 0.001 R² = 0.9993 -0.1 0 0.1 0.2 0.3 0.4 0.5 0 0.2 0.4 0.6 A b sor b an si st an d ar Konsentrasi
28
Ditanyakan : kandungan TAN? Penyelesaian :
absorbansi sampel = 0,8653(TAN) - 0,0010 0,035 = 0,8653 (TAN) – 0,0010 0,035 + 0,0010 = 0,8653 (TAN)
= TAN
29
29
RIWAYAT HIDUP
Penulis dilahirkan di Subang, pada tanggal 20 Oktober 1994. Penulis merupakan anak pertama dari dua bersaudara dari pasangan Bapak Pepen Apendi (Alm.) dan Ibu Titi Sumarni serta mempunyai satu orang adik perempuan yang bernama Mutiara Dwi Evanty. Pendidikan formal penulis ditempuh di Subang dimulai dari SDN Karang Sari pada tahun 2000 sampai 2006. Pendidikan formal selanjutnya dtempuh di SMPN 1 Binong hingga tahun 2009. Pendidikan formal selanjutnya ditempuh di SMAN 1 Subang dan tamat pada tahun 2012.
Penulis diterima sebagai mahasiswa pada Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor melalui jalur SNMPTN Tertulis pada tahun 2012. Selama mengikuti perkuliahan penulis aktif dalam organisasi Himpunan Mahasiswa Teknologi Hasil Perairan (HIMASILKAN) sebagai anggota Divisi Infokom pada 2013-2014 dan anggota Divisi Kewirausahaan pada tahun 2014-2015. Penulis juga aktif mengikuti lomba Pekan Kreativitas Mahasiswa (PKM) di bidang kewirausahaan sebagai ketua dan didanai oleh DIKTI dengan judul “SHARK: Sabun Kecantikan Herbal Alami dari Rumput Laut dan Minyak Kelapa” dan PKM Penelitian dengan judul “ Efektivitas Anastesi Alami Ekstrak Daun Sirih Hijau (Piper betle) terhadap Kelangsungan Hidup Ikan Konsumsi Ekonomis sebagai Optimalisasi Transportasi Sistem Kering” sebagai anggota, lalu mengikuti Pekan Ilmiah Mahasiswa Nasional (PIMNAS) ke-28 di Universitas Haluoleo. Penulis merupakan penerima beasiswa Perhimpunan Orang tua Mahasiswa IPB (POM) pada tahun 2012-2013, beasiswa BUMN pada tahun 2013-2014 dan beasiswa Genksi Sosial Fund (GSF) pada tahun 2014-2016.
Penulis melakukan praktik lapangan di UMKM Indrasari, Indramayu dengan judul “Perencanaan Penerapan HACCP pada Proses Pembuatan Kerupuk di UMKM Indrasari Indramayu, Jawa Barat”. Penulis melakukan penelitian dengan judul “Pemanfaatan Daun Sirih (Piper betle) sebagai Bahan Anestesi pada Proses Transportasi Ikan Nila (Oreochromis niloticus)” sebagai salah satu syarat untuk memperoleh gelar sarjana di Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor dibawah bimbingan Dr Ir Ruddy Suwandi MS MPhil dan Priadi Setyawan SPi MSi.