C - 114
UJI BIOAKTIVITAS EKSTRAK KLOROFORM RHIZOPHORA APICULATA (MANGROVE) TERHADAP SPODOPTERA LITTURA FABR.
SEBAGAI INSEKTISIDA NABATI Ika Fatchur Rochmah dan Tukiran
Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Negeri Surabaya, Jln. Ketintang, Surabaya, 60231
ABSTRAK
Telah dilakukan penelitian untuk mengetahui bioaktivitas dari ekstrak kloroform kulit batang tumbuhan Rhizophora apiculata (EKRA) terhadap ulat grayak (Spodoptera Littura Fabr.) meliputi mortalitas, LC50. Pengujian bioaktivitas insektisida terhadap pertumbuhan ulat grayak menggunakan metode semprot dan celup agar diyakini terjadinya racun kontak atau racun perut. Konsentrasi ekstrak EKRA yang diujikan adalah K0= kontrol, K1= 200 mg/L, K2= 400 mg/L, K3= 800 mg/L, K4= 1600 mg/L, K5= 3200 mg/L, K6= 6400 mg/L dengan perlakuan diulang sebanyak 4 kali. Hasil dari persentase mortalitas ekstrak kloroform tersebut adalah 0%, 25 %, 26,7 %, 33,3 %, 36,7 %, 45 %, dan 55 %. Hasil analisis probit dari data tersebut diperoleh nilai LC50 sebesar 4759,487 mg/L. Dengan
demikian, ekstrak kulit batang tumbuhan Rhizophora apiculata (EKRA) dapat dijadikan alternatif bioinsektisida.
Kata kunci: Bioaktivitas, Ekstrak kloroform, Rhizophora apiculata, Spodoptera littura Fabr.
PENDAHULUAN
Dalam upaya meningkatkan mutu dan produktivitas hasil pertanian, penggunaan pestisida untuk membasmi hama tanaman sering tak terhindarkan. Pestisida yang digunakan diharapkan dapat
membantu petani dalam
mendapatkan keuntungan yang maksimal. Namun, penggunaan pestisida dengan dosis besar dan dilakukan secara terus menerus akan menimbulkan beberapa kerugian, antara lain residu pestisida akan terakumulasi pada produk-produk
pertanian, pencemaran pada
lingkungan pertanian, penurunan produktivitas, keracunan pada hewan, dan keracunan pada manusia yang berdampak buruk terhadap
kesehatan. Dampak negatif lain dari penggunaan pestisida diantaranya adalah peningkatan daya tahan hama terhadap pestisida, pembengkakan biaya perawatan akibat tingginya harga pestisida dan penggunaan yang salah dapat mengakibatkan racun bagi lingkungan, manusia serta ternak (Maulana, 2010). Tingginya dampak negatif yang ditimbulkan oleh pestisida sintetis maka mendorong berbagai usaha untuk mengembangkan jenis pestisida nabati. Salah satunya yaitu jenis bioinsektisida baru. Bioinsektisida tersebut dapat diperoleh dari berbagai tumbuhan penghasil senyawa metabolit sekunder yang berfungsi sebagai penghasil racun. Jenis tumbuhan yang diketahui
C - 115 bioinsektisida antara lain famili Meliaceae, Annonaceae, Piperaceae, Asteraceae, Zingiberaceae, Rutaceae dan Leguminosae (Hamdani, 2008). Adapun famili lain yang diduga sebagai penghasil racun bagi insektisida adalah jenis famili Rhizophoraceae.
Bahan aktif senyawa
metabolit sekunder yang telah ditemukan dalam studi fitokimia pada beberapa spesies mangrove di antaranya ditemukan senyawa seperti alkaloid, flavonoid, fenol, terpenoid, steroid, dan saponin. Golongan senyawa ini merupakan bahan obat-obatan modern (Eryanti et al., 1999). Kulit kayu mengandung tannin terutama pada famili Rhizophoraceae. Tumbuhan ini merupakan jenis bakau sejati yang tumbuh di hutan pasang surut, serta tampak sepanjang pantai. Tumbuhan mangrove famili ini kaya akan senyawa steroid, saponin, dan flavonoid (Anonim, 2009). Pada penelitian sebelumnya telah dilakukan penelitian tentang potensi berbagai tumbuhan penghasil racun bagi insektisida di antaranya adalah telah diisolasi 5 alkohol alifatik
berantai panjang, 11 asam
karboksilat jenuh alifatik berantai panjang, dan 3 steroid yaitu 2,6-dimethoxy-p-benzoquinone,
syringaldehid, dan sitosteryl 3-glukosida dari bagian tengah kayu Rhizophora apiculata (Kokpol, U. et.al., 1993). Selanjutnya diuji bioaktivitasnya untuk antifeedant terhadap kumbang tumbuhan kapas, anti jamur, dan anti mikroba. Sementara itu, Senyawa 2,6-dimethoxy-p-benzoquinone adalah
satu-satunya senyawa yang
memperlihatkan aktivitasnya. Hal ini menunjukkan bahwa senyawa ini
aktif melawan jamur, bakteri, dan kumbang tumbuhan kapas.
Golongan senyawa steroid pertama telah diidentifikasi sebagai 2,6-dimethoxy-p-benzoquinone dengan membandingkan data spektra dan sifat kimianya terhadap literatur. Senyawa ini juga menunjukkan aktivitas anti bakteri melawan X. campestris sebesar 64% dan aktivitas antifeedant terhadap kumbang tumbuhan kapas sebesar 89% pada dosis 6 mg (Kokpol, U. et.al., 1993).
Golongan senyawa steroid kedua telah diidentifikasi sebagai
syringaldehyde dengan
membandingkan data spektra dan sifat kimia terhadap literature.
Senyawa syringaldehyde ini
menunjukkan aktivitas anti jamur melawan H. teres sebesar 80%. Sedangkan, senyawa steroid terakhir
yaitu, sitosteryl
3-O-β-glucopyranoside telah diidentifikasi dengan co-TLC dan dicampur
dengan penanda asli dan
perbandingan dari spektra 1H dan 13C NMR juga data fisik lainnya yang sesuai dengan literatur (Kokpol, U. et.al., 1993).
Beberapa tumbuhan bakau
genus Rhizophoraceae telah
dilakukan uji terhadap daya toksisitas terhadap larva suatu serangga diantaranya adalah Brugueira cylindrica, Ceriops decandra, Rhizophora apiculata, Rhizophora lamarckii, dan Rhizophora mucronata. Dari tanaman-tanaman tersebut, ekstrak petroleum ether dari tanaman Rhizophora apiculata yang paling efektif terhadap larva nyamuk Culex quinquefasciatus dengan nilai LC50
sebesar 25,7 mg/L (Thangam & Kathiresan, 1997).
Berdasarkan hasil penelitian tentang senyawa metabolit sekunder
C - 116 yang terkandung di dalam tumbuhan Rhizophora apiculata sebagai sumber bioinsektisida maka akan dilakukan uji bioaktivitas ekstrak untuk mengetahui efektivitas dari ekstrak Rhizophora apiculata terhadap Spodoptera littura Fabr. sebagai sumber bioinsektisida baru. METODE PENELITIAN
Alat:
Alat-alat yang digunakan dalam proses ekstraksi adalah seperangkat alat ekstraksi secara maserasi meliputi, vacuum rotary evaporator, water bath. Sementara itu, peralatan yang digunakan pada pengujian bioinsektisida meliputi: toples plastik (berdiameter 15 cm, tinggi 15 cm) sebanyak 28 buah, kain kasa 20 x 20 cm, tutup toples, menara semprot potter, gelas ukur, labu ukur, cawan petri, pipet, kuas halus, timbangan analitik, kertas tissue, botol, spatula dan lain-lain. Bahan:
Bahan penelitian yang digunakan adalah kulit batang tumbuhan Rhizophora apiculata dan untuk ekstraksi pelarut yang digunakan adalah pelarut kloroform p.a. Sementara bahan-bahan yang
digunakan untuk pengujian
bioinsektisida meliputi daun jarak kepyar yang segar, bahan bioaktif (ekstrak kloroform) sebanyak 1,6 g dari kulit batang tumbuhan Rhizophora apiculata, bahan pengemulsi (tween 80), aquades, larutan uji EKPK (0, 200, 400, 800, 1600, 3200 dan 6400) mg/L dan serangga uji sebanyak 420 ekor yang berasal dari perbanyakan di laboratorium hama dan penyakit tanaman BALITTAS Karang Ploso
Malang, Jawa Timur. Untuk
keperluan pengujian digunakan larva instar II.
Metode:
Sampel tumbuhan bakau minyak (Rhizophora apiculata) diperoleh dari daerah Osowilangun, Gresik, Jawa Timur. Sebelum diteliti, terlebih dahulu diidentifikasi ke LIPI UPT Balai Konservasi Tumbuhan Kebun Raya Purwodadi, Pasuruan, Jawa Timur. Tumbuhan tersebut selanjutnya dibersihkan dari kotoran yang melekat, lalu dikeringkan tanpa penyinaran matahari secara langsung dengan cara diangin-anginkan untuk
mengurangi penguapan yang
mengikutkan senyawa yang
terkandung didalamnya, sehingga diperoleh ±5 kg sampel tumbuhan
bakau minyak (Rhizophora
apiculata) kering, kemudian digiling hingga berbentuk serbuk kering kulit batang tumbuhan bakau minyak (Rhizophora apiculata) seberat 10 Kg.
Serangga uji yang
digunakan pada penelitian ini berasal
dari hasil perbanyakan di
Laboratorium Hama dan penyakit tanaman di Balai Penelitian Tanaman Tembakau dan Serat (BALITTAS) Karang Ploso Malang, Jawa Timur.
Untuk keperluan pengujian
digunakan larva instar II karena praktis dan lebih mudah ditangani serta aktivitas makannya jelas terlihat.
Jarak kepyar yang
digunakan berasal dari BALITTAS Karang Ploso Malang, untuk keperluan uji yang bertujuan untuk menstabilkan hidup dari ulat grayak yang diamati.
C - 117 Pembuatan ekstrak EKRA dimulai dengan melakukan maserasi terhadap serbuk kering kulit batang tumbuhan Rhizophora apiculata yang ditimbang seberat 3 Kg dengan pelarut kloroform ± 1 cm diatas sampel selama 24 jam. Filtrat hasil tiap maserasi kemudian diuapkan dengan vacuum rotary evaporator untuk memperoleh ekstrak dan
hasilnya ditimbang untuk
mengetahui berat ekstrak EKRA. Selanjutnya residu dikeringkan kembali dengan cara diangin-anginkan untuk dimaserasi kembali dengan kloroform p.a ± 1 cm diatas sampel selama 24 jam dan diulang sebanyak 3 kali hingga diperoleh berat ekstrak EKRA seberat 1,6 g untuk keperluan uji bioaktivitas ekstrak.
Pembuatan larutan uji ekstrak EKRA dengan cara membuat larutan induk terlebih dahulu dengan konsentrasi larutan induk sebesar 6400 mg/L, yaitu dengan cara 1,6 g EKRA dituang ke dalam gelas kimia, lalu ditambahkan beberapa tetes tween 80 sebagai emulsifier (bahan pengemulsi, karena ekstrak tidak dapat larut dalam air), kemudian ditambah dengan aquades sedikit demi sedikit (sebagai bahan
pembawa pada water based
formulation) dan diaduk hingga homogen. Kemudian dimasukkan ke dalam labu ukur 250 mL. Membuat larutan uji ekstrak EKRA dengan metode deret ukur pada variasi konsentrasi 0; 200; 400; 800; 1600; 3200; dan 6400 mg/L. Untuk mendapatkan variasi konsentrasi larutan uji EKRA: 0; 200; 400; 800; 1600; 3200; dan 6400 mg/L, dilakukan dengan cara mengambil 0; 3,13; 6,25; 12,50; 25,00; dan 50,00 mL dari larutan induk 6400 mg/L
kemudian dimasukkan ke dalam labu ukur 100 mL, ditambahkan sedikit aquades, larutan dikocok hingga menjadi homogen dan ditambahkan dengan aquades hingga tanda batas.
Disisi lain, menyiapkan 1 lembar daun jarak kepyar dengan ukuran yang telah disesuaikan dengan wadah uji, disemprot dengan menggunakan menara potter pada masing-masing larutan uji hingga membasahi seluruh permukaan daun. Mengangin-anginkan di udara terbuka daun jarak kepyar yang sudah disemprot hingga seluruh permukaannya kering. Memasukkan daun jarak kepyar yang sudah diangin-anginkan ke dalam toples plastik. Kemudian memasukkan 15 ekor ulat grayak instar II ke dalam cawan petri dan disemprot dengan menara potter untuk setiap konsentrasi uji. Memasukkan ulat grayak ke dalam toples plastik yang telah berisi daun jarak kepyar. Menutup toples plastik dengan menggunakan kain kasa dan tutup toples yang telah di lubangi tengahnya. Melakukan pengamatan pada selang waktu 24 jam selama 3 hari setelah pemberian perlakuan daun jarak kepyar dengan variasi konsentrasi larutan uji untuk menghitung jumlah ulat grayak yang mati.
Melakukan pengulangan sebanyak 4 kali dan banyaknya ulangan mengikuti kaidah sebagai berikut:
(p-1) (u-1) > 15, dengan u > 4 p = Jumlah perlakuan
C - 118 Menghitung tingkat mortalitas dapat dinyatakan dengan presentase mortalitas sebagai berikut:
P = Presentase mortalitas X = Jumlah larva yang mati Y = Jumlah larva yang diamati
Mortalitas median (LC50)
pada uji bioaktivitas, dihitung dengan analisis Probit menggunakan Program Minitab for Windows Version 13. Hasil analisis ini akan diperoleh nilai LC50 untuk
masing-masing bahan bioaktif insektisida yang paling efektif atau kuat pengaruhnya terhadap serangga uji ulat grayak (Herminto, et al., 2004). HASIL DAN PEMBAHASAN
Pengamatan uji bioaktivitas ekstrak dilakukan setelah selang waktu 24 jam selama 3 hsp. Data pengamatan hasil uji bioaktivitas yang diperoleh menunjukkan jumlah kematian larva seperti yang terlihat pada tabel 1. Larva tersebut dikatakan mati apabila disentuh tidak memberikan respon berupa gerakan atau tanda kehidupan.
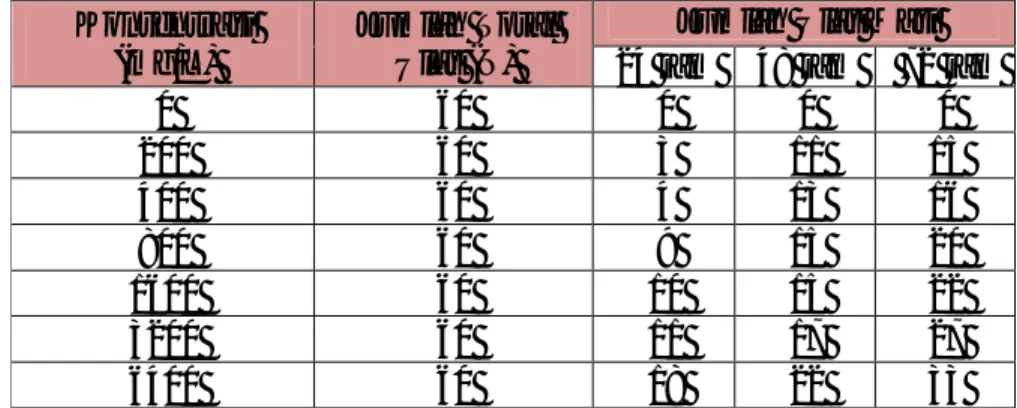
Tabel 1. Pengaruh Konsentrasi EKRA terhadap Jumlah Ulat Mati Hingga 3 hsp
EKRA dengan konsentrasi
yang berbeda menyebabkan
mortalitas ulat grayak yang bervariasi. Pengaruh konsentrasi
EKRA terhadap persentase
mortalitas ulat grayak ditunjukkan pada tabel 2 berikut.
Tabel 2. Pengaruh Konsentrasi EKRA terhadap % Mortalitas Ulat Grayak Hingga 3 hsp
Konsentrasi (mg/L)
Jumlah Total Ulat (N)
Jumlah Ulat Mati 24 jam 48 jam 72 jam
0 60 0 0 0 200 60 3 11 15 400 60 4 13 16 800 60 9 15 20 1600 60 10 15 22 3200 60 11 17 27 6400 60 18 22 33 Konsentrasi (mg/L) Jumlah Total Ulat (N) % Mortalitas 24 jam 48 jam 72 jam
0 60 0,00 0,00 0,00 200 60 5,00 18,33 25,00 400 60 6,66 21,67 26,67 800 60 15,00 25,00 33,33 1600 60 16,67 25,00 36,66 3200 60 18,33 28,33 45,00 6400 60 30,00 36,66 55,00
C - 119 Pada tabel 2 di atas terlihat bahwa peningkatan
konsentrasi EKRA dapat
menyebabkan peningkatan
mortalitas pada larva ulat grayak. Data pengamatan yang dihasilkan pada tabel 2
selanjutnya digunakan untuk
menganalisis pengaruh
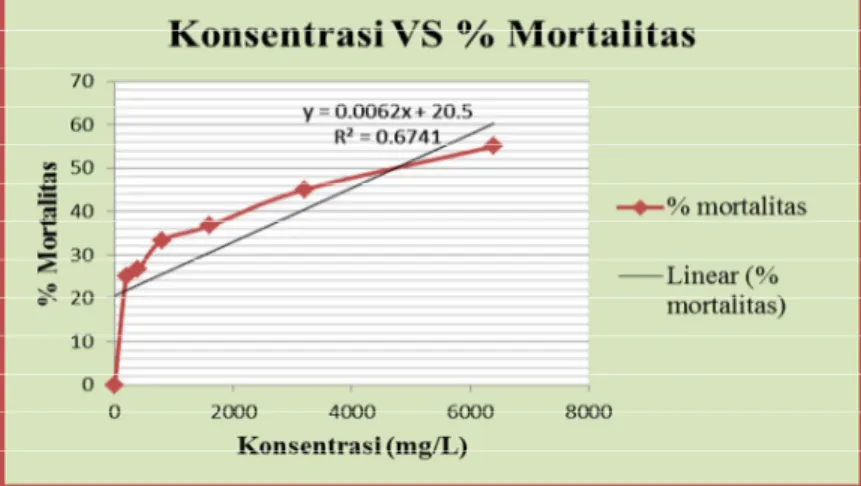
konsentrasi EKRA terhadap mortalitas ulat grayak pada 3 hsp seperti tampak pada Gambar 2 berikut.
Gambar 2. Hubungan Antara Konsentrasi EKRA dengan Mortalitas Ulat Grayak
Gambar 2 diatas
memperlihatkan hubungan
antara pengaruh konsentrasi EKRA terhadap mortalitas ulat grayak. Pada Gambar 2 terlihat bahwa pola hubungan antara konsentrasi dan mortalitas ulat grayak adalah nyata, yang menyatakan bahwa konsentrasi EKRA yang semakin tinggi
menyebabkan terjadinya
mortalitas ulat grayak yang
semakin tinggi secara nyata. Hal ini dapat dilihat dari nilai koefisien determinasi (R2 = 0,6741).
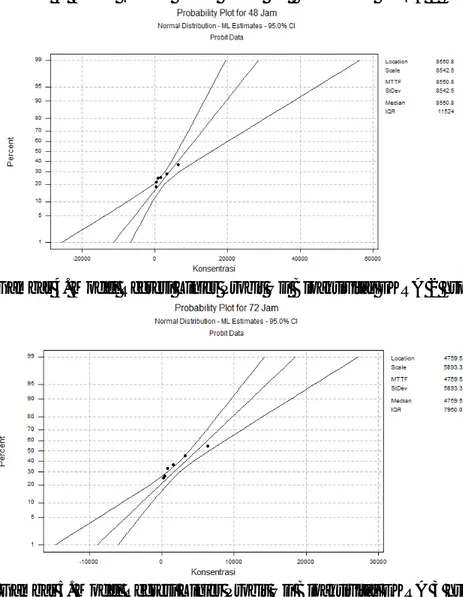
Data pengamatan yang dihasilkan pada tabel 1 selanjutnya digunakan untuk menghitung nilai mortalitas median (LC50) dari EKRA untuk
1-3 hsp, dimana hasil grafik analisis probit terlihat seperti Gambar 3, 4, dan 5 berikut.
C - 120
Gambar 3. Model Regresi Linier Probit Uji Bioaktivitas EKRA 1 hsp
Gambar 4. Model Regresi Linier Probit Uji Bioaktivitas EKRA 2 hsp
Gambar 5. Model Regresi Linier Probit Uji Bioaktivitas EKRA 3 hsp Berdasarkan ketiga
gambar grafik di atas, dapat dijelaskan bahwa pemilihan konsentrasi untuk mematikan ulat grayak sudah benar karena tanda titik yang berada dalam gambar tidak melewati garis
standar deviasi. Berdasarkan grafik analisis probit dari larutan uji EKRA untuk 1-3 hsp diperoleh persamaan linearitas dan nilai LC50 seperti tampak
pada tabel 3 berikut. Tabel 3. Persamaan Linearitas dan Nilai LC50
Hsp Persamaan Linear LC50 (mg/L)
1 y = 3,5086 + 0,00016553x 9009.573
2 y = 3,9990 + 0,00011706x 8550.761
C - 121 Nilai y merupakan nilai tetapan transformasi dari persentase menjadi probit, dan x merupakan konsentrasi yang dibutuhkan untuk mematikan ulat grayak pada persentase tertentu. Persamaan tersebut diperoleh dari tabel regresi pada hasil analisis (Lampiran 1), dimana persamaan dasar probit yaitu y = (a+5) + bx, nilai a diperoleh dari koefisien konstanta probit dan nilai b diperoleh dari koefisien konsentrasi larutan.
Analisis data
dilakukan dengan menggunakan
analisis probit dengan
menggunakan program Minitab 13 for windows. Analisis probit digunakan dalam pengujian biologis untuk mengetahui respon subyek yang diteliti oleh adanya stimulasi dalam hal ini insektisida dengan mengetahui respon berupa mortalitas (Umniyati, 1990).
Pendugaan nilai
toksisitas insektisida terhadap serangga hama diukur dengan nilai LC50, yaitu suatu
konsentrasi atau dosis yang dapat menyebabkan kematian 50% serangga hama yang diuji (Moekasan, 1993). Dari hasil analisis probit, nilai LC50 pada
tabel 1 dapat dilihat bahwa dengan lama pemaparan yang berbeda akan menghasilkan nilai LC50 yang berbeda pula. Lama
pemaparan yang paling efektif
digunakan adalah 3 hsp dengan nilai LC50 yang kecil sebesar
4759,478 mg/L dan persentase mortalitas yang besar yaitu 55,00 %.
Menurut Mumford
dan Norton (1984 dalam Laba dan Soekarno), suatu insektisida dikatakan efektif apabila mampu
mematikan minimal 80%
serangga uji (untuk insektisida sintetik). EKRA merupakan insektisida nabati yang daya
kerjanya lebih lambat
dibandingkan insektisida sintetik sehingga walaupun tingkat kematian populasi hewan uji belum mencapai 80% pada 3
hsp, namun EKRA dapat
dikatakan efektif pada tingkat mortalitas 50%. Jadi, EKRA dapat dikatakan efektif karena pada konsentrasi 4759,487 mg/L dapat mematikan ulat grayak sebesar 50%.
Pada pengamatan
secara visual terhadap perilaku makan dan gerak ulat grayak nampak berbeda dengan kontrol. Pada masing-masing perlakuan EKRA terhadap ulat grayak mengalami gejala keracunan
yang ditandai dengan
kehilangan kegesitan, aktivitas makan menurun (antifeedant), warna tubuh menjadi coklat kehitaman, dan akhirnya ulat grayak mati dengan tubuh mengering seperti yang terlihat
C - 122
Gambar 6. Larva yang Mati Akibat Perlakuan EKRA Gejala keracunan
diduga karena terganggunya sistem syaraf dan sistem metabolisme yang disebabkan adanya senyawa-senyawa kimia pada EKRA. Hasil penelitian ini juga diperkuat oleh Hoesain (1995), yang menyebutkan bahwa sifat serangga yang
menolak makan dapat
disebabkan senyawa penganggu proses fisiologi yang terjadi pada sel reseptor kimiawi.
Weinzierl (1991),
menambahkan bahwa salah satu
keuntungan insektisida nabati adalah cara kerjanya yang cepat dalam menghentikan proses makan serangga walaupun tidak menyebabkan kematian dalam beberapa jam atau hari. Namun dengan segera menyebabkan kelumpuhan atau penghentian aktivitas makan.
Nilai LC50 yang
diperoleh dari analisis probit untuk uji bioaktivitas insektisida pada EKRA dapat dilihat pada Tabel 4.
Tabel 4. Nilai LC50 untuk EKRA Tabel 5. Hubungan antara LC50 dengan
kategori toksisitas Lama Pengamatan (jam) LC50 (mg/L) 24 9009.573 48 8550.761 72 4759.487 Kategori LC50 Supertoksik Sangat toksik Toksik Toksik sedang Toksik ringan Praktis tidak toksik ≤ 5 mg/kg 5-50 mg/kg 50-500 mg/kg 0,5-5 g/kg 5-15 g/kg > 15 g/kg (Sumber: Lu, Frank (1995))
Hubungan antara LC50
dengan klasifikasi toksisitas relatif suatu zat kimia dinyatakan dalam kategori toksisitas, sebagaimana tercantum pada Tabel 5. Berdasarkan Tabel 5 di atas, maka dapat dikatakan bahwa EKRA bersifat toksik sedang karena
mempunyai nilai LC50 sebesar
4759,487 mg/L. SIMPULAN
Berdasarkan data dan analisis diatas dapat disimpulkan beberapa hal, sebagai berikut:
C - 123 1. Pada Konsentrasi K0= 0 mg/L,
K1= 200 mg/L, K2= 400 mg/L, K3= 800 mg/L, K4= 1600 mg/L, K5= 3200 mg/L, K6= 6400 mg/L diperoleh presentase mortalitas berturut-turut adalah 0,00; 25,00 ;26,67 ;33,33 ;36,66 ;45,00 ;55,00 % (R2 = 0,6741)
2. Berdasarkan hasil analisis probit minitab 13, uji bioaktivitas insektisida EKRA memberikan nilai LC50 sebesar 4759,487 mg/L
3. Berdasarkan tabel dan diagram hubungan konsentrasi zat bioaktif dengan mortalitas ulat grayak di atas tersebut, diketahui bahwa insektisida EKRA semakin efektif untuk waktu pemaparan yang lebih lama.
DAFTAR PUSTAKA
Anonim. 2009a. Kandungan
Senyawa Kimia Mangrove Berpotensi Sebagai Obat (Online),(http://www.lintasbe rita.com/Sains/Kandungan_S enyawa_Kimia_Mangrove_B erpotensi_Sebagai_Obat, diakses pada tanggal 4 Maret 2011).
Dwi, Septina Rahayu dan Tukiran.
2010. Formulasi
Bioinsektisida dan Uji Efikasi Semi Lapang untuk Pengelolaan Hama Tanaman Sawi dalam upaya Mengurangi Penggunaan Sintetik. Makalah yang Disampaikan pada Seminar
Nasional Kimia Unesa
Surabaya 20 Februari 2010. Eryanti. 1999. Identifikasi dan
isolasi senyawa kimia dari Mangrove (hutan Bakau). Laporan Hasil Penelitian Pusat Penelitian Kawasan
Pantai dan Perairan
Universitas Riau. 18 hal.
Fessenden, Ralp J, & Joan S. Fessenden. 1986. Organic Chemistry. California: Wadsworth, Inc., Belmont. Hamdani, 2008. Selamatkan Tanaman
dengan Insektisida Nabati. Lampung
Post.http://www.lampungpos t.com/cetak/cetak.php?id=20 08090910185632 (diakses pada tanggal 25 Desember 2011).
Khopkar, S. M. 2002. Konsep Dasar Kimia Analitik. Jakarta: UI-Press.
Kusmana, cecep, onrizal & sudarmadji. 2003. Jenis-Jenis Pohon Mangrove di Teluk Bintuni, Papua. (Online), (http://www.onrizal.files.wor dpress.com
/2008/10/mangrovebintuni.pd f, diakses pada tanggal 18 Juli 2011)
Kokpol, U. et.al., 1993. Long Chain Aliphatic Alcohols and Saturated Carboxylic Acids from Heartwood of Rhizophora apiculata. Phytochemistry, Vol. 33, No. 5, pp. 1129-1131.
Lu, Frank. C., 1995, Toksikologi Dasar (Asas, Organ sasaran dan Penilaian risiko), Jakarta: Universitas Indonesia.
Marliana, S. D., Suryanti, V., dan Suyono,. 2005. Skrining Fitokimia dan Analisis Kromatografi Lapis Tipis Komponen Kimia Buah Labu Siam (Sechium edule Jacq. Swartz.) dalam Ekstrak Etanol. Surakarta: Jurusan Kimia FMIPA Universitas Sebelas Maret.
Maulana, Awal. 2010. (Online), Pertanian Organik (Pestisida
C - 124 Nabati).
http://worldplant.multiply.co m/journal/item/24/Pertanian_ Organik_Pestis-ida_Nabati, diakses pada tanggal 1 April 2011.
Suyani, H. 1991. Kimia dan Sumber Daya Alam. Padang: Pusat Penelitian Universitas Andalas.
Utami, Maya. 2005. Pengembangan Formula Insektisida Nabati Dari Bahan Aktif Ekstrak Metanol Kulit Batang Tumbuhan Pacar Cina (Aglalia odorata Lour.).
Skripsi yang tidak
dipublikasikan. Surabaya: FMIPA UNESA.